Концепция физиологического шунта. Концепция физиологического мертвого пространства
Добавил пользователь Alex Обновлено: 28.01.2026
- ЖАНРЫ 362
- АВТОРЫ 289 732
- КНИГИ 699 078
- СЕРИИ 26 811
- ПОЛЬЗОВАТЕЛИ 612 783
: 01.1. АНАТОМИЯ И ГИСТОЛОГИЯ ЛЕГКИХ
Анатомия, топографическая анатомия легких и структура их отдельных элементов изучены достаточно подробно и представлены в учебниках, руководствах и атласах по анатомии человека. В главе будут рассмотрены анатомия и гистология воздухопроводящих путей (трахея, бронхи, альвеолярные ходы), респираторной части легких (альвеолярные ходы, мешочки, альвеолы, аэрогематический барьер), сосудов легких, нервной и лимфатической системы легких, плевры и диафрагмы.
Воздухоносные пути - это структуры между окружающей средой и терминальной респираторной единицей (ТРЕ). ТРЕ является структурнофункциональным образованием, которое включает в себя 100 альвеолярных ходов и около 2000 альвеол, расположенных дистальнее респираторных бронхиол первого порядка. В легких насчитывается всего 150 000 ТРЕ. Эту структурнофункциональную единицу клинические физиологи, анатомы и патологоанатомы традиционно выделяют как основную структурную единицу - ацинус [1].
Трахея является продолжением гортани, представляет собой полую эластическую трубку, которая начинается от перстневидного хряща и заканчивается бифуркацией на уровне IV грудного позвонка, разделяясь на два главных бронха под углом 65 - 95 0 ;. Длина трахеи у взрослого человека колеблется от 90 до 150 мм, диаметр от 15 до 16 мм. Остов трахеи состоит из 16 - 20 хрящевых неполных колец, обращенных к пищеводу и соединенных между собой кольцевидными связками [2]. Задняя стенка ее представлена мембранозной частью, состоящей из коллагеновых, эластических и гладкомышечных волокон. Такое строение трахеи позволяет ей при разных условиях менять свою конфигурацию, а следовательно, и воздушный поток. Минимальный размер трахеи соответствует фазе выдоха, максимальный - фазе вдоха. При кашлевом толчке просвет трахеи уменьшается в 3 - 10 раз в зависимости от возраста человека (чем моложе, тем больше сужается просвет). Во время вдоха бифуркация трахеи смещается вниз и на 2 - 3 см кпереди.
БРОНХИАЛЬНОЕ ДЕРЕВО
Бронхиальное дерево состоит из двух главных бронхов (правого и левого) и 23 - 26 генераций ветвлений, включая бронхиолы и альвеолярные ходы (рис. 1-1). Общее число ветвлений равно 223, т.е. около 8x106 [3]. Правый главный бронх отходит под углом 15 - 40 0 , длина его 28 - 32 мм, диаметр 12 - 22 мм. Левый отходит под углом 50 - 70 0 , длина составляет 40 - 50 мм, а диаметр - 8 - 16 мм [4]. Таким образом, правый главный бронх короче, шире и имеет более вертикальное направление, чем левый. Главные бронхи делятся, как правило, дихотомически на долевые, сегментарные, субсегментарные и на бронхи более мелких генераций, вплоть до терминальных и респираторных бронхиол. В стенках респираторных бронхиол I, II и III порядка уже появляются альвеолы. Респираторные бронхиолы и их альвеолы одновременно выполняют воздухопроводящую и газообменную функцию. На протяжении субсегментарных бронхов может насчитываться до 5 делений, в малых (мышечных) бронхах - до 15 делений. По мере ветвления бронхов закономерно уменьшается и их диаметр. Размерные взаимоотношения предыдущей и последующей генераций бронхов оптимальны для того, чтобы обеспечить должный поток воздуха с минимальными затратами энергии на этот процесс [5].
Рис. 1-1. Строение дыхательных путей (по Э.Р. Вейбелю, 1970 [3]).
Бронхи с 4й по 13ю генерацию имеют диаметр до 2 мм; общее число таких бронхов около 400. Наибольшее число бронхов диаметром 2 мм наблюдается с 7й по 9ю генерацию [3]. В терминальных бронхиолах диаметр колеблется от 0,5 до 0,6 мм, диаметр респираторных бронхиол (17 - 19я генерации) и альвеолярных ходов от 0,2 до 0,6 мм. Длина воздухоносных путей от гортани до ацинусов составляет 23 - 38 см, протяженность от 9й генерации бронхов до респираторных бронхиол около 5 см. В воздухоносных путях выделяют около 50 типов клеток, 12 из которых относятся к эпителиальным [6].
По мере уменьшения калибра бронхов и бронхиол хрящевая пластинка в них сначала уменьшается в размерах, а в терминальных бронхиолах исчезает. Для того чтобы бронхиолы не спадались при вдохе, они располагаются внутри легочной паренхимы, которая за счет эластической тяги расправляется при вдохе и расширяет бронхи. Кроме того, в хрящевых бронхах мышечная оболочка не столь мощная, как в бронхиолах, в стенке мало сосудов, и каждый бронх имеет адвентицию. В стенках мелких бронхов много сосудов и отсутствует адвентиция [7].
Эпителиальная выстилка трахеи и бронхов образована многорядным реснитчатым эпителием с бокаловидными, промежуточными и базальными клетками. Указывается также на наличие нейроэндокринных клеток. На уровне сегментарных бронхов толщина эпителия составляет от 37 до 47 мкм. Собственная пластинка слизистой оболочки трахеи и бронхов уплотнена и образует отчетливую базальную мембрану, толщина которой колеблется от 3,7 до 10,6 мкм. Ткань, расположенная глубже, называется подслизистой основой. В нее погружены секреторные отделы многочисленных белково-слизистых желез, расположенные в треугольнике между двумя хрящами [8].
Белковослизистые железы являются дериватом секреторных клеток слизистой оболочки воздухоносных путей и функционально взаимосвязаны с ней. Железы имеют альвеолярно-трубчатую структуру и состоят из ацинусов, содержат серозные и слизистые клетки, расположенные на базальной мембране. Серозные клетки имеют призматическую форму, эллипсоидное ядро и пиронинофильную цитоплазму. Белковослизистые железы выделяют смешанный белково-мукополисахаридный секрет, в котором преобладают муцины. Секреция осуществляется по мерокриновому и апокриновому типам. Выводные протоки желез выстланы мерцательным кубическим однослойным эпителием, расположенным на базальной мембране; в стенке протоков содержится сеть эластических волокон. По периферии подслизистых желез расположены соединительная ткань, подразделяющая их на дольки, а также скопления лимфоидных клеток (особенно в области протоков), единичные макрофаги, тучные клетки, плазмоциты. Между эпителиальными клетками и базальной мембраной располагаются миоэпителиальные клетки, сокращение которых способствует выведению секрета из концевых отделов желез, протоки которых открываются на внутренней поверхности трахеи и бронхов [9].
Структурная организация всех слоев стенки воздухоносных путей обеспечивает три основные функции: барьернозащитную с обеспечением мукоцилиарного клиренса, контроль за калибром бронхов и бронхиол, механическую стабильность воздухоносных путей.
Эпителиальная выстилка воздухоносных путей здорового человека включает следующие разновидности клеток: реснитчатые (РК), секреторные (бокаловидные) (СК), переходные, или промежуточные (ПК), базальные (БК), нейроэндо-кринные (НЭК) (рис. 1-2) [10].
При изучении поверхности эпителиального пласта воздухоносных путей человека и экспериментальных животных был выявлен ряд закономерностей [11, 12]:
---вопервых, все клетки эпителиальной выстилки воздухоносных путей имеют на своей апикальной поверхности микроворсинки - небольшие выросты цитоплазмы. Наличие этих структур способствует увеличению поверхности эпителиального пласта, соприкасающегося с жидким надэпителиальным секреторным покрытием, и указывает на возможность всасывания путем эндоцитоза жидкой части секрета из просвета бронхов;
---вовторых, межклеточные контакты плотные и представлены в виде валикообразных структур или черепицеобразных наложений, что обеспечивает непрерывность эпителиальной выстилки и позволяет ей выполнять барьернозащитную функцию;
---в-третьих, распределение, а следовательно, и соотношение реснитчатых и секреторных клеток в разных областях эпителиальной выстилки структур одного и того же калибра неодинаковое в продольном направлении и по периметру бронхов или бронхиол. Так, в бесхрящевой части трахеи и по всему периметру слизистой оболочки бесхрящевых бронхов отчетливо выражена ее складчатость в результате сокращения гладкой мускулатуры в этой зоне. В эпителиальном пласте таких зон преобладают реснитчатые клетки, на долю которых приходится до 70 - 80%, а иногда и все 100%. В тех местах, где по периметру трахеи и бронхов содержатся хрящевые полукольца или пластинки, поверхность эпителиальной выстилки ровная, без складок. В эпителии бронхов были выявлены зоны с разным соотношением реснитчатых и секреторных клеток: 1) с преобладанием реснитчатых клеток (до 80%), чаще соотношение СК:РК составляет 1:4 или 1:7; 2) с почти равным соотношением реснитчатых и секреторных клеток; 3) с преобладанием секреторных и микроворсинчатых клеток; 4) с полным или почти полным отсутствием реснитчатых клеток, которые можно назвать «безреснитчатыми».
Мертвое пространство легких и его значение в процессе дыхания
Для начала надо определиться, как более правильно называть участок дыхательный путей в которых не происходит газообмен — анатомическое мертвое пространство или физиологическое/функциональное?
p, blockquote 1,0,0,0,0 -->
Если мыслить логически, то анатомически пространство никак не может быть мертвым. Оно либо есть, либо его нет. А вот с точки зрения физиологии или функциональности, да, действительно, пространство может быть «мертвым», т.к. является с определенной точки зрения «бесполезным», пустым, неиспользуемым, нефункциональным. Но хоть в дыхательных путях и не происходит газообмена между кровью и вдыхаемым воздухом, все же оно не бесполезное, т.к. выполняет определенные функции, о которых подробно будет написано ниже.
p, blockquote 2,0,0,0,0 -->
Что такое функциональное МП
Как уже было написано выше, под функциональным мертвым пространством легких подразумевается часть дыхательной системы, которая не участвует в процессе газообмена между капиллярной кровью и альвеолярным воздухом. Другими словами, это пространство которое участвует в транспортировке воздуха от атмосферы к альвеолам и обратно. Если еще проще, то это дыхательный «трубопровод» для легких.
p, blockquote 3,0,0,0,0 -->
Объем
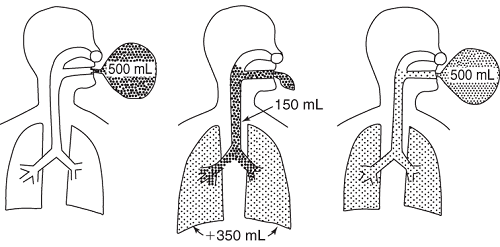
Для взрослого человека общий объем мертвого пространства разнится в зависимости от роста, веса и анатомических особенностей дыхательных путей и составляет от 120 до 180 мл. В среднем, эту величину считают равной 150 мл.
p, blockquote 4,0,0,0,0 -->
p, blockquote 5,0,0,0,0 -->
Ученые-медики вывели усредненную формулу, которая помогает более менее точно определить объем физиологического мертвого пространства, зная только вес взрослого человека. V=2,2*m(кг). Или просто посчитайте на этом калькуляторе, где достаточно только указать свой вес:
p, blockquote 6,0,0,0,0 -->
p, blockquote 7,0,1,0,0 -->
Еще раз повторюсь, что это для взрослых людей.
p, blockquote 8,0,0,0,0 -->
У детей этот физиологический объем значительно ниже. Для них, к сожалению, не применима простая формула вычисления искомого объема по весу тела, но есть сложная логарифмическая формула, которая учитывает его изменение в зависимости от возраста ребенка.
p, blockquote 9,0,0,0,0 -->
Не стану расписывать результаты логарифмического вычисления для детей разных возрастов, но методику вычисления, любезно предоставленную на одном научном англоязычном сайте, приведу — вдруг кому-то из моих читателей она будет действительно полезна: V = 3,28 — 0,56 [ln (1 + возраст)].
p, blockquote 10,0,0,0,0 -->
Какие органы входят
Как уже понятно из определения, в ФМП входят все воздухопроводящие органы, в которых не происходит газообмен между кровью капилляров и воздухом альвеол. Таким образом, «живым» является только объем альвеол, а все остальное является «мертвым».
p, blockquote 11,0,0,0,0 -->
Итак, перечислим эти органы:
- Полость носа и придаточные пазухи носа (ротовая полость — если дыхание через рот)
- Носоглотка
- Гортань
- Трахея
- Бронхи
- Бронхиолы
Носовая и ротовая полость, носовые пазухи, носоглотка и гортань формируют внегрудное МП. Трахея, бронхи и бронхиолы — внутригрудное. Для взрослых это не имеет особого значения, т.к. независимо от комплекции тела, внегрудное и внутригрудное МП находятся приблизительно в одинаковых пропорциях. А вот для детей это имеет значение, т.к. размеры головы, а значит и части верхних дыхательных путей, несоразмерно больше грудной полости и объема бронхиального дерева. Именно поэтому для детей применяется такая сложная формула расчета объема ФМП.
p, blockquote 13,0,0,0,0 -->
Помимо всех этих классификаций, в физиологии выделяется еще одно — мертвое пространство легких. С анатомической точки зрения — это бронхиальное дерево расположенное в легких, т.е. начиная от долевых бронхов и заканчивая бронхиолами.
p, blockquote 14,1,0,0,0 -->
Выполняемые функции
Как уже было сказано выше, ФМП не является «бесполезным» пространством, а выполняет очень важные функции без которых дыхательный процесс в легких был бы просто невозможен. Как и обещал, сейчас мы подробно рассмотрим в чем же заключается его польза для человеческого организма.
p, blockquote 15,0,0,0,0 -->
Нормализация температуры
Пока вдыхаемая воздушная смесь доходит до альвеол, она нагревается в этом «бесполезно-полезном» физиологическом пространстве до температуры тела.
p, blockquote 16,0,0,0,0 -->
Впрочем это может быть не обязательно нагрев, но и охлаждение, т.к. воздух вокруг человека может быть горячее тела (жаркий день, жаркое помещение, в пустыне и т.д.), а следовательно вдыхаемую воздушную смесь необходимо будет охладить до температуры тела.
p, blockquote 17,0,0,0,0 -->
Действительно важная роль, т.к. альвеолы не смогут функционировать, если в них, к примеру, будет попадать воздушная смесь с температурой 15 градусов С. Мало того что биохимические процессы практически остановились бы, так и капилляры …. хотел написать спазмируются, но нет, не спазмируются. В них же нет мышечного слоя. Но кровоток в любом случае замедлится, гемоглобин перестанет выполнять свои функции, а также возникнет реальная угроза инфекционного процесса — пневмонии.
p, blockquote 18,0,0,0,0 -->
Увлажнение воздуха
По мере прохождения воздуха по верхним дыхательным путям, а также бронхам и бронхиолам, он увлажняется до 100%. Так что в альвеолы он поступает уже абсолютно увлажненным.
p, blockquote 19,0,0,0,0 -->
Тоже незаменимая роль, т.к. при поступлении в альвеолы воздуха даже 90% влажности они просто не смогут выполнять свою прямую обязанность — осуществлять перенос кислорода в кровь, а углекислого газа в полость альвеолы. Даже в научно-медицинских источниках очень мало подробной информации о необходимой влажности поступающего в альвеолы воздуха, но если представить физиологический процесс дыхания, то становится понятно, что даже при 95% влажности все равно было бы постепенное пересыхание стенок альвеолярного мешочка. Так что только 100% влажность и никак иначе.
p, blockquote 20,0,0,0,0 -->
В обоих случаях, что приведения температуры вдыхаемого воздуха до температуры тела, что его увлажнение до 100% влажности, титаническую роль играет бронхиальное дерево. Именно оно, за счет сильно разветвленной сети бронхов и бронхиол, успевает довести эти показатели до необходимой нормы.
p, blockquote 21,0,0,1,0 -->
Альвеолярное мертвое пространство
Как было указано в определении, функциональное мертвое пространство — это часть дыхательной системы, которая не участвует в газообмене.
p, blockquote 22,0,0,0,0 -->
Альвеолы — это как раз та часть легких, в которой и происходит газообмен, поэтому назвать их мертвым пространством, именно с этой точки зрения, никак нельзя. Но с другой стороны, есть неработающие альвеолы и есть «остаточный» объем воздуха в этих альвеолах, которые как раз и не работают в процессе дыхания.
p, blockquote 23,0,0,0,0 -->
«Мертвые» альвеолы
По ряду причин (тромбозы, фиброз и т.д.) кровообращение в части альвеол может быть нарушено, в следствие чего газообмена так происходить не будет. Суммарный объем воздуха таких альвеол можно считать альвеолярным мертвым пространством.
p, blockquote 24,0,0,0,0 -->
«Пустой» объем
При спокойном выдохе в альвеолах остается остаточный воздух, который содержит кислорода значительно меньше, чем содержится во вдыхаемом воздухе. Следовательно, в каком-то смысле этот объем альвеолярного пространства можно считать «мертвым».
p, blockquote 25,0,0,0,0 -->
После спокойного выдоха человек может выдохнуть еще около 1300 мл воздуха. Именно такой объем воздуха остается в альвеолах после выдоха при спокойном дыхании.
Выводы
Как уже понятно из вышепрочитанного, «мертвым» оно является исключительно из-за отсутствия в нем процесса газообмена. Но как говорится: «Кесарю-кесарево», что в данной ситуации означает, что в нем и не должно быть газообмена, т.к. выполняет оно совсем другие функции.
p, blockquote 27,0,0,0,0 --> p, blockquote 28,0,0,0,1 -->
Еще один важный момент, который необходимо учитывать — при ряде заболеваний дыхательной системы (например, выраженных бронхоэктазах), «бесполезный» объем будет значительно выше, что обязательно скажется на сатурации и в длительной перспективе может привести к хроническому кислородному голоданию, что чревато своими последствиями. Если, к примеру, количество обедненного кислородом воздуха увеличится со 150 мл до 250 мл, то при дыхательном объеме в 500 мл соотношение к обогащенной воздушной смеси к обедненной изменится с 2,33 до 1,0. Это очень весомо.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. По всем медицинским вопросам обязательно проконсультируйтесь со специалистом!
Ваш комментарий Отменить ответ
Отправляя комментарий, вы разрешаете сбор и обработку персональных данных. Политика конфиденциальности.
Концепция физиологического шунта. Концепция физиологического мертвого пространства
Диссоциация оксигемоглобина и ее зависимость. Эффект Бора
а) Факторы, сдвигающие кривую диссоциации оксигемоглобина. Их значение для транспорта кислорода. Кривые диссоциации оксигемоглобина (для облегчения понимания просим вас изучить рисунки ниже) справедливы для нормальной крови со средними показателями. Однако существует ряд факторов, которые могут сдвигать эту кривую в одну или другую сторону. На рисунке видно, что при некотором закислении крови со снижением рН от нормального уровня 7,4 до 7,2 кривая диссоциации смещается в среднем на 15% вправо, а повышение уровня рН от нормального уровня 7,4 до 7,6 смещает кривую на такое же расстояние влево.
Влияние PO2 крови на количество связанного гемоглобина на 100 мл крови Сдвиг кривой диссоциации оксигемоглобина вправо в результате повышения концентрации ионов водорода (снижения pH). ДФГ — 2,3-дифосфоглицерат
Кроме изменений рН известны и другие факторы, которые могут сдвигать кривую диссоциации. Назовем три, действие которых сдвигает кривую вправо: (1) повышение концентрации двуокиси углерода; (2) повышение температуры крови; (3) повышение концентрации 2,3-дифосфоглицерата — метаболически важного фосфата, который в зависимости от метаболических условий присутствует в крови в разных концентрациях.
б) Повышение снабжения тканей кислородом в случаях, когда двуокись углерода и ионы водорода сдвигают кривую диссоциации оксигемоглобина. Эффект Бора. Сдвиг кривой диссоциации оксигемоглобина в ответ на повышение содержания двуокиси углерода и ионов водорода в крови имеет существенное влияние, выражающееся в ускорении высвобождения кислорода из крови в тканях и увеличении оксигенации крови в легких. Это называют эффектом Бора и объясняют его следующим образом.
При прохождении крови через ткань двуокись углерода диффундирует из клеток ткани в кровь. В результате в крови увеличивается PO2, а затем концентрации угольной кислоты (H2CO3) и ионов водорода. Эти изменения сдвигают кривую диссоциации оксигемоглобина вправо и вниз (для облегчения понимания просим вас изучить рисунок выше), уменьшая сродство кислорода к гемоглобину, и в результате увеличивается выход кислорода в ткани.
При диффузии двуокиси углерода из крови в альвеолы происходят процессы обратного направления — в результате в крови снижаются PCO2 и концентрация ионов водорода, сдвигая кривую диссоциации оксигемоглобина влево и вверх. При этом значительно увеличивается количество кислорода, связывающегося с гемоглобином при любом существующем уровне альвеолярного PO2, что увеличивает транспорт кислорода к тканям.
в) Сдвиг кривой диссоциации оксигемоглобина под влиянием дифосфоглицерата. Нормальное содержание ДФГ в крови вызывает постоянный небольшой сдвиг кривой диссоциации оксигемоглобина вправо. В случае гипоксического состояния, продолжающегося более нескольких часов, концентрация ДФГ в крови значительно возрастает, и кривая диссоциации оксигемоглобина сдвигается вправо еще больше.
В присутствии такой концентрации ДФГ кислород в тканях высвобождается при PO2, превышающем нормальный уровень на 10 мм рт. ст., поэтому в некоторых случаях такой механизм с участием ДФГ может оказаться важным для адаптации к гипоксии, особенно если причиной гипоксии является уменьшение в ткани кровотока.
г) Сдвиг кривой диссоциации во время физической нагрузки. Во время физической нагрузки некоторые факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина вправо, поэтому активные, выполняющие физическую работу мышечные волокна получают дополнительное количество кислорода. В свою очередь, работающие мышцы высвобождают большое количество двуокиси углерода; это в совокупности с действием некоторых других кислот, высвобождающихся мышцами, повышает концентрацию ионов водорода в крови капилляров мышц.
Кроме того, во время работы температура мышцы часто повышается на 2-3°С, что может еще больше увеличивать доставку кислорода мышечным волокнам. Все эти факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина в крови капилляров мышц вправо. Сдвиг вправо означает высвобождение кислорода гемоглобином в мышце при достаточно высоком уровне PO2 (40 мм рт. ст.) даже в случаях, когда из него уже высвободилось 70% кислорода. Сдвиг кривой в другую сторону показывает, что в легких присоединилось дополнительное количество кислорода из альвеолярного воздуха.
Видео физиология газообмена в легких и транспорта газов кровью - профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
а) Концепция физиологического шунта (когда VA/Q ниже нормы). Когда VA/Q ниже нормы, причиной этого является неадекватная вентиляция, не способная обеспечивать приток кислорода в количестве, необходимом для полной оксигенации протекающей через альвеолярные капилляры крови, поэтому определенная доля проходящей через легочные капилляры крови не оксигенируется. Эту фракцию называют шунтированной кровью. Кроме того, определенное дополнительное количество крови проходит через бронхиальные сосуды, не заходя в альвеолярные капилляры (в норме это составляет около 2% сердечного выброса). Эта порция также не оксигенируется и относится к шунтированной крови.
Общее количество шунтированной крови в минуту называют физиологическим шунтом. В клинических лабораториях, исследующих легочные функции, величина физиологического шунта измеряется путем определения концентрации кислорода в смешанной венозной крови и в артериальной крови с одновременным определением сердечного выброса. Зная эти величины, можно вычислить величину физиологического шунта с помощью следующей формулы:
где QPS — объем шунтированного кровотока в минуту, QT — сердечный выброс в минуту, СiO2 — концентрация кислорода в артериальной крови при наличии «идеального» вентиляционно-перфузионного соотношения, СaO2 — наличная концентрация кислорода в артериальной крови и CvO2 — наличная концентрация кислорода в смешанной венозной крови.
Чем больше физиологический шунт, тем больше объем крови, который при прохождении легких не оксигенируется.
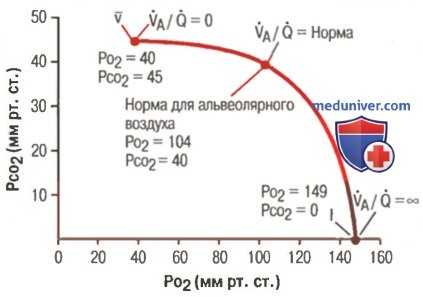
Диаграмма нормальных величин PO2-PCO2, VA/Q
б) Концепция физиологического мертвого пространства (когда VA/Q выше нормы). Если в некоторых альвеолах вентиляция большая, а альвеолярный кровоток мал, то в этих альвеолах находится больше кислорода, чем из них может транспортироваться кровотоком. Вентиляцию в таких альвеолах называют неэффективной. Вентиляция дыхательных путей — анатомического мертвого пространства — также является неэффективной. Сумму этих двух видов неэффективной вентиляции называют физиологическим мертвым пространством. В клинических лабораториях для изучения функционального состояния легких его измеряют при помощи точных определений состава крови и выдыхаемого воздуха, пользуясь так называемым уравнением Бора:
где VDphys — физиологическое мертвое пространство, VT — дыхательный объем, РаCO2 — парциальное давление двуокиси углерода в артериальной крови и РeCO2 — среднее парциальное давление двуокиси углерода во всем объеме выдыхаемого воздуха.
При большом объеме физиологического мертвого пространства большая часть вентиляционной работы является неэффективной из-за того, что большая часть вентилируемого воздуха вообще не доходит до дыхательной мембраны.
в) Отклонение от нормы вентиляционно-перфузионного коэффициента:
1. Аномалии VA/Q в верхней и нижней частях нормальных легких. У здорового человека в положении стоя капиллярный кровоток в верхней части легких, а также альвеолярная вентиляция имеют значительно меньший объем, чем в нижней части. При этом объем кровотока снижается больше, чем объем вентиляции, поэтому в верхушке легкого VA/Q примерно в 2,5 раза больше идеального, в результате там возникает средней величины физиологическое мертвое пространство.
В другом конце легкого (в нижней части) вентиляция по сравнению с кровотоком слегка снижена, и VA/Q составляет только 0,6 от идеального. В этой части легкого небольшая часть крови оксигенируется меньше нормы — налицо явление физиологического шунта.
В обоих случаях несоответствие вентиляции и перфузии слегка снижает эффективность работы легких в обмене кислорода и двуокиси углерода. Однако во время физической работы кровоток к верхней части легких значительно возрастает, возникает физиологическое мертвое пространство намного меньшего объема, и эффективность газообмена приближается к оптимальному.
2. Аномальный VA/Q при хроническом обструктивном заболевании легких. У многих курящих со стажем развивается разной степени бронхиальная обструкция; у некоторых это состояние достигает такой степени тяжести, что появляется серьезная задержка альвеолярного воздуха и в результате — эмфизема легких. Эмфизема, в свою очередь, вызывает разрушение стенок многих альвеол. Эти аномалии могут стать причиной возникновения у курящих аномального VA/Q. Во-первых, из-за обструкции многих маленьких бронхиол альвеолы за местом обструкции не вентилируются и VA/Q приближается к нулю. Во-вторых, в участках легких, где многие стенки альвеол разрушены, но альвеолярная вентиляция продолжается, большая часть этой вентиляции неэффективна из-за неадекватного транспорта газов в кровотоке.
Таким образом, при хроническом обструктивном заболевании легких в некоторых участках легких возникает значительной величины физиологическое шунтирование, а в других — значительной величины физиологическое мертвое пространство. Оба эти фактора существенно снижают эффективность работы легких как органов газообмена, иногда оставшаяся эффективность может оказаться на уровне только 1/10 нормы. На сегодняшний день именно это является наиболее часто встречающейся причиной легочной недостаточности.
Вентиляция легких. Вентиляция кровью легких. Физиологическое мертвое пространство. Альвеолярная вентиляция.
Вентиляцией легких обозначают процесс обмена воздуха между легкими и атмосферой. Количественным показателем вентиляции легких служит минутный объем дыхания, определяемый как количество воздуха, которое проходит (или вентилируется) через легкие в 1 мин. В покое у человека минутный объем дыхания составляет 6—8 л/мин. Только часть воздуха, которым вентилируются легкие, достигает альвеолярного пространства и непосредственно участвует в газообмене с кровью. Эта часть вентиляции легких называется альвеолярной вентиляцией. В покое альвеолярная вентиляция равна в среднем 3,5—4,5 л/мин. Основная функция альвеолярной вентиляции заключается в поддержании необходимой для газообмена концентрации 02 и С02 в воздухе альвеол.
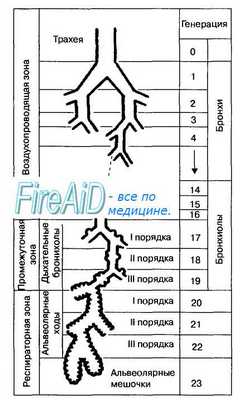
Рис. 10.11. Схема дыхательных путей легких человека. Дыхательные пути от уровня трахеи (1-я генерация) до долевых бронхов (2—4-я генерации деления) поддерживают свой просвет благодаря хрящевым кольцам в их стенке. Дыхательные пути от сегментарных бронхов (5—11-я генерации) до терминальных бронхиол (12— 16-я генерации) стабилизируют свой просвет с помощью тонуса гладких мышц их стенок. 1—16-я генерации дыхательных путей образуют возду-хопроводящую зону легких, в которой не происходит газообмена. Респираторная зона легких имеет длину порядка 5 мм и включает первичные дольки или ацинусы: дыхательные бронхиолы (17—19-я генерации) и альвеолярные протоки (20—22-я генерации). Альвеолярные мешочки состоят из многочисленных альвеол (23-я генерация), альвеолярная мембрана которых является идеальным местом для диффузии 02 и С02.
Легкие состоят из воздухопроводящей (дыхательные пути) и респираторной зон (альвеолы). Дыхательные пути, начиная от трахеи и до альвеол, делятся по типу дихотомии и образуют 23 генерации элементов дыхательного тракта (рис. 10.11). В воздухопроводящей или кондуктивной зонах легких (16 генераций) отсутствует газообмен между воздухом и кровью, поскольку в этих отделах дыхательные пути не имеют достаточной для этого процесса сосудистой сети, а стенки дыхательных путей, из-за их значительной толщины, препятствуют обмену газов через них. Этот отдел воздухоносных путей называется анатомическим мертвым пространством, объем которого составляет в среднем 175 мл. На рис. 10.12 показано, каким образом воздух, заполняющий анатомическое мертвое пространство в конце выдоха, смешивается с «полезным», т. е. атмосферным воздухом и вновь поступает в альвеолярное пространство легких.
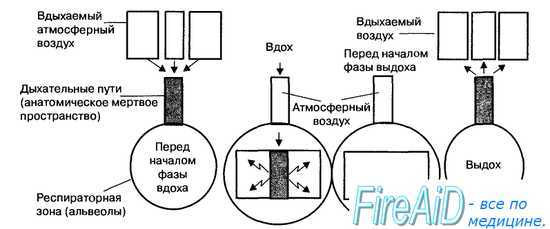
Рис. 10.12. Эффект воздуха мертвого (вредного) пространства на вдыхаемый воздух в легкие. В конце выдоха анатомическое мертвое пространство заполняется выдыхаемым воздухом, в котором пониженное количество кислорода и высокое процентное содержание углекислого газа. При вдохе «вредный» воздух анатомического мертвого пространства смешивается с «полезным» атмосферным воздухом. Эта газовая смесь, в которой меньше, чем в атмосферном воздухе, кислорода и больше углекислого газа, поступает в респираторную зону легких. Поэтому газообмен в легких происходит между кровью и альвеолярным пространством, заполненным не атмосферным воздухом, а смесью «полезного» и «вредного» воздуха.
Дыхательные бронхиолы 17—19-й генераций относят к переходной (транзиторной) зоне, в которой начинается газообмен в малочисленных альвеолах (2 % от общего числа альвеол). Альвеолярные ходы и альвеолярные мешочки, непосредственно переходящие в альвеолы, образуют альвеолярное пространство, в области которого происходит в легких газообмен 02 и С02 с кровью. Однако у здоровых людей и, особенно, у пациентов с заболеваниями легких часть альвеолярного пространства может вентилироваться, но при этом не участвовать в газообмене, поскольку эти отделы легких не перфузируются кровью. Сумму объемов таких областей легких и анатомического мертвого пространства обозначают как физиологическое мертвое пространство. Увеличение физиологического мертвого пространства в легких приводит к недостаточному снабжению тканей организма кислородом и к увеличению содержания в крови углекислого газа, что нарушает в ней газовый гомеостазис.
Читайте также:
