Лечение миеломенингоцеле. Прогноз
Добавил пользователь Алексей Ф. Обновлено: 30.01.2026
Лечение миеломенингоцеле. Прогноз
Терапия и наблюдение за ребенком с миеломенингоцеле требует мультидисциплинарного подхода. В совместном лечении пациента участвует хирург и терапевт, из них один специалист (часто — педиатр) действует как координатор лечебного процесса. Информация о таком тяжелом заболевании новорожденного ребенка, как миеломенингоцеле, вызывает сильное чувство горя и гнев у родителей. Родителям необходимо время для изучения заболевания и связанных с ним осложнений, чтобы активно участвовать в лечебном процессе.
Беседу с родителями должен провести опытный специалист, предоставив нужную информацию спокойно, неторопливо и так, чтобы его слова не вызывали страх и тревогу у родителей. При возможности следует организовать встречу с другими родителями детей с пороком развития нервной трубки, такие совместные обсуждения помогают разрешить важные вопросы и проблемы.
После закрытия дефекта (хирургического удаления миеломенингоцеле), как правило, необходима операция шунтирования для лечения гидроцефалии. В случае появления признаков дисфункции ромбовидного мозга показана ранняя хирургическая декомпрессия продолговатого мозга и шейного отдела спинного мозга. При косолапости может потребоваться шинирование или применение лонгет, при вывихе бедра — хирургическое лечение.
Подробное обследование и повторная оценка функции мочеполовой системы — один из наиболее важных компонентов терапевтической тактики. Обучение родителей, а со временем и пациента регулярной катетеризации при неврогенном мочевом пузыре необходимо для поддержания остаточного объема мочи на низком уровне, что предотвращает развитие инфекционных процессов мочевых путей и рефлюкса, служащего причиной пиелонефрита и гидронефроза. Периодический посев мочи и оценка функции почек, включая определение электролитов и креатинина в плазме, а также УЗИ почек, внутривенная пиелография и КТ почек наззначаются в зависимости от прогрессирования процесса и результатов физикального обследования.
Совершенствование подходов к лечению заболеваний мочевыделительной системы привело к значительному сокращению хирургического лечения и уменьшению частоты тяжелых осложнений и летальных исходов, ассоциированных с прогресирующим заболеванием почек у этих пациентов. У некоторых детей для лечения недержания мочи в более старшем возрасте возможна хирургическая имплантация искусственного сфинктера мочевого пузыря или хирургическое увеличение размера мочевого пузыря. Хотя недержание кала (энкопрез) встречается часто и вызывает значительные социальные проблемы в школьном возрасте, риск тяжелых осложнений при этом состоянии значительно ниже, чем при недержании мочи. У многих детей возможна «тренировка кишечника» с помощью клизм или введения ректальных свеч по схеме, что приводит к опорожнению кишечника в уста; новленное время 1 или 2 раза в день. Может быть целесообразным наложение аппендикостомы для антеградного промывания кишечника.
Восстановление функции самостоятельной ходьбы после операции — желание любого ребенку и его родителей — зависит от уровня поражения и сохранения функции подвздошно-поясничных мышц. Восстановление самостоятельной ходьбы возможно практически у всех детей, у которых по. ражение локализовано в крестцовом или пояснично-крестцовом отделе; почти в 50 % случаев при более высокой локализации дефекта передвижение возможно с использованием ортопедических аппаратов и костылей.
Прогноз миеломенингоцеле. У детей, рожденных с миеломенингоцеле, после активной терапевтической тактики летальность составляет примерно 10-15 %, в большинстве случаев смерть наступает до 4-летнего возраста. По крайней мере у 70 % выживших пациентов интеллект соответствует норме, однако нарушения школьной успеваемости и судороги встречаются чаще, чем в общей популяции. Эпизоды менингита или вентрикулита в анамнезе оказывают негативное влияние на интеллект пациента в будущем. Поскольку миеломенингоцеле — хроническое инвалидизирующее заболевание, на протяжении всей жизни пациентам требуется периодическое катамнестическое наблюдение с привлечением специалистов различного профиля.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Миеломенингоцеле. Причины и клиника
Миеломенингоцеле представляет собой наиболее тяжелую форму дизрафии с поражением позвоночника и возникает с частотой примерно 1:4000 родившихся живыми.
Причина миеломенингоцеле неизвестна, однако, как и при всех дефектах закрытия нервной трубки, имеется генетическая предрасположенность к развитию данной аномалии. После рождения одного ребенка с данной патологией риск формирования миеломенингоцеле при последующих беременностях достигает 3-4 %, а после рождения двух детей с этой аномалией в одной семье — до 10 %. Нарушение питания и неблагоприятные факторы внешней среды, несомненно, играют важную роль в формировании миеломенингоцеле.
Современная диета обеспечивает примерно 1/2 суточной потребности в фолиевой кислоте. С целью увеличения содержания фолиевой кислоты в пищевом рационе в 1998 г. в США и Канаде выпускались пищевые продукты, обогащенные фолиевой кислотой: мука, макаронные изделия, рис и кукурузная мука содержали 0,15 мг фолиевой кислоты на 100 г продукта. Но, к сожалению, доза фолиевой кислоты, получаемой с пищей, не достигает минимальной дозы, позволяющей предотвратить пороки развития нервной трубки. Поэтому необходимо создание информативных обучающих программ для женщин, планирующих беременность. Некоторые лекарственные препараты, включая антагонисты фолиевой кислоты, такие как триметоприм и антиконвульсанты (фенитоин, карбамазепин, фенобарбитал и примидон), повышают риск развития миеломенингоцеле. При приеме антиконвульсантов — препаратов вальпроевой кислоты во время беременности риск пороков развития нервной трубки достигает примерно 1-2 %. Некоторые врачи рекомендуют всем женщинам репродуктивного возраста, страдающим эпилепсией и принимающим антиэпилептические препараты, получать заместительную терапию фолиевой кислотой.
Миеломенингоцеле заболевание вызывает дисфункцию не только периферической и центральной нервной системы, но и многих других органов и структур организма, включая костную систему, кожу, мочеполовую систему. Миеломенингоцеле (спинномозговая грыжа) может локализоваться в любом участке вдоль нервной трубки (осевой части ЦНС), однако наиболее часто (75 % случаев) локализуется в пояснично-крестцовом отделе. Распространенность и степень тяжести неврологического дефицита зависят от локализации миеломенингоцеле.
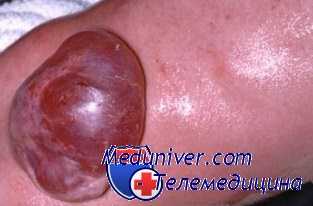
Поражение в нижней части крестцовой области приводит к нарушению функции тазовых органов (недержание мочи и кала) в сочетании с анестезией в области промежности, но без изменения двигательной функции. Миеломенингоцеле, локализующееся у новорожденных в средней части крестцовой области, обычно имеет мешковидную форму, кистообразную структуру и покрыто тонким слоем частично эпителизированной ткани. Под оболочкой видны рудименты нервной ткани, возможен разрыв оболочки с истечением ликвора.
При неврологическом осмотре выявляются вялый паралич нижних конечностей, отсутствие глубоких сухожильных рефлексов, реакции на прикосновение и болевой чувствительности; с высокой частотой встречаются постуральные аномалии нижних конечностей, включая косолапость и подвывих бедер. Возможно постоянное выделение мочи по каплям и расслабление анального сфинктера. Таким образом, при локализации миеломенингоцеле в среднем поясничном отделе отмечаются признаки поражения периферических мотонейронов вследствие поражения конуса спинного мозга.
При распространении миеломенингоцеле на грудной отдел спинного мозга, как правило, выявляются прогрессирующие неврологические нарушения. Тем не менее у пациентов с миеломенингоцеле в верхней грудной или шейной области обычно имеется минимальный неврологический дефицит и в большинстве случаев гидроцефалия не развивается.
Гидроцефалия в сочетании с аномалией Киари типа II развивается по крайней мере в 80 % случаев у пациентов с миеломенингоцеле. Как правило, чем ниже локализовано миеломенингоцеле (например, в крестцовом отделе), тем меньше риск гидроцефалии. Увеличение желудочков может быть медленно прогрессирующим и не проявляться клинически или развивается быстро, приводя к внутричерепной гипертензии (выбухание переднего родничка, дилатация черепных вен, симптом «заходящего солнца», раздражительность и рвота в сочетании с увеличением окружности головы).
Нередко у младенцев с гидроцефалией и аномалией Киари типа II выявляются симптомы дисфункции ромбовидного мозга, включая нарушение глотания, поперхивание, стридор, апноэ, паралич голосовых связок, слюнотечение, а также спастичность в верхних конечностях. В отсутствие терапии возможен летальный исход. Такие кризисы Киари обусловлены вклинением продолговатого мозга и миндалины мозжечка в большое затылочное отверстие.
Менингомиелоцеле
Менингомиелоцеле – это грыжа спинномозгового канала, при которой происходит выпячивание тканей и вещества спинного мозга через костный дефект позвоночного столба. Клиническая картина включает в себя наличие грыжеобразного выпячивания на спине ребенка в поясничной или крестцовой области. Сразу или с возрастом возникает нарушение иннервации нижерасположенных сегментов, вследствие чего развиваются тазовая дисфункция, парапарезы или параплегия. Диагностика основывается на наружном осмотре, подтверждении поражения ЦНС при помощи КТ и МРТ. Лечение хирургическое с последующей симптоматической терапией.
Общие сведения
Менингомиелоцеле или spina bifida cystica – это одна из форм спинального дизрафизма, которая проявляется выходом тканей спинного мозга за пределы позвоночного канала через костный дефект дужек. Впервые патология была описана в 1641 году Н. Тульпиусом. Распространенность составляет 5-20 на 10000 новорожденных. Является тяжелым заболеванием, которое вызывает серьезные неврологические нарушения и в некоторых случаях приводит к полному обездвиживанию больного. При менингомиелоцеле грыжевой мешок содержит оболочки спинного мозга, спинномозговую жидкость и корешки спинальных нервов. Чаще заболевание наблюдается при беременности матери в возрасте после 35 лет. В 6-8% случаев прослеживается наследственная склонность, что свидетельствует о генетическом характере патологии. При адекватном своевременном лечении прогноз относительно благоприятный.
Причины менингомиелоцеле
Менингомиелоцеле развивается при наличии одного или нескольких факторов риска со стороны матери: прием фармакологических средств (оральные контрацептивы, препараты из групп салицилатов, вальпроатов, амфетаминов); употребление алкогольных напитков, табачных изделий, наркотиков, других тератогенных веществ; недостаточность микроэлементов и питательных веществ (в частности – Zn, Fe, фолиевая кислота) в рационе беременной; TORCH-инфекции (чаще всего – вирусы краснухи, гриппа и парагриппа). Также патология может иметь наследственный характер – установлен аутосомно-рецессивный механизм передачи заболевания, однако в 90-95% случаев семейный анамнез не отягощен.
Нервная трубка образуется из нервной пластинки на 19-20 день гестации. В нормальных условиях ее анатомическое закрытие происходит на 22-24 сутки, в результате чего остаются только верхнее и нижнее отверстие. Существует закономерность: чем позднее развивается менингомиелоцеле – тем ниже его локализация. Патогенез менингомиелоцеле досконально не изучен. На данный момент в педиатрии существуют 3 основных теории, объясняющих механизм развития данной патологии. Первая – это патология закрытия нервной трубки или теория Реклингхаузена. Она объясняет развитие спинального дизрафизма дефектом нейроэктодермы, возникающим в периоде раннего онтогенеза – на 25-30 день после оплодотворения.
Вторая – гидродинамическая или теория Моргани. Ее суть заключается в повышении давления внутри спинномозгового канала в I триместре беременности. Повышение давления провоцирует выпирание оболочек с последующим формированием костного дефекта и грыжи. Косвенным подтверждением данной теории является сопутствующая гидроцефалия в 90% случаев заболевания. Третья теория объясняет развитие менингомиелоцеле нарушением темпа роста тканей спинномозгового канала. При этом скорость дифференциации костных тканей позвоночного столба отстает или опережает развитие нервной трубки, из-за чего формируется дефект позвоночного столба.
Симптомы менингомиелоцеле
Клинические проявления менингомиелоцеле наблюдается уже с момента рождения ребенка. Основной признак – наличие характерного «мешка», который являет собой грыжеобразное выпячивание спинного мозга на спине ребенка. В некоторых случаях данное образование покрыто тонким шаром эпидермиса, но зачастую в дефекте позвоночного столба визуализируются непосредственно оболочки спинномозгового канала и нервные корешки. Наиболее характерная локализация – поясничный или крестцовый отдел. Примерно у половины новорожденных с изолированной формой изменения общего состояния изначально не возникает, однако с возрастом у всех детей появляются неврологические нарушения. Степень поражения напрямую зависит от уровня спинного мозга, на котором сформировалась грыжа.
При развитии менингомиелоцеле ниже 4 поперечного сегмента (L4) наблюдаются нарушения иннервации мочевого пузыря, реже – терминальных отделов кишечного тракта. Типичное проявление – недержание мочи. В более тяжелых случаях помимо тазовой дисфункции развиваются расстройства чувствительности и моторной функции нижних конечностей по типу парапареза. При локализации грыжевого выпячивания выше уровня 3 поперечного сегмента (L3) возникает полная параплегия, приводящая к тотальному обездвиживанию ног. Менингомиелоцеле зачастую сочетается с гидроцефалией и мальформацией Арнольда-Киари II типа с характерными для них клиническими проявлениями: увеличением размеров головы, рвотой, бессонницей, конвульсиями, атаксией, нарушением акта глотания, головными болями в области затылка, задержкой психофизического развития и т. д. Значительно реже в виде осложнения возникает эпилепсия.
Начиная с 12-ти месячного возраста, часто наблюдаются задержка в физическом развитии, набор излишней массы тела и деформации нижних конечностей. Ожирение в основном связано с малоподвижным или неподвижным образом жизни, а деформация – с отсутствием осевой нагрузки на ноги и отсутствием сопротивления для внутренних групп мышц стопы. На фоне дисфункции мочевого пузыря учащается пузырно-мочеточниковый рефлюкс, увеличивается вероятность развития инфекционных заболеваний мочевой системы, что может привести к почечной недостаточности.
Диагностика менингомиелоцеле
Диагностика менингомиелоцеле базируется на сборе анамнестических данных, проведении физикального обследования, использовании лабораторных и инструментальных методов исследования. При сборе анамнеза педиатр может установить факторы риска заболевания или возможную этиологию. Физикальное исследование заключается в непосредственном осмотре грыжевого выпячивания, определении уровня поражения и выявлении симптомов сопутствующих патологий. В общих лабораторных тестах (ОАК, ОАМ) при изолированной форме менингомиелоцеле отклонения от нормы не выявляются. При наличии в анамнезе данных, указывающих на возможную этиологию, могут использоваться специфические анализы – определение концентрации фолиевой кислоты, железа, цинка в плазме крови; ПЦР или ИФА на возбудителей TORCH-инфекций. Для уточнения уровня поражения спинного мозга и размера дефекта применяются методы нейровизуализации – компьютерная и магнито-резонансная томография. Также данные исследования позволяют выявить сопутствующие аномалии строения ЦНС – гидроцефалию, мальформацию Арнольда-Киари и другие. Дифференциальная диагностика менингомиелоцеле проводится с другой формой расщепления позвоночника – менингоцеле.
Лечение менингомиелоцеле
Основное лечение менингомиелоцеле осуществляется хирургическим путем. Суть – послойное закрытие дефекта и формирование спинномозгового столба. Ход операции: выделение и вскрытие грыжевого мешка, погружение тканей ЦНС в позвоночный канал, удаление дефекта и сшивание его остатков, коррекция дужек при помощи миофасциального лоскута. После операции, несмотря на восстановление нормальной структуры спинного мозга, избежать неврологических нарушений удается редко, т. к. ткани спинного мозга и корешков во время внутриутробного развития подвергаются необратимой дегенерации. При сопутствующей гидроцефалии также проводится ее нейрохирургическая коррекция.
Симптоматическая терапия подразумевает лечение развившихся осложнений. Назначают уросептики при частых инфекциях мочеполовой системы, оксибутинина гидрохлорид при дисфункции мочеиспускания и антихолинергические средства для стимуляции нейромедиаторной передачи. Важная роль отводится коррекции рациона ребенка, направленной на компенсацию дефицита микроэлементов. Применяют препараты цинка и железа, фолиевой кислоты, витамина С и В12. При частых запорах рекомендовано увеличить объем потребляемой жидкости.
Прогноз и профилактика менингомиелоцеле
Прогноз при менингомиелоцеле зависит от эффективности проводимого лечения. Как правило, при своевременной хирургической коррекции патологии, адекватной симптоматической терапии и рациональном питании исход достаточно благоприятный.
Специфической профилактики для данной патологии не существует. При отягощенном семейном анамнезе беременной проводится амниоцентез с целью антенатальной диагностики дефектов строения позвоночного столба и спинного мозга плода. Кроме того, используются общепринятые методы исследования в период беременности: УЗИ, определение концентрации альфа-фетопротеина в околоплодных водах. При выявлении TORCH-инфекций осуществляется их лечение и полноценное обследование матери и плода после проведенной терапии. Беременным рекомендуется увеличить количества метионина, витамина В12 и фолиевой кислоты в рационе, т. к. данные вещества снижают риск расщепления позвоночника ребенка.
Хронический миелолейкоз
Хронический миелолейкоз – это злокачественное миелопролиферативное заболевание, характеризующееся преимущественным поражением гранулоцитарного ростка. Может долгое время протекать бессимптомно. Проявляется склонностью к субфебрилитету, ощущением полноты в животе, частыми инфекциями и увеличением селезенки. Наблюдаются анемия и изменение уровня тромбоцитов, сопровождающиеся слабостью, бледностью и повышенной кровоточивостью. На заключительной стадии развиваются лихорадка, лимфоаденопатия и кожная сыпь. Диагноз устанавливается с учетом анамнеза, клинической картины и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10
Хронический миелолейкоз – онкологическое заболевание, возникающее в результате хромосомной мутации с поражением полипотентных стволовых клеток и последующей неконтролируемой пролиферацией зрелых гранулоцитов. Составляет 15% от общего количества гемобластозов у взрослых и 9% от общего числа лейкозов во всех возрастных группах. Обычно развивается после 30 лет, пик заболеваемости хроническим миелолейкозом приходится на возраст 45-55 лет. Дети до 10 лет страдают исключительно редко.
Хронический миелолейкоз одинаково распространен у женщин и у мужчин. Из-за бессимптомного или малосимптомного течения может становиться случайной находкой при исследовании анализа крови, взятого в связи с другим заболеванием или во время профилактического осмотра. У части больных хронический миелолейкоз выявляется на заключительных стадиях, что ограничивает возможности терапии и ухудшает показатели выживаемости. Лечение проводят специалисты в области онкологии и гематологии.
Причины
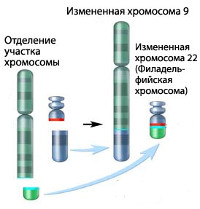
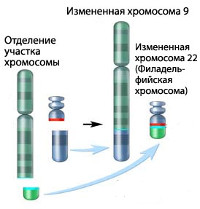
Хронический миелолейкоз считается первым заболеванием, при котором достоверно установлена связь между развитием патологии и определенным генетическим нарушением. В 95% случаев подтвержденной причиной хронического миелолейкоза является хромосомная транслокация, известная как «филадельфийская хромосома». Суть транслокации заключается во взаимной замене участков 9 и 22 хромосом. В результате такой замены формируется устойчивая открытая рамка считывания. Образование рамки вызывает ускорение деления клеток и подавляет механизм восстановления ДНК, что увеличивает вероятность возникновения других генетических аномалий.
В числе возможных факторов, способствующих появлению филадельфийской хромосомы у больных хроническим миелолейкозом, называют ионизирующее облучение и контакт с некоторыми химическими соединениями.
Патогенез
Итогом мутации становится усиленная пролиферация полипотентных стволовых клеток. При хроническом миелолейкозе пролиферируют преимущественно зрелые гранулоциты, но аномальный клон включает в себя и другие клетки крови: эритроциты, моноциты, мегакариоциты, реже – В- и Т-лифоциты. Обычные гемопоэтические клетки при этом не исчезают и после подавления аномального клона могут служить основой для нормальной пролиферации кровяных клеток. Для хронического миелолейкоза характерно стадийное течение.
- При первой, хронической (неактивной) фазе отмечается постепенное усугубление патологических изменений при сохранении удовлетворительного общего состояния.
- Во второй фазе хронического миелолейкоза – фазе акселерации изменения становятся явными, развиваются прогрессирующие анемия и тромбоцитопения.
- Заключительной стадией хронического миелолейкоза является бластный криз, сопровождающийся быстрой экстрамедуллярной пролиферацией бластных клеток.
Источником бластов становятся лимфатические узлы, кости, кожа, ЦНС и т. д. В фазе бластного криза состояние больного хроническим миелолейкозом резко ухудшается, развиваются тяжелые осложнения, завершающиеся гибелью больного. У некоторых пациентов фаза акселерации отсутствует, хроническая фаза сразу сменяется бластным кризом.
Симптомы хронического миелолейкоза
Клиническая картина определяется стадией заболевания. Хроническая фаза в среднем продолжается 2-3 года, в некоторых случаях – до 10 лет. Для этой фазы хронического миелолейкоза характерно бессимптомное течение или постепенное появление «легких» симптомов: слабости, некоторого недомогания, снижения трудоспособности и чувства переполнения живота. При объективном осмотре больного хроническим миелолейкозом может обнаруживаться увеличение селезенки. По анализам крови выявляется повышение количества гранулоцитов до 50-200 тыс./мкл при бессимптомном течении заболевания и до 200-1000 тыс./мкл при «легких» признаках.
На начальных стадиях хронического миелолейкоза возможно некоторое снижение уровня гемоглобина. В последующем развивается нормохромная нормоцитарная анемия. При исследовании мазка крови пациентов с хроническим миелолейкозом отмечается преобладание молодых форм гранулоцитов: миелоцитов, промиелоцитов, миелобластов. Наблюдаются отклонения от нормального уровня зернистости в ту или иную сторону (обильная или очень скудная). Цитоплазма клеток незрелая, базофильная. Определяется анизоцитоз. При отсутствии лечения хроническая фаза переходит в фазу акселерации.
О начале фазы акселерации может свидетельствовать как изменение лабораторных показателей, так и ухудшение состояния пациентов. Возможно нарастание слабости, увеличение печени и прогрессирующее увеличение селезенки. У больных хроническим миелолейкозом выявляются клинические признаки анемии и тромбоцитопении или тробоцитоза: бледность, быстрая утомляемость, головокружения, петехии, кровоизлияния, повышенная кровоточивость. Несмотря на проводимое лечение, в крови пациентов с хроническим миелолейкозом постепенно увеличивается количество лейкоцитов. При этом отмечается возрастание уровня метамиелоцитов и миелоцитов, возможно появление единичных бластных клеток.
Бластный криз сопровождается резким ухудшением состояния больного хроническим миелолейкозом. Возникают новые хромосомные аномалии, моноклоновое новообразование трансформируется в поликлоновое. Отмечается нарастание клеточного атипизма при угнетении нормальных ростков кроветворения. Наблюдаются ярко выраженные анемия и тромбоцитопения. Суммарное количество бластов и промиелоцитов в периферической крови составляет более 30%, в костном мозге – более 50%. Пациенты с хроническим миелолейкозом теряют вес и аппетит. Возникают экстрамедуллярные очаги незрелых клеток (хлоромы). Развиваются кровотечения и тяжелые инфекционные осложнения.
Диагностика
Диагноз устанавливается на основании клинической картины и результатов лабораторных исследований. Первое подозрение на хронический миелолейкоз часто возникает при повышении уровня гранулоцитов в общем анализе крови, назначенном в порядке профилактического осмотра или обследования в связи с другим заболеванием. Для уточнения диагноза могут использоваться данные гистологического исследования материала, полученного при стернальной пункции костного мозга, однако окончательный диагноз «хронический миелолейкоз» выставляется при выявлении филадельфийской хромосомы при помощи ПЦР, флюоресцентной гибридизации или цитогенетического исследования.
Вопрос о возможности постановки диагноза хронический миелолейкоз при отсутствии филадельфийской хромосомы остается дискутабельным. Многие исследователи считают, что подобные случаи могут объясняться комплексными хромосомными нарушениями, из-за которых выявление данной транслокации становится затруднительным. В ряде случаев филадельфийскую хромосому можно обнаружить при использовании ПЦР с обратной транскрипцией. При отрицательных результатах исследования и нетипичном течении заболевания обычно говорят не о хроническом миелолейкозе, а о недифференцированном миелопролиферативном/миелодиспластическом расстройстве.
Лечение хронического миелолейкоза
Тактику лечения определяют в зависимости от фазы заболевания и выраженности клинических проявлений. В хронической фазе при бессимптомном течении и слабо выраженных лабораторных изменениях ограничиваются общеукрепляющими мероприятиями. Больным хроническим миелолейкозом рекомендуют соблюдать режим труда и отдыха, принимать пищу, богатую витаминами и т. д. Лечение может включать:
- Монохимиотерапию. При повышении уровня лейкоцитов используют бусульфан. После нормализации лабораторных показателей и уменьшения селезенки пациентам с хроническим миелолейкозом назначают поддерживающую терапию или курсовое лечение бусульфаном. При бластных кризах осуществляют лечение гидроксикарбамидом.
- Радиотерапию. Облучение обычно используют при лейкоцитозе в сочетании со спленомегалией. При снижении уровня лейкоцитов делают паузу продолжительностью не менее месяца, а затем переходят на поддерживающую терапию бусульфаном. Радиотерапию также назначают при хлоромах.
- Полихимиотерапию. В прогрессирующей фазе хронического миелолейкоза возможно использование одного химиопрепарата или полихимиотерапии. Применяют митобронитол, гексафосфамид или хлорэтиламиноурацил. Как и в хронической фазе, проводят интенсивную терапию до стабилизации лабораторных показателей, в последующем переходят на поддерживающие дозы. Курсы полиохимиотерапии при хроническом миелолейкозе повторяют 3-4 раза в год.
- Гемокоррекцию. При неэффективности терапии используют лейкоцитаферез. При выраженной тромбоцитопении, анемии выполняют переливания тромбоконцентрата и эритроцитарной массы.
- ТКМ.Пересадку костного мозга проводят в первой фазе хронического миелолейкоза. Продолжительной ремиссии удается достичь у 70% пациентов.
- Удаление селезенки. При наличии показаний осуществляют спленэктомию. Экстренная спленэктомия показана при разрыве или угрозе разрыва селезенки, плановая – при гемолитических кризах, «блуждающей» селезенке, рецидивирующих периспленитах и резко выраженной спленомегалии, сопровождающейся нарушением функций органов брюшной полости.
Прогноз
Прогноз при хроническом миелолейкозе зависит от множества факторов, определяющим из которых является момент начала лечения (в хронической фазе, фазе активации или в период бластного криза). В качестве неблагоприятных прогностических признаков хронического миелолейкоза рассматривают значительное увеличение печени и селезенки (печень выступает из-под края реберной дуги на 6 и более см, селезенка – на 15 и более см), лейкоцитоз свыше 100x10 9 /л, тромбоцитопению менее 150x10 9 /л, тромбоцитоз более 500х10 9 /л, повышение уровня бластных клеток в периферической крови до 1% и более, повышение суммарного уровня промиелоцитов и бластных клеток в периферической крови до 30% и более.
Вероятность неблагоприятного исхода при хроническом миелолейкозе возрастает по мере увеличения количества признаков. Причиной гибели становятся инфекционные осложнения или тяжелые геморрагии. Средняя продолжительность жизни пациентов с хроническим миелолейкозом составляет 2,5 года, однако при своевременном начале терапии и благоприятном течении заболевания этот показатель может увеличиваться до нескольких десятков лет.
Миеломная болезнь причины, симптомы, методы лечения и профилактики
Миеломная болезнь — разновидность хронического лейкоза, которая приводит к накоплению в крови патологических однотипных иммуноглобулинов, провоцирует сбои гуморального иммунитета и разрушение костной ткани. Поражает преимущественно кости и костный мозг, реже локализуется в лимфоидной ткани и лимфоузлах, а также в почках, кишечнике, селезёнке и других органах.
Точные причины развития миеломы, как и других форм рака, не установлены. Предположительно, ее провоцируют наследственные факторы, неблагоприятная экология, воздействие радиации. Для лечения миеломной болезни обращайтесь к онкологу.

Формы миеломной болезни
- Локальная узловая форма. Протекает с возникновением одиночного очага поражения. Может быть костной с образованием опухоли в костях, костном мозге и мягкотканной с поражением лимфоидной ткани.
- Множественная форма. Имеет несколько очагов, которые поражают костный мозг позвоночника, плоских и длинных трубчатых костей. Может быть множественно-узловатой, диффузной и диффузно-узловатой.
Статью проверил
Дата публикации: 24 Марта 2021 года
Дата проверки: 24 Марта 2021 года
Дата обновления: 26 Августа 2022 года
Содержание статьи
Симптомы миеломной болезни
На ранних стадиях болезнь протекает бессимптомно, а по мере прогрессирования выдает себя следующими признаками:
- болью в позвоночнике, грудине, ребрах, тазовых, бедренных и других костях, в зависимости от локализации опухоли
- усилением болевых ощущений при пальпации, движениях
- спонтанными переломами костей, компрессионными переломами поясничного и грудного отделов позвоночника
- нарушениями чувствительности, сбоями в работе мочевого пузыря, кишечника
- амилоидозом внутренних органов, суставов, дермы, органов зрения с нарушением их функций: сердечной и почечной недостаточностью, деформацией суставов, ухудшением зрения, кожными высыпаниями
Методы диагностики
Чтобы поставить диагноз, врач собирает анамнез, назначает лабораторные анализы и пройти аппаратную диагностику
МРТ (магнитно-резонансная томография)
УЗИ (ультразвуковое исследование)
Дуплексное сканирование
Компьютерная топография позвоночника Diers
Чек-ап (комплексное обследование организма)
КТ (компьютерная томография)
К какому врачу обратиться
При общем недомогании обратитесь к терапевту. Врач проведет обследование и при необходимости привлечет профильных специалистов. Диагностикой и лечением миеломной болезни занимаются врачи-гематологи.
Как лечить миеломную болезнь
Чтобы добиться ремиссии и улучшить состояние пациента назначают полихимотерапию и поддерживающую терапию.
Последствия
Прогноз при миеломной болезни неблагоприятный. Полной ремиссии удается добиться только в 10% случаев. У остальных пациентов лечение приводит к временном ремиссии, но регулярно происходят рецидивы. С каждым последующим рецидивом период ремиссии становится короче.
Профилактика
Специфическая профилактика болезни не разработана. В целом врачи рекомендуют регулярно проходить профилактические обследования и вести здоровый образ жизни.
Читайте также:
