Строение и функции кадгеринов
Добавил пользователь Евгений Кузнецов Обновлено: 30.01.2026
Кадгерины — основной класс молекул клеточной адгезии, обеспечивающие кальций-зависимое гомофильное соединение клеток в плотных тканях организма. Кадгерины, помимо участия в механическом соединении клеток друг с другом, важны для развития организма (Tepass et al. 2002), образования слоев и групп клеток, узнавания клеток друг другом, передачи сигналов. Классические кадгерины - это первые кадгерины, выделенные в отдельный субтип. Классические кадгерины принадлежат большой семье генов, кодирующей такие молекулы адгезии, как десмосомальный кадгерин, Т-кадгерин (Aberle at al 1996). По структуре классический кадгерин представляет собой трансмембранный протеин, существующий в форме параллельного димера.
Содержание
Классификация
| субтип | пример |
|---|---|
| классические кадгерины | Тип I: Е-кадгерин, N-кадгерин, R-кадгерин |
Тип II: VE-кадгерин
Структура классических кадгеринов
В структуре классических кадгеринов выделяют две части — экстрацеллюлярная и цитоплазматическая.
Структура экстрацеллюлярной части
Классические кадгерины подразделяют на два типа — I и II. Экстрацеллюлярная часть обоих типов состоит из пяти повторяющихся доменов, которые обозначают как EC-1-5, в зависимости от удаленности домена от Н-терминаля. Домен EC-1 (повторяющийся домен, который максимально удален от клетки) — отвечает за специфичность образования контактов, то есть клетки могут вступать в контакт (Zonula adherens) только с клетками, экспримирующими идентичный кадгерин(Nose at al. 1988, Chen et al 2005 Patel at al. 2006), однако в некоторых случаях возможны также гетерофильные контакты между классическими кадгеринами (Shimoyama et al. 2000, Niessen and Gumbiner 2002, Foty and Steinberg 2005). Специфичность образования контактов между клетками очень важна для развития организма, в частности для образования тканей из клеток. Другие EC домены могут взаимодействовать с различными партнерами, тем самым обеспечивая уникальную функциональность кадгеринов. Например домен EC4 может взаимодействовать с рецептор фактора роста фибробластов (FGFR) (Williams et al. 2001).
Структура цитоплазматической части
Цитоплазматическая часть кадгеринов является консервативной. Для каждого субтипа характерна своя структура. Цитоплазматическая часть протеина соединена с бета-катенином (плакоглобином) и белком p120, который стабилизирует кадгерин на поверхности клетки (Davis at al. 2003). Бета-катенин соединяет цитоплазаматическую часть кадгерина с альфа-катенином (Aberle at al. 1994). Последний соединен с актином цитоплазматического скелета(Kobielak and Fuchs 2004). Перечисленные протеины образуют стабильный кадгерин-катениновый комплекс. К этому комплексу подсоединяются также некоторые другие белки, роль которых пока недостаточно изучена.
Распространение среди групп живых организмов
Кадгерины важны как для простых, так и для сложных организмов. Помимо позвоночных, насекомых и нематод, Кадгерины встречаются также в одноклеточных организмах, например в хоанофлаггеллятах (King at al.2003), эукариотических организмах, например Гидрах (Hobmayer at al. 2000), в губках, например Oscarella carmela (Nichols at al. 2006).
Строение и функции кадгеринов
Механизмы адгезии нейронов нейрональными молекулами клеточной адгезии (NCAM)
• Нейрональные молекулы клеточной адгезии (NCAM) экспрессируются только в нейронах и в основном принимают участие в межклеточной гомотипической адгезии, а также функционируют в качестве сигнальных рецепторов
• В нейронах экспрессируются три разных типа белков NCAM, которые являются продуктами альтернативного сплайсинга единственного гена
• Некоторые NCAM ковалентно модифицируются путем присоединения к ним длинных цепей полисиаловой кислоты (PSA), что ослабляет гомотипическое связывание. Ослабление адгезии может играть важную роль в процессе развития нейронов при образовании и разрыве контактов между ними
Хотя такие белки, как кадгерины и интегрины, для выполнения своих функций должны связываться с внеклеточными ионами кальция, это не имеет места для всех белков клеточной адгезии. Основной класс белков адгезии, независимых от кальция, представляют собой нейрональные молекулы клеточной адгезии (NCAM). Они в основном функционируют в качестве рецепторов межклеточной адгезии, хотя также способны связываться с гепарансульфат протеогликанами. NCAM экспрессируются только в нейронах. Они расположены в местах контактов между соседними клетками органов центральной и периферической нервной системы, особенно в нервных волокнах.
В нервных клетках экспрессируются три различных белка NCAM, которые являются продуктами альтернативного сплайсинга единственного гена. Эти белки относятся к суперсемейству иммуноглобулинов (Ig) и содержат характерный структурный элемент, известный под названием домен иммуноглобулина. Домен включает примерно 100 аминокислот, которые образуют петлю, имеющую форму двух b-слоев.
Как показано на рисунке ниже, все три NCAM на амино-конце содержат пять таких петель Ig-доменов, а также два домена фибронектина типа III. NCAM-180 и NCAM-140 (цифры обозначают размер молекулы в килодальтонах) содержат по одному трансмембранному домену и различаются С-концевыми цитоплазматическими участками. Напротив, NCAM-120 своим гликозилфосфатидилинозитоловым концом прикрепляется к клеточной поверхности. Все три формы NCAM могут диссоциировать с поверхности клеток — NCAM-180 и NCAM-140 за счет протеолиза, NCAM-120 при действии фосфолипаз — и высвобождаться в виде растворимых молекул, диффундирующих в спинномозговую жидкость и плазму. Растворимые NCAM способствуют адгезии нейронов и образованию нейритов (представляющих собой аксоны).
NCAM клеточной поверхности могут функционировать в качестве сигнальных рецепторов, связываясь со специфической областью на рецепторах фактора роста фибробластов. Образование на поверхности клеток таких латеральных ассоциатов приводит к открытию кальциевых каналов, по-видимому, в результате протекания сигнальных процессов с участием фосфолипазы С, диацилглицерина и арахидоновой кислоты. По крайней мере, одна форма NCAM, NCAM-140, также связывается с тирозинкиназой нерецепторного происхождения — p59fyn, которая обеспечивает связь рецептора с активацией киназы фокальной адгезии. Таким образом, рецепторы NCAM активируют те же сигнальные процессы, которые активируют и другие рецепторы. Эти процессы подробно не изучены.
После образования в эндоплазматическом ретикулуме, на пути к поверхности клеток, NCAM подвергаются различным посттрансляционным модификациям, которые происходят в аппарате Гольджи. Эти модификации включают фосфорилирование, сульфатирование и гликозилирование. К наиболее значительной из этих модификаций относится добавление к молекуле длинных линейных цепей, состоящих из сиаловых кислот. Они называются полисиаловые кислоты (PSA) и присоединяются к N-сахарам, расположенным на двух аспарагиновых остатках пятого домена Ig.
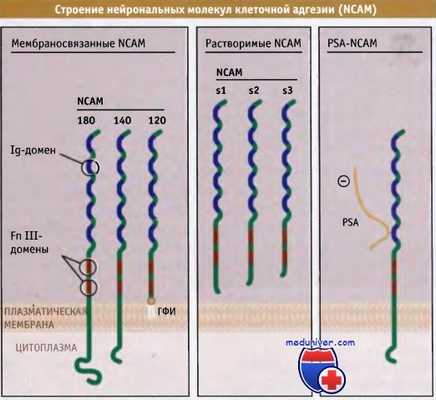
NCAM образуются как в виде мембраносвязанных, так и растворимых белков различной величины.
Представлена доменная организация NCAM. Внеклеточные участки молекулы NCAM могут модифицироваться при добавлении полисиаловой кислоты (PSA),
которая присоединяется к остатку аспарагиновой кислоты при прохождении белка по секреторному пути (представлена модель трансмембранной формы PSA-NCAM, размером 140 кДа).
Добавление PSA существенно меняет форму и функции NCAM. Поскольку сиаловые кислоты несут отрицательный заряд, их цепи распространяются в стороны от молекулы белка, притягивают к себе катионы, и, подобно цепям гликозаминогликанов в протеогликанах, связываются с молекулами воды. Присоединение PSA к NCAM оказывает наиболее сильное влияние на адгезивную функцию рецепторов. В основном мембраносвязанные NCAM связываются с такими же рецепторами, расположенными на соседних клетках. Подробности механизма этого гомофильного связывания неизвестны, однако в нем принимают участие Ig-домены на амино-концевых участках каждого рецептора.
Согласно представлениям современной модели, все пять Ig-доменов рецепторов NCAM перекрываются, что приводит к формированию сильной и прочной адгезии между примыкающими клетками. Однако рецепторы PSA-NCAM перекрываются неполностью, вероятно, из-за большого объема гидратации и отрицательного заряда на цепях PSA. Это вызывает отталкивание Ig-доменов комплементарных рецепторов, расположенных на примыкающих клетках. В результате клетки, содержащие PSA-NCAM, менее прочно связываются друг с другом, чем клетки, в которых NCAM не модифицирован PSA.
В чем заключаются преимущества существования сильно и слабо связывающихся форм одного и того же рецептора? Вспомним, что в процессе развития клетки должны расти и проявлять подвижность с тем чтобы возможно было формирование тканей. В течение этого периода клетки неоднократно образуют между собой контакты и разрушают их. Это особенно характерно для таких клеток, как нейроны, которые в зрелом организме должны сформировать множественные и в высшей степени специфичные межклеточные контакты.
Поэтому для развивающихся нейронов крайне необходимы межклеточные взаимодействия, которые осуществляются с участием PSA-NCAM и характеризуются низким сродством, но высокой специфичностью.
Прямые подтверждения того, что PSA необходимы для контроля развития нейронов, получить крайне трудно, однако несколько групп данных говорят в пользу этого предположения:
• Иммуногистохимическими методами с применением антител, специфичных к NCAM, содержащим и не содержащим цепи PSA, показано, что около 30% NCAM в клетках мышиных эмбрионов содержат PSA, причем в клетках взрослых животных это количество снижается до 10%.
• Два фермента, принимающие участие в образовании PSA, полисиалилтрансфераза и сиалилтрансфераза-X экспрессируются, главным образом, в эмбриональной нервной ткани.
• Нарушение функций PSA-NCAM в процессе развития животных или с помощью ферментов, отщепляющих PSA, или антител, блокирующих PSA-NCAM, вызывает формирование пороков развития головного мозга.
• Аналогичные дефекты обнаруживаются у мышей с нокаутом генов NCAM.
NCAM также могут играть важную роль в структурных перестройках нейронов, происходящих у взрослых животных. Поскольку они участвуют в перестройке нейронных связей, PSA-NCAM могут отвечать за физическое ремоделирование головного мозга, происходящее в процессах запоминания и обучения. В под держку этого предположения свидетельствуют данные о том, что у грызунов уровень PSA-NCAM после обучения увеличивается, и отщепление PSA от NCAM (при действии эндосиалидазы) снижает скорость и точность выполнения тестов памяти.
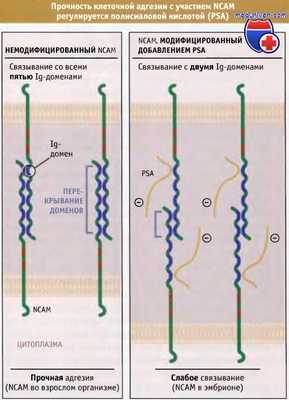
Немодифицированные NCAM связываются между собой посредством пяти Ig-доменов, что обеспечивает прочную адгезию.
NCAM, модифицированный при присоединении PSA, связывается только с двумя Ig-доменами,
и это снижает прочность адгезии.
В присутствии PSA нарушается перекрывание молекул селектинов,
что приводит к слабой адгезии в процессе развития организма.
У взрослых организмов не происходит присоединения PSA к селектинам,
и, таким образом, у них обеспечивается прочность межклеточных взаимодействий.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Строение и свойства адгезивных контактов клеток
• Адгезивные контакты представляют собой семейство близких поверхностных доменов, которые связывают соседние клетки друг с другом
• Адгезивные контакты содержат трансмембранные кадгериновые рецепторы
• Наиболее полно изученный адгезионный контакт, называемый опоясывающим зональным контактом, или адгезивным пояском (zonula adherens), расположен в контактном комплексе, который образуется в некоторых тканях между соседними эпителиальными клетками
• В опоясывающем зональном контакте адаптерные белки, которые называются катенинами, связывают кадгерины с актиновыми филаментами
Адгезивные контакты представляют собой компоненты контактного комплекса, благодаря которому скрепляются между собой клетки эпителия и эндотелия. В электронном микроскопе адгезивные контакты выглядят в виде темных утолщенных полос, расположенных в примыкающих областях плазматической мембраны соседних клеток, связанных стержнеобразными структурами, простирающимися в межклеточное пространство. На представлен наиболее полно исследованный адгезивный контакт, называемый опоясывающий зональный контакт, или адгезивный поясок (zonula adherens) В комплексе, формирующемся между некоторыми эпителиальными клетками, он располагается непосредственно под плотным контактом.
(Исследователи, впервые обнаружившие этот контакт, назвали его «опоясывающей десмосомой» из-за внешнего сходства с большой десмосомой. Сейчас мы знаем, что этот контакт отличается от десмосомы, и поэтому старое название больше не используется.) Другие примеры адгезивных контактов включают контакт в синапсе между нейронами ЦНС, контакт во вставочных дисках между клетками миокарда, и контакт между слоями миелиновой оболочки, окружающей периферические нервы.
Несмотря на свое местоположение, адгезивные контакты имеют два общих свойства. Во-первых, они содержат трансмембранные белки-рецепторы, которые называются кадгерины. Эти белки связываются с одноименными белками, расположенными на соседних клетках. Связывание рецепторов, расположенных на одной клетке, с такими же рецепторами другой называется гомофильным связыванием.
Предполагается, что этот тип связывания играет важную роль в обеспечении клеточной организации ткани, способствуя возникновению специфического взаимодействия клеток между собой. Это можно проиллюстрировать, экспрессируя гены двух различных кадгериновых рецепторов в двух разных популяциях одних и тех же клеток, поместив эти популяции в одну чашку Петри. Через несколько часов клетки самоорганизуются в группы, экспрессирующие тот или иной рецептор.
Если к культуре добавить антитела, блокирующие сайты гомофильного связывания кадгеринов, то группы клеток не образуются.
Димеры кадгериновых рецепторов, участвующие в адгезивных контактах, содержат пять внеклеточных доменов, которые полностью обеспечивают гомофильное связывание. Как показано на рисунке ниже, возможны три отдельных перекрывающихся положения этих доменов. Наиболее прочное связывание происходит, когда рецепторы перекрываются антипараллельно и полностью, в то время как их частичное перекрывание обеспечивает более слабые взаимодействия.
При изменении числа кадгериновых рецепторов на поверхности клеток может меняться прочность их связывания с соседними клетками; этот процесс называется модуляцией связывания. Мы не располагаем данными в пользу того, что кадгерины претерпевают конформационные изменения, приводящие к изменению сродства и контролирующие прочность связывания адгезивных контактов. Такие конформационные изменения известны под названием модуляции сродства и характерны для интегриновых рецепторов.
Второе свойство адгезивных контактов связано с тем, что они оказываются достаточно сильными для того, чтобы изменять форму ткани и/или противостоять силам сдвига. Например, как схематически показано на рисунке ниже, в связывании цитоплазматических хвостов кадгериновых рецепторов с пучками актина в опоясывающем зональном контакте участвуют якорные белки, известные под названием катенины. В свою очередь, актиновые филаменты этих пучков присоединены к миозиновым белкам, которые обеспечивают им возможность скользить по отношению друг к другу.
Считается, что это приводит к сокращениям, меняющим форму апикального полюса эпителиальных клеток. Это может быть важно, например, при развитии нервной трубки, когда за счет инвагинации эпителиальных клеток закрывается ее желобок.
Наряду с адгезивными функциями, обусловленными присутствием кадгерина, адгезивные контакты также участвуют в специфических процессах неизвестной природы. На основании генетических экспериментов на плодовой мушке предполагается, что в формировании морфологически четких опоясывающих зональных контактов участвуют белки, отличные от кадгеринов и катенинов. Эти дополнительные белки могут также регулировать сборку цитоскелета на сайтах, расположенных на значительных расстояниях от самих адгезивных контактов. Например, они могут участвовать в формировании полярности эпителиальных клеток, и, таким образом, косвенно влиять на сборку других клеточных контактов, включая плотные. В настоящее время исследователи пытаются выяснить, каким образом это происходит.
Опоясывающий зональный контакт является частью контактного комплекса.
С цитоплазматической стороны плазматической мембраны к контакту примыкают актиновые пучки.
Кадгерины образуют стержневые структуры между клетками и связываются с актиновым цитоскелетом через якорные белки, такие как катенины. Каждый тип адгезивных контактов прочно удерживает соседние клетки вместе Клетки, экспрессирующие идентичные кадгериновые рецепторы, селективно связываются между собой.
Такое гомофильное связывание играет важную роль в формировании тканей в процессе развития. Кадгериновые белки образуют димеры, которые связываются друг с другом.
Показаны три типа взаимодействия кадгеринов.
Прямые измерения силы взаимодействия показывают,
что наибольшей степени перекрывания соответствует максимальная прочность связывания.
• Кадгерины принадлежат к семейству белков трансмембранных рецепторов клеточной поверхности; это семейство подразделяется на восемь групп
• Наиболее полно изученная группа кадгеринов, «классические кадгерины», играет роль в формировании и функционировании таких межклеточных адгезивных комплексов, как адгезивные контакты
• Классические кадгерины функционируют в виде кластеров димеров, и прочность адгезивных контактов регулируется изменением числа димеров, которые экспрессируются на поверхности клетки, а также степенью их кластеризации
• Классические кадгерины присоединяются к цитоплазматическим адаптерным белкам, называемым катенинами, которые связывают кадгерины с актиновым цитоскелетом
• Кластеры кадгеринов регулируют процессы внутриклеточной передачи сигналов, образуя каркас цитоскелета, который способствует трехмерной организации комплексов из сигнальных белков и их субстратов
• Классические кадгерины необходимы для тканевого морфогенеза; в основном они контролируют специфичность межклеточной адгезии, а также изменения формы и подвижности клеток
Семейство кадгеринов состоит более чем из 70 структурно близких белков, которые имеют два общих свойства: внеклеточные участки этих белков для приобретения правильной конфигурации должны связываться с ионами кальция (отсюда «ка» в их названии), и эти белки присоединяются к другим белкам (отсюда от англ, adhere «адгерин»).
Кадгерины участвуют в межклеточной адгезии, миграции клеток и в передаче сигналов. Впервые кадгерины были обнаружены в белках опоясывающего зонального контакта, образующегося между эпителиальными клетками. Сейчас эти белки называются классические кадгерины, что позволяет отличить их от других, более отдаленных, представителей этого семейства.
Все классические кадгерины являются трансмембранными рецепторами, обладающими одним трансмембранным доменом, пятью внеклеточными доменами, расположенными на N-концевом участке молекулы, и консервативным цитоплазматическим С-хвостом, как представлено на рисунке ниже. У позвоночных пять классических кадгеринов обозначаются как Е-, Р-, N-, R- и VE-кадгерины. Это сокращенные обозначения органов и тканей, в которых они впервые были обнаружены: эпителий, плацента, нервная система, сетчатка и эндотелий сосудов.
Сейчас мы знаем, что экспрессия каждого типа кадгеринов не ограничивается этими тканями, однако названия «прижились».
Классические кадгерины функционируют в виде кластеров димеров, расположенных на поверхности клеток. Эти димеры связываются с идентичными димерами, находящимися на соседних клетках (гомофильное связывание). N- и R-пары кадгеринов также связываются друг с другом (гетерофильное связывание). Клетки контролируют прочность связывания за счет модуляции авидности, что включает как изменение общего числа рецепторов на их поверхности, так и латеральную диффузию рецепторов по плазматической мембране. Не собранные в кластеры кадгерины не образуют прочных контактов с окружающими клетками.
Существуют прямые доказательства участия кадгериновых кластеров в межклеточной адгезии. В соответствующих экспериментах продемонстрирована роль цитоплазматических хвостов кадгеринов в образовании димеров. Как показано на рисунке ниже, рекомбинантный химерный белок, содержащий внеклеточный и трансмембранный домены кадгеринового рецептора и цитоплазматический хвост от совершенно другого белка, FKBP12, экспрессировали в клетках, которые обычно друг с другом не связываются.
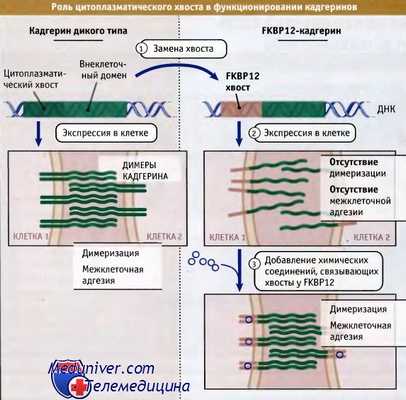
В адгезии, происходящей с участием внеклеточных доменов кадгеринов,
важную роль играет их цитоплазматический хвост.
Поскольку цитоплазматические хвосты FKBP12 не связываются между собой, химерный белок не образует димеров. В результате клетки не агрегируют. Однако при добавлении химического соединения, которое связывается с цитоплазматическим хвостом белка FKBP12, происходит сближение кадгериновых участков химерного белка, и они образуют кластеры димеров. При этом клетки связываются друг с другом.
Область, расположенная с С-концевой стороны участка цитоплазматического хвоста классического кадгерина, связывается с цитоплазматическим белком, который называется b-катенин. Эта область включает 56 аминокислот. Будучи связанным с кадгерином, b-катенин действует как адаптерная молекула, присоединяясь к а-катенину, который, в свою очередь, скрепляется с актиновыми филаментами. (a- и b-катенины обладают различной первичной структурой).
Поэтому b-катенин служит связующим звеном цепи белков, образующейся между кадгериновыми димерами на поверхности клеток и актиновым цитоскелетом. Как отмечалось выше, разрыв этой цепи при невозможности образования димеров приводит к нарушениям клеточной адгезии. Еще один эксперимент, в котором продемонстрирован разрыв этой цепи, представлен на рисунке ниже. Клетки, экспрессирующие мутантный ген b-катенина, который не обладает последовательностью, кодирующей сайт связывания а-катенина, не связываются друг с другом. Это происходит потому, что мутантный b-катенин может связываться с цитоплазматическим хвостом кадгеринов, но не связывается с а-катенином.
b-Катенин, не связанный с кадгеринами, участвует во внутриклеточных системах передачи сигналов, особенно при действии такого фактора роста, как Wnt, который изменяет экспрессию генов. В клетках, стимулированных Wnt, b-катенин, не связанный с кадгеринами и а-катенином, связывается с фактором транскрипции. р-Катенин поступает в ядро и связывается с факторами транскрипции, контролирующими экспрессию генов клеточного роста.
Считается, что кадгерины контролируют рост клеток косвенным образом, изолируя b-катенин в адгезивном комплексе и ограничивая активность фактора роста Wnt.
Еще один белок, который связывается с цитоплазматическим хвостом кадгерина, представляет собой сигнальный адаптерный белок, p120CAS. Этот белок также служит субстратом для Src семейства тирозинкиназ, присутствующих в кадгериновых адгезивных контактах. В кадгериновых кластерах также обнаружены другие сигнальные молекулы, что позволяет рассматривать кадгерины как непосредственных участников систем передачи внутриклеточных сигналов.
Фактически b-катенин фосфорилируется Src тирозинкиназами. Однако мы не располагаем данными, свидетельствующими о том, что сами кадгерины являются сигнальными молекулами. Более вероятно, что поскольку они могут связываться с цитоскелетом и с такими сигнальными адаптерами как p120CAS, то кадгерины и образуемые ими контакты могут выступать в качестве структурной основы, организующей сигнальные молекулы в целях регуляции их активности. Образование комплекса взаимодействующих сигнальных молекул характерно для процессов передачи сигналов и происходит, например, в фокальных адгезиях, связанных с кластерами интегриновых рецепторов. Используя аналогию, можно сказать, что кадгерины действуют как коммутатор, а не как телефонный аппарат.
Классические кадгерины играют очень важную роль в процессах развития, контролируя степень межклеточной адгезии и участвуя в процессе специфического узнавания клеток. Например, в процессе развития Е-кадгерины экспрессируются на стадии образования бластоцисты, и считается, что за счет них клеточная адгезия увеличивается, когда в развивающемся эмбрионе возникают плотные контакты и впоследствии происходит поляризация клеток эпителия.
Неудивительно, что генетический нокаут Е-кадгериновых генов приводит к гибели организмов на ранних этапах развития.
Мутации в генах других кадгеринов или их нокаут оказывает влияние на развитие многих органов, включая головной и спинной мозг, легкие и почки. Существенным моментом, общим для всех этих процессов развития, является форма движения клеток, известная под названием инвагинация. Например, у позвоночных нервная ткань закладывается при образовании гребня клетками эктодермы вдоль внешней поверхности эмбриона. Нервный гребень углубляется в желобок, который затем замыкается, образуя нервную трубку.
При образовании нервной трубки апикальные домены эпителиальных клеток должны сократиться, и клетки должны загнуться внутрь, формируя желобок, а затем диссоциировать и переместиться на новое место с тем, чтобы закрыть нервную трубку. Подобная инвагинация происходит при образовании многих тканей из клеток эктодермы, причем с участием различных типов межклеточных контактов. При делеции кадгериновых генов наблюдаются такие аномалии развития, как формирование неустойчивых моторных навыков. Эта аномалия связана с появлением функционально неполноценных нейронов, также обусловленным нарушением инвагинации эпителия.
Цитоплазматические хвосты кадгерина связываются с актиновыми филаментами через катениновые белки.
Катениновые комплексы также содержат другие линкерные и сигнальные белки, которые на схеме не показаны.
Для межклеточной адгезии с участием кадгерина, на b-катенине необходимо присутствие домена, связывающегося с а-катенином. При образовании нервной трубки апикальная поверхность клеток нервной пластинки сокращается,
что вызывает загиб ее краев внутрь.
N-кадгерин
N-кадгерин вместе с E- и P-кадгеринами относится к 1-му типу кадгеринов, кальций-зависимым белкам клеточной адгезии. Они вовлечены в гомофильные взаимодействия, образуя межклеточные контакты. N-кадгерин участвует в механизме нейронального распознавания. В нейронах гиппокампа он может регулировать плотность дендритных шипиков. [2]
Структура
N-кадгерин состоит из 747 аминокислот (после созревания), молекулярная масса белковой части — 99,8 кДа. Основной N-концевой участок (565 аминокислот) является внеклеточным, далее расположен единственный трансмембранный фрагмент и внутриклеточный фрагмент (161 аминокислота). Внеклеточный фрагмент включает 5 повторов кадгеринового домена и от 4 до 7 участков N-гликозилирования. Цитозольный фрагмент содержит участок фосфорилирования (по тирозиновому остатку).
Взаимодействует с CDCP1. Обнаружен в комплексе с FGFR4, NCAM1, PLCG1, FRS2, SRC, SHC1, GAP43 и CTTN. Взаимодействует с PCDH8, образуя комплекс, который может содержать TAOK2 и интернализоваться через механизм, опосредованный TAOK2/p38 MAPK.
См.также
Примечания
- ↑ Reid RA, Hemperly JJ (October 1990). «Human N-cadherin: nucleotide and deduced amino acid sequence». Nucleic Acids Res.18 (19): 5896. PMID 2216790.
- ↑Uniprot database entry for CD325 (accession number P19022)
Библиография
- Becker SF, Langhe R, Huang C, Wedlich D, Kashef J (March 2012). «Giving the right tug for migration: Cadherins in tissue movements». Arch Biochem Biophys. DOI:10.1016/j.abb.2012.02.013. PMID 22387375.
- Brigidi GS, Bamji SX (April 2011). «Cadherin-catenin adhesion complexes at the synapse». Curr. Opin. Neurobiol.21 (2): 208–14. DOI:10.1016/j.conb.2010.12.004. PMID 21255999.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "N-кадгерин" в других словарях:
VE-кадгерин — Кадгерин 5 2 го типа (сосудистого эндотелия), VE кадгерин Обозначения Символы CDH5; 7B4, CD144 Entrez Gene … Википедия
E-кадгерин — E кадгерин, кадгерин 1 Структура молекулы E кадгерина Обозначения … Википедия
Кадгерины — Кадгерины основной класс молекул клеточной адгезии, обеспечивающие кальций зависимое гомофильное соединение клеток в плотных тканях организма. Кадгерины, помимо участия в механическом соединении клеток друг с другом, важны для развития… … Википедия
16-я хромосома человека — Идиограмма 16 й хромосомы человека 16 я хромосома человека одна из 23 человеческих хромосом. Хромосома содержит около 90 млн пар оснований[1] … Википедия
Катенин (белок) — У этого термина существуют и другие значения, см. Катенин. Катенин бета 1 (белок, связанный с кадгеринами), 88 кДа … Википедия
VLA-2 — Интегрин альфа 2 Структура белка ITGA2 Обозначения … Википедия
Подоцит — Строение почечного тельца Кровь течет в приносящую артериолу (9) вверху, и из выносящей артериолы (11) внизу. Кровь протекает через капилляры клубочка (10), где она фильтруется за счет давлени … Википедия
Читайте также:
