Лимфатическая мальформация у новорожденного
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
А.В. Петухов, Д.Ю. Комелягин, О.З. Топольницкий, С.В. Яматина
Детская городская клиническая больница святого Владимира; Московский государственный медико-стоматологический университет им. А.И. Евдокимова; НИИ хирургии детского возраста РНИМУ им. Н.И. Пирогова
Введение. Лимфатическая мальформация (ЛМ) — это порок развития лимфатических сосудов, имеющий различные формы проявления. Порок развития лимфатических сосудов и вен является комбинированным и носит название лимфовенозной мальформации (ЛВМ). В области головы и шеи встречается кистозный тип мальформаций.
Ранее к доброкачественным образованиям из лимфатических сосудов применялся термин «лимфангиома», а к лимфовенозным мальформациям — термин «лимфгемангиома». В настоящее время с помощью иммуногистохимических методов исключены маркеры опухолей в данных образованиях и рекомендовано их называть мальформациями или ангиодисплазиями (P. North, 2010).
Вышеуказанные нозологические единицы представлены в одной из современных классификаций пороков развития сосудов, а именно классификации Международного общества по изучению сосудистых мальформаций (ISSVA, 2014 г.). В данное международное сообщество входят специалисты из всех стран мира, активно занимающиеся изучением сосудистых опухолей и ангиодисплазий.
Основными методами лечения лимфатических мальформаций у детей в области головы и шеи являются следующие: хирургический, склерозирующая терапия и комбинированный (А.П. Малинин, 1974; В.В. Приходченко, 1986).
По мере накопления опыта лечения больных склерозирующей терапией отечественными учеными были выявлены следующие недостатки данного метода лечения: введение в патологические ткани 70 и 96% растворов спирта вызывало выраженный болевой синдром; существовал высокий риск передозировки склерозирующего раствора; раствор хинин-уретана оказался не-удобен для применения из-за быстрой дезактивации раствора, наличия индивидуальной непереносимости к хинину, частого отсутствия необходимых ингредиентов. Также к недостаткам относились длительность лечения и необходимость многократных инъекций склерозирующих растворов для получения полного фиброзирования образования (А.П. Малинин, 1974).
S. Wiegand (2011) провела анализ публикаций по склерозирующей терапии и указала на следующие данные: при крупнокистозной форме мальформаций препарат ОК-432 был эффективен у 96% пациентов в исследовании C. Giguere (2002), а по данным J. Yoo (2009), хороший результат при лечении 55 больных был получен в 76% случаев; P. Burrows (2008), пролечив 41 пациента с лимфатической мальформацией головы и шеи доксициклином, получил хороший результат в 83% случаев; Z. Qin (1998) пролечил 200 пациентов с лимфангиомами препаратом блеомицин и получил хороший результат в 86% случаев.
Несмотря на полученные хорошие результаты лечения, разнообразие применяемых препаратов косвенно говорит об отсутствии идеального препарата. При этом анализ результатов проводился с использованием разных критериев, что приводило к отличающимся численным данным.
По изученным источникам литературы, отсутствие стандартов лечения является причиной разработки новых методик лечения.
Цель исследования — разработать алгоритм склерозирующей терапии для лечения детей с лимфатическими и лимфовенозными мальформациями головы и шеи с применением современных препаратов.
Материал и методы. С 2011 по 2017 г. в отделении челюстно-лицевой хирургии ДГКБ святого Владимира (Москва) проведено лечение 42 детей с лимфатическими и лимфовенозными мальформациями в области головы и шеи методом пункционной склерозирующей терапии. Из них 15 (35,7%) девочек, 27 (64,3%) мальчиков. ЛМ были у 31 (73,8%), ЛВМ — у 11 (26,2%) больных. По возрастным группам пациенты делились следующим образом: с рождения до 1 года включительно было 12 детей, с 1 года до 3 лет — 12 пациентов, с 3 до 7 лет — 13, с 7 до 11 лет — 4, с 12 до 17 лет — 1 ребенок. Общее число детей до 3 лет 24 (57,1%).
Крупнокистозная форма была выявлена у 22 (52,4%) пациентов, смешанная — у 19 (45,2%) больных, мелкокистозная — у 1 (2,4%) ребенка.
Ограниченная форма мальформации, когда патологические ткани занимают не более 2 областей, встретилась у 20 (47,6%) больных. Патологические ткани локализовались в следующих областях: орбитальная — 1 (5%), щечная — 4 (20%); околоушно-жевательная — 3 (15%); дно полости рта — 2 (10%), шея — 10 (50%).
Обширная форма мальформаций (порочные ткани занимают 3 области и более) выявлена у 22 (52,4%) больных. Наиболее часто ЛМ и ЛВМ определялись в областях дна полости рта с распространением на околоушно-жевательную область и шею.
Крупнокистозная форма ЛМ и ЛВМ встречалась в областях шеи и в щечной области, мелкокистозная мальформация располагалась в области языка, подбородка, верхней губы. При локализации патологических тканей в пространствах дна полости рта, орбите, околоушно-жевательной области чаще всего определялась смешанная форма мальформации.
Операции проводились по жизненным, функциональным и косметическим показаниям.
Пациенты готовились к плановой операции по общим правилам, для чего собирались данные по общему и биохимическому анализам крови, общему анализу мочи, ЭКГ.
В алгоритм обследования детей с ЛМ и ЛВМ были включены следующие обследования: ультразвуковое исследование (Toshiba Aplio MX), МРТ (Toshiba Atlas 1,5T), фиброларингоскопия (Olympus Exera II CLV 180), магнитно-резонансная томография (Toshiba Atlas 1,5T). Компьютерная томография (Toshiba Aquilion 16) проводилась при обширных образованиях с подозрением на поражение костей черепа и деформацию последних.
При проведении диагностики образований наибольшую трудность вызывало установление до операции диагноза ЛВМ. В ходе операции данный диагноз ставился после пункции кисты и получения лимфы с кровью. Однако в дальнейшем, при накоплении опыта проведения МРТ, предварительный диагноз лимфовенозная мальформация ставился по данным обследования, проведенного в режиме Т2-взвешенного изображения, когда получали 2 разных сигнала от жидкостей, находящихся в одной кисте и четко разделенных друг от друга. Один сигнал характеризовал наличие в кисте жидкого содержимого (лимфы), а другой — более насыщенной или густой жидкости (крови). Диагноз Л.М. ставился при получении из образования лимфы.
Противопоказаниями для применения доксициклина являлись: гиперчувствительность, порфирия, тяжелая печеночная недостаточность, лейкопения; для блеомицина: гиперчувствительность, выраженная дыхательная недостаточность (фиброз легких, хроническая интерстициальная пневмония, острые легочные инфекции), тяжелая хроническая почечная недостаточность, атаксия-телеангиэктазия (синдром Луи—Бар). Противопоказаний к применению данных препаратов у пролеченных детей выявлено не было.
Склерозирующая терапия проводилась пункционным методом с ультразвуковой навигацией в условиях общей анестезии. Вид анестезии, комбинированный ингаляционный наркоз с интубацией трахеи или использованием ларингеальной маски зависел от локализации и объема патологических тканей. Интубация трахеи проводилась, во-первых, при наличии риска развития отека тканей дна полости рта, глотки и гортани, во-вторых, при локализации патологических тканей в полости рта для удобства проведения операции.
Пункция, аспирация содержимого полостей мальформации и введение в полость склерозирующего препарата проводились с использованием внутривенных катетеров 14G (2,1×45 мм) или 16G (1,8×45 мм), которые фиксировались к кожному покрову узловыми швами. Большой диаметр рабочей части позволил уменьшить риск закупорки входного отверстия катетера взвесью, образующейся в кисте после обработки склерозирующим раствором, а также снизил возможность перекрытия входа в катетер септой многокамерной формы мальформации.
Эвакуируемое содержимое полостей направлялось на цитологическое исследование. В эвакуируемой лимфе выявлены лимфоциты, единичные макрофаги на фоне слущенного эпителия, единичные клетки красной крови. При ЛВМ в пунктате на кровянистом фоне были определены лимфоидные элементы в большом количестве, моноцитарные структуры, клетки красной крови в большом количестве.
Объем склерозирующего раствора, вводимого в полость кисты, соответствовал объему лимфы (ЛМ) или лимфы с примесью крови (ЛВМ), удаленной из образования. Экспозиция препарата составляла 60 мин.
Сразу после операции (в течение 5 сут) проводилась оценка возможной токсической и аллергической реакции, местных воспалительных симптомов, выраженности болевого синдрома.
Введенный в образование раствор пассивно эвакуировался из полости мальформации в специальную емкость в течение 3—5 сут через установленный катетер. Последний удалялся из полости мальформации при отсутствии отделяемого из образования. Обычно это происходило на 3—5-е сутки. В послеоперационном периоде использовались давящие повязки. На 1-е, 3-и сутки после операции проводились контрольные ультразвуковые исследования. Пациент выписывался на 5-е сутки после операции. Клинический и ультразвуковой осмотры проводились через 1, 3, 6, 12 мес после операции и далее каждые 6 мес при отсутствии жалоб. Через 6 мес после операции проводилась контрольная магнитно-резонансная томография. Далее данное исследование проводилось 1 раз в год.
Результаты. Анализ результатов лечения и осложнений у детей с ЛМ и ЛВМ головы и шеи проводился по ряду параметров. Оценивались, во-первых, токсические и аллергические реакции, местные воспалительные симптомы, выраженность болевого синдрома, во-вторых, уменьшение объема образования. Наибольшая длительность наблюдения больных составила 6 лет.
Стоит отметить, что в результате проведенной работы не выявлена зависимость результатов лечения от вида мальформации (ЛМ, ЛВМ).
Одному ребенку с обширной лимфовенозной мальформацией дна полости рта, шеи, языка была проведена склерозирующая терапия крупных кист по жизненным показаниям. В результате лечения общий объем патологических тканей уменьшился незначительно. Послеоперационный период осложнился развитием некроза подкожно-жировой клетчатки и кожи, прилежащих к кистам образования. Однако угрозы жизни удалось избежать. От дальнейшего хирургического удаления патологических тканей отказались родители.
В послеоперационном периоде после применения раствора доксициклина отмечались выраженный болевой синдром у 25 (81%) больных, диспепсические расстройства (тошнота, рвота) у 5 (16%) детей. Болевой синдром купировался применением анальгетиков или нестероидных противовоспалительных препаратов в возрастных дозировках. У всех пациентов тошнота и однократная рвота купировались самостоятельно в течение суток. В ряде случаев в месте введения данного склерозирующего раствора через сутки после операции определялась выраженная инфильтрация мягких тканей.
У пациентов, которым применялся раствор блеомицина, болевого синдрома не было, однако диспепсические расстройства и лихорадка (субфебрильная, фебрильная) присутствовали у большинства больных (9 детей, 82%). Данные симптомы купировались самостоятельно или на фоне инфузионной терапии, приема жаропонижающих средств.
Аллергических реакций на введенные препараты выявлено не было ни у одного пациента.
Предварительные результаты лечения оценивались после однократного введения склерозирующего раствора не ранее чем через 3 мес после операции. Критерием оценки результатов лечения было уменьшение объема образования. Оценка проводилась на основании клинических данных и результатов ультразвукового исследования.
Отличный результат определялся при уменьшении объема образования более чем на 90%, хороший результат — от 50 до 90%, удовлетворительный — от 30 до 50%, неудовлетворительный — менее 30%.
Через 3 мес после применения доксициклина при лимфатической и лимфовенозной мальформации были получены следующие результаты: отличный — 15 (48,4%) детей, хороший — 9 (29%) больных, удовлетворительный — 2 (6,5%) пациента и неудовлетворительный — 5 (16,1%) детей. При крупнокистозной, ограниченной форме ЛМ и ЛВМ отличный результат был получен более чем в 85% случаев. При мелкокистозной форме мальформации результат лечения был неудовлетворительным.
После применения 11 больным раствора блеомицина отличный результат был получен у 1 (9,0%) ребенка, хороший — у 3 (27,3%), удовлетворительный — у 3 (27,3%), неудовлетворительный — у 4 (36,4%) пациентов. С крупнокистозной формой мальформации отличный результат лечения был получен только у 1 (14,3%) больного.
Таким образом, отличный и хороший результаты после применения доксициклина были получены в 77,4%, а при использовании раствора блеомицина — в 36,4% случаев.
При сохранении образования через 3 мес после лечения, но уменьшении его объема проводилось наблюдение до 6 мес после операции. Через 6 мес после операции проводилась контрольная магнитно-резонансная томография, по результатам которой при наличии крупных кист (более 1 см в диаметре) выставлялись показания к повторной операции. Повторные операции проводились также при наличии функциональных и косметических показаний.
После однократного применения доксициклина повторная склерозирующая терапия из 11 детей с хорошими и удовлетворительными результатами была проведена только 2 пациентам в связи с наличием функциональных и косметических показаний. Повторная операция после применения блеомицина проведена 4 больным с улучшением клинического результата лечения.
Детям с обширной смешанной формой ЛМ и ЛВМ с неудовлетворительным результатом склерозирующей терапии (7 (16,6%) детей) было выполнено удаление патологических тканей с последующим достижением хорошего результата лечения.
При наблюдении в динамике (с 2011 по 2017 г.) за больными с отличными и хорошими результатами после проведенной склерозирующей терапии растворами доксициклина и блеомицина показаний к повторной операции не было выявлено ни у одного больного.
Вывод. Склерозирующая терапия растворами доксициклина и блеомицина показана пациентам с крупнокистозной формой лимфатической или лимфовенозной мальформации при наличии функциональных и косметических показаний. При данном типе мальформации был получен в большинстве случаев отличный результат. Наилучший эффект от лечения достигается у детей с ограниченной крупнокистозной формой лимфатической или лимфовенозной мальформации.
При жизнеугрожающих состояниях данный вид лечения не показан из-за длительного ожидания результата лечения. Также склерозирующая терапия не показана при мелкокистозной форме мальформации.
При смешанной форме ЛМ и ЛВМ, когда крупнокистозный компонент преобладает над мелкокистозным компонентом, показано проведение склерозирующей терапии с возможным получением хорошего клинического результата.
Удовлетворительный и неудовлетворительные результаты лечения были связаны с наличием у пациентов смешанной формы лимфатической мальформации, при которой значительно выражена строма образования и основной объем представлен мелкими кистами. Также причинами неудовлетворительного результата являлись мелкокистозная форма лимфатической мальформации и возможное вовлечение в патологический процесс околоушной слюнной железы. Данной группе больных склерозирующая терапия показана как этапное хирургическое лечение с целью уменьшения объема образования перед хирургическим удалением последнего, что в дальнейшем способствовало сокращению времени операции и травматизации тканей, или после операции при появлении новых крупных кист.
Доксициклин значительно более эффективен, чем блеомицин, в пункционной склерозирующей терапии детей с лимфатическими и лимфовенозными мальформациями в области головы и шеи.
В большинстве случаев (28 (66,7%) пациентов) для получения отличного или хорошего клинического результата после склерозирующей терапии было достаточно 1—2 операци.
Лимфатическая мальформация у новорожденного
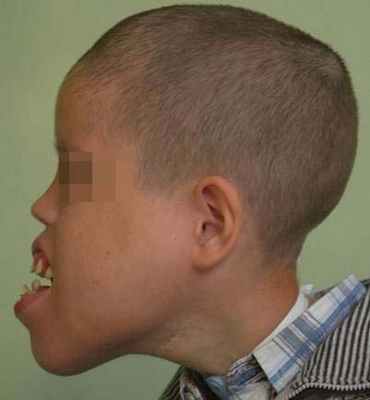
Чаще всего образование локализуется в поднижнечелюстной, позадичелюстной и надключичной области, нередко с распространением на область лица, дна полости рта и языка. На лице лимфатическая мальформация наиболее часто поражает верхнюю губу, щечную и околоушную области и нередко язык.
Лимфатической мальформации дна полости рта и шеи, как правило, представлены кистозными или кистозно-кавернозными вариантами. Лимфатической мальформации языка, щечной и околоушно-жевательной областей - капиллярными или кавернозными.
Клиническая картина лимфатической мальформации у детей зависит от ее локализации, размера, распространения и гистологической структуры.
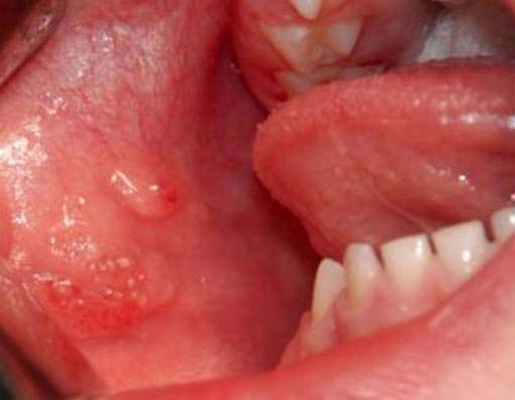
При изолированном поражении верхней губы определяется, как правило, безболезненная при пальпации припухлость без четких границ, обусловливающая сглаженность носогубной борозды. Красная кайма губы расширена, угол рта растянут и опущен. Основным клиническим диагностическим признаком лимфатической мальформации считается наличие на слизистой оболочке полости рта, губы единичных или множественных пузырьков, наполненных прозрачным или кровянистым содержимым.
При локализации в щечной области пузырьковые высыпания обнаруживаются на слизистой оболочке щеки. Пузырьки лимфатической мальформации не всегда определяются одновременно с выявлением новообразования. Они могут появиться через некоторое время, даже через несколько лет после обнаружения лимфатической мальформации (при воспалении, после травмы или оперативного вмешательства).
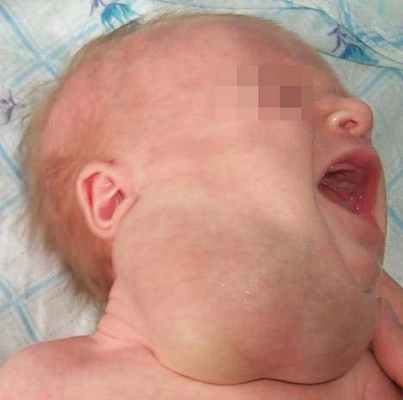
На шее наиболее частой локализацией лимфатической мальформации являются поднижнечелюстная и надключичная области, внутренний и наружный треугольник шеи с проникновением в сторону дна полости рта и языка. Захватывая по мере роста жизненно важные органы (трахею, пищевод, сосудисто-нервные пучки шеи, средостение), лимфатическая мальформация может вызывать при этом соответствующие осложнения: стридорозное дыхание, дисфонию, остановку дыхания, цианоз или угрожающую жизни одышку.
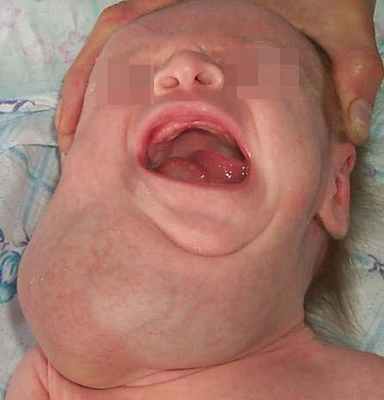
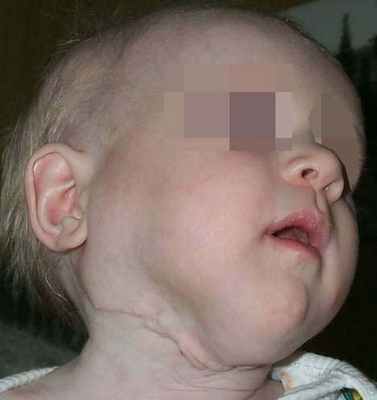
Лимфатическая мальформация языка, как правило, сопровождается макроглоссией различной степени выраженности. При выраженной макроглоссии язык не умещается в полости рта, выступает между зубами и губами, губы сомкнуты с напряжением или рот вынужденно открыт. При этом формируется открытый прикус с контактом зубов-антагонистов в области моляров, а иногда и с полным отсутствием контакта зубов верхней и нижней челюстей.
Наблюдаются чрезмерное развитие подбородочного отдела нижней челюсти, увеличение угла между ветвью и телом, удлинение переднего отдела нижней челюсти. Нарушение прикуса и макроглоссия вызывают функциональные нарушения жевания, дыхания, речи. Постоянное травмирование языка зубами приводит к частым воспалительным процессам. Изменения на слизистой оболочке при диффузной лимфатической мальформации языка типичны и аналогичны признакам поверхностной формы этого вида патологии.
Лимфатические мальформации дна полости рта и шеи чаще бывают кистозными или кистозно-кавернозными, языка, щечной и околоушно-жевательной областей - капиллярными или кавернозными. При кистозных лимфатическая мальформациях клинически определяются припухлости мягких тканей округлой формы, эластичные и безболезненные при пальпаци. Кожные покровы над опухолью обычной окраски или с синеватым оттенком, часто с выраженным сосудистым рисунком. Поверхность опухоли обычно гладкая или бугристая вследствие выбухания отдельных кист. Клинической особенностью кистозных мальформаций является многомерность их строения и поражение нескольких анатомических областей челюстно-лицевой области и шеи.
Возможна локализация лимфатической мальформации в области глазницы. При этом глазная щель суживается или полностью смыкается, при пальпации ощущается безболезненное образование тестоватой консистенции, без четких границ. По краю века, на конъюнктиве возможны пузырьковые высыпания с серозным или кровянистым содержимым, которые могут лопаться и кровоточить. При распространении лимфатической мальформации на ретробульбарную область появляется экзофтальм со снижением или полной потерей зрения.
Особенностью клинического проявления лимфатической мальформации являются ее периодические воспаления. Причиной воспаления этих образований чаще всего являются острые респираторные заболевания, обострения хронических очагов инфекции в полости рта, обострения хронических заболеваний желудочно-кишечного тракта.
Воспаления лимфатической мальформации у детей носят рецидивирующий характер и бывают различной степени выраженности. При незначительных местных проявлениях, когда воспаление продолжается несколько дней, общее состояние ребенка изменяется незначительно. При выраженных местных проявлениях воспаления обширных опухолей лица и шеи общее состояние ребенка изменяется - появляются симптомы интоксикации организма. В периферической крови увеличивается лейкоцитоз, наблюдаются значительный сдвиг формулы белой крови влево, повышение СОЭ. При длительно протекающем и часто рецидивирующем воспалении может развиваться картина анемии, у детей грудного возраста могут быть симптомы нефропатии с появлением в моче белка, форменных элементов крови.
Воспаление глубоких обширных лимфангиом шеи может сопровождаться функциональными расстройствами дыхания и глотания за счет механического сдавления верхних дыхательных путей и глотки и требует неотложной терапии с целью профилактики бронхолегочных осложнений. Местные симптомы воспаления кавернозных, кавернозно-кистозных лимфатических мальформаций - увеличение образования и появление воспалительного инфильтрата в мягких тканях пораженной области. В стадии выраженного воспаления возможны гиперемия и напряженность кожи, болезненность при пальпации.
Диагностика лимфатических мальформаций лица, полости рта и шеи основывается на совокупности данных анамнеза, клинического исследования, при необходимости данных УЗИ. В особо затрудненных случаях диагноз подтверждается результатами гистологического исследования. В верхней части дермы располагаются кистозно-расширенные лимфатические сосуды, выстланные одним слоем эндотелиоцитов. Иногда кроме лимфы в них содержится немного эритроцитов. Толщина эпидермиса неодинаковая, над кистами он обычно истончается. В других участках могут быть акантоз и папилломатоз с неравномерно выраженными эпидермальными выростами. Некоторые резко расширенные сосуды оказываются как бы включенными в эпидермис. Расширение лимфатических сосудов может наблюдаться вплоть до средней части дермы, но не ниже. При кистозной лимфангиоме гиперкератоз и папилломатоз выражены сильнее, увеличение просвета лимфатических сосудов наблюдается в подкожной клетчатке, где часто можно видеть расширенные лимфатические сосуды крупного калибра с гипертрофированными мышечными стенками. При кавернозной форме в глубоких отделах дермы и в подкожной жировой ткани образуются широкие, неправильной формы щели, часто содержащие эритроциты.
Особую сложность в раннем детском возрасте представляет дифференциальная диагностика лимфатической мальформации с нейрофиброматозом, который также проявляется при рождении или в первые месяцы жизни ребенка. Клинически диффузная форма нейрофиброматоза представляет собой припухлость без четких границ, переходящую в окружающие здоровые ткани, безболезненную или слабоболезненную при пальпации. Однако в отличие от лимфатической мальформации ткани при нейрофиброматозе более плотные на ощупь. При нейрофиброматозе могут определяться поверхностно расположенные отдельные узлы плотноэластической консистенции, что совпадает с локализацией утолщенных нервных стволов или отдельных неврином. В полости рта на стороне поражения выявляются типичные для нейрофиброматоза изменения: утолщение или чрезмерное развитие альвеолярного отростка и тела челюсти, макродентия, раннее прорезывание зубов на стороне поражения. У детей старше 3-4 лет одним из симптомов при нейрофиброматозе может быть наличие пигментных пятен на коже цвета "кофе с молоком" в области поражения или в любом другом месте.
Для уточнения диагноза и дифференциальной диагностики лимфатической мальформации с другими заболеваниями и врожденными пороками развития ЧЛО, для выявления степени распространенности и взаимоотношения с жизненно важными органами шеи и дальнейшего планирования объема и тактики хирургического лечения необходимо использовать УЗИ. Метод эхографии неинвазивен, достаточно прост и информативен, что имеет большое значение при работе с детьми. При подозрении на наличие сосудистой опухоли необходимо провести эхо-допплерографию с целью установления интенсивности и скорости кровотока.
Лечение детей с лимфатическими мальформациями определяется их локализацией, объемом образования и возрастом пациентов. Хирургический метод является ведущим при локализации лимфатических мальформаций в челюстно-лицевой области. Для уточнения топографии поражения в предоперационном периоде необходимо выполнить МРТ. Однако радикальное удаление образования невозможно при его расположении на лице и языке, что диктует необходимость частичной резекции с введением в остаточные полости спиртово-йодного раствора или другого склерозанта. Целесообразность проведения хирургического лечения при обширных лимфатических мальформациях лица и шеи у детей в возрасте до 1 года диктуется состоянием пациента. Чаще всего показанием к оперативному вмешательству служит дыхательная обструкция. После воспаления опухоли ее удаление следует осуществлять не ранее чем через 3-4 нед после клинического выздоровления ребенка. Некоторые специалисты используют методику пункционного склерозирования поражения с применением ультразвуковой навигации и введением доксициклина. Из новых технологий перспективна ультразвуковая деструкция патологической ткани с одновременной аспирацией (аппарат CUSA). Метод используется в Клинике ДЧЛХ.
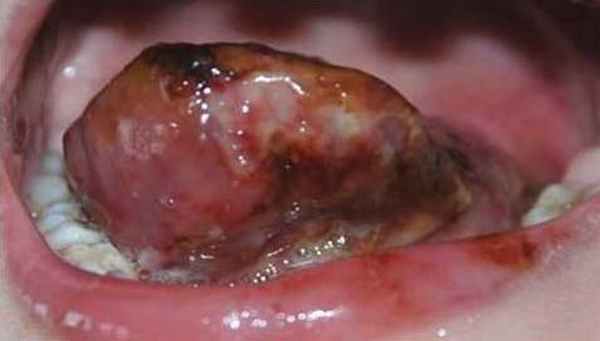
При воспалении лимфатической мальформации лица, полости рта и шеи необходимы:
- противовоспалительная медикаментозная терапия препаратами, уменьшающими проницаемость сосудистой стенки (растворы кальция хлорида, кальция глюконата,аскорутин), протеолитические ферменты, дегидратационная терапия;
- антибактериальная терапия сульфаниламидными препаратами, антибиотиками;
- борьба с общей интоксикацией организма путем коррекции водно-солевого обмена переливанием изотонического раствора натрия хлорида, полиглюкина, гемодеза;
- гипосенсибилизирующая терапия антигистаминными препаратами;
- общеукрепляющее лечение;
- пункция опухоли с аспирацией содержимого (по показаниям);
- гирудотерапия.
Местно применяют повязки с мазями противовоспалительного и антибактериального действия на гидрофильной основе.
При значительно выраженном и длительно текущем воспалении некоторым детям проводят повторные курсы лечения. Показателем излечения воспалительного процесса считается полное стихание местных проявлений воспаления, улучшение общего состояния ребенка с нормализацией картины периферической крови и мочи.
Особенности лечения лимфатических мальформаций у детей с применением видеоэндоскопического оборудования
Проблема лечения пациентов с лимфангиомами остается открытой для врачей различных хирургических специальностей ввиду специфической локализации, возраста клинической манифестации и отсутствия единого алгоритма курации таких пациентов. Цель — разработать оптимальный малоинвазивный метод лечения детей с лимфангиомами. Приведены результаты оперативного лечения 7 детей с лимфангиомами по двум разработанным в нашей клинике способам с применением видеоэндоскопического оборудования. Показано, что пациенты с лимфангиомами различных видов и топографических локализаций нуждаются в индивидуальном подходе при выборе оптимального метода лечения, учитывающего всевозможные риски рецидива. Разработанные способы лечения лимфангиом с применением видеоэндоскопического оборудования позволяют проводить миниинвазивные оперативные вмешательства у детей (в том числе новорожденных) и могут применяться для лечения при лимфангиомах как поверхностной локализации, так и многокамерных диффузно расположенных. При лечении 7 детей достигнут положительный результат при радикальном одномоментном удалении лимфангиомы под видеоконтролем, а также в случае дополненного склеротерапией способа лечения. Считаем предложенные способы лечения лимфангиом обоснованными в связи с положительным клиническим результатом и хорошим косметическим эффектом.
Ключевые слова
Об авторах
ФГБОУ ВО Казанский государственный медицинский университет Минздрава России; ГАУЗ Детская республиканская клиническая больница Минздрава Республики Татарстан
Россия
Нурмеев Ильдар Наилевич — доктор медицинских наук, профессор кафедры детской хирургии Казанского ГМУ, сосудистый хирург Детской республиканской КБ
Зыкова Мария Александровна — врач—детский хирург
ФГБОУ ВО Казанский государственный медицинский университет Минздрава России; ГАУЗ Детская республиканская клиническая больница Минздрава Республики Татарстан
Россия
Миролюбов Леонид Михайлович — доктор медицинских наук, профессор кафедры детской хирургии Казанского ГМУ, сердечно-сосудистый хирург
Подшивалин Андрей Александрович — врач—детский хирург, заведующий отделением хирургии детей раннего возраста.
420138 Казань, ул. Оренбургский тракт, д. 140
Список литературы
1. Кармазановский Г.Г., Степанова Ю.А., Дубова Е.А., Жу-ренкова Т.В., Кригер А.Г. Кистозная лимфангиома поджелудочной железы: возможности лучевых методов исследования. Медицинская визуализация 2009; 3: 95100.
2. Чундокова М.А., Уварова Е.В., Шафранов В.В., Вельская Ю.И., Волков В.В., Эмирбекова С.К. и др. Лимфангиома промежности у девочки 8 лет (клиническое наблюдение). Репродуктивное здоровье детей и подростков 2015; 1: 44—49.
4. Wegner G. Lymphangiome. Arch Klin Chir 1877; 20: 641.
6. Детская хирургия. Национальное руководство. Ю.Ф. Исаков, А.Ф. Дронов (ред.). М.: ГЭОТАР-Медиа, 2009; 1168.
7. Parsi K. Congenital Vascular Malformations. In: Congenital Vascular Malformations. W. Kim (ed.). Springer-Verlag Berlin Heidelberg, 2017; 241-256.
8. Jung E., Won H.S., Lee P.R., Lee I.S., Kim A., Nam J.H. The progression of mediastinal lymphangioma in utero. Ultrasound Obstet Gynecol 2000; 16(7): 663-666. DOI:10.1046/j.1469-0705.2000.00271.x
9. Ruano R., Takashi E., Schultz R., Zugaib M. Prenatal diagnosis of posterior mediastinal lymphangioma by two- and three-dimensional ultrasonography. Ultrasound Obstet Gynecol 2008; 31(6): 697-700. DOI: 10.1002/uog.5327
10. Неонатальная хирургия. Ю.Ф. Исаков, Н.Н. Володин, А.В. Гераськин (ред.). М.: Издательство «Династия», 2011; 680.
11. Chen Y.N., Chen C.P., Lin C.J., Chen S.W. Prenatal Ultrasound Evaluation and Outcome of Pregnancy with Fetal Cystic Hygromas and Lymphangiomas. J Med Ultrasound 2017; 25(1): 12-15. DOI: 10.1016/j.jmu.2017.02.001
12. Поддубный И.В., Рябов А.Б., Абрамян М.А., Трунов В.О., Козлов М.Ю., Топилин О.Г. и др. Хирургическое лечение лимфангиом у детей: описание серии случаев. Онкопедиатрия 2019; 6(1): 53-64. DOI: 10.15690/onco.v6i1/1998.
13. Исаков Ю.Ф. Хирургические болезни детского возраста. М.: ГЭОТАР-МЕД, 2004; 2: 584.
15. Cahill A.M., Nijs E, Ballah D, Rabinowitz D., Thompson L., Rintoul N. et al. Percutaneous sclerotherapy in neonatal andinfant head and neck lymphatic malformations: a single center experience. J Pediatr Surg 2011; 46(11): 2083—95. DOI: 10.1016/j.jpedsurg.201L07.004
18. Da Ros V., Iacobucci M., Puccinelli F, Spelle L, Saliou G. Lymphographic-Like Technique for the Treatment of Microcystic Lymphatic Malformation Components of
22. Поддубный И.В., Рябов А.Б., Трунов В.О., Козлов М.Ю., Топилин О.Г., Манукян С.Р. и др. Хирургическое лечение кистозной лимфангиомы сложной анатомической локализации у ребенка в возрасте 1 года 7 мес. Детская хирургия 2018; 2(3): 155-157.
Лимфатическая мальформация у новорожденного
Лимфатическая мальформация у новорожденного
Микрокистозные лимфатические мальформации, которые в медицинской литературе ранее определялись как ограниченная лимфангиома, образуют группу локализованных врожденных пороков лимфатической системы. Большинство из них проявляется при рождении или в младенческом возрасте.
Такие очаги иногда представляют собой лимфатические структуры, которые не соединились с остальной частью лимфатической или венозной системы. Клинически похожие очаги могут быть проявлением лимфедемы, возникшей вследствие опухолевой инфильтрации, хирургической или случайной травмы нормальной лимфатической системы.
Более крупные и глубокие очаги с большими, наполненными лимфой кистозными полостями известны как макрокистозные лимфатические пороки. Местами их предпочтительной локализации являются голова и шея, при этом они могут окружать и сжимать жизненно важные структуры в передней части шеи.
На наличие таких пороков могут указывать расположенные над ними поверхностные лимфатические мальформации или сосудистые капиллярные пороки, такие как «винное» пятно. Может встречаться комбинация микро- и макрокистозных очагов. Примерно 90% лимфатических мальформации затрагивают кожу и мягкие ткани, остальные 10% поражают внутренние органы или кости.
Поверхностные лимфатические мальформации состоят из одного или нескольких пятен, включающих толстостенные везикулы цвета кожи или сероватого оттенка, которые напоминают рыбью или лягушачью икру. При тромбозе или кровоизлиянии в везикулы после травмы они приобретают лиловый или черный цвет. Очаги могут сочетаться с припухлостью подлежащих мягких тканей или обширным отеком пораженного участка.
Хотя предпочтительными локализациями очагов являются проксимальные отделы конечностей, плечевой и тазовый пояс, они могут встречаться на любом участке поверхности кожи или слизистых оболочек.
Лимфатические мальформации могут сочетаться со сложными врожденными сосудистыми пороками. При синдроме Протея обширные лимфатические и сосудистые мальформации в дерме и подкожной ткани сочетаются с кожными «винными» пятнами, опухолями мягких тканей и эпидермальными невусами. Сосудистые мальформации могут доходить до средостения, брюшины, забрюшинного пространства и внутренних органов.
Дисфункция органов, рецидивирующая инфекция мягких тканей и поражение скелетно-мышечной системы истощают пациента и угрожают его жизни.
Хирургическая терапия лимфангиом сложная, поскольку они часто находятся вблизи жизненно важных структур, а степень рецидивов довольно высокая. Поверхностные очаги можно удалить лазером на углекислом газе, а более глубокие мальформации можно улучшить склеротерапией.
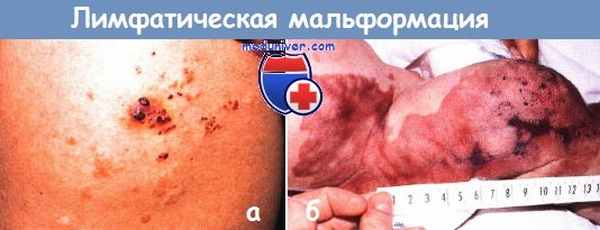
а - ограниченная лимфангиома.
Небольшое скопление серовато-лиловых везикул на колене подростка демонстрирует типичную картину «лягушачьей икры».
б - синдром Протея.
Массивная гипертрофия ноги сочеталась с обширным кожным «винным» пятном, опухолями мягкой ткани и глубокой лимфангиогемангиомой,
которая захватывала бедра, брюшную полость и забрюшинное пространство у мальчика 1 мес.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лимфатическая мальформация у новорожденного
Лазерная хирургия — способ проведения хирургических операций, заключающийся в удалении или прижигании небольших участков тканей с минимальным повреждением при помощи лазерного аппарата.
Сосудистая патология
Часть сосудистой патологии является лишь косметическим дефектом, но существуют и сосудистые образования, потенциально угрожающие жизни и здоровью маленького пациента — они требуют активного лечения.
Сосудистая патология у детей разнообразна, она может быть как врождённой, так и приобретённой. Частота встречаемости врожденной сосудистой патологии у детей — от 2% до 10%.
Согласно современным представлениям о сосудистой патологии, все нозологические формы делят на 2 основные группы:
- сосудистые опухоли (гемангиомы);
- пороки развития сосудов (капиллярные мальформации или венозные дисплазии).
Сосудистые опухоли и мальформации могут поражать любой орган и часть тела, но чаще всего сосудистые опухоли встречаются в области головы и шеи, вызывая не только нарушения жизненно важных функций (снижение зрения, ухудшение слуха, нарушения дыхания и глотания, судороги), но и тяжелые эмоциональные страдания.
Послеожоговые рубцы
В детском и подростковом возрасте ожоговая травма — является наиболее частой причиной инвалидизации. В России ежегодно 2000 детей становятся инвалидами вследствие получения травмы. Инвалидность — это не только боль и страдания ребенка, это тяжелый удар для всех членов семьи как в психологическом, так и в финансовом отношении.
Во всем мире отмечается рост количества пациентов детского возраста с последствиями травмы. Так, в России каждые 76 минут погибает один ребёнок, каждые 10 секунд регистрируется одна детская травма, из которых медицинская помощь требуется каждому второму-третьему ребёнку.
В проблеме лечения обширных послеожоговых рубцов можно выделить функциональную и эстетическую составляющие. Функциональная потребность выражается в восстановлении эластичности тканей и подвижности суставов, ограниченных рубцовой тканью, и как результат — возвращение способности к самообслуживанию. Эстетическая потребность выражается в том, что грубые рубцы придают человеку отталкивающий внешний вид, что сказывается на его взаимоотношениях в социуме, особенно среди детей и подростков, а исключение такого ребенка из социума может привести к попыткам самоубийства.
Лечение
Основной задачей в лечении сосудистой патологии является удаление патологических сосудов с помощью лазеров или IPL систем, введения склерозирующих растворов, в тяжелых случаях проводится хирургическое удаление. Чаще всего для эффективного лечения сосудистой патологии применяют сочетание различных методов лечения.
Отличные результаты в лечении сосудистой патологии были получены при применении IPL систем и сосудистых лазеров.Суть методики заключается в том, что лазерный луч без повреждения кожи проникает в глубокие слои мягких тканей и коагулирует патологические сосуды, которые спустя 2–4 месяца перестраиваются в соединительную ткань и исчезают полностью. Период реабилитации короткий, а риск формирования рубцовых изменений на коже минимальный.
В клинической практике во многих случаях подвижность суставов, ограниченная рубцовой тканью, может быть восстановлена корригирующими пластическими операциями. Однако иссечения «проблемных» рубцов не всегда достаточно для достижения необходимого эстетического результата. По своей сути иссечение тоже травма, и в ответ на эту травму снова образуется грубый рубец, больший по размеру. Такие острые для пациента проблемы могут быть решены с помощью инновационной методики лечения — фракционной СО2 лазерной абляции, как в качестве монотерапии, так и в комбинации с хирургическими методами лечения. Данная методика безопасна, может проводиться даже у самых маленьких пациентов, имеет короткий период восстановления и не дает инфекционных осложнений. А результат, полученный от лечения, с течением времени только усиливается.
Медицинские организации
Благотворительный фонд оказывает помощь на базе отделения лазерной хирургии РДКБ ФГБОУ ВО РНИМУ им. Пирогова.
Читайте также:
- Вакцина против гриппа
- Струма яичника. Карциноид яичника. Гонадобластома яичников.
- Сегменты печени. Сегментарное строение печени. Сегменты печени по Куино. Иннервация печени. Лимфоотток от печени.
- Инфекционно-токсический неврит слухового нерва. Атрофия слухового нерва
- Терапия ожирения. Сибутрамин и орлистат
