Лимфоидные или плазмацитоидные дендритные клетки. Функции дендритных клеток
Добавил пользователь Евгений Кузнецов Обновлено: 30.01.2026
Миелоидные дендритные клетки. Фолликулярные, опухоль-ассоциированные дендритные клетки
На зрелых дендритных клетках отмечается повышенная экспрессия хемокиновых молекул CCR7 и снижается CCR5, что позволяет ДК мигрировать в регионарные лимфатические узлы, где ДК представляют Т-лимфоцитам процессированный антиген, а также информацию об особенностях патогена. Таким образом, зрелые ДК активируют наивные лимфоциты, в результате чего последние приобретают патогенспецифические свойства. Затем большинство ДК исчезает, как предполагают, путем апоптоза.
Экспрессия CD80 и CD86 молекул на поверхности антигенпредставляющей клетки контролируется врожденными механизмами иммунитета. TLRs индуцируют появление данных молекул на АПК после распознавания своих PAMPs. Т-клетка, в свою очередь, способна к активации комплексами МНС-пептид, образующимися в результате детекции PAMPs типа ЛПС.
Помимо дендритных клеток миелоидного и лимфоидного происхождения, существует целый ряд и других ДК, располагающихся в лимфоидных и других тканях:
— фолликулярные ДК имеют мезенхимальное происхождение, не экспрессируют белки, но связывают антигены посредством рецепторов к компонентам комплемента (CD21, CD35/ CR1), ассоциированными с иммунными комплексами (иккосомами). Фолликулярные ДК экспрессируют рецепторы для Fc-фрагмента IgG и только на них идентифицирована молекула VCAM-1. Фолликулярные ДК прочно соединяются десмосомами отростков в стабильную сеть и являются резидентными клетками.
— ДК центров размножения обнаруживаются внутри вторичных В-клеточных фолликулов. Экспрессируют белки МНС II класса. Данные ДК усиливают пролиферацию CD40- и IL-2-активированных В-клеток, а также продукцию антител. Такие свойства ДК центров размножения обусловлены, в частности, экспрессией ими IL-12 и CD40L
— эпидермальные клетки Лангерганса располагаются в базальных и супрабазальных слоях эпидермиса. Экспрессируют поверхностные гликопротеины: МНС I и II, CD1a, CD1c, CD4, CD83, CD86, рецепторы для Fc-фрагмента IgG, для С3b (CR1) и СЗЫ (CR3) компонентов, интегрины (b1, VLA4,5,6) лангерин и Lag.
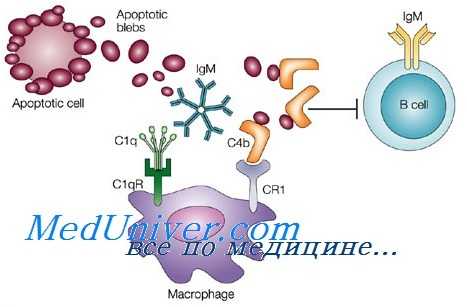
— интерстициальные ДК являются разновидностью миелоидные ДК и известны как тканевые ДК Интерстициальные ДК локализуются в дерме и большинстве органов, включая легкие и сердце. Они экспрессируют CD1a, CD14, CD68, CD9, CD83, CD86 и фактор ХIIIа. Способны индуцировать дифференцировку В-клеток, активно захватывать антиген.
— дермальные ДК являются разновидностью интерстициальных ДК.
Таким образом, иммунофенотипически и функционально различающиеся типы ДК, образующиеся из различных гемопоэтических предшественников и локализующиеся в разных тканях и органах, образуют единую систему клеточных популяций, распознающих и представляющих антигены Т- и В-лимфоцитам или формирующих у них толерантность к аутоантигенам.
Отличительной чертой ДК от других АПК (макрофаги, тучные клетки, В-лимфоциты) является то, что стимулирующий эффект ДК на Т-лимфоциты во много раз (10-100) сильнее других АПК. Во-вторых, ДК являются единственными антигенпрезентирующими клетками, способными представлять наивным Т-клеткам неизвестные антигены и усиливать иммунный ответ. Мощный потенциал ДК стимулировать Т-клеточный ответ осуществляется благодаря их способности экспрессировать:
1) от 10 до 100 раз активнее комплекс МНС-пептид на своей поверхности по сравнению с другими АПК;
2) адгезивные молекулы ДК, способствующие усилению взаимодействия между антигенспецифическими МНС и TCR;
3) костимулирующие молекулы, активирующие наивные и покоящиеся Т-клетки в эффекторные Т-клетки. ДК могут активировать Т-клетки путем проведения антигенспецифических стимулов (через MHC-TCR взаимодействия) и костимулирующих сигналов (через акцессорные контакты);
4) мощные регуляторные цитокины, такие как IL-12, усиливающие естественную резистентность организма благодаря индукции и активации NK-клеток и Т клеток.
Удивительная пластичность плазмацитоидных пpe-DCs отличает их от других клеточных типов иммунной системы, имеющих ограниченные функции, и свидетельствует о том, что эти клетки могут играть ключевую роль в интеграции врожденного и адаптивного иммунного ответа.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лимфоидные или плазмацитоидные дендритные клетки. Функции дендритных клеток
Дендритные клетки и клетки Лангерганса при воспалении легких.
За последние 10 лет наши представления о дендритных клетках, их происхождении и функциях значительно уточнились. Доказано костномозговое происхождение дендритных клеток. Однако конкретный этап начала дифференцировки дендритных клеток еще нуждается в уточнении. Возможны два пути дифференцировки: из отдельной клетки-предшественника дендритной клетки или из общего предшественника миело-моноцитарной серии, который дифференцируется до стадии моноцита, а моноцит может дифференцироваться либо в тканевой макрофаг, либо в дендритную клетку. Возможно, что предшественники дендритных клеток из костного мозга через кровяное русло заселяют различные нелимфоидные ткани: эпидермис кожи, слизистые оболочки воздухоносных путей, желудочно-кишечного и урогенитального трактов, интерстициальные ткани сердца, почек и других органов. В эпидермисе кожи и слизистых воздухоносных путей эти клетки носят название "клетки Лаигерганса". Иммиграция дендритных клеток-предшественников из периферической крови в кожу может быть связана с тем, что на них усиливается экспрессия лиганд для селектинов эндотелия. Одновременно на эндотелиальных клетках дермальных капилляров усиливается экспрессия Е-селектинов. Заселение нелимфоидных тканей дендритными клетками стимулирует ростовой фактор - GM-CSF.
Усиленная продукция GM-CSF в легочной ткани при воспалении ведет к рекрутированию в легочную ткань клеток типа Лангерганса. Самые ранние иммигранты в очаг бактериального воспаления в легких - это дендритные клетки-предшественники, экспрессирующие антигены МНС 2 класса. Прибывшие клетки остаются в связи с эпителиальными и дифференцируются в типичные дендритные клетки. Дендритные клетки рекрутируются в эпителий дыхательных путей в ответ на аэрозольное введение бактериального ЛПС. Тот же ЛПС, очевидно, через индукцию синтеза TNF-a может послужить сигналом ухода дендритных клеток из периферической ткани в дренирующий лимфоузел. В нелимфоидных тканях происходит начальная дифференцировка дендритных клеток с приобретением ими максимальной активности захвата антигенов, их переработки и формирования комплексов антигенных пептидов с собственными молекулами гистосовместимости. Провоспалительные цитокины (IL-1, TNF-a) вызывают ускоренное созревание дендритных клеток и их миграцию из нелимфоидных органов в кровь или в афферентную лимфу. Таким образом, дендритные клетки мигрируют в лимфоузлы, где их фенотип резко меняется: они превращаются в зрелые "презентирующие" клетки, экспрессирующие на мембранах костимулирующие молекулы и способные инициировать специфический ответ Т-лимфоцитов.
К числу цитокинов, усиливающих дифференцировку дендритных клеток, относятся: TNF-a, GM-CSF, IL-4, IFNy. В отличие от этого, продуцируемый кератиноцитами 1L-10 угнетает антигенпрезентирующие функции дендритных клеток.

Дендритные клетки, наряду с макрофагами и В-лимфоцитами, являются профессиональными антиген-презентирующими клетками. Дендритные клетки наиболее активны в инициации первичного иммунного ответа. В легких дендритные клетки считаются основными антиген-презентирующими клетками.
Дендритные клетки имеют многие черты сходства с макрофагами, но имеют и существенные отличия. Фагоцитарной активностью обладают лишь незрелые дендритные клетки на ранних стадиях дифференцировки в нелимфоидных тканях, например клетки Лангерганса. Основной путь захвата антигена, свойственный дендритным клеткам, - это макропиноцитоз, в результате которого антиген поступает в вакуоль, где перерабатывается, и образовавшиеся пептиды соединяются с молекулами МНС [54]. Как правило, дендритные клетки захватывают антиген на периферии (в нелимфоидных тканях), после чего они мигрируют в лимфоузлы, где презентируют этот антиген для распознавания Т-клеточными рецепторами и активации Т-клеток. При этом происходит переключение функций дендритных клеток с захвата антигена на стимуляцию Т-лимфоцитов, для чего на мембране дендритных клеток начинают экспрессироваться соответствующие адгезионные (ICAM-1, LFA-3) и костимулирующие (В7-1, В7-2, CD40) молекулы, а также молекулы CD44, контролирующие миграцию дендритных клеток в лимфоидные органы. Дендритные клетки могут презентировать переработанный в фаголизосомах антиген в комплексе с молекулами МНС 2 класса, а растворимые экзогенные антигены - в комплексе с молекулами МНС 1 класса. При этом захват антигена и его презентация разобщены во времени и пространстве. В отличие от макрофагов, дендритные клетки не способны выполнять функции "мусорщика" с перевариванием захваченных белков до отдельных аминокислот. У дендритных клеток эндоцитоз служит лишь первым этапом презентации антигена. Они считаются наиболее активными из профессиональных антиген-презентирующих клеток, способных презентировать и собственные аутоантигенные эпитопы, и туморассоциированные антигенные эпитопы. Кроме того, дендритные клетки способны к конститутивному синтезу физиологически значимых количеств биологически активного М1Р-1у, который опосредует хемотаксис и миграцию Т-лимфоцитов, т.е. дендритные клетки могут участвовать в рекрутировании Т-лимфоцитов (как CD4+, так и CD8+) перед их активацией.
В эпителии воздухоносных путей (в частности, трахеи и бронхов) человека обнаружена сеть дендритных клеток, экспрессирующих антигены МНС 2 класса и сходных с клетками Лангерганса. Этот пул дендритных клеток постоянно истощается миграцией зрелых клеток в дренирующие лимфоузлы и постоянно обновляется за счет притока предшественников из костного мозга. Их полупериод жизни не более двух дней в отличие от клеток Лангерганса с полупериодом жизни 15 дней. Быстрый круговорот дендритных клеток слизистых отражает их адаптацию к постоянной экспозиции попадающих с вдыхаемым воздухом чужеродных антигенов, которые необходимо презентировать распознающим Тлимфоцитам в регионарных лимфоузлах. Популяция дендритных клеток воздухоносных путей увеличивается под влиянием бактериальных компонентов и продуктов.
В коже и бронхиальной системе атопических больных обнаружено повышенное количество потенциально мобильных дендритных клеток. Часть из них несет на поверхности IgE, связанные рецепторами FceRl. Высокоаффинные FceRI на дендритных клетках могут участвовать в IgE-опосредованном захвате антигена и его презентации. У больных атопиями уровень экспрессии этих рецепторов на дендритных клетках повышен, т.е. они могут связать одномоментно большее количество IgE, разных по антигенной специфичности.
Лимфоидные дендритные клетки или плазмацитоидные дендритные клетки являются основными IFN-a-продуцирующими клетками Лимфоидные ДК образуются в тимусе из унипотентного предшественника Т-лимфоцитов, а именно из CD11cIL-3Ra-клеток. Основной ростовой фактор для лимфоидных ДК — IL-3 (он также является антиапоптотическим фактором); ранние стадии их гематопоэза стимулируют также FltЗ-лиганд, G-CSF и CSF. Плазмацитоидные ДК на всех этапах дифференцировки экспрессируют высокие уровни a-цепи рецептора к IL-3 (CD123). Описаны два специфических поверхностных маркера плазмацитоидных ДК человека: CD303 (BDCA-2) и CD304 (BDCA-4).
Лимфоидные дендритные клетки присутствуют в крови, лимфатических узлах, селезенке и тимусе. Судьба лимфоидных ДК, поступающих в Т-клеточные области лимфоузлов из крови, неизвестна. В тимусе лимфоидные ДК принимают участие в процессе отрицательной селекции, то есть отвечают за элиминацию Т-клеток, реагирующих на собственные антигены.
Незрелые дендритные клетки и их предшественники избирательно реагируют на патогены. В отличие от миелоидных пре-ДК плазмацитоидные пре-ДК заселяют преимущественно Т-клеточные зоны вторичных лимфоидных органов, а в нелимфоидных практически отсутствуют Незрелые ДК и их предшественники (пpe-DCs) вовлекаются во врожденное распознавание микробов, в то время как пре-DCsl (предшественники миелоидных ДК) фагоцитируют и вызывают киллинг различных бактерий и грибков. Пpe-DCs2 (предшественники лимфоидных ДК) играют главную роль в раннем антивирусном иммунном ответе, продуцируя IFN-a и В. Эти клетки были названы натуральными интерферонпродуцирую-щими клетками (NIPCs).
NIPCs продуцируют в 200-1000 раз больше IFN, чем другие клетки крови после микробной инфекции или после стимуляции ЛПС и бактериальными ДНК. Пре-DCs составляют менее 1% мононуклеаров крови и имеют фенотип lin CD11сCD123CD303CD304*HLA-DR.
В отличие от других клеток врожденного иммунитета (нейтрофилы, эозинофилы и базофилы), которые погибают после выполнения их функций, пре-DCsl и пpe-DCs2 дифференцируются в ДК.
Плазмацитоидные дендритные клетки участвуют в В-клеточном ответе на вирусы: после их элиминации из культур МЛПК уровень продукции антител резко падает. За счет секреции интерферонов I типа лимфоидные ДК стимулируют пролиферацию плазмобластов, а проведение сигналов с TLRs ДК способствует выработке ими IL-6 и индукции синтеза специфических антител В-клетками.
При аллергических реакциях и некоторых видах хронического воспаления пpe-DCs привлекаются как в пораженные нелимфоидные ткани, так и в реактивно измененные регионарные лимфатические узлы; они инфильтрируют также опухолевую ткань при некоторых злокачественных новообразованиях.
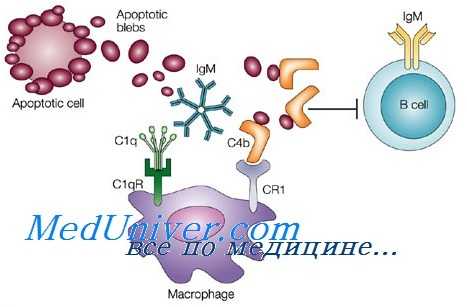
В тканях незрелые дендритные клетки могут поглощать антигены различными способами:
— макропиноцитозом (растворимые АГ);
— рецептор-опосредованным эндоцитозом через лектиновые рецепторы, FcR и рецептор комплемента (CR3) (поглощают иммунные комплексы, опсонизированные частицы и бактерии);
— путем фагоцитоза через CD36 и ар-интегрины (латекс, вирусы, бактерии, внутриклеточные паразиты);
— через TLRs идет распознавание патогенов и сбор информации о природе микроорганизмов);
— через поверхностные рецепторы (CD91) поглощают белки теплового шока gp96 и др70.
Созревание дендритных клеток инициируется различными факторами:
— после воздействия PAMPs на TLRs;
— TNF-подобными сигналами (TNF, FasL, CD40L), поступающими от лимфоцитов (Т, В, NK, NKT), тромбоцитов, тучных клеток;
— провоспалительными и противовоспалительными цитокинами (IL-1, -2, -6, -13, TNF-a), GM-CSF;
— механическим стрессом.
Морфология, иммунофенотип и функциональная активность ДК зависят от активации и дифференцировки. Основным морфологическим признаком ДК является наличие многочисленных подвижных отростков разнообразной формы — нитевидной, вуалевидной, луковичных псевдоподий. Благодаря отросткам, ДК обладают большой совокупной поверхностью, обеспечивающей уникальные условия для эффективного межклеточного взаимодействия. Для ДК характерно наличие крупных митохондрий, большого количество эндосом и лизосом, имеющих важное значение для процессинга антигена.
Дендритные клетки весьма лабильны в отношении путей активации и дифференцировки под воздействием многочисленных факторов на разных стадиях созревания, в связи с чем у авторов статей, изучающих морфо-функциональную характеристику ДК, нет единства мнений относительно иммунофенотипических особенностей этой клеточной популяции. Однако в настоящее время выявлены некие общие закономерности в экспрессии поверхностных клеточных маркеров, характерных для зрелых и незрелых ДК.
На поверхности мембран ДК экспрессируются маркеры антигенного представления (CDIa, МНС I и II), костимулирующие молекулы (CD80, CD86, CD40) (перечисленные маркеры экспрессируются преимущественно на зрелых ДК); маркеры моноцитов/макрофагов (CD14, CD68, CD115), адгезивные молекулы (CD54, CD58, семейство молекул CD11, CD29 и т.д.), хемокиновые рецепторы (CCR-1, -2, -5, -6, -7, СХ-CR-4) и другие молекулы.
Незрелые дендритные клетки экспрессируют хемокиновые рецепторы CCR-1, -2, -5, -6 и CXCR-1 и способны активно мигрировать в очаг воспаления в ответ на воспалительные хемокины семейства МСР и MIP-1, а также RANTES и IL-8.
В процессе созревания ДК теряют способность захватывать антиген, но они приобретают свойство экспрессировать процессированный пептидный антиген в контексте собственных молекул МНС I и МНС II. Зрелые ДК продуцируют провоспалительные и регуляторные цитокины IL-6, IL-10, IL-12, IL-18, IL-23, IL-27 и TNF-a, лимфоидные ДК экспрессируют TLR7-9 и продуцируют IFN-a. Напротив, миелоидные ДК и моноциты отличаются экспрессией TLR1-6, TLR8. Индукция IFN-B осуществляется через лигацию TLR3 и 4 с двуспиральными РНК и ЛПС. Эти различия в экспрессии TLRs и пути INF-индукции свидетельствуют, что субпопуляции ДК распознают дифференцированно микробные патогены.
Дендритные клетки: профессиональные разведчики в «Опухолевой войне»
Обзор
коллаж автора статьи
Автор
Редакторы
Статья на конкурс «био/мол/текст»: «Рак» — как много тревожных мыслей вызывает это слово! Около 7 миллионов человек в год умирают от рака. Трудно переоценить опасность подобных заболеваний, именно поэтому ученые заняты поисками действенного метода лечения различных типов злокачественных опухолей. Существуют некоторые виды терапии онкологических заболеваний, но достаточно ли они эффективны?
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Что не так с этими опухолевыми клетками?
В человеческом организме происходит постоянное обновление клеточной структуры, старые клетки умирают, новые рождаются. Но наряду со здоровыми клетками, в результате мутаций (то есть изменений набора наследственной информации под действием внешних или внутренних сил) образуются нетипичные клетки. Такие «эксцентрики» чаще всего не могут правильно выполнять свои функции, и при неблагоприятном сценарии их появление приводит к образованию злокачественной опухоли.
В норме такие атипичные клетки уничтожает иммунная система, которая является своеобразной армией, противостоящей врагам организма. Но особенность злокачественных клеток в их способности «ускользать» от иммунного контроля. Делают это они очень изощренно и крайне эффективно, так, что иммунные молекулы-разведчики часто не могут обнаружить их (рис. 1), а клетки-киллеры деактивируются из-за экспрессии опухолевыми клетками блокирующих факторов.
Рисунок 1. Умелая маскировка опухолевых клеток.
Дополнительным фоном для развития опухолевых клеток является ослабление иммунитета в результате болезней, стрессов, неправильного образа жизни. В результате опухолевые клетки становятся «особенными» в организме, они игнорируют «антиростовые» стимулы, сигналы запуска клеточной гибели и т.п. Особенности опухолевых клеток можно соотнести с поведением психопата-эгоиста, эти клетки мало того, что не выполняют надлежащих им функций, так еще и бесконтрольно делятся и распространяются по всему организму, в сумасшедших количествах потребляют питательные вещества, которые потом тратят на создание таких же «психопатов» (рис. 2) [1]. Следовательно, нарушается метаболизм и функционирование тканей организма, что чаще всего приводит к плачевным последствиям.
Рисунок 2. Что умеют раковые клетки.
Почему же так трудно лечить рак?
Заранее стоит заметить, что под понятием «рак» скрывается целая совокупность огромного количества типов злокачественных опухолей. Некоторые из них настолько сильно различаются, что найти что-то общее у них крайне трудно. Более того, не все типы опухолевых заболеваний корректно называть раковыми: рак — лишь частный случай онкологии, изучающей как злокачественные, так и доброкачественные опухоли. Именно поэтому, скорее всего, мы не увидим на полках аптек универсального лекарства от рака. Вследствие такого разнообразия онкологических заболеваний каждый пациент нуждается в персональном подходе к лечению. Но даже это персональное лечение в нынешней практике часто не эффективно. Самыми распространенными методами являются химиотерапия, хирургический метод (когда это возможно) и лучевая терапия. Но, к сожалению, эти методы тоже не всегда результативны и зачастую несут с собой колоссальные побочные эффекты, иногда не совместимые с жизнью.
В настоящий момент множество групп ученых работает над повышением эффективности традиционных методов лечения опухолевых заболеваний. Все же существенно повысить выживаемость онкобольных, применяя только стандартную терапию, становится уже практически нереальным, особенно на последних стадиях, а своевременная диагностика зачастую невозможна из-за позднего обращения пациентов за помощью. Так или иначе, рано вешать нос.
Иммунотерапия
Достижения в иммунологии за последние несколько десятков лет привели к созданию совершенно новых подходов к лечению онкологических заболеваний. Результаты исследований уже дали право на существование многим иммунологическим методам [2]. Ведь хорошая же идея — заставить сам организм бороться с опухолью! Иммунотерапия заключается в воздействии на иммунную систему для повышения эффективности ее противостояния раковым клеткам [3]. Для этого в кровь пациента вводят вещества, в той или иной степени представляющие собой опухолевые антигены (молекулы, которые организм рассматривает как чужеродные и опасные и запускает против них иммунный ответ), способствующие размножению специальных иммунных клеток-убийц, которые будут препятствовать развитию опухоли и разрушать ее.
Важным преимуществом иммунотерапии является то, что, в силу своей специфической направленности, она почти не повреждает здоровые ткани. Данный метод более эффективен для лечения последних стадий онкологических заболеваний по сравнению с традиционными подходами. Кроме того, иммунотерапию можно использовать для снижения побочных эффектов лучевой терапии и химиотерапии.
Однако все не так радужно, как могло показаться. Иммунотерапия была крайне неэффективна при лечении некоторых типов опухолевых заболеваний, например предстательной железы [4]. Проблема, опять же, заключалась в недостаточной направленности препаратов.
Но я, мечту свою лелея, решил проблему гениально.
Благодаря интенсивным исследованиям в области иммунологии открыто множество факторов, влияющих на осуществление иммунного ответа [5]. Стало ясно, что одну из ключевых ролей в спектакле «Иммунный ответ» играют особые отростчатые клетки — дендритные (ДК). Открыл их в 1868 году немецкий ученый Пауль Лангерганс, который ошибочно принял эти клетки за нервные окончания с подобными отростками. ДК вновь описал в 1973 году Ральф Стайнман, он же установил их принадлежность к иммунной системе [6]. Лишь через 38 лет он был посмертно удостоен Нобелевской премии за проделанную работу.
В последние десятилетия развивалась тенденция по внедрению дендритных клеток в качестве вспомогательных средств для лечения различных типов рака. По мнению ученых, их систематическое применение в иммунотерапии позволит добиться от нее максимального эффекта.
Дендритные клетки — популяция особых клеток, функция которых заключается в презентации «вражеских» антигенов другим клеткам иммунной системы. Таким способом они активируют адаптивный иммунитет [6]. По научному, такие клетки-посредники называются антигенпрезентирующими (АПК). Свое название ДК получили благодаря разветвленным отросткам мембраны, напоминающим дендриты нервных клеток, которые вырастают у них на определенных этапах развития. ДК располагаются, в основном, в крови и тканях, которые соприкасаются с внешней средой. Эти клетки обладают специальными механизмами распознания «врагов». В периферических тканях ДК захватывают антигены через несколько дополнительных механизмов [7]. Проще говоря, они способны к поглощению инородцев, то есть фагоцитозу и пиноцитозу антигенов, выпячивая клеточную мембрану и захватывая вражескую частицу.
После «трапезы» с током крови или по лимфатическим сосудам они перемещаются в лимфатические узлы [8]. Между тем, в ДК происходит преобразование (процессинг) белковых антигенов и расщепление их на кусочки-пептиды, которые в конечном итоге связываются с молекулами главного комплекса гистосовместимости (major histocompatibility complex, MHC), расположенными на поверхности ДК [9]. После этого ДК достигает полной зрелости и при помощи молекул MHC презентует вражеский антиген другим клеткам иммунной системы.
В качестве этих «других клеток» выступают «армейские новобранцы», еще не обученные Т-клетки, ранее не сталкивавшиеся с противником-антигеном. После столкновения Т-клетки начинают активно делиться и дифференцироваться в войска спецназа, или антиген-специфические эффекторные Т-клетки. Особые подразделения спецназа — CD4+ T-клетки — становятся незаменимыми помощниками или T-хелперами (рис. 3). Они стимулируют солдат химических войск — В-лимфоцитов, которые производят антитела. Это специальные белковые молекулы, которые, как противоядия, идут на борьбу с конкретными чужеродными частицами [10]. Такая химическая защита или иммунный ответ с участием антител относится к гуморальному иммунитету.
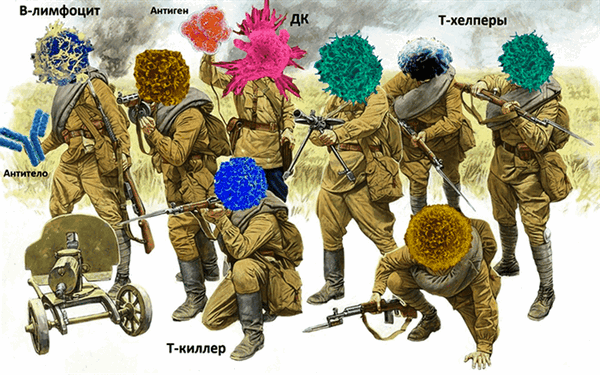
Рисунок 3. Иммунная армия.
Кроме того, необученные T-клетки и Т-хелперы посредством выделения активирующего вещества интерлейкина-2 (IL-2), привлекают на помощь снайперов Т-киллеров, которые в дальнейшем уничтожают зараженные клетки, ведя обстрел ядовитыми цитотоксинами. Таким образом работает клеточный иммунитет.
Некоторая часть «обученных» Т-клеток становится клетками памяти, они живут в организме годами. Всякий раз, когда они встречают старого знакомого врага, то очень быстро запускают иммунный ответ.
Дендритные клетки в иммунотерапии
Поскольку опухолевые клетки великолепно владеют искусством маскировки, иммунной системе очень сложно распознать антигены на их поверхности. Встает вопрос о том, как можно создать действительно мощный иммунный ответ, направленный на их уничтожение.
На мышиных моделях показано, что ДК могут захватывать антигены, которые высвобождаются из опухолевых клеток, и представлять их Т-клеткам в лимфоузлах. Это приводит к активации опухолеспецифических Т-клеток и последующему отторжению опухоли [12], [13]. По сравнению с другими АПК, такими как макрофаги, дендритные клетки чрезвычайно эффективны при представлении антигена, тем самым объясняя свое прозвище «профессиональных АПК». Это говорит о том, что ДК можно использовать для терапевтических вмешательств при онкопатологии.
В настоящее время развивают две темы исследований: как опухолевые клетки изменяют физиологию ДК, и как мы можем опираться на мощные свойства ДК при создании новых методов иммунотерапии рака.
Опухолевые клетки так просто не сдаются!
Дендритные клетки обнаруживают в большинстве опухолей. ДК отбирают образцы опухолевых антигенов путем захвата умирающих клеток или буквальным откусыванием частей живых [14]. В свою очередь опухоли могут препятствовать представлению и созданию иммунных реакций с помощью различных механизмов. В пример можно привести такие антигены опухолей, как раково-эмбриональный антиген (РЭА) и муцин-1, которые, попав в ДК, могут быть ограничены ранними эндосомами, то есть плазматической мембраной, что предотвращает эффективную обработку и презентацию антигена Т-клеткам [15].
Также опухоли могут мешать созреванию ДК. Во-первых, они могут блокировать, то есть ингибировать, созревание ДК путем выделения особого белка IL-10, который приводит к полному отсутствию реакции (антиген-специфической анергии) [16], [17]. Во-вторых, факторы, выделяемые опухолью, могут изменять созревание ДК, вызывая образование клеток-предателей, которые косвенно способствуют росту этой опухоли («проопухолевые» дендритные клетки) [18]. Поэтому понимание функций ДК в онкологических процессах представляет собой обширную область для исследований. В конечном счете, «перевоспитание» проопухолевых ДК в противоопухолевые может вести к зарождению нового подхода в иммунотерапии.
Вакцина на основе дендритных клеток
ДК могут быть получены из кровяных клеток-предков (моноцитов) пациента, которые загружают антигенами ex vivo, то есть знакомят с врагом вне организма в стерильных лабораторных условиях. Затем эти моноциты надлежащим образом созревают и вводятся обратно пациенту при вакцинации. Теоретически это должно давать целый набор дендритных клеток, запускающих иммунные войны.
В последнее десятилетие значительные экспериментальные и клинические ресурсы были отданы на разработку противораковых вакцин на основе ДК [19], [20]. Это привело к созданию многочисленных типов вакцин, которые различаются протоколами загрузки ДК антигенами или биохимическим манипулированием клетками. Например, один из типов вакцин подразумевает введение антигенов опухоли и их прямую доставку в ДК непосредственно в организме пациента.
Еще одна стратегия вакцинации, которая совсем недавно начала привлекать внимание, связана с естественными подмножествами дендритных клеток, которые могут быть выделены с помощью высокоэффективных магнитных гранул, покрытых антителами [21], [22]. Накопленные клинические данные говорят о том, что такие вакцины достигают многообещающей эффективности у пациентов с меланомой — долгосрочной выживаемости без прогрессирования (1–3 года) у 28% пациентов [22]. Те или иные разновидности вакцин применяют в зависимости от типа опухолевого заболевания и его стадии.
В целом эффективность вакцинации на основе ДК зависит от множества различных факторов, включая характер и источники антигенов, иммунологический статус пациента, тип вовлеченных рецепторов на ДК и подмножества специфических ДК, на которые осуществляется воздействие [23–27].
Важно отметить факт, что на май 2017 года только одна клеточная терапия с участием ДК лицензирована для лечения людей, а именно Sipulteucel-T (Provenge, США). C 2010 года Sipulteucel-T одобрен для лечения бессимптомного и минимально-симптоматического метастатического рака, а также рака предстательной железы [28–31].
Безопасность — наше все!
Безопасность противоопухолевых вакцин на основе ДК подтверждена и хорошо документирована во многих клинических исследованиях [32]. Местные реакции в виде зуда, сыпи или боли обычно мягкие и самоограничивающиеся. Они характерны и для других лечебных процедур. Случаются и системные побочные эффекты, связанные с заболеванием гриппом или другими инфекциями вследствие переброса защитных сил на опухолевый фронт.
Одной из особых проблем иммунотерапии является возможность развития аутоиммунитета. Это состояние, при котором иммунная система принимает собственные здоровые клетки организма за чужеродные и атакует их [33]. Однако стратегии противоопухолевой вакцинации дендритными клетками редко ассоциируются с тяжелой иммунной токсичностью. Ожидается, что иммунотерапия на основе ДК сохранит качество жизни пациентов с онкозаболеваниями на более высоком уровне.
Качество жизни является важным показателем при оценке новых противоопухолевых средств. Например, в работе Николая Леонарцбергера у всех 55 пациентов с таким типом рака, как карцинома почек, при иммунотерапии на основе ДК не было выявлено отрицательного влияния на качество жизни. Это выгодно отличается от других существующих методов лечения, вызывающих существенное токсическое действие [34].
Вместе с тем, отчетов о результатах изменения качества жизни пациентов после дендритной клеточной иммунотерапии недостаточно, что требует дальнейших исследований.
Перспективы
Разработка вакцин на основе дендритных клеток — весьма «горячая тема». Большинство исследователей используют ДК, подверженные воздействию опухолевой РНК, лизатов и антигенов опухолевых клеток. При этом многие научные работы проверяют введение вакцин на основе ДК в сочетании со стандартной химиотерапией или лучевой терапией [35]. В некоторых испытаниях тестируют комбинации вакцин и противовоспалительных препаратов.
Это позволяет надеяться на скорейшее внедрение новых эффективных методик иммунотерапии онкозаболеваний, которые позволят успешно бороться с различными типами рака.
Заключение
Ученые все чаще приходят к выводу о том, что иммунотерапия на основе дендритных клеток является достойным, безопасным и хорошо переносимым иммунотерапевтическим методом, который может вызывать иммунные реакции даже у пациентов с раком последней стадии. В последнее время разработано множество стратегий использования противоопухолевой активности ДК. Существует реальная необходимость в клинических исследованиях, демонстрирующих, что вакцины на основе дендритных клеток могут вызывать долговременные объективные ответы и улучшать долгосрочную выживаемость пациентов.
Общее развитие вакцин с ДК постоянно сталкивается со множеством препятствий. Помимо проблем с эффективностью вакцин, разработка терапии для клинического применения является финансово затратной, требует хорошо оснащенных современных лабораторий и наличия высококвалифицированных научных кадров, что позволило бы проводить многоцентровые клинические испытания последних фаз с участием большого количества пациентов.
В заключение хочется сказать, что иммунотерапия весьма перспективна и требует дальнейшего раскрытия своего потенциала. Речь идет не только о вакцинах на основе ДК, но и о многочисленных специфичных антителах и т.п. Онкология не обойдется без комбинирования различных методов терапии, традиционных и инновационных. С другой стороны, встает вопрос о доступности этих инновационных методик конкретно на местах лечения онкобольных.
В России сегодня иммунотерапия слабо развита, она не преобладает над стратегиями лучевой терапии и химиотерапии. В то же время в США и Израиле иммунотерапия развивается быстрее и уже активно используется в онкоцентрах как в качестве профилактических вакцин, так и для продления жизни тяжелобольных пациентов [37]. Иммунотерапия на основе дендритных клеток только начинает свою историю, в которую еще предстоит вписать лучшие страницы.
Дендритные клетки

Дендритные клетки (ДК), названные так из-за их «древовидной», имеющей отростки (дендриты), формы, являются антигенпрепрезентирующими клетками (АПК) иммунной системы, то есть обрабатывают антигенный материал и представляют его на своей поверхности для Т-клеток иммунной системы. Они служат связующим звеном между врожденной и приобретенной иммунными системами.
Пауль Лангерганс впервые описал ДК, найденные в человеческой коже в 1868 году, но ошибочно принял их за нервные клетки. Ральф Штейнман и Занвил Кон открыли ДК в 1973 году, но идея о том, что ДК имеют уникальную роль в иммунной системе, десятки лет воспринималась скептически. В XXI веке стало понятно, как именно ДК инициируют приобретенные иммунные ответы. Сейчас все более очевидным становится их вклад в индукцию толерантности к аутоантигенам. Изучаются связи и сигнальные пути ДК с другими иммунными клетками, их роль в развитии различных патологий, разрабатываются лекарства и вакцины против некоторых патогенов, опухолей и аутоиммунных заболеваний. В знак признания важности открытия дендритных клеток Ральф Штайнман был удостоен нескольких престижных премий, в том числе международной премии Фонда Гарднера в 2003 году, премии Альберта Ласкера в 2007 году и Нобелевской премии по физиологии и медицине в 2011 году.
ДК — это образующиеся в костном мозге лейкоциты, которые являются наиболее эффективным типом антигенпредставляющих клеток. ДК также могут быть получены in vitro из костного мозга и крови с использованием различных комбинаций факторов роста, таких как гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) и Flt3-лиганд. ДК специализированы для захвата и обработки антигенов, превращения белков в пептиды и их представления на основных комплексах гистосовместимости (MHC-II), распознаваемых Т-клетками. Они являются гетерогенной, т. е. разнородной по происхождению и составу, группой клеток, включающей в себя миелоидную (или классическую, открытую Штайнманом) и плазмоцитоидную субпопуляции. Отдельно в классической субпопуляции выделяют ДК лимфоидной и нелимфоидной ткани, а также те самые клетки Лангерганса кожи. Хотя все ДК способны поглощать, обрабатывать и представлять антигены наивным Т-клеткам, вышеперечисленные подвиды имеют свои четкие фенотипические маркеры и различаются по местоположению, миграционным путям, специфическим иммунологическим функциям, а также по наличию зависимости их образования от инфекций или воспалительных стимулов.
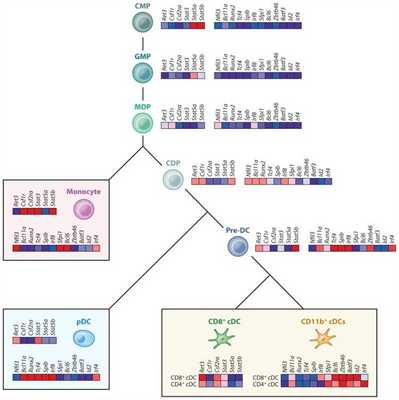
Рисунок 1 | Транскрипционный контроль дифференциации ДК. На иллюстрации изображена тепловая карта цитокинов, TLR и некоторых факторов транскрипции, которые экспрессируются в миелоидной линии, начиная от обычных миелоидных предшественников (CMP) до предшественников гранулоцитов макрофагов (GMP), предшественников макрофагов ДК (MDP), общих предшественников ДК (CDPs), циркулирующих кДК-предшественников (pre-cDCs), моноцитов, плазмоцитоидных ДК (pDCs) и клеток лимфоидной ткани CD8+ и CD11b+ ДК.
Плазмоцитоидные ДК (пДК) представляют собой небольшую субпопуляцию, происхождение которой сходно с классической, но их жизненный цикл протекает иначе. Они накапливаются преимущественно в крови и лимфоидных тканях и попадают в лимфатические узлы через кровоток, экспрессируют низкие уровни MHC-II, костимулирующих молекул и интегрина CD11c в неактивном состоянии, а также узкий диапазон паттерн-распознающих рецепторов (PRR), которые включают в себя Toll-подобные рецепторы (TLR) 7 и 9. При распознавании чужеродных нуклеиновых кислот пДК продуцируют интерфероны типа I и приобретают способность представлять чужеродные антигены.
Классические ДК (кДК) являются субпопуляцией тканевых гемопоэтических клеток, которые заполняют большинство лимфоидных и нелимфоидных тканей. Они более тонко ощущают тканевые повреждения, захватывая связанные с окружающей средой и чужеродными клетками антигены, обрабатывая и представляя их Т-лимфоцитам. Благодаря этому кДК индуцируют иммунитет к любым чужеродным антигенам, нарушающим целостность тканей, и обеспечивают толерантность к аутоантигенам. Они отлично подходят для выполнения этих функций из-за нескольких ключевых особенностей:
- они локализованы практически в любой нелимфоидной ткани и в маргинальной зоне селезенки, где они постоянно контактируют с антигенами;
- вырабатывают ферменты для обработки и представления антигенов;
- в ответ на взаимодействие с некоторыми хемокинами, такими как CCL19 и CCL21, они «проползают» через клетки тканей, пересекают эндотелий лимфатических сосудов и начинают перемещаться в лимфоузлы. Активированные ДК не захватывают новые антигены, синтезируют костимулирующие молекулы, такие как CD80, CD86 и C-C-рецептор хемокина 7 типа, а также провоспалительные цитокины TNF-α и IL-12;
- в лимфоузлах ДК мигрируют в Т-зону, где и вызывают ответ CD4 и CD8 T-лимфоцитов, при этом одна ДК вызывает ответ нескольких Т-клеток.
Дендритные клетки присутствуют в тканях, контактирующих с внешней средой — например, в коже (где имеется специализированный тип дендритных клеток — клетки Лангерганса), слизистых оболочках дыхательных путей, легких, желудка и кишечника. Также они могут быть обнаружены в незрелом состоянии в крови и соединительной ткани. Зрелые/активные формы ДК мигрируют в лимфоузлы.
Таблица 1 | Фенотипы мышиных кДК лимфоидной и нелимфоидной тканей.
Дефицит дендритных клеток у человека
У людей описано три генетических синдрома дефицита ДК. Первый — синдром дефицита DCML, вызван мутацией GATA-связывающего фактора 2 (GATA2), ведущей к полному отсутствию ДК, циркулирующих моноцитов, B- и NK-лимфоцитов, но не влияющей на гранулоциты и тромбоциты. Этот синдром также связан с отсутствием лимфоидных предшественников и уменьшением предшественников гранулоцит-макрофагов (GMP), что указывает на то, что дефицит GATA2 предотвращает дифференциацию этих предшественников в ДК. У пациентов с DCML значительно (примерно в 100 раз) был повышен уровень сывороточного FLT3L без признаков миелопролиферации.
Второй синдром связан с мутациями регуляторного фактора интерферона 8 (IRF8), который участвует в дифференциации общего миелоидного предшественника в ДК и моноциты. У одного пациента с ноль-мутацией IRF8 наблюдалось увеличенное количество гранулоцитов, полное отсутствие циркулирующих моноцитов, пДК, кДК и дермальных ДК, а также недостаточная продукция IL-12. Интересно, что эпидермальные клетки Лангерганса у этого пациента присутствовали в нормальном количестве, из чего можно сделать предположение, что эпидермальные клетки Лангерганса и кДК имеют различное происхождение. Другой вид мутации IRF8, наблюдаемой у двух пациентов, приводил к уменьшению количества CD1c+ кДК в крови и дефектам в продукции IL-12, но нарушения образования гранулоцитов, моноцитов или пДК не происходило.
Третий синдром связан с мутацией аденилаткиназы 2-фосфотрансферазы, необходимой для нуклеотидного гомеостаза. Эта мутация вызывает особую форму тяжелого комбинированного иммунодефицита, известную как ретикулярный дисгенез. Синдром характеризуется нарушением образования всех зародышевых клеток крови, включая нейтрофилы, лимфоциты, моноциты, кДК и клетки Лангерганса.
Иммунотерапия
Использование иммунорегуляторных возможностей дендритных клеток имеет большие перспективы в лечении онкозаболеваний, аутоиммунных заболеваний и профилактики отторжения трансплантата. Манипуляции с ДК могут превратить их в наиболее эффективный адъювант для усиления иммунной защиты хозяина. Было показано, что злокачественные новообразования подавляют ДК, выделяя противовоспалительные цитокины, такие как IL-10, чем обусловливают образование супрессивных Т-клеток. Для того, чтобы подорвать эти механизмы, можно создать нацеленные на опухолевые антигены ДК ex vivo и ввести их пациенту для повышения иммунитета к опухолевым клеткам. Дендритные клеточные вакцины, создаваемые таким образом, безопасны, имеют минимум побочных эффектов и в целом выглядят как выполнимый, перспективный и эффективный метод лечения.
Читайте также:
- Инъекции ботокса против мимических морщин. Все за и против
- Омская геморрагическая лихорадка. Эпидемиология омской геморрагической лихорадки. Клиника омской геморрагической лихорадки.
- Осложнения установки (имплантации) кардиостимулятора
- Симптомы рака глотки и его лечение
- Бурсит тазобедренного сустава. Диагностика и лечение
