Мембранопролиферативный гломерулонефрит
Добавил пользователь Skiper Обновлено: 27.01.2026
ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» МЗ РФ; клиника нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева УКБ № 3, Институт профессионального образования, кафедра нефрологии и гемодиализа
В настоящее время мембранопролиферативный гломерулонефрит (МПГН) рассматривается как морфологический вариант гломерулярного повреждения, развивающийся при различном спектре нозологий. Ранее МПГН разделялся на первичный, идиопатический, и вторичный. В свою очередь первичный по локализации депозитов разделялся на МПГН I, II и III типов. В связи с появлением новых данных об этиологии и патогенезе заболевания эта классификация претерпела изменения. Изучение состава депозитов при иммунофлюоресцентной микроскопии позволило выделить особую группу нефритов, связанных с аномалиями альтернативного пути комплемента. Эта группа получила название С3 гломерулопатии. К основным представителям этой группы относятся болезнь плотных депозитов, ранее называвшаяся МПГН II типа, и С3-гломерулонефрит. В обзоре представлены новые данные о патогенезе и классификации МПГН.
Введение
Мембранопролиферативный гломерулонефрит (МПГН) до недавнего времени рассматривался как вариант иммунокомплексного нефрита, клинически проявляющегося гематурией, протеинурией различной степени выраженности, нефротическим синдромом, нередко в сочетании с элементами остронефритического синдрома, в т.ч. (в ряде случаев) нарушением функции почек [1].
По происхождению выделяли первичный, или идиопатический, МПГН, этиология которого оставалась неясной, и вторичный МПГН с установленной этиологией [2]. Идиопатический МПГН, как правило, дебютирует в детстве мочевым синдромом (порой слабовыраженным), который может длительно персистировать, однако у части больных изменения постепенно нарастают, приводя к формированию нефротического и/или остронефритического синдромов. Причины вторичного МПГН многообразны и включают системную патологию (СКВ, синдром Шегрена, ревматоидный артрит), инфекции (в первую очередь гепатиты С и В, а также др. вирусные, бактериальные, грибковые и паразитарные заболевания [1]), моноклональную гаммапатию [1]. Поскольку причину развития МПГН удавалось установить далеко не всегда, в недавнем прошлом идиопатическая форма болезни была доминирующей. Диагноз устанавливался при светооптической микроскопии на основании выраженной мезангиальной пролиферации и утолщения гломерулярной базальной мембраны (ГБМ), нередко с двойным контуром. Эти изменения определили название данной формы гломерулонефрита (ГН) – мембранопролиферативный, или мезангиокапиллярный [1, 3]. Исторически сложилось, что в Европе и в нашей стране чаще использовался термин «мезангиокапиллярный» ГН, а в Северной Америке – «мембранопролиферативный» [3]. Однако сегодня практически повсеместно принято использовать последний термин [4]. Наличие иммунных депозитов, выявляемых при электронной микроскопии, считается характерной чертой МПГН. По локализации депозитов выделяли три типа болезни. I тип характеризовался наличием депозитов в мезангиальной и субэндотелиальной областях (т.н. классический МПГН), II тип – электронно-плотными депозитами, располагавшимися преимущественно в интрамембранозной, а также мезангиальной областях [2, 5]. В связи с характерным видом этих очень плотных интрамембранозных электронных депозитов данный тип ГН с 1975 г. по предложению R. Habib стали называть болезнью плотных депозитов (dense deposit disease, DDD) [6]. III тип МПГН характеризовался комбинацией признаков первых двух типов: депозиты в мезангиальной, субэндотелиальной областях в сочетании с субэпителиальными и/или интрамембранозными депозитами [2]. Ряд авторов подразделяли III тип на два подтипа (с субэпителиальными депозитами – Burkholder субтип [7] и интрамембранозными – Strife and Anders субтип [8, 9]. Однако не всегда выявленные изменения укладывались в рамки какого-то одного типа и в одном биопсийном препарате, а порой даже в пределах одного клубочка, патолог мог видеть признаки сразу нескольких типов МПГН [5].
Таким образом, прежняя классификация МПГН основывалась на результатах световой (СМ) и электронной микроскопии (ЭМ) и давала представление о характере повреждения клубочков и локализации иммунных депозитов, но не о механизме развития данного повреждения. Это привело к трудностям с определением подходов к лечению: до настоящего времени эффективность терапии МПГН по сравнению с другими морфологическими вариантами относительно низка.
До недавнего времени патогенез всех типов МПГН представлялся иммунокомплексным с обязательной последующей активацией комплемента по классическому пути (чем объяснялось свечение иммуноглобулинов и компонентов комплемента в депозитах и снижение в крови общей гемолитической активности комплемента СН50 у некоторых пациентов), однако в ряде случаев патологи отмечали свечение только С3-компонента комплемента в отсутствие иммуноглобулинов (ИГ), что не укладывалось в стандартное представление об МПГН. Активное изучение роли альтернативного пути активации комплемента в патогенезе заболевания в последние годы привело к появлению нового представления о природе и патогенезе МПГН и обновлению классификации. В 2011 г. на основе данных иммунофлюоресцентной микроскопии (ИФ) (свечение ИГ и/или комплемента) S. Sethi and F. Fervenza предложили новую систему классификации, согласно которой МПГН может быть подразделен на 2 вида: опосредованный иммунными комплексами (ИК-опосредованный) и комплемент-опосредованный МПГН [10] (рис. 1). ИК-опосредованный МПГН развивается при высоком уровне циркулирующих иммунных комплексов (ИК), комплемент-опосредованный МПГН – вследствие нарушения регуляции альтернативного пути комплемента [1].
ИК-опосредованный МПГН
Развитие ИК-опосредованного нефрита обусловлено постоянным присутствием в крови антигена, что приводит к образованию и отложению в клубочках комплексов антиген–антитело при хронических инфекциях, аутоиммунных болезнях [1, 11]. ИК вызывают активацию классического пути комплемента (КПК) и отложение его компонентов в мезангии и вдоль капиллярных стенок (субэндотелиально.
Публикации в СМИ
Мезангиопролиферативный гломерулонефрит (МПГН) — часто встречающаяся форма гломерулонефрита, характеризующаяся очаговой или диффузной пролиферацией клеток почечных клубочков. Статистические данные. Встречается часто, выступает причиной 10% случаев нефротического синдрома у взрослых и 15% — у детей. Чаще болеют дети старшего возраста, молодые люди. Преобладающий пол — мужской.
Патогенез. Иммунокомплексное воспаление клубочков почки.
Патоморфология. Пролиферация эндотелиальных, мезангиальных клеток. Отложения в мезангии IgA, IgG, IgM, компонентов комплемента С3, С4. Преобладание IgA и С3 в отложениях классифицируют как IgA-нефропатию (болезнь Берже).
Клиническая картина • Изолированный мочевой синдром • Рецидивирующая или персистирующая гематурия (IgA-нефропатия) • Остронефритический синдром (до 30–35% случаев заболевания) • Нефротический синдром (до 25% случаев) • ХПН (развивается медленно).
Лабораторные данные • Уровень сывороточного IgA повышен при IgA-нефропатии, титр антистрептолизина О не изменён.
Диагностика. Окончательный диагноз устанавливают при биопсии.
Дифференциальная диагностика • СКВ, узелковый полиартериит, болезнь Шёнляйна–Геноха, болезнь Гудпасчера, подострый инфекционный эндокардит, гранулематоз Вегенера • Болезнь Берже как одна из форм МПГН.
Лечение • Диета (см. Гломерулонефрит хронический) • Доказательств эффективности воздействия ГК и цитостатиков на течение медленно прогрессирующих форм МПГН нет, поэтому больным с изолированной гематурией и неизменёнными функциями почек «агрессивная» терапия не показана • При прогрессирующем течении (протеинурия более 1 г/сут, нефротический синдром, артериальная гипертензия) начинают с ГК в сочетании с антикоагулянтами, антиагрегантами. При рецидивах, неэффективности преднизолона назначают цитостатики (в сочетании с преднизолоном или без него). ГК и/или цитостатики можно назначать в составе многокомпонентных схем (см. Гломерулонефрит хронический): 3-компонентной, 4-компонентной (схемы Кинкайд–Смит), схемы Понтичелли, схемы Стейнберга • При отсутствии эффекта от предшествующей иммунодепрессивной терапии — циклоспорин по 5 мг/кг/сут 6–12 мес • Рыбий жир 12 г/сут в течение 2 лет (результаты контролируемых исследований разноречивы) • Антигипертензивные средства — ингибиторы АПФ при повышенном или нормальном АД • Лечение нефротического синдрома — см. Синдром нефротический.
Профилактика • Первичная профилактика — лечение стрептококкового фарингита антибиотиками • Тонзиллэктомия • Антибиотики при острой респираторной или желудочно-кишечной инфекции — снижают число эпизодов макрогематурии, замедляют прогрессирование МПГН.
Прогноз • 10-летняя выживаемость — 81% • Прогноз лучше при эффективности ГК, хуже — при выраженной гематурии, протеинурии, артериальной гипертензии, почечной недостаточности, выраженных изменениях при морфологическом исследовании.
Сокращение: МПГН — мезангиопролиферативный гломерулонефрит.
МКБ-10. N00–N07 с подрубрикой 3 «Диффузный мезангиальный пролиферативный гломерулонефрит»
Код вставки на сайт
Гломерулонефрит мезангиопролиферативный
Мезангиопролиферативный гломерулонефрит (МПГН) — часто встречающаяся форма гломерулонефрита, характеризующаяся очаговой или диффузной пролиферацией клеток почечных клубочков. Статистические данные. Встречается часто, выступает причиной 10% случаев нефротического синдрома у взрослых и 15% — у детей. Чаще болеют дети старшего возраста, молодые люди. Преобладающий пол — мужской.
Патогенез. Иммунокомплексное воспаление клубочков почки.
Патоморфология. Пролиферация эндотелиальных, мезангиальных клеток. Отложения в мезангии IgA, IgG, IgM, компонентов комплемента С3, С4. Преобладание IgA и С3 в отложениях классифицируют как IgA-нефропатию (болезнь Берже).
Клиническая картина • Изолированный мочевой синдром • Рецидивирующая или персистирующая гематурия (IgA-нефропатия) • Остронефритический синдром (до 30–35% случаев заболевания) • Нефротический синдром (до 25% случаев) • ХПН (развивается медленно).
Лабораторные данные • Уровень сывороточного IgA повышен при IgA-нефропатии, титр антистрептолизина О не изменён.
Диагностика. Окончательный диагноз устанавливают при биопсии.
Дифференциальная диагностика • СКВ, узелковый полиартериит, болезнь Шёнляйна–Геноха, болезнь Гудпасчера, подострый инфекционный эндокардит, гранулематоз Вегенера • Болезнь Берже как одна из форм МПГН.
Лечение • Диета (см. Гломерулонефрит хронический) • Доказательств эффективности воздействия ГК и цитостатиков на течение медленно прогрессирующих форм МПГН нет, поэтому больным с изолированной гематурией и неизменёнными функциями почек «агрессивная» терапия не показана • При прогрессирующем течении (протеинурия более 1 г/сут, нефротический синдром, артериальная гипертензия) начинают с ГК в сочетании с антикоагулянтами, антиагрегантами. При рецидивах, неэффективности преднизолона назначают цитостатики (в сочетании с преднизолоном или без него). ГК и/или цитостатики можно назначать в составе многокомпонентных схем (см. Гломерулонефрит хронический): 3-компонентной, 4-компонентной (схемы Кинкайд–Смит), схемы Понтичелли, схемы Стейнберга • При отсутствии эффекта от предшествующей иммунодепрессивной терапии — циклоспорин по 5 мг/кг/сут 6–12 мес • Рыбий жир 12 г/сут в течение 2 лет (результаты контролируемых исследований разноречивы) • Антигипертензивные средства — ингибиторы АПФ при повышенном или нормальном АД • Лечение нефротического синдрома — см. Синдром нефротический.
Профилактика • Первичная профилактика — лечение стрептококкового фарингита антибиотиками • Тонзиллэктомия • Антибиотики при острой респираторной или желудочно-кишечной инфекции — снижают число эпизодов макрогематурии, замедляют прогрессирование МПГН.
Прогноз • 10-летняя выживаемость — 81% • Прогноз лучше при эффективности ГК, хуже — при выраженной гематурии, протеинурии, артериальной гипертензии, почечной недостаточности, выраженных изменениях при морфологическом исследовании.
Сокращение: МПГН — мезангиопролиферативный гломерулонефрит.
МКБ-10. N00–N07 с подрубрикой 3 «Диффузный мезангиальный пролиферативный гломерулонефрит»
Мембранопролиферативный гломерулонефрит в российской популяции
Мембранопролиферативный гломерулонефрит в российской популяции
Цель исследования. Анализ клинико-морфологических проявлений, подходов к терапии и прогноза мембранопролиферативного гломерулонефрита (МПГН).
Материалы и методы. В период 2000–2017 гг. ретроспективно выявляли случаи МПГН с анализом этиологии, клинических данных и морфологии (включая депозиты иммуноглобулинов – Ig – и С3-фракции комплемента). В исследование включено 214 случаев МПГН. Средний возраст пациентов – 44±16 лет. Оценивали достижение полных и частичных ремиссий (ПР, ЧР), общую выживаемость, прогрессирование (по композитной конечной точке: снижение расчетной скорости клубочковой фильтрации – рСКФ – на 50% и более от исходной, или рСКФ Результаты и обсуждение. Нефротический синдром выявлен у 72% больных; в 58,4% случаев рСКФ достигала Заключение. Синдром МПГН представляет собой тяжелый вариант повреждения клубочков с гетерогенной этиологической структурой и серьезным прогнозом. Целенаправленная клинико-морфологическая диагностика позволяет идентифицировать причину МПГН в большинстве случаев, что является основой для выбора адекватного лечения и улучшения исходов.
Ключевые слова: мембранопролиферативный гломерулонефрит, этиология, морфология, клиническая картина, лечение, прогрессирование, полная ремиссия, частичная ремиссия.
Aim. Analysis of etiology, clinical and morphological manifestations, approaches to therapy and prognosis of membranoproliferative glomerulonephritis (MPGN).
Materials and methods. Cases of MPGN were retrospectively identified in the period 2000–2017 with subsequent analysis of etiology, clinical data and morphology (including deposits of immunoglobulins (Ig) and C3 complement fractions). The achievement of complete and partial remissions (PR, CR), overall survival, progression (by composite endpoint: decrease in the estimated GFR (eGFR) ≥50% from the baseline or eGFR Results and discussion. 214 cases of MPGN entered the study with the average age of 44±16 years. Most patients had nephrotic syndrome and significant hematuria. In 58.4% of cases, eGFR was Conclusion. MPGN is a severe variant of glomerular damage with a heterogeneous etiological structure and an unfavorable prognosis. Targeted clinical and morphological diagnostics of MPGN allows to identify the cause of the disease in most cases. This approach is reliable for the adequate treatment choice and improvement of outcomes in MPGN.
Keywords: membranoproliferative glomerulonephritis, etiology, morphology, immunomorphology, clinical manifestations, complete remissions, partial remissions, therapy, prognosis, survival.
В.А. Добронравов, А.В. Смирнов
Научно-исследовательский институт нефрологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Санкт-Петербург, Россия
V.A. Dobronravov, A.V. Smirnov
Research Institute of Nephrology, I.P. Pavlov First Saint Petersburg State Medical University of the Ministry of Health of the Russian Federation, Saint Petersburg, Russia
Мембранопролиферативный гломерулонефрит
А.Н. Цыгин, Н.Н. Картамышева, Д.П. Шкляев, Л.В. Леонова, П.Е. Повилайтите
Научный центр здоровья детей РАМН, Москва; Хабаровская краевая детская больница, Хабаровск; ГУЗ Ростовской области "Патологоанатомическое бюро”, Ростов-на-Дону
Мембранопролиферативный гломерулонефрит II типа (болезнь плотных депозитов) – редкая форма гломерулонефрита, патогномоничным признаком которой является отложение электронно-плотного материала в толще гломерулярной базальной мембраны. Развитие заболевания обусловлено бесконтрольной активацией комплемента по альтернативному пути. В ряде случаев выявляется генетическая природа заболевания. Болезнь чаще встречается в детском возрасте и имеет неблагоприятный прогноз. В статье представлено клиническое наблюдение с комментариями.
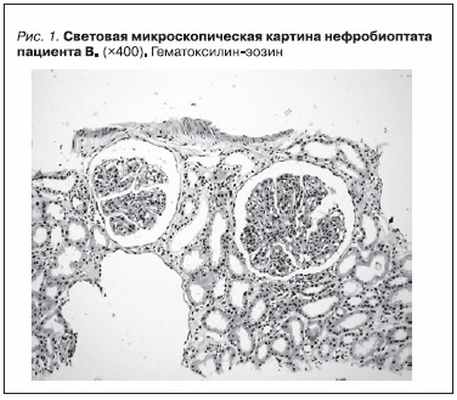
Мембранопролиферативный гломерулонефрит II типа (МПГН-II) характеризуется диффузным утолщением стенок клубочковых капилляров с возможной интерпозицией мезангия в эту область, что приводит к картине двухконтурности (“трамвайный путь”) гломерулярной базальной мембраны
(ГБМ). Имеются выраженная гиперцеллюлярность клубочка и расширение мезангиального матрикса. Особо типичной является электронно-микроскопическая картина, демонстрирующая электронно-плотные интрамембранозные депозиты, состоящие из С3 и продуктов деградации комплемента. По их
наличию данную патологию определяют так же, как и болезнь плотных депозитов (БПД).
Заболевание относится к числу очень редких (2–3 случая на миллион населения) и встречается практически исключительно в возрасте от 5 до 15 лет.
В отличие от мембранопролиферативного гломерулонефрита I типа, считающегося иммунокомплексным заболеванием почек, при МПГН-II доказательств иммунокомплексной природы болезни не имеется. В патогенезе БПД основная роль отводится дисфункции системы комплемента с неконтролируемой активацией его альтернативного пути. У 80 % пациентов с МПГН-II определяется сывороточный С3-нефритический фактор (C3NeF) – аутоантитело к C3bBb, конвертазе альтернативного пути каскада комплемента. Поскольку C3NeF определяется и при МПГН-I более чем у половины больных, основой диагностики является электронная микроскопия биоптата почки.
Когда C3NeF связывается с C3bBb, устойчивость последней к метаболической деградации повышается, активность этой конвертазы сохраняется более длительно, что и поддерживает неконтролируемую активацию альтернативного пути каскада комплемента с низким уровнем С3 и его депозицией в ГБМ.
Помимо этого существует несколько факторов регуляции комплемента, наиболее значимым из которых при описываемой патологии является фактор H (fH) – растворимый гликопротеин, дестабилизирующий конвертазу C3bBb. Активность последней возрастает при дефиците fH, обусловленной мутацией гена на хромосоме 1q32, ответственного за его синтез, или с присутствием антител к fH. Данные нарушения также сопровождаются активацией альтернативного пути комплемента. Наряду с МПГН-II дефицит fH лежит в основе патогенеза некоторых форм атипичного гемолитико-уремического синдрома, часто носящего семейный характер при наличии мутаций fH [1, 2].
Клинически у всех пациентов отмечена гематурия и протеинурия, почти в половине случаев приводящие к нефротическому синдрому. Болезнь носит прогрессирующий характер, и примерно у 70 % больных в течение 10 лет развивается терминальная стадия хронической почечной недостаточности.
К экстраренальным проявлениям МПГН-II относятся изменения на сетчатке, напоминающие старческую дегенерацию с наличием характерных бляшек беловато-желтого цвета (drusen), которые только со временем могут нарушить зрительную функцию.
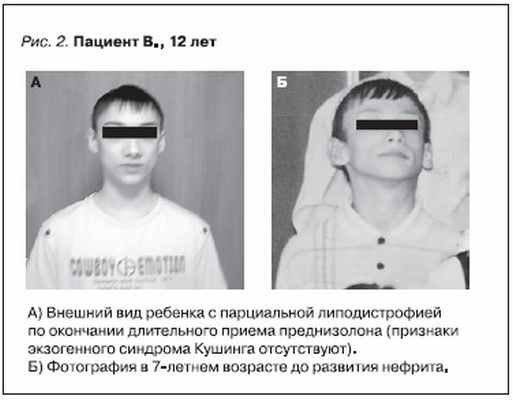
МПГН-II может сопровождаться приобретенной парциальной липодистрофией (ПЛД), преимущественно затрагивающей верхние отделы тела. ПЛД может отмечаться за годы до развития нефрита, и уже в это время наблюдается низкий уровень С3 в сыворотке. Развитие ПЛД связано с отложением активированных продуктов каскада комплемента в жировой ткани и разрушением адипоцитов [3].
Эффективных способов лечения МПГН-II не известно. Контролируемых исследований не проводилось из-за крайней редкости заболевания. Иммуносупрессивная терапия не приводит к увеличению выживаемости больных, хотя в некоторых случаях определенный эффект возможен, вероятно вследствие подавления продукции антител к fH. Умеренной эффективностью обладают сочетанное применение антикоагулянтов и антиагрегантов, а также терапевтический плазмаферез с введением свежезамороженной плазмы. Это может объясняться удалением C3NeF и введением экзогенного fH.
Перспективными новыми методами считаются применение препарата Экулизумаб, моноклонального антитела к протеину C5-комплемента. Экулизумаб ингибирует каскад комплемента за счет снижения активности ряда конвертаз. Ведутся также работы по синтезу рекомбинантного fH.
МПГН-II развивается в почечном трансплантате практически в 100 % случаев, однако болезнь при этом не носит столь тяжелого характера, как в нативной почке, и в отношении трансплантации у таких больных не должно быть полного отрицания [4, 5]. Обсуждается вопрос об эффективности
трансплантации печени при дефиците fH, т. к. последний синтезируется именно в печени.
В отделении нефрологии НЦЗД РАМН в течение 1,5 лет (03.2009–09.2010) с диагнозом “мембранопролиферативный гломерулонефрит II типа (пункционная нефробиопсия 04.2008) с парциальной липодистрофией” наблюдался пациент В. 1996 г. р.
Семейный анамнез у больного отягощен не был. До начала настоящего заболевания мальчик считался практически здоровым.
Дебют заболевания имел место в феврале 2007 г. в возрасте 10 лет с развернутого нефротического синдрома (протеинурия – до 6 г/л, гипопротеинемия – 30–40 г/л, гиперхолестеринемия – более 10ммоль/л, выраженные отеки), гематурии, артериальной гипертензии до 160/100 мм рт. ст. Терапия преднизолоном в дозе 60 мг/сут в течение 2,5 недель, далее в связи с развитием гастродуоденита в дозе 40 мг/сут длительностью ~3 месяцев оказалась неэффективной. При этом развития кушингоидного синдрома не наблюдалось.
В июне 2007 г. по месту жительства проведена нефробиопсия, выявившая мембранопролиферативный гломерулонефрит с выраженными тубулоинтерстициальными изменениями. Был проведен курс лечения циклоспорином А в течение ~1 года с незначительной положительной динамикой. Далее в связи с
отсутствием препарата терапия продолжена приемом мофетила микофенолата в сочетании с преднизолоном 30 мг/48 ч. С целью коррекции артериальной гипертензии мальчик получал ингибитор ангиотензинпревращающего фермента лизиноприл с положительным эффектом.
Спустя ~6 месяцев от начала терапии мофетила микофенолатом отмечено снижение активности заболевания. Протеинурия составила 0,5–1,4 г/сут, уровень общего белка в сыворотке крови – 57 г/л, холестерина – 7,8 ммоль/л. Содержание С3-компонента комплемента в сыворотке крови было снижено до 12,2 мг%. Скорость клубочковой фильтрации (СКФ) соответствовала I стадии хронической болезни почек (ХБП), равной 110,5 мл/мин. Артериальное давление по однократным измерениям не поднималось выше 120/75 мм рт. ст., хотя по данным суточного мониторирования средние показатели в
дневные и ночные часы были повышены (130/92 и 113/77 мм рт. ст. соответственно). Гемоглобин был на уровне 109 г/л. Специальные методы исследования не подтвердили наличия гепатитов и системных заболеваний.
Тогда же были изучены биоптаты почечной ткани, полученные при проведении по месту жительства повторной нефробиопсии в апреле 2008 г. (рис. 1). Был заподозрен МПГН-II. Обращала на себя внимание парциальная липодистрофия лица (рис. 2), подтвержденная рядом фотографий начиная с
возраста 5 лет.
Было продолжено лечение мофетила микофенолатом. Спустя ~1 год от начала указанной терапии вновь отмечено возрастание активности нефротического синдрома. Уровень протеинурии составил 3–6 г/л, общего белка в сыворотке крови – 30–40 г/л, холестерина – более 10 ммоль/л; имели
место выраженные отеки век, голеней, стоп. Была проведена интенсивная симптоматическая и ренопротективная терапия, продолжен прием мофетила микофенолата.
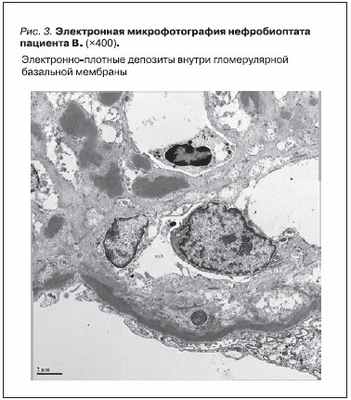
По данным электронной микроскопии был подтвержден МПГН-II с распространенными электроно-плотными депозитами по ходу всей гломерулярной базальной мембраны (рис. 3). Проведен забор крови для молекулярно-генетического исследования, хотя полученные значительно позднее (02.2011)
результаты исследования мутаций в гене fН-комплемента в “горячих точках” их не подтвердили.
Полученные результаты обследования и характер течения заболевания позволили считать лечение иммуносупрессивными препаратами в дальнейшем нецелесообразным. Была рекомендована ренопротективная и симптоматическая терапия, которая затем проводилась нерегулярно.
Спустя 7 месяцев отмечено существенное ухудшение в состоянии ребенка. Имели место выраженные отеки голеней, век. Протеинурия составила 4–6 г/сут, уровень общего белка в сыворотке крови – 35 г/л, альбуминов 12 г/л, холестерина – 17,5 ммоль/л. Содержание С3-компонента комплемента в
сыворотке крови было снижено до 0,21 г/л. СКФ соответ ствовала II стадии ХБП – 78,6 мл/мин. Артериальное давление по однократным измерениям составило 150/90 мм рт. ст., по данным суточного мониторирования средние показатели в дневные и ночные часы были повышены (147/112 и 141/103
мм рт. ст. соответственно). Выявлено расширение полости левого желудочка (50/34 мм), утолщение его стенок (задняя стенка левого желудочка 8,5 мм). Сохранялась анемия: уровень Нв – 108 г/л. Вновь был проведен подбор антигипертензивной терапии. Была использована многокомпонентная схема,
включившая ингибитор ангиотензинпревращающего фермента лизиноприл, антогонист кальция амлодипин, диуретики (гидрохлортиазид, индапамид). Назначены антиагрегантная и антикоагулянтная терапия, препараты кальция, витамина D, железа, эритропоэтина. На этом фоне удалось достичь стабилизации состояния, выраженность отеков существенно снизилась, уровень артериального давления составил 120/90 мм рт. ст., уменьшились размеры левого желудочка (44/26
мм), гемоглобин достиг 123 г/л. Рекомендовано продолжить отмеченную выше терапию, однако в дальнейшем заболевание имело быстропрогрессирующий характер.
Таким образом, особенности течения заболевания (дебют в возрасте 10 лет, высокая активность нефротического синдрома, сохранявшаяся на фоне интенсивной иммуносупрессивной терапии, трудноподдающаяся коррекции артериальная гипертензия, прогрессирующее снижение почечных
функций), низкий уровень С3-компонента комплемента в сыворотке крови, характерные морфологические изменения, наличие парциальной липодистрофии позволили поставить
указанный выше диагноз, несмотря на результаты молекулярно-генетического исследования. Некоторое снижение активности заболевания в начале лечения мофетила микофенолатом, возможно, обусловлено в определенной степени подавлением на фоне указанной терапии С3-нефритического
фактора – антитела, направленного против С3-конвертазы, регулирующей альтернативный путь комплементного каскада, некотролируемая активация которого лежит в основе патогенеза МПГН-II.
Литература
1. Martinez-Barricarte R., Heurich M., Valdes-Canedo F. et al. Human C3 mutation reveals a mechanism of dense deposit disease pathogenesis and provaides insights into complement activation and regulation. J. Clin. Invest.
2010;120(10):3702–3712.
2. Lachmann P.J. The amplification loop of complement pathways. Adv. Immunol. 2009;104:115–149.
3. Суханов А.В., Румянцев А.Л., Цыгин А.Н. Мембранопролиферативный гломерулонефрит 2-го типа (болезнь плотных подоцитов) с быстропрогрессирующим течением. Нефрология и диализ. 2003;5(4):
399–400.
4. Appel B. Gerald, Cook Terence H., Hageman G. et al. Membranoproliferative Glomerulonephritis Type II (Dense Deposit Disease): An Update. J. Am. Soc. Nephrol. 2005;16:1392–1404.
5. Smith R.J.H., Alexander J., Barlow P.N. et al. New Approaches to the Treatment of Dense Deposit Disease. J. Am. Soc. Nephrol. 2007;18: 2447–2456.
Об авторах / Для корреспонденции
Болезни почечных клубочков
Этиология
• Первичные
• Вторичные: системная красная волчанка, геморрагический васкулит, тиреотоксикоз, инфекционный эндокардит, вирусный гепатит, лекарства, опухоль.
Течение
• Острое: недели.
• Быстропрогрессирующее: недели–3 мес.
• Хроническое: >3 мес.
Гистология
• Мембранозная нефропатия.
• Мембранопролиферативные гломерулонефриты: иммунокомплексные, C3 гломерулопатии (болезнь плотных депозитов, C3 гломерулонефрит), типы I–III.
• Мезангиопролиферативные гломерулонефриты: IgM-нефропатия, IgA-нефропатия, C1q нефропатия, волчаночный нефрит (II класс).
• Фокально-сегментарный гломерулосклероз.
• Болезнь минимальных изменений.
• Фибриллярный гломерулонефрит.
• Гломерулонефрит с антителами к базальной мембране.
• Острый постстрептококковый гломерулонефрит.
• Нефритический синдром: отеки, гипертензия, макрогематурия, протеинурия <3–3.5 г/сут, острое повреждение почек, олигурия <400 мл/сут.
• Нефротический синдром: протеинурия >3.5 г/сут или 3 г/л, гипоальбуминемия • Артериальная гипертензия.
• Гематурия: микроскопическая (≥3 эритроцитов в поле зрения), макроскопическая.
• Протеинурия: асимптоматическая, нефротического уровня (без признаков нефротического синдрома).
• Снижение функции почек: острое повреждение почки, транзиторное снижение СКФ, хроническая болезнь почек.
• Нефритический синдром: 36%.
• Асимптомная протеинурия/гематурия: 35%.
• Артериальная гипертензия: 14%.
• Острый нефрит: 7%.
• Макрогематурия: 4%.
• Другие проявления: 4%.
• Хроническая почечная недостаточность:
• Анализ мочи: гематурия, протеинурия.
• Анализ крови: креатинин, СКФ, калий, натрий.
• Фазовоконтрастная микроскопия мочи (источник гематурии).
• Биопсия почки: основной метод диагностики клубочковых болезней.
Показания
• Нефротический синдром.
• Острое повреждение почек неясное >2–4 нед.
• Неясная тяжелая ХПН (СКФ • Быстрое снижение функции почек.
• Быстропрогрессирующий нефритический синдром.
• Персистирующая протеинурия >1 г/сут.
• Микрогематурия с гипертензией/протеинурией/дисфункцией почек.
• Контроль лечения
• Подозрение на отторжение трансплантанта
Лечение возможно без биопсии (KDIGO)
• Стероид-чувствительный нефротический синдром у детей до 12 лет.
• Постстрептококковый гломерулонефрит у детей.
• Мембранозный гломерулонефрит с PLA2R антителами.
• MPO+ или PR3+ ANCA васкулит.
• Мембранная болезнь с антителами к базальной мембране клубочков.
• Болезнь Альпорта.
• Болезнь Фабри.
• Семейный фокальный сегментарный гломерулосклероз в семьях с установленной мутацией.
• Системная красная волчанка.
Противопоказания
• Поликистоз.
• Активная инфекция почки.
• Обструктивная нефропатия (гидронефроз).
• Неконтролируемая гипертензия.
• Повышенный риск кровотечения.
• Аномалии почки.
• Почки • Единственная почка (исключая трансплантант).
• Опухоль почки.
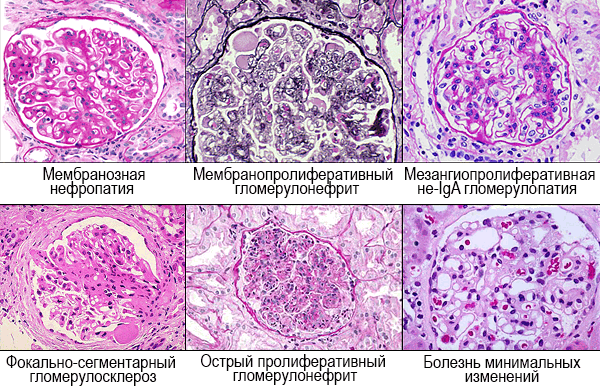
Морфология: утолщение мембран, иммунные депозиты субэпителиально.
Клиника: нефротический синдром (80%), протеинурия >3 г/сут, гематурия, гипертензия, ХБП.
Лечение: при высоком риске прогрессировния (рСКФ 8 г/сут >6 мес, жизнеугрожающий нефротический синдром, быстрое ухудшение функции почек) ритуксимаб или циклофосфамид + кортикостероид, ингибитор кальциневрина + ритуксимаб.
Морфология: пролиферация мезангиальных клеток, эндокапиллярная пролиферация, ремоделирование мембраны с двойным контуром, депозиты иммунных комплексов и/или факторов комплемента в мезангии и стенке капилляров.
Клиника: нефритический синдром, нефротический синдром, протеинурия, гематурия, гипертензия, ХБП.
Лечение: кортикостероиды при нефротическом синдроме, циклофосфамид или ритуксимаб + кортикостероид, микофенолата мофетил.
Морфология: пролиферация мезангиальных клеток, иммунные депозиты (чаще IgA) в мезангии.
Клиника: асимптомная макро- или микрогематурия, протеинурия, гипертензия.
Лечение: иАПФ/БРА при протеинурии >0.5 г/сут, кортикостероиды (метилпреднизолон до 48 мг/сут) до 6–9 мес при протеинурии >1 г/сут через 3 мес лечения иАПФ/БРА и отсутствии противопоказаний (рСКФ
Морфология: участки склероза и гиалиноза клубочков.
Клиника: нефротический синдром, протеинурия, гематурия (50%), гипертензия (30%), ХБП.
Лечение: иАПФ/БРА, преднизолон 1 мг/кг (
Морфология: повреждение отростков висцеральных эпителиальных клеток.
Клиника: женщины в 2–3 раза чаще, нефротический синдром (рецидивирующий), выраженная протеинурия, гипертензия, легкая ХБП.
Лечение: кортикостероиды при нефротическом синдроме до 16 нед, постепенно снижать дозу через 2 нед полной ремиссии. При противопоказания к кортикостероидам: циклофосфамид, ингибиторы кальциневрина, микофеналат.
Морфология: инфильтрация нейтрофилами, пролиферация мезангиальных клеток
Клиника: после фарингита через 7–21 сут остронефритический синдром.
Лечение: спонтанное разрешение через 1–2 нед, лечение гипертензии и отеков.
Морфология: пролиферация клеток боуменовой капсулы, >60% клубочков с полулуниями, антитела к базальной мембране клубочков
Клиника: остронефритический синдром, быстропрогрессирующая почечная дисфункция, гипертензия.
Лечение: кортикостероид + циклофосфамид, плазмаферез.
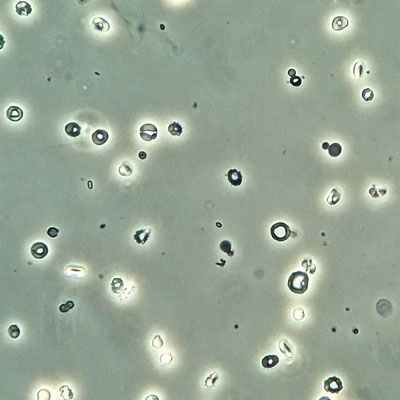
□ Хронический гломерулонефрит, ХБП C2. [N07.8]
□ Хронический мембранопролиферативный гломерулонефрит, нефротический синдром, артериальная гипертензия, обострение. [N03.03]
□ Системная красная волчанка, подострое течение, полиартрит, правосторонний экссудативный плеврит, нефрит, ХБП C4. [M32]
• Общие рекомендации: отказ от курения, физические нагрузки, ограничение соли • Нефротический синдром: кортикостероиды (преднизолон 1 мг/кг [ • Отеки: ограничение соли • Артериальная гипертензия (цель • Протеинурия (цель • Почечная дисфункция: ограничение белка, ИАПФ/БРА, диализ, трансплантация почки.
Читайте также:
