Методы и препараты таргетной химиотерапии в онкогинекологии
Добавил пользователь Alex Обновлено: 28.01.2026
Химиопрепараты — лекарственные средства, которые повреждают клетки во время деления. В первую очередь их мишенью являются раковые клетки, так как они активно размножаются. Но «под удар» попадают и некоторые здоровые ткани, в связи с этим возникают побочные эффекты, иногда весьма серьезные.
Химиотерапия — один из трех основных методов лечения онкозаболеваний, наряду с хирургией и лучевой терапией.
Врачи «Евроонко» проводят курсы химиотерапии любой сложности, при раке яичников любой стадии. Мы руководствуемся международными протоколами и применяем оригинальные европейские и американские препараты с доказанной эффективностью.
Какие химиопрепараты применяют при раке яичников?
Существуют разные группы препаратов с различными механизмами действия. Чаще всего применяют препараты платины (цисплатин, карбоплатин) в комбинации с таксанами (паклитаксел). Первые повреждают ДНК раковых клеток, тормозя их размножение и приводя к гибели, вторые повреждают внутриклеточные структуры, необходимые для деления клеток.
Также применяют другие виды химиопрепаратов:
- альтретамин (Гексален);
- капецитабин (Кселода);
- циклофосфамид (Цитоксан);
- доцетаксел (Таксотер);
- доксорубицин (Адриамицин);
- этопозид (VP-16);
- гемцитабин (Гемзар);
- ифосфамид (Ифекс);
- иринотекан (Камптозар);
- мелфалан (Алкеран);
- пеметрексед (Алимт);
- топотекан (Гикамтин);
- винорелбин (Навельбин).
Обычно химиопрепараты при раке яичников вводят внутривенно. Некоторые (альтретамин, этопозид) принимают в виде таблеток. Иногда препараты вводят интраперитонеально — в брюшную полость. Во время операции хирург оставляет в животе катетер, второй конец которого выводят наружу и соединяют с порт-системой — небольшим резервуаром, одна из стенок которого представляет собой тонкую мембрану.
Порт-систему подшивают под кожу, при этом под ней должна находиться плотная костная структура, например, ребро или кость таза. Когда в брюшную полость нужно ввести химиопрепарат, врач протыкает специальной иглой кожу и мембрану порт-системы, и вводит раствор.
Таргетные препараты
Таргетные препараты — современные средства для борьбы с раком, которые, в отличие от классических химиопрепаратов, атакуют только раковые клетки и не затрагивают здоровые. У каждого таргетного препарата есть специфическая мишень — молекула, которая играет важную роль в развитии рака.
Американская авторитетная организация NCCN, на стандарты которой ориентируются врачи «Евроонко», рекомендует при злокачественных опухолях яичников три таргетных препарата:
- Бевацизумаб. Блокирует VEGF — вещество, которое выделяют раковые клетки, чтобы стимулировать рост новых сосудов, необходимых для обеспечения опухоли кислородом и питательными веществами.
- Олапариб. Блокирует фермент PARP, который участвует в репарации поврежденной ДНК.
- Пазопаниб. Блокирует фермент тирозинкиназу, которая играет важную роль во многих клеточных функциях.
Гормональные препараты
Некоторые опухоли яичников являются гормонозависимыми, то есть растут под действием эстрогенов и прогестерона. В таких случаях могут быть эффективны гормональные препараты: тамоксифен, мегестрола ацетат, анастрозол, экземестан, леупролид ацетат. Гормональную терапию назначают при рецидивах опухолей яичников.
Что такое циклы?
Из-за того, что химиопрепараты повреждают не только опухолевые, но и здоровые клетки, применять их нужно с осторожностью, по особым правилам. После того как больной получил определенную дозу, его организм должен «отдохнуть».
Химиотерапию проводят циклами. Один цикл (введение препарата + перерыв) при раке яичника может продолжаться 7, 14, 21 или 28 дней.

Курсы химиотерапии на разных стадиях рака яичников
Для каждой стадии рака яичников существуют четкие алгоритмы лечения — они называются протоколами. Протоколы составлены на основании наблюдений за тысячами онкологических пациентов. В них прописаны оптимальные комбинации химиопрепаратов, количество и продолжительность циклов.
Врачи «Евроонко» работают по протоколам NCCN — авторитетной американской ассоциации, в которую входят крупнейшие онкоцентры США. Мы также можем продолжить лечение по протоколу, которым руководствовался ваш предыдущий лечащий врач.
На I стадии рака яичников проводят хирургическое лечение, которое дополняют 3–6 циклами химиотерапии. Назначают комбинации карбоплатина с паклитакселом или доцетакселом.
На II–IV стадиях лечение начинают с хирургического вмешательства, а если оно невозможно — с курса химиотерапии, чтобы уменьшить размер опухоли. Количество циклов увеличивается до 6–8. Применяют комбинации паклитаксела с цисплатином или карбоплатином, доцетаксел + карбоплатин, бевацизумаб + паклитаксел + карбоплатин.
Рецидив рака яичников лечат сочетаниями различных химиопрепаратов, таргетных и гормональных препаратов.
Один из основных критериев подбора терапии — чувствительность опухоли к препаратам платины. Если рецидив произошел менее чем через полгода после курса химиотерапии, это означает, что рак плохо реагирует на лечение карбоплатином и цисплатином. Если рецидив произошел более чем через полгода, значит, препараты платины работали хорошо, и их можно назначить снова.
Главный принцип работы «Евроонко» звучит так: «помочь можно любому пациенту, на любой стадии рака». Наши врачи берутся за подготовку и проведение курса химиотерапии в случаях, когда женщинам отказывают в лечении в других больницах. Паллиативная терапия в сочетании с противоопухолевым лечением помогает продлить жизнь, обеспечить её достойное качество без боли и других мучительных симптомов.
Методы и препараты таргетной химиотерапии в онкогинекологии
Препараты для химиотерапии, применяемые при опухолях женских половых органов
1. Алкилирующие средства в онкогинекологии
Алкилирующие средства препятствуют клеточному делению за ечет перекрестного связывания цепей ДНК. Вследствие продолжающегося синтеза других клеточных компонентов, таких как РНК и белка, нарастают нарушения в клеточном балансе и клетка гибнет. Действие алкилирующих средств не зависит от синтеза ДНК в клетке-мишени. Однако циклофосфамид ингибирует также синтез ДНК, что отличает его от остальных алкилирующих средств по способу и спектру своей деятельности.
На данный момент к алкилирующим средствам, используемыми в онкогинекологии, относятся:
- карбоплатин,
- цисплатин,
- оксалиплатин,
- циклофосфамид,
- хлорамбуцил,
- мелфалан,
- триэтиленэтиофосфорамид,
- ифосфамид,
- алтретамин (гексаметилмеламин).
2. Антиметаболиты в онкогинекологии
Антиметаболиты действуют, ингибируя основные метаболические процессы, которые необходимы для синтеза пуринов, пиримидинов и нуклеиновых кислот. Обычно эти вещества S-фазоспецифические. На сегодня применяются следующие препараты этой категории:
- фторурацил,
- метотрексат,
- цитарабин,
- капецитабин,
- гемцитабин.
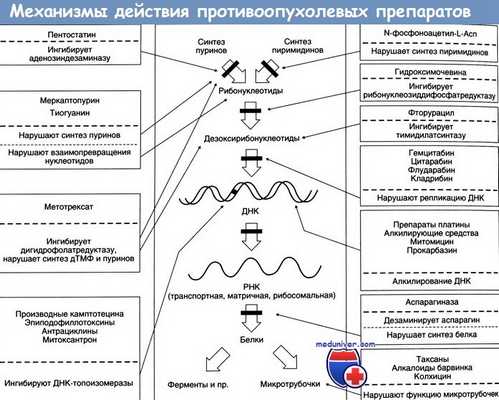
3. Противоопухолевые антибиотики в онкогинекологии
Противоопухолевые антибиотики, как правило, получают из продуктов брожения различных грибов, и большинство препаратов оказывает действие при включении в ДНК. Некоторые цитотоксические антибиотики используются в XT при определенных злокачественных новообразованиях. В настоящее время в онкогинекологии используются:
- дактиномицин (актиномицин D),
- блеомицин,
- доксорубицин и липосомный доксорубицина гидрохлорид,
- митомицин С,
- митоксантрон.
4. Препараты растительного происхождения в онкогинекологии
Некоторые химиопрепараты имеют растительное происхождение. Алкалоиды барвинка, эпидофиллотоксины и таксаны оказывают действие, повреждая нормальную сборку, разборку и стабилизацию микротрубочек. Аналоги камптотецина ингибируют топоизомеразу I,таким образом индуцируя одноцепочечные разрывы ДНК. Применяются следующие препараты:
- Алкалоиды барвинка: винбластин, винкристин, винорелбин.
- Таксаны: паклитаксел, доцетаксел.
- Эпиподофиллотоксин: этопозид.
- Аналоги камптотецина: топотекан, иринотекан.
5. Гормональные препараты в онкогинекологии
Эти вещества часто применяются при лечении РЭ, РМЖ и РЯ и подразделяются на две больших категории: антиэстрогены и прогестины. Мегестерола ацетат может как ингибировать эстрогензависимые гены, так и уменьшать количество доступных эстрогенных рецепторов на поверхности клеток. Примеры этих препаратов:
• Антиэстрогены:
• тамоксифен.
• Прогестины: мегестрола ацетат, медроксипрогестерона ацетат, гидрокси прогестерон.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Роль таргетных препаратов в терапии рака яичников
В статье рассмотрены современное состояние и перспективы применения разных групп таргетных препаратов (ингибиторов ангиогенеза, фолатных рецепторов, PARP, PI3K/Akt-сигнального пути, HER2/neu) в аспекте гистологической и молекулярно-биологической классификации рака яичников. Показано, что при любом гистотипе рака яичников могут использоваться только ингибиторы ангиогенеза, наиболее изученным из которых является бевацизумаб. Для индивидуализации лечебных подходов при разных формах рака яичников необходимы дальнейшие исследования.
- КЛЮЧЕВЫЕ СЛОВА: рак яичников, таргетная терапия, бевацизумаб
Рис. 1. Медиана времени до прогрессирования на фоне терапии бевацизумабом у пациенток с раком яичников (данные исследования GOG-0218)
Рис. 2. Медиана времени до прогрессирования на фоне терапии бевацизумабом у пациенток с раком яичников (данные исследования ICON7)
Рис. 3. Медиана времени до прогрессирования на фоне терапии бевацизумабом у пациенток с раком яичников (данные исследования OCEANS)
Рис. 4. Медиана времени до прогрессирования на фоне терапии бевацизумабом у пациенток с раком яичников (данные исследования AURELIA)
Рис. 5. Увеличение медианы времени до прогрессирования при добавлении винтафолида (EC 145) к пегилированному липосомальному доксорубицину у пациенток с платинорезистентным раком яичников (данные исследования PRECEDENT)
Рис. 6. Медиана времени до прогрессирования при поддерживающем лечении олапарибом больных с платиночувствительными рецидивами высокозлокачественного серозного рака яичников
Молекулярные основы патогенеза рака яичников
Рак яичников – чрезвычайно гетерогенное заболевание. Формы рака яичников различаются по клиническому течению, а также по молекулярным нарушениям, лежащим в основе опухолевой прогрессии. Именно этим еще недавно объяснялись неудачи исследований таргетной терапии при раке яичников. Однако в последние годы удалось создать молекулярно-биологическую классификацию рака яичников. На основании данных молекулярно-генетического и клинико-морфологического анализа пограничных и инвазивных опухолей яичников установлены два принципиально разных пути канцерогенеза наиболее часто встречающегося серозного рака яичников. На молекулярном уровне опухоли первого типа характеризуются наличием мутаций генов KRAS, BRAF, PTEN, присутствием дикого типа TP53, относительной генетической стабильностью, низкой степенью злокачественности и возникают на месте хорошо описанных предшественников, в частности из пограничных опухолей [1]. Второй путь (примерно 75% случаев) характерен для агрессивных, высокозлокачественных опухолей, возникающих без каких-либо предшественников. Такие опухоли отличаются наличием мутации TP53, выраженной генетической нестабильностью и отсутствием мутаций генов, характерных для опухолей первого типа (таблица). Эти и еще некоторые особенности канцерогенеза рака яичников дают основу для разработки таргетных препаратов, воздействующих на относительно часто встречающиеся молекулярные нарушения в опухолевых клетках.
Антиангиогенная терапия
По данным крупных исследований III фазы GOG-0218 и ICON7, хорошо известный препарат бевацизумаб, действие которого реализуется за счет связывания с VEGF (vascular endothelial growth factor – фактор роста эндотелия сосудов), статистически значимо увеличивает время до прогрессирования рака яичников в комбинации с паклитакселом и карбоплатином в первой линии химиотерапии по сравнению с терапией карбоплатином и паклитакселом без бевацизумаба [2, 3].
1. Cho K.R. Ovarian cancer update: lessons from morphology, molecules, and mice // Arch. Pathol. Lab. Med. 2009. Vol. 133. № 11. P. 1775–1781.
2. Burger R.A., Brady M.F., Bookman M.A. et al. Phase III trial of bevacizumab (BEV) in the primary treatment of advanced epithelial ovarian cancer (EOC), primary peritoneal cancer (PPC), or fallopian tube cancer (FTC): A Gynecologic Oncology Group study // J. Clin. Oncol. 2010. Vol. 28. № 18. Suppl. Abstr. LBA1.
3. Perren T., Swart A.M., Pfisterer J. et al. ICON7: A phase III randomized gynecologic cancer intergroup trial of concurrent bevacizumab by maintenance bevacizumab, versus chemotherapy alone in women with newly diagnosed epithelial ovarian cancer (EOC), primary peritoneal (PPC) or fallopian tube cancer (FTC) // Ann. Oncol. 2010. Vol. 21. Suppl. 8. P. viii2. Abstr. LBA4.
4. Aghajanian C., Finkler N.J., Rutherford T. et al. OCEANS: A randomized, double-blinded, placebo-controlled phase III trial of chemotherapy with or without bevacizumab (BEV) in patients with platinum-sensitive recurrent epithelial ovarian (EOC), primary peritoneal (PPC), or fallopian tube cancer (FTC) // J. Clin. Oncol. 2011. Vol. 29. Suppl. 18. Abstr. LBA5007.
5. Pujade-Lauraine E., Hilpert F., Weber B. et al. AURELIA: a randomized phase III trial evaluating bevacizumab plus chemotherapy for platinumresistant recurrent ovarian cancer // J. Clin. Oncol. 2012. Vol. 30. Suppl. Abstr. LBA5002.
6. Keith B., Simon M. Tumor angiogenesis // The Molecular Basis of Cancer / Ed. by J. Mendelsohn. 3rd ed. Elseiver, 2008. P. 241–251.
7. Matulonis U.A., Berlin S., Ivy P. et al. Cediranib, an oral inhibitor of vascular endothelial growth factor receptor kinases, is an active drug in recurrent epithelial ovarian, fallopian tube, and peritoneal cancer // J. Clin. Oncol. 2009. Vol. 27. № 33. P. 5601–5606.
8. Karlan B.Y., Oza A.M., Hansen V.L. et al. Randomized, double-blind, placebo-controlled phase II study of AMG 386 combined with weekly paclitaxel in patients (pts) with recurrent ovarian carcinoma // J. Clin. Oncol. 2010. Vol. 28. № 15. Suppl. Abstr. 5000.
9. Kalli K.R., Oberg A.L., Keeney G.L. et al. Folate receptor alpha as a tumor target in epithelial ovarian cancer // Gynecol. Oncol. 2008. Vol. 108. № 3. P. 619–626.
10. Naumann R.W., Coleman R.L., Burger R.A. et al. PRECEDENT: A randomized phase II trial comparing EC145 and pegylated liposomal doxorubicin (PLD) in combination, versus PLD alone, in subjects with platinum-resistant ovarian cancer // J. Clin. Oncol. 2011. Vol. 29. № 15. Suppl. Abstr. 5045.
11. Weil M.K., Chen A.P. PARP inhibitor treatment in ovarian and breast cancer // Curr. Probl. Cancer. 2011. Vol. 35. № 1. P. 7–50.
12. Audeh M.W., Carmichael J., Penson R.T. et al. Oral poly(ADP-ribose) polymerase inhibitor olaparib in patients with BRCA1 or BRCA2 mutations and recurrent ovarian cancer: a proof-of-concept trial // Lancet. 2010. Vol. 376. № 9737. P. 245–251.
13. Kaye S., Kaufman B., Lubinski J. et al. Phase II study of the oral PARP inhibitor olaparib (AZD2281) vs liposomal doxorubicin in ovarian cancer patients with BRCA1 and/or BRCA2 mutations // Ann. Oncol. 2010. Vol. 21. Suppl. 8. P. viii304–viii313. Abstr. 9710.
14. Gelmon K.A., Hirte H.W., Robidoux A. et al. Can we define tumors that will respond to PARP inhibitors? A phase II correlative study of olaparib in advanced serous ovarian cancer and triple negative breast cancer // J. Clin. Oncol. 2010. Vol. 28. № 15. Suppl. Abstr. 3002.
15. Cancer Genome Atlas Research Network. Integrated genomic analyses of ovarian carcinoma // Nature. 2011. Vol. 474. № 7353. P. 609–615.
16. Ledermann J., Harter P., Gourley C. et al. Olaparib maintenance therapy in platinum-sensitive relapsed ovarian cancer // N. Engl. J. Med. 2012. Vol. 366. № 15. P. 1382–1392.
17. Asadollahi R., Hyde C.A., Zhong X.Y. Epigenetics of ovarian cancer: from the lab to the clinic // Gynecol. Oncol. 2010. Vol. 118. № 1. P. 81–87.
18. Modesitt S.C., Sill M., Hoffman J.S. et al. A phase II study of vorinostat in the treatment of persistent or recurrent epithelial ovarian or primary peritoneal carcinoma: a Gynecologic Oncology Group study // Gynecol. Oncol. 2008. Vol. 109. № 2. P. 182–186.
19. Manetta A., Blessing J.A., Look K.Y. A phase II study of fazarabine in patients with advanced ovarian cancer. A Gynecologic Oncology Group study // Am. J. Clin. Oncol. 1995. Vol. 18. № 2. P. 156–157.
20. Matei D., Shen C., Fang F. at al. A phase II study of decitabine and carboplatin in recurrent platinum (Pt)-resistant ovarian cancer (OC) // J. Clin. Oncol. 2011. Vol. 29. Suppl. Abstr. 5011.
21. Bookman M.A., Darcy K.M., Clarke-Pearson D. et al. Evaluation of monoclonal humanized anti-HER2 antibody, trastuzumab, in patients with recurrent or refractory ovarian or primary peritoneal carcinoma with overexpression of HER2: a phase II trial of the Gynecologic Oncology Group // J. Clin. Oncol. 2003. Vol. 21. № 2. P. 283–290.
22. Han C.P., Hsu J.D., Yao C.C. et al. HER2 gene amplification in primary mucinous ovarian cancer: a potential therapeutic target // Histopathology. 2010. Vol. 57. № 5. P. 763–764.
23. McAlpine J.N., Wiegand K.C., Vang R. et al. HER2 overexpression and amplification is present in a subset of ovarian mucinous carcinomas and can be targeted with trastuzumab therapy // BMC Cancer. 2009. Vol. 9. P. 433.
24. Tan D.S., Iravani M., McCluggage W.G. et al. Genomic analysis reveals the molecular heterogeneity of ovarian clear cell carcinomas // Clin. Cancer. Res. 2011. Vol. 17. № 6. P. 1521–1534.
25. Wu R., Hendrix-Lucas N., Kuick R. et al. Mouse model of human ovarian endometrioid adenocarcinoma based on somatic defects in the Wnt/beta-catenin and PI3K/Pten signaling pathways // Cancer Cell. 2007. Vol. 11. № 4. P. 321–333.
26. Bast R.C. Jr., Hennessy B., Mills G.B. The biology of ovarian cancer: new opportunities for translation // Nat. Rev. Cancer. 2009. Vol. 9. № 6. P. 415–428.
27. Mazzoletti M., Broggini M. PI3K/AKT/mTOR inhibitors in ovarian cancer // Curr. Med. Chem. 2010. Vol. 17. № 36. P. 4433–4447.
Таргетная терапия опухолей
Таргетная терапия – направление в лечении онкологических заболеваний с использованием лекарственных препаратов, блокирующих определенные молекулы опухолевых клеток. За счет этого раковые клетки перестают размножаться, ухудшается их кровоснабжение или достигаются другие лечебные эффекты. По сравнению с классическими химиопрепаратами, таргетные препараты действуют более прицельно и почти не затрагивают здоровые клетки. Таргетную терапию можно применять отдельно или в сочетании с другими противоопухолевыми препаратами, лучевой терапией.
Таргетная терапия возникла почти полвека назад, когда ещё не было термина «таргетная», не было понимания противоопухолевого механизма действия и даже не совсем ясно представляли молекулярные характеристики рака, через которые реализуется лечебный эффект лекарств.
Первыми проводниками таргетной терапии в онкологии, буквально «удара по конкретной цели», стали гормональные препараты, успешно убивавшие клетки рака молочной железы. Четверть века назад стали понимать подоплёку механизмов противоопухолевого действия, но не сами механизмы, и полтора десятилетия назад появился термин «таргетная терапия». [1]
Сегодня поиск лекарственных средств идёт целенаправленно и в клинической практике уже используются три варианта таргетного воздействия:
- Действие на определённые клеточные мишени, в числе которых рецепторы половых гормонов, гены и внутриклеточные ферменты.
- Повреждение обеспечивающих нормальную жизнедеятельность раковой опухоли внеклеточных структур, например, питающих опухоль сосудов.
- Выключение передачи внутриклеточных биохимических сигналов, которые позволяют раку жить и размножаться, в цепочке биохимических реакций — сигнального пути.
Таргетная терапия входит в лекарственное противоопухолевое лечение, но постепенно отделяется от понятия химиотерапии, поскольку механизм действия иной, но результат общий — уничтожение рака. Лекарства эти применяются только вместе с цитостатиками и усиливают их эффективность.
Нельзя утверждать, что препараты таргетной терапии не дают осложнений, потому что не повреждают здоровые клетки. Действительно, в нормальных клетках нет генов, на которые они влияют, и концентрация «целевого продукта» выше, тем не менее клеточную биохимию они нарушают, отчего развиваются своеобразные побочные эффекты. [2,4]
Преимущества таргетной терапии
Можно выделить следующие преимущества таргетных препаратов: [5]
- Они могут быть эффективны против рака, который слабо отвечает на химиотерапию. Если химиопрепараты перестают помогать, и раковые клетки обладают определенными молекулярно-генетическими свойствами, таргетная терапия становится основным видом лечения.
- Таргетные препараты не атакуют, как химиопрепараты, все быстро делящиеся клетки без разбора. У них есть конкретная «мишень». Они действуют более прицельно, поэтому вызывают меньше побочных эффектов.
- Таргетные препараты, будучи добавлены к курсу химиотерапии, могут существенно повысить эффективность лечения.
- Зачастую таргетные препараты помогают лечить запущенный рак как временно хроническое заболевание, подарить пациенту недели, месяцы, а иногда и годы жизни.
Препараты для таргетной терапии
В настоящее время существует довольно много разных таргетных препаратов. Одни уже давно внедрены в клиническую практику, другие недавно закончили или все еще проходят испытания. В зависимости от эффектов, их можно разделить, на несколько групп: [4,5]
- В каждой клетке человека работают так называемые сигнальные пути — каскады химических реакций, итогом которых является то или иное событие. Таргетные препараты могут блокировать звенья в сигнальных путях, отвечающих за размножение клеток.
- Некоторые препараты изменяют важные белки таким образом, что клетка погибает.
- Злокачественная опухоль активно растет и распространяется по организму, поэтому ей нужно много кислорода и питательных веществ. Раковые клетки выделяют вещества, которые стимулируют ангиогенез — рост новых сосудов. Существуют антиангиогенные таргетные препараты, которые могут их заблокировать.
- Воздействуя на некоторые молекулы, можно активировать иммунитет, заставить его распознавать и убивать раковые клетки.
- Есть таргетные препараты, которые вводят в раковые клетки токсины (при этом не затрагивая здоровые клетки), уничтожающие их.
При каких онкозаболеваниях применяют таргетную терапию?
Чтобы разобраться, будет ли эффективна таргетная терапия у конкретного пациента, необходимо провести молекулярно-генетический анализ клеток опухоли. Это поможет понять, есть ли в раковых клетках «мишень», против которой направлен тот или иной таргетный препарат. Зачастую врач назначает таргетную терапию при метастазах, при раке IV стадии, если другие препараты оказались неэффективны, если, несмотря на лечение, опухоль продолжает расти и распространяться по организму. [2,6]

Таргетная терапия в лечении рака молочной железы
Рак молочной железы первым подвергся таргетной терапии в виде антигормонального препарата тамоксифена из группы антиэстрогенов. Внутри ядра клетки молочной железы находится гормональный рецептор, который соединяется с циркулирующими в крови половыми гормонами. Образовавшийся в результате слияния комплекс «рецептор+гормон» даёт импульс для дальнейшей клеточной жизнедеятельности: росту, размножению, изменению функций, то есть несёт в себе программу дальнейшей жизни (см. клинические исследования).
Гормональные препараты, созданные для лечения рака молочной железы, весьма похожи на настоящие гормоны, но несут в себе не программу жизни рака, а программу его смерти, и гормональный рецептор активно выбирает не родной гормон, а лекарство. Сегодня наряду с тамоксифеном используются антиэстрогены торемифен (фарестон) и фульвестрант (фазлодекс).
Вторую группу таргетных гормональных средств составляют ингибиторы фермента ароматазы, превращающего один вид полового гормона в другой. Ароматаза находится в жировой клетчатке и синтезируется яичниками, выключение её с помощью лекарственного препарата нарушает синтез гормона, в котором нуждаются раковые клетки. [1]
Лечение герцептином
Чувствительность к химиотерапии можно предсказать по наличию специфического гена HER2-neu — гена множественной лекарственной резистентности. Обнаружение этого гена говорит о том, что опухоль может не реагировать на присутствие лекарства-убийцы.
Раковая клетка пытается избежать гибели несколькими способами, одновременно включая механизмы:
- быстрого выведения химиопрепаратов в межклеточное пространство;
- обезвреживая цитостатик специальными белками;
- быстро восстанавливая повреждения;
- изменяя мишень для препарата, предлагая ему похожий белок, не имеющий принципиального значения для дальнейшей жизнедеятельности;
- изменяя роль ключевых генов, контролирующих клеточный апоптоз (гибель), которые больше не могут запустить фатальные изменения.
Найден ключевой ген рака молочной железы, получивший название HER 2, и заставляющий рецепторы на клеточной поверхности избыточно активно захватывать факторы клеточного роста, что приводит к неуправляемому делению. В некоторых случаях ген амплифицируется, то есть образует в ДНК не одну, а целый пучок генетических копий.
Блокирует ген HER 2 препарат герцептин (трастузумаб). Сам по себе герцептин не убивает рак, а «снимает» с него устойчивость к лекарствам, поэтому применяется вместе с химиопрепаратами. Замечена связь герцептина с иммунными защитниками, при большой концентрации в раке Т-лимфоцитов активность герцептина снижается.
Помогает работе герцептина ещё один таргетный препарат перьета (пертузумаб) — белок, синтезируемый иммунными клетками, или моноклональное антитело. Перьета на поверхности раковой клетки соединяется с определённым рецептором, не позволяя фактору роста проникнуть внутрь и активировать ген HER2. Перьета вводится вместе с герцептином и химиопрепаратом доцетакселом.
Аналогично герцептину работает лапатиниб (тайверб), применяемый во второй очереди после герцептина с перьетой. [2,7]

Таргетная терапия при метастатическом раке легкого
Таргетные препараты при немелкоклеточном раке легкого могут применяться в сочетании с химиопрепаратами или самостоятельно. Применяются препараты, которые блокируют ангиогенез (рамицирумаб, бевацизумаб), мутантные белки, заставляющие раковые клетки размножаться: EGFR (афатиниб, эрлотиниб, гефитиниб), ALK (бригатиниб, алектиниб, церитиниб, кризотиниб), BRAF (траметиниб, дабрафениб). [7]
Таргетная терапия при меланоме
Исследования показывают, что примерно в половине всех меланом клетки имеют мутацию в гене BRAF. Из-за этого в них образуется одноименный мутантный белок, и они быстро размножаются. В таких случаях эффективны таргетные препараты из группы ингибиторов BRAF: дабрафениб, вемурафениб.
В тандеме с геном BRAF работает ген MEK. Если в нем обнаружена мутация, врач может назначить ингибиторы MEK: кобиметиниб и траметиниб.
Некоторые меланомы (на участках кожи, на которые постоянно воздействуют солнечные лучи, на ладонях и подошвах, слизистых оболочках, под ногтями) имеют мутацию в гене C-KIT. При этом могут помочь препараты иматиниб и нилотиниб. [2,7]
Таргетная терапия при раке поджелудочной железы
На поздних стадиях рака поджелудочной железы некоторым пациентам назначают химиотерапию в сочетании с эрлотинибом, таргетным препаратом, который блокирует рецептор эпидермального фактора роста (EGFR). [7]
Таргетная терапия при колоректальном раке
При раке толстой и прямой кишки применяются три группы таргетных препаратов: [5,7]
- Ингибиторы фактор роста эндотелия сосудов (VEGF), белка, который вырабатывается раковыми клетками и стимулирует ангиогенез: рамуцирумаб, бевацизумаб.
- Ингибиторы рецепторов эпидермального фактора роста, которые находятся на поверхности раковых клеток и, находясь в активном состоянии, заставляют их размножаться: панитумумаб, цетуксимаб.
- Ингибиторы киназы — белка-фермента, который выполняет разные функции, в том числе стимулирует клеточный рост: регорафениб.
Таргетная терапия при раке желудка
Примерно в 1 из 5 случаев в клетках злокачественных опухолей желудка содержится повышенное количество белка HER2-neu (или только HER2), который стимулирует их размножение. В таких случаях применяют таргетный препарат трастузумаб (Герцептин). Также при раке желудка применяют ингибитор ангиогенеза рамуцирумаб (Цирамза). [7]
Таргетная терапия при раке почки
При раке почек применяют: [2,7]
- Таргетные препараты, которые блокируют ангиогенез: бевацизумаб.
- Таргетные препараты, которые блокируют белки-тирозинкиназы: сорафениб, сунитиниб, пазопаниб, акситиниб, кабозантиниб, ленватиниб.
- Таргетные препараты, которые блокируют белок mTOR: темсиролимус, эверолимус.
Отзыв пациента о таргетной терапии
Я нашла клинику по принципу применения таргетной терапии. Искала тщательно и выяснила, что у «Евроонко» самый большой опыт её применения для лечения меланомы. Меня приняли очень быстро, подтвердили диагноз и по гистологическому исследованию назначили дабрафениб, так как есть браф-мутация. Сейчас прохожу второй курс. Побочные эффекты есть, но не такие, как при обычной химии. Судя по динамике, всё хорошо, и вполне можно ожидать хорошего исхода. Доктору Пылёву доверяю полностью. Считаю, что с клиникой и врачами мне очень повезло.
- — 6 900 руб.
- Проведение внутрипузырной химиотерапии (без стоимости лекарственных препаратов) — 34 400 руб.
- Проведение внутрибрюшинной химиотерапии (без стоимости лекарственных препаратов) — 31 400 руб.
- Проведение иммунотерапии (без стоимости лекарственных препаратов) — 24 700 руб.
- Проведение интратекальной химиотерапии — 34 600 руб.
- Проведение гипертермической интраперитонеальной химиотерапии — 457 600 руб.
- Проведение химиотерапии с использованием инфузионной помпы 1 сутки (без стоимости лекарственных препаратов) — 29 400 руб.
- Проведение анти PD-1 терапии — 550 600 руб.
В «Евроонко» не ограничиваются химиотерапией, а при всех известных злокачественных заболеваниях используют весь спектр противоопухолевых средств, в том числе и инновационную таргетную терапию. Специальные программы помогают лучшей переносимости лечения и улучшению результатов противоопухолевой терапии.
Лечение рака яичников. Таргетная терапия
Являясь не самым распространённым заболеванием в онкологии (9 место в структуре всех онкологических заболеваний с риском возникновения около 1,5 % в женской популяции), рак яичников по-прежнему занимает лидирующие позиции в показателях смертности

Оставайся здоровым!

Наши стоматологи владеют специальными навыками психологической адаптации детей с негативным опытом лечения зубов.
Главное о нас
ЭКСТРЕННАЯ ПОМОЩЬ любой сложности взрослым и детям. Мы работаем круглосуточно и без выходных
Отзывы о врачах Ильинской Больницы
СЕМЕЙНАЯ МЕДИЦИНА. Мы обеспечиваем постоянную и всестороннюю заботу о здоровье детей, взрослых и людей в почтенном возрасте
ПЕДИАТРИЯ. Вашему ребенку нужен только один врач - педиатр. Он "единая точка входа" для решения любых медицинских проблем
НАШИ ПРИНЦИПЫ. Ключевым аспектом отношений врача и пациента мы считаем способность врача к эмпатии, т.е. осознанному сопереживанию эмоциональному состоянию пациента
СТАЦИОНАР. Мы относимся к нашим пациентам как к близким людям, каждому обеспечивается персональный уход и комфорт
РЕАБИЛИТАЦИЯ. Индивидуальные программы реабилитации после инсульта и травм.
Являясь не самым распространённым заболеванием в онкологии (9 место в структуре всех онкологических заболеваний с риском возникновения около 1,5 % в женской популяции), рак яичников по-прежнему занимает лидирующие позиции в показателях смертности, занимая первое место в онкогинекологии. Одной из основных причин этому является тот факт, что 80% всех случаев мы диагностируем на III или IV стадии. Попытки разработать программы скрининга для рака яичника пока успехом не увенчались, и тогда упор был сделан на поиск новых методов диагностики и лечения. И в этой области сделан настоящий прорыв!
Появление молекулярно-генетического тестирования дало нам понимание, что существуют два совершенно разных типа рака, которые по разному протекают, по- разному рецидивируют, и что самое главное, по- разному лечатся. И кроме классического подхода в лечении: операция и химиотерапия, появились таргетные препараты, или «целенаправленное» лечение.
Теперь во всем мире каждая пациентка с диагностированным раком яичников проходит генетическое тестирование, как для определения дальнейшего лечения, так и для проведения онкопрофилактики у ближайших родственников с наследственными формами рака яичников, коих приблизительно 15%.
Введение в широкую практику целенаправленной терапии позволило значительно улучшить несколько важных показателей в онкологии: platina-free, progression-free, и как результат, главного показателя - общей выживаемости пациентов.
Речь идет об иммунотерапии моноклональными антителами, которые подавляют фактор роста эндотелия сосудов опухоли и приводят к усилению противоопухолевого иммунного ответа (препараты- иммуномодуляторы). А также, об ингибиторах PARP-ферментов поли (АДФ-рибоза) полимераз, которые действуют на уровне ДНК опухолевых клеток, повреждая его при делении и вызывая их гибель. Препараты из этой группы подходят, в первую очередь, пациенткам с подтвежденной мутацией BRCA, как соматической (возникшей в клетках самой опухоли), так и герминальной (унаследованной и имеющейся во всех клетках организма) - около 30% всех случаев рака яичников.
На сегодня не существует стандартной схемы таргетной терапии при раке яичников.
И если коротко, то иммунопрепараты показали наилучшую эффективность при лечении пациенток с рецидивом или с платина- резистентными видами рака яичников в комбинации с химиотерапией и в монотерапии после её завершения.
У PARP-ингибиторов же впервые была доказана эффективность у пациенток с BRCA мутацией и платиночувствительными опухолями и ремиссией минимум 6 месяцев. В поддерживающем режиме после окончания химиотерапии препарат продлевал общую выживаемость на 13 месяцев, а интервал между первой и второй линией химиотерапии на 20 месяцев.
На сегодняшний день эти препараты имеют место как в лечении впервые выявленной опухоли, так и рецидивов, что послужило поводом для дальнейших исследований по комбинированию таргетных препаратов с химиотерапией и друг с другом.
В данный момент проходит 3 фаза исследований по сочетанию Рукапариба с Новолумабом (ATHENA trial) у пациенток с распространенным раком яичников, чувствительным к первой линии химиотерапии. Исследования, проводимые в 24 центрах по всему миру, включающие около 1000 исследуемых, должны показать эффективность сочетания этих препаратов в сравнении с монотерапией Рукапарибом.
Сочетание Авастина (ингибитора VEGF) с Мирветуксимабом (ингибитор альфа- фолатных рецепторов) (FORWARD II study) показало свою эффективность у 50% пациенток, в том числе, с платино-резистентными опухолями, что особенно важно, поскольку других опций лечения у данных пациентов по сути нет.
Исследования комбинации Олапариба с Дурвалумабом и Бевацизумабом (MEDIOLA trial) показывают увеличение безрецидивной выживаемости при назначении данной комбинации препаратов в поддерживающем режиме после окончания химиотерапии. Исследования доказывают эффективность при лечении данной комбинацией препаратов по сравнению с монотерапией PARP-ингибиторами у пациенток, не имеющих герминальную мутацию BRCA с планина-чувствительным рецидивом опухоли.
Конечно, использование данных препаратов и различных их комбинаций также имеет ряд побочных эффектов, самым частым из которых была анемия, иногда требующая переливания крови.
Можно уверенно говорить о том, что комбинирование таргетных препаратов открывает новые возможности в лечении пациенток с раком яичников.
Читайте также:
- Поражение сосудов при сахарном диабете. Атеросклероз сосудов при диабете
- Поражение глаз гидрохиноном. Гидрохиноновые поражения конъюнктивы и роговицы
- Диссоциативное расстройство личности: что такое раздвоение личности, симптомы и лечение
- Влияние простагландина на плод и беременность
- Контрактуры нижней челюсти. Профилактика контрактуры нижней челюсти.
