Влияние простагландина на плод и беременность
Добавил пользователь Владимир З. Обновлено: 24.01.2026
Кафедра акушерства и гинекологии №2 Казанского государственного медицинского университета;
акушерское отделение патологии беременности ГКБ №7, Казань
К вопросу о применении простагландина Е2 у беременных с рубцом на матке после кесарева сечения
Журнал: Российский вестник акушера-гинеколога. 2013;13(2): 48‑52
Габидуллина Р.И., Шамсутдинова Л.Г. К вопросу о применении простагландина Е2 у беременных с рубцом на матке после кесарева сечения. Российский вестник акушера-гинеколога. 2013;13(2):48‑52.
Gabidullina RI, Shamsutdinova LG. The use of prostaglandin E2 in pregnant women with a uterine scar after cesarean section. Russian Bulletin of Obstetrician-Gynecologist. 2013;13(2):48‑52. (In Russ.).
Цель настоящего исследования - изучение эффективности и безопасности применения простагландина Е2 (ПГ Е2) интрацервикально в подготовке шейки матки к родам у беременных с рубцом на матке после кесарева сечения. В исследование были включены 98 беременных с рубцом на матке и 61 без рубца в сроки гестации 40-41 нед с "незрелой" и "недостаточно зрелой" шейкой матки. В зависимости от наличия рубца на матке и индукции родов ПГ Е2 беременные были распределены на три группы. Проводился статистический анализ исходов родов для матери и плода. Сравнительный анализ исходов родов у женщин с рубцом на матке после кесарева сечения позволил выявить снижение процента кесарева сечения при индукции родов динопростоном при "недостаточно зрелой" шейке матки. Проведенные исследования показали эффективность применения интрацервикального геля простагландина Е2 в подготовке родовых путей и успешном проведении вагинальных родов у 2/3 пациенток с рубцом на матке после кесарева сечения.
Частота кесарева сечения (КС) имеет тенденцию к росту во всем мире, что создает проблему ведения беременности и родов у женщин с рубцом на матке [1, 15]. Реальной альтернативой снижения числа повторных операций, которые составляют почти 30% всех абдоминальных родоразрешений, являются вагинальные роды [4, 19]. В настоящее время множество исследований подтвердили высокую частоту успешных родов через естественные родовые пути после КС [5, 7, 18]. Нерешенным остается вопрос применения простагландинов у женщин с рубцом на матке. Введение простагландина Е 2 (ПГ Е 2 ) вызывает как «созревание» шейки матки, так и сокращения миометрия, являясь пусковым моментом для начала родов. Несмотря на то что производителями ПГ Е 2 (в связи с боязнью разрыва матки) наличие рубца на ней отнесено к противопоказаниям, простагландины нашли широкое применение в акушерской практике. При этом сведения о разрыве матки весьма противоречивы [12, 14, 15, 17].
Цель настоящего исследования - изучение эффективности и безопасности применения ПГ Е 2 интрацервикально при подготовке шейки матки к родам у беременных с рубцом на матке после КС.
Материал и методы
В исследование были включены 98 беременных с рубцом на матке после КС и 61 без рубца в сроки гестации 40-41 нед в отсутствие готовности организма беременных к родам. Пациентки были распределены на три группы: 1-я группа - у 61 беременной с рубцом на матке для подготовки шейки матки применялся ПГ Е 2 ; 2-я группа - у 61 беременной без рубца на матке также применялся ПГ Е 2 ; 3-я группа - у 37 беременных с рубцом на матке родовая деятельность развилась самостоятельно. Состояние шейки матки оценивали по шкале Bishop. По результатам оценки каждая группа была разделена на 2 подгруппы: а) беременные с «незрелой» (0-5 баллов) и б) «недостаточно зрелой» (6-8 баллов) шейкой матки. Число больных в подгруппах 1а и 1б составило 32 (52,5%) и 29 (47,5%), в подгруппах 2а и 2б - 30 (49,2%) и 31 (50,8%), в подгруппах 3а и 3б - 20 (54,1%) и 17 (45,9%) соответственно.
Средний возраст женщин был равен 28,35±3,55 года. Интервал между КС и повторными родами колебался от 2 до 8 лет. Беременные в группах не имели достоверных различий по возрасту, интервалу между родами, социальному статусу. Группы были достаточно однородны по экстрагенитальным заболеваниям, акушерско-гинекологическому анамнезу. Самопроизвольные срочные роды в анамнезе были в среднем у 24,7% женщин.
Наиболее частыми показаниями к предыдущему КС в 1-й и 3-й группах соответственно явились слабость родовой деятельности, не поддающаяся медикаментозной терапии - у 24 (39,3%) и 14 (37,8%); отслойка нормально расположенной плаценты - у 11 (18%) и 4 (10,8%) пациенток; тазовое предлежание плода при массе более 3600 г - у 7 (11,5%) и 4 (10,8%); дистресс плода - у 5 (8,2%) и 2 (5,4%); крупный плод - у 2 (3,3%) и 2 (5,4%) пациенток (p>0,05).
Настоящая беременность осложнилась угрозой прерывания в разные сроки у 23,9% женщин, ранним токсикозом - у 27,9%, анемией - у 66,7% в отсутствие достоверных различий между группами.
Критериями отбора беременных с рубцом на матке для родоразрешения через естественные родовые пути явились КС в нижнем сегменте матки поперечным разрезом, благоприятное течение послеоперационного периода, клиническая и эхографическая состоятельность рубца на матке, добровольное информированное согласие пациентки. Большое значение имели психологический настрой и желание беременной быть родоразрешенной через естественные родовые пути. Условиями для подготовки шейки матки простагландином Е 2 явились срок беременности 40-41 нед, удовлетворительное состояние плода, одноплодная беременность, головное предлежание, целый плодный пузырь, нормальные результаты влагалищного мазка и добровольное информированное согласие беременных на введение препарата.
На проведение исследований было получено одобрение Республиканского комитета по этическим вопросам при проведении клинических испытаний-исследований лекарственных средств при Министерстве здравоохранения Республики Татарстан (протокол №4 от 25.05.07).
Простагландин Е 2 (динопростон 0,5 мг) в виде геля в одноразовом шприце в объеме 2,5 мл вводили интрацервикально. Клинический эффект оценивали через 3, 6, 12 и 24 ч.
Ультразвуковое исследование (УЗИ) проводилось эндовагинальным датчиком при наполненном мочевом пузыре на сканере HDI 1000. В задачи УЗИ входило определение состояния рубца (равномерность, однородность, наличие дефектов в виде «ниш»), толщины нижнего сегмента матки.
Оценка внутриутробного состояния плода проводилась с помощью допплерометрического исследования кровотока в системе мать-плацента-плод аппаратом HDI 1000 и кардиотокографии.
Роды у женщин с рубцом на матке проводили при постоянном присутствии опытного акушера-гинеколога и готовности к развертыванию операционной.
Результаты
Результаты исследований показали, что применение ПГ Е 2 с целью подготовки шейки матки к родам у беременных с рубцом на матке после КС в случаях с «недостаточной зрелостью» шейки матки оказалось эффективным в 100% случаев. При «незрелой» шейке матки эффективность индукции родов при однократном введении геля составила 93,8%. Через 12 ч наблюдения у 8 (25%) из 32 беременных с рубцом на матке и «незрелой» шейкой матки не удалось достигнуть эффекта «созревания» шейки, хотя определялась положительная динамика в оценке шейки матки по шкале Bishop в среднем на 3 балла. Из них у 4 пациенток родовая деятельность началась спонтанно в течение суток и успешно завершилась родами через естественные родовые пути - у 3. У 1 роженицы при неправильном вставлении головки было проведено оперативное родоразрешение. Трем пациенткам через сутки произвели повторное введение геля при «недостаточно зрелой» шейке матки, что привело к развитию регулярной родовой деятельности, однако в одном случае роды были завершены оперативным путем в связи с начавшейся внутриутробной гипоксией плода. Индукция родов путем амниотомии у 1 пациентки с «созревшей» шейкой матки привела к развитию слабости родовой деятельности, не поддающейся медикаментозной терапии, и КС. В группе беременных без рубца на матке гель был введен повторно 1 пациентке через 6 ч, роды завершились оперативным путем при развитии дисстресс-синдрома у плода. Учитывая риск разрыва матки по рубцу, мы считаем оправданной подобную выжидательную тактику при использовании ПГ Е 2 у данного контингента беременных.

Спонтанная родовая деятельность развилась у 60 (98,4%) беременных с рубцом на матке и в 100% случаев без рубца. После введения препарата у беременных с рубцом на матке при «незрелой» шейке родовая деятельность началась в среднем через 5 ч 27 мин (табл. 1). У беременных с «недостаточно зрелой» шейкой матки подготовка к родам заняла достоверно меньше времени и родовая деятельность развилась в среднем через 1 ч 22 мин (р<0,05). При использовании динопростона у беременных без рубца при «незрелой» шейке матки родовая деятельность началась в среднем через 4 ч 43 мин, у беременных с «недостаточно зрелой» - через 2 ч 06 мин. Достоверных различий между указанными значениями у беременных 1-й и 2-й групп не выявлено.
Длительность родов определялась биологической готовностью организма беременных к родам. При «недостаточно зрелой» шейке матки роды проходили быстрее, чем при «незрелой» шейке во всех группах с достоверными различиями в 1-й группе (p<0,01) (см. табл. 1).
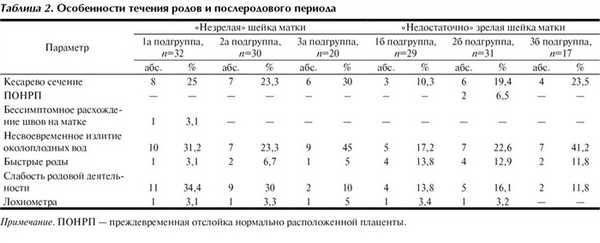
Особенности течения родов представлены в табл. 2. Первичная слабость родовой деятельности развилась практически у каждой третьей роженицы подгруппы 1а с «незрелой» шейкой матки при использовании динопростона, что в 3 раза превысило частоту этого осложнения родов в подгруппе женщин 3а (самопроизвольное начало родов у женщин с рубцом на матке. В подгруппах 1б, 2б, 3б показатели достоверно не различались.
Обращает на себя внимание высокая частота КС у рожениц с «незрелой» шейкой матки (подгруппы 1а, 2а, 3а). Подготовка «недостаточно зрелой» шейки матки динопростоном позволила снизить процент КС в 2,2 раза в подгруппе 1б по сравнению с таковым в подгруппе 3б (см. табл. 2). При «незрелой» шейке матки имела место тенденция к снижению процента КС в подгруппе 1а по сравнению с этим показателем в подгруппе 3а. На операции признаков несостоятельности рубца не было обнаружено.
По числу случаев быстрых родов достоверных различий между подгруппами не было выявлено, хотя следует отметить, что в подгруппах с «недостаточно зрелой» шейкой матки их число было выше, чем в подгруппах с «незрелой» шейкой.
В подгруппе 1а у 1 женщины при пальцевом исследовании рубца после успешных вагинальных родов было обнаружено расхождение рубца на матке длиной 1 см без признаков внутрибрюшного кровотечения. Учитывая желание женщины повторно забеременеть, произвели лапаротомию с иссечением старого рубца на матке.
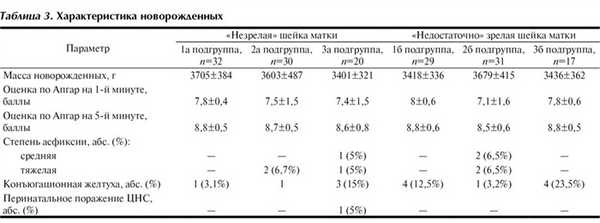
В состоянии новорожденных статистически значимых различий между показателями в подгруппах не было выявлено (табл. 3).
Во всем мире частота КС растет. В США число случаев КС увеличилось более чем на 50% с 1996 г., достигнув в 2007 г. 31,8% от всех родов [19]. В частных клиниках Аргентины, Бразилии и Чили число оперативных родоразрешений достигло 50% [8]. На этом фоне достаточно благополучной выглядит Великобритания, в которой абдоминальным путем родоразрешаются 21,3% женщин [10].
Повторное КС составляет в настоящее время порядка 30% оперативных родов. Доказано, что повторная операция связана с увеличением риска развития таких осложнений, как кровотечения и потребность в переливании крови, послеродовые воспалительные заболевания, ранения мочевого пузыря и кишечника, тромбозы глубоких вен. Для младенцев основные проблемы связаны с дыхательными расстройствами [11]. Кроме того, на основе метаанализа 48 исследований (553 306 женщин после родов в 31 стране мира) было установлено негативное влияние КС в отсутствие родовой деятельности на раннее грудное вскармливание, что неблагоприятно отразилось на состоянии младенцев [16].
Реальной альтернативой снижения частоты повторного КС являются вагинальные роды [2, 3, 5]. Увеличение числа родов через естественные родовые пути с 5 до 20% в период с 1985 по 1996 г. в США привело к уменьшению числа случаев КС в целом по стране до 20% [15].
Рекомендованные в 1999 г. Американским колледжем акушеров-гинекологов вагинальные роды после КС успешно завершаются, по данным разных авторов, в 56-80% случаев [7, 18]. В России первыми разработали и научно обосновали и в дальнейшем усовершенствовали методы диагностики состояния рубца на матке и тактику родоразрешения, а затем внедрили в клиническую практику технологию ведения родов через естественные родовые пути в Московском областном НИИ акушерства и гинекологии профессора В.И. Краснопольский и Л.С. Логутова [4, 5]. Впоследствии эта инициатива была подхвачена в других регионах страны [2, 3, 6].
На современном этапе нерешенным остается вопрос индукции вагинальных родов у беременных с рубцом на матке. Одни исследователи [14, 17] с индукцией родов, особенно при использовании простагландинов, связывают увеличение частоты разрывов матки. Другие авторы [12, 15] такой связи не находят. Отсутствие достаточной доказательной базы в настоящее время не позволило в последнем Кохрейновском обзоре определить тактику родоразрешения женщин с рубцом на матке при неподготовленных родовых путях: предпочесть плановое КС или индукцию родов [10]. Остается неясным механизм разрыва матки при использовании простагландинов: воздействие на соединительную ткань рубца или просто результат неподготовленности шейки матки [9, 13].
В своем исследовании мы сравнили исходы родов для матери и плода при подготовке родовых путей ПГ Е 2 , вводимым интрацервикально, у беременных с рубцом на матке после КС и в отсутствие рубца. Отсутствие статистически значимых различий между группами позволило сделать вывод, что состоятельный рубец после КС не оказывает влияния на родовую деятельность.
Сравнительный анализ исходов родов у женщин с рубцом на матке позволил выявить снижение частоты КС при индукции динопростоном «недостаточно зрелой» шейки матки. При «незрелой» шейке матки отмечена тенденция уменьшения процента оперативных родов при использовании ПГ Е 2 . Однако необходимо учесть, что ежегодно до 15% показаний к повторному КС при доношенной беременности связаны с неподготовленностью родовых путей. Поэтому реальное число КС при неподготовленных родовых путях у беременных с рубцом на матке значительно выше, чем представлено в нашей работе.
Все младенцы от матерей с рубцом на матке, у которых была проведена медикаментозная подготовка шейки матки, родились в удовлетворительном состоянии, что связано с повышенным вниманием к состоянию этих женщин в ожидании возможных тяжелых осложнений.
Бессимптомное расхождение рубца на матке в родах, наблюдавшееся у одной пациентки с «незрелой» шейкой матки при индукции динопростоном, возможно, связано с применением простагландина. Вместе с тем бессимптомное расхождение рубца не приравнивается к разрыву матки [12].
Выводы
1. Проведенные исследования показали эффективность и безопасность применения интрацервикального геля простагландина Е 2 в подготовке родовых путей при «недостаточно зрелой» шейке матки у беременных с рубцом после кесарева сечения.
2. Медикаментозная подготовка родовых путей простагландином Е 2 у беременных с рубцом на матке после кесарева сечения позволяет у 2 / 3 пациенток избежать повторного кесарева сечения.
Влияние простагландина на плод и беременность
Простагландины — это природные продукты, индуцирующие и регулирующие родовую деятельность. При введении женщине на любой стадии беременности они вызывают сокращения матки и изгнание эмбриона. С точки зрения акушерства интерес представляют 3 простагландина: F2а (динопрост), Е2 (динопростон) и натриевая соль простациклина (эпопростенол-натрий, простациклин, PGI2).
Простагландин F2а и его 15-метильный аналог эффективно индуцируют аборт и роды. Инъекцию этих соединений в миометрий делали для купирования послеродового кровотечения, вызванного приросшей плацентой и маточной гипотонией. Простагландин Е2 применяют по таким же показаниям.
Одна беременная в возрасте 42 лет случайно получила ударную внутривенную дозу простациклина (250 мкг в 50 мл стерильного растворителя со скоростью 25 мл/ч), что обусловило эритему и тяжелую гипотензию. Она выжила после внутривенного введения гидроксиацетилкрахмала глюконата кальция и эфедрина. Беременной в возрасте 31 года было введено 40 мг (нормальная доза составляет 1—5 мг) простагландина F2a в нижний сегмент матки.
У нее развились сердечно-сосудистый коллапс, острый отек легких и ранняя экстрасистолия желудочков. Она выжила после лечения сосудосуживающими аминами, кортикостероидами, внутривенным вливанием жидкостей и вспомогательной вентиляцией.
Клиническая картина отравления простагландинами. Простагландины могут вызвать опасную для жизни тяжелую гипотензию, инфаркт миокарда, бронхоспазм, припадки у эпилептичек, разрыв матки при абортировании в середине триместра, амниотическую эмболию, внутриматочную смерть плода в третьем триместре, желудочковую тахикардию, закупорку пилорического отверстия желудка у новорожденных, респираторный дистресс-синдром новорожденных, гиперстимуляцию матки (обратимую b2-адренергическими средствами) и гипокалиемию. После инъекции простагландина Е2 в миометрий наблюдалась остановка сердца.
Механизм действия простагландинов. Простагландины действуют на гладкую мускулатуру кровеносных сосудов, бронхов и матки. Они могут вызвать расширение сосудов, ведущее к падению кровяного давления, увеличению частоты сердечных сокращений и сердечного выброса.
На миокард они оказывают как инотропное, так и хронотропное действие. Они способны вызывать бронхостеноз (F2a) и расслабление гладкой мускулатуры бронхиол (Е2). У небеременных они обусловливают расслабление маточной мускулатуры, а у беременных — ее сокращение.
Лабораторные данные при отравлении простагландинами. Для определения простагландинов проводят иммуноферментный твердофазный тест (ELISA). С его помощью можно обнаружить даже 2 пг 19-гидроксипростагландина в 100 мл раствора.
Лечение отравления простагландинами. Лечение при передозировке простагландинов симптоматическое и поддерживающее. Полезно временное прекращение внутривенных вливаний. При болях применяют анальгетики.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Современные методы подготовки организма к родам, родовозбуждение и родостимуляция

Революционные изменения в экспертной диагностике. Безупречное качество изображения, молниеносная скорость работы, новое поколение технологий визуализации и количественного анализа данных УЗ-сканирования.
Современные принципы подготовки к родам и их ведения должны обеспечивать рождение не только живого, но и здорового ребенка. Соответственно, от успешности подготовки к родам и качества их проведения во многом зависит дальнейшее физическое развитие и здоровье ребенка. Для эффективного начала и дальнейшего прогрессирования нормальной родовой деятельности одним из важных условий является наличие "зрелой" шейки матки, что отражает готовность организма матери и плода к родам. При "незрелой" шейке матки нельзя проводить родовозбуждение и усиливать родовую деятельность из-за опасности нарушения сократительной деятельности матки, возникновения гипоксии и травмы плода.
Простагландины
Согласно современным представлениям подготовка шейки матки к родам происходит не только под влиянием гормонов, а в первую очередь под действием веществ, которые получили название простагландины. В данном случае речь идет о двух видах: простагландин Е2 и F2α. Так, в частности, простагландин Е2 вырабатывается плодовой частью плаценты, в организме плода, а также в тканях шейки матки. Он способствует изменению структуры тканей шейки матки, обеспечивая ее созревание, а также оказывает определенное расслабляющее действие на перешеек, шейку и нижний сегмент матки. При достижении должной степени созревания шейки матки, под действием простагландина Е2 постепенно начинается развитие родовой деятельности. Следовательно, именно простагландин Е2 принадлежит пусковая роль начала родов. Простагландин F2α вырабатывается в материнской части плаценты и в стенках матки. Он поддерживает уже начавшуюся родовую деятельность, оказывая наиболее сильное и эффективное сокращающее воздействие, способствует ограничению кровопотери в родах.
Для подготовки шейки матки к родам наиболее физиологически обоснованным и рациональным является использование естественных стимуляторов развития родовой деятельности, т.е. препаратов, содержащих простагландин Е2. Введение простагландина Е2 должно приводить как к созреванию шейки матки, так и вызывать сокращения миометрия, являясь пусковым моментом для начала родов. Для предотвращения чрезмерно сильной сократительной деятельности матки, при использовании простагландина Е2 необходимо добиться равновесия между созреванием шейки матки и степенью ее зрелости с одной стороны, и стимуляцией сократительной активности матки, с другой. В связи с этим местное применение простагландина Е2 путем введения препарата в канал шейки матки или в задний свод влагалища является наиболее предпочтительным.
Широкое распространение способ местного применения простагландинов получил после того, как были разработаны специальные гели, содержащие необходимую дозу препарата. Обычно для достижения достаточной зрелости шейки матки и подготовки ее к родам простагландиновый гель вводят в канал шейки матки. Для успешного использования препарата и предотвращения возможных осложнений при его использовании следует соблюдать ряд условий, а также придерживаться соответствующих показаний и противопоказаний. Так, необходимость в применении простагландинового геля для подготовки шейки матки возникает при отсутствии биологической готовности организма к родам (незрелая шейка матки) и наличии показаний для срочного родоразрешения при различных акушерских или других осложнениях (например, при перенашивании беременности, гестозе, фетоплацентарной недостаточности и др.).
Противопоказаниями для применения препарата являются: наличие рубца на матке после кесарева сечения или после других операций на матке; предлежание плаценты; многоплодная беременность; выраженные признаки нарушения состояния плода; узкий таз; подтекание околоплодных вод; аллергия на простагландины; астма; повышенное внутриглазное давление. Простагландиновый гель применяют только в стационаре в следующих случаях: наличие незрелой или недостаточно зрелой шейки матки; целый плодный пузырь; отсутствие противопоказаний для проведения родов через естественные родовые пути.
Родовозбуждение, подготовка шейки матки
Перед использованием препарата необходимо определить состояние шейки матки, частоту пульса и дыхания, величину артериального давления, а также оценить состояние плода и сократительную активность матки. Гель вводят в канал шейки матки в положении беременной на спине, под контролем зеркал. Для предотвращения вытекания геля беременную оставляют в положении лежа в течение 30 мин.
При последующем наблюдении за пациенткой осуществляют мониторный контроль за сократительной активностью матки и состоянием плода. Оценивают состояние шейки матки (каждые 2-3 час), пульс, артериальное давление и частоту дыхания. Под действием препарата происходит не только созревание шейки матки, может начаться родовая деятельность. В этом случае, после достижения достаточной степени зрелости и открытия шейки матки не менее чем на 4 см вскрывают плодный пузырь, если до этого он не вскрылся самостоятельно. Чаще всего, после применения простагландинового геля в первые 3-4 часа более чем у половины пациенток уже отмечаются заметные изменения состояния шейки матки. При этом она укорачивается и размягчается, располагаясь по оси таза. В последующие 3 часа (через 6 часов после введения геля) зрелая шейка отмечается еще у 1/3 пациенток. У многих пациенток, в среднем через 9 -10 час развивается родовая деятельность. В том случае, если после применения геля в течение 6 час, шейка матки остается незрелой, то препарат вводят повторно в той же дозе.
Максимально допустимо трехкратное введение геля в течение 24 часов. При дородовом или раннем излитии околоплодных вод повторное введение геля противопоказано, и далее роды ведут в зависимости от акушерской ситуации. Эффективным применение геля считают при достижение достаточной степени зрелости шейки матки в течение 12 час, и начале родовой деятельности в течение 24 час от момента его введения. Обычно после применения геля сократительная деятельность матки является нормальной, при этом не происходит патологических изменений артериального давления и частоты пульса у матери, а также не отмечается признаков нарушений со стороны плода.
Для родовозбуждения при достаточной степени зрелости шейки матки целесообразно применение геля, содержащего простагландин Е2, во влагалище. Препарат применяют в тех случаях, когда имеется необходимость срочного родоразрешения из-за акушерских или каких-то других осложнений. Условия и противопоказания для использования вагинального геля такие же, как и при использовании простагландинового геля для введения в канал шейки матки.
Основной целью введения этого препарата является, прежде всего, развитие родовой деятельности. В качестве дополнительного эффекта отмечается его положительное воздействие на процесс созревания шейки матки при её недостаточной готовности к родам. При последующем наблюдении и ведении пациенток необходимо соблюдение следующих принципов: каждые 3 часа после введения вагинального геля оценивают состояние шейки матки. Если раскрытие шейки матки происходит менее чем на 3 см после 6 час от момента введения геля, или отсутствует регулярная родовая деятельность за этот промежуток времени, то препарат вводят повторно еще 1 или 2 раза, также с интервалом в 6 часов. Если происходит спонтанное вскрытие плодных оболочек до истечения 6 ч от момента последнего введения геля, препарат более не вводят. Если после введения препарата происходит открытие шейки матки не менее чем на 4 см при регулярной родовой деятельности, возможно вскрытие плодного пузыря, однако не ранее чем через 6 часов после введения геля. При необходимости возможно введение окситоцина внутривенно капельно для родостимуляции, однако, не ранее чем через 6 часов после введения геля.
В процессе наблюдения за роженицей проводят мониторный контроль состояния плода, сократительной активностью матки, контролируют пульс, артериальное давление и частоту дыхания. Коррекция слабой сократительной активности матки и неэффективной родовой деятельности должна предусматривать использование наиболее эффективных медикаментозных препаратов в соответствии с научными данными о механизмах развития родовой деятельности.
В акушерской практике для усиления сократительной активности матки при слабости родовых сил используются различные препараты, которые вводят внутривенно. Наиболее популярным среди них пока еще остается окситоцин. Однако в ряде случаев, например при недостаточно зрелой шейке матки и дородовом излитии околоплодных вод возможно применение внутривенно капельно препарата, содержащего простагландин Е2. А при первичной слабости родовой деятельности целесообразно внутривенное капельное введение препарата, содержащего простагландин F2α.
Особенности применения окситоцина
Результаты проведенных исследований указывают на то, что в процессе искусственного усиления сократительной деятельности матки происходит снижение антистрессовой устойчивости плода, подавление его защитно-приспособительных возможностей. При этом использование окситоцина для усиления родовой деятельности оказывает наименее благоприятное воздействие на течение родов, состояние плода и новорожденного в сравнении с препаратами, содержащими простагландины Е2 и F2α, которые используются с этой же целью и при сходной акушерской ситуации.
Неблагоприятное влияние окситоцина может быть особенно выражено в тех случаях, когда плод ещё до начала родов испытывал гипоксию, а введение окситоцина продолжалось более 3 часов. Выявленные данные подчеркивают высокий риск для здоровья новорожденного при длительном применении окситоцина. Комбинированное внутривенное применение раствора содержащего простагландин F2α и окситоцина в половинной дозировке оказывает более мягкое влияние на плод, и является целесообразным при необходимости усиления схваток в активную фазу родов.
Родостимуляция
Родостимуляция препаратами, содержащими простагландин Е2 позволяет добиться наилучшего эффекта при первичной слабости родовой деятельности, недостаточной зрелости шейки матки и дородовом излитии околоплодных вод. Для достижения наилучшего эффекта от введения препаратов для коррекции слабости родовой деятельности необходимо соблюдение некоторых принципов и условий. Так, перед родостимуляцией важно исключить узкий таз, неполноценность стенки матки вследствие многочисленных или осложненных искусственных абортов или воспалительных процессов.
Применение родостимуляции противопоказано при наличии рубца на матке после кесарева сечения или других операций, а также при неудовлетворительном состоянии плода. Родостимуляция должна как бы имитировать естественное развитие родовой деятельности, чтобы добиться физиологического темпа родов. В процессе родостимуляции осуществляют постоянный мониторный контроль за состоянием плода и сократительной деятельностью матки. Длительность родостимуляции не должна превышать 3-4 часов. При возникновении чрезмерной сократительной активности матки или при ухудшении состояния плода на фоне введения препаратов родостимуляцию прекращают.
УЗИ аппарат RS85
ФГАО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Россия
Первый Московский государственный медицинский университет им. И.М. Сеченова, Москва, Россия
БУЗ ВО «Вологодская областная клиническая больница», Вологда
Российский университет дружбы народов, Москва, Россия
Болезни пародонта и осложненное течение беременности
Цель исследования — на основании данных, имеющихся в современной литературе, провести исследование о влиянии стоматологических заболеваний на течение и исход беременности, главным образом влиянии болезней пародонта на низкий вес новорожденного и преждевременные роды. Материал и методы. Статья основана на изучении материалов зарубежных и отечественных исследований баз данных PubMed и Elibrary. Использованы данные литературы за последние 15 лет. Результаты. Большинство беременных женщин, не получающих должного стоматологического обследования и страдающих теми или иными заболеваниями полости рта, имеют неблагоприятный исход беременности, в том числе преждевременные роды и низкий вес недоношенного новорожденного. Четко показана роль хронического воздействия микроорганизмов полости рта Porphyromonas gingivalis (P. gingivalis) и Fusobacterium nucleatum, а также локального увеличения простагландина E (PGE) и фактора некроза опухоли (TNF-α), в реализации воспалительной реакции, приводящей к снижению веса плода на 15—18%. Заключение. Благодаря проведенному исследованию было установлено, что болезни пародонта и другие инфекционные заболевания полости рта негативно сказываются на течении беременности и на ее исходе. Главными проблемами становятся отсутствие санитарного просвещения женщин в плане подготовки к беременности и санации очагов инфекции в полости рта как до, так и во время беременности, а также низкая обращаемость к стоматологу, отсутствие должной профилактики и лечения заболеваний полости рта.
В последнее время уделяется много внимания влиянию болезней пародонта на неблагоприятный исход беременности. Несмотря на прогресс современной науки и медицины, проблема преждевременных родов занимает одно из первых мест в практическом акушерстве и перинатологии. Низкая масса тела недоношенных при рождении (Preterm Low Birth Weight — PLBW) имеет значительные последствия с точки зрения финансовых затрат на их лечение, высоких цифр смертности и повышенной восприимчивости к определенным медицинским осложнениям [1, 2]. Причин недоношенности и преждевременных родов множество; в отношении многих разработаны четкие критерии профилактики, диагностики и тактики ведения, однако хроническим очагам инфекции в полости рта (ПР) не придается должного значения, беременные не получают необходимой санации ввиду низкой обращаемости к стоматологам. Некоторые авторы рассматривают также такие причины пародонтита у беременных, как диабет, сердечно-сосудистые и легочные заболевания, инфекции и их влияние на течение беременности и состояние плода. Цель данного обзора — определить роль заболеваний пародонта, связанных с риском PLBW. Проанализированы данные литературы за последние 15 лет с использованием поисковых систем PubMed и Elibrary (44 публикации).
Низкая масса тела у недоношенных при рождении
R. Gibbs в обзорной статье представил подробный анализ возможной связи между инфекциями и неблагоприятными исходами беременности [16]. Согласно предложенной им гипотезе, при субклиническом течении инфекционного процесса микроорганизмы и их липополисахариды проникают в полость матки во время беременности по восходящему пути от нижнего полового тракта или гематогенно по негенитальному пути [17, 19].
В начале 1990-х S. Offenbacher и соавт. [30] предположили, что факторы нарушения оральной микрофлоры, такие как периодонтит, могут быть значительным источником как инфекции, так и воспаления во время беременности. Авторы отметили, что заболевание пародонта представляет собой грамотрицательную анаэробную инфекцию, которая способна привести к бактериемии и вызвать осложнения беременности. В серии знаковых исследований на животных они продемонстрировали, что хроническое воздействие Porphyromonas gingivalis привело к снижению массы плода на 15—18%, а также к локальному увеличению уровня простагландина E2 и фактора некроза опухоли-α (ФНО-α) в плодном яйце [28].
M. Jeffcoat и соавт. провели проспективное когортное исследование 1313 беременных с тяжелым или генерализованным периодонтитом [31]. Возраст обследованных составил от 20 до 30 лет; 83% испытуемых были афроамериканками, остальные 17% принадлежали к европеоидной расе. У обследованных был выявлен значительно больший риск преждевременных родов: относительный риск 4,45 преждевременных родов до 37 нед беременности, 5,28 — до 35 нед и 7,07 — до 32 нед.
В крупном проспективном когортном исследовании с участием 812 пациенток, проведенном S. Offenbacher и соавт. [32], выявлено, что заболевание пародонта у матери является значительным фактором риска досрочного рождения плода с низкой массой тела. Скорректированная распространенность умеренно-тяжелого периодонтального заболевания увеличивалась с уменьшением гестационного возраста. Авторы сообщили о его 9% распространенности до гестационного возраста 37 нед, 10,2% — до 35 нед, 13,6% — до 32 нед и 18,4% — до 28 нед.
Исследование B. Romero и соавт. [33], в котором изучалось соотношение между периодонтальным статусом матери и состоянием питания новорожденных, дало аналогичные результаты. Авторами был сделан вывод, что средняя масса тела новорожденных и гестационный возраст взаимосвязаны со степенью тяжести пародонтита у матери. Однако, несмотря на растущую тенденцию к выявлению положительной корреляции между периодонтальной болезнью и низкой массой тела при рождении, в недавно опубликованном исследовании [34] сообщается об обратном. В исследовании случай—контроль (236 наблюдений — PLBW и 507 — контроль), E. Davenport и C. Williams (2002) не обнаружили никакой связи между болезнью пародонта у матери и повышенным риском PLBW [34]. S. Lieff и соавт. [35] сообщили об увеличении глубины пародонтальных карманов (ПК) до 1,6—1,7 мм, что было статистически значимым.
Необходимо проведение рандомизированных интервенционных исследований для дальнейшей оценки причинно-следственных связей между периодонтальной болезнью и PLBW. Имеются данные клинических исследований, многообещающие с точки зрения дальнейшей оценки влияния терапии болезней пародонта на исходы беременности. В исследовании, проведенном D. Mitchell-Lewis и соавт. (2001) у молодых женщин в Центральном Гарлеме, у 74 пациенток произведена механическая и медикаментозная обработка корневых каналов (SRP) и им предоставлены инструкции по гигиене ПР, тогда как 90 других пациенток не получали периодонтального вмешательства. PLBW наблюдалась у 18,9% женщин, которые не получали пародонтологической терапии, и только у 13,5% женщин, получавших пародонтальное лечение [36]. Эти выводы совпадают с данными H. Lopez и соавт. (2002), сообщивших о значительном сокращении частоты PLBW при терапии болезней пародонта у 351 беременной [37]. У женщин, которые получали терапию заболеваний пародонта, частота PLBW составила только 1,84% по сравнению с 10,11% у нелеченых.
Как упоминалось ранее, воспалительные заболевания пародонта представляют собой инфекционное поражение, вызванное анаэробными грамотрицательными бактериями. Эти бактерии ранее были разделены на 2 основных кластера, или комплекса микроорганизмов, а именно «красный» и «оранжевый», описанные S. Socransky и соавт. [39]. Были проведены исследования >13 тыс. образцов подъязычной бляшки у 185 взрослых пациентов. Виды бактерий были сгруппированы с использованием кластерного анализа и методов координации сообщества. 6 тесно связанных видов бактерий были последовательно распознаны и впоследствии окрашены в соответствующие комплексы. Описаны «голубые», «зеленые», «желтые» и «пурпурные» комплексы ранних колонизаторов поверхности зуба, которые образуют кондиционирующую пленку перед размножением более патогенных «оранжевых» и «красных» комплексов. Показано, что во время созревания биопленки в зубной бляшке микроорганизмы из «оранжевого» комплекса необходимы для дальнейшего установления и колонизации «красного» комплекса. Наличие этих 2 комплексов, в частности «красного», тесно коррелирует с тяжелым и прогрессирующим периодонтальным заболеванием [40].
Потенциал Campylobacter rectus и Porphyromonas gingivalis в опосредовании неблагоприятных исходов беременности недавно был изучен на модели мыши. На модели мышиного плодного яйца доказательством концепции проблемы исходов беременности являлось обнаружение C. rectus, что вызывало неблагоприятные исходы беременности. У беременных мышей, получавших C. rectus, было больше рецидивов задержки роста плода после заражения C. rectus в количестве 10 7 или 10 9 колониеобразующих единиц (КОЕ)/мл (соответственно 24,1 и 30,1%), чем в контроле (9%). Более высокая частота задержки роста наблюдалась также в группах, зараженных C. rectus (21%), чем в контроле (2,3%). Плоды из матки, инфицированной 10 9 КОЕ/мл C. rectus, весили меньше (0,49 г) и имели более короткие коронки (14,69 мм), чем контрольные (соответственно 0,53 г и 15,54 мм).
В исследовании, проведенном D. Lin и соавт. [41], изучалось на мышах влияние инфекции P. gingivalis и сообщалось о подобных результатах. Данные этих работ показывают, что по крайней мере на модели мыши заражение пародонтальным патогеном на удаленном участке влияет на развитие и жизнеспособность плода. Это могло быть результатом распространения и транслокации пародонтального патогена в систему кровообращения беременных мышей, а также возможной индукции иммунных/воспалительных реакций у матери и плода.
Хотя представляется вероятным, что бактериальный вагиноз является основным источником инфекционного заражения, который вносит вклад в PLBW [43], был продемонстрирован потенциал пероральных возбудителей, участвующих в внутриамниальной инфекции и выступающих в качестве дополнительного фактора риска, который может способствовать PLBW [42, 44]. Микробиологические продукты, такие как эндотоксин, будут инициировать иммунный ответ хозяина, вызывающий воспаление и активацию провоспалительных медиаторов, таких как интерлейкин-1, ФНО-α и MMP, которые в свою очередь могут пересекать барьер плаценты и оказывать повреждающее воздействие на плод, приводящее к преждевременным родам и рождению детей с низкой массой тела.
Проводилось также исследование 203 беременных, целью которого было выяснить, насколько периодонтальная болезнь, оцениваемая по глубине ПК (ГПК) или степени зубных отложений (CAL), увеличивает риск последующих преждевременных родов и (или) низкую массу тела при рождении (low birth weight — LBW). Однако ГПК и CAL не всегда отражают текущее воспаление тканей пародонта. Поэтому может быть уместной оценка кровоточивости по индексу зондирования (БОП) и показателю воспаления периодонта. Длина бедренной кости плода антенатально, а также рост и масса тела у новорожденных от матерей с низкой степенью воспаления периодонта были значительно выше, чем у матерей с выраженным периодонтальным воспалением (p<0,05). Частота PLBW в группе выраженного воспаления периодонта была значительно выше, чем в группе, в которой проводилась терапия во время беременности (p<0,05). Это позволило сделать вывод, что воспаление периодонта коррелирует с длиной плода, массой тела при рождении и сроком гестации к моменту родов [45].
Итак, результаты многочисленных клинических наблюдений и исследований на животных подтверждают наличие крайне неблагоприятного влияния воспалительных заболеваний пародонта, особенно средней и тяжелой степеней, на исход беременности. Установлена связь стоматогенных очагов хронической инфекции с преждевременными родами и низкой массой тела новорожденных. Поэтому необходимы санитарное просвещение и санация ПР женщин на этапе планирования беременности, поддержание стоматологического здоровья во время беременности и после родов.
Простагландины ( ПГ ) и их действие на матку при родах. Простациклин. Простагландин F2. Простагландин E. Синтез простагландинов.
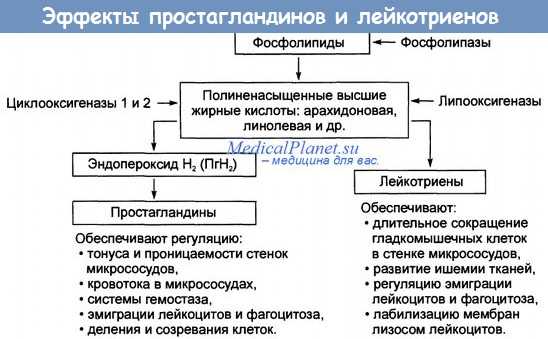
Простагландины ( ПГ ) представляют собой ненасыщенные жирные кислоты с 20 углеродными атомами, окружающими скелет молекулы простаноевой кислоты. Различают четыре серии натуральных простагландинов: Е, F, А и В. Особый интерес в репродуктивной физиологии представляют соединения серии Е и F.
Синтез простагландинов F2 и Е2 из ненасыщенных жирных кислот был осуществлен S. Bergstrom ct al. (1964) и DA Van Dorpet al. (1964), после чего эти вещества начали использоваться в клинике. Позже S. Bergstrom et al. были удостоены Нобелевской премии за синтез простагландинов и фундаментальные исследования в этой области.
В настоящее время доказана роль ПГ в наступлении родов. Установлено следующее: 1) уровень ПГ в амниотической жидкости, в материнской крови, моче и тканях матки в родах возрастает; 2) простагландины ПГF2а и ПГЕ2, введенные в любые сроки беременности, приводят к сокращению миомет-рия и вызывают аборт или роды; 3) простагланднны эффективны для вызывания родов при введении их per os , в амниотическую жидкость, внутривенно, экстраовулярно; 4) введение ингибиторов синтеза ПГ ведет к пролонгированию беременности и удлинению родового процесса; 5) введение ингибиторов синтеза ПГ эффективно при лечении преждевременных родов; 6) простагландины могут использоваться как утеротропины.
Источником образования простагландинов является арахидоновая кислота. Знание механизма синтеза простагландинов в тканях является источником для понимания процесса родов. Биосинтез простагландинов осуществляется в различных тканях: простациклин ПЦ2 синтезируется в миометрии, Е2 — в амнионе и хорионе, ПГF2a — в децидуальной ткани.
Нет четких доказательств увеличения скорости образования ПГ во внутриматочных тканях до начала родов. Тогда как в родах имеется резкое возрастание концентрации ПГ Е2 и ПГ F2 амниотической жидкости. Возрастает также концентрация метаболитов ПГ F2, а именно 13-14 дсгидро-15 кето-ПГ F2 амниотической жидкости, крови и моче. С другой стороны нет четкого доказательства возрастания уровня ПГЕ2 (или метаболитов) в материнской крови (Mitchell M. D., 1988).
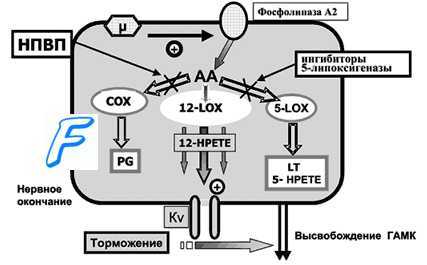
ПГ F2 может продуцироваться в децидуальной оболочке и в миометрии, по не в плодных оболочках, однако возрастание концентрации ПГ F2 и его метаболитов во время родов отмечено в амниотической жидкости, крови матери и моче.
Важно подчеркнуть, что амниотическая жидкость способствует сохранению простагландинов. Так, период полураспада ПГ F2 и Е2 в крови составляет 6- 8 мин, тогда как в амниотической жидкости он колеблется от 4 до 6 часов. Существует гипотеза, что децидуальная активность синхронна с началом родов. Во время родов в амниотической жидкости аккумулируются биологически активные вещества, а именно, арахидоновая кислота, простагландины, цитокины.
Концентрация арахидоновой кислоты в амниотической жидкости в родах возрастает в 5-10 раз.
Действие простагландинов осуществляется через фосфолипазу А2 или аденилатциклазпую систему, увеличивается количество рецепторов к ПГ Е2 и ПГ F2, а также возрастают концентрации гликозаминглнканов. Установлено, что ПГ Е2 в 10 раз активнее, чем ПГ F2a, что обусловлено количеством рецепторов,
В возникновении родовой деятельности простагландины Е и F играют важную роль. Механизм действия их на сократительную деятельность матки изучен недостаточно. Полагают, что механизм стимулирующего действия на матку реализуется деполяризацией клеточных мембран и освобождением ионов кальция (Са2+), что ведет к активации киназой легкой цепи миозина, фосфорилироваиию миозина и взаимодействию фосфорилированного миозина и актина (Carsten M.E., Miller J.D., 1983), а возможно, их прямым стимулирующим влиянием на гипофиз, в результате усиливается синтез окситоцина (Gillespie Л., 1973). Установлено, что при сочетанном применении ПГЕ2 или ПГ F2 с окситоцином эффективность действия смеси выше, чем одного простагландина.
Установлено, что манипуляции с плодными оболочками при влагалищном исследовании (отслаивание, введение баллона), амниотомия, манипуляции с шейкой матки способствуют выработке ПГ F2 и его метаболитов (Mitchell M.D., 197G; Mortimer G. et al., 1985; Mc Colgin S.W. et al., 1993)
Синтез простагландинов увеличивается и при прижатии плодных оболочек головкой плода. Их концентрация в передних водах выше, чем в задних.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:
