Миелоидные дендритные клетки. Фолликулярные, опухоль-ассоциированные дендритные клетки
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Дендри́тные кле́тки (ДК, англ. Dendritic cells, DC ) — специализированные на презентации антигенов лейкоциты, имеющие характерную отростчатую морфологию. Дендритные клетки относят к «профессиональным» антигенпрезентирующим клеткам. Дендритные клетки играют важнейшую роль в функционировании иммунной системы, поскольку они необходимы для активации T-клеточного ответа. Дендритные клетки экспрессируют молекулы главного комплекса гистосовместимости I ( MHC-I [en] ) и II ( MHC-II [en] ), на которых представляют фрагменты антигенов T-клеткам. Без участия антигенпрезентирующих клеток T-клетки не могут распознать антиген.
Почти все дендритные клетки имеют костномозговое происхождение, за исключением фолликулярных дендритных клеток, имеющих мезенхимальное происхождение. Дендритные клетки костномозгового происхождения могут относиться как к миелоидному, так и лимфоидному ряду. Дендритные клетки можно получить из фибробластов, а также из моноцитов периферической крови или стволовых клеток костного мозга. Существует несколько разновидностей дендритных клеток: миелоидные дендритные клетки, плазмоцитоидные дендритные клетки, фолликулярные дендритные клетки и клетки Лангерганса.
Дендритные клетки играют важную роль в развитии и терапии аутоиммунных заболеваний, рака и других болезней. Для ряда вирусов, например, ВИЧ, дендритные клетки выступают в роли мишени. Иногда дендритные клетки сами становятся причиной рака и претерпевают злокачественное перерождение.
Дендритные клетки впервые описал Пауль Лангерганс в 1868 году. Впоследствии найденную им разновидность дендритных клеток назвали клетками Лангерганса. Функциональную роль дендритных клеток удалось установить во второй половине XX века. В 1973 году Ральф Стайнман и Занвиль Кон [en] ввели в употребление термин «дендритные клетки». В 2011 году за открытие дендритных клеток Стайнману была присуждена Нобелевская премия по физиологии или медицине.
Содержание
Дендритные клетки представляют собой подвижные крупные (диаметром 15—20 мкм) клетки овальной или многоугольной формы с эксцентрически расположенным ядром [1] [2] и длинными цитоплазматическими выростами, причём некоторые цитоплазматические выросты превышают 10 мкм. Цитоплазма дендритных клеток содержит небольшое количество внутриклеточным органелл [3] , но достаточно большое количество митохондрий [4] . Отростчатая морфология, наличие псевдоподий и ворсинок присущи всем зрелым дендритным клеткам независимо от их специализации. Именно наличию отростков дендритные клетки обязаны своим названием [5] . К свойствам, универсальным для всех дендритных клеток, можно также отнести повышенный уровень экспрессии главного комплекса гистосовместимости I ( MHC-I [en] ) и II ( MHC-II [en] ) классов, а также костимулирующих [en] молекул CD80 и CD86. Кроме того, все дендритные клетки могут путём пиноцитоза или, в меньшей степени, фагоцитоза захватывать антиген для дальнейшего процессинга [en] и презентации его T-клеткам, что приводит к активации последних [6] .
В крови здоровых людей дендритные клетки имеют малый уровень экспрессии молекул CD83, CD80, CCR7, независимо от типа клетки [2] [7] .
Начало дендритным клеткам дают кроветворные стволовые клетки, то есть дендритные клетки, за исключением фолликулярных дендритных клеток, имеющих мезенхимальное происхождение, происходят из костного мозга. Дендритные клетки образуются из клеток-предшественников как миелоидного, так и лимфоидного ряда, причём дифференцировка предшественников в дендритные клетки возможна даже на ранних стадиях развития. В то же время допускается существование особой клетки-предшественницы дендритных клеток [6] .
Большинство дендритных клеток принадлежат к миелоидному ряду. Считается, что in vivo дендритные клетки могут образовываться как из гранулоцитарно-моноцитарных предшественников, так и из моноцитов. В культуре миелоидные дендритные клетки можно получить и из клеток костного мозга в присутствии GM-CSF и других цитокинов, а также из моноцитов в присутствии GM-CSF и IL-4. Дендритные клетки лимфоидного ряда дифференцируются из общего лимфоидного предшественника, а также предшественников T- и B-клеток, в частности, тимоцитов [en] на самой ранней стадии их развития в тимусе (DN1-клеток). Предшественников лимфоидных и миелоидных дендритных клеток объединяет экспрессия цитокинового рецептора [en] FLT3, что отличает их от предшественников других иммунных клеток. Таким образом, дендритные клетки могут образовываться из 6—7 клеточных источников [8] .
В периферической крови присутствуют незрелые дендритные клетки, которые составляют менее 0,5 % от общего числа лейкоцитов в кровотоке и выступают предшественниками дендритных клеток миелоидного и лимфоидного рядов, а также клеток Лангерганса. Маркерами [en] клеток-предшественников миелоидных клеток являются молекулы CD11c и MHC-II. Большинство незрелых дендритных клеток кровотока составляют так называемые плазмоцитоидные дендритные клетки, которые относятся к лимфоидному ряду. Незрелые дендритные клетки мигрируют из периферической крови в ткани благодаря тому, что на их поверхности располагаются рецепторы к практически всем β-хемокинам. Хотя дендритные клетки присутствуют во многих тканях и органах, их количество мало, поэтому и открыты они были сравнительно поздно. Как и макрофаги, дендритные клетки подразделяют на резидентные, которые присутствуют преимущественно в барьерных тканях (в коже и слизистых оболочках), и воспалительные [9] .
Основная функция дендритных клеток — презентация антигенов T-лимфоцитам, поэтому их относят к «профессиональным» антигенпрезентирующим клеткам. По эффективности презентации они на два порядка превосходят макрофаги благодаря повышенной экспрессии MHC, особенно MHC-II, а также молекул-костимуляторов. Презентация антигена дендритными клетками наивным T-клеткам [en] запускает иммунный ответ [10] .
Дендритные клетки активно и непрерывно распознают патогены (точнее, патоген-ассоциированные молекулярные паттерны [en] , PAMP [11] ) с помощью Toll-подобных рецепторов и поглощают соответствующие антигены по пути пиноцитоза и, в меньшей степени, фагоцитоза [6] . Если чужеродных антигенов вокруг дендритной клетки нет, то она поглощает и презентирует T-клеткам материал собственных тканей организма, но без корецепторного стимула, и иммунный ответ против собственных тканей организма не развивается. До активации антигеном дендритные клетки остаются незрелыми и имеют низкую презентирующую способность. Созревание дендритной клетки происходит при распознавании патогена Toll-подобными рецепторами. Дендритные клетки миелоидного ряда, подобно макрофагам, несут рецепторы маннозы, липополисахарида, а также TLR2 и TLR4, позволяющие распознавать грамотрицательные и грамположительные бактерии соответственно. Плазмоцитоидные дендритные клетки несут TLR7 и TLR9, распознающие ДНК вирусов и бактерий [12] .
После распознавания патогена в дендритных клетках увеличивается продукция цитокинов и хемокинов, а также повышается экспрессия адгезивных молекул, необходимые для представления антигенов и стимуляции Т-клеток [13] . В большинстве случаев фрагменты процессированного антигена представляются дендритными клетками в комплексе с MHC-II. В отличие от других антигенпрезентирующих клеток дендритные клетки могут презентовать антиген цитотоксическим CD8+ T-лимфоцитам в комплексе с MHC-I. Этот процесс известен как кросс-презентация [en] [14] . Одна зрелая дендритная клетка может активировать от 100 до 3 тысяч T-клеток [15] .
Под действием хемокинов CCL19 [en] , CCL21 [en] и CXCL12 зрелые дендритные клетки мигрируют из покровных тканей и по тканевой жидкости попадают в лимфатические сосуды, откуда перемещаются в региональные лимфоидные органы, например, в паракортикальную зону лимфатических узлов. В ходе миграции дендритная клетка практически утрачивает способность к эндоцитозу и проводит процессинг антигена с дальнейшим представлением его фрагментов в составе MHC. Попадание дендритных клеток в T-зависимую зону лимфатических узлов обеспечивается изменением экспрессии рецепторов хемокинов. Вместо рецепторов для хемокинов, которые продуцируются клетками барьерных тканей, дендритные клетки начинают экспрессировать рецепторы CCR7 и CXCR4, которые распознают хемокины, выделяемые клетками стромы T-зависимых зон лимфатических узлов. В этих зонах происходит презентация антигенов дендритными клетками T-лимфоцитам и активация последних через корецепторы CD40, CD80 и CD86. Контакт дендритной клетки и T-клетки через презентированный на MHC-II антиген получил название иммунологического синапса. Без иммунологического синапса дальнейшее развитие иммунного ответа невозможно [16] . Именно большое количество MHC-II, а также CD80 и CD86 на поверхности зрелых дендритных клеток делает их антигенпрезентирующими [17] . Активированные дендритные клетки продуцируют CD154, который связывается с CD40 на поверхности дендритных клеток [3] . Зрелые дендритные клетки, доставившие антиген в T-зависимую зону лимфоузла, становятся частью его стромы и называются интердигитальными дендритными клетками, так как между их отростками, напоминающими пальцы, располагаются T-лимфоциты [11] .
Резидентные миелоидные дендритные клетки заселяют органы на стадии клеток-предшественников или незрелых дендритных клеток и завершают своё развитие уже в органе, который в дальнейшем не покидают. Многие резидентные дендритные клетки располагаются в тимусе, зародышевых центрах, маргинальной зоне [en] селезёнки, печени и других органах [11] .
Клетки эпителия миндалин и желудочно-кишечного тракта продуцируют хемокин MIP-3α [en] , который привлекает незрелые дендритные клетки за счёт взаимодействия с рецептором [en] CCR6 на поверхности незрелых дендритных клеток. Синтез этого хемокина активируется при воспалении. При созревании дендритные клетки перестают экспрессировать CCR6 и перестают реагировать на MIP-3α, но на их поверхности появляется другой хемокиновый рецептор — CCR7. Созревающие дендритные клетки начинают реагировать на хемокины MIP-3β и SLC [en] , продуцируемый вторичными лимфоидными тканями, что привлекает дендритные клетки в лимфоузлы [3] .
Некоторые факторы могут системно изменять и даже нарушать функционирование дендритных клеток. Так, дислипидемия изменяет функцию презентации антигена, а никотин повреждает их способность начинать пролиферацию Т-клеток и вырабатывать цитокины [18] .
Зрелые дендритные клетки подразделяют на два типа: DC1 (миелоидные) и DC2 (лимфоидные). Основные свойства клеток этих типов представлены в таблице ниже [17] :
Незрелые лимфоидные дендритные клетки представлены плазмоцитоидными дендритными клетками. Особняком стоят эпидермальные дендритные клетки, известные как клетки Лангерганса, и фолликулярные дендритные клетки, имеющие мезенхимальное, а не костномозговое происхождение. В тимусе присутствуют в основном лимфоидные дендритные клетки, но есть и миелоидные. В селезёнке и брыжеечных лимфатических узлах преобладают в разных соотношениях популяции миелоидных лимфоидных клеток. В лимфатических узлах, связанных с кожей, помимо миелоидных дендритных клеток в больших количествах присутствуют клетки Лангерганса [19] .
Согласно альтернативной классификации, дендритные клетки подразделяются на классические и плазмоцитоидные (см. ниже). Классические дендритные клетки стимулируют T-клеточный ответ. Именно классические дендритные клетки являются преобладающей группой дендритных клеток в лимфоидных тканях. Классические дендритные клетки дополнительно подразделяются на основные и кросс-презентирующие [20] . Плазмоцитоидные дендритные клетки — это незрелые клетки, которые происходят от того же предшественника, что и классические дендритные клетки, и локализованы в основном в кровотоке, в меньшей степени — в лимфоидных органах. В отличие от классических дендритных клеток, плазмоцитоидные дендритные клетки практически неспособны к фагоцитозу и не поглощают антигены. Основной функцией плазмоцитоидных клеток является продукция интерферона [21] .
Миелоидные дендритные клетки (МДК) — дендритные клетки-предшественницы гемопоэтического происхождения. МДК имеют схожую морфологию, а также эндоцитозную и ферментативную активность с макрофагами и моноцитами. Локализируются в эпидермисе, дерме, дыхательных путях, кишечнике, тимусе, селезёнке, печени и лимфоидной ткани. Они характеризуются низким уровнем экспрессии MHC, а также костимуляторных и адгезивных молекул. С помощью пиноцитоза и фагоцитоза МДК захватывают чужеродные антигены, после чего экспрессируют антигенную детерминанту в комплексе с молекулами MHC-II. Затем они мигрируют в местные лимфатические узлы, где стимулируют пролиферацию и дифференцировку антигенспецифических Т-лимфоцитов, провоцируя и стимулируя иммунный ответ. В ответ на стимуляцию индукторами созревания, МДК продуцируют преимущественно цитокины Т-Хелпера 1 типа, включая IL-6, IL12RB1, фактор некроза опухоли и интерферон γ. Маркерами МДК являются молекулы CD1c и CD141 [4] [7] [22] .
Плазмоцитоидные дендритные клетки (ПДК) — незрелые клетки лимфоидного происхождения, морфологически напоминают плазматические клетки. ПДК — преобладающая разновидность незрелых дендритных клеток, циркулирующих в крови. ПДК меньше моноцитов (8—10 мкм), их ядро имеет менее выраженную выемку. Помимо кровотока, ПДК локализируются в Т-клеточных зонах лимфоидных тканей, миндалинах, тимусе, печени, лёгких и в коже. В присутствии IL-3 и бактериальных антигенов ПДК дифференцируются в зрелые лимфоидные дендритные клетки. На своей поверхности ПДК не несут молекул CD83, CD11b и CD11c, которые характерны для миелоидных дендритных клеток, а также CD13 и CD14, характерные для большинства миелоидных клеток. В ПДК экспрессируются гены RAG [en] , которые необходимы для перестройки генов антигенраспознающих рецепторов. На поверхности ПДК присутствуют CD45R0 и рецепторы для IL-3, при этом MHC-II представлены в меньшей степени, чем на миелоидных дендритных клетках, причём молекулы MHC-II есть не только на поверхности, но и в цитоплазме. В геномах ПДК имеются признаки перестройки генов T-клеточных рецепторов, которые характерны для T-клеток. ПДК выделяют в больших количествах интерфероны I типа [en] (α, β и ω), являясь основными поставщиками интерферона клеткам крови, поэтому ПДК также известны как клетки-продуценты интерферона. ПДК секретируют большие количества интерферонов преимущественно на первые сутки после стимуляции нуклеиновыми кислотами вирусного происхождения. Также они ответственны за производство цитокинов IL-4 и IL-10, которые переключают дифференцировку наивных Т-хелперов в Т-хелперы 2 типа. В спектре Toll-подобных рецепторов, экспрессируемых ПДК, преобладают рецепторы, находящиеся на цитоплазматических гранулах и распознающие нуклеиновые кислоты. В частности, экспрессия TLR9, лигандами которого являются CpG-олигонуклеотиды бактериальной ДНК, позволяет им обнаруживать патогены. Маркерами ПДК являются молекулы CD303, CD304, CD141, рецептор IL-3 CD123, а также иммуноглобулиноподобные рецепторы CD85k и CD85g [en] [4] [13] [22] [23] [24] .
ПДК попадают в лимфатические узлы тем же путём, что и T-клетки, а именно, через высокий эндотелий посткапиллярных венул. В то же время клетки-предшественницы миелоидных дендритных клеток проникают в лимфоузлы вместе с афферентным током лимфы. Как упоминалось выше, в течение первых суток после стимуляции вирусами или IL-3 ПДК усиленно экспрессируют интерфероны. В течение вторых суток они дифференцируются в зрелые дендритные клетки лимфоидного ряда. По мере созревания на поверхности ПДК повышается количество молекул MHC-II, появляются молекулы-костимуляторы CD80 и CD86. Во время созревания ПДК продолжают выделять интерфероны, но в меньшем количестве. При вирусной стимуляции созревающая ПДЦ способствует дифференцировке T-хелперов 1 типа (Th1-клеток), продуцирующих интерферон γ, а при стимуляции IL-3 — T-хелперов 2 типа (Th2-клеток), продуцирующих IL-4 [25] .
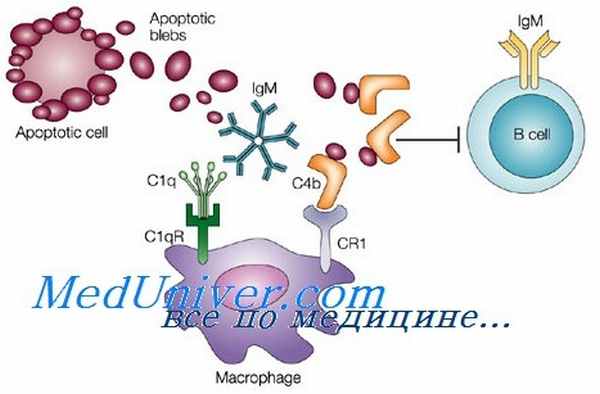
Фолликулярные дендритные клетки (ФДК) — зрелые клетки, в отличие от остальных дендритных клеток, имеют мезенхимальное происхождение. Прочно соединяясь десмосомами отростков, образуют стабильную сеть, благодаря которой они не мигрируют в другие области. ФДК локализируются в клеточных зонах лимфатических узлов и селезёнке. Они представляют антиген В-лимфоцитам во вторичных лимфоидных органах. Антиген на поверхности ФДК пассивен, сохраняет исходную конформацию антигена с антителом. Эти клетки являются особым микроокружением, на котором происходит уникальный для В-лимфоцитов процесс соматической гипермутации вариабельных сегментов генов, кодирующих антитела, и отбор наиболее аффинных к антигену вариантов антител. Они не экспрессируют белки MHC-II, но несут много молекул Fcγ-рецепторов, CR1 [en] и CR2, что позволяет им связывать иммунные комплексы [en] и представлять содержащийся в комплексах антиген В-лимфоцитам. При повторном поступлении антигена в организм, когда он связывается с ранее наработанными антителами, ФДК стимулируют B-клетки памяти [4] [26] .
Миелоидные дендритные клетки. Фолликулярные, опухоль-ассоциированные дендритные клетки
Миелоидные дендритные клетки. Фолликулярные, опухоль-ассоциированные дендритные клетки
На зрелых дендритных клетках отмечается повышенная экспрессия хемокиновых молекул CCR7 и снижается CCR5, что позволяет ДК мигрировать в регионарные лимфатические узлы, где ДК представляют Т-лимфоцитам процессированный антиген, а также информацию об особенностях патогена. Таким образом, зрелые ДК активируют наивные лимфоциты, в результате чего последние приобретают патогенспецифические свойства. Затем большинство ДК исчезает, как предполагают, путем апоптоза.
Экспрессия CD80 и CD86 молекул на поверхности антигенпредставляющей клетки контролируется врожденными механизмами иммунитета. TLRs индуцируют появление данных молекул на АПК после распознавания своих PAMPs. Т-клетка, в свою очередь, способна к активации комплексами МНС-пептид, образующимися в результате детекции PAMPs типа ЛПС.
Помимо дендритных клеток миелоидного и лимфоидного происхождения, существует целый ряд и других ДК, располагающихся в лимфоидных и других тканях:
— фолликулярные ДК имеют мезенхимальное происхождение, не экспрессируют белки, но связывают антигены посредством рецепторов к компонентам комплемента (CD21, CD35/ CR1), ассоциированными с иммунными комплексами (иккосомами). Фолликулярные ДК экспрессируют рецепторы для Fc-фрагмента IgG и только на них идентифицирована молекула VCAM-1. Фолликулярные ДК прочно соединяются десмосомами отростков в стабильную сеть и являются резидентными клетками.
— ДК центров размножения обнаруживаются внутри вторичных В-клеточных фолликулов. Экспрессируют белки МНС II класса. Данные ДК усиливают пролиферацию CD40- и IL-2-активированных В-клеток, а также продукцию антител. Такие свойства ДК центров размножения обусловлены, в частности, экспрессией ими IL-12 и CD40L
— эпидермальные клетки Лангерганса располагаются в базальных и супрабазальных слоях эпидермиса. Экспрессируют поверхностные гликопротеины: МНС I и II, CD1a, CD1c, CD4, CD83, CD86, рецепторы для Fc-фрагмента IgG, для С3b (CR1) и СЗЫ (CR3) компонентов, интегрины (b1, VLA4,5,6) лангерин и Lag.
— интерстициальные ДК являются разновидностью миелоидные ДК и известны как тканевые ДК Интерстициальные ДК локализуются в дерме и большинстве органов, включая легкие и сердце. Они экспрессируют CD1a, CD14, CD68, CD9, CD83, CD86 и фактор ХIIIа. Способны индуцировать дифференцировку В-клеток, активно захватывать антиген.
— дермальные ДК являются разновидностью интерстициальных ДК.
Таким образом, иммунофенотипически и функционально различающиеся типы ДК, образующиеся из различных гемопоэтических предшественников и локализующиеся в разных тканях и органах, образуют единую систему клеточных популяций, распознающих и представляющих антигены Т- и В-лимфоцитам или формирующих у них толерантность к аутоантигенам.
Отличительной чертой ДК от других АПК (макрофаги, тучные клетки, В-лимфоциты) является то, что стимулирующий эффект ДК на Т-лимфоциты во много раз (10-100) сильнее других АПК. Во-вторых, ДК являются единственными антигенпрезентирующими клетками, способными представлять наивным Т-клеткам неизвестные антигены и усиливать иммунный ответ. Мощный потенциал ДК стимулировать Т-клеточный ответ осуществляется благодаря их способности экспрессировать:
1) от 10 до 100 раз активнее комплекс МНС-пептид на своей поверхности по сравнению с другими АПК;
2) адгезивные молекулы ДК, способствующие усилению взаимодействия между антигенспецифическими МНС и TCR;
3) костимулирующие молекулы, активирующие наивные и покоящиеся Т-клетки в эффекторные Т-клетки. ДК могут активировать Т-клетки путем проведения антигенспецифических стимулов (через MHC-TCR взаимодействия) и костимулирующих сигналов (через акцессорные контакты);
4) мощные регуляторные цитокины, такие как IL-12, усиливающие естественную резистентность организма благодаря индукции и активации NK-клеток и Т клеток.
Удивительная пластичность плазмацитоидных пpe-DCs отличает их от других клеточных типов иммунной системы, имеющих ограниченные функции, и свидетельствует о том, что эти клетки могут играть ключевую роль в интеграции врожденного и адаптивного иммунного ответа.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
IV Международная студенческая научная конференция Студенческий научный форум - 2012

Дендритные клетки (ДК) представляют собой профессиональные антигенпредставляющие клетки (АПК) костномозгового происхождения. ДК - ключевой тип клеток на всех этапах реализации эффекторных функций иммунитета, имеющих наиболее мощный потенциал по сравнению с другими АПК. Они обладают уникальной способностью индуцировать и регулировать и первичный, и вторичный иммунный ответ. Кроме того, дендритные клетки способны активировать В-лимфоциты и NK (натуральные киллеры). ДК играют важную роль в инициации и регулировке иммунных реакций, направленных против вирусов, бактерий и других патогенных организмов. Они участвуют в реакции отторжения трансплантата, в развитии иммунологической толерантности, а также в патогенезе различных клинических симптомов и заболеваний. Самое важное свойство дендритных клеток - способность примировать «наивные» Т-лимфоциты при первом их контакте с антигеном. Следовательно, дендритные клетки являются специализированными индукторами специфического Т-клеточного ответа.
ДК, как и клетки крови, имеют своё происхождение от гемопоэтических стволовых клеток. Одна из самых ранних стадий - развитие клеток-предшественников, которые имеют выраженную тенденцию изменения в сторону лимфоидных или миелоидных клеток. Помимо ДК миелоидного и лимфоидного происхождения, циркулирующих в крови и лимфе, существует целый ряд ДК, располагающихся в лимфоидных и в других тканях. Фолликулярные ДК экспонируют антиген В-клеткам в центрах размножения фолликулов лимфатических узлов, селезёнки и лимфоидной ткани слизистых оболочек. Дендритные клетки центров размножения, экспрессирующие белки главного комплекса гистосовместимости II класса, обнаруживаются внутри вторичных В-клеточных фолликулов. Опухоль-ассоциированные ДК характеризуются фенотипом незрелых ДК с высокой экспрессией CD1a и низкой экспрессией костимулирующих молекул (CD80, CD86, CD40). Эпидермальные ДК - клетки Лангерганса располагаются в базальных и супрабазальных слоях эпидермиса. Интерстициальные ДК (иДК) являются разновидностью миелоидных ДК и известны как тканевые ДК. Дермальные ДК являются разновидностью иДК, локализуются в периваскулярных областях дермы, участвуют в активации Т-клеток и контактной гиперчувствительности. Все разновидности дендритных клеток выполняют единую функцию.
Студенческий научный форум - 2012
IV Международная студенческая научная конференция
В рамках реализации «Государственной молодежной политики Российской Федерации на период до 2025 года» и направления «Вовлечение молодежи в инновационную деятельность и научно-техническое творчество» коллективами преподавателей различных вузов России в 2009 году было предложено совместное проведение электронной научной конференции «Международный студенческий научный форум».
Клеточные компоненты иммунной системы
Хотя некоторые антигены (АГ) могут непосредственно стимулировать иммунный ответ, Т-клеточно-зависимый приобретенный иммунный ответ обычно требует присутствия АГ-презентирующих клеток (АПК), которые представляют пептиды АГ в комплексе с молекулами МНС (главного комплекса гистосовместимости).
Внутриклеточные антигены (например, вирусы) могут быть преобразованы и представлены рецептором CD8 Т-лимфоцитов любыми ядерными клетками, поскольку все они несут на своей поверхности молекулы МНС I класса. С помощью кодирующих их белков, которые вмешиваются в данный процесс, некоторые вирусы (например, цитомегаловирус) избегают уничтожения.
Внутриклеточные антигены (например, от многих бактерий) должны быть преобразованы в пептид и представлены в комплексе с молекулами МНС II класса на поверхности АПК (которые специализируются на презентации антигенов Т-клеткам) для распознавания CD4 Т-хелперами (Th). Клетками, конститутивно экспрессирующими молекулы ГКГ класса II, и поэтому действующие как так называемые профессиональные АПК, являются:
Дендритные клетки присутствуют в коже (клетки Лангерганса), лимфоузлах и в тканях всего организма. Дендритные клетки в коже – пограничные АПК, они захватывают АГ, доставляют его в локальные лимфоузлы, где активируют Т-лимфоциты. Фолликулярные дендритные клетки – это клетки особой клеточной линии, которые не экспрессируют молекулы МНС II класса и поэтому не представляют АГ TH-клеткам. Они не фагоцитируют, но содержат рецепторы к кристаллизирующемуся фрагменту (Fc) иммуноглобулина (Ig) G и комплементу, что позволяет им связываться с иммунными комплексами и представлять их В-лимфоцитам зародышевых центров вторичных лимфоидных органов.
Моноциты в кровотоке являются предшественниками тканевых макрофагов. Моноциты мигрируют в ткани, где через 8 часов они развиваются в макрофаги под воздействием колоние-стимулирующего фактора макрофагов (М-КСФ), секретируемого различными типами клеток (например, клетками эндотелия, фибробластами). В очагах инфекции активированные Т-клетки секретируют цитокины (например, интерферон-гамма [ИФН-гамма]), которые индуцируют продукцию фактора ингибирования миграции макрофагов, тем самым предотвращая выход макрофагов.
Макрофаги активируются цитокинами (например, ИФН-гаммой, интерлейкином (ИЛ)-4, ИЛ-13) и различными микробными компонентами (например, липополисахаридом). Активированные макрофаги уничтожают внутриклеточные микроорганизмы и секретируют цитокины (например, фактор некроза опухолей-альфа (ФНО-альфа), ИЛ-10. Основываясь на различных профилях экспрессии генов, были идентифицированы подтипы макрофагов (например, М1, М2), которые играют различную роль в усилении или ограничении воспалительного ответа.
Основная функция В-клеток - превращаться в плазматические клетки, которые вырабатывают и секретируют антитела.
Лимфоциты
2-мя важнейшими типами лимфоцитов являются:
В-лимфоциты (которые созревают в костном мозге)
Т-лимфоциты (которые созревают в тимусе)
Основные типы лимфоцитов не различаются с точки зрения морфологии, но имеют разные иммунные функции. Они отличаются друг от друга АГ-специфическими поверхностными рецепторами и другими молекулами клеточной поверхности, называемыми кластерами дифференцировки (CD), которые присутствуют или отсутствуют в определенном клеточном подтипе. Было идентифицировано более 300 CD, многих из которых нет в лимфоцитах, но они находятся в других клетках иммунной системы. CD-молекулы участвуют в клеточной адгезии, клеточной передаче сигналов, в качестве рецепторов Fc-области иммуноглобулинов, в качестве рецепторов для компонентов системы комплемента и других процессах. (Для получения дополнительной информации о молекулах CD см. веб-сайт Human Cell Differentiation Molecules (Молекулы дифференциации клеток человека)). Каждый лимфоцит распознает специфический АГ посредством поверхностных рецепторов.
В-клетки
Составляют от 5 до 15% всех лимфоцитов крови; также присутствуют в костном мозге, селезенке, лимфоузлах, на слизистой оболочке лимфоидных тканей.
После случайной реаранжировки генов, кодирующих иммуноглобулин (lg), В-лимфоциты в совокупности способны распознавать практически бесконечное число уникальных АГ. Перегруппировка генов последовательно происходит во время развития В-лимфоцитов в красном костном мозге. Процесс начинается с направленной стволовой клетки, которая проходит стадии про-В- и пре-В-лимфоцитов, и завершается образованием незрелого В-лимфоцита. В этот момент любые клетки, взаимодействующие с собственными АГ (аутоиммунные клетки), удаляются из популяции незрелых В-лимфоцитов путем инактивации (анергии) или апоптоза. Элиминация таких клеток гарантирует, что иммунная система с меньшей вероятностью распознает эти антигены как чужеродные (иммунная толерантность). Неудаленные В-лимфоциты (то есть, взаимодействовавшие не с собственными АГ организма) могут продолжить развитие до стадии зрелого молодого В-лимфоцита, покинуть красный костный мозг и переместиться в периферические лимфоидные органы, где может произойти их встреча с АГ.
Их ответ на антигенпроисходит в 2 этапа:
Первичный иммунный ответ: когда зрелые молодые В-лимфоциты впервые сталкиваются с АГ, эти клетки претерпевают бласт-трансформацию, клональную пролиферацию и дифференцировку в клетки памяти, которые отреагируют на такой же АГ в будущем, или в зрелые АТ-продуцирующие плазмоциты. До продукции АТ существует латентный период в несколько дней. Затем, продуцируются только IgM. После взаимодействия с Т-лимфoцитами в В-лимфоцитах может иметь место дальнейшая перегруппировка генов lg, что переключает синтез на IgG, IgA или IgE. Таким образом, при первичной встрече с АГ иммунный ответ развивается медленно и первоначально обеспечивает ограниченную иммунную защиту.
Вторичный (анамнестический или бустерный) иммунологический ответ: когда В-клетки и TH -клетки памяти повторно подвергаются воздействию АГ, В-клетки быстро пролиферируют, дифференцируются в зрелые плазмоциты и быстро продуцируют большое количество АТ (главным образом, IgG, т. к. Т-лимфоциты индуцируют переключение синтеза этого изотипа). АТ поступают в кровь и другие ткани, где могут взаимодействовать с АГ. Таким образом, после повторной встречи с АГ иммунный ответ более быстрый и эффективный.
Т-клетки
Источником развития Т-клеток являются стволовые клетки костного мозга, которые мигрируют в тимус, где происходит процесс строгой селекции. Существует 3 основных типа Т-лимфоцитов:
При селекции Т-клетки, которые способны реагировать на антиген в комплексе с молекулами ГКГ собственного организма (или сильно реагирующие на собственные молекулы ГКГ независимо от представленного АГ), элиминируются путем апоптоза, ограничивая вероятность аутоиммунных процессов. Остаются только Т-лимфоциты, опознающие чужеродный АГ, связанный с молекулами МНС собственного организма; они покидают тимус, выходят в периферическую кровь и лимфоидные ткани.
Более зрелые Т-лимфоциты экспрессируют CD4 или CD8, а также АГ-связывающие lg-подобные рецепторы, называемые Т-клеточными рецепторами (РТК). Существует 2 типа РТК:
Альфа-бета РТК: состоят из РТК альфа- и бета-цепей; присутствуют на большинстве Т-лимфоцитов
Гамма-дельта РТК: состоят из РТК гамма- и дельта-цепей; присутствуют на небольшой популяции Т-лимфоцитов
Гены, кодирующие РТК, как и гены Ig, перестраиваются; в результате этого достигается определенная специфичность и аффинность к АГ. Большинство Т-клеток (у которых альфа-бета-РТК) распознают антиген-производный пептид, представленный молекулами MHC на антигенпрезентирующих клетках. Гамма-дельта Т-клетки распознают белок антигена напрямую или распознают липид антигена, выделяемый МНС-подобной молекулой, называемой CD1. Как и у В-лимфоцитов, число специфичных связей у Т-лимфоцитов практически неограниченно.
Для активации альфа-бета Т-лимфоцитов необходимо связывание РТК с антиген-МНС (см. рисунок Модель двух сигналов для активации Т-лимфоцитов [ Two-signal model for T cell activation Модель двух сигналов для активации Т-лимфоцитов ]) . Также требуется взаимодействие со вспомогательными молекулами (например, CD28 на Т-клетках взаимодействует с CD80 и CD86 на антигенпрезентирующих клетках); в противном случае Т-лимфоцит останется неактивированным или погибнет в результате апоптоза. Некоторые вспомогательные молекулы (например, CTLA-4 [цитотоксический Т-лимфоцитарный антиген 4] на Т-клетке, взаимодействующий также с CD80 и CD86 на антигенпрезентирующей клетке, PD-1 [белок запрограммированной клеточной смерти 1] на Т-клетке, который взаимодействует с PD-L1 [лиганд белка запрограммированной клеточной смерти 1] на антигенпрезентирующей клетке) ингибируют предварительно активированные Т-клетки и, таким образом, ослабляют иммунный ответ. Такие молекулы, как CTLA-4 и PD-1, и их лиганды, называются контрольными точками, поскольку они подают сигнал о прекращении активации Т-лимфоцитов. Таким образом, раковые клетки, которые экспрессируют молекулы контрольных точек, могут быть защищены от иммунной системы путем ограничения активности опухолеспецифических Т-клеток.
Моноклональные антитела, которые нацелены на молекулы контрольных точек как Т-клеток, так и опухолевых клеток (так называемые ингибиторы контрольных точек – см. таблицу Клиническое использование некоторых иммунотерапевтических агентов Некоторые иммунотерапевтические препараты для клинического применения ) используются для предотвращения подавления противоопухолевых иммунных реакций и эффективного лечения некоторых резистентных до настоящего времени типов раковых заболеваний и усиления противоопухолевого ответа. Однако, поскольку молекулы контрольных точек также участвуют в предотвращении других типов иммунного ответа (таких как самостоятельные аутоиммунные реакции), ингибиторы контрольных точек могут вызывать тяжелые иммунные воспалительные и аутоиммунные реакции (как системные, так и органоспецифические) или усугублять аутоиммунные нарушения.
Полиморфизм гена CTLA-4 ассоциирован с некоторыми аутоиммунными патологиями, в том числе, с болезнью Грейвса ЭтиологияМодель двух сигналов для активации Т-лимфоцитов
Альфа (α) и бета (β) цепи Т-клеточного рецептора (РТК) связываются с комплексом антиген (АГ)-главный комплекс гистосовместимости (МНС) на поверхности антиген-презентирующей клетки (АПК), и рецептор CD4 или CD8 вступает во взаимодействие с МНС. Оба эти действия через дополнительные цепи CD3 стимулируют Т-лимфоциты (1-й сигнал). Тем не менее, без 2-го сигнала (сочетанная активация) Т-лимфоцит останется анергичным или толерантным к АГ.
РТК структурно гомологичен рецептору В-клеток; α и β (или гамма [γ] и дельта [δ] ) цепи содержат постоянную (C) и вариабельную (V) области. (1) = 1-й сигнал; (2) = 2-й сигнал.
Миелоидные дендритные клетки. Фолликулярные, опухоль-ассоциированные дендритные клетки
Презентация антигена,
кооперация иммунокомпетентных клеток
Антигенраспознающий В-клеточный рецептор В-линфоцитов (BcR - англ. В-се11 Receptor) построен из молекулы мембранного иммуноглобулина (mlg, состоящий из двух одинаковых тяжелых Н- и двух одинаковых легких - L-цепеи) и двух молекул CD79 (Igα, Igβ) - BcR имеет трансмембранные и внутрицитоплазматические сегменты, передающие внутриклеточные сигналы.
Антигенраспознающий Т-клеточный рецептор Т-лиифоцитов (TcR - англ. Т-се11 Receptor) имеет две формы - αβ и γδ, которые соединены в мембране клетки с комплексом CD3. Димеры αβ и γδ также как молекулы иммуноглобулина, имеют V- и С-домены. TcR совместно с корецепторами CD8 или CD4 распознает комплекс пептид-антиген + МНС первого (I) или второго (II) класса.
Антигенпрезентирующая, или антигенпредставляющая, клетка (АПК) захватывает антиген путем эндоцитоза и расщепляет его до пептидных фрагментов, которые связываются внутри клетки с молекулами МНС I или II класса и выставляются на поверхность клетки. Профессиональными АПК для лимфоцитов являются дендритные клетки (DC), В-лимфоциты, макрофаги. Роль АПК могут также выполнять эндотелиальные клетки, фибробласты, кератиноциты и некоторые другие клетки, способные при активации экспрессировать МНС и цитокины.
| Дендритные клетки (DC) |
Дендритные клетки (DC) - отростчатые, ветвистые клетки, основные представители антигенпрезентирующих клеток (АПК).
Дендритные клетки костномозгового происхождения находятся в слизистых оболочках и коже (клетки Лангерганса, или белые отростчатые эпидермоциты). Они более активны, чем макрофаги в индукции имуиного ответа. Захватив и переработав антиген, DC перемещаются в регионарные лимфоидные образования, тимусзависимые зоны, (в виде интердигитальных клеток) где с помощью молекул МНС презентируют антиген Т-лимфоцитам. В тимусе имеются интердигитальные медуллярные клетки, являющиеся антигенпрезентирующими клетками.
Дендритные клетки некостномозгового происхождения - фолликулярные дендритные клетки (FDC - Follicular Dendritic Cell) находятся в первичных и вторичных фолликулах лимфоузлов, селезенки и лимфоидной ткани слизистых оболочек. Они несут на поверхности иммунные комплексы антиген-антитело (без поглощения) и презентируют антиген В-лимфоцитам с помощью антительного Fc-рецептора (Fcγ R) и рецептора к комплементу (CRl, CR2), связанных с мембраной FDC. Фолликулярные дендритные клетки не имеют молекул МНС II.
Недавно во вторичных В-клеточных фолликулах лимфоидной ткани обнаружены дендритные клетки центров размножения . Они имеют молекулы МНС II, могут мигрировать и взаимодействовать с Т-лимфоцитами.
| Разновидности антигенпрезентирующих клеток |
| Т-лимфоциты |
Т-лимфоциты (тимусзависимые лимфоциты) дифференцируются в тимусе - лимфоциты Тαβ . Другие - лимфоциты Тγδ возможно дифференцируются в слизистых оболочках ЖКТ. Имеют антигенраспознающий рецептор - TcR (T-клеточный рецептор), состоящий из двух форм - αβ или γδ. Антигенраспознающий рецептор - TcR распознает антигенный пептид, связанный с МНС антигенпрезентирующих клеток (АПК). В результате, при действии костимулирующих факторов, клетки дифференцируются в Т-хелперы или цитотоксические Т-лимфоциты. Важными корецепторными взаимодействиями между Т-лимфоцитом и антигенпрезентирующей клеткой являются CD28 - CDS80, CD154 (CD40L) - CD40.
Наивные Т-хелперы под действием различных факторов дифференцируются: Th1 лимфоциты отвечают за стимуляцию клеточного иммунитета; Th2-лимфоциты - гуморального иммунитета.
Цитотоксические Т-лимфоциты (ЦТЛ , CTL, или Т-киллеры) имеют - Т-клеточный рецептор (TcR) и корецептор CDS, которые участвуют в распознавании комплекса антигенный пептид + МНС I класса. Активированные, дифференцированные цитотокеические Т-лимфоциты, вызывают гибель клеток-мишеней в результате контакта и участия перфорина, гранзимов, Fas-рецепторов и факторов некроза опухолей.
NК-клетки (normal killers, или natural killers - нормальные киллеры) в кооперации с цитокинами оказывают неспецифическую цитотоксичность против инфицированных вирусом клеток, стареющих и опухолевых клеток. NK-клетки убивают клетки-мишени на основе лектинового распознавания или антителозависимои клеточной цитотоксичности (АЗКЦ). NK-клетки убивают клетки-мишени, которые (в какой-либо момент) не экспрессируют МНС I. Цитотоксическое действие NK-клеток сходно с действием цитотоксических лимфоцитов. При соединении NK-клетки с Fc-фрагментом антител, прикрепленных к клеткам с чужеродными антигенами, развивается антителозависимая клеточная цитотоксичность.
Различают две субпопуляции NК : CD56 много /CDl6 - и CD56 мало /CDl6 + . Субпопуляция NK с фенотипом CD56 мало /CDl6 + участвует в АЗКЦ. Вторая субпопуляция NK с фенотипом CD56 много /CDl6 - (так называемые Pit-клетки ) находится в синусоидах печени. Схожие клетки имеются в матке. Эти клетки убивают любые лимфоциты, которые активируются пищевыми антигенами и антигенами плода, обуславливая толерантность к этим антигенам.
В-лимфоциты дифференцируются в костном мозге (или в бурсе - фабрициевой сумке, находящейся в клоаке птиц). Выполняют роль антигенпрезентирующей клетки (АПК) и, после преобразований (в результате связывания антигена) В-лимфоциты дифференцируются в плазматические клетки , продуцирующие антитела. В-лимфоциты получают антиген от фолликулярных дендритных клеток (FDC), несущих иммунные комплексы антиген-антитело, а также в результате рецептор-опоередованного поглощения.
В-лимфоциты экспрессируют следующие молекулы: 1. Антигенраспознающий В-клеточный рецептор (BcR) представленный, гл. обр., мембранными иммуноглобулинами - мономерами mlg M, mlg D; 2. Корецепторный комплекс мембранных молекул [CD19/CR2 (CD21)/ТАРА-1], связанных с системами внутриклеточного проведения сигналов; 3. BcR-ассоциированные молекулы [Igα (CD79a) и Igβ (CD79b)], необходимые для сигнальной трансдукции; 4. Костимулирующие молекулы (CD28, CD40 и др.) для дополнительных стимулов и переключения синтеза разных изотипов антител; 5. Адгезивные молекулы (ICAM-3 и др.) для контакта клеток.
В иммунном ответе клетки взаимодействуют при межклеточном контакте мембранами и с помощью цитокинов. Различают следующие молекулы межклеточной адгезии : селектины, муциноподобные адрессины сосудов, интегрины и молекулы из суперсемейства иммуноглобулинов.
Селектины - молекулы (рецепторы) поверхности лимфоцитов, нейтрофилов, моноцитов, эозинофилов, взаимодействующие с лигандами (муциноподобными молекулами адрессинов CD34, GlyCAM-1 и MAdCAM-1) эндотелия сосудов. Участвуют в остановке клеток для их миграции через эндотелий.
Интегрины - молекулы поверхности Т-лимфоцитов, моноцитов, макрофагов, дендритных клеток, нейтрофилов, взаимодействующие с молекулами клеточной адгезии, фрагментами комплемента или с компонентами внеклеточного матрикса.
Читайте также:
