Надпочечниковая недостаточность у тяжелых пациентов. Инфекционные осложнения
Добавил пользователь Евгений Кузнецов Обновлено: 30.01.2026
Надпочечниковая недостаточность у тяжелых пациентов. Инфекционные осложнения
Повышение концентрации тканевых кортикостероидов во время критического состояния неотъемлемая часть нормального ответа в ходе физиологического стресса. Нормальный кортикостероидный ответ может быть нарушен при многих состояниях, включая сепсис, ССВО, травматическое повреждение головного мозга и т. д.
Несвоевременная диагностика и лечение надпочечниковой недостаточности приводят к повышению летальности. Все пациенты, с тяжело текущим сепсисом, ССВО, длительной дыхательной недостаточностью, необъяснимой артериальной гипотензией или лабильностью артериального давления должны быть отнесены к высокому риску по надпочечниковой недостаточности.
Единого стандарта в диагностике острой надпочечниковой недостаточности у критически больных нет. Случайная проба на кортизол может быть полезна в скрининге, с последующим лечением при его низких значениях (< 15 мкг/ дл) или проведением кортикотропин-стимулирующего теста с референсным интервалом (15-34 мг/дл). При ненормальных показателях стимуляционного теста (< 9 мг/дл) необходимо назначение кортикостероидов.
Другой подход — использование скрининга бессывороточного кортизола, значительно снижающего частоту ложноположительных тестов вследствие влияния гипотермии на уровень кортизола (90% всего кортизола связано с белком).
Инфекционные осложнения при травме
Инфекционные осложнения обширной травмы могут быть результатом как самого повреждения (открытые переломы), так и осложнением проводимого лечения (несостоятельность анастомозов) или ятрогенным следствием интенсивной терапии (респиратор-ассоциированная пневмония). Специфика мониторинга инфекции зависит от типа и тяжести травмы, проводимых вмешательств, и длительности течения посттравматической болезни.
Мониторинг инфекции в ОИТ сложный процесс и требует особого внимания. Смертность в ОИТ напрямую зависит от частоты инфекционных осложнений и как причина смерти регистрируется в более 88000 случаев за год. В исследованиях использующих множественный регрессионный анализ, наиболее важными факторами инфекционной инвазии были определены центральные венозные катетеры, плевральные дренажи, открытые переломы и проведение искусственной вентиляции легких.
Пациенты, находящиеся в зоне повышенного риска инфекционных осложнений, должны обследоваться в обычном порядке. На регулярной основе должен проводиться забор посевов на стерильность, оценка клинический данных, таких как гипертермия, лейкоцитоз, поиск изменений при физикальном исследовании, таких как пиурия, откашливание гнойной мокроты, а также выявление инфильтратов при рентгенологии органов грудной клетки.
Решение о назначении превентивной (эмпирической) антибиотикотерапии должно основываться на анализе факторов риска, ожидаемых осложнениях травмы и предыдущих инфекционных заболеваниях пациента. Превентивное лечение должно начинаться только при показаниях, с заранее определенным временем окончания у пациентов с отрицательными результатами посевов или пересматриваться с учетом чувствительности и вида микробиологической культуры при получении положительных результатов.
Не всем травмированным пациентам в критическом состоянии с необъяснимыми эпизодами фебрильной температуры априори должны назначаться антибиотики. Стойко температурящие, с отрицательными посевами пациенты представляются сложными случаями при проведении диагностики и лечения. Лихорадка у таких больных может быть неинфекционного характера или являться следствием латентной инфекции, которую не рассматривают по причине отсутствия роста при посевах или манифестации нехарактерными для данного вида признаками или симптомами.
При длительном нахождении пациента в ОИТ развивается некоторая степень иммуносупрессии, вследствие массивной антибиотикотерапии, и при отрицательных посевах должен быть заподозрен вялотекущий грибковый сепсис.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Мониторинг питания и гликемии у тяжелого пациента. Принципы
Оценка и мониторинг питания у критически больных пациентов должны начинаться сразу после поступления в отделение интенсивной терапии. Должно отдаваться предпочтение энтеральному питанию, для упрощения этого процесса и уменьшения нарушения барьерной функции слизистой кишечника. Мониторинг питания должен начинаться с определения уровня питания до травмы параллельно с выявлением потребностей в данный момент времени.
Расчет азотистого баланса обеспечивает более точное определение суточной калорической потребности и у критически больных травматологических пациентов должен проводиться еженедельно. Подсчет ведется определением разницы выделенного азота (рассчитанного по азоту мочи за 24 часа сбора) и поступившего энтерально или парентерально. Основная цель состоит в достижении положительного азотистого баланса от 2 до 4 граммов в сутки. Непрямая калориметрия (метаболическая карта) обеспечивает измерение в реальном времени потребности организма в калориях и метаболического статуса.
Используемая технология подразумевает измерение количества выделенного СО2 с выдыхаемой смесью газов у больного на ИВЛ. Основной принцип заключается в том, что в процессе метаболизма потребляется О2 с выработкой СО2 при расходе азота и воды. Непрямая калориметрия подразумевает измерение доставки О2 и выработки СО2 за определенный период времени. При известном значении RQ за это время, энергетическая потребность может быть экстраполирована на 24 часа. RQ может варьировать от 0,7 до 1,2 в зависимости от потребляемого организмом состава и соотношения метаболического субстрата. Измерения обычно проводятся несколько раз в день или непрерывно для установления калорической потребности в течение суток.
Контроль гликемии в отделении интенсивной терапии
Часто встречающимся синдромом у критически больных может быть гипергликемия, которая может сопровождаться относительной инсулинорезистентностью. Основываясь на литературных данных по диабету, в которых отдаленные исходы лучше при поддержании уровня сахара менее 215 мг/дл, Van den Berghe et al. предположили, что гипергликемия, или недостаточность инсулина приводит к ухудшению исходов у критически больных.
В их проспективном рандомизированном контролируемом исследовании продемонстрировано, что нормализация уровня глюкозы (менее 110 мг/дл) посредством интенсивной инсулинотерапии снижает показатели смертности, частоты инфекционных осложнений, полиорганной недостаточности, длительности нахождения на ИВЛ и заболеваемости.
Специально сфокусировавшись на эффектах контроля гликемии у критически больных травматологических пациентах, Vogelzang et al. ретроспективно оценили данные за 12 лет по группам травматологических и не травматологических пациентов, обнаружив, что гипергликемия в первом случае связана с большей вероятностью смерти, чем у других хирургических пациентов.
Синдром Уотерхауса — Фридериксена (аддисонический криз) - симптомы и лечение
Что такое синдром Уотерхауса — Фридериксена (аддисонический криз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Троицкой Ирины Николаевны, эндокринолога со стажем в 8 лет.
Над статьей доктора Троицкой Ирины Николаевны работали литературный редактор Вера Васина , научный редактор Екатерина Шрёдер и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Синдром Уотерхауса — Фридериксена (Waterhouse — Friderichsen syndrome) — это острая надпочечниковая недостаточность, которая развивается при двустороннем кровоизлиянии в надпочечники. Может возникать на фоне сепсиса. Проявляется слабостью, головокружением, рвотой, диареей, низким давлением, обмороками и судорогами [1] .
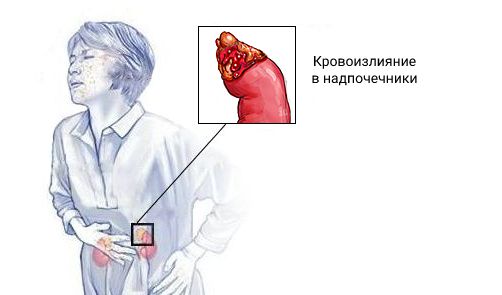
Заболевание ещё называют гипоадреналовым кризом, острым гипокортицизмом, кризом надпочечниковой недостаточности и аддисоническим кризом [1] .
Синдром Уотерхауса — Фридериксена — это редкое состояние, которое чаще развивается у детей. Среди всех заболевших 90 % — дети до 9 лет, 70 % — до 2 лет [24] .
Причины синдрома Уотерхауса — Фридериксена
- Бактериальная инфекция. Менингококковая инфекция — это самая распространённая причина кровоизлияния в надпочечники, но к этому состоянию могут привести и другие бактерии: стрептококки, которые вызывают пневмонию, гемофильная и кишечная палочки, золотистый стафилококк, гемолитический стрептококк группы А, гонококк, бледная трепонема и другие микробы [6][8][13] .
- Вирусы: цитомегаловирус, парвовирус, вирус ветряной оспы и Эпштейна — Барр [15][16] .
- Приём антикоагулянтов — препаратов, которые препятствуют свёртыванию крови [17] .
- Генетические заболевания: антифосфолипидный синдром, гемофилия, болезнь Шенлейн — Геноха, системная красная волчанка, узелковый периартериит[1][12] .
- Травма надпочечников [3] .
- Ожоги [1] .
- Адреналэктомия — удаление надпочечников [1] .
- Операция — осложнение после хирургического лечения, например эндопротезирования [3][18] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Уотерхауса — Фридериксена
К первым проявлениям синдрома Уотерхауса — Фридериксена относятся:
- слабость и упадок сил;
- головокружение;
- ухудшение аппетита;
- снижение артериального давления;
- чаще увеличение и реже замедление частоты сердечных сокращений;
- угнетение рефлексов;
- уменьшение объёма мочи [23] .
При заболевании резко снижается давление, кожа становится бледной и синюшной. Уменьшение уровня кортизола и глюкозы проявляется потерей сознания и судорогами [1] . Присоединяются рвота и диарея, приводящие к обезвоживанию и коме [23] .
Если синдром Уотерхауса — Фридериксена развился на фоне менингококковой инфекции, на туловище, ногах и слизистых оболочках может появиться петехиальная сыпь. Петехии — это красные пятна размером меньше 2 мм. Они могут объединяться в кровоизлияния покрупнее: пурпуру и экхимозы (больше 2 и 3 мм). Чем ниже уровень тромбоцитов, тем чаще возникают крупные кровоизлияния [14] .
![Петехиальная сыпь [25]](/pimg3/nadpochechnikovaya-nedostatochnost-tyazh-87C1285.jpeg)
Патогенез синдрома Уотерхауса — Фридериксена
К развитию синдрома Уотерхауса — Фридериксена приводят:
- нарушение работы надпочечников;
- интоксикация из-за острой инфекции.
Эти процессы отягощают друг друга. Из-за прекращения работы надпочечников нарушается выработка глюко- и минералокортикоидных гормонов, которые участвуют в белковом, углеводном, жировом и водно-электролитном обмене. При нехватке этих гормонов нарушается обмен веществ, что приводит к сбою в работе всех клеток . Ионы натрия и хлориды при этом выводятся с мочой, хуже всасываются в кишечнике, что приводит к обезвоживанию — так возникает порочный круг заболевания.
Нарушения электролитного баланса проявляются сильной рвотой и частым жидким стулом, у новорождённых — срыгиваниями [1] . Уменьшение объёма крови из-за резкой потери жидкости приводит к шоку.
Также в организме нарушается обмена калия: он плохо выводится с мочой, повышается его уровень в крови, клетках и жидкости между ними. Из-за избытка калия в миокарде сердце начинает хуже сокращаться и не может адекватно реагировать на повышенную нагрузку.
При синдроме Уотерхауса — Фридериксена также нарушается углеводный обмен, в частности снижается уровень глюкозы в крови. Если это происходит резко, то развивается гипогликемическая кома [19] .
Классификация и стадии развития синдрома Уотерхауса — Фридериксена
Общепринятой классификации синдрома Уотерхауса — Фридериксена не существует.
В Международной классификации болезней (МКБ-10) он кодируется как:
- E35.1 — синдром Уотерхауса — Фридериксена;
- А39.1 — менингококковая инфекция [10] .
Осложнения синдрома Уотерхауса — Фридериксена
Синдром Уотерхауса — Фридериксена сам по себе является осложнением инфекций и ожогов, следствием удаления надпочечников, побочным эффектом приёма антикоагулянтов и осложнением операций.
При заболевании резко ухудшается работа надпочечников и развивается сосудистый коллапс. Без своевременной медицинской помощи наступает кома и смерть [1] .
Диагностика синдрома Уотерхауса — Фридериксена
При подозрении на синдром Уотерхауса — Фридериксена собирают анамнез, проводят осмотр, применяют лабораторные и инструментальные методы диагностики.
Сбор анамнеза
По возможности врач постарается выяснить историю болезни: наличие заболеваний надпочечников, ДВС-синдрома (нарушения свёртываемости крови), острой инфекции, ожогов и перенесённой операции.
При синдроме Уотерхауса — Фридериксена пациенты часто жалуются на головные боли, тошноту, боли в животе, диарею и сильную рвоту, возможно с кровью.
Осмотр
Состояние обычно тяжёлое, возникает заторможенность, ступор и бред.
При осмотре врач обратит внимание на положительные менингеальные симптомы, характерные для синдрома:
- поза «легавой собаки» — больной лежит на боку, ноги согнуты в коленях и подтянуты к животу, голова запрокинута назад;
- ригидность затылочных мышц — при попытке пригнуть голову к груди мышцы сопротивляются и не дают этого сделать;
- симптом Кернига — ногу, согнутую под прямым углом в коленном и тазобедренном суставе, невозможно разогнуть в колене [22] .
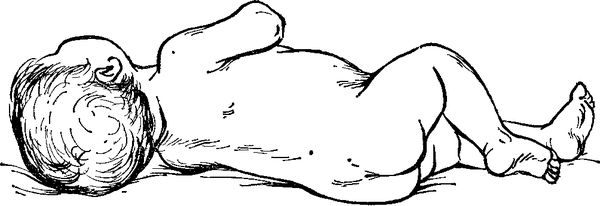
Тоны сердца глухие, пульс едва прощупывается. Развиваются судороги и очаговые неврологические симптомы. Кожа бледная, может появиться сыпь, руки и ноги холодные, давление сильно снижено, вплоть до коллапса, сердцебиение учащается, может прекратиться выделение мочи [1] .
Лабораторная диагностика
Проводится анализ на базальные уровни гормонов коры надпочечников. Кровь нужно сдавать с 6 до 9 утра, так как именно в это время вырабатывается больше всего гормонов. Анализ назначают строго до начала лечения глюкокортикоидами: Гидрокортизоном, Дексаметазоном, Преднизолоном [23] .
Также проводятся другие анализы:
- Общий анализ крови — при синдроме Уотерхауса — Фридериксена сильно увеличены лейкоциты со сдвигом лейкоцитарной формулы влево, повышены эозинофилы.
- Коагулограмма (исследование системы свёртывания крови) — снижен протромбиновый индекс, повышено активированное частичное тромбопластиновое время и международное нормализованное отношение (АЧТВ и МНО).
- Анализ крови на электролиты — калий повышен, натрий снижен.
- Анализ на глюкозу — уровень глюкозы в крови понижен [23] .
Инструментальная диагностика
- Электрокардиография (ЭКГ) — на кардиограмме видны изменения, характерные для высокого уровня калия в крови.
- Рентген органов грудной клетки — видны очагово-инфильтративные изменения в лёгких.
- Ультразвуковое исследование почек и надпочечников (УЗИ) — наличие кровоизлияний в надпочечники.
- Компьютерная томография или магнитно-резонансная томография (КТ или МРТ) — может проводиться при стабильном состоянии, чтобы выявить причину кровоизлияния в надпочечники, например очаг инфекции в головном мозге, грудной клетке или брюшной полости, туберкулёз, опухоли и метастазы. КТ надпочечников при инфильтративном процессе не всегда информативна [1][21] .
Дифференциальная диагностика
Синдром Уотерхауса — Фридериксена следует отличать от септического шока. Эту форму сепсиса можно предположить, если давление остаётся низким, несмотря на введение вазопрессоров [19] .
Также симптомы острой надпочечниковой недостаточности бывают схожи с гиповолемическим шоком. Эти два состояния легко спутать, особенно если нет бактериальной инфекции.
Лечение синдрома Уотерхауса — Фридериксена
При подозрении на синдром Уотерхауса — Фридериксена больного нужно немедленно госпитализировать в реанимационное отделение.
Лечение начинают сразу, не дожидаясь результатов анализов. Если пациент находится в бессознательном состоянии, устанавливают катетер для введения лекарств, мочевой катетер для выведения мочи и желудочный зонд для промывания желудка.
При острой надпочечниковой недостаточности внутривенно вводят 0,9 % -й раствор натрия хлорида или 5 % -й раствор глюкозы. В первые сутки потребуется не меньше четырёх литров жидкости. Восполнение потерянной при рвоте и диарее жидкости поможет предотвратить развитие гиповолемического шока [1] .
Лечение проводят под контролем артериального и центрального венозного давления, объёма мочи и хрипов в лёгких. Также каждые два часа проверяют уровень калия, натрия и глюкозы.
При неукротимой рвоте в начале лечения и повторно при очень низком артериальном давлении внутривенно вводят 10 % -й раствор хлорида натрия. При необходимости используют плазму крови и её заменители.
Из-за нарушенной работы надпочечников в крови повышен калий и снижен натрий. Поэтому нельзя применять диуретики, калийсодержащие и гипотонические растворы.
Чтобы заместить выработку гормонов надпочечников, вводят Гидрокортизон. Препарат применяют немедленно, а затем через каждые шесть часов. При острой надпочечниковой недостаточности используют Гидрокортизон натрия гемисукцинат, его можно вводить внутривенно и внутримышечно. Другой препарат — Гидрокортизон ацетат — действует медленнее, поэтому не подходит для неотложной помощи [1] .
Если нет Гидрокортизона, например при транспортировке пациента в специализированный стационар, можно использовать Дексаметазон или Преднизолон. Но это временное лечение, затем нужно перейти на Гидрокортизон [1] .
Гидрокортизон применяют до тех пор, пока пациент не будет выведен из коллапса и систолическое артериальное давление не повысится до 100 мм рт. ст. На 2–3-и сутки лечения при стабилизации состояния дозировку постепенно снижают.
При уменьшении дозы Гидрокортизона добавляют Флудрокортизон (Кортинефф): при низких дозах Гидрокортизон перестаёт оказывать минералокортикоидный эффект, т. е. замедлять выделение натрия и воды из организма, а также усиленно выводить калий с мочой.
При лихорадке применяют антибиотики. Исключение — лихорадка на фоне обезвоживания [1] .
Прогноз. Профилактика
Прогноз зависит от тяжести заболевания. При двухстороннем поражении надпочечников около 15 % пациентов погибает, но при своевременной диагностике и адекватном лечении даже с таким диагнозом можно выздороветь. Около половины смертей связаны с поздним обращением за медицинской помощью [9] .
Профилактика синдрому Уотерхауса — Фридериксена
Всем пациентам с заболеваниями надпочечников рекомендуется носить идентификационный браслет или кулон, где будет указан диагноз и препараты, которые нужно ввести. Также желательно иметь под рукой инъекции глюкокортикостероидов для неотложных ситуаций.
Пациентам с болезнями надпочечников нужно не реже раза в год посещать эндокринолога. Это важно для оценки адекватности дозировки заместительной гормональной терапии [20] .
Острая надпочечниковая недостаточность ( адреналовый криз ). Причины ( этиология ) надпочечниковой недостаточности. Патогенез адреналового криза.
Острая надпочечниковая недостаточность (адреналовый криз при Аддисоновой болезни) — патологический синдром, возникающий при внезапном уменьшении или прекращении секреции гормонов коры надпочечников, чаще всего на почве хронической надпочечниковой недостаточности, и клинически проявляющийся сосудистым коллапсом, резкой адинамией, постепенным нарушением сознания.
Этиология надпочечниковой недостаточности ( адреналового криза ). Декомпенсация обменных процессов у больных, возникающая в результате неадекватной заместительной терапии на фоне острых инфекций, травм, операций, смены климата, тяжелой физической нагрузки, сопровождается развитием острой формы болезни.
Аддисонический криз постоянно угрожает больным с двусторонней адреналэктомией, произведенной у больных болезнью Ицен-ко-Кушинга и других состояниях.

К заболеваниям надпочечников, при которых возможны кризы, относятся адреногенитальный синдром и изолированная недостаточность секреции альдостерона. У детей с солетеряюшей формой адреногенитального синдрома и у взрослых во время интеркуррент-ных заболеваний в экстремальных состояниях возникает острая над-почечниковая недостаточность. Ее развитие возможно при вторичной надпочечниковой недостаточности, обусловленной заболеваниями гипоталамо-гипофизарного происхождения, или вследствие экзогенного введения кортикостероидов. Вероятность надпочечнико-вого криза возрастает при гипоталамо-гипофизарной недостаточности, сопровождающейся дефицитом АКТГ и других тропных гормонов, оперативном удалении аденом гипофиза и лучевой терапии при акромегалии, болезни Иценко-Кушинга.
Синдром «отмены», протекающий как острая надпочечниковая недостаточность, возникает у больных при быстром снятии гормонов, если их длительно применяли при различных заболеваниях.
Внезапное развитие острой надпочечниковой недостаточности может произойти в результате тромбоза или эмболии вен надпочечников (синдром Уотерхауса-Фридериксена).
Патогенез надпочечниковой недостаточности ( адреналового криза ). В основе острого гипокортицизма лежит декомпенсация всех видов обмена и процессов адаптации, связанная с прекращением секреции гормонов коры надпочечников.

При заболевании, из-за отсутствия синтеза глюко- и минералокортикоидных гормонов коры надпочечников, происходит потеря ионов натрия и хлоридов с мочой и уменьшается их всасывание в кишечнике. Это сопровождается ,одновременной потерей большого количества воды. Наступает обезвоживание за счет выделения внеклеточной жидкости и вторичного перехода воды из внеклеточного пространства в клетки. В связи с резкой дегидратацией организма уменьшается объем крови, что приводит к гиповолемии и нарушению электролитного баланса.
В патогенезе острой надпочечниковой недостаточности принимает участие и нарушение обмена калия. Повышается его уровень в сыворотке крови, в межклеточной жидкости и в клетках, уменьшается выделение его с мочой. Избыток калия в сердечной мышце ведет к нарушению сократительной способности миокарда.
В условиях аддисонического криза в организме нарушается углеводный обмен: уровень сахара в крови снижается, уменьшаются запасы гликогена в печени и скелетных мышцах, повышается чувствительность к инсулину. При недостатке глюкокортикоидов снижается уровень мочевины — конечного продукта азотистого обмена.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Болезнь Иценко — Кушинга - симптомы и лечение
Что такое болезнь Иценко — Кушинга? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ворожцова Е. И., эндокринолога со стажем в 12 лет.
Над статьей доктора Ворожцова Е. И. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Болезнь Иценко — Кушинга (БИК) — тяжёлое многосистемное заболевание гипоталомо-гипофизарного происхождения, клинические проявления которого обусловлены гиперсекрецией гормонов коры надпочечников. [1] Является АКТГ-зависимой формой гиперкортицизма (заболевания, связанного с избыточным выделением гормонов корой надпочечников).
Основная причина заболевания — кортикотрофная микроаденома (доброкачественная опухоль) гипофиза. Возникновение последней может быть связано со множеством факторов. Часто заболевание развивается после травмы головного мозга, беременности, родов, нейроинфекции.
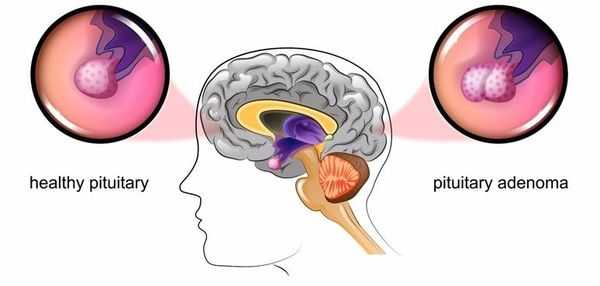
Болезнь Иценко — Кушинга является редким заболеванием, частота встречаемости которого составляет 2-3 новых случая в год на один миллион населения. [2]
Симптомы болезни Иценко — Кушинга
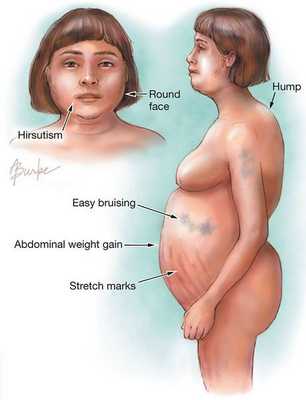
Клинические признаки данной болезни обусловлены гиперсекрецией кортикостероидов. В большинстве случаев первым клиническим признаком является ожирение, которое развивается на лице, шее, туловище и животе, при этом конечности становятся тонкими. Позднее проявляются кожные изменения — истончение кожи, трудно заживающие раны, яркие стрии (растяжки), гиперпигментация кожи, гирсутизм (избыточное появление волос на лице и теле).
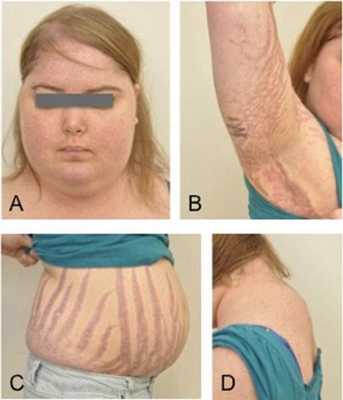
Также важным и частым симптомом является мышечная слабость, развитие остеопороза.
Артериальная гипертензия при БИК носит постоянный и умеренный характер, в редких случаях артериальное давление остаётся в норме. Это связано с тем, что глюкокортикоиды (гормоны, вырабатываемые корой надпочечников) повышают сосудистый тонус и чувствительность адренорецепторов к катехоламинам (природным веществам, контролирующим межклеточное взаимодействие в организме).
Более чем у половины больных возникают нарушения психики. Наиболее частые из них: эмоциональная неустойчивость, депрессия, раздражительность, панические атаки, расстройство сна.
Нарушения менструального цикла (редкие, скудные менструации или их отсутствие) встречается у 70-80% пациенток, также довольно часто встречается бесплодие. У мужчин при БИК снижается половое влечение и возникает эректильная дисфункция.
Болезнь Иценко — Кушинга сопровождается иммунодефицитом, который проявляется в виде рецидивирующей инфекции (чаще всего возникает хронический пиелонефрит).
Частота клинических проявлений БИК: [3]
- лунообразное лицо — 90%;
- нарушенная толерантность к глюкозе — 85%;
- абдоминальный тип ожирения и гипертензия — 80%;
- гипогонадизм (недостаток тестостерона) — 75%;
- гирсутизм — 70%;
- остеопороз и мышечная слабость — 65%;
- стрии — 60%;
- отёк суставов, акне и отложение жира в области VII шейного позвонка — 55%;
- боли в спине — 50%;
- нарушения психики — 45%;
- ухудшение заживления ран — 35%;
- полиурия (избыточное мочеобразование), полидипсия (чрезмерная жажда) — 30%;
- кифоз (искривление позвоночника) — 25%; и полицитемия (увеличение концентрации эритроцитов в крови) — 20%.
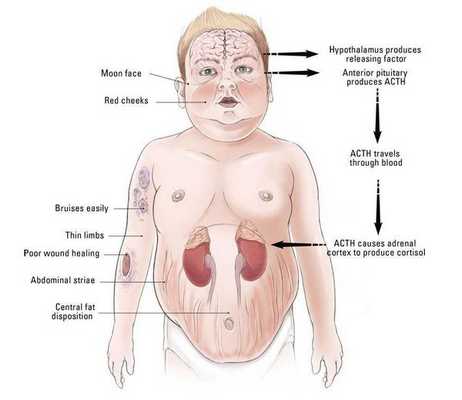
Патогенез болезни Иценко — Кушинга
Патогенез данного заболевания носит многоступенчатый характер.
В кортикотрофах гипофиза возникают характерные рецепторно-пострецепторные дефекты, в дальнейшем приводящие к трансформации нормальных кортикотрофов в опухолевые с гиперпродукцией адрено-кортикотропного гормона и последующим развитием гиперкортицизма. [4]
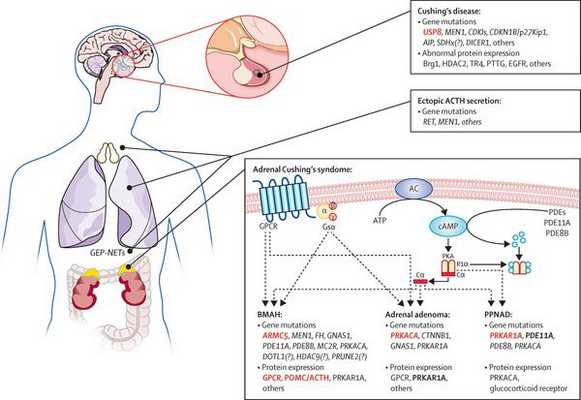
На трансформацию нормальных кортикотрофов в опухолевые влияют гормоны гипоталамуса и местные ростовые факторы:
- эпидермальный фактор роста (стимулирует рост клеток эпителия);
- цитокины (отвечают за межклеточное взаимодействие);
- грелин (нарушает углеводный обмен); [14]
- сосудистый эндотелиальный фактор роста (способствует росту клеток эндотелия).
Хронически повышенная концентрация АКТГ приводит к повышенной секреции кортизола, который и обуславливает характерную клиническую картину БИК.
Классификация и стадии развития болезни Иценко — Кушинга
Классификация БИК по степени тяжести: [5]
- лёгкая форма — симптомы выражены в умеренной степени;
- средняя форма — симптомы явно выражены, осложнения отсутствуют;
- тяжёлая форма — при наличии всех симптомов БИК возникают различные осложнения.
Классификация БИК по течению:
- торпидное (патологические изменения формируются постепенно, на протяжении 3-10 лет);
- прогрессирующее (нарастание симптомов и осложнений заболевания происходит в течение 6-12 месяцев от начала заболевания);
- циклическое (клинические проявления возникают периодически, непостоянно).
Осложнения болезни Иценко — Кушинга
- Сосудистая исердечная недостаточность. Данное осложнение развивается у половины пациентов после 40 лет. Данная патология может привести к смерти. В большинстве случаев это происходит по причине тромбоэмболии лёгочной артерии, острой сердечной недостаточности и отёка легких.
- Патологические остеопоретические переломы. Наиболее часто встречаются переломы позвоночника, рёбер, трубчатых костей.
- Хроническая почечная недостаточность. У 25-30% больных снижается клубочковая фильтрация и канальцевая реабсорбция (обратное поглощение жидкости).
- Стероидный сахарный диабет. Данное осложнение наблюдается у 10-15% пациентов с данным заболеванием.
- Атрофия мыщц, в результате которой появляется выраженная слабость. У больных возникают трудности не только при передвижении, но и в момент вставания.
- Нарушения зрения (катаракта, экзофтальм, нарушение полей зрения).
- Психические расстройства. Наиболее часто встречается бессонница, депрессия, панические атаки, параноидальные состояния, истерия.
Диагностика болезни Иценко — Кушинга
Диагноз «Болезнь Иценко — Кушинга» можно установить на основании характерных жалоб, клинических проявлений, гормонально-биохимических изменений и данных инструментальных исследований.
Исключительно важными гормональными показателями для данной патологии будут АКТГ и кортизол. Уровень АКТГ повышается и колеблется в пределах от 80 до 150 пг/мл. [7] Повышение уровня кортизола в крови не всегда является информативным, так как увеличение данного показателя может быть обусловлено рядом других причин (стрессы, алкоголизм, беременность, эндогенная депрессия, семейная резистентность (споротивляемость) к глюкокортикоидам и т. д.). В связи с этим разработаны методы исследования уровня свободного кортизола в суточной моче или слюне. Наиболее информативным является исследование свободного кортизола в слюне в 23:00. [6]
Для доказательства гиперкортицизма используется малый дексаметазоновый тест. При БИК данная проба будет отрицательной, так как подавление кортизола при приёме 1 мг дексаметазона не происходит. [7]
Биохимический анализ крови способен выявить многочиселнные измения:
- повышение в сыворотке крови уровня холестерина, хлора, натрия и глобулинов;
- снижение в крови концентрации калия, фосфатов и альбуминов;
- снижение активности щелочной фосфатазы.
После подтверждённого гиперкортицизма необходимо проведение инструментальных методов исследования (МРТ гипофиза, КТ надпочечников).
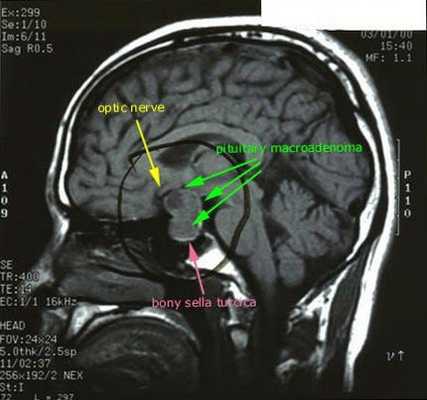
При БИК в 80-85% случаев выявляют микроаденому гипофиза (опухоль до 10 мм), у остальных 15-20% — макроаденому (доброкачественное новообразование от 10 мм). [7]
Лечение болезни Иценко — Кушинга
Медикаментозная терапия
В настоящее время эффективных лекарственных препаратов для лечения данной патологии не существует. В связи этим они используются либо при наличии противопоказаний для оперативного лечения, либо как вспомогательная терапия. Применяются следующие медикаменты:
- нейромодуляторы — блокируют образование АКТГ аденомой гипофиза (каберголин, бромкриптин, соматостатин); [8]
- препараты, блокирующие синтез стероидов в надпочечниках (кетоконазол, аминоглютетимид, митотан, метирапон);
- антагонисты глюкокортикоидов (мифепристон). [9]
Кроме препаратов данных групп пациентам назначается симптоматическая терапия для снижения симптомов гиперкортицизма и улучшения качества жизни пациента:
- гипотензивная терапия (ингибиторы АПФ, антагонисты кальция, диуретики, бета-адреноблокаторы);
- антирезорбтивная терапия при развитии стероидного остеопороза;
- препараты, корректирующие нарушения углеводного обмена (метформин, препараты сульфанилмочевины, инсулин);
- терапия, направленная на коррекцию дислипидемии;
- антиангинальная терапия.
Оперативная терапия
- Транссфеноидальная аденомэктомия в настоящее время считается наиболее эффективным и безопасным способом лечения БИК. [7] Противопоказаниями для данного вида лечения служат супраселлярный рост аденомы с прорастанием в боковые желудочки, тяжёлые сопутствующие заболевания, определяющие общий плохой послеоперационный прогноз. К осложнениям транссфеноидальной аденомэктомии относятся: ликворея (потеря спиномозговой жидкости), пансинусит (воспаление всех пазух носовой полости), несахарный диабет, приходящий гипокортицизм.
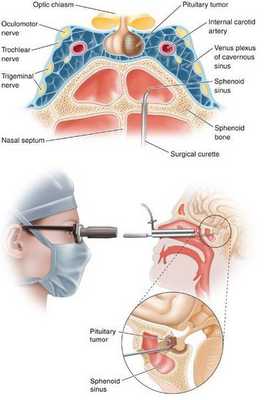
- Двусторонняя адреналэктомия используется при неэффективности аденомэктомии и радиохирургии. [10]
Радиохирургия
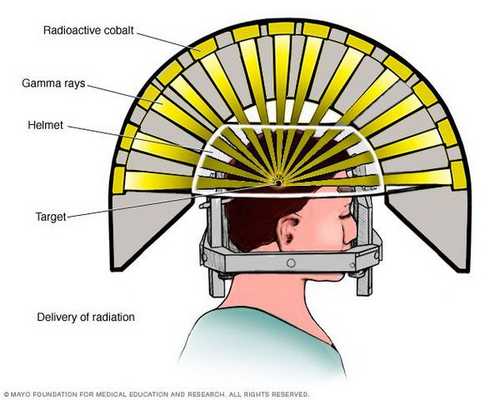
- Операция с помощью гамма-ножа. Во время проведения хирургического вмешательства луч радиации, направленный непосредственно в аденому гипофиза, разрушает её клетки. Данный метод лечения предотвращает рост опухоли при помощи однократной дозы радиации. Процедура длится около двух-трёх часов. Она не затрагивает окружающие структуры мозга, производится с точностью до 0,5 мм. Осложнения данной терапии — гиперемия (увеличение притока крови) в зоне облучения, алопеция (выпадение волос).
- Протонотерапия. [11] Данный вид лечения использует протонную энергию, которая генерируется в ядерных ускорителях. Протоны повреждают ДНК клеток, вследствие чего они погибают. Протоновый пучок фокусируют непосредственно на аденому, не повреждая окружающие ткани. Голова пациента фиксируется в специальной маске, которая изготавливается для каждого индивидуально. Во время процедуры облучения врач контролирует состояние больного, а операторы дистанционно наблюдают за пучком. Данный вид лечения обычно хорошо переносится пациентами. Улучшение самочувствия наблюдается уже через 1-1,5 месяца.
- Мегавольтное тормозное излучение медицинских ускорителей позволяет проникать электронам на большие расстояния. Данный вид терапии часто даёт хорошие результаты, но, одновременно с этим, усложняет дозиметрию (расчёты ионизирующих излучений), что может привести к опасным радиационным авариям.
Прогноз БИК зависит от нескольких показателей: формы и длительности заболевания, наличия осложнений, состояния иммунитета и других факторов.
Полное выздоровление и восстановление трудоспособности возможно при лёгкой форме болезни и небольшом стаже заболевания.
При средней и тяжёлой формах БИК трудоспособность крайне снижена или отсутствует. После проведённой двусторонней адреналэктомии развивается хроническая надпочечниковая недостаточность, которая диктует пожизненный приём глюко- и минералкортикоидов.
В целом любое лечение, как правило, приводит к улучшению качества жизни больного, однако она остаётся ниже, чем у лиц без данной патологии.
Болезнь Иценко — Кушинга — тяжёлое хроническое заболевание, которое при отсутствии своевременного лечения может стать причиной летального исхода. Смертность при данной патологии составляет 0,7%.
Пятилетняя выживаемость при БИК без проведения лечения составляет 50%, но заметно улучшается даже если проводить только паллиативное лечение (при двухсторонней адреналэктомии выживаемость увеличивается до 86%). [13]
Первичной профилактики БИК не существует. Вторичная профилактика заболевания направлена на предотвращение рецидива болезни.
Читайте также:
