Наследственные аневризмы и расслоения артерий. Врожденная извитость артерий
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Наиболее часто встречающаяся аномалия артерий головы и шеи. Эта аномалия уступает только атеросклеротическому поражению по своей распространенности. У детей с патологической извитостью ВСА выявляются фенотипические маркеры соединительнотканной дисплазии.
Существует генетическая предрасположенность к патологической извитости ВСА (внутренней сонной артерии). Патологическая извитость ВСА -это врожденная патология -ангиодисплазия с наследственной предрасположенностью.
Термин «патологическая извитость» ВСА в нашей стране распространен для обозначения клинически значимых деформаций. В мире наибольшее распространение получила — ангиографическая классификация деформаций ВСА:
Tortuosity — извитость S-, С- или волнообразной формы, без острых углов и видимых нарушений кровотока. Это гемодинамически малозначимые, чаще врожденные аномалии.
Kinking — углообразование, перегиб, гемодинамически значимые извитости.
Сoiling — петлеобразование, гемодинамически значимые и малозначимые извитости. Как петли змеи.
УЗИ сосудов шеи может выявить следующие характеристики деформаций ВСА: форму деформаций, её локализацию (проксимальная, средняя, дистальная треть ВСА), величину угла деформации-острый, тупой, прямой; а также, что наиболее важно, гемодинамическую значимость извитости.
Принято считать, что гемодинамические нарушения в зоне патологической извитости ВСА обусловлены наличием септального стеноза. Важнейшим проявлением деформации является увеличение пиковой скорости кровотока, как и при стенозе, вызванном атеросклеротическим поражением. В качестве критерия гемодинамической значимости деформации ВСА используем ускорение пиковой скорости более 150 см/сек в месте деформации. Имеются несколько объективных сложностей при попытке определить пиковую скорость.
- Сложности корректной установки допплеровского угла на участках извитого сосуда.
- Не исключены ошибки в измерении пиковой скорости даже при правильно «выставленном» угле (60 градусов и менее).
- Степень септального стеноза напрямую зависит от упруго-эластических свойств сосуда. Поэтому у детей и людей молодого возраста, имеющих эластичные артерии, не бывает высокой скорости в зоне деформации.
- Имеется понятие «играющего» угла, который возникает из-за высокого давления, которое создает кровь в месте деформации артерии.
- Винтовая геометрия деформации патологической извитости поддерживает в ней винтовой кровоток. Это снижает сопротивление потоку крови в зоне извитости — стенотический прирост скорости выражен значительно меньше.
Исходя из всего этого, корректная регистрация скорости кровотока в зоне извитости ВСА невозможна из-за вышеперечисленных проблем. Гидродинамическая сущность деформации заключается в дезорганизации кровотока. Эту дезорганизацию кровотока в месте деформации ВСА независимо от угла сканирования адекватно отражает допплерография.
Изменения гемодинамики в зоне патологической извитости- увеличение скорости кровотока на 30% и более в извитой артерии, дезорганизация потока в зоне ангуляции в виде увеличения спектрального разрешения.
Локальные нарушения гемодинамики в зоне извитости — причина нарушения кровотока в интракраниальных артериях в виде снижения скорости кровотока в средней мозговой артерии на пораженной стороне.
Важное значение при патологической извитости ВСА может иметь эмболическое поражение ветвей мозговых артерий. Тромбообразованию и церебральной эмболии способствуют турбуленция кровотока в зоне деформации ВСА, дегенеративные изменения стенки ВСА с повреждением эндотелия, дисплазия соединительной ткани с нарушением тромбоцитарного гемостаза.
Дуплексное сканирование для выявления и оценки деформаций ВСА имеет очень важное значение. Поэтому разработана классификация этой патологии. Важнейшими признаками извитости являются гемодинамическая значимость — нарушение локальной и региональной гемодинамики.
УЗ-классификация деформаций ВСА:
1. Гемодинамически значимые деформации:
- С-образная извитость с острым углом и нарушением гемодинамики;
- S-образная извитость с острым углом и нарушением гемодинамики;
- Петлеобразная извитость с нарушением гемодинамики;
- Сложная форма с острыми углами и нарушением гемодинамики.
2. Гемодинамически незначимые деформации:
- С, S, волнообразные извитости с тупыми углами без нарушения гемодинамики;
- петлеобразная извитость без нарушения гемодинамики;
- нарушение хода сосуда (непрямолинейный, волнообразный ход сосуда).
Критерии локальной гемодинамической значимости деформации ВСА:
- острый угол деформации;
- турбулентность;
- прирост пиковой скорости более чем на 30%.
Дезорганизация кровотока в зоне деформации — объективный показатель гемодинамической значимости патологической извитости ВСА. Важный показатель патологической извитости — острый угол деформации, при котором почти всегда регистрируется нарушение локальной гемодинамики.
Критерии региональной гемодинамической значимости деформации ВСА:
- асимметрия кровотока по СМА со снижением на стороне поражения на 30% и более;
- снижение цереброваскулярной СО2-реактивности.
Редкие аномалии сонных артерий — аплазия, гипоплазия, низкая или высокая бифуркация, артериовенозные мальформации, аневризмы.
ДЕФОРМАЦИИ ПОЗВОНОЧНЫХ АРТЕРИЙ
Локализуются на экстракраниальном уровне, могут приводить к нарушению кровообращения в вертебробазилярном бассейне. Также как и при деформации ВСА, задачей УЗИ является оценка локализации, формы, гемодинамической значимости. По форме деформаций ПА различают С-образные и S-образные извитости. Локальную гемодинамическую значимость оценивают, как и в ВСА. По снижению и асимметрии кровотока в V 4-сегменте ПА оценивают региональную значимость.
ЭКСТРАВАЗАЛЬНОЕ ВОЗДЕЙСТВИЕ НА ПА
Возникает при патологии шейного отдела позвоночника. Это краниовертебральные аномалии, дисфиксационные нарушения, посттравматические деформации позвоночника, остеохондроз шейного отдела позвоночника. Эти процессы вызывают непосредственное сдавление ПА.
УЗИ-признаки экстравазального воздействия на ПА: локальное ускорение кровотока в месте компрессии, неравномерное положение поперечных отростков шейного отдела позвоночника. Доказательством экстравазального воздействия на ПА является положительная поворотная проба, при которой в сегменте V4 при интракраниальном исследовании происходит снижение скорости кровотока более 30%.
При гипоплазии ПА регистрируется высокорезистентный низкоскоростной спектр кровотока. А при спазме ПА, обусловленным экстравазальным воздействием на неё, нормальный спектр кровотока.
Часто встречается высокое впадение артерии в канал поперечных отростков С4-С5 и выше.
Наследственные аневризмы и расслоения артерий. Врожденная извитость артерий
Наследственные аневризмы и расслоения артерий. Врожденная извитость артерий
В большом количество описаны родословные, где такие заболевания, как расширение корня аорты, аневризма брюшной аорты, расслоение стенок аорты без ее расширения или сочетание этих проявлений, наследуются по аутосомно-доминантному чипу без признаков дисплазии соединительной ткани.
В силу значительной вариабельности и естественного хода развития заболеваний аорты необходимость выявления возможных гетерозигот при отсутствии у них симптомов заболевания весьма сомнительна, как и подтверждение повышенного риска у родственников, находящихся в репродуктивном периоде и не желающих пропустить подобное заболевание у своих детей.
Сочетание расслоения восходящей аорты с двухстворчатым аортальным клапаном и коарктацией аорты — хорошо изученная патология, хотя, за исключением редких семейных случаев, патогенетические механизмы остаются нераскрытыми. При врожденном двухстворчатом аортальном клапане в стенке проксимальных участков аорты обнаруживают аномалии эластических волокон и микрофибрилл.
Все лица с врожденным двухстворчатым аортальным клапаном или коарктацией аорты должны быть обязательно обследованы для определения расширения корня аорты, а их родственники первой линии — на наличие поражения обоих видов. Такие рекомендации частично базируются на данных, что наличие двухстворчатого аортального клапана является врожденным пороком в виде леводоминирующего кровообращения с относительно высоким риском развития патологии у братьев, сестер и потомков пробанда.
В нескольких семьях аутосомно-доминантное наследование двухстворчатого аортального клапана ассоциировалось с мутацией гена NOTCH1.
В двух семьях с аутосомно-доминантным типом наследования артериальной аневризмы и незначительно повышенной хрупкости кожи со склонностью к кровоподтекам были обнаружены различные мутации в гене, кодирующем проколлаген типа III. Таким образом, в зависимости от мутации дефицит коллагена типа III вызывает либо сосудистую форму синдрома Ehlers-Danlos, либо наследственно-обусловленные разрывы артерий — форм, намного менее выраженную, но столь же драматичную по летальному исходу.
В семьях, где обнаружены мутации, целесообразно проводить доклиническую и пренатальную диагностику. Однако предположения о том, что большинство случаев аневризмы аорты, включая аневризмы брюшной аорты у пожилых, можно объяснить мутациями гена коллагена типа III, необоснованны.
Широко обследованы семьи с аневризмой, расслоением или обеими патологиями грудной аорты; обнаруженные фенотипы связывают с пятью локусами: 3р25-р24.2, 5ql.3-ql4, 9q33-q34, 11q23.3-q24 и 6pl3.13-pl.3-12. За семейные заболевания, сцепленные с локусом Зр. ответственны мутации в гене TGFBR2, по у одного больного была обнаружена мутация в гене TGFBR1 (9q33-q34). Мутации гена MYH11, кодирующего тяжелую цепь миозина на коротком плече хромосомы 16, вызывает расслоение восходящей аорты, ассоциированное с ОАП.
Показано, что предрасположенность к расслоению стенки шейных артерии у молодых людей в ряде семей ассоциируется с лентигинозом, наследуемым предположительно по аутосомно-рецессивному типу (лентигиноз, или лентикулярный генерализованный меланоз, — это дерматоз неизвестной этиологии, характери зующийся высыпанием пятен ленттиго по всему кожному покрову). Обнаружена связь между расслоением шейных артерий и внутричерепными кровоизлияниями, особенно при наличии врожденных дефектов ССС, в частности при двухстворчатом аортальном клапане или коарктации аорты.
Результаты формального генетического анализа, проведенного в 91 семье, где иробандом служил больной с аневризмой брюшной аорты, позволяют думать о наличии предрасположенности к аутосомпо-рецессинному наследованию поздних аневризм. Результаты этого и других исследовании служат обоснованием для необходимости скринирующего УЗИ среди близких родственников больных С расширением брюшной аорты.
Врожденная извитость артерий
Это аутосомно-рецессивное заболевание с похожими на инсульт эпизодами и наличием сильно извитых экстрацеребральных и интрацеребральных артерий, периферического легочного стеноза обычно диагностируют среди младенцев. Однако это заболевание находят не только у маленьких детей. Недавно у некоторых взрослых была выявлена выраженная изнитость различных артерий эластического и мышечного типов, зачастую с минимальной симптоматикой.
Основной дефект связан с геном GLUT10, кодирующим глюкозный транспортер ядерной мембраны. Полагают, что патогенетический механизм заключается в нарушении регуляции белков внеклеточного матрикса, которые контролируют экспрессию TGF-бета. Иными словами, этот синдром в некоторой степени связан с нарушениями, обусловленными мутациями генов рецепторов TGF-бета.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Аневризма и расслоение аорты
Аневризма аорты – локальное патологическое увеличение ее диаметра. Расслоение аорты – неполный разрыв или надрыв внутренней выстилки (эндотелия), после чего кровь под высоким давлением начинает распространяться между слоями стенки аорты, расслаивая ее. Очень часто эти две патологии тесно связаны, в таком случае говорят о расслаивающей аневризме.
Причины
Основная причина возникновения аневризмы и расслоения аорты – патология ее стенки на фоне атеросклеротического поражения. К сожалению, серьезность этой проблемы иногда недооценивается, что может быть связано с длительным отсутствием симптомов заболевания. Так как просвет аорты очень велик, то перекрытие ее атеросклеротической бляшкой невозможно, а вот деформация аорты, нарушение ее эластической функции (аорта пульсирует подобно другим артериям, но только сильнее) и окклюзия отходящих от аорты ветвей – очень тяжелые последствия атеросклероза со своими осложнениями в виде аневризмы и расслоения.
Длительные, в течение многих лет, большие и резкие перепады артериального давления также негативно отражаются на состоянии аорты, способствуя повреждению ее внутреннего слоя с последующим расслоением и образованием аневризмы.
Таким образом, атеросклеротическое поражение и артериальная гипертензия – наиболее распространенные факторы дестабилизации аортальной стенки.
Значительно реже аневризма и расслоение аорты возникают на фоне деструктивных инфекционных процессов как в самой аорте, так и в окружающих ее тканях и органах (например, гнойный медиастинит), при сифилисе, врожденных пороках развития аорты, травмах груди и брюшной полости, генетических заболеваниях (синдром Марфана).
Симптомы аневризмы и расслоения аорты
Аневризмы аорты, которые появились в результате врожденной, наследственной или перенесенной патологии и не связаны с расслоением сосудистой стенки, в большинстве случаев не имеют явных клинических признаков и представляют собой случайную находку.
Аневризмы больших размеров могут сопровождаться чувством распирания, тупой боли в спине, могут возникать симптомы сдавления соседних органов.
Более яркую и характерную клиническую картину имеет расслаивающая аневризма аорты. В момент надрыва внутренней аортальной стенки возникает резкая боль в груди, спине или пояснице (в зависимости от локализации повреждения). Эта боль кратковременная, но может вызвать рефлекторное падение артериального давления и обморок.
Спустя некоторое время пациента начинает беспокоить жгучая боль в груди с распространением на руки, шею, под лопатки, эта боль не снимется нитроглицерином, появляется сухой кашель, чувство нехватки кислорода, падает артериальное давление, возникает коллапс.
Если расслоение произошло в нижних отделах аорты, то боль отмечается в пояснице с иррадиацией в малый таз и ноги. Если расслоение затрагивает устья отходящих от аорты ветвей, наблюдаются симптомы нарушения кровообращения в соответствующих органах.
Обычно на этом этапе пациенты госпитализируются и подлежат экстренному оперативному вмешательству.
В случае полного разрыва стенки аорты – возникает массивное кровотечение и терминальный шок. К сожалению более 90% таких пациентов погибает.

Диагностика
Расслоение начальных отделов аорты может быть определено при помощи трансторакальной или чреспищеводной ЭХО-КГ.
Одним из наиболее достоверных методов диагностики всей аорты является аортография. Этот метод в режиме реального времени позволяет увидеть дефекты стенок аорты, образовавшийся в результате расслоения вторичный просвет и полость аневризмы. Если же место надрыва закрылось тромбом, то аортография может дать ложноотрицательный результат.
Этот недостаток может быть устранен после выполнения компьютерной томографии с контрастированием сосудов, которую можно выполнить в К+31.
Лечение аневризмы и расслоения аорты
За аневризмой малого размера, которая не беспокоит пациента, достаточно наблюдать. Большие аневризмы подлежат плановому удалению с последующей пластикой аорты.
В случае расслаивающей аневризмы аорты пациенту с обезболивающей целью вводится морфин для профилактики болевого шока и выполняется экстренное оперативное лечение, которое обычно заключается в иссечении пораженного участка аорты и установке на его место синтетического сосудистого протеза.
После подобных тяжелых операций Клиника К+31 помогает пройти курс реабилитационного лечения. Мы держим в фокусе здоровье, предлагаем пациентам свое активное участие в профилактике повторного расслоения аорты и возникновения аневризм.
Наследственные аневризмы и расслоения артерий. Врожденная извитость артерий
Московский областной научно-исследовательский клинический институт
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Церебральная сосудистая патология при наследственной дисплазии соединительной ткани
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(5): 94‑97
Сидорова О.П., Котов С.В., Поплавская Н.М. Церебральная сосудистая патология при наследственной дисплазии соединительной ткани. Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(5):94‑97.
Sidorova OP, Kotov SV, Poplavskaia NM. Cerebral vascular pathology in hereditary dysplasia of the connective tissue. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2012;112(5):94‑97. (In Russ.).
Московский областной научно-исследовательский клинический институт
Московский областной научно-исследовательский клинический институт
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Патология сосудов (аневризмы и другие нарушения) описана при наследственной патологии соединительной ткани [9, 13, 14]. Группа заболеваний, относящихся к наследственной дисплазии соединительной ткани, — это гетерогенная группа моногенных болезней, которые обусловлены наличием мутации в генах белков внеклеточного матрикса или ферментов их биосинтеза, а также в генах, которые участвуют в регуляции морфогенеза соединительной ткани.
Соединительная ткань распространена в организме и является основой для костно-суставной, сердечно-сосудистой систем, кожи и фасций, связочного аппарата, органа зрения. Этим объясняется полисистемность поражения при синдроме Марфана и другой наследственной патологии соединительной ткани. Структурную целостность соединительной ткани поддерживают коллагены, которые представлены большим семейством близкородственных внеклеточных матриксных белков, составляющих более 30% общей массы белков тела млекопитающих. Коллагены представляют собой семейство структурных белков экстраклеточного матрикса соединительной ткани и являются преобладающим компонентом экстраклеточного матрикса кожи, сухожилий, костной, хрящевой ткани, стромы паренхиматозных органов, базальных мембран, стенок кишечника, кровеносных сосудов. Известно 27 типов коллагеновых белков. Первичная структура фибриллярных коллагеновых белков представлена повторяющейся аминокислотной последовательностью вида (Gly-X-Y), в которой X-позицию занимает пролин, Y-позицию — чаще всего гидроксипролин или гидроксилизин, каждой третьей аминокислотой является глицин. Аминокислотные цепи подвергаются различным преобразованиям в эндоплазматическом ретикулуме — процессингу. В результате этого образуется молекула белка, состоящая из трех длинных левозакрученных спиралей, которые сплетены в виде длинного каната. Спираль в составе «тройного каната» — это мономер, или альфа-цепь. Три скрученные полипептидные альфа-цепи образуют структуру, напоминающую трехгранный шнур. Коллагены могут быть образованы тремя одинаковыми альфа-цепями, двумя или тремя различными полипептидами в соотношении 2:1 или 1:1:1 соответственно [5]. Каждая альфа-цепь кодируется отдельным геном, что приводит к большему разнообразию генов, чем соответствующих белков. Разделяют фибриллярные коллагены, их супрамолекулярной структурой являются фибриллы (типы I, III, V), и нефибриллярные коллагены, для каждого их типа характерна индивидуальная супрамолекулярная структура в связи с присутствием глобулярных участков — неколлагеновых доменов. В разных тканях присутствуют различные типы коллагенов [5]. До 90% всех коллагеновых белков составляют коллагены I и III типов. Коллаген I типа — самый распространенный в организме человека, более всего представлен в фиброзных тканях (сухожилия, фасции, связки, строма органов), в коже, костях, артериях. Основным компонентом стенок сосудов и кишечника является эмбриональный коллаген III типа. Каркас внутри фибрилл образует коллаген V типа. В эндотелии сосудов и роговицы обнаружены коллагены VIII и XVIII типов, они регулируют неоваскуляризацию и образование мембраны Десцемета. Остальные коллагены способствуют взаимодействию мажорных коллагенов I и II типов с другими белками внеклеточного матрикса.
Открыто около 40 коллагеновых генов и расшифрована их молекулярная природа. Известно около 70 моногенных заболеваний — наследственных коллагенопатий.
К таким заболеваниям относят синдром Марфана, синдром Элерса—Данло, недифференцированную дисплазию соединительной ткани. Наследственные заболевания соединительной ткани делят на дифференцированные и недифференцированные соединительнотканные дисплазии [4, 6, 15]. К дифференцированным дисплазиям соединительной ткани относят синдромы Марфана и Элерса—Данло. Эти заболевания имеют определенный тип наследования с хорошо изученными генными и биохимическими дефектами. Так, при синдроме Элерса—Данло выявлена патология, по крайней мере, трех типов коллагена — COL I, COL III и COL V [27, 29, 32]. При гистологическом исследовании тканей больных синдромом Элерса—Данло выявлено изменение толщины и плотности фибрилл [35], нарушение их формы [37], изменение агрегации фибрилл в пучки из-за уменьшения числа поперечных связей, фрагментации волокон, снижения числа пучков волокон [21].
Синдром Марфана представляет собой аутосомно-доминантную патологию соединительной ткани с мутацией в гене фибриллина — эластического компонента соединительной ткани [16, 23, 33]. При этом заболевании нарушен синтез микрофибриллярных волокон в стенках сосудов и других органов. Отмечается поражение 6 систем — аномалии скелета, органа зрения, сердечно-сосудистой системы, легких, кожи, твердой мозговой оболочки [24, 30]. Имеются отдельные описания аневризмы сосудов головного мозга при синдроме Марфана, но нет данных о частоте встречаемости этого синдрома при аневризмах головного мозга [36]. Также отмечаются спонтанные диссекции сонных артерий.
MASS-фенотип напоминает синдром Марфана, но отсутствует поражение глаз. MASS-фенотип включает: пролапс митрального клапана — М (mitral); расширение аорты — диаметр на верхней границы нормы, нет прогрессирования с развитием аневризмы или диссекции — А (aorta); стрии на коже — S (skin); изменение скелета, как при синдроме Марфана (сколиоз, деформация грудной клетки, гипермобильность суставов) — S (skeletal). Тип наследования аутосомно-доминантный.
Синдром Элерса—Данло представляет собой гетерогенную группу заболеваний соединительной ткани, характеризующихся гиперэластичностью кожи, гипермобильностью суставов и другими симптомами, обусловленными слабостью соединительной ткани. Данные о частоте встречаемости синдрома Элерса—Данло значительно варьируют — от 1:560 000 до 1:5000 [34]. Некоторые авторы считают, что этот синдром является наиболее распространенным наследственным заболеванием соединительной ткани [22]. Синдром Элерса—Данло обнаруживается с рождения или в дошкольном возрасте, с возрастом выраженность его может уменьшаться. Основное проявление синдрома — повышенная растяжимость, гиперэластичность кожи: взятая в складку кожа легко оттягивается на несколько сантиметров, а затем быстро возвращается в исходное положение. Повышенная растяжимость свойственна и слизистым оболочкам: некоторые больные легко достают нос кончиком языка. Отмечаются легкая ранимость кожи (даже при минимальной травме возможны разрывы ткани, которые медленно заживают, оставляя после себя келлоидные рубцы), повышенная подвижность и разболтанность суставов, иногда легкая ранимость артерий с возникновением кровотечений, возможно образование кальцифицированных подкожных узелков и псевдоопухолей, конгломерата разрушенных соединительнотканных структур и организующихся гематом. Патологическая подвижность суставов проявляется вывихами и подвывихам. Повторные подвывихи наиболее часто встречаются в плечевых, нижнечелюстных суставах и надколенниках. Встречаются также хронические артралгии без признаков воспаления суставов. Отмечаются сколиоз, кифоз, их сочетание, а также плоскостопие. Часто отмечается нарушение прочности тканей внутренних органов. Характерны грыжи, опущение внутренних органов (выпадение прямой кишки у маленьких детей, гениталий — у женщин). У женщин бывают преждевременный разрыв плодных оболочек, преждевременные роды и послеродовые кровотечения.
Выделяют 10 типов синдрома Элерса—Данло. Классификация основана на типе наследования, молекулярном дефекте и клинических проявлениях. Критерии диагностики синдрома включают определение степени гипермобильности суставов [18—20, 26] и наличия других признаков слабости соединительной ткани [1, 2].
Сосудистые осложнения при синдроме Элерса—Данло возникают при поражении различных артерий, в том числе и церебральных [8, 17, 18]. Диагностируются каротидно-кавернозные фистулы. Описаны также аневризмы. В половине случаев происходит их разрыв. Частота внутричерепных кровоизлияний у таких больных составляет около 4% [22]. Частым осложнением у больных синдромом Элерса—Данло является расслоение экстра- или интракраниального сегментов позвоночных артерий [25, 38, 39]. У больных синдромом Элерса—Данло чаще, чем в популяции, отмечаются аневризмы сосудов головного мозга, что обусловлено структурными изменениями сосудистой стенки. Данная патология является причиной инсульта у молодых пациентов. Средний возраст разрыва интракраниальной аневризмы, спонтанной фистулы каротидно-кавернозного синуса, аневризмы цервикальной артерии — 28 лет [31].
Недифференцированная дисплазия соединительной ткани диагностируется в тех случаях, когда набор фенотипических признаков не укладывается ни в одно из дифференцированных заболеваний [3, 4, 10].
У больных с наследственной патологией соединительной ткани также описано нарушение реологических свойств крови. А.В. Суворова [12] описала вызванную коллагеном активацию тромбоцитов. В.Г. Стуров и соавт. [11] выявили в крови у детей с дисплазией соединительной ткани снижение уровня белка фибронектина, который участвует в адгезии тромбоцитов к эластину.
Е. Lebedeva и соавт. [28] изучили встречаемость различных признаков соединительнотканной недостаточности у 199 больных с внутричерепной аневризмой в сравнении со 194 лицами контрольной группы. Авторы установили достоверное повышение частоты встречаемости признаков слабости соединительной ткани у больных по сравнению со здоровыми исследуемыми. Показано, что системная дисплазия соединительной ткани является фактором риска развития внутричерепной аневризмы.
М.А. Лобов и соавт. [7] опубликовали данные скринингового обследования детей с мигренью и мигренеподобной головной болью. Целью этого обследования были установление частоты встречаемости патологической извитости внутренней сонной артерии и диагностика наследственных заболеваний соединительной ткани у больных с выявленной сосудистой патологией. Всего дуплексное сканирование брахиоцефальных артерий было проведено 236 детям. В 29,2% случаев выявлена патологическая извитость внутренней сонной артерии. Из них в 21,8% случаев диагностирован синдром Элерса—Данло, в 37,5% — недифференцированная дисплазия соединительной ткани. Обследование на предмет выявления синдромов дисплазии соединительной ткани проведено только больным с выявленной патологической извитостью прецеребральных сосудов. Высокий процент выявления наследственной синдромальной патологии связан с избирательностью исследуемой группы. В остальных случаях у большинства обследованных детей были определены различные признаки слабости соединительной ткани, выраженные не так значительно, как при наследственной синдромальной патологии. В семейных случаях был проведен сегрегационный анализ. Выявлено соответствие аутосомно-доминантной модели наследования, не исключена роль главного гена при мультифакториальном наследовании.
Д.Х. Хайбуллина [14] изучала распространенность различных проявлений слабости соединительной ткани у больных с инсультом. Были обследованы 100 пациентов в возрасте от 35 до 70 лет, из них у 67% был диагностирован ишемический инсульт, у 33% — геморрагический. В данной публикации не анализировали наличие артериальной гипертонии, атеросклероза и других частых факторов риска инсульта. Всем больным проводили транскраниальную допплерографию и дуплексное сканирование магистральных сосудов головы и шеи. Три и более признака слабости соединительной ткани было выявлено у 57,5% больных с ишемическим и у 34,3% — с геморрагическим инсультом. У 16 пациентов диагностирована наследственная синдромальная патология: синдром Марфана — у 3, элерсоподобный фенотип — у 1, синдром гипермобильности — у 7, MASS-фенотип — в 5 случаях. Признаки «ангиодисплазии» (без описания конкретных их проявлений) были выявлены у 82,7% больных с признаками соединительнотканной недостаточности. Ангиодисплазия без других признаков слабости соединительной ткани определена у 21,4% больных. Степень инвалидизации после инсульта у пациентов с признаками слабости соединительной ткани была выше, чем у больных, этих признаков не имеющих.
А.В. Суворова и соавт. [13] изучали встречаемость цереброваскулярной патологии у 372 детей с дисплазиями соединительной ткани. Наибольшую группу составили пациенты с недифференцированной дисплазией соединительной ткани (318 пациентов), синдром Марфана был диагностирован у 18 больных, несовершенный остеогенез — у 12, синдром Элерса—Данло — у 11, диспластический сколиоз — у 10, болезнь Рандю-Ослера — у 3. В 352 (94,6%) случаях выявлена патологическая извитость прецеребральных артерий, основными клиническими проявлениями которой были симптомы цереброваскулярной недостаточности. При петлеобразной патологической извитости внутренней сонной артерии у ряда больных развивались острые нарушения мозгового кровообращения. У 19,5% обследованных также отмечались эпилептические припадки.
Было проведено исследование вклада патологической извитости прецеребральных артерий в развитие ишемического инсульта у взрослых пациентов [9, 10]. При проведении дуплексного сканирования брахиоцефальных артерий в 47% случаев была выявлена патологическая извитость прецеребральных артерий. Среди больных с патологической извитостью внутренней сонной артерии значительно преобладали женщины. Наиболее часто отмечалась гемодинамически значимая патологическая извитость сосудов по вариантам кинкинга (перегиба артерии с образованием острого угла) или койлинга (петлеобразования). На предмет выявления дисплазии соединительной ткани были обследованы 25 больных с патологической извитостью прецеребральных артерий. Среди них у 4 пациентов выявлены случаи наследственной синдромальной патологии соединительной ткани, а в целом по группе та или иная степень выраженности поражения соединительной ткани определялась у трети больных. У остальных обследованных взрослых пациентов причиной выявленной патологической извитости артерий, по-видимому, была не врожденная патология, а приобретенные сосудистые заболевания (артериальная гипертония, атеросклероз).
Таким образом, наследственно обусловленная патология соединительной ткани вносит вклад в развитие церебральной сосудистой патологии наряду с широко известными факторами риска, такими как артериальная гипертония. Выявление больных с данной патологией и проведение профилактических мероприятий для предупреждения неврологических осложнений является актуальным.
Аневризмы брюшного отдела аорты (АБОА)
Диаметр брюшной аорты ≥ 3 см обычно свидетельствует о наличии аневризмы брюшной аорты. Причина многофакторная, но часто присутствует атеросклероз. Большинство аневризм растут медленно (~10% в год), не вызывая симптомов, при этом большинство из них обнаруживают случайно. Риск разрыва пропорционален размеру аневризмы. Диагноз устанавливается по результатам ультрасонографии или КТ-сканирования. Лечением является хирургическое вмешательство или эндоваскулярная имплантация стент-графта.
Этиология аневризмов брюшного отдела аорты
Причины возникновения аневризм брюшной аорты многофакторные, но обычно это происходит вследствие ослабления артериальной стенки, что связано, как правило, с атеросклерозом Атеросклероз Атеросклероз характеризуется образованием неоднородных бляшек (атером) в интиме средних и крупных артерий; бляшки содержат липиды, воспалительные клетки, гладкомышечные клетки и соединительную. Прочитайте дополнительные сведенияНаименее редкими причинами, приводящими к истончению артериальной стенки и формированию инфекционных (микотических) аневризм, служат сифилис и ограниченная бактериальная или грибковая инфекция вследствие сепсиса или инфекционного эндокардита Инфекционный эндокардит Инфекционный эндокардит (ИЭ) – инфекция эндокарда, обычно бактериальная (чаще стрептококковая или стафилококковая) либо грибковая. Он может проявляться лихорадкой, шумами в сердце, петехиями. Прочитайте дополнительные сведения Staphylococcus aureus является причиной микотических аневризм номер один, за ним следует Salmonella.
Факторы риска
Факторы риска аневризм брюшной аорты включают:
Курение (наиболее значимый фактор риска)
Пожилой возраст (пик заболеваемости в возрасте от 70 до 80 лет)
Семейную историю (от 15 до 25%)
Расовая принадлежность (чаще встречается у белых, чем у темнокожих)
Симптомы и признаки аневризм брюшной аорты
Большинство аневризм брюшной аорты бессимптомны. Симптомы и признаки, если они возникают, могут быть неспецифическими, но обычно являются результатом компрессии соседних структур. По мере расширения, АБА может вызывать болевой синдром, который имеет постоянный, ноющий, надоедливый и висцеральный характер, и локализируется преимущественно в пояснично-крестцовой области. Пациенты могут отмечать видимую брюшную пульсацию. Хотя большинство аневризм растут медленно и бессимптомно, быстро увеличивающиеся аневризмы, которые близки к разрыву, могут давать болезненные ощущения.
В некоторых случаях в зависимости от размеров аневризм и конституции пациента может пальпироваться пульсирующее образование. Вероятность того, что у пациента с пульсирующим образованием есть аневризма более 3 см, составляет около 40% (положительная прогностическая значимость). Кроме того над аневризмой может выслушиваться систолический шум.
Иногда пациенты с скрытыми АБОА обращаются с симптомами, связанными с осложнениями или с причиной (например, лихорадка, недомогание или снижение массы тела из-за инфекционного процесса или васкулита).
Осложнения
Основные осложнения аневризм брюшной аорты включают
Разрыв с большей вероятностью может возникнуть в области левой заднелатеральной стенки на 2–4 см ниже почечных артерий. При разрыве АБА большинство пациентов умирает еще до поступления в медицинское учреждение. Если разрыв АБА не сопровождался мгновенным летальным исходом, пациент предъявляет жалобы на боли в животе или спине, сопровождающиеся гипотонией и тахикардией. В анамнезе могут быть указания на недавнюю травму верхних отделов живота. Даже среди пациентов, которые все же попадают в больницу, смертность составляет около 50%.
Дистальная эмболизация тромбом или атероматозным веществом может сдвигать и блокировать артерии нижних конечностей, почек и кишечника. Пациенты, как правило, испытывают внезапную одностороннюю боль в конечностях и часто бледность и потерю пульса (см. Также Острая периферическая артериальная окклюзия (Acute Peripheral Arterial Occlusion) Острая окклюзия периферических артерий Острая окклюзия периферической артерии может произойти вследствие тромбоза, эмболии, расслоения аорты или острого компартмент-синдрома. Острая окклюзия периферических артерий может возникать. Прочитайте дополнительные сведенияДиагностика аневризмы брюшного отдела аорты
Выявляется чаще всего случайно
Подтверждение при проведении компьютерной томографии или ультразвукового исследования органов брюшной полости
Иногда по результатам КТ ангиографии или магнитно-резонансной ангиографии
Большинство аневризм брюшной аорты диагностируются случайно во время объективного осмотра, а также при проведении УЗИ брюшной полости, КТ или МРТ, выполнявшихся по другим причинам. У пациентов пожилого возраста с жалобами на острые боли в животе или спине необходимо исключать АБА независимо от наличия или отсутствия пульсирующего образования.
Этот пациент имеет аневризму брюшной аорты размером 3,4 см (между белыми крестами), наблюдаются также атеросклеротическая бляшка или пристеночный тромб (красная стрелка).
© 2017 Elliot K. Фишман (Fishman), врач
Белая стрелка показывает аневризму брюшной аорты размером 5 см с неоднородным потоком и пристеночной бляшкой.
© 2017 Elliot K. Фишман (Fishman), врач
Белая стрелка указывает на надпочечниковую псевдоаневризму брюшной аорты. А также массивные бляшки инфраренальной аорты и подвздошных артерий.
© 2017 Elliot K. Фишман (Fishman), врач
В тех случаях, когда симптоматика или объективный осмотр позволяет заподозрить АБА, для верификции диагноза выполняют дообследование: УЗИ или КТ брюшной полости, которые являются основными методами диагностики. Симптомные пациенты должны в кратчайшие сроки выполнить дополнительные методы обследования в целях предотвращения разрыва аорты. У гемодинамически нестабильных пациентов с подозрением на разрыв аорты УЗИ проводят в кратчайшие сроки у кровати пациента, однако известно, что вздутие живота и кишечные газы могут затруднить диагностику данной патологии.
Лабораторные исследования, включая полный анализ крови (ОАК), тесты на электролиты, азот мочевины крови (АМК), креатинин, протромбиновое время (ПВ), частичное тромбопластиновое время (ЧПВ), а также тип крови и перекрестное совпадение, проводятся в рамках подготовки к возможной операции.
Если нет подозрений на разрыв аневризмы, для более точной характеристики размеров аневризмы и ее анатомических особенностей выполняется КТ-ангиография или МР-ангиография. При наличии пристеночных тромбов в аневризме стандартная ангиография может недооценить ее настоящие размеры; КТ может обеспечить более точную оценку При подозрении на вовлечение в процесс почечных артерий или аорто-подвздошной области и перед эндоваскулярной имплантацией стент-графта иногда необходимо провести аортографию.
Обзорная рентгенография брюшной полости имеет низкую специфичность и чувствительность, однако полученная с целью другой диагностики, позволяет тем не менее диагностировать кальцификацию аорты вдоль стенки аневризмы.
При подозрении на грибковую этиологию аневризмы необходимо выполнение бактериологических посевов крови.
Лечение аневризмов брюшного отдела аорты
Консервативное лечение, особенно контроль артериального давления и прекращение курения
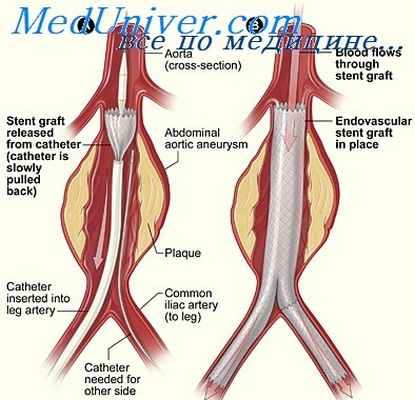
Общепринятыми методами является хирургическое лечение или эндоваскулярная имплантация стент-графта
Некоторые аневризмы брюшной аорты увеличиваются со скоростью 10% в год. Увеличение часто происходит поэтапно с периодами отсутствия роста. Другие аневризмы увеличиваются скачкообразно, а около 20% АБА не меняют свой размер продолжительное время.
Необходимость хирургического лечения соотносится с размером аневризмы, который предопределяет риск разрыва (см. таблицу Размер аневризмы брюшного отдела аорты и риск разрыва Размер аневризмы брюшного отдела аорты и риск разрыва* ). Плановое хирургическое лечение является методом выбора при аневризмах > 5,0–5,5 см.
Разрыв аневризм брюшного отдела аорты является показанием к незамедлительному открытому хирургическому вмешательству или эндоваскулярной имплантации стент-графта. Без лечения летальность приближается к 100%. В случае выполнения хирургического вмешательства смертность составляет около 50%. Смертность при эндоваскулярной имплантации стента в целом ниже (от 20 до 30%). Причинами высокой смертности служит сопутствующий коронарный, цереброваскулярный и периферический атеросклероз.
Пациентам, которые поступают в состоянии геморрагического шока необходимо проведение жидкостной ресусцитации Инфузионные растворы Почти все шоковые состояния кровообращения требуют большого объема жидкости так же, как и тяжелое обезвоживание внутрисосудистого русла (например, из-за диареи или теплового удара). Дефицит. Прочитайте дополнительные сведения и переливание крови, но среднее артериальное давление не должно превышать > 70–80 мм рт.ст. (пермиссивная гипотензия), в связи с риском усиления кровотечения. Важное значение имеют предоперационный контроль и предотвращение гипертензии.
Здравый смысл и предостережения
Если у пациента с гипотонией произошёл разрыв аневризмы брюшной аорты, не поднимайте среднее артериальное давление > 70-80 мм рт.ст., потому что может увеличиться кровотечение.
Плановая хирургическая реконструкция рекомендована при
Аневризмах > 5 см у женщин и > 5,5 см у мужчин (когда риск разрыва увеличивается до > 5–10% в год), кроме наличия сопутствующих заболеваний, которые являются противопоказанием для хирургического вмешательства
Дополнительные показания для планового хирургического вмешательства включают
Увеличение размера аневризмы на > 0,5 см на протяжении 6 месяцев независимо от размера
Хроническая боль в животе
Аневризмы подвздошной или бедренной артерий, вызывающие ишемию нижних конечностей
Перед плановым оперативным лечением часто необходимо клиническое рассмотрение вероятности ишемической болезни сердца (ИБС) и необходимости дальнейшего обследования (см. таблицу Исследования, используемые для уточнения анатомических особенностей и функции сердца Исследования, используемые для уточнения анатомических особенностей и функции сердца ), потому что некоторые пациенты с АБА имеют значительные риски сердечно-сосудистых осложнений. Существенными являются агрессивная консервативная терапия и контроль факторов риска. Рутинно коронарная ангиопластика или коронарное шунтирование не должны выполнятся перед хирургическим или эндоваскулярным лечением аневризмы; реваскуляризация венечных артерий должна учитываться только у пациентов с нестабильной ИБС.
Хирургическое лечение состоит в замене аневризматической части брюшной аорты на синтетический графт. Если вовлечены подвздошные артерии графт должен быть установлен и в них. При аорто-бифеморальной реконструкции важно обеспечить поток по крайней мере по одной внутренней подвздошной артерии (гипогастральной артерии), чтобы избежать васкулогенной эректильной дисфункции и ишемии органов таза. Если аневризма располагается над почечными артериями, они должны быть имплантированы в графт либо должны быть созданы анастамозы.
Эндоваскулярная имплантация стент-графта в просвет аневризмы через бедренную артерию является альтернативным и менее инвазивным методом лечения, который имеет меньшую частоту возникновения заболеваний и смертей, чем при открытой операции. Эта процедура исключает аневризму из системного кровотока и уменьшает риск разрыва. С течением времени аневризма тромбируется, а 50% из них в последующем уменьшается в размерах. Краткосрочные результаты данного метода хорошие, а долгосрочные результаты благоприятные. Возможны осложнения после установки стент-графта, среди которых поворот стента, его сгибание или миграция, тромбоз и истечение крови (постоянный ток крови в аневризматический мешок после установки протеза). Поэтому контрольные посещения после установки стент-графта должны быть более регулярными, чем после стандартного восстановления целостности сосуда. При отсутствии осложнений контрольные осмотры, включающие любой визуализирующий метод, рекомендуются через 1, 6 и 12 месяцев, а затем ежегодно. Анатомически особенности (такие, как короткая шейка аневризмы ниже почечных артерий, выраженная артериальная извитость) могут приводить к невозможности повсеместной установки стент-графта у 30–40% пациентов; однако, для преодоления этих проблем были разработаны новые устройства. В целом для успешной эндоваскулярной реконструкции хирургам следует выбрать конкретное устройство, которое будет соответствовать анатомическим особенностям пациента.
В большинстве случаев протезирование аневризм < 5 см не повышает выживаемость. Поскольку пациенты различаются по комплекции, более точным будет предлагать реконструкцию, когда у данного пациента аневризма по своим размерам становится в два раза больше диаметра его нормальной аорты. Пациенты с аневризмами таких размеров должны наблюдаться, каждые 6–12 месяцев им необходимо выполнять ЭхоКГ или КТ брюшной полости до тех пор, пока аневризмы не увеличатся до размеров, которые потребуют оперативного вмешательства.
Лечение микотических аневризм основано на применении интенсивной противомикробной терапии с учетом возбудителя с последующим устранением аневризмы. Ранние диагностика и лечение улучшают прогноз.
Хирургические осложнения
В раннем послеоперационном периоде основной причиной смерти является инфаркт миокарда Острый инфаркт миокарда (ИМ) Острое поражение миокарда - это миокардиальный некроз в результате резкой обструкции коронарной артерии. Симптоматика данных состояний включает дискомфорт в грудной клетке, сопровождающийся. Прочитайте дополнительные сведенияОсложнения после реконструкции аневризмы брюшной аорты включают
Тяжелое повреждение вен вследствие проксимального пережатия
Эректильную дисфункцию (в результате повреждения нервов или снижения кровотока)
Атеросклеротическую окклюзию трансплантата
Основные положения
Диаметр брюшного отдела аорты ≥ 3см свидетельствует о наличии аневризмы брюшной аорты (АБА).
Размер АБА обычно увеличивается на 10% в год, но некоторые по неизвестным причинам увеличиваются скачкообразно; около 20% АБА не изменяют свой размер продолжительное время.
Риск разрыва пропорционален размеру аневризмы.
Диагностика проводится с помощью ультрасонографии или брюшного КТ; если нет разрыва аневризмы, для более точной характеристики ее размеров и анатомических особенностей выполняются КТ-ангиография или МР-ангиография.
Разрыв АБОА является показанием к незамедлительному открытому хирургическому вмешательству или эндоваскулярной имплантации стент-графта; даже при высоком уровне смертности.
Избирательное хирургическое вмешательство рекомендуется для аневризм > 5–5,5 см и для тех, которые быстро увеличиваются или вызывают ишемические или эмболические осложнения.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Читайте также:
