Недостаточность миелопероксидазы (МПО). Клиника и диагностика
Добавил пользователь Дмитрий К. Обновлено: 24.01.2026
Антитела к миелопероксидазе представляют разновидность антинейтрофильных цитоплазматических антител (АНЦА, ANCA).
Миелопероксидаза - один из бактерицидных ферментов азурофильных гранул, генерирующий кислородные радикалы и обладающий выраженным положительным зарядом. В иммунофлюоресцентном тесте антитела к миелопероксидазе индуцируют перинуклеарный тип флюоресценции (пАНЦА, pANCA), обусловленный перераспределением миелопероксидазы внутри клетки при ее фиксации. В отличие от антител к протеиназе 3 (см. описание теста), антитела к миелопероксидазе не обладают высокой специфичностью для диагностики какого-либо конкретного васкулита, а могут выявляться при всех АНЦА-ассоциированных васкулитах и родственных им заболеваниях. Антитела к миелопероксидазе встречаются у большинства больных идиопатическим некротизирующим васкулитом с полулуниями, микроскопическим полиангиитом, синдромом Чарга-Страусс, а также при гранулематозе Вегенера без антител против протеиназы 3. Антитела к МПО могут выявляться при синдроме Гудпасчера.
Несмотря на высокую специфичность выявления антинейтрофильных антител по отношению к системным васкулитам, они могут встречаться при инфекционном, паранеопластическом и лекарственном васкулитах. Антитела к миелопероксидазе редко могут встречаться при волчаночном нефрите.
Преобладающей формой васкулитов у больных с антителами к миелопероксидазе является микроскопический полиангиит, который поражает сосуды мелкого калибра и клинически проявляется сочетанным поражением легких и почек. Кроме того, приблизительно у трети больных с антителами к миелопероксидазе отмечается быстропрогрессирующий гломерулонефрит с полулуниями, который не сопровождается внепочечными проявлениями. Уровни антител к миелопероксидазе максимальны во время активно протекающего гломерулонефрита. Затихание процесса или Показания к назначению теста: ранняя диагностика и дифференциальная диагностика системных васкулитов; диагностика микроскопического полиангиита и синдрома Чарга-Страусс; диагностика быстропрогрессирующего гломерулонефрита и острой почечной недостаточности; ифференциальная диагностика полинейропатии. подавление активности васкулита при эффективной цитостатической терапии приводит к элиминации антител у 95% больных, причем у 75% больных такая сероконверсия происходит в течение ближайших 6 месяцев после достижения клинической ремиссии процесса. Другой частой клинической формой гранулематозных васкулитов, которая сопровождается наличием антител к миелопероксидазе, является синдром Чарга-Страусс. Клиническая симптоматика этого заболевания представлена легочным васкулитом с эозинофильными инфильтратами, астмой и гиперэозинофилией. Антитела к миелопероксидазе при синдроме Чарга-Страусс выявляются у 40-70% больных. Антитела к миелопероксидазе практически не встречаются при васкулитах крупных сосудов (аортоартериите Такаясу, болезни Кавасаки, гигантоклеточном артериите) и крайне редко выявляются при классическом узелковом полиартериите.
Для повышения чувствительности серологического обследования пациентов с системными васкулитами действующие международные рекомендации требуют одновременного использования иммунофлюоресцентного теста (см. АНЦА №970) и определения антител к протеиназе 3 (см. № 955) и антител к миелопероксидазе.
Недостаточность миелопероксидазы (МПО). Клиника и диагностика
Хроническая гранулематозная болезнь. Причина и клиника
При хронической гранулематозной болезни нейтрофилы и моноциты сохраняют способность поглощать каталазаположительные микроорганизмы, но из-за отсутствия метаболитов кислорода не уничтожают их. Это заболевание встречается редко (4-5:1 000 000) и наследуется рецессивно. Причиной служат мутации генов, кодирующих компоненты НАДФ-оксидазы (одного на Х-хромосоме и трех аутосомных генов).
Генетика и патогенез хронической гранулематозной болезни. Активация НАДФ-оксидазы в нейтрофилах требует сборки в клеточной мембране отдельных субъединиц фермента. Вначале происходит фосфорилирование катионного цитоплазматического белка p47phox (белок «оксидазы фагоцитов» с молекулярной массой 47 кДа). Фосфорилированный p47phox вместе с двумя другими цитоплазматическими компонентами оксидазы — р67phox и низкомолекулярной гуанозинтрифосфатазой (Rac-2) — транслоцируется в клеточную мембрану, где все эти белки взаимодействуют с цитоплазматическими доменами трансмембранного флавоцитохрома b558, образуя активную оксидазу.
Флавоцитохром представляет собой гетеродимер, состоящий из двух пептидов — p22phox и богатого углеводными остатками gp91phox. Согласно современной модели, три трансмембранных домена N-концевой части флавопротеида содержат остатки гистидина, определяющие связывание гема. Пептид р22phoxстабилизирует gp91phox. Роль p40phox в активации оксидазы остается неясной. Пептид gp91phox необходим для транспорта электронов с участием НАДФ-, флавин- и гемсвязывающего доменов. Пептид р22phox не только стабилизирует gp91phox, но и содержит сайты связывания цитоплазматических субъединиц фермента. Цитоплазматические р47phox, р67phox и Rac-2, по-видимому, играют регуляторную роль, активируя цитохром b558.
Примерно 2/3 больных с хронической гранулематозной болезнью — это мужчины, наследующие мутации расположенного на Х-хромосоме гена, который кодирует gp91phox, а 1/3 больных аутосомно-рецессивно наследуют мутацию гена, кодирующего р47phox (хромосома 7). Около 5% больных аутосомно-рецессивно наследуют дефекты генов р67phox (хромосома 1) и р22phox (хромосома 16).
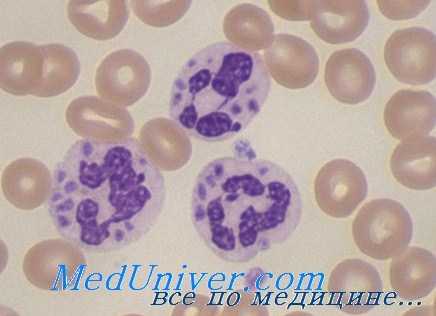
Нормальная фагоцитарная функция нейтрофилов требует активации НАДФ-оксидазы. Электроны переносятся с НАДФ-Н на флавин, затем на гемовую простетическую группу цитохрома b558 и, наконец, на молекулярный кислород, приводя к образованию О2-. При неэффективном функционировании этой системы О2- не образуется.
Нарушения окислительного обмена в нейтрофилах при хронической гранулематозной болезни создают условия для выживания микробов. Среда в вакуолях фагоцитов остается кислой, и бактерии не перевариваются. Окраска макрофагов больных гематоксилин-эозином выявляет золотистый пигмент, отражающий накопление в клетках поглощенного материала, что и лежит в основе диффузного гранулематоза, давшего название этой патологии.
Клинические проявления хронической гранулематозной болезни
Подозревать хроническую гранулематозную болезнь следует у любого больного с повторными или необычными лимфаденитами, печеночными абсцессами, множественным остеомиелитом, частыми инфекциями в семейном анамнезе или инфекциями, вызываемыми каталазаположительными микробами (например, S. aureus).
Клинические признаки и симптомы хронической гранулематозной болезни могут возникать как в грудном, так и в раннем зрелом возрасте. Частота возникновения и тяжесть инфекционных заболеваний крайне непостоянны. Возбудителем обычно является S. aureus, хотя возможно инфицирование любыми другими каталазаположительнымим микроорганизмами. К частым возбудителям инфекций относятся Serratia marcescens, Burkhoderia cepacia, Aspergillus, Candida albicans и Salmonella. Обычно возникают пневмонии, лимфадениты и поражения кожи.
Осложнения хронических инфекций включают анемию, лимфаденопатию, гепатоспленомегалию, хронический гнойный дерматит, рестриктивные нарушения, гингивит, гидронефроз и стеноз привратника. На возможность хронической гранулематозной болезни указывают также парапроктиты и повторные кожные инфекции, в том числе фолликулиты, гранулемы и дискоидная красная волчанка. Гранулемы и воспалительные процессы, если они вызывают стеноз привратника, сужение мочеиспускательного канала или свищи прямой кишки, напоминающие болезнь Крона, требуют безотлагательного подтверждения диагноза.
Синдром Чедиака-Хигаси. Клиника и диагностика
При редком аутосомно-рецессивном синдроме Чедиака-Хигаси повышенная восприимчивость к инфекциям связана с нарушением дегрануляции нейтрофилов. Характерна легкая кровоточивость, депигментация кожи и глаз, прогрессирующая периферическая невропатия и гиперплазия лимфоидной ткани. В нейтрофилах, моноцитах и лимфоцитах обнаруживаются гигантские цитоплазматические гранулы. Депигментация волос, кожи и глазного дна обусловлена патологической агрегацией меланосом и связана с нарушением перекреста зрительных и слуховых нервов. Повышенная восприимчивость к инфекциям частично объясняется нарушениями хемотаксиса, дегрануляции и бактерицидной активности нейтрофилов.
Гигантские гранулы в них препятствуют прохождению клеток в ткани через узкие межклеточные промежутки эндотелия.
Генетика и патогенез синдрома Чедиака-Хигаси. Мутантный ген, расположенный на хромосоме 1 (участок q2-q44), клонирован. Он гомологичен гену, ответственному за соответствующий синдром у мышей (фенотип beige); его продукт обладает структурным сходством с дрожжевым белком сортировки вакуолей, носящим название VPS15. Считается, что этот белок участвует в транспорте везикул и опосредует межбелковые взаимодействия и связь белков с мембранами.
Почти все клетки больных с синдромом Чедиака-Хигаси содержат крупные лизосомы неправильного строения, плотные гранулы или везикулярные структуры. Из-за нарушения дисперсии гигантских меланосом они не поступают в кератиноциты и волосяные фолликулы, вследствие чего стержни волос лишаются пигментных гранул. В результате волосы и кожа больных выглядят светлее, чем у родителей. Те же нарушения меланоцитов обусловливают частичный глазной альбинизм, сопровождающийся светобоязнью.
Слияние гигантских первичных гранул друг с другом и с компонентами цитоплазматических мембран на ранних стадиях развития нейтрофилов приводит к образованию огромных вторичных лизосом с уменьшенным содержанием гидролитических ферментов — протеаз, эластазы и катепсина G. Это и может лежать в основе нарушенной бактерицидной активности нейтрофилов. Повышенная текучесть клеточных мембран при синдроме Чедиака-Хигаси сказывается на экспрессии рецепторов, приводя к повышению внутриклеточного уровня цАМФ, нарушению сборки микротрубочек и их взаимодействия с мембранами лизосом.
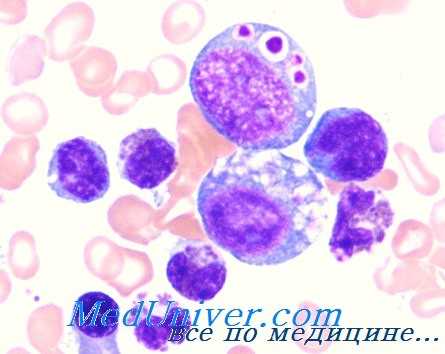
Клинические проявления синдрома Чедиака-Хигаси. Кожа у больных светлая, волосы имеют серебристый оттенок. Нередко отмечаются солнечные ожоги и светобоязнь. Характерны частые инфекции и невропатия. Инфекции поражают слизистые оболочки, кожу и дыхательные пути. Повышена восприимчивость как к грамположительным, так и грамотрицательным бактериям и грибам. Наиболее частый возбудитель S. aureus. Невропатия бывает сенсорной и моторной, приводя к атаксии. Нередко она развивается в подростковом возрасте и становится основной жалобой.
Время кровотечения увеличено; количество тромбоцитов нормально, но их агрегация (из-за дефицита плотных гранул, содержащих АДФ и серотонин) нарушена. Нарушена и функция NK-клеток.
Наиболее опасное осложнение синдрома Чедиака-Хигаси — ускорение пролиферации лимфоцитов с панцитопенией, высокой температурой тела и лимфогистиоцитарной инфильтрацией печени, селезенки и лимфатических узлов. Это может произойти в любом возрасте и, по-видимому, связано с отсутствием сопротивляемости вирусу Эпштейна-Барр. Клиническая картина в таких случаях напоминает вирусный гемофагоцитарный синдром. Пролиферация лимфоцитов сопровождается учащением бактериальных и вирусных инфекций и обычно приводит к смерти. Многочисленные лимфогистиоцитарные инфильтраты, обнаруживаемые при аутопсии в печени, селезенке и лимфатических узлах, лишены гистологических признаков злокачественности.
Лабораторные исследования синдрома Чедиака-Хигаси. Диагностическим признаком синдрома Чедиака-Хигаси служат крупные включения во всех ядерных клетках крови. Они видны при окраске мазков крови по Райту, но лучше выявляются на пероксидазе.
Лечение синдрома Чедиака-Хигаси. Некоторым больным в стабильной фазе синдрома помогают высокие дозы аскорбиновой кислоты (200 мг/сут для грудных детей и 2000 мг/сут для взрослых). Ее эффективность вызывает сомнения, но безопасность витамина С оправдывает его введение всем больным.
Единственно надежный метод лечения синдрома Чедиака-Хигаси при ускоренной пролиферации лимфоцитов — трансплантация костного мозга от HLA-идентичных родственников или доноров, совместимых по локусу D. Трансплантация костного мозга в таких случаях нормализует гемопоэтические и иммунологические функции и восполняет дефицит NK-клеток, но не излечивает и не предотвращает невропатию.
Антитела к миелопероксидазе (МПО, Myeloperoxidase Antibody, MPO)
Миелопероксидаза относится к семейству гемосодержащих пероксидаз млекопитающих, содержится в азурофильных гранулах нейтрофилов, моноцитов и некоторых видах тканевых макрофагов, и секретируется при фагоцитозе внутрь фагосомы. Генерированные этим ферментом активные формы кислорода и свободные радикалы вовлечены в анти-микробную активность нейтрофилов, которая обеспечивает врожденный неспецифический иммунитет. При определенных условиях миелопероксидаза может секретироваться во внеклеточную жидкость и участвовать в повреждении собственных тканей организма. В настоящем обзоре рассмотрены биологические функции и патогенетическая роль миелопероксидазы.
Миелопероксидаза (МРО, Н2О2-оксиредуктаза, ЕС 1.11.1.7) является одной из самых изученных эндогенных пероксидаз млекопитающих. В основном этот фермент содержится в азурофильных гранулах нейтрофилов (до 5% сухого веса клетки), а также в моноцитах и некоторых типах тканевых макрофагах. После активации фагоцитов происходит дегрануляция, и МРО секретируется либо внутрь фагосомы, либо во внеклеточное пространство [16].
Биосинтез МРО осуществляется во время дифференциации миелоцитов в костном мозге и заканчивается ко времени выхода зрелых гранулоцитов и моноцитов в кровеносное русло [19].
МРО (150 кД) состоит из двух идентичных, соединенных между собой дисульфидной связью, димеров, каждый из которых содержит гликозилированную тяжелую α-субъединицу (57 кД) с ковалентно связанным гемом (протопорфирин IX с ионом железа в центре) и негликозилированную легкую β-субъединицу (12 кД) [1].
Основным субстратом МРО является перекись водорода, которая продуцируется in vivo при «дыхательном взрыве». Продуктами катализируемых МРО реакций являются сильные окислители (в частности, гипохлорит), реактивные производные азота и свободные радикалы, которые в свою очередь инициируют перекисное липидов [30] и вызывают модификацию белков, включая галогенирование, нитрирование, окисление и образование сшивок [20].
Кроме того, физиологическим субстратом МРО может служить также оксид азота (NO), который при этом выступает лигандом для гемовой группы [12].
Биологические функции МРО
МРО является важной составной частью антимикробной активности фагоцитов, обеспечивающей врожденный неспецифический иммунитет.
In vivo МРО высвобождается во внеклеточную жидкость (в частности, в кровь), в том случае, если по какой либо причине нейтрофил не может фагоцитировать мишень, при клеточной лизисе или когда нейтрофил подвергается воздействию различным растворимых факторов [16]. При наличии воспаления уровень свободной МРО в крови повышается. Будучи катионным белком, МРО может связываться с отрицательно-заряженной клеточной мембраной, в частности эндотелиальной, и при наличии субстрата может вызывать окислительные повреждения тканей организма в очагах воспаления [3].
Предполагают также, что МРО может проникать через эндотелиальный барьер посредством трансцитоза, медиатором которого по-видимому служить альбумин. Сайт связывания МРО с альбумином предположительно находится на участке 425-454 а.о. тяжелой цепи. Трансцитоз комплекса альбумин-МРО осуществляется за счет альбумин-связывающих белков в кавеолах эндотелиоцитов [24]. В субэндотелии МРО может вызывать модификацию белков внеклеточного матрикса (в частности, фибронектина), приводя к ремоделированию тканей в очагах воспаления [3].
МРО и сердечно-сосудистые заболевания (ССЗ)
Было установлено, что повышенный системный уровень МРО (содержание МРО в нейтрофилах и в крови) был ассоциирован с наличием коронарных артериальных заболеваний [29]. Кроме того, что повышенный уровень МРО в крови прогнозировал риск развития неблагоприятных кардиологических событий (инфаркт миокарда, внезапная смерть и др.) у больных с грудной болью и острым коронарных синдромом [4, 7].
В опытах in vitro было показано, что МРО может переводить липопротеины низкой плотности в т.н. «атерогенную», легко захватываемую макрофагами, форму за счет окисления лизиновых остатков и нитрирования аполипопротеина В-100 и инициации перекисного окисления липидов [21]. Кроме того, МРО может переводить липопротеины высокой плотности в дисфункциональную форму за счет нитрирования и хлорирования тирозиновых остатков в аполипотеине A-I, нарушая тем самым клеточный транспорт холестерина [18]. Предполагают, что таким образом МРО может способствовать возникновению и росту атеросклеротической бляшки.
Кроме того, полагают, что МРО может участвовать в развитии т.н. нестабильности бляшки. В опытах in vitro было показано, что низкие концентрации генерированного МРО гипохлорита вызывают активацию эндотелиоцитов, сопровождающуюся увеличением экспрессии Р-селектина и тканевого фактора, что приводит к повышению тромбогенности эндотелиальной поверхности. Высокие концентрации гипохлорита приводят к апоптозу эндотециоцитов. Кроме того, МРО может вызывать активацию латентной матриксной металлопротеазы-7 [10].
В пользу возможности участия МРО в атерогенезе свидетельствуют многочисленные клинические данные. Так, иммуногистохимически и с помощью масс-спектрометрии было показано присутствие МРО и продуктов опосредованных ею реакций (хлорированные и нитрированные остатки тирозина, хлорированные липиды) в атеросклеротической бляшке по сравнению с нормальной интимой [8, 23]. Анализ аполипопротеина А-I, выделенного из плазмы крови больных с ССЗ выявил повышенное содержание нитрированных и хлорированных остатков тирозина по сравнению со здоровыми субъектами [31]. Патоморфологические исследование поврежденных бляшек у внезапно умерших больных показало солокализацию МРО и гипохлорит-модифицированных белков, ассоциированных с внутрикоронарными тромбами [22].
Предполагают также, что за счет потребления эндогенного NO в качестве субстрата, МРО может участвовать в развитии дисфункции эндотелия, являющейся одним из ранних изменений атерогенеза и характеризующейся развитием ненормальной сосудистой реактивности и экспрессией различных провоспалительных и протромботических факторов. Так было показано, что МРО усиливает катаболизм NO во время ишемии миокарда и реперфузии [5]. Была установлена обратная корреляция между сывороточным уровнем МРО и потоко-опосредованной дилатацией плечевой артерии [25].
МРО и системные васкулиты
Системный микрососудистый васкулит (МСВ) характеризуется микроваскулярным воспалением и некрозом и чаще всего поражает почки и легкие, вызывая быстро прогрессирующий гломерулонефрит и легочную геморрагию [14].
В 80-х годах было показано, что МСВ ассоциирован с наличием аутоантител к цитоплазматическим, лизосомальным компонентам нейтрофилов и моноцитов, в частности к МРО. Такие аутоантитела были названы анти-нейтрофильными цитоплазматическими аутоантителами (ANCA) [26].
Аутоантитела к МРО были обнаружены у больных с микроскопическим полиангиитом, аутоиммуным некротизирующим серповидным гломерулонефритом и синдромом Churg-Strauss [15]. При этом изменения титра аутоантител отражали интенсивность заболевания [9].
В опытах in vitro было показано, что ANCA могут активировать TНФa-примированные нейтрофилы, вызывая дегрануляцию, продукцию реактивных окислительных метаболитов, секрецию провоспалительных цитокинов. Кроме того, ANCA усиливали адгезию нейтрофилов к эндотелиальному монослою. Совместная инкубация ANCA-активированных нейтрофилов и эндотелиальных клеток приводила к лизису эндотелиоцитов [11].
Ряд клинических данных свидетельствует в пользу патогенетической роли ANCA. Описан случай, когда у больного на фоне ANCA-ассоциированного васкулита при отсутствии почечной и легочной дисфункции, а также классических факторов риска цереброваскулярного заболевания, развился геморрагический инсульт [13]. В пупочной крови новорожденных, чьи матери страдали ANCA-ассоциированным васкулитом, был обнаружен повышенный уровень анти-МРО аутоантител, что сопровождалось легочными геморрагиями и почечной дисфункцией [6].
Изучение патогенетической роли МРО и аутоантител к МРО на животных моделях
В опытах с МРО нокаутированными мышами была подтверждена доминантная роль МРО в инициации перекисного окисления липидов и внеклеточного нитрирования белков в очагах острого воспаления [30].
В модели хронической перевязки коронарной артерии МРО нокаутированные мыши продемонстрировали заметно сниженные инфильтрацию лейкоцитов и дилатацию левого желудочка, что ассоциировалось с сохранением систолической функции, что предполагает участие МРО в патологическом ремоделировании желудочка после инфаркта миокарда [2].
На крысиной модели баллонного повреждения каротидной артерии было показано, что МРО в присутствии перекиси водорода может вызывать гиперплазию неоинтимы [28].
Было показано, что введение анти-МРО антител, полученых путем иммунизации МРО нокаутированных мышей мышиной МРО, вызывает у интактных мышей развитие гломерулонефрита и легочного васкулита [27].
Иммунизация крыс человеческой МРО вызывало индукцию анти-МРО антител, которые перекрестно реагировали с крысиной МРО и вызывали развитие почечной дисфункции, выражающейся появлением крови и белка в моче [17].
Согласно полученным нами предварительным данным, стрессовые воздействия влияют на уровень МРО в крови. Уже через 1 час после холодового стресса уровень МРО в плазме у крыс повышался более чем в 2 раза, а через сутки - более, чем в 3 раза, по сравнению с исходным уровнем.
Заключение
Основной функцией МРО в организме является защита от внешней инфекции, однако при ряде условий она может вызывать повреждение собственных тканей организма в очагах воспаления. Как показатель активности нейтрофилов, МРО может служить маркером интенсивности воспалительных процессов.
В клинической практике уровень МРО в крови представляется перспективным диагностическим и прогностическим показателем при ряде заболеваний и патологических состояний. Аутоантитела к МРО являются биохимическим маркером системных васкулитов, а также, по-видимому, могут участвовать в патогенезе таких заболеваний.
Читайте также:
- Консультация больных для профилактики заболеваний.
- Запах ( запахи ). Классификация запахов. Стереохимическая теория запахов.
- Повреждение латерального мениска. Повреждение обоих менисков колена
- Диастолические органические шумы сердца. Шумы сердца при инфаркте миокарда
- Диссоциированное развитие близнецов. Осложнения развития близнецов из двойни
