Нежелательные зубные явления при лечении по NCI
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
Кафедра ортопедической стоматологии и ортодонтии стоматологического факультета ГБОУ ВПО «Южно-Уральский государственный медицинский университет» Минздрава России, Челябинск, Россия
Стоматологические осложнения, возникающие после проведения комплексного лечения злокачественных образований полости рта и глотки
Журнал: Стоматология. 2012;91(1): 35‑39
Нуриева Н.С. Стоматологические осложнения, возникающие после проведения комплексного лечения злокачественных образований полости рта и глотки. Стоматология. 2012;91(1):35‑39.
Nurieva NS. The stomatologic complications arising after carrying out of complex treatment of malignant formations of an oral cavity and drinks. Stomatologiya. 2012;91(1):35‑39. (In Russ.).
Комплексное лечение злокачественных опухолей полости рта и глотки включает в себя в основном комбинацию хирургических, лучевых и химиотерапевтических методов лечения. Все перечисленные компоненты лечения, применяемые в области головы и шеи, приводят к развитию стоматологических осложнений. Возникающие осложнения, наслаиваясь друг на друга, вызывают симптомы взаимного отягощения. Коррекция данных состояний целиком ложится на врача-стоматолога. Статья посвящена анализу возникающих осложнений и их влиянию друг на друга.
Лечение злокачественных опухолей орофарингеальной области на современном этапе основывается на принципах мультидисциплинарного подхода, что позволяет уменьшить объем хирургических вмешательств, а в некоторых случаях даже избежать их [3]. Результаты применения комплексного подхода в лечении опухолей данной локализации, полученные большинством авторов, более эффективны, нежели результаты изолированного лучевого, химиотерапевтического или хирургического методов лечения [7].
Ведущие онкологические клиники имеют достаточный опыт комбинированного лечения опухолей орофарингеальной области, что позволяет оценивать отдаленные результаты и сравнивать их [4]. Однако для оценки эффективности лечения важным является изучение не только положительных, но и отрицательных эффектов, то есть осложнений и реакций. Одним из важнейших критериев эффективности любого метода лечения является снижение уровня отрицательных реакций и осложнений[1].
Материал и методы
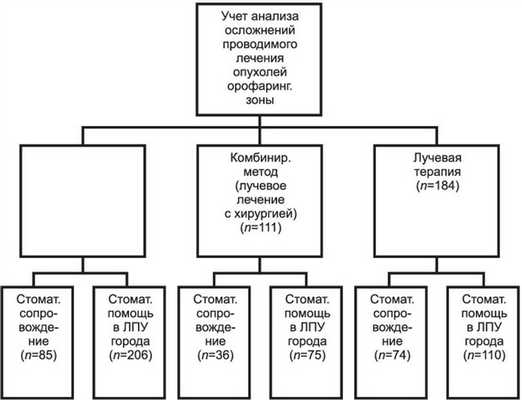
Материалом настоящего исследования послужили данные проспективного, лонгитудинального изучения результатов лечения 586 больных со злокачественными новообразованиями орофарингеальной области. Все пациенты были разделены на 2 группы. В основную группу были включены 195 пациентов, группа сравнения была сформирована из 391 пациента. Отбор больных для исследования производился в соответствии со стандартными критериями включения и исключения. Критериями включения считали установленный диагноз злокачественного новообразования, планируемое комплексное противоопухолевое лечение, возраст от 18 до 84 лет, информированное добровольное согласие на участие в исследовании. Критериями исключения считались отказ больных от участия в исследовании, наличие тяжелой сопутствующей соматической патологии и психических заболеваний. При формировании групп для сравнительного анализа принимали во внимание индивидуальность подходов к лечению злокачественных новообразований в зависимости от локализации, стадии, гистологического варианта и особенностей лечебной программы (рис. 1). Рисунок 1. Распределение больных по группам.
Результаты исследования
Анализ осложнений химиолучевого компонента комплексного лечения. В зависимости от продолжительности времени после облучения и химиотерапии местные повреждения делятся на ранние и поздние. Ранние повреждения развиваются в процессе лучевой терапии или в ближайшие 3 мес после нее (крайний срок восстановления сублетального повреждения клеток). Поздними считают химиолучевые повреждения, развившиеся после указанного срока, чаще — через несколько лет [6].
В основе поздних химиолучевых повреждений лежат нарушения более радиорезистентных структур, являющиеся следствием постепенного накапливания изменений в мелких кровеносных и лимфатических сосудах, обусловливающих нарушение микроциркуляции и развитие гипоксии облученных тканей, что может впоследствии стать причиной фиброза и склероза [2, 4].
Из химиолучевых повреждений при проведении комплексного лечения рака орофарингеальной области мы в нашем исследовании наблюдали ксеростомию, лучевой кариес и лучевой остеорадионекроз.
Ксеростомию называют отсроченным осложнением, однако на самом деле она начинает развиваться с первого дня лучевой терапии. Кроме того, это серьезное пожизненное осложнение, постоянно преследующее пациента и вызывающее ощущение сухой, жесткой слизистой оболочки. В первую неделю лучевой терапии наблюдается резкое снижение слюноотделения, которое за 2 нед лечения сокращается на 90%. При накоплении кумулятивной дозы облучения 40 Гр слюноотделение уменьшается на 95% по сравнению с первоначальным, и происходит необратимое поражение слюнных желез. Такое типичное уменьшение слюноотделения тесно связано с дозой облучения. При химиотерапии клиническая гипосаливация наблюдается только во время лечения и является обратимой.
Под нашим наблюдением находились 52 пациента из группы сравнения и 44 пациента из основной группы с ксеростомией, возникшей после химиолучевого лечения. Всем проводилась сиалометрия на момент госпитализации и после окончания курса химиолучевого лечения по «Методике сбора смешанной нестимулированной слюны в состоянии покоя». Средний показатель сиалометрии (общей нестимулированной слюны) на момент госпитализации составлял M=3,98±0,04. Все пациенты получили дозу облучения не менее 40 Гр. Повторные осмотры проведены нами по окончанию лучевого лечения и затем с 6-месячными перерывами.
Как правило, выделяются три степени ксеростомии, поэтому все пациенты были нами объединены и сгруппированы по степени выраженности симптомов (табл. 1).
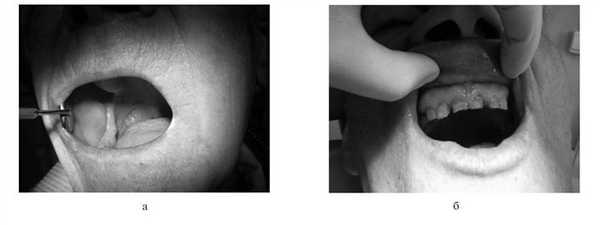
Безусловно, наиболее тяжелой для пациента (и для коррекции) является ксеростомия III степени. При нарушении функции слюнных желез III степени (функция слюнных желез полностью угнетена) больных беспокоят резкая сухость во рту, болезненные ощущения в слюнных железах, боль при еде, нарушение сна, речи. Отмечаются явления катарального глоссита, стоматита, слизистая оболочка ротовой полости сухая, гиперемирована, нередко с трещинами, эрозиями. Гипосаливация (сиалометрия — до 2 мл), повышенная вязкость, кислотность, пенистость слюны. Губы сухие, шелушатся, покрыты корками. Ксеростомия часто сопровождается множественным кариесом зубов (рис. 2, а). Рисунок 2. Осложнения химиолучевой терапии. а — ксеростомия III степени, б — лучевой кариес.
Степень выраженности симптомов ксеростомии уменьшается с течением времени даже при отсутствии стоматологической помощи. Так, нами были обследованы пациенты группы сравнения (52 человека) непосредственно после завершения лучевой терапии и затем с 6-месячными перерывами. Динамика зависимости симптомов ксеростомии от времени, прошедшего с момента окончания химиолучевой терапии, представлена в табл. 2.
Так, симптомы, соответствующие III степени, наблюдались на протяжении 1,42±0,02 года и затем имели тенденцию к снижению, достигая своего минимума в среднем через 2,21±0,03 года.
При этом имеется прямая корреляционная зависимость степени выраженности ксеростомии от общей лучевой дозы (табл. 3).
Так, симптомы, соответствующие III степени ксеростомии, проявлялись при СОД=59 Гр. Предоперационный вариант лучевой терапии СОД=50 Гр приводил к возникновению ксеростомии I степени. Как видно из представленных выше данных, симптомы химиолучевой ксеростомии обратимы, что свидетельствует об отсутствии структурных поражений слюнных желез в процессе химиолучевого лечения. Однако восстановление количества отделяемой слюны — процесс достаточно длительный и тяжелый для пациента.
Лучевой кариес (рис. 2, б) возникает после воздействия ионизирующего излучения на ткани зуба при лечении злокачественных образований головы и шеи. Клинические признаки постлучевого поражения зубов достаточно характерны. Обычно спустя 3—6 мес после лучевого воздействия эмаль зубов утрачивает характерный блеск, становится тусклой, серовато-блеклого цвета. Отмечается ломкость, стертость жевательной и вестибулярной поверхности зубов. На этом фоне появляются участки некроза, вначале локальные, а затем по типу циркулярного поражения зубов. Указанные поражения обычно темного цвета, заполненные рыхлой некротической массой, безболезненные. Отсутствие болевого симптома — характерная особенность радиационного поражения зубов, свидетельствующая о подавлении функции одонтобластов. Постепенно участки некроза расширяются и захватывают значительную часть зуба. Удаление некротических масс из очага поражения, как правило, безболезненное, поэтому требует особой осторожности. Если не применять радикальные вмешательства, то через 1—2 года окажутся пораженными более 96% зубов. Нами были обследованы пациенты через 2 года после завершения комплексного лечения опухолей орофарингеальной области. Все осмотренные пациенты получали лучевое лечение не менее 40 Гр. Лучевой кариес при осмотре диагностирован в 88% случаев (табл. 4, 5). В табл. 6 представлена корреляционная зависимость развития лучевого кариеса в зависимости от полученной суммарной дозы (СОД).
Лучевой остеонекроз, радионекроз, некроз лучевой (radionecrosis) — некроз ткани (чаще всего костной ткани или кожи), за счет угнетения ее регенераторной способности после проведенного курса противоопухолевой радиотерапии. Травма или хирургическое вмешательство (например, удаление зуба) после облучения могут усилить процесс радионекроза.
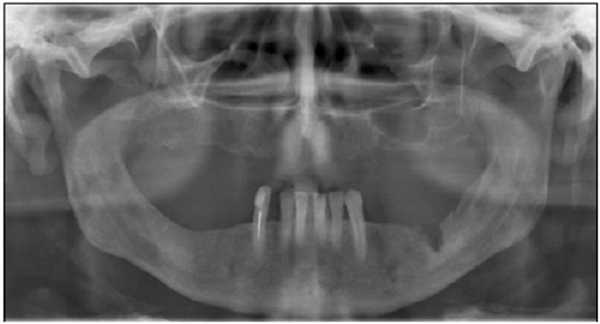
Лучевой остеонекроз представляет собой гибель костной ткани и является наиболее тяжелым последствием лучевой терапии онкологических заболеваний головы и шеи. В нашем случае 7 (9,3%) пациентов группы контроля обратились с жалобами на боли и длительное незаживление лунок после удаления зубов. Удаления были произведены в стоматологических учреждениях города в сроки от 7 до 12 мес после окончания лучевой терапии. Во всех случаях был выставлен диагноз «остеорадионекроз» (рис. 3). Рисунок 3. Остеорадионекроз. Во всех случаях остеорадионекроз характеризовался длительным течением, с периодами обострения и отсутствием четко определяемых границ демаркации секвестра. Хирургическое вмешательство в основном было направлено на предупреждение развития абсцессов и флегмон ЧЛО. В одном случае течение радионекроза сочеталось с одновременным рецидивом опухоли.
Нами были обследованы 73 пациента с дефектами челюстных костей: 54 (73,9%) случая — верхняя челюсть, 19 (26,1%) случаев — нижняя.
Дефекты верхней челюсти определялись по классификации D. Okay и соавт. (2001), разделяющей изъяны на 3 основных класса и 2 подкласса.
На нижней челюсти для систематизации возможных вариантов дефектов и деформаций и составления плана лечебной тактики мы использовали классификацию Л.В. Горбаневой, Б.К. Костур и В.А. Миняевой (1995), так как данная классификация не только рассматривает указанную патологию в зависимости от тяжести и степени выраженности дефекта или деформации, но и учитывает характер сращения или несращения отломков нижней челюсти, а также часто встречающиеся варианты дефектов нижней челюсти, образующихся после онкостоматологических операций в результате экзартикуляции половины или полного удаления нижней челюсти. Полученные результаты представлены в табл. 7.
К осложнениям хирургического лечения злокачественных новообразований орофарингеальной области также относятся: развитие контрактур, сужение ротовой щели (микростома), ограничение подвижности языка, губ и щек.
Контрактура — ограничение подвижности сустава вследствие патологических изменений мягких тканей, костей или мышечных групп, функционально связанных с данным суставом.
Все контрактуры, возникающие после комплексного лечения опухолей орофарингеальной области, относятся к внесуставному типу. По степени раскрывания рта, внесуставные контрактуры делятся: на тяжелые (раскрывание рта до 1 см), средней тяжести (раскрывание рта на 1—2 см) и легкие (раскрывание рта на 2—3 см). Нами был обследован 391 пациент, получивший хирургическое лечение (в схеме комплексного лечения рака орофарингеальной области). Результаты оценки степени развития контрактур представлены в табл. 8.
Главными стоматологическими осложнениями, возникающими после химиолучевой терапии, являются ксеростомия и лучевой кариес. Данные осложнения имеют высокую частоту встречаемости и, как правило, не проходят без оказания квалифицированной стоматологической помощи. Остеорадионекроз, являясь грозным осложнением лучевой терапии, к счастью имеет не столь широкое распространение. Основными осложнениями хирургического лечения, безусловно, являются дефекты челюстных костей и мягких тканей орофарингеальной области, сопровождающие каждое хирургическое вмешательство, а также возникающие послеоперационные внесуставные контрактуры. Все перечисленные осложнения имеют симптом взаимного отягощения, т.е. могут осложнять друг друга при проведении комплексной противоопухолевой терапии. Все развившиеся осложнения нуждаются в стоматологической коррекции. Стоматологическая помощь таким пациентам оказывается непосредственно после выписки из онкологического учреждения, далее в течение первого года стоматологический осмотр необходимо осуществлять каждые 3 мес, что будет сочетаться с контролем онкологическим. После первого года стоматологическое обследование выполняется каждые 3—6 мес в зависимости от индивидуальных факторов: уровня гигиены, степени развития ксеростомии, наличия восстанавливающих ортопедических конструкций.
Выводы
Проведенное нами исследование позволяет сделать следующие выводы.
1. Значительная часть нежелательных эффектов комплексного лечения злокачественных опухолей орофарингеальной области связана с химиолучевым компонентом и представлена в основном химиолучевыми реакциями. Из которых 34% приходится на клинически значимые радиомукозиты, вынуждающие делать перерывы в лечении и как следствие приводящие к снижению эффективности химиолучевого компонента.
2. Ксеростомия как осложнение химиолучевой терапии развивается с первого дня специализированной противоопухолевой терапии, причем в первую неделю наблюдается резкое снижение слюноотделения, которое при накоплении кумулятивной дозы облучения 40 Гр уменьшается до 95% по сравнению с первоначальным, однако степень выраженности симптомов ксеростомии уменьшается с течением времени даже при отсутствии стоматологической помощи.
3. Лучевой кариес, возникающий после воздействия ионизирующего излучения на ткани зуба, определяется до 88% случаев при облучении 40 Гр и до 96% случаев при облучении до 70 Гр, вызывая поражения твердых тканей зубов в сроки от 6 до 24 мес.
Последствия местной анестезии, требующие внимания
Стоматологические процедуры часто проводятся с использованием обезболивающих препаратов. Эта статья поможет разобраться, имеет ли местная анестезия в стоматологии побочные эффекты, и если да, то как избежать негативного влияния.
Виды местных анестетиков
Все применяемые стоматологами препараты имеют в основе вещества одной из двух химических групп:
Сложные эфиры: новокаин, тетракаин (дикаин), бензокаин (анестезин). Эти соединения не очень стойкие и быстро разрушаются в тканях тела, поэтому их действие непродолжительно.
Амиды: лидокаин, тримекаин, меливакаин, бупивакаин, ультракаин (артикаин). Устойчивы, проникают глубоко в ткани и, соответственно, обеспечивают более эффективное обезболивание [1] .
Побочные эффекты обезболивающих
Негативные последствия местной анестезии, хотя и редко возникают, могут быть достаточно серьёзными. Некоторые из них развиваются очень быстро, и стоматолог должен быть готов оперативно принять меры в каждом из возможных случаев.
Токсическое действие: судороги, падение артериального давления, аритмия, сонливость. Это наиболее распространённая группа побочных эффектов. Развиваются при передозировке или случайном попадании иглы внутрь кровеносного сосуда.
Реакции в месте укола: отёчность, воспаление, появление ишемических зон. Обычно возникают при нарушении техники инъекции.
Действие на центральную нервную систему: нервозность, головокружение, беспричинный страх, двоение в глазах, скачки температуры, конвульсии, потеря сознания.
Действие на сердечно-сосудистую систему: снижение частоты сердечного ритма, падение артериального давления.
Аллергические реакции: зуд, выделения из глаз или носа, отёк Квинке [2] .
Тем не менее местная анестезия значительно безопаснее общего наркоза, который в стоматологии применяется лишь в крайних случаях.
Опасность добавок к анестетикам
Многие побочные реакции вызывает не само действующее вещество, а добавки в составе препарата. Они выполняют важные функции, но вместе с тем и повышают риски анестезии.
Вазиконстрикторы
Замедляют проникновение обезболивающего в кровь, тем самым повышая его эффективность. Такой способностью обладают:
Для вазиконстрикторов характерны следующие осложнения:
подъём артериального давления;
учащённое сердцебиение (тахикардия);
нарушение ритма сердца;
Консерванты
Благодаря антибактериальному и противогрибковому действию защищают препарат от микроорганизмов. Однако способны вызвать сенсибилизацию организма и анафилактический шок.
Стабилизаторы
Препятствуют окислительным процессам, повышая срок годности обезболивающего. Опасны появлением крапивницы, отёков, нервных и вагусных рефлексов [2] .
Аллергические реакции на обезболивающие препараты
Аллергия — пример побочного действия анестетиков, которое связано в первую очередь с добавками. Изредка реакцию провоцируют сложные эфиры и значительно чаще консерванты (метилпарабен, пропилпарабен, парабензойная кислота) или стабилизатор бисульфит.
Аллергические реакции бывают двух типов:
Немедленная гиперчувствительность. Проявляется в течение одного часа, в тяжёлых случаях — практически сразу.
Замедленная гиперчувствительность. Ухудшение состояния наблюдается через 24–72 часа после инъекции [3] .
Группы риска
Некоторые категории пациентов отличаются повышенной чувствительностью к местной анестезии. В таблице перечислены основные группы риска и возможные решения для них.
Группа риска
Рекомендации
По возможности отложить лечение.
Снизить дозу препарата.
Не использовать буливакаин и препараты с вазиконстриктором филипрессином.
Уменьшить концентрацию вазиконстриктора адреналина.
Использовать препараты без консервантов.
Использовать анестетики на основе сложных эфиров.
Гипертензия (высокое давление)
Нарушения сердечного ритма
Ишемическая болезнь сердца
Уменьшить концентрацию вазиконстриктора.
Не использовать лидокаин и меливакаин.
Не использовать препараты с вазиконстриктором норадреналином.
Эмфизема и хроническая обструктивная болезнь лёгких
Снизить дозу препарата [3] .
Минимизация рисков
Если вы находитесь в группе риска, в самом начале приёма расскажите об этом стоматологу. Также очень важно сообщить, если у вас хотя бы однажды была аллергическая реакция на анестезию. Запишите, какой именно препарат её спровоцировал, и обязательно уведомляйте врачей.
Стоматологи, в свою очередь, принимают все меры предосторожности, чтобы свести опасность к минимуму:
тщательно изучают анамнез;
отдают предпочтение препаратам с минимальной концентрацией вазиконстрикторов;
проводят аспирационную пробу: после введения иглы всасывают среду, в которой находится её кончик, чтобы исключить попадание в кровеносный сосуд;
вводят анестетик медленно, наблюдая за реакцией пациента;
имеют под рукой экстренный медицинский набор для реанимационных мероприятий;
применяют седативные препараты (успокаивающую премедикацию), которые расслабляют пациента и позволяют снизить дозу анестетика [3, 4] .
Уже на предварительной консультации можно понять, насколько психологически сложно будет для пациента перенести операцию. Если пациент сразу говорит, что ему нужно больше анестезии, потому что она на него “не действует”, это первый признак, что он очень боится операции (вообще-то анестезия на всех действует одинаково). И значит, успокаивающая премедикация может понадобиться.
Ашурко И. П., к. м. н., доцент Сеченовского университета [4]
Во время травматичных манипуляций в полости рта — например, вживления имплантата или удаления зуба — без анестезии не обойтись. Однако многие проблемы современное стоматологическое оборудование позволяет решать, практически не причиняя боли. Зачастую лечение кариеса или установку пломбы вполне можно проводить без местного наркоза. Постарайтесь отказаться от обезболивающих при несложных вмешательствах, чтобы наверняка избежать связанных с ними неприятных последствий.
Нежелательные зубные явления при лечении по NCI
Опубликованы в Journal of Clinical Oncology 37, no. 25 (September 2019).
Лекарственный остеонекроз челюсти (ЛОНЧ) – это состояние, продолжающееся не менее 8 недель, при котором кость челюсти обнажается либо ее можно прощупать сквозь внутриротовой(-ые) или внеротовой(-ые) свищ(и) челюстно-лицевой области. Оно возникает у пациентов, получающих препараты, модифицирующие костную ткань (ПМКТ, остеомодифицирующие агенты), или у пациентов, получающих ингибиторы ангиогенеза, у которых в анамнезе отсутствует облучение области головы и шеи [1, 2]. Данное явление может затрагивать как верхнюю, так и нижнюю челюсть. ПМКТ, которые ассоциируются с развитием ЛОНЧ, – это, главным образом, бисфосфонаты и деносумаб. ПМКТ являются ключевым компонентом терапии онкологических пациентов с метастазами в кости. Эти препараты обладают рядом клинических преимуществ, в частности, они снижают риск возникновения нежелательных явлений со стороны скелета (например, патологических переломов или компрессии спинного мозга) и снижают потребность в лучевой терапии и хирургическом вмешательстве на костях. Применение ПМКТ ассоциируется с развитием ЛОНЧ, частота которого у пациентов с распространенным раком составляет примерно от 1% до 9% (таблица 1). Зачастую ЛОНЧ плохо поддается терапии и может быть причиной выраженной боли и снижения качества жизни. В многочисленных исследованиях было установлено, что методы профилактической санации полости рта в сочетании с правильным уходом за полостью рта ассоциируются с более низкой частотой возникновения ЛОНЧ 24.
Таблица 1. Препараты, модифицирующие костную ткань, и риск развития ЛОНЧ.
| Препарат | Показание | Путь введения | Доза, мг | Режим приема | Частота ЛОНЧ* |
|---|---|---|---|---|---|
| Памидронат | Костные метастазы при солидных опухолях | в/в | 90 | Каждые 3-4 недели | 3,2-5,0 [3, 4] |
| Множественная миелома | |||||
| Золедроновая кислота | Костные метастазы при солидных опухолях | в/в | 4 | Каждые 3-4 недели или 12 недель | 1,0-8,0 [5, 6] |
| Множественная миелома | |||||
| Адъювантная терапия | в/в | 4 | Каждые 3-6 месяцев | 0-1,8 7 | |
| Деносумаб | Костные метастазы при солидных опухолях | п/к | 120 | Каждые 4 недели | 0,7-6,9** 10 |
| Адъювантная терапия | п/к | 60 | Каждые 6 месяцев | 0 [13] |
Сокращения: в/в – внутривенно; ЛОНЧ – лекарственный остеонекроз челюсти; п/к – подкожно.
* Риск ЛОНЧ различается в зависимости от длительности лечения.
** Показатель 6,9% взят из двух исследований III фазы [10]. Этот показатель приведен без поправки на длительность лечения в пациенто-годах и без учета периода последующего наблюдения. Данный показатель не включает случаи, когда явление возникало во время слепой фазы лечения. После поправки на пациенто-годы частота подтвержденного ОНЧ составила 1,1% в период первого года лечения деносумабом, 37% во время второго года лечения и 4,6% в каждый последующий год [14].
Клинический вопрос 1. Каково определение остеонекроза челюсти (верхней и нижней), возникающего на фоне применения лекарственных препаратов у пациентов с онкологическими заболеваниями, и какой термин предпочтительнее использовать для данного состояния?
- Рекомендация 1.1. Если речь идет об остеонекрозе на фоне применения лекарственных препаратов, рекомендуется использовать термин «лекарственный остеонекроз челюсти» (тип рекомендации: формальный консенсус; уровень достоверности: недостаточный; сила рекомендации: слабая).
- Рекомендация 1.2. Для установления диагноза ЛОНЧ врачу следует убедиться, что присутствуют все три из нижеперечисленных критериев диагностики: 1) пациент получал или получает в настоящий момент терапию ПМКТ или ингибитором ангиогенеза; 2) кость обнажена или прощупывается через внутриротовой или внеротовой свищ челюстно-лицевой области, данное состояние отмечается на протяжении более 8 недель; 3) отсутствие в анамнезе лучевой терапии в области челюстей и метастазов в челюсти (тип рекомендации: формальный консенсус; уровень достоверности: недостаточный; сила рекомендации: слабая).
Клинический вопрос 2. Какие шаги следует предпринять для снижения риска развития ЛОНЧ?
- Рекомендация 2.1: Правильное планирование лечения пациента. Онкологическим пациентам, которые получают терапию вне отделений неотложной помощи, до начала терапии следует провести диагностику состояния полости рта (в том числе, по возможности, детальное обследование у стоматолога, пародонтолога и рентгенологическое исследование). В зависимости от полученных результатов может потребоваться план стоматологического лечения. Схема терапии пациента должна быть согласована между стоматологом и онкологом таким образом, чтобы необходимые стоматологические процедуры проводились до начала терапии ПМКТ. Далее стоматолог должен осуществлять регулярное наблюдение за состоянием пациента, например, каждые 6 месяцев после начала терапии ПМКТ (тип рекомендации: научно обоснованные данные; уровень достоверности: низкий/средний; сила рекомендации: средняя).
- Рекомендация 2.2. Управляемые факторы риска: специалисты междисциплинарной команды должны как можно ранее начать внедрение стратегии по снижению факторов риска ЛОНЧ у пациента. Факторы риска включают, в частности, неудовлетворительное состояние полости рта, инвазивные стоматологические процедуры, плохо подобранные зубные протезы, неконтролируемый сахарный диабет, курение (тип рекомендации: формальный консенсус; уровень достоверности: недостаточный; сила рекомендации: средняя).
- Рекомендация 2.3. Элективная дентоальвеолярная хирургия: в период активной терапии ПМКТ в дозе, необходимой для онкологического лечения, не следует проводить элективные дентоальвеолярные хирургические процедуры (например, удаление зуба по немедицинским показаниям, альвеолопластику, установку имплантов). Исключением могут быть случаи, когда специалист-стоматолог, компетентный в лечении и профилактике ЛОНЧ, взвесил все риски и пользу планируемой инвазивной процедуры и обсудил их с пациентом и командой онкологических специалистов (тип рекомендации: научно обоснованные данные; уровень достоверности: средний; сила рекомендации: средняя).
- Рекомендация 2.4. Контроль над состоянием пациента после дентоальвеолярной хирургии: после проведения дентоальвеолярной хирургии специалист (стоматолог/челюстно-лицевой хирург) должен регулярно и достаточно часто проводить оценку состояния пациента (например, каждые 6-8 недель) до момента полного восстановления слизистой в области хирургического вмешательства. При этом желательно держать врача-онколога в курсе того, как проходит процесс заживления, особенно если в дальнейшем планируется назначение ПМКТ (таблица 2) (тип рекомендации: формальный консенсус; уровень достоверности: недостаточный; сила рекомендации: средняя).
- Рекомендация 2.5. Временное прекращение применения ПМКТ перед проведением дентоальвеолярного хирургического вмешательства: существует ограниченное количество данных относительно того, следует ли прекращать применение ПМКТ перед проведением дентоальвеолярного хирургического вмешательства у онкологических пациентов, получающих ПМКТ в дозе, необходимой для онкологического лечения. Применение ПМКТ может быть прервано по усмотрению лечащего врача, при этом решение следует обсудить с пациентом и стоматологом (тип рекомендации: неформальный консенсус; уровень достоверности: недостаточный; сила рекомендации: слабая).
Клинический вопрос 3. Каковы стадии развития ЛОНЧ?
- Рекомендация 3.1. Для определения степени тяжести и стадии ЛОНЧ, а также принятия решений о выборе терапии необходимо руководствоваться разработанной системой классификации. В частности, можно применять систему классификации 2014 г. Американской ассоциации челюстно-лицевых хирургов, Общие терминологические критерии нежелательных явлений, версия 5.0, и классификацию ЛОНЧ 2017 г. Международной рабочей группы по остеонекрозу челюсти. На протяжении всего курса лечения пациента должна использоваться одна и та же система классификации. В дополнение к этим системам классификации можно использовать данные методов диагностической визуализации (тип рекомендации: формальный консенсус; уровень достоверности: недостаточный; сила рекомендации: слабая).
- Рекомендация 3.2. Желательно, чтобы определение стадии заболевания проводил врач с опытом ведения пациентов с ЛОНЧ (тип рекомендации: формальный консенсус; уровень достоверности: недостаточный; сила рекомендации: слабая).
Клинический вопрос 4. Какова тактика лечения ЛОНЧ?
- Рекомендация 4.1: Начальная терапия ЛОНЧ. Начинать терапию ЛОНЧ следует с консервативных методов лечения. Консервативные меры могут включать антибактериальное полоскание полости рта, антибиотикотерапию по клиническим показаниям, эффективные способы гигиены полости рта и консервативное хирургическое вмешательство, например, удаление поверхностных костных спикул (тип рекомендации: формальный консенсус; уровень достоверности: недостаточный; сила рекомендации: средняя).
- Рекомендация 4.2: Терапия рефрактерного ЛОНЧ. Агрессивное хирургическое вмешательство (например, пластика лоскутом слизистой оболочки, блоковая резекция некротизированной костной ткани или ушивание мягких тканей) может применяться в случаях, если, несмотря на проведение консервативной терапии, симптомы ЛОНЧ сохраняются или нарушают функционирование. Не рекомендуется проводить агрессивное хирургическое вмешательство при бессимптомном обнажении кости. Перед проведением агрессивного хирургического вмешательства медицинским специалистам междисциплинарной команды вместе с пациентом следует обсудить риски и пользу планируемого вмешательства (тип рекомендации: формальный консенсус; уровень достоверности: недостаточный; сила рекомендации: слабая).
Клинический вопрос 5. Следует ли на время прекратить терапию ПМКТ после того, как был установлен диагноз ЛОНЧ?
- Рекомендация 5. Существует ограниченное количество данных относительно того, следует ли прекращать применение ПМКТ пациентам, у которых был диагностирован ЛОНЧ на фоне терапии ПМКТ. Применение ПМКТ может быть прервано по усмотрению лечащего врача, при этом решение следует обсудить с пациентом и стоматологом (тип рекомендации: формальный консенсус; уровень достоверности: недостаточный; сила рекомендации: слабая).
Клинический вопрос 6. Какие критерии оценки исхода заболевания следует использовать в клинической практике для определения ответа на лечение при ЛОНЧ?
- Рекомендация 6. При проведении курса лечения ЛОНЧ стоматолог/узкий специалист в области стоматологии должен информировать врача-онколога об объективном и субъективном статусе места поражения: состояние разрешилось, улучшилось, стабилизировалось или прогрессирует. В зависимости от того, как протекает ЛОНЧ, может потребоваться проведение/изменение местной и/или системной терапии в связи с прекращением или возобновлением ПМКТ (тип рекомендации: формальный консенсус; уровень достоверности: недостаточный; сила рекомендации: слабая).
По мнению организаций MASCC/ISOO и ASCO, онкологические клинические исследования необходимы для принятия ответственных медицинских решений и для улучшения качества онкологического лечения. Все пациенты должны иметь возможность принять участие в клинических исследованиях.
В статье представлен обзор литературы о текущем состоянии проблемы бисфосфонатного остеонекроза челюсти, сформулированы рекомендации по тактике лечения пациентов, а также предложены меры, направленные на профилактику развития данного осложнения. С каждым годом спрос на информацию о бисфосфонатах увеличивается, так как длительное использование этого лекарства проявляется нежелательным явлением в виде бисфосфонатного остеонекроза челюсти. Бисфосфонатным некрозом челюсти называют осложнение антирезорбтивной терапии, характеризующиеся некрозом и оголением кости, которое длится более восьми недель, с последующим прогрессированием процесса при условии отсутствия лучевой терапии в челюстно-лицевой области в анамнезе. Бисфосфонаты являются одними из самых предписываемых препаратов в мире у пациентов с высоким уровнем заболеваемости раком и частыми метастазами в кости. Приведенный в статье анализ известных на сегодняшний момент данных должен привлечь внимание врачей к данной проблеме.
5. Cella L., Oppici A., Arbasi M. et al. Autologous bone marrow stem cell intralesional transplantation repairing bisphosphonate related osteonecrosis of the jaw. Head Face Med. 2011; 7: 16.
7. Fliefel R., Tröltzsch M., Kühnisch J. et al. Treatment strategie and outcomes of bisphosphonate-related osteonecrosis of the jaw (BRONJ) with characterization of patients: a systematic review. Int. J. Oral. Maxillofac. Surg. 2015; 44 (5) : 568
12. Marx R.E., Sawatari Y., Fortin M., Broumand V. Bisphosphonate-induced exposed bone (osteonecrosis/osteopetrosis) of the jaws: risk factors, recognition, prevention, and treatment. J. Oral. Maxillofac. Surg. 2005; 63: 1567–1575.
13. Ripamonti C.I., Cislaghi E., Mariani Maniezzo M. Efficacy and safety of medical ozone (O(3) ) delivered in oil suspension applications for the treatment of osteonecrosis of the jaw in patients with bone metastases treated with bisphosphonates: preliminary results of a phase I–II study. Oral. Oncol. 2011; 47: 185–190.
14. Rollason V., Laverrière A., MacDonald L.C. et al. Interventions for treating bisphosphonate-related osteonecrosis of the jaw (BRONJ). Cochrane Database Syst. Rev. 2016; 26: 2 CD008455. DOI: 10.1002/14651858.
17. Давыдов М.И. Статистика злокачественных новообразований в России и странах СНГ в 2006 г. Вести российского онкологического научного центра им. Н.Н. Блохина РАМН 2008; 19: 2: прил 1: 52–58.
18. Заславская Н.А., Дробышев А.Ю., Волков А.Г. Опыт лечения остеонекрозов челюстей у пациентов, получающих антирезорбтивную терапию (бисфосфонаты, «Деносумаб»). Cathedra. 2014; (47) : 32–34.
19. Слетов А.А., Сирак С.В., Давыдов А.Б. и др. Аппаратный метод лечения переломов нижней челюсти при бисфосфонатных остеонекрозах. Стоматология для всех. 2014; (2) : 32–36. [Sletov A.A., Sirak S.V., Davydov A.B. et al. Hardware method of treatment mandibular fractures bisphosphonate osteonecrosis. Stomatologiya dlya vsekh. 2014; (2) : 32–36. (In Russ.) ]
20. Сулейманов A.M., Мингазов Г.Г., Саляхова Г.А. Бисфосфонатные остеонекрозы челюстей. Мед. вестн. Башкортостана. 2012; 7 (2) : 112–115.
21. Тарасенко С.В., Дробышев А.Ю., Шипкова Т.П. и др. Тактика лечения больных с бисфосфонатным остеонекрозом челюстей. Рос. стоматол. 2012; (2) : 3–13.2
22. Торопцова Н.В., Беневоленская Л.И. Бисфосфонаты: приверженность терапии – залог успешного лечения остеопороза. Соврем. ревматол. 2008; (1) : 78–81.
В течение последних пятнадцати лет наблюдается растущий спрос на информацию о бисфосфонатах, так как длительное использование этого лекарства позволило выявить нежелательные явления, проявляющиеся в виде бисфосфонатного остеонекроза челюсти (БОНЧ). Эта проблема актуальна, поскольку, раньше частота осложнений ограничивалась единичными клиническими наблюдениями, а сейчас, по сведениям разных авторов, в среднем, достигает 12% [Bamias A., Bartl R., Dimopoulos M., Marx R.E.]. Приведенный в статье анализ известных на сегодняшний момент данных должен привлечь внимание врачей к данной проблеме.
Цель – изучить текущее состояние проблемы бисфосфонатного остеонекроза челюсти (БОНЧ).
– выявить факторы риска возникновения БОНЧ;
– изучить особенности клинической картины БОНЧ;
– сформулировать рекомендации по профилактике БОНЧ.
Материалы и методы. Проведен анализ научной литературы, научных статей и стоматологических журналов.
Результаты и обсуждение
Впервые информация об остеонекрозе челюсти у пациентов, принимающих бисфосфонаты, была опубликована в 2003 году [6]. Последующие публикации вызвали еще больше обеспокоенность врачей. Вследствие этого производители бисфосфонатов издали письмо-предостережение врачам – онкологам и челюстно-лицевым хирургам.
Бисфосфонаты являются одними из самых предписываемых препаратов в мире у пациентов с высоким уровнем заболеваемости раком и частыми метастазами в кости. Этот вид лекарств, который предотвращает потерю костной массы, имеет различные показания и используется для профилактики и лечения остеопороза, лечения болезни Педжета и паранеопластической гиперкальциемии; его применяют как часть схемы лечения рака, особенно метастатического рака кости и множественной миеломы [8]. В России эти злокачественные новообразования составляют 25% в общей структуре онкологической заболеваемости [17]. Различают два класса бисфосфонатов: азотсодержащие (ибандронатовая кислота, золендроновая кислота, алендронат натрия, ибандронат натрия) и без содержания азота (клодроновая кислота, этидронат натрия, тилудронат натрия). Несмотря на то, что лечение бисфосфонатами имеет много преимуществ для пациентов с заболеваниями костной ткани, оно также имеет ряд неблагоприятных эффектов. Наиболее серьезным, из которых является остеонекроз челюсти.
Бисфосфонатным некрозом челюсти называют осложнение антирезорбтивной терапии, характеризующиеся некрозом и оголением кости, которое длится более восьми недель, с последующим прогрессированием процесса при условии отсутствия лучевой терапии в челюстно-лицевой области в анамнезе [6]. Чаще всего процесс развития остеонекроза возникает на нижней челюсти, чем на верхней. Сочетанное повреждение челюстей встречается крайне редко [7]. Поражения могут быть разными по размеру и степени тяжести [12]. На сегодняшний день о развитии БОНЧ у детей и подростков не сообщалось. Выделяют 4 стадии БОНЧ. При 0-й стадии возможно отсутствие обнажения некротизированной кости. 1-я стадия характеризуется обнажением участка некротизированной кости без признаков воспаления и боли. На 2-й стадии наблюдается появление боли и явлений воспаления на обнаженном участке. Во время 3-й стадии встречается один или несколько признаков: обнажение альвеолярной кости, наличие патологического перелома, свищевой ход на коже.
Основополагающие патофизиологические механизмы, лежащие, в основе БОНЧ на данный момент до конца не изучены. Бисфосфонаты ингибируют пролиферацию эндотелия, прерывают внутрикостную циркуляцию и костный кровоток, способствуя развитию остеонекроза [13]. Эту группу препаратов можно рассматривать как селективные лекарственные средства, так как бисфосфонаты поглощаются преимущественно остеокластами в участках активной перестройки кости. Сообщается, что БОНЧ проявляется через 6 – 60 месяцев после начала лечения бисфосфонатами. В костной ткани происходит кумуляция препарата.
Кость челюсти (частично или полностью) становится хрупкой как мел и со временем может обнажаться [11]. Это является причиной сильной боли, а также вызывает проблемы во время приема пищи, разговора, проведения чистки зубов.
Предшествующими событиями развития БОНЧ часто является: удаление зубов, заболевания периодонта, мандибулярные экзостозы, установка дентальных имплантов. Другие факторы, способствующие распространению инфекции, включают в себя: местную инфекцию, использование кортикостероидов и химиотерапию. Также сообщалось, что негативное влияние оказывает плохой стоматологический статус, употребление алкоголя и табака, преклонный возраст, диабет, иммуносупрессия [4].
Известно, что кости челюсти наиболее уязвимы к инфекции, являются своего рода «мишенью», поскольку полость рта имеет тонкую слизистую оболочку. [9]. Кроме того, бактерии имеют более легкий путь к челюсти через тонкие периодонтальные связки. По мнению многих авторов, развитие остеонекроза происходит в челюстных костях из-за особенностей их строения, поскольку, кортикальная костная ткань челюстей имеет скудную васкуляризацию. Бисфосфонаты значительно ухудшают заживление костей, тем самым повышают риск остеонекроза.
К клиническим проявлениям БОНЧ относят: нарушение чувствительности; боль и отек на пораженной челюсти, при отсутствии патологии зубочелюстной системы; нагноение мягких тканей, дефекты слизистых оболочек с гладкими или неровными краями с оголением кости на верхней или нижней челюсти, сохраняющиеся более восьми недель.
Бисфосфонаты назначают перорально и внутривенно. Сообщалось, что БОНЧ чаще всего встречался у пациентов, которые получали золедроновую кислоту, гораздо реже отмечался при приеме пероральных бисфосфонатов [11].
Ключевым фактором этих путей введения является биодоступность. Распространенность остеонекроза челюсти у пациентов, принимающих оральные бисфосфонаты, варьирует от 0,07 до 0,10% [3]. Повышение биодоступности путем парентерального введения повышает эффективность препарата, но может являться причиной более высокой распространенности БОНЧ. В среднем колеблется от 0,8 до 20% [5].
Несмотря на то, что риск не может быть устранен, прогноз обычно хорош для пациентов, принимающих пероральные бисфосфонаты. Площадь экспозиции кости обычно ограничена (от 2 до 10 мм) и имеет меньшую степень тяжести по сравнению с пациентами с раком, которые получают внутривенную терапию. При исследовании остеонекроза челюсти, вызванного пероральными бисфосфонатами, после четырехмесячного перерыва приема лекарства, было достигнуто полное разрешение в 16 из 17 случаев: 11 разрешенных – без хирургического вмешательства, 3 – с местным лечением, а 2 – с резекцией нижней челюсти. Считается, что заболеваемость БОНЧ является низкой в течение 6 месяцев после начала терапии бисфосфонатом, и поэтому пациенты, которые только начали эту терапию, должны пройти тщательную оценку и лечение зубов, если это не было проведено профилактически.
Всем пациентам, которые начинают принимать бисфосфонаты, рекомендуется определить факторы риска БОНЧ (травмы челюсти, активная зубная инфекция, удаление зубов), регулярно проходить стоматологическое обследование, поддерживать хорошую гигиену полости рта и обязательно сообщать о любых симптомах, локализованных в полости рта. Следует избегать хирургических вмешательств.
На начальных стадиях симптоматика может быть недостаточно выражена. Диагноз ставят при визуальном осмотре на основании клинических данных. Диагностировать остеонекроз челюсти можно с помощью МРТ, рентгенодиагностики и компьютерной томографии. Применение лучевых методов значительно расширяет возможности диагностики и способствует постановке диагноза на ранних стадиях [18].
Целью лечения остеонекроза челюсти является предотвращение потери костной массы, сохранение пораженных суставов, стимулирование роста новой кости. Тип лечения зависит от стадии, на которой был диагностирован БОНЧ и объема пораженной челюстной кости. Выделяют два метода лечения БОНЧ – консервативный и хирургический. Консервативная терапия предполагает назначение антибактериального курса, симптоматическую терапию, ежедневную обработку очагов поражения растворами антисептиков [1]. При выборе хирургического метода, производят кюретаж лунок удаленных зубов, резекцию челюсти, секвестрэктомию [2].
Дополнительно с основными методами лечения, некоторые авторы, успешно используют озонотерапию, эрбиевый лазер и крайне высокочастотную терапию [8, 9, 10, 14].
На данный момент нельзя выявить лиц, у которых в последствие разовьется БОНЧ [21]. Лечение бисфосфонатами необходимо назначать всем нуждающимся в нем пациентам, но следует проводить регулярную санацию полости рта. Врачи, которые сталкиваются в своей практике с данной проблемой, должны быть проинформированы о существующем риске БОНЧ. Необходимо своевременно осведомлять пациентов, что терапия бисфосфонатами должна быть отложена, пока не проведется лечение зубов [22].
При лечении пациентов, принимающих бисфосфонаты, врачи должны руководствоваться индивидуальным подходом, так как вероятность возникновения БОНЧ зависит от класса бисфосфонатов, длительности приема, особенностей пациента и стоматологического лечения.
Ранняя диагностика БОНЧ имеет решающее значение для предотвращения чрезмерной потери костной массы.
С целью уменьшения риска развития БОНЧ, пациентам необходимо проводить профилактическую процедуру – санацию полости рта перед началом терапии. В дальнейшем, пациенты должны быть под динамическим наблюдением стоматолога. Больные, в свою очередь, обязаны соблюдать хорошую гигиену полости рта.
Побочные эффекты при приеме нестероидных противовоспалительных лекарств — чем они опасны?

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 13.06.2022
- Reading time: 5 минут чтения
Доказано, что нестероидные противовоспалительные лекарства негативно влияют на пищеварительную систему, способствуют возникновению гипертонии, проявляют гепатотоксические свойства, обостряют респираторные заболевания, вызывают аллергию и гематологические осложнения. Побочные эффекты возникают и в результате передозировки, и независимо от принятой дозы.
Разберемся, чем и для кого опасны НПВП и рассмотрим симптомы, связанные с побочными эффектами этих лекарств.
Побочные эффекты НПВП
К побочным эффектам лекарственного средства относят любой непреднамеренный и неблагоприятный эффект, возникающий при приеме рекомендуемых доз в диагностических, профилактических или терапевтических целях. Серьезные нежелательные эффекты лекарств возникают независимо от принятой дозы.
К тяжелым побочным эффектам относят любые события, отвечающие одному или нескольким условиям:
- Вызывающие необходимость госпитализации или ее продления.
- Приносящие значительный ущерб здоровью, опасный для жизни. Например, внутримозговое кровоизлияние, анафилактический шок, инфаркт миокарда, гибель.
- Приводящие к повреждению плода и врожденным аномалиям.
Особая группа — неожиданные побочные реакции.
Осложнения, вызванные приемом лекарств, можно разделить на:
- субъективные, которые пациент ощущает, но их сложно подтвердить;
- объективные, которые легко обнаружить.
Также существует классификация по типам, включающая 6 основных групп, отмеченных буквами алфавита от A до F.
Таблица 1. Виды побочных эффектов НПВП
| Тип и условие побочного эффекта | Характеристика нарушений | Примеры симптомов |
| А — дозозависимый | Частые лекарственные осложнения, зависящие от введенной дозы. Симптомы быстро проходят после прекращения приема препарата. Основные причины: разнонаправленное действие препарата, низкая селективность, ошибочная передозировка. Иногда вызваны взаимодействием лекарств или продуктов питания или являются вторичными лекарственными осложнениями. | Одышка, нарушения слуха и равновесия, поражение органов, реакция Яриша-Герксгеймера в виде кожных поражений и др. симптомов |
| B — дозозависимый | Представляет четверть всех осложнений, связанных с приемом лекарств. Обычно это непредсказуемые, иммунологические симптомы — реакции гиперчувствительности по Джеллу и Кумбсу, псевдоаллергические реакции и реакции, обусловленные генетическими детерминантами. Такие побочные эффекты требуют отмены лечения | Анафилактический шок, гемолитическая анемия, крапивница |
| C — зависит от длительности приема | В эту группу входят побочные эффекты от препаратов, используемых, несмотря на заведомо известные побочные эффекты, лекарственные заболевания, опиоидных обезболивающих и слабительных. | Остеопороз после длительного приема глюкокортикоидов, тромбоз у женщин, принимающих противозачаточные средства |
| D — с задержкой по времени | Могут возникать через несколько месяцев и даже лет после окончания терапии. | Возникновение новообразований репродуктивного тракта у дочерей женщин, принимавших диэтилстильбэстрол во время беременности |
| E — вызван отменой препарата | Вызваны внезапным прекращением приема лекарств, назначаемых пожизненно. Болезнь может рецидивировать или усугубиться. | Внезапное прекращение терапии бета-адреноблокаторами может быть причиной тяжелых симптомов ишемической болезни сердца |
| F — недостаточная эффективность терапии | Эти типы осложнений обычно вызваны лекарственной устойчивостью. | Растущая бактериальная резистентность может сделать противомикробный препарат неэффективным. |
Виды побочных эффектов от приема нестероидных противовоспалительных препаратов
Нестероидные противовоспалительные препараты характеризуются обезболивающим, противовоспалительным, жаропонижающим и антикоагулянтным действием. Некоторые лекарства из этой группы выпускаются в аптеке без рецепта. Часто бывает так, что пациент использует несколько НПВС одновременно или использует их постоянно без консультации с врачом, несмотря на противопоказания.
Необоснованное, хроническое самолечение нестероидными противовоспалительными препаратами приводит к развитию побочных эффектов со стороны желудочно-кишечного тракта, почек и печени, а также может вызвать приступ одышки у пациентов с аспириновой астмой даже после приема разовой дозы препарата.
Влияние НПВП на ЖКТ
Симптомы со стороны желудочно-кишечного тракта испытывает каждый третий пациент, принимающий НПВП.
Слабые кислоты ослабляют слизистую желудка и повреждают естественный защитный барьер желудочно-кишечного тракта, подавляя выработку простагландинов, что приводит к язвам и эрозиям. Также НПВП снижают количество вырабатываемой желудком кислоты. При этом несмотря на уменьшение объема раствора, концентрация ионов водорода сохраняется, что повышает эрозионную активность.
НПВП также способствуют развитию кровотечений из нижних и верхних отделов ЖКТ и энтеропатии, особенно у больных старше 65 лет, больных с язвами и кровотечениями в анамнезе.
Другие негативные эффекты их приема включают: диарею, тошноту и расстройство желудка
Значительно увеличивает риск гастропатии и лекарственной энтеропатии, не увеличивая при этом эффективность лекарств, комбинация двух или более НПВП.
Чтобы снизить вредное воздействие, НПВС следует принимать после еды, запивая большим количеством воды, чтобы свести к минимуму раздражение ЖКТ. Также по этой же причине не стоит принимать эти препараты непосредственно перед сном, так как они могут прилипать к пищеводу и раздражать его, вызывая перфорации.
Влияние НПВП на развитие гипертонии и сердечно-сосудистых заболеваний
Результаты исследований, представленные на конгрессе Европейского общества кардиологов (2017), показали, насколько высок риск развития гипертонии при приеме целекоксиба, ибупрофена и напроксена через 4 месяца терапии ревматических заболеваний. У больных, принимающих ибупрофен, систолическое артериальное давление повышалось на 3 мм рт. и этих пациентов чаще госпитализировали из-за артериальной гипертензии. В группе среднего риска оказался напроксен. Минимальные риски были отмечены при приеме целекоксиба.
Другое исследование показало, что Рофекоксиб увеличивает риск сердечного приступа, а диклофенак, лумиракоксиб и ибупрофен — инсульта. Диклофенак и эторикоксиб также увеличивают вероятность смерти от сердечно-сосудистых причин.
Хроническое использование высоких доз НПВП (за исключением сердечных доз ацетилсалициловой кислоты) оказывает неблагоприятное влияние на агрегацию тромбоцитов и артериальное давление и повышает риск сердечно-сосудистых событий, включая инсульты и сердечные приступы. Это касается и группы селективных ингибиторов ЦОГ-2 (коксибов), представители которых (рофекоксиб, вальдекоксиб) по этой причине были запрещены во многих странах уже 20 лет назад.
Поражение почек при приеме нестероидных противовоспалительных препаратов
Назначение НПВП пациентам в ситуации пониженного кровотока, например, пожилым в состоянии стресса, увеличивает риск поражения почек. Это связано с тем, что обезболивающие, взаимодействуя с ЦОГ-1, блокируют образование простагландинов PGE 2 и PGI 2 в почках. Это, в свою очередь, снижает перфузию почек, что приводит к острой почечной недостаточности.
Влияние НПВП на печень
Чаще отмечается бессимптомное повышение печеночных ферментов, в основном трансаминаз. Однако длительный прием высоких доз нестероидных ПВ лекарств приводит к повреждению клеток печени.
НПВП проявляют гепатотоксические свойства при высокой концентрации в печени и желчных протоках. Один из механизмов их действия — проникновение через мембраны гепатоцитов, что приводит к повреждению митохондрий. Напрямую повреждает гепатоциты диклофенак. Комбинация двух или более препаратов увеличивает риск гепатотоксичности в 6 раз.
Наибольшей гепатотоксичностью характеризуется Нимесулид, поэтому рекомендуется ограничить терапию нимесулидом до 14 дней. В случае появления симптомов: боли в животе, тошнота, рвота, отсутствие аппетита, желтуха, нужно срочно обратиться к врачу.
То же самое относится и к целекоксибу. Пациентам, страдающим умеренной печеночной недостаточностью, этот препарат следует начинать принимать с половины рекомендуемой дозы.
Значительный гепатотоксический эффект проявляет и парацетамол, часто ошибочно относимый к группе нестероидных противовоспалительных препаратов. Его эффект значительно усиливается алкоголем.
Гематологические осложнения при приеме нестероидных противовоспалительных препаратов
Первое гематологическое осложнение НПВП — лекарственная гемолитическая анемия на фоне приема ибупрофена и пара-аминосалициловой кислотой. Этот побочный эффект не зависит от количества и частоты приема препарата. На риски влияет индивидуальная восприимчивость к препарату.
Второе — селективная аплазия эритроцитов, связанная с приемом аминосалициловой и ацетилсалициловой кислоты. P-аминосалициловая кислота, используемая в медицине в качестве анальгетика и жаропонижающего средства, также может вызывать метгемоглобинемию.
НПВП также могут быть причиной возникновения лекарственно-индуцированной гранулоцитопении, составляющей примерно 40% всех гематологических осложнений, вызванных лекарственными средствами.
Другие осложнения, вызванные приемом НПВП
Среди частых осложнений стоит отметить:
- Обострение заболеваний дыхательных путей. Развивается на почве хронического ринита или бронхиальной астмы. Симптомы: приступы одышки, кашля, хрипов, насморка. Это острая реакция, развивающаяся после приема препарата через нескольких минут или часов.
- Кожные симптомы. Возникают на основе хронической крапивницы и проявляется острыми симптомами — отечностью и сыпью.
- Острая аллергия.Анафилаксия / отек / крапивница, на фоне лекарственной и пищевой аллергии.
- Реакции замедленного типа, вызванные однократным приемом НПВП. Симптомы: аллерго-токсический Синдром Стивенса-Джонсона, выражающийся образованием язв на слизистых, отслоением эпидермиса и др. симптомами, стойкая эритема, фотоаллергические реакции, макулопапулезные высыпания, нефрит, менингит.
У людей, страдающих астмой или аллергическими заболеваниями, НПВС усугубляют аллергические реакции и провоцируют приступы одышки через бронхоспазм.
Причины усиления побочных эффектов
- Применение нескольких НПВП одновременно. Такая тактика лечения нецелесообразна, поскольку накапливаются побочные эффекты, затрагивающие верхние отделы желудочно-кишечного тракта, печени и почек, а терапевтический эффект не усиливается.
- Длительный прием лекарств из группы НПВС. Эта тактика несет риск снижения кровотока через почки. Риски повреждения почек препаратами, выводимыми с мочой, возрастает с продолжительностью их действия. Нарушение функции почек приводит к задержке натрия в организме, что проявляется повышенной жаждой, сухостью слизистых оболочек и сердцебиением.
- Избыток натрия в организме. Приводит к снижению выведения воды и образованию отеков, предрасполагает к развитию гипертонической болезни. Если у больного уже есть гипертония, нестероидные противовоспалительные препараты усиливают ее, в том числе за счет ослабления действия антигипертензивных препаратов.
- Подавление синтеза цитопротекторных простагландинов. Отвечает за гастротоксическое действие. НПВП снижают рН желудочного сока, уменьшают секрецию слизи и кровоток через стенки желудка, что становится причиной образования язвы желудка. Симптомы раздражения слизистой оболочки кишечника и желудочно-кишечного кровотечения: рвота, боли в животе, чередование поноса с запорами, изжогой и потерей веса.
Нужно запивать НПВП большим количеством воды и не употреблять их чаще, чем каждые 4 – 6 часов. Лучше всего принимать такие таблетки вместе с пищей. Это несколько задерживает результат, но значительно снижает риск раздражения слизистой оболочки желудка.
Читайте также:
- Недостаточность коры надпочечников - сиптомы, причины, как лечить
- Наращивание ногтей биогелем. - Преимущества и недостатки
- Пересадка слизистой при ожогах конъюнктивы и роговицы. Рекомендации
- Диск зрительного нерва при альбинизме
- Гистологическое строение себорейной карциномы. Лечение себорейной карциномы.
