Недостаточность коры надпочечников - сиптомы, причины, как лечить
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Что такое надпочечниковая недостаточность (недостаточность коры надпочечников, гипокортицизм)?
Недостаточность коры надпочечников - это синдром, все проявления которого являются следствием недостаточности выделения гормонов коры надпочечников в кровь.
Причины, вызывающие недостаточность коры надпочечников
Недостаточность коры надпочечников бывает острая и хроническая. Хроническая недостаточность коры надпочечников может быть первичной и вторичной.
Первичная недостаточность коры надпочечников (болезнь Аддисона) возникает в результате разрушения ткани самого надпочечника. Первичная недостаточность надпочечников развивается, если сохранено и функционирует менее 10-15% ткани надпочечника.
К предрасполагающим факторам первичной надпочечниковой недостаточности относятся:
инфекционные заболевания (сифилис, туберкулез, грибковые заболевания надпочечников); амилоидоз надпочечников; ВИЧ-инфекция; идиопатическая атрофия коры надпочечника (аутоиммунный процесс, при этом в организме по неизвестной пока причине нарушается система иммунного контроля, и образуются аутоантитела, разрушающие клетки собственных надпочечников).
Вторичная недостаточность коры надпочечника возникает при заболеваниях головного мозга с поражением гипофиза или гипоталамуса (опухоли головного мозга, черепно-мозговые травмы, после операций на головном мозге, после лучевой терапии, при различных интоксикациях), которые в норме контролируют работу надпочечников.
Острая надпочечниковая недостаточность, или аддисонический криз - острое коматозное состояние.
Острая недостаточность коры надпочечников может развиться:
- на фоне уже имеющейся хронической недостаточности гормонов коры надпочечников;
- при оперативном удалении надпочечников по поводу болезни Иценко-Кушинга (синдром Нельсона);
- при резкой отмене глюкокортикоидов, назначенных с целью лечения.
Причиной острой надпочечниковой недостаточности может стать аутоиммунный тиреоидит (синдром Шмидта).
Острая недостаточность коры надпочечников может возникнуть у новорожденного вследствие кровоизлияния в надпочечники во время тяжелых и затяжных родов, вследствие родовой травмы или воздействия различных инфекций. Такое состояние называется синдром Уотерхауза-Фридериксена. У взрослых и пожилых людей кровоизлияние в надпочечники может произойти на фоне травм живота и грудной клетки, при передозировки антикоагулянтов, при оперативных вмешательствах, сепсисе, перитонитах, ожогах.
При недостаточности коры надпочечников резко падает содержание в крови их гормонов – глюкокортикоидов и минералокортикоидов. При этом организм теряет способность адаптации к стрессовой ситуации.
Признаки, характерные для недостаточности коры надпочечников
Первичная надпочечниковая недостаточность (аддисонова болезнь) - встречается сравнительно редко, возникает в любом возрасте и представителей обоего пола.
Первичная недостаточность коры надпочечников обычно начинается постепенно. В начале появляются жалобы на слабость, утомляемость, особенно к вечеру. Иногда такая слабость возникает только после физических нагрузок или стрессовых ситуаций. Ухудшается аппетит, пациенты часто болеют простудными заболеваниями. Появляется плохая переносимость солнечного излучения, сопровождающаяся стойким загаром.
С течением болезни Аддисона мышечная слабость становится все более выраженной. Пациенту тяжело осуществлять любые движения. Даже голос становится тихим. Снижается масса тела. Почти у всех больных появляется стойкая гиперпигментация (усиление окраски кожи), особенно в местах трения одежды, на открытых местах тела, подвергающихся загару, усиливается окраска сосков, губ, щек. Возникает стойкое снижение артериального давления, учащение сердечного ритма. Появляются нарушения со стороны желудочно-кишечного тракта: тошнота, рвота, запор, сменяющийся поносом. Снижается количество глюкозы в крови. Нарушается работа почек, часто проявляющаяся ночным мочеиспусканием. Со стороны центральной нервной системы возникают нарушения внимания, памяти, депрессивные состояния. У женщин в связи с недостатком андрогенов выпадают волосы на лобке и в подмышечных впадинах.
У больных с вторичной недостаточностью коры надпочечников отмечаются большинство тех же признаков и симптомов, что у больных с аддисоновой болезнью, но для них характерно отсутствие гиперпигментации.
Для аддисонического криза характерны: сердечно-сосудистая недостаточность, падение артериального давления, желудочно-кишечные расстройства (неукротимая рвота, жидкий многократный стул), нервно-психические нарушения.
Прогноз
Прогноз у больных с аддисоновой болезнью зависит в основном от профилактики и лечения аддисоновых кризов. В случае инфекции, травмы, включая хирургические операции, желудочно-кишечных расстройств или других видов стресса необходимо немедленно увеличивать дозы принимаемого гормона. Лечение должно быть направлено на быстрое повышение уровня глюкокортикоидов в крови и восполнение дефицита натрия и воды.
Что может сделать Ваш врач?
Диагностика ранних стадий недостаточности надпочечников часто затруднена. Однако легкие нарушения со стороны желудочно-кишечного тракта с уменьшением массы тела, потерей аппетита и подозрением на усиленную пигментацию оправдывают проведение специальных провоцирующих тестов, для исключения недостаточности надпочечников, особенно до начала заместительной терапии гормонами. Все больные с аддисоновой болезнью должны получать специфическую заместительную терапию с гормонами: глюкокортикоиды и минералокортикоиды.
В процессе лечения больных с аддисоновой болезнью следует периодически регистрировать массу тела, уровень калия в сыворотке крови и артериальное давление.
Заместительная глюкокортикоидная терапия у больных с вторичной недостаточностью коры надпочечников не отличается от таковой у больных с аддисоновой болезнью. В заместительной минералокортикоидной терапии обычно нет нужды. Во всем остальном лечение больных с вторичной недостаточностью коры надпочечников базируются на тех же принципах.
Адекватная заместительная терапия кортикостероидными гормонами под постоянным контролем – наиболее эффективные методы профилактики аддисонического криза.
Что можете сделать Вы?
При появлении вышеперечисленных симптомов необходимо незамедлительно обратиться к врачу. В случае нелечения данного заболевания в любой момент может возникнуть аддисонический криз, который тяжело поддается лечению и может привести к гибели.
Перед началом применения любого препарата посоветуйтесь со специалистом и ознакомьтесь с инструкцией по применению.
Гиперальдостеронизм - симптомы и лечение
Что такое гиперальдостеронизм? Причины возникновения, диагностику и методы лечения разберем в статье доктора Матвеева М. А., эндокринолога со стажем в 11 лет.
Над статьей доктора Матвеева М. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
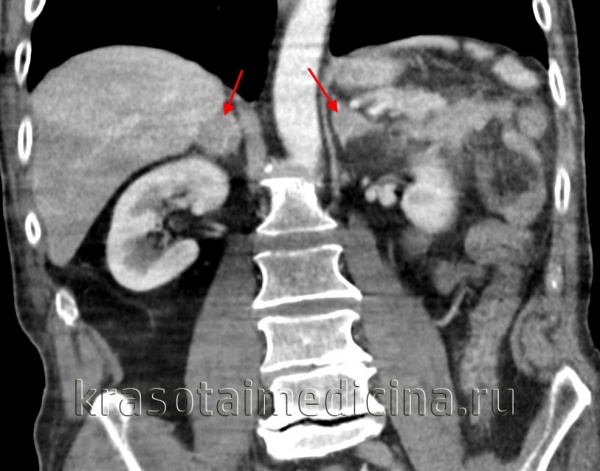
Определение болезни. Причины заболевания
Гиперальдостеронизм — это синдром, при котором кора надпочечников вырабатывает повышенное количество гормона альдостерона. Он сопровождается развитием артериальной гипертензии и поражением сердечно-сосудистой системы [1] . Нередко артериальная гипертензия, развившаяся на фоне повышенного уровня альдостерона, носит злокачественный характер: крайне плохо поддаётся медикаментозной коррекции и приводит к ранним и серьёзным осложнениям, таким как ранний инсульт, инфаркт миокарда, фибрилляция предсердий, внезапная сердечная смерть и др.
Гиперальдостеронизм является одной из самых частых причин артериальной гипертензии. По некоторым данным, он выявляется в 15-20 % всех случаев [5] .
В силу стёртой клинической картины данный синдром диагностируется редко. Однако его выявление имеет огромное значение как из-за своей распространённости, так и в связи с возможным своевременным лечением причины артериальной гипертензии и предотвращением тяжёлых сердечно-сосудистых осложнений, улучшая прогноз и качество жизни пациентов.
Кора надпочечников выделяет большое количество альдостерона либо автономно, либо в ответ на стимулы вне надпочечников.
Причинами автономной секреции альдостерона являются заболевания надпочечников:
- аденома (доброкачественная опухоль) надпочечника, продуцирующая альдостерон (синдром Крона);
- двусторонний идиопатический гиперальдостеронизм (точна причина неизвестна);
- односторонняя гиперплазия надпочечника (развивается в результате микро- или макронодулярного разрастания клубочковой зоны коры одного надпочечника);
- семейный гиперальдостеронизм (наследственное заболевание, встречается крайне редко);
- карцинома (злокачественная опухоль) надпочечника, вырабатывающая альдостерон.
Самой частой причиной гиперальдостеронизма является аденома (обычно односторонняя), состоящая из клеток клубочковой зоны. У детей аденомы встречаются редко. Как правило, это состояние у них вызвано раком или гиперплазией (разрастанием) одного надпочечника. У пожилых пациентов аденома встречается реже. Она связана с двусторонней гиперплазией надпочечников [4] [10] .
Вненадпочечниковыми причинами синдрома являются:
- стеноз (сужение) почечной артерии, приводящий к снижению почечного кровотока и, как следствие, гиперсекреции альдостерона;
- почечная вазоконстрикция (сужение любых сосудов почки), в том числе из-за опухолевого процесса;
- застойная сердечная недостаточность, цирроз печени с асцитом (скоплением жидкости в брюшной полости) и др., т. е. состояния, которые приводят к повышению альдостерона за счёт снижения печеночного кровотока и скорости метаболизма альдостерона [10] .
Крайне редко возможно развитие псевдогиперальдостеронизма — артериальной гипертензии и низкого уровня калия в крови, имитирующих симптомы гиперальдостеронизма. Причиной тому является существенная передозировка солодки или жевательного табака, которые влияют на метаболизм гормонов в надпочечниках.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гиперальдостеронизма
Клинические проявления гиперальдостеронизма чаще встречаются в возрасте 30-50 лет, однако описаны случаи выявления синдрома и в детском возрасте [1] .
Основным и постоянным симптомом гиперальдостеронизма является артериальная гипертензия. В 10-15 % она носит злокачественный характер [3] . Клинически гипертония проявляется головокружением, головными болями, мельканием "мушек" перед глазами, перебоями в работе сердца, в особо тяжёлых случаях — даже временной потерей зрения. Систолическое артериальное давление достигает 200-240 мм рт. ст.
Обычно гипертония при данном синдроме устойчива к препаратам, нормализующим давление. Однако этот признак гиперальдостеронизма далеко не всегда становится определяющим, поэтому его отсутствие не исключает диагноз и может привести к диагностической ошибке. Течение артериальной гипертензии при наличии синдрома может быть умеренным и даже мягким, поддающимся коррекции небольшими дозами препаратов. В редких случаях артериальная гипертензия носит кризовый характер, что требует дифференциальной диагностики и тщательного клинического разбора.
Второй признак гиперальдостеронизма — нейромышечный синдром. Он встречается довольно часто. Его основные проявления включают мышечную слабость, судороги, ползанье "мурашек" по ногам, особенно в ночные часы. В тяжёлых случаях могут быть временные параличи, которые внезапно начинаются и исчезают. Они могут длиться от нескольких минут до суток [3] [4] .
Третий признак гиперальдостеронизма, встречающийся не менее чем в 50-70 % случаев, — почечный синдром. Он представлен, как правило, невыраженной жаждой и учащённым мочеиспусканием (часто в ночное время).
Выраженность всех вышеперечисленных проявлений напрямую связана с концентрацией альдостерона: чем выше уровень этого гормона, тем выраженнее и тяжелее проявления гиперальдостеронизма.
Патогенез гиперальдостеронизма
Надпочечники — это парные эндокринные железы, расположенные над верхними полюсами почек. Они являются жизненно необходимой структурой. Так, удаление надпочечников у экспериментальных животных приводило к смерти через несколько суток [2] .
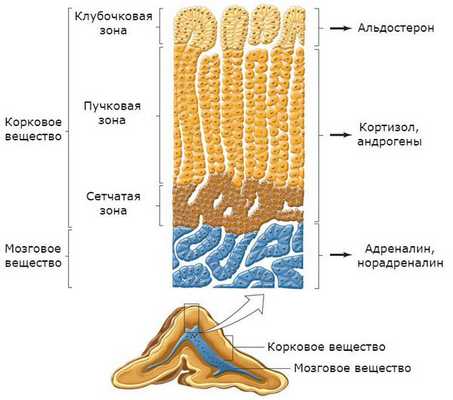
Надпочечники состоят из коркового и мозгового вещества. В корковом веществе, которое составляет до 90 % всей ткани надпочечника, выделяют три зоны:
- клубочковая;
- пучковая;
- сетчатая.
В клубочковой зоне синтезируются минералокортикоиды — подкласс кортикостероидных гормонов коры надпочечников, к коим относится альдостерон. К ней прилежит пучковая зона, вырабатывающая глюкокортикоиды (кортизол). Самая внутренняя зона — сетчатая — секретирует половые гормоны (андрогены) [2] .
Главным органом-мишенью для альдостерона являются почки. Именно там данный гормон усиливает всасывание натрия, стимулируя выделение фермента Na + /K + АТФазы, таким образом повышая его уровень в плазме крови. Второй эффект воздействия альдостерона — выделение почками калия, снижая его концентрацию в плазме крови.
При гиперальдостеронизме, т.е. при повышенной альдостерона, натрия в плазме крови становится чрезмерно много. Это приводит к повышению осмотического давления плазмы, задержке жидкости, гиперволемию (увеличение объёма жидкости или крови в сосудистом русле), в связи с чем развивается артериальная гипертензия.
Дополнительно высокий уровень натрия повышает чувствительность стенок сосудов к их утолщению, воздействию веществ, повышающих артериальное давление (адреналин, серотонин, кальций и др.) и развитию фиброза (разрастанию и рубцеванию) вокруг сосудов. Низкий уровень калия в крови в свою очередь вызывает поражение почечных канальцев, что приводит к снижению концентрационной функции почек. В результате этого довольно быстро развивается полиурия (увеличение объёма выделяемой мочи), жажда и никтурия (ночное мочеиспускание). Также при низком уровне калия нарушается нейромышечная проводимость и pH крови [1] [3] . Сходным образом альдостерон влияет на потовые, слюнные и кишечные железы [2] .
Из всего выше сказанного можно сделать вывод о том, что основная жизненно важная функция альдостерона — это поддержание физиологической осмолярности внутренней среды, т. е. баланса суммарной концентрации растворённых частиц (натрия, калия, глюкозы, мочевины, белка).
Классификация и стадии развития гиперальдостеронизма
В зависимости от причин гиперсекреции альдостерона выделяют первичный и вторичный гиперальдостеронизм. Подавляющее большинство случаев данного синдрома являются именно первичными.
Первичный гиперальдостеронизм — это повышенная секреция альдостерона, независящая от гормональной системы, которая контролирует объём крови и кровяное давление. Он возникает из-за заболеваний надпочечников.
Вторичный гиперальдостеронизм — это повышенная секреция альдостерона, вызванная вненадпочечниковыми стимулами (заболеваниями почек, застойной сердечной недостаточностью).
Отличительные клинические признаки этих двух типов гиперальдостеронизма указаны в таблице ниже [10] .
Осложнения гиперальдостеронизма
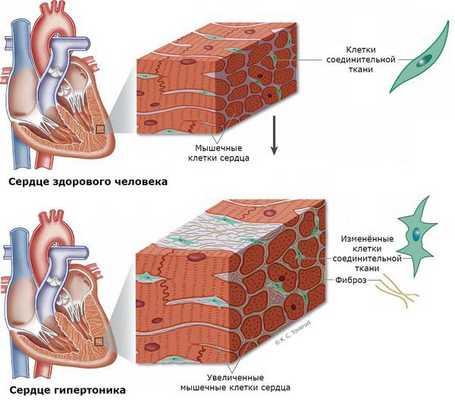
У пациентов с гиперальдостеронизмом крайне часто наступают сердечно-сосудистые поражения и смерть в сравнении с людьми с аналогичной степенью артериальной гипертензии, но вызванной другими причинами [11] [12] . Такие пациенты имеют очень высокий риск развития инфаркта и нарушение ритма сердца, в частности фибрилляции предсердий, что потенциально является фатальным состоянием. Риск внезапной сердечной смерти у пациентов с гиперальдостеронизмом увеличивается в 10-12 раз [13] .
Нередко у пациентов выявляются вызванные гиперальдостеронизмом кардиосклероз, гипертрофия левого желудочка и дисфункция эндотелия (внутреннего слоя сосудов) [3] . Это объясняется прямым повреждающим влиянием альдостерона на миокард и сосудистую стенку. Доказано, что увеличение массы миокарда при гиперальдостеронизме развивается раньше и достигает больших размеров [1] .
При развитии почечного синдрома (из-за интенсивного выведения почками калия) нарушается выведение ионов водорода. Это приводит к защелачиванию мочи и предрасполагает к развитию пиелита и пиелонефрита (воспаления почек), микроальбуминурии и протеинурии (выделения повышенного уровня альбумина и белка с мочой). У 15-20 % больных развивается почечная недостаточность с необратимыми изменениями работы почек. В 60 % случаев выявляется поликистоз почек [12] [13] .
Неотложным состоянием, связанным с гиперальдостеронизмом, является гипертонический криз. Его клинические проявления могут ничем не отличаться от обычных гипертонических кризов, проявляющихся головными болями, тошнотой, болями в области сердца, одышкой и т. д. Заподозрить нетипичный гипертонический криз в такой ситуации поможет наличие брадикардии (редкого пульса) и отсутствие периферических отёков. Эти данные в корне изменят тактику лечения и направят диагностический поиск в правильном направлении.
Диагностика гиперальдостеронизма
Для того чтобы не пропустить гиперальдостеронизм, вначале крайне важно выделить основные факторы риска, которые помогут заподозрить это заболевание. К ним относятся:
- артериальная гипертония II степени, т. е. стабильное повышение систолического (верхнего) артериального давления более 160/179 мм рт. ст., диастолического (нижнего) — более 100/109 мм рт. ст.;
- артериальная гипертония, устойчивая и/или плохо контролируемая препаратами (хотя этот признак далеко не всегда указывает на патологию);
- сочетание артериальной гипертонии с низким уровнем калия в крови (независимо от приёма мочегонных средств);
- артериальная гипертония и случайно выявленное (при УЗИ и/или КТ) образование надпочечника;
- отягощённый семейный анамнез: развитие артериальной гипертонии и/или острых сердечно-сосудистых катастроф до 40 лет, а также родственники, у которых уже был диагностирован гиперальдостеронизм [1][5] .
Следующий этап диагностики — лабораторное подтверждение. Для этого исследуется альдостерон-рениновое соотношение (АРС). Данное исследование является наиболее надёжным, информативным и доступным. Оно должно проводиться в ранние утренние часы: в идеале не позднее чем через два часа после пробуждения. Перед забором крови необходимо спокойно посидеть 5-10 минут.
ВАЖНО: некоторые препараты могут повлиять на концентрацию альдостерона и активность ренина плазмы, что, в свою очередь, изменит АРС. Поэтому за две недели до сдачи данного анализа важно отменить такие препараты, как спиронолактон, эплеренон, триамтерен, тиазидные диуретики, препараты из группы ингибиторов АПФ, БРА (блокаторов рецепторов ангиотензина) и другие. Врач должен проинформировать об этом пациента и временно назначить другую схему лечения гипертонии.
При положительном АРС необходимо провести подтверждающий тест с физиологическим раствором. Он проводится в условиях стационара, т. к. имеет ряд ограничений и требует исследование уровня альдостерона, калия и кортизола исходно и после 4-часового вливания двух литров физиологического раствора. В норме в ответ на большое количество вводимой жидкости выработка альдостерона подавляется, однако при гиперальдостеронизме подавить гормон таким способом не удаётся.
Низкий уровень калия в крови отмечается лишь в 40 % случаев синдрома, поэтому он не может быть надёжным критерием диагностики. А вот щелочная реакция мочи (вследствие повышенного выведения калия почками) является довольно характерным признаком патологии.
При подозрении на семейные формы гиперальдостеронизма проводится генетическое типирование (исследование на предрасположенность) с консультацией генетика [3] [6] .
Третий этап диагностики — топическая диагностика. Она направлена на поиски очага заболевания. Для этого используются различные способы визуализации внутренних органов.
УЗИ надпочечников — низкочувствительный метод диагностики. Предпочтительнее проводить КТ: она помогает выявить как макро- и микроаденомы надпочечников, так и утолщения ножек надпочечников, гиперплазии и другие изменения [14] .
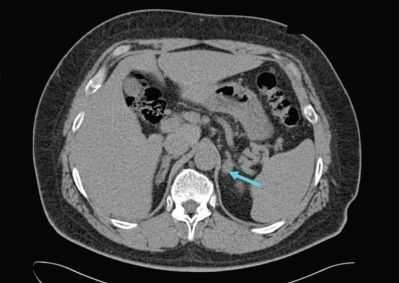
Для уточнения формы гиперальдостеронизма (одностороннего и двустороннего поражения) проводится селективный забор крови из вен надпочечников в специализированных центрах [9] . Это исследование эффективно снижает риск необоснованного удаления надпочечника только по данным КТ [4] .
Лечение гиперальдостеронизма
Оперативное лечение
Методом выбора при аденоме надпочечника, синтезирующей альдостерон, и односторонней гиперплазии надпочечника является эндоскопическая адреналэктомия — удаление одного или двух надпочечников через небольшие разрезы.
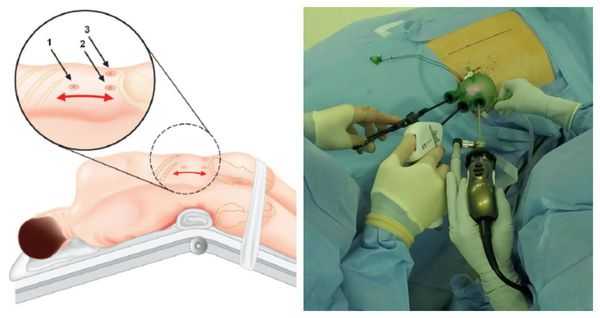
Данная операция выравнивает концентрацию калия в крови и улучшает течение артериальной гипертонии почти у 100 % больных. Полное излечение без использования антигипертензивной терапии достигается примерно у 50 %, шанс контроля артериального давления на фоне адекватной терапии увеличивается до 77 % [1] . В ряде исследований продемонстрировано уменьшение массы миокарда левого желудочка и устранение альбуминурии, что значительно повышает качество жизни таких пациентов.
Однако если гиперальдостеронизм не был диагностирован долгое время, то и после операции артериальная гипертония может сохраняться, а развившиеся сосудистые осложнения могут стать необратимыми, как и поражение почек. Поэтому крайне важно выявлять и лечить гиперальдостеронизм как можно раньше [7] .
Противопоказания к удалению надпочечника:
- возраст пациента;
- небольшая ожидаемая продолжительность жизни;
- тяжёлая сопутствующая патология;
- двусторонняя гиперплазия надпочечников (когда нет возможности провести селективный забор крови из вен надпочечников);
- гормонально-неактивная опухоль надпочечника, ошибочно принятая за источник выработки альдостерона.
Консервативное лечение
При наличии этих противопоказаний, высоком риске операции или отказе от хирургического вмешательства показано консервативное лечение специальными препаратами — антагонистами минералокортикоидных рецепторов (АМКР). Они эффективно снижают артериальное давление и защищают органы от избытка минералокортикоидов [7] [12] .
К этой группе препаратов относится калийсберегающий диуретик спиронолактон, который блокирует минералокортикоидные рецепторы и препятствует развитию фиброза миокарда, связанного с альдостероном. Однако он обладает рядом побочных эффектов, воздействуя ещё и на рецепторы андрогенов и прогестерона: может привести к гинекомастии у мужчин, снижению либидо, вагинальным кровотечениям у женщин. Все эти эффекты зависят от дозы препарата: чем больше доза препарата и длительность его применения, тем побочные эффекты более выражены.
Также существует относительно новый селективный препарат из группы АМКР — эплеренон. Он не воздействует на стероидные рецепторы в отличие от его предшественника, поэтому число неблагоприятных побочных эффектов будет меньше [9] .
При двусторонней гиперпродукции альдостерона показано длительное консервативное лечение. При вторичном гиперальдостеронизме следует лечить основное заболевание и корректировать артериальную гипертонию также с помощью препаратов группы АМКР [12] .
Прогноз. Профилактика
Выявление и адекватное лечение гиперальдостеронизма в большинстве случаев позволяет устранить артериальную гипертонию и связанные с ней осложнения или значительно смягчить её течение. Причём чем раньше синдром будет диагностирован и пролечен, тем благоприятнее прогноз: улучшается качество жизни, снижается вероятность инвалидизации и фатальных исходов [4] . Рецидивы после своевременной односторонней адреналэктомии, выполненной по показаниям, не возникают.
При запоздалой диагностике гипертония и осложнения могут сохраняться даже после терапии.
Гиперальдостеронизм может довольно долго протекать только с симптомами гипертонии.
Постоянно высокие цифры артериального давления (более 200/120 мм рт. ст.), нечувствительность к антигипертензивным препаратам, низкий уровень калия в крови — далеко не обязательные признаки синдрома. А ведь именно на это, зачастую, ориентируются врачи, чтобы заподозрить заболевание, "пропуская" гиперальдостеронизм с относительно "мягким" течением на ранних этапах.
Чтобы решить эту проблему, врачам, которые работают с пациентами с артериальной гипертензией, необходимо выявлять группы высокого риска и прицельно обследовать их на предмет наличия гиперальдостеронизма.
Надпочечниковая недостаточность
Надпочечниковая недостаточность – заболевание, возникающее вследствие недостаточной гормональной секреции коры надпочечников (первичная) или регулирующей их гипоталамо-гипофизарной системы (вторичная надпочечниковая недостаточность). Проявляется характерной бронзовой пигментацией кожных покровов и слизистых оболочек, резкой слабостью, рвотой, поносами, склонностью к обморокам. Ведет к расстройству водно-электролитного обмена и нарушению сердечной деятельности. Лечение надпочечниковой недостаточности включает устранение ее причин, заместительную терапию кортикостероидными препаратами, симптоматическую терапию.
Общие сведения
Надпочечниковая недостаточность – заболевание, возникающее вследствие недостаточной гормональной секреции коры надпочечников (первичная) или регулирующей их гипоталамо-гипофизарной системы (вторичная надпочечниковая недостаточность). Проявляется характерной бронзовой пигментацией кожных покровов и слизистых оболочек, резкой слабостью, рвотой, поносами, склонностью к обморокам. Ведет к расстройству водно-электролитного обмена и нарушению сердечной деятельности. Крайним проявлением надпочечниковой недостаточности является надпочечниковый криз.
Корковое вещество надпочечников вырабатывает глюкокортикостероидные (кортизол и кортикостерон) и минералокортикоидные (альдостерон) гормоны, регулирующие основные виды обмена в тканях (белковый, углеводный, водно-солевой) и адаптационные процессы организма. Секреторная регуляция деятельности коры надпочечников осуществляется гипофизом и гипоталамусом посредством секреции гормонов АКТГ и кортиколиберина.
Надпочечниковая недостаточность объединяет различные этиологические и патогенетические варианты гипокортицизма - состояния, развивающегося в результате гипофункции коры надпочечников и дефицита вырабатываемых ею гормонов.
Причины
Первичная надпочечниковая недостаточность развивается при поражении 85-90% ткани надпочечников.
В 98% случаев причиной первичного гипокортицизма служит идиопатическая (аутоиммунная) атрофия коркового слоя надпочечников. При этом по неизвестным причинам в организме образуются аутоиммунные антитела к ферменту 21-гидроксилазе, разрушающие здоровые ткани и клетки надпочечников. Также у 60% пациентов с первичной идиопатической формой надпочечниковой недостаточности отмечаются аутоиммунные поражения других органов, чаще – аутоиммунный тиреоидит. Туберкулезное поражение надпочечников встречается у 1-2% пациентов и в большинстве случаев сочетается с туберкулезом легких.
Редкое генетическое заболевание – адренолейкодистрофия служит причиной первичной надпочечниковой недостаточности в 1-2% случаев. В результате генетического дефекта Х-хромосомы возникает недостаток фермента, расщепляющего жирные кислоты. Преимущественное накопление жирных кислот в тканях нервной системы и коры надпочечников вызывает их дистрофические изменения.
Крайне редко к развитию первичной надпочечниковой недостаточности приводят коагулопатии, опухолевые метастазы в надпочечники (чаще из легкого или молочной железы), двусторонний инфаркт надпочечников, ВИЧ-ассоциированные инфекции, двустороннее удаление надпочечника.
Предрасполагают к развитию атрофии коры надпочечников тяжелые нагноительные заболевания, сифилис, грибковые поражения и амилоидоз надпочечников, злокачественные опухоли, пороки сердца, использование некоторых лекарственных препаратов (антикоагулянтов, блокаторов стероидгенеза, кетоконазола, хлодитана, спиронолактона, барбитуратов) и т. д.
Вторичная надпочечниковая недостаточность вызывается деструктивными или опухолевыми процессами гипоталамо-гипофизарной области, приводящими к нарушению кортикотропной функции, в результате:
- опухолей гипоталамуса и гипофиза: краниофарингиомы, аденомы и др.;
- сосудистых заболеваний: кровоизлияния в гипоталамус или гипофиз, аневризма сонной артерии;
- гранулематозных процессов в области гипоталамуса или гипофиза: сифилис, саркоидоз, гранулематозный или аутоиммунный гипофизит;
- деструктивнотравматических вмешательств: лучевая терапия гипоталамуса и гипофиза, операции, длительное лечение глюкокортикоидами и т. д.
Первичный гипокортицизм сопровождается снижением секреции гормонов коры надпочечников (кортизола и альдоатерона), что приводит к нарушению обмена веществ и баланса воды и солей в организме. При дефиците альдостерона развивается прогрессирующее обезвоживание, обусловленное потерей натрия и задержкой калия (гиперкалиемия) в организме. Водно-электролитные расстройства вызывают нарушения со стороны пищеварительной и сердечно-сосудистой систем.
Уменьшение уровня кортизола снижает синтез гликогена, приводя к развитию гипогликемии. В условиях дефицита кортизола гипофиз начинает повышенно вырабатывать АКТГ и меланоцитостимулирующий гормон, вызывающий усиление пигментации кожи и слизистых. Различные физиологические стрессы (травмы, инфекции, декомпенсация сопутствующих заболеваний) вызывают прогрессирование первичной надпочечниковой недостаточности.
Вторичный гипокортицизм характеризуется только дефицитом кортизола (в результате недостатка АКТГ) и сохранением продукции альдостерона. Поэтому вторичная надпочечниковая недостаточность, по сравнению с первичной, протекает относительно легко.
Классификация
Недостаточность коры надпочечников может носить острое и хроническое течение.
Острая форма надпочечниковой недостаточности проявляется развитием тяжелого состояния - аддисонического криза, обычно представляющего собой декомпенсацию хронической формы заболевания. Течение хронической формы надпочечниковой недостаточности может быть компенсированным, субкомпенсированным или декомпенсированный.
Согласно начальному нарушению гормональной функции хроническую надпочечниковую недостаточность разделяют на первичную и центральную (вторичную и третичную).
- Первичная недостаточность коры надпочечников (1-НН, первичный гипокортицизм, аддисонова или бронзовая болезнь) развивается в результате двустороннего поражения самих надпочечников, встречается более чем в 90% случаев, не зависимо от пола, чаще в зрелом и пожилом возрасте.
- Вторичная и третичная надпочечниковая недостаточность встречаются гораздо реже и возникают вследствие недостатка секреции АКТГ гипофизом или кортиколиберина гипоталамусом, приводящих к атрофии коры надпочечников.
Симптомы надпочечниковой недостаточности
Ведущим критерием первичной хронической надпочечниковой недостаточности является гиперпигментация кожных покровов и слизистых оболочек, интенсивность которой зависит от давности и тяжести гипокортицизма. Вначале более темную окраску приобретают открытые участки тела, подверженные солнечному облучению, - кожа лица, шеи, рук, а также участки, имеющие в норме более темную пигментацию, - ареолы сосков, наружные половые органы, мошонка, промежность, подмышечные области. Характерным признаком является гиперпигментация ладонных складок, заметная на фоне более светлой кожи, потемнение участков кожи, в большей степени соприкасающихся с одеждой. Цвет кожи варьирует от легкого оттенка загара, бронзового, дымчатого, грязной кожи до диффузно-темного. Пигментация слизистых оболочек (внутренней поверхности щек, языка, неба, десен, влагалища, прямой кишки) синевато-черной окраски.
Реже встречается надпочечниковая недостаточность с мало выраженной гиперпигментацией - «белый аддисонизм». Нередко на фоне участков гиперпигментации у пациентов обнаруживаются беспигментные светлые пятна – витилиго, размером от мелких до крупных, неправильной формы, выделяющиеся на более темной коже. Витилиго встречается исключительно при аутоиммунном первичном хроническом гипокортицизме.
У пациентов с хронической надпочечниковой недостаточностью снижается масса тела от умеренного похудания (на 3-5 кг) до значительной гипотрофии (на 15-25 кг). Отмечаются астения, раздражительность, депрессия, слабость, вялость, вплоть до потери трудоспособности, снижение полового влечения. Наблюдается ортостатическая (при резком изменении положения тела) артериальная гипотензия, обморочные состояния, вызываемые психологическими потрясениями и стрессами. Если до развития надпочечниковой недостаточности у пациента в анамнезе присутствовала артериальная гипертензия, АД может быть в пределах нормы. Практически всегда развиваются расстройства пищеварения - тошнота, понижение аппетита, рвота, боль в эпигастрии, жидкий стул или запоры, анорексия.
На биохимическом уровне происходит нарушение белкового (снижение синтеза белка), углеводного (снижение уровня глюкозы натощак и плоская сахарная кривая после глюкозной нагрузки), водно-солевого (гипонатриемия, гиперкалиемия) обменов. У пациентов отмечается выраженное пристрастие к употреблению соленой пищи, вплоть до употребления чистой соли, связанное с нарастающей потерей солей натрия.
Вторичная надпочечниковая недостаточность протекает без гиперпигментации и явлений недостаточности альдостерона (артериальной гипотонии, пристрастия к соленому, диспепсии). Для нее характерны неспецифические симптомы: явления общей слабости и приступов гипогликемии, развивающихся через несколько часов после еды.
Осложнения
Наиболее грозным осложнением хронического гипокортицизма при не проводимом или неправильном лечении является надпочечниковый (аддисонический) криз – резкая декомпенсация хронической надпочечниковой недостаточности с развитием коматозного состояния. Аддисонический криз характеризуется резчайшей слабостью (вплоть до состояния прострации), падением артериального давления (вплоть до коллапса и потери сознания), неукротимой рвотой и жидким стулом с быстрым нарастанием обезвоживания организма, запахом ацетона изо рта, клоническими судорогами, сердечной недостаточностью, еще большей пигментацией кожных покровов.
Острая надпочечниковая недостаточность (аддисонический криз) по преобладанию симптомов может протекать в трех клинических формах:
- сердечно-сосудистой, при которой доминируют нарушения кровообращения: бледность кожи, акроцианоз, похолодание конечностей, тахикардия, артериальная гипотония, нитевидный пульс, коллапс, анурия;
- желудочно-кишечной, напоминающей по симптоматике признаки пищевой токсикоинфекции или клинику острого живота. Возникают спастические боли в животе, тошнота с неукротимой рвотой, жидкий стул с кровью, метеоризм.
- нервно-психической, с преобладанием головной боли, менингеальных симптомов, судорог, очаговой симптоматики, бреда, заторможенности, ступора.
Аддисонический криз трудно поддается купированию и может вызвать гибель пациента.
Диагностика
Диагностику надпочечниковой недостаточности начинают с оценки анамнеза, жалоб, физикальных данных, выяснения причины гипокортицизма. Проводят УЗИ надпочечников. О первичной надпочечниковой недостаточности туберкулезного генеза свидетельствует наличие кальцинатов или очагов туберкулеза в надпочечниках; при аутоиммунной природе гипокортицизма в крови присутствуют аутоантитела к надпочечниковому антигену21-гидроксилазе. Дополнительно для выявления причин первичной надпочечниковой недостаточности может потребоваться МРТ или КТ надпочечников. С целью установления причин вторичной недостаточности коры надпочечник КТ и МРТ головного мозга.
При первичной и вторичной надпочечниковой недостаточности наблюдается снижение в крови кортизола и уменьшение суточного выделения свободного кортизола и 17-ОКС с мочой. Для первичного гипокортицизма характерно повышение концентрации АКТГ, для вторичного – его уменьшение. При сомнительных данных за надпочечниковую недостаточность проводят стимуляционный тест с АКТГ, определяя содержание кортизола в крови через полчаса и час после введения адренокортикотропного гормона. Повышение уровня кортизола менее чем на 550 нмоль/л (20 мкг/дл) свидетельствует о недостаточности надпочечников.
Для подтверждения вторичной недостаточности коры надпочечников применяют пробу инсулиновой гипогликемии, вызывающей в норме значительный выброс АКТГ и последующее повышение секреции кортизола. При первичной надпочечниковой недостаточности в крови определяются гипонатриемия, гиперкалиемия, лимфоцитоз, эозинофилия и лейкопения.
Лечение надпочечниковой недостаточности
Современная эндокринология обладает эффективными методами лечения надпочечниковой недостаточности. Выбор метода лечения зависит прежде всего от причины возникновения заболевания и преследует две цели: ликвидацию причины надпочечниковой недостаточности и замещение гормонального дефицита.
Устранение причины надпочечниковой недостаточности включает медикаментозное лечение туберкулеза, грибковых заболеваний, сифилиса; противоопухолевую лучевую терапию на область гипоталамуса и гипофиза; оперативное удаление опухолей, аневризм. Однако при наличии необратимых процессов в надпочечниках, гипокортицизм сохраняется и требует пожизненного проведения заместительной терапии гормонами коры надпочечников.
Лечение первичной надпочечниковой недостаточности проводят глюкокортикоидными и минералокортикоидными препаратами. При легких проявлениях гипокортицизма назначаются кортизон или гидрокортизон, при более выраженных - комбинация преднизолона, кортизона ацетата или гидрокортизон с минералокортикоидами (дезоксикортикостерона триметилацетат, ДОКСА - дезоксикортикостерона ацетат). Эффективность терапии оценивается по показателям артериального давления, постепенному регрессу гиперпигментации, прибавке массы тела, улучшению самочувствия, исчезновению диспепсии, анорексии, мышечной слабости и т. д.
Гормональная терапия у пациентов с вторичной надпочечниковой недостаточностью проводится только глюкокортикоидами, т. к. секреция альдостерона сохранена. При различных стрессовых факторах (травмах, операциях, инфекциях и др.) дозы кортикостероидов увеличивают в 3-5 раз, при беременности незначительное увеличение дозы гормонов возможно лишь во втором триместре.
Назначение анаболических стероидов (нандролон) при хронической надпочечниковой недостаточности показано и мужчинам, и женщинам курсами до 3-х раз в год. Пациентам с гипокортицизмом рекомендовано соблюдение диеты, обогащенной белком, углеводами, жирами, солями натрия, витаминами В и С, но с ограничением солей калия. Для купирование явлений аддисонического криза проводят:
- регидратационную терапию изотоническим раствором NaCl в объеме 1,5-2,5 л в сутки в сочетании с 20 % р-ром глюкозы;
- внутривенную заместительную терапию гидрокортизоном или преднизолоном с постепенным снижением дозы по мере стихания явлений острой надпочечниковой недостаточности;
- симптоматическую терапию заболеваний, приведших к декомпенсации хронической надпочечниковой недостаточности (чаще антибактериальную терапию инфекций).
Прогноз и профилактика
В случае своевременного назначения адекватной гормонально-заместительной терапии течение надпочечниковой недостаточности относительно благоприятное. Прогноз у пациентов с хроническим гипокортицизмом во многом определяется профилактикой и лечением надпочечниковых кризов. При сопутствующих заболеванию инфекциях, травмах, хирургических операциях, стрессах, желудочно-кишечных расстройствах необходимо немедленное увеличение дозы назначенного гормона.
Необходимо активное выявление и постановка на диспансерный учет у эндокринолога пациентов с надпочечниковой недостаточностью и лиц группы риска (длительно принимающих кортикостероиды при различных хронических заболеваниях).
Надпочечниковая недостаточность у детей ( Гипокортицизм у детей )
Надпочечниковая недостаточность у детей (гипокортицизм) возникает при поражении паренхимы надпочечников либо при нарушениях в гипофизарно-гипоталамическом звене, которое регулирует производство гормонов периферическими эндокринными железами. Основные симптомы: гиперпигментация кожи, снижение веса, повышенная утомляемость. При гипокортицизме также отмечаются сердечно-сосудистые и неврологические нарушения. Диагностика основана на определении гормонального уровня, рентгенологической визуализации надпочечников и центральных эндокринных органов. Лечение предполагает длительную (пожизненную) заместительную терапию гормонами.
МКБ-10
Заболевание встречается с частотой около 1 случая на 10 тыс. населения, в 2 раза чаще у мальчиков. У 74-86% недоношенных новорожденных и младенцев с врожденными пороками развития наблюдается относительный гипокортицизм, который обычно протекает в субклинической форме. Надпочечниковая недостаточность характеризуется длительным бессимптомным течением и появлением клинических симптомов только при тотальном поражении эндокринных желез. Поэтому ее максимально ранняя диагностика и лечение составляют актуальную проблему в педиатрической практике.
До 60% случаев надпочечниковой недостаточности в детской эндокринологии связывают с первичной атрофией коркового вещества на фоне аутоиммунного адреналита. Болезнь появляется у детей при сочетании наследственной предрасположенности и экзогенных триггеров (стрессы, вирусные инфекции). Зачастую заболевание сопровождается аутоиммунным тиреоидитом или полигландулярным синдромом типа 2. Кроме аутоиммунного поражения, выделяют следующие причины надпочечниковой недостаточности:
- Кровоизлияния. Геморрагии в паренхиму надпочечников — типичный фактор гипофункции органа у новорожденных. Патология возникает как проявление геморрагического диатеза, наблюдается в первые дни после рождения ребенка. В раннем детстве надпочечниковая недостаточность часто связана с синдромом Уотерхауса-Фридериксена.
- Адренолейкодистрофия. Врожденное заболевание с Х-сцепленным типом наследования вызывает до 1-2% всех случаев гипокортицизма у детей. В паренхиме органа накапливаются жировые отложения и нарастают дистрофические изменения, поэтому синтез гормонов снижается.
- Гипоталамо-гипофизарные патологии. Эта группа включает большой перечень этиологических факторов, наиболее значимые из которых — опухоли, кровоизлияния, гранулематозные процессы (саркоидоз, аутоиммунный гипофизит). Изредка причиной становится лучевое повреждение гипофизарно-гипоталамической системы.
- Ятрогенные факторы. Нарушения синтеза гормонов встречаются при резкой отмене кортикостероидов, длительной терапии антикоагулянтами и противогрибковыми препаратами. Надпочечниковая недостаточность может наблюдаться после интубационного наркоза, электронаркоза. Заболевание является закономерным осложнением адреналэктомии.
Патогенез
При гипокортицизме в организме ребенка определяется абсолютный недостаток как глюкокортикоидов, так и минералокортикоидов, что сопровождается характерными симптомами. О нехватке кортизола свидетельствуют нарушение всех видов обмена веществ, задержка роста и развития. Дефицит альдостерона вызывает электролитный дисбаланс и вторичные сердечно-сосудистые расстройства.
При первичной форме болезни у детей компенсаторно активируется гипоталамо-гипофизарное звено регуляции, что проявляется повышенным синтезом АКТГ. Гормон не может повлиять на надпочечниковую кору, поскольку в ней происходят дистрофические процессы, но вместе с ним начинает вырабатываться меланоцитстимулирующее вещество, которое обуславливает специфическую пигментацию кожи пациентов.
В зависимости от клинической картины надпочечниковая недостаточность бывает острой, возникающей при травмах и кровоизлияниях в эндокринные железы, и хронической (болезнь Аддисона), которая встречается в практике эндокринологов намного чаще. По степени тяжести выделяют стадии компенсации, субкомпенсации и декомпенсации. По локализации патологического процесса гипокортицизм классифицируют на:
- Первичный. Отмечается при повреждении коркового вещества и нормальной работе гипоталамо-гипофизарного звена эндокринной регуляции.
- Вторичный. Наблюдается при болезнях гипофиза и снижении выработки тропного гормона АКТГ.
- Третичный. Развивается при заболеваниях гипоталамуса и уменьшении синтеза кортиколиберина.
Симптомы
Хроническая надпочечниковая недостаточность
ХНН у детей длительное время протекает малосимптомно, а выраженные клинические проявления возникают, когда поражено более 95% паренхимы органа. При врожденных формах болезни признаки появляются в первые месяцы жизни младенца, но они не всегда корректно диагностируются. У малышей основными симптомами ХНН называют плохую прибавку в весе, частую рвоту и срыгивание, нарушения стула.
У детей старшего возраста первым проявлением болезни служит слабость и сильная усталость в конце дня, которая не соответствует степени умственной и физической нагрузки. Симптомы уменьшаются после ночного отдыха, а затем возникают снова. Характерна потеря веса и изменение вкусовых пристрастий, при этом патогномоничным признаком считается тяга к соленой пище. При выраженной недостаточности минералокортикоидов ребенок может есть чистую соль.
Постепенно присоединяются другие признаки: диспепсические расстройства, снижение артериального давления, которое проявляется головными болями и головокружениями. Из-за нарушений работы сердца заметна одышка при физической нагрузке. Патогномоничный симптом: золотисто-коричневая окраска кожи и слизистых оболочек с максимальной интенсивностью пигментации в области грудных желез, половых органов, кожных складок и типичных мест трения одеждой.
Острая надпочечниковая недостаточность
ОНН (аддисонический криз) имеет 3 стадии. Сначала ребенка беспокоят тошнота и головная боль, пропадает аппетит, снижается давление. Затем появляется резкая слабость, боли в животе, многократная рвота, вследствие чего наступает дегидратация. О третьей стадии свидетельствуют развитие сосудистого коллапса, почечной недостаточности и коматозного состояния.
Основное негативное последствие гипокортицизма — надпочечниковый криз. Наиболее опасна ОНН для детей до 2 лет, у которых риск смертельного исхода при этой болезни в 10 раз выше, чем в других возрастных группах. Иногда надпочечниковая недостаточность развивается молниеносно в течение нескольких часов, поэтому врачи не во всех случаях успевают оказать младенцу комплексную медицинскую помощь, если ситуация произошла за пределами стационара.
Осложнение может протекать в 3 формах. Для сердечно-сосудистой формы характерно коллаптоидное состояние, резкое усиление пигментации, снижение температуры тела. При желудочно-кишечном варианте ОНН на первый план выходит неукротимая рвота и диарея, поэтому смерть ребенка может наступить от эксикоза. При нервно-психической форме наблюдается судорожный синдром и нарушения сознания, которые без лечения заканчиваются комой и отеком мозга.
Дефицит надпочечниковых гормонов у детей имеет специфические внешние признаки, поэтому опытный детский эндокринолог может поставить предварительный диагноз уже при физикальном осмотре ребенка. Врач обращает внимание на цвет кожных покровов, симптомы истощения, изменение пульса и артериального давления. Специалист тщательно собирает анамнез, чтобы установить возможные причины гипокортицизма. Для уточнения диагноза назначаются следующие методы:
- КТ надпочечников. Рентгенологическая визуализация рекомендована для обнаружения кровоизлияний, очагов дистрофии и других патологических признаков, которыми проявляется первичная надпочечниковая недостаточность. Для оценки структуры гипофиза показана рентгенография турецкого седла, КТ головного мозга.
- ЭКГ. Исследование применяется для подтверждения признаков гиперкалиемии у детей: высокого и заостренного зубца Т, замедления внутрисердечной проводимости, расширения комплекса QRS. При длительном существовании патологии снижается систолический выброс и уменьшаются размеры сердца, что подтверждается с помощью эхокардиографии.
- Гормональные исследования. При первичном варианте болезни кортизол и альдостерон в утренней пробе крови будут снижены, а АКТГ в пределах нормы или повышен. При вторичном и третичном гипокортицизме уменьшены концентрации всех гормонов. Для дифференциальной диагностики проводятся нагрузочные пробы с синактеном. Гормоны также определяют в слюне и моче.
- Анализы крови. В гемограмме эндокринолог видит относительный лимфоцитоз, умеренную эозинофилию, повышение гематокрита. При ХНН показатели могут быть в норме. При биохимическом исследовании выявляется гипонатриемия, гипохлоремия и гиперкалиемия. Реже диагностируется гипогликемия, гипопротеинемия и гиперкетонемия.
Лечение надпочечниковой недостаточности у детей
При остром надпочечниковом кризе ребенку требуется неотложная медицинская помощь. Лечение начинается с введения инфузионных растворов, терапии препаратами глюко- и минералокортикоидов, которые вводятся внутривенно болюсно до стабилизации состояния. Медикаменты назначаются под контролем электролитного состава крови. После нормализации лабораторных показателей переходят на поддерживающий прием препаратов.
Основной принцип терапии при хронической форме гипокортицизма — подбор адекватных доз надпочечниковых гормонов для постоянной заместительной терапии. Детские эндокринологи отдают предпочтение гидрокортизону, поскольку он обладает и глюкокортикоидной, и минералокортикоидной активностью. Дозировки и кратность приема подбираются с учетом физиологического ритма работы надпочечников.
Гормонотерапию проводят под постоянным наблюдением врача, дозировки препаратов увеличивают в периоды нарушений функционального состояния организма. При стрессах, травмах, операциях суточную норму повышают в 2-3 раза, иногда показан переход с пероральной на парентеральную форму введения. Перед небольшими медицинскими манипуляциями рекомендовано разовое введение дополнительной дозы.
При правильном подборе гормональной терапии удается устранить неприятные симптомы и стабилизировать состояние ребенка. Критериями адекватности лечения являются: нормализация АД, физиологические прибавки веса, отсутствие гиперпигментации кожи. При хронических формах недостаточности прогноз в основном благоприятный, а острый гипокортицизм без экстренной терапии чреват летальным исходом.
Учитывая многообразие причин и частый аутоиммунный характер патологии, специфические профилактические меры не разработаны. Врачи рекомендуют ограничить стрессовые воздействия, соблюдать противоэпидемические меры для предупреждения вирусных инфекций. Вторичная профилактика осложнений гипокортицизма включает постановку ребенка на диспансерный учет и динамическое наблюдение у эндокринолога (1 раз в квартал).
1. Детская эндокринология: учебник/ И.И. Дедов, В.А. Петеркова, О.А. Малиевский, Т.Ю. Ширяева. — 2016.
3. Клинические рекомендации по ведению и терапии новорожденных с заболеваниями надпочечников/ Д.О. Иванов, Т.К. Мавропуло. — 2016.
Читайте также:
