Образование гноя. Эозинофилы и базофилы
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Эффекты воспаления. Макрофаги и нейтрофилы при воспалении
а) Воспаление. При повреждении ткани независимо от его причины (бактерии, травма, химические агенты, тепло или любое другое явление) выделяется множество веществ, вызывающих существенные вторичные изменения в окружающих неповрежденных тканях. Весь комплекс этих тканевых изменений называют воспалением.
Воспаление характеризуется:
(1) расширением местных кровеносных сосудов с последующим избыточным местным кровотоком;
(2) увеличением проницаемости капилляров, что способствует утечке большого количества жидкости в интерстициальное пространство;
(3) часто — свертыванием жидкости в интерстициальном пространстве в связи с избытком фибриногена и других белков, вытекающих из капилляров;
(4) миграцией большого числа гранулоцитов и моноцитов в ткани;
(5) отеком тканевых клеток.
К тканевым продуктам, вызывающим эти реакции, относятся гистамин, брадикинин, серотонин, простагландины, несколько разных продуктов реакции системы комплемента, продукты реакции свертывающей системы крови и множество веществ, называемых лимфокинами, которые выделяются активированными Т-клетками (частью иммунной системы). Некоторые из этих веществ мощно активируют макрофагальную систему, и в течение нескольких часов макрофаги начинают уничтожать поврежденные ткани. Но иногда макрофаги повреждают еще живые тканевые клетки.
б) «Ограждающий» эффект воспаления. Одним из первых результатов воспаления является «ограждение» области повреждения от остальных тканей. Тканевые пространства и лимфатические сосуды в воспаленной области блокируются сгустками фибрина, поэтому через небольшой промежуток времени жидкость с трудом протекает через интерстиций. Этот процесс отгораживания задерживает распространение бактерий или токсических продуктов.
Интенсивность воспалительного процесса обычно пропорциональна степени повреждения ткани. Например, когда стафилококки проникают в ткани, они выделяют смертельно опасные клеточные токсины. В результате воспаление развивается быстро, гораздо быстрее, чем сами стафилококки могут размножиться и распространиться. Следовательно, для локальной стафилококковой инфекции характерно быстрое отгораживание, предохраняющее от распространения ее по телу.
Стрептококки, напротив, не вызывают такого интенсивного локального разрушения тканей. Следовательно, процесс отгораживания развивается медленно, на протяжении многих часов, в течение которых стрептококки успевают размножиться и мигрировать. В результате стрептококки часто проявляют гораздо более выраженную тенденцию к распространению в организме и развитию смертельных состояний, чем стафилококки, несмотря на то, что стафилококки гораздо более губительны для тканей.
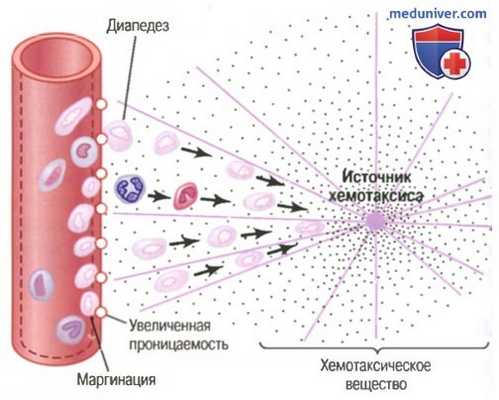
Движение нейтрофилов путем диапедеза через поры капилляров и путем хемотаксиса по направлению к области повреждения ткани
Реакции макрофагов и нейтрофилов во время воспаления
а) Тканевые макрофаги - первая «линия обороны» против инфекции. Тканевые макрофаги - первая «линия обороны» против инфекции. В течение нескольких минут после начала воспаления макрофаги, уже присутствующие в тканях, немедленно начинают свое фагоцитарное действие, будь то гистиоциты в подкожных тканях, альвеолярные макрофаги в легких, микроглия в мозге или др. При активации продуктами инфицирования и воспаления первым эффектом является быстрое увеличение каждого из макрофагов.
Затем многие из ранее неподвижных макрофагов отделяются от мест их прикрепления и становятся мобильными, формируя первую «линию обороны» против инфекции в течение примерно первого часа. Количество этих рано мобилизуемых макрофагов часто незначительно, но они спасают жизнь.
б) Вторжение нейтрофилов в воспаленную область является второй «линией обороны». В течение примерно первого часа после начала воспаления большое число нейтрофилов начинает внедряться в воспаленную область из крови. Этот процесс вызывается продуктами воспаленных тканей, которые инициируют следующие реакции:
(1) изменяют внутреннюю поверхность эндотелия капилляров, способствуя прилипанию нейтрофилов к стенкам капилляров в воспаленной области. Этот эффект, показанный на рисунке выше, называют маргинацией (или краевым стоянием лейкоцитов),
(2) ведут к разрыхлению сцеплений между эндотелиальными клетками капилляров и небольших венул, обеспечивая появление достаточно больших отверстий для прохождения нейтрофилов путем диапедеза непосредственно из крови в тканевые пространства;
(3) другие продукты воспаления вызывают хемотаксис нейтрофилов в направлении поврежденных тканей, как объяснялось ранее.
Таким образом, в течение нескольких часов после начала повреждения тканей область обильно заполняется нейтрофилами. Поскольку нейтрофилы крови — уже зрелые клетки, они готовы немедленно начать свои очистительные функции для уничтожения бактерий и удаления инородного материала.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Образование гноя. Эозинофилы и базофилы
а) Образование гноя. Когда нейтрофилы и макрофаги поглощают большое количество бактерий и некротической ткани, практически все нейтрофилы и многие (но не большинство) макрофаги погибают. Через несколько дней в воспаленной ткани часто формируется полость, содержащая различные части некротизированной ткани, погибшие нейтрофилы и макрофаги, а также тканевую жидкость. Эту смесь обычно называют гноем. После прекращения инфекционного процесса мертвые клетки и некротическая ткань в гное постепенно, в течение нескольких дней растворяются, а конечные продукты в итоге всасываются в окружающие ткани и лимфу до тех пор, пока большинство признаков повреждения ткани не исчезнут.
б) Эозинофилы. В норме эозинофилы составляют около 2% всех лейкоцитов крови. Эозинофилы — слабые фагоциты и способны к хемотаксису, но в отличие от нейтрофилов значение эозинофилов в защите против обычных типов инфицирования сомнительно.
Однако у людей с паразитарными инфекциями часто образуется большое число эозинофилов, которые мигрируют в ткани, пораженные паразитами. Хотя большинство паразитов слишком велики, чтобы их могли поглотить эозинофилы или любые другие клетки-фагоциты, эозинофилы способны прикрепляться к паразитам с помощью специфических поверхностных молекул и выделять вещества, губительные для многих из них. Например, одной из наиболее распространенных паразитарных инфекций является шистосомоз, которым страдает треть населения в некоторых развивающихся странах. Паразит, вызывающий эту инфекцию, может проникать в любую часть тела.
Эозинофилы прикрепляются к незрелым формам паразитов и уничтожают многих из них несколькими способами:
(1) выделением гидролитических ферментов из гранул, представляющих собой модифицированные лизосомы;
(2) выделением высокореактивных форм кислорода, особенно губительных для паразитов;
(3) выделением из гранул полипептида, убивающего личинки, который называют главным основным белком.
В некоторых районах мира эозинофилию вызывает другое паразитарное заболевание — трихинеллез. Оно возникает в результате проникновения в мышцы тела паразита трихинеллы (Trichinella, или «свиной червь») после того, как человек съедает плохо проваренную свинину.
Эозинофилы обычно собираются также в тканях, где осуществляются аллергические реакции, например в перибронхиальных тканях легких у людей с астмой и в коже после аллергических кожных реакций. Частично это связано с фактом участия в аллергических реакциях многих тучных клеток и базофилов, которые мы обсудим в следующем разделе. Тучные клетки и базофилы выделяют эозинофилъный хемотаксический фактора заставляющий эозинофилы мигрировать по направлению к ткани, воспаленной в связи с аллергической реакцией.
Полагают, что эозинофилы нейтрализуют некоторые из вызывающих воспаление веществ, выделяемых тучными клетками и базофилами и, вероятно, фагоцитируют и разрушают комплексы аллерген-антитело, предупреждая чрезмерное распространение местного воспалительного процесса.
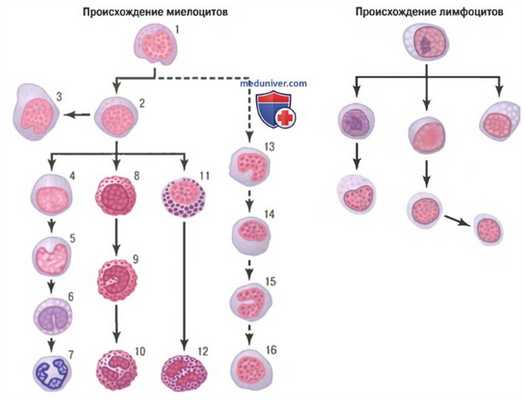
Происхождение белых клеток крови. Разные клетки миелоцитарного ряда:
1 - миелобласт; 2 -промиелоцит; 3 — мегакариоцит;
4 - нейтрофильный миелоцит; 5 — молодой нейтрофильный метамиелоцит; 6 - палочкоядерный нейтрофильный метамиелоцит;
7 - полиморфноядерный нейтрофил; 8 — эозинофильный миелоцит; 9 - эозинофильный метамиелоцит;
10 - полиморфноядерный эозинофил; 11 - базофильный миелоцит; 12 - полиморфноядерный базофил;
13-16 - стадии формирования моноцитов
в) Базофилы. Базофилы циркулирующей крови похожи на большие тканевые тучные клетки, локализованные непосредственно снаружи капилляров. И тучные клетки, и базофилы высвобождают в кровь гепарин — вещество, способное предупреждать свертывание крови.
Эти клетки выделяют также гистамин и небольшое количество брадикинина и серотонина. В воспаленных тканях именно тучные клетки в основном высвобождают эти вещества.
Тучные клетки и базофилы играют чрезвычайно важную роль в некоторых типах аллергических реакций, поскольку вызывающий эти реакции особый тип антител — иммуноглобулин Е (IgE) — имеет специфическую способность прикрепляться к тучным клеткам и базофилам. Когда впоследствии специфический антиген реагирует со специфическим IgE антителом, возникающее в результате прикрепление антигена к антителу заставляет тучную клетку или базофил разрываться и выделять очень большие количества гистамина, брадикинина, серотонина, гепарина, медленно действующей анафилактической субстанции и ряда лизосомальных ферментов.
Они вызывают локальные сосудистые и тканевые реакции, лежащие в основе большинства аллергических реакций.
Нейтрофилия. Защитные механизмы воспаления
а) Резкое увеличение количества нейтрофилов в крови - нейтрофилия. В течение нескольких часов после начала острого, тяжелого воспаления количество нейтрофилов в крови возрастает иногда в 4-5 раз, т.е. от нормального количества 4000-5000 до 15000-25000 нейтрофилов в 1 мкл. Это состояние называют нейтрофилией, что означает увеличение количества нейтрофилов в крови.
Нейтрофилия вызывается продуктами воспаления, которые входят в кровоток, транспортируются к костному мозгу и там действуют на резервные нейтрофилы костного мозга, заставляя их выходить в циркулирующую кровь. Это обеспечивает возможность доставки еще большего числа нейтрофилов в воспаленную тканевую область.
б) Вторичная инвазия макрофагов в воспаленную ткань является третьей «линией обороны». Вместе с инвазией нейтрофилов моноциты поступают из крови в воспаленную ткань и увеличиваются, становясь макрофагами. Однако количество моноцитов в циркулирующей крови низкое; запас моноцитов в костном мозге также гораздо меньший, чем запас нейтрофилов. Следовательно, увеличение количества макрофагов в воспаленной ткани происходит значительно медленнее, чем нейтрофилов, и требует нескольких дней, чтобы стать эффективным.
Более того, даже после внедрения в воспаленную ткань моноциты являются еще незрелыми клетками, и нужно 8 ч или более для разбухания их до значительных размеров и развития громадного количества лизосом; только тогда они приобретают характерную для тканевых макрофагов высокую способность к фагоцитозу. Однако на протяжении периода от нескольких дней до нескольких недель макрофаги становятся преобладающими фагоцитарными клетками воспаленной области из-за значительного увеличения продукции новых моноцитов костным мозгом, что будет объяснено далее.
Как уже подчеркивалось, в сравнении с нейтрофилами макрофаги могут фагоцитировать гораздо больше бактерий (примерно в 5 раз) и значительно более крупные частицы, включая даже сами нейтрофилы и большое количество некротизированной ткани. Кроме того, макрофаги играют важную роль в инициации развития антител.
в) Увеличение продукции гранулоцитов и моноцитов костным мозгом является четвертой «линией обороны». Это происходит в связи со стимуляцией гранулоцитарных и моноцитарных клеток-предшественников костного мозга. Однако требуются 3-4 сут, прежде чем вновь сформированные гранулоциты и моноциты достигнут стадии, когда они покидают костный мозг. Если стимул из воспаленной ткани продолжает действовать, костный мозг может непрерывно производить эти клетки в огромных количествах в течение нескольких месяцев и даже лет, иногда со скоростью, в 20—50 раз превышающей норму.
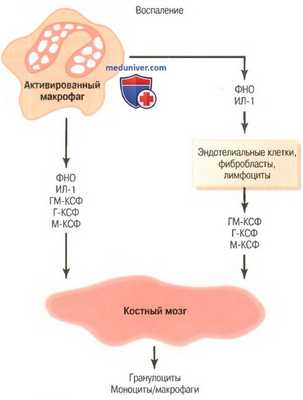
Регуляция формирования гранулоцитов и моноцитов-макрофагов костным мозгом с помощью множества факторов роста, выделяемых из активированных макрофагов в воспаленной ткани.
Г-КСФ - гранулоцитарный колониестимулирующий фактор, ГМ-КСФ - гранулоцитарно-моноцитарный колониестимулирующий фактор,
ИЛ-1 - интерлейкин-1, М-КСФ — моноритарный колониестимулирующий фактор,
ФНО - фактор некроза опухоли
г) Регуляция реакций макрофагов и нейтрофилов по принципу обратной связи. В настоящее время известно более двух дюжин факторов, участвующих в регуляции реакции макрофагов на воспаление, пять из них, как полагают, играют доминирующую роль. Они представлены на рисунке выше и включают:
(1) фактор некроза опухоли (ФНО);
(2) интерлейкин-1 (ИЛ-1);
(3) гранулоцитарно-моноцитарный колониестимулирующий фактор (ГМ-КСФ);
(4) гранулоцитарный колониестимулирующий фактор (Г-КСФ);
(5) моноцитарный колониестимулирующий фактор (М-КСФ).
Эти факторы формируются активированными макрофагальными клетками и в меньших количествах — другими клетками воспаленной ткани.
Основными стимуляторами увеличения продукции гранулоцитов и моноцитов костным мозгом являются три колониестимулирующих фактора, один из которых (ГМ-КСФ) повышает продукцию и гранулоцитов, и моноцитов; два других (Г-КСФ и М-КСФ) усиливают продукцию гранулоцитов и моноцитов, соответственно. Эта совокупность ФНО, ИЛ-1 и колониестимулирующих факторов обеспечивает мощный механизм обратной связи, который начинается с воспаления ткани и развивается до формирования большого количества защитных белых клеток крови, которые помогают удалять причину воспаления.
Видео физиология защитной функции крови (иммунитета) и группы крови - профессор, д.м.н. П.Е. Умрюхин
Эозинофилия (эозинофильный лейкоцитоз), или повышение уровня эозинофилов в крови
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Эозинофилия: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Эозинофилия – это состояние, при котором отмечается повышение уровня эозинофилов в крови. Эозинофилы представляют собой один из видов белых клеток крови – лейкоцитов, образуются в костном мозге, откуда попадают в кровоток. Повышение их количества отмечается при паразитарных и аллергических заболеваниях, туберкулезе, инфекционных процессах и некоторых других состояниях и заболеваниях, требующих полноценного обследования и специфической терапии.
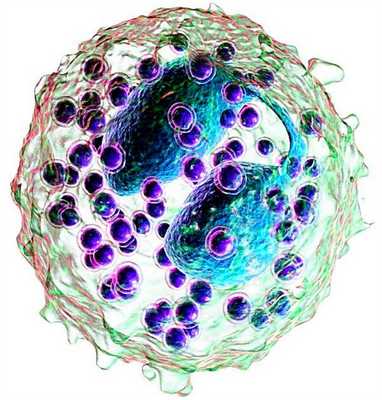
Разновидности эозинофилии
По количеству клеток в единице крови различают следующие эозинофилии:
- легкая, когда содержание эозинофилов составляет от 500 до 1500 в микролитре крови;
- умеренная, когда содержание эозинофилов составляет от 1500 до 5000 в микролитре крови;
- выраженная, когда содержание эозинофилов составляет более 5000 в микролитре крови.
- первичную, или клональную эозинофилию, которая наблюдается при патологиях крови;
- вторичную, или реактивную эозинофилию, которая развивается как ответная реакция на аллергены, паразитарные инвазии и т.д.
- идиопатическую, или транзиторную эозинофилию, причины которой выяснить не удается.
В наибольшей степени эозинофилы задействованы в иммунном ответе с выраженным аллергическим компонентом.
Аллергическая реакция является одной из форм ответа организма на проникновение извне чужеродных агентов (аллергенов).
Аллергеном может стать практически любое вещество, однако чаще в роли аллергена выступают белки. При первом попадании аллергена в организм клетки лимфоциты начинают вырабатывать особый вид антител IgE, играющих ключевую роль в развитии аллергической реакции при повторном контакте организма с данным аллергеном. Антитела активируют эозинофилы, приводя к их повышенному содержанию в крови.
Заболевания, при которых повышаются эозинофилы крови
Эозинофилия является характерным проявлением аллергических заболеваний и состояний, таких как:
- аллергический ринит и конъюнктивит;
- атопический дерматит;
- бронхиальная астма;
- пищевая аллергия и др.
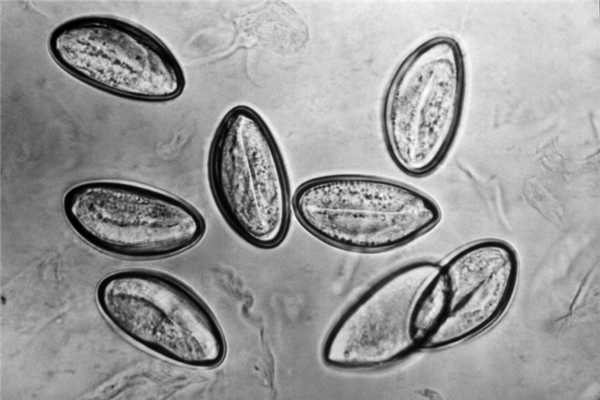
С одной стороны, эозинофилы обладают противопаразитарной активностью, за счет способности выделять эозинофильный катионный белок и активные формы кислорода, которые губительны для гельминтов. С другой стороны, продукты метаболизма гельминтов вызывают реакцию гиперчувствительности, для которой свойственны симптомы аллергии.
Следующая группа заболеваний, протекающих с повышением количества эозинофилов, - ревматологические патологии, или системные воспалительные заболевания соединительной ткани. Данные заболевания в абсолютном большинстве случаев являются аутоиммунными.
В основе аутоиммунных процессов лежит нарушение распознавания клетками иммунной системы собственных тканей, в результате чего они воспринимаются как чужеродные. Против них начинают вырабатываться антитела, и запускается воспалительный процесс.
Одним из аутоиммунных заболеваний, для которого характерна эозинофилия, является разновидность васкулита (воспаления сосудов) – эозинофильный гранулематоз с полиангиитом, или синдром Черджа–Стросса (воспаление мелких и средних кровеносных сосудов).
Эозинофилия может свидетельствовать о наличии в организме злокачественного процесса. Это связано с тем, что клетки злокачественных опухолей вырабатывают, среди прочего, вещества, стимулирующие образование эозинофилов. Так, эозинофилия является частым симптомом хронического миелолейкоза.
К каким врачам обращаться при эозинофилии
Эозинофилия не является самостоятельным заболеванием, но может быть признаком аллергических, аутоиммунных, инфекционных патологий.
Поэтому сначала можно обратиться к терапевту (врачу общей практики) или педиатру , если пациентом является ребенок. Зачастую данных, собранных в процессе опроса и клинического осмотра пациента, может оказаться достаточно для направления на прием к узкопрофильному специалисту. Так, при впервые выявленном аллергическом заболевании требуется консультация аллерголога-иммунолога, при гельминтозе - врача-инфекциониста, а при подозрении на аутоиммунный процесс – ревматолога.
Диагностика и обследование при эозинофилии
После тщательного сбора анамнеза и выявления ключевых фактов развития заболевания назначают лабораторные обследования.
Клинический анализ крови с определением лейкоцитарной формулы необходим для определения количества эозинофилов. В данном исследовании важно провести микроскопию мазка, которая позволяет не только достоверно подсчитать количество эозинофилов, но и выявить наличие в крови специфических клеток, характерных, например, для лейкоза и некоторых аутоиммунных заболеваний.
Синонимы: Общий анализ крови (ОАК); Гемограмма; КАК; Развернутый анализ крови. Full blood count; FBC; Complete Blood Count (CBC); Hemogram; CBC with White Blood Cell Differential Count; Peripheral Blood Smear; Blood Film Examination; Comp.
Читайте также:
