Общий вариабельный иммунодефицит
Добавил пользователь Владимир З. Обновлено: 07.01.2026
Патогенез.Иммунодефицит развивается в результате нарушения способности В-лимфоцитов дифференцироваться в плазматические клетки и продуцировать антитела.
Диагностика. У больных наблюдаются низкие концентрации в сыворотке крови IgА, IgМ, IgG, сниженная продукция специфических антител на патоген ( в ответ на иммунизацию). При этом у таких лиц в крови наблюдается нормальный или несколько сниженный уровень В-лимфоцитов. Показатели Т-звена иммунитета в пределах нормы.
Клиника.Заболевание может возникнуть в любом возрасте, часто проявляется на 14-36 годах жизни, проявляется развитием рецидивирующих и хронических инфекций бактериальной природы бронхолегочного тракта, придаточных пазух носа, уха, бактериальными поражениями кожи и подкожной клетчатки, развитием энтероколита и дисбактериоза.
Лечение.Симптоматическое. Назначение антибактериальных препаратов. Пожизненной заместительной терапии антителосодержащими препаратами.
7. Транзиторная гипогаммаглобулинемия у детей
Патогенез. Характеризуется гипогаммаглобулинемией вследствие нарушения образования IgG у детей раннего возраста и диагностируется после исчезновения материнских трансплацентарных IgG. Транзиторная гипогаммаглобулинемия сохраняется у детей с 6 мес до 2-3 лет. Уровень IgG при этом снижен в два раза по сравнению с возрастной нормой при нормальных или сниженных показателях IgA и IgM.
Клиника.У некоторых младенцев симптомы не проявляются. Они нормально отвечают на антигены вакцин и спустя несколько лет «перерастают» гипогаммаглобулинемию. У других детей выявляют рецидивирующие бактериальные инфекционные заболевания начиная с первого месяца жизни. Основные клинические проявления — бактериальные инфекции верхних дыхательных путей. У некоторых детей выявляют рецидивирующую диарею, тяжелые формы ветряной оспы, длительно сохраняющийся оральный кандидоз. У большинства детей развиваются аллергические заболевания. Лимфатические узлы и миндалины у таких детей гипоплазированы.
Диагностика:Уровень сывороточных IgA и IgG обычно снижен, а IgM чаще в норме или повышен. Содержание В-лимфоцитов в норме, нейтропения и реже тромбоцитопения. У большинства детей симптомы транзиторной гипогаммаглобулинемии исчезают к 2-3 годам. Повторно определять уровни иммуноглобулинов необходимо с интервалом 6-12 мес, пока не восстановятся нормальные показатели.
Лечение симптоматическое, направленное на купирование инфекций. В тяжелых случаях показана заместительная терапия препаратами иммуноглобулинов.
8. Синдром тяжелого иммунодефицита .
Тяжёлый комбинированный иммунодефицит (Глянцмана-Риникера)— генетическое заболевание, при котором в результате дефекта одного из генов нарушается работа компонентов адаптивной иммунной системы B- и T-лимфоцитов. Тяжёлый комбинированный иммунодефицит— это тяжёлая форма наследственного иммунодефицита, который также известен как синдром мальчика в пузыре, так как больные крайне уязвимы перед инфекционными болезнями и вынуждены находиться в стерильной среде. Тяжёлый комбинированный иммунодефицит является результатом настолько сильного повреждения иммунной системы, что последняя считается практически отсутствующей.
Симптомы - хроническая диарея, ушные инфекции, возвратный пневмоцистоз, обильные кандидозы полости рта. Без лечения, в случае, если не было произведено успешной трансплантации гемопоэтических стволовых клеток, дети обычно умирают в течение первого года жизни от тяжёлых возвратных инфекций.
Лечение.Наиболее распространённым методом лечения тяжёлого комбинированного иммунодефицита является трансплантация гемопоэтических стволовых клеток, которая проходит успешно либо при участии неродственного донора, либо при участии полу-совместимого донора, которым может являться один из родителей.
Есть также некоторые нелечебные методы терапии тяжёлого комбинированного иммунодефицита. Обратная изоляция предполагает использование ламинарного потока воздуха и механических барьеров (для избежания физического контакта с другими людьми), чтобы изолировать пациента от любых вредных патогенных микроорганизмов, присутствующих во внешней среде.
Первичный иммунодефицит. ОВИН - общая вариабельная иммунная недостаточность
Общая вариабельная иммунная недостаточность - нарушение, характеризующееся низкими уровнями иммуноглобулинов (антител) в сыворотке крови и повышенной чувствительностью к инфекциям. В большинстве случаев генетические причины низких уровней иммуноглобулинов сыворотки крови неизвестны. Эта форма иммунодефицита встречается относительно часто, в связи с чем в ее названии есть слово “общая”. Степень и тип недостаточности иммуноглобулинов в сыворотке крови, а также клиническое течение у разных пациентов различны, что объясняет наличие слова “вариабельная”.
Общая вариабельная иммунная недостаточность (ОВИН) - нарушение, характеризующееся низкими уровнями иммуноглобулинов (антител) в сыворотке крови и повышенной чувствитель-ностью к инфекциям. Обычно точные причины низких уровней иммуноглобулинов сыворотки крови неизвестны. Эта форма иммунодефицита встречается относительно часто, в связи с чем в ее названии есть слово “общая”. Степень и тип недостаточности иммуноглобулинов в сыворотке крови, а также клиническое течение у разных пациентов различны, что объясняет наличие слова “вариабельная”. У некоторых пациентов имеется снижение таких иммуноглобулинов, как IgG и IgA. У других могут быть снижены уровни всех трех основных видов иммуноглобулинов (IgG, IgA
и IgM). Клинические признаки и симптомы также могут иметь различную степень выраженности - от легких до тяжелых. Частые и необычные инфекции могут впервые возникнуть в раннем детстве, в подростковом возрасте или у взрослых людей. У большинства пациентов это состояние диагностируется лишь в возрасте 20-40 лет. Однако примерно у 20% пациентов симптомы заболевания возникают или состояние иммунодефицита выявляется до 16-летнего возраста. В связи с относительно поздним началом симптомов и постановкой диагноза ОБЩАЯ ВАРИАБЕЛЬНАЯ ИММУННАЯ НЕДОСТАТОЧНОСТЬ это заболевание также имеет другие названия, в том числе приобретенная агаммаглобулинемия, агаммаглобулинемия взрослых или поздняя
гипогаммаглобулинемия. Термин “приобретенный иммунодефицит” в настоящее время применя- ется для обозначения синдрома, вызываемого вирусом СПИДа (ВИЧ), и его не следует использо-
вать для обозначения общей вариабельной иммунной недостаточности (ОВИН) в связи со
значительным различием этих нарушений. Причины ОВИН в значительной степени неизвестны, однако недавно проведенные исследования выявили участие небольшой группы генов у некоторых пациентов. На протяжении последних десятилетий исследования клеток иммунной системы у больных ОВИН выявили многие нарушения лимфоцитов. У большинства пациентов обнаруживается нормальное число В-лимфоцитов, у которых не происходит нормальное
созревание до плазматических клеток, способных вырабатывать различные виды иммуноглобули-
нов и антител. У других пациентов функция Т-лимфоцитов-помощников недостаточна для нормальной выработки антител. У третьей группы пациентов имеется чрезмерное количество цитотоксических Т-лимфоцитов, хотя роль этих клеток в данном заболевании не ясна.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
Общая вариабельная иммунная недостаточность (ОВИН) может быть как у мужчин, так и у женщин. У некоторых пациентов симптомы возникают на протяжении первых лет жизни, однако у многих пациентов они могут возникнуть лишь в возрасте 10-30 лет или даже позже. Основным проявлением ОВИН у большинства пациентов являются рецидивирующие инфекции уха, придаточных пазух, носа, бронхов и легких. При значительной тяжести и частоте инфекций легких может возникнуть необратимое поражение бронхов (дыхательных путей) с развитием хронических изменений - расширения и рубцовых изменений - этих структур. Такое состояние называется бронхоэктазом. Эти инфекции обычно вызываются бактериями, широко распростра-ненными среди людей и часто вызывающими пневмонию (Haemophilus influenzae, пневмококки и стафилококки). Лечение легочных инфекций направлено на предупреждение их рецидивов и сопутствующего хронического поражения легочной ткани. Регулярный кашель по утрам с выделением желтой или зеленой мокроты может быть проявлением хронической инфекции или бронхоэктазов (расширения, рубцовых изменений и воспаления бронхов). При ОВИН могут быть увеличены шейные, грудные или брюшные лимфатические узлы. Точная причина неизвестна, однако увеличение лимфатических узлов может быть вызвано инфекцией, нарушением
иммунной регуляции или сочетанием этих факторов. Аналогичным образом, часто наблюдается увеличение селезенки, а также увеличенные узелковые скопления лимфоцитов в стенках кишечника, называемые пейеровыми бляшками. Несмотря на то, что у больных ОВИН снижено образование антител и имеются низкие уровни иммуноглобулинов крови (гипогаммаглобулине-
мия), некоторые антитела, вырабатываемые организмом этих пациентов, могут атаковать их собственные ткани (аутоантитела). Эти аутоантитела могут атаковать и уничтожать клетки крови (например, эритроциты, лейкоциты или тромбоциты). Хотя у большинства пациентов первым
проявлением ОВИН является рецидивирующая бактериальная инфекция, примерно у 20% иммунная недостаточность впервые обнаруживается как значительное снижение количества тромбоцитов в крови или даже тяжелая анемия в связи с разрушением красных кровяных клеток.
Аутоантитела могут также вызвать артрит или эндокринные нарушения, например, заболевание щитовидной железы. У некоторых больных ОВИН, не получающих достаточной заместительной
терапии иммуноглобулинами, может также развиться болезненное воспаление одного или нескольких суставов. Это состояние называется полиартритом. В большинстве таких случаев суставная жидкость не содержит бактерий. Чтобы убедиться в отсутствии излечимой инфекции
в суставах, можно иглой взять образец внутрисуставной жидкости и исследовать ее на предмет присутствия бактерий. В некоторых случаях, которые трудно диагностировать, причиной такого состояния могут быть бактерии рода Mycoplasma. В типичном случае артрит, связанный с ОВИН,
может охватывать крупные суставы, например, коленные, голеностопные, локтевые и суставы кистей рук. Более мелкие суставы (например, суставы пальцев рук) поражаются редко. Симптомы воспаления суставов обычно исчезают при достаточной иммуноглобулиновой терапии и правильном введении антибиотиков. Однако у некоторых пациентов артрит может наблюдаться даже при достаточной заместительной терапии иммуноглобулинами. У некоторых больных ОВИН возникают жалобы на желудочно-кишечные расстройства, например, боль в животе, повышенное газообразование, тошноту, понос и снижение веса тела. Тщательное обследование органов
пищеварения может выявить нарушение всасывания жира и некоторых сахаров. Если взять небольшой фрагмент (биопсию) слизистой оболочки кишечника, можно обнаружить характерные изменения. Эти изменения помогают диагностировать и лечить это нарушение. У некоторых
пациентов с нарушением функций пищеварительного тракта в биопсийном материале и при анализе кала выявляется микроскопический паразит - лямблии Giardia. Уничтожение этого паразита при помощи лекарственных средств может устранить желудочно-кишечные расстройства. Наконец, при ОВИН может увеличиваться риск развития рака, особенно рака лимфоидной системы, кожи и желудочно-кишечного тракта. При отсутствии осложнений ОВИН не сопровождается физическими нарушениями. У некоторых пациентов с ОВИН могут быть увеличены селезенка и лимфатические узлы. При развитии хронического поражения
легких у пациента может снизиться физическая работоспособность и жизненный объем легких (максимальное количество воздуха, которое можно произвольно набрать в легкие). Поражение желудочно-кишечного тракта в некоторых случаях может повлиять на нормальный рост детей
или вызвать снижение веса тела у взрослых.
ДИАГНОЗ
Подозрение на общую вариабельную иммунную недостаточность (ОВИН) возникает при обследовании детей или взрослых с рецидивирующей инфекцией ушей, придаточных пазух носа, бронхов и легких. Диагноз подтверждается обнаружением низких уровней иммуноглобулинов, в том числе IgG, IgA и обычно IgM. У пациентов, полностью иммунизированных против полиомие-
лита, кори, дифтерии и столбняка, антитела к одной или нескольким из этих вакцин могут иметь очень низкие уровни или отсутствовать. Для определения степени нарушения иммунитета
выполняется иммунизация другими вакцинами, например, пневмококковой. В некоторых случаях эти исследования позволяют врачу определить, поможет ли пациенту заместительная терапия иммуноглобулинами. В образцах крови можно также определить количество Т-лимфоцитов
и исследовать их функцию. Специальные методы лабораторных исследований позволяют определить, вырабатывают ли В-лимфоциты антитела в пробирках (культурах ткани) и нормальны ли функции Т- лимфоцитов.
ГЕНЕТИКА И НАСЛЕДОВАНИЕ
В связи с тем, что генетическая природа общей вариабельной иммунной недостаточности (ОВИН) не ясна, точный тип наследования не определен. В некоторых случаях у нескольких членов семьи обнаруживается недостаточность одного или нескольких видов иммуноглобулинов.
Например, нередко один из членов семьи страдает ОВИН, а у другого имеется избирательный дефицит иммуноглобулина А. За последние нескольких лет обнаружена связь мутаций в некоторых генах с ОВИН. Например, аутосомно-рецессивное наследование ОВИН было связано в одной семье с индуцируемой костимуляцией (ICOS), а в некоторых семьях с белком на В-клетках (CD19). Примерно в 10% случаев ОВИН обнаруживаются мутации клеточного рецептора (TACI)
двух факторов (BAFF or APRIL), необходимых для нормального роста и регуляции В-клеток. Еще не ясно, могут ли эти мутации стать причиной нарушения иммунитета, поскольку некоторые из них можно обнаружить у лиц с нормальным содержанием иммуноглобулинов.
ЛЕЧЕНИЕ
Лечение общей вариабельной иммунной недостаточности (ОВИН) похоже на лечение других нарушений, характеризуемых низкими уровнями иммуноглобулинов сыворотки крови. При отсут-
ствии значительного нарушения Т-лимфоцитов или поражения органов заместительная терапия иммуноглобулинами почти всегда снижает тяжесть симптомов. Иммуноглобулины выделяют из больших объемов плазмы крови человека. Эти препараты состоят в основном из IgG и содержат все важные антитела, имеющиеся у здоровых людей. Пациенты с хроническим синуситом или хроническими заболеваниями легких могут также нуждаться в длительном лечении антибио-тиками широкого спектра действия. При подозрении на инфекцию микроорганизмами родов Mycoplasma или Chlamydia могут быть назначены антибиотики, обладающие избирательным действием на эти микроорганизмы. При развитии бронхоэктазов необходима физиотерапия
и ежедневные процедуры с принятием положений тела, способствующих выделению мокроты из легких и бронхов. Пациенты с желудочно-кишечными симптомами или нарушением всасывания следует обследовать для выявления кишечных лямблий Giardia, ротавируса или некоторых других инфекций желудочно-кишечного тракта. Большинство пациентов с иммунодефицитом и артритом дают благоприятные реакции на заместительную терапию иммуноглобулинами.
ПРОГНОЗ
Заместительная терапия иммуноглобулинами в сочетании с антибиотикотерапией значительно улучшили прогноз для пациентов с общей вариабельной иммунной недостаточностью (ОВИН). Цель лечения - защитить пациента от инфекций и предупредить хронические поражения
легких. Прогноз у пациентов с ОВИН зависит от степени поражения легких и других органов до постановки диагноза и начала заместительной терапии иммуноглобулинами, а также от успеха профилактики инфекций введением иммуноглобулинов и антибиотиков в дальнейшем.
Статья любезно предоставлена всемирной организацией IPOPI - работающей на улучшение жизни людей с первичным иммунодефицитом.
Авторские права 2007 принадлежат фонду Immune Deficiency Foundation, США. "Руководство по первичным иммунодефицитным заболеваниям для больных и членов их семей", из которого этот материал взят по лицензии, было разработано Immune Deficiency Foundation при поддержке компании Baxter Healthcare Corporation.
Другие статьи
Колонка эксперта - Беллы Брагвадзе. Удивительный мир иммунитета.
Чем настоящий иммунодефицит отличается от частой простуды
Почему дети должны болеть, о бессмысленности иммуномодуляторов и о том, чем настоящий иммунодефицит отличается от частой простуды, — иммунолог Анна Щербина Иммунодефицит — это состояние, сопровождающееся значительными и долговременными изменениями в иммунной системе и серьезными симптомами. Есть иммунодефициты вторичные, а есть первичные (ПИД). Первичные обусловлены генетически. Как правило, симптомы возникают в раннем возрасте, однако иногда могут возникнуть и у взрослых. Но в любом случае проявления будут очень тяжелыми. С первичными иммунодефицитами встречаются крайне редко. Подтвердить многие такие заболевания можно, обнаружив дефект гена. Но пока, правда, найдены мутации не при всех ПИД, поиск продолжается. Текст: Дарья Саркисян Фотографии: Максим Шер Журнал "Большой город"
ЧТО ТАКОЕ ПЕРВИЧНЫЙ ИММУНОДЕФИЦИТ
Как рассказать детям об иммунитете
Презентация для школьников о том, что такое иммунитет, какие нарушения встречаются, как живут дети с первичным иммунодефицитом и как им можно помочь.
Первичный иммунодефицит. Х-сцепленный лимфопролиферативный синдром
Х-сцепленный лимфопролиферативный синдром – первичный иммунодефицит, при котором у пациентов мужского пола отмечается нарушение иммунного ответа на вирус Эпштейн-Барра.
Первичный иммунодефицит. Аутоиммунный лимфопролиферативный синдром
Аутоиммунный лимфопролиферативный синдром – первичный иммунодефицит, при котором отмечается хроническое незлокачественное увеличение лимфоузлов, печени и селезенки, аутоиммунная патология, повышение уровня иммуноглобулинов в крови.
Первичный иммунодефицит. Синдром Ди Джорджи
Синдром Ди Джорджи – врожденный дефект, который приводит к гипоплазии или отсутствию тимуса (вилочковой железы) в сочетании с пороками развития крупных сосудов, сердца, паращитовидных желез, костей лицевого черепа и верхних конечностей
Оптимизация диагностики и терапии наследственного ангионевротического отека у взрослых.
Особенности редкой формы первичного иммунодефицита, клинические проявления, иммунологические нарушения и принципы терапии наследственного ангионевротического отека. Индивидуальные планы самоконтроля для каждого пациента и оценкаа их эффективность. Караулов А.В., Сидоренко И.В., Капустина А.С. Первый Московский государственный медицинский университет им. И. М. Сеченова, Москва
Наследственный ангионевротический отек
Наследственный ангионевротичекий отёк - редкое, жизнеугрожающее заболевание, которое относится к группе первичных иммунодефицитов. Причина - недостаточность общего уровня или снижение функциональной активности С1-ингибитора системы комплемента. Жизнь таких больных становится кошмаром: они никогда не знают, где и когда начнется отек. Пациенты нередко испытывают страх очередного приступа, для них характерны чувство одиночества, ощущение безысходности и бесконечные проблемы на работе, в учебе и быту.
Первичный иммунодефицит. Хроническая гранулематозная болезнь
Хроническая гранулематозная болезнь (ХГБ) – генетическое заболевание, связанное с дефектом фагоцитов, клеток иммунной системы, которые защищают организм путем поглощения (фагоцитоза) вредных чужеродных частиц, бактерий, а также мертвых или погибающих клеток, из-за которого снижается их антимикробная активность.
Иммунодефицитные состояния
Слово «иммунитет» давно вошло в обиход не только врачей, но и не связанных с медициной людей: нам часто приходится слышать его в различных рекламных роликах, передачах по охране окружающей среды и т.д. Действительно, динамические изменения показателей иммунной системы происходят в ответ на различные состояния организма: инфекции, травмы, опухоли. Является ли это патологией? В большинстве случаев – нет, это нормальная реакция живого организма. Ведь основная функция иммунной системы – это борьба со всем чужеродным, будь то бактерия или опухолевая клетка. Однако в некоторых случаях изменения иммунной системы носят долгосрочный, патологический характер, такие состояния называются иммунодефицитными (ИДС).
Первичный иммунодефицит. Синдром Вискотта-Олдрича
Синдром Вискотта-Олдрича является первичным иммунодефицитным состоянием, поражающим как Т- лимфоциты, так и В-лимфоциты. Также тяжело поражаются тромбоциты - клетки, помогающие останавливать кровотечение. Информация в статье предназначена для пациентов и членов их семей и не должна заменять рекомендаций и назначений лечащего врача и клинициста-иммунолога.
Первичный иммунодефицит. Х-сцепленная агаммаглобулинемия
У больных с Х-сцепленной агаммаглобулинемией основным дефектом является неспособность предшественников В-лимфоцитов созревать до состояния В-лимфоцитов, а затем плазматических клеток. Поскольку у этих больных нет клеток, вырабатывающих иммуноглобулины, наступает тяжелая недостаточность иммуноглобулинов. Информация в статье предназначена для пациентов и членов их семей и не должна заменять рекомендаций и назначений лечащего врача и клинициста-иммунолога.
Первичный иммунодефицит. ТКИН - тяжелая комбинированная иммунная недостаточность
Тяжелая комбинированная иммунная недостаточность (ТКИН) - самый тяжелый диагноз в списке первичных иммунодефицитов - является редким синдромом, обусловленным различными генетическими факторами, и сочетающим отсутствие функций Т- и В- лимфоцитов (а во многих случаях также отсутствие функции естественных киллеров или NK-лимфоцитов). Эти нарушения приводят к чрезвычайной чувствительности к тяжелым инфекциям. Информация в статье предназначена для пациентов и членов их семей и не должна заменять рекомендаций и назначений лечащего врача и клинициста-иммунолога.
12 настораживающих признаков первичного иммунодефицита
ПИД не СПИД. Первичный иммунодефицит является врожденным нарушением в иммунной системе, имеющим генетическую природу. Показанием для направления к иммунологу является сочетание рецидивирующих вирусных и бактериальных инфекций либо наличие тяжелых, затяжных бактериальных инфекций. Данные Всемирной организации здравоохранения свидетельствуют о том, что частота ОРВИ 8 раз в год является нормальным показателем для детей дошкольного и младшего школьного возраста, посещающих детские учреждения.
Часто болеющие дети: чем они больны на самом деле?
Инфекции уха, горла, носа, а также бронхолёгочные инфекции составляют основной перечень заболеваний в детском возрасте. Данные ВОЗ свидетельствуют о том, что частота ОРВИ 8 раз в год является нормальным показателем для детей дошкольного и младшего школьного возраста, посещающих детские учреждения. Показанием для направления к иммунологу является сочетание рецидивирующих вирусных и бактериальных инфекций либо наличие тяжелых, затяжных бактериальных инфекций.
Иммунодефициты у детей.
Диагноз «иммунодефицит» становится все более популярным у врачей разных специальностей. Создается впечатление, что зачастую врачи, вместо того, чтобы четко определить диагноз и проводить лечение заболевания в соответствии с утвержденными стандартами, назначают иммунотропные средства, не представляя эффект и последствия такой терапии.
Диагностика семей с иммунодефицитом
Первичные иммунодефициты, являются наследуемыми заболеваниями, при которых родители являются носителями больного гена и передают его детям. В результате чего у ребенка развивается заболевание. В настоящее время в связи с развитием генетики и иммунологии известны многие гены, мутация в которых приводит к развитию различных форм первичных иммунодефицитов.
Общая вариабельная иммунная недостаточность: клинический случай
Первичные иммунодефициты являются редкой врожденной патологией, связанной с несостоятельностью иммунной системы, проявляющейся нарушением ее функции. Эти дефекты приводят к повышенной восприимчивости пациентов к различным инфекционным агентам, а также появлению аутоиммунных, онкологических и других заболеваний. Первичные иммунодефициты относят к редким болезням, что ранее ассоциировалось с плохим прогнозом высокого риска летальности в детском возрасте. На сегодняшний день появление высокоэффективных методов лечения позволило изменить течение и прогноз данных заболеваний. Все чаще врачи различных специальностей встречаются с данной патологией в повседневной практике, в том числе у взрослых. В связи с этим становится актуальной ранняя диагностика первичных иммунодефицитов у взрослых, что связано с подбором оптимальной терапии, предупреждением тяжелых поражений внутренних органов, определением тактики ведения пациентов, а также необходимостью выявления наследственных нарушений и предоставления информации семье пациента. Зачастую несвоевременная верификация диагноза может привести к инвалидизации пациента и развитию необратимых, часто смертельных осложнений. В данной работе представлен пример собственного клинического случая пациента с впервые установленным диагнозом: общая вариабельная иммунная недостаточность – наиболее частая форма первичного иммунодефита у взрослых. Симптоматика общей вариабельной иммунной недостаточности проявляется у пациентов в зрелом возрасте, но качественно собранный анамнез позволит ввыявить симптомы у пациентов еще в раннем детстве. Обычно имеется задержка в несколько лет между началом заболевания и постановкой диагноза, так как часто ставится ошибочный диагноз в связи с неспецифическими клиническими симптомами, напоминающими другие, более частые заболевания. Прогноз у пациентов с общей вариабельной иммунной недостаточностью зависит от нескольких факторов: частоты инфекций, структурных нарушений в легких, возникновения аутоиммунных заболеваний и успешности профилактики инфекций. Таким образом, разнообразие клинических форм первичных иммунодефицитов, недостаточная осведомленность врачей о данной патологии, сложность проведения иммунологического обследования в общей лечебной сети приводят к тому, что общая вариабельная иммунная недостаточность длительно не диагностируется и больные не получают необходимой патогенетической терапии. Необходимо привлечь внимание врачей различных специальностей к тому, что причиной часто рецидивирующих воспалительных процессов различной локализации, плохо поддающихся адекватной традиционной терапии, могут быть изменения в иммунной системе, вплоть до врожденных, генетически обусловленных иммунодефицитов.
Ключевые слова
Об авторах
ФГБОУ ВО «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого» Министерства здравоохранения РФ; КГБУЗ «Краевая клиническая больница»
Россия
Собко Елена Альбертовна – д.м.н., доцент, профессор кафедры внутренних болезней и иммунологии с курсом ПО; заведующая отделением аллергологии
660022, г. Красноярск, ул. Партизана Железняка, 1
ФГБОУ ВО «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого» Министерства здравоохранения РФ; КГБУЗ «Краевая клиническая больница»
Россия
д.м.н., профессор, заведующая кафедрой внутренних болезней и иммунологии с курсом ПО; заведующая легочно-аллергологическим центром
ФГБОУ ВО «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого» Министерства здравоохранения РФ; КГБУЗ «Краевая клиническая больница»
Россия
д.м.н., доцент, доцент кафедры внутренних болезней и иммунологии с курсом ПО; врач-пульмонолог лечебно-диагностического отделения
ФГБОУ ВО «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого» Министерства здравоохранения РФ; КГБУЗ «Краевая клиническая больница»
Россия
к.м.н., доцент, доцент кафедры внутренних болезней и иммунологии с курсом ПО; врач-пульмонолог лечебно-диагностического отделения
ФГБОУ ВО «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого» Министерства здравоохранения РФ; КГБУЗ «Краевая клиническая больница»
Россия
к.м.н., доцент кафедры внутренних болезней и иммунологии с курсом ПО; врач-пульмонолог лечебно-диагностического отделения
ФГБОУ ВО «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого» Министерства здравоохранения РФ
Россия
ординатор кафедры внутренних болезней и иммунологии с курсом ПО
врач иммунолог консультативно-диагностической поликлиники
ФГБОУ ВО «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого» Министерства здравоохранения РФ; КГБУЗ «Краевая клиническая больница»
Россия
к.м.н., доцент кафедры внутренних болезней и иммунологии с курсом ПО, врач аллерголог отделения аллергологии
Список литературы
1. Буйнова С.Н., Шинкарева В.М., Павлова Т.Б. Создание регистра первичных иммунодефицитов у детей Иркутской области // Сибирский медицинский журнал, 2017. Т. 133, № 2. С. 83-86.
2. Козлова О.С. Первичные иммунодефициты в Самарской области // Аспирантский вестник Поволжья, 2015. Т. 2, № 5-6. С. 227-229.
3. Латышева Е.А. Первичные иммунодефициты у взрослых. Преимущественное нарушение синтеза антител // Терапия, 2018. Т. 25, № 7. С. 119-124.
5. Al-Herz W., Bousfiha A., Casanova J.L. Primary immunodeficiency disease. An update on the classification from the International Union of Immunological Societies Expert Committee for Primary immunodeficiency. J. Clin. Immunol., 2015, Vol. 35, no. 8, pp. 696-726.
6. Ameratunga R., Brewerton M., Slade C., Jordan A., Gillis D., Steele R., Koopmans W., Woon S.T. Comparison of diagnostic criteria for common variable immunodeficiency disorder. J. Front. Immunol., 2014, Vol. 15, no. 5, pp. 1-9.
8. Bousfiha A., Jeddane L., Ailal F., Benhsaien I., Mahlaoui N., Casanova J.L., Abel L. Primary immunodeficiency diseases worldwide: more common than generally thought. J. Clin. Immunol., 2013, Vol. 33, no. 1, pp. 1-7.
10. Chapel H., Lucas M., Lee M., Bjorkander J., Webster D., Grimbacher B., Fieschi C., Thon V., Abedi M.R., Hammarstrom L. Common variable immunodeficiency disorders: division into distinct clinical phenotypes. Blood, 2008, Vol. 112, no. 2, pр. 277-286.
12. Jolles S. The variable in common variable immunodeficiency: a disease of complex phenotypes. J. Allergy Clin. Immunol. Pract., 2013, Vol. 1, no. 6, pp. 545-556.
13. Kumar Y., Bhatia A. Common variable immunodeficiency in adults: current diagnostic protocol and laboratory measures. J. Expert Rev. Clin. Immunol., 2014, Vol. 10, no. 2, pp. 187-188.
14. Perez E.E., Orange J.S., Bonilla F., Chinen J., Chinn I.K., Dorsey M., El-Gamal Y., Harville T.O., Hossny E., Mazer B., Nelson R., Secord E., Jordan S.C., Stiehm E.R., Vo A.A., Ballow M. Update on the use of immunoglobulin in human disease: a review of evidence. J. Allergy Clin. Immunol., 2017, Vol. 139, no. 3, pp. 1-46.
Общий вариабельный иммунодефицит
ЖВП — желчевыводящие пути
ЖКТ — желудочно-кишечный тракт
НСТ — нитросиний тетразолий
ОВИН — общий вариабельный иммунодефицит
ПИД — первичные иммунодефициты
Привычным является представление о первичных иммунодефицитах (ПИД) как о патологии, свойственной детскому возрасту [1—4]. При этом распространенность таких заболеваний может быть разной в зависимости от пенетрантности мутантных генов — виновников ПИД и вида наследования: от 1:500 до 1:5 000 000 новорожденных [1—4]. В настоящее время появились данные о большей распространенности таких наследственных заболеваний [2, 3] и увеличивающемся числе случаев регистрации ПИД у взрослых пациентов [2,3, 5—8]. В частности, к ним относится общий вариабельный иммунодефицит (ОВИН, англ.— сommon variable immunodeficiency — CVID). Этот термин обозначает группу генетических, но не до конца дифференцированных ПИД, характеризующихся разнообразными иммунными нарушениями, среди которых преимущественными считают дефекты синтеза антител, обусловленные повреждениями регуляторных функций как Т-клеток, так и/или В-клеток [1, 2, 3—8]. Распространенность ОВИН составляет от 1:25 000 до 1:70 000, хотя приводятся и другие цифры (до 1:200 000) [1, 3—8]. В отечественной литературе в последние годы опубликован целый ряд работ, качественно и скрупулезно представляющих все клинические особенности этой патологии, ее патогенеза, лечения и прогноза. Несмотря на это, верификация диагноза зачастую запаздывает на месяцы и годы, что ухудшает качество жизни пациентов и прогноз, способствует развитию тяжелой хронической патологии, особенно дыхательной системы, и инвалидности у больных ввиду несвоевременности и неадекватности лечения.
Цель работы: анализ 7 случаев ОВИН, выявленных нами в последние 5 лет у взрослых пациентов.
В исследование включили 7 пациентов с ОВИН (2 мужчин и 5 женщин) в возрасте от 44 до 57 лет (табл. 1). Амбулаторное обследование больных включало сбор анамнестических данных (первые симптомы заболевания и время их появления, динамика развития, предшествующая терапия и ее эффективность, обращение к специалистам и т. д.), а также оценку результатов общеклинических, лабораторных, инструментальных исследований и заключения врачей — специалистов разного профиля. Диагноз установлен амбулаторно на основании полученных сведений и в дальнейшем неоднократно подтвержден иммунологическими показателями. Субпопуляционный состав лимфоцитов определяли иммуноцитохимическим методом CD-типирования с использованием моноклональных антител («DAKO», США). Определяли относительное и абсолютное число Т-лимфоцитов CD3 + , Т-хелперов CD4 + , цитотоксических Т-лимфоцитов CD8 + , В-лимфоцитов CD19 + , естественные киллеры CD56 + в периферической крови. Для оценки гуморального иммунного ответа исследовали уровни иммуноглобулинов классов А, M, G (IgA, IgM, IgG) в сыворотке крови нефелометрическим методом на анализаторе белков Turbox plus («Orion Diagnostica», Финляндия). Для оценки функциональной активности нейтрофилов, обусловленной зависимыми от кислорода механизмами, использовали спонтанную и индуцированную зимозаном («Sigma», США) реакцию восстановления нитросинего тетразолия (НСТ). Фагоцитарную и киллерную активность нейтрофилов изучали с использованием референтного штамма Candida albicans. Киллинг оценивали числом убитых клеток гриба на 100 дрожжевых форм, выраженном в процентах. Продукцию интерферонов (IFN-γ и IFN-α) определяли с помощью коммерческих иммуноферментных тест-систем («Цитокин», Россия) в супернатантах клеток крови после 24-часовой индукции фитогемагглютинином («Sigma», США). Чувствительность метода при использовании тест-систем составляла 5—30 пг/мл. В качестве контрольных показателей использованы референтные значения, а также результаты иммунологического обследования 20 практически здоровых людей (медиана возраста 29 лет).
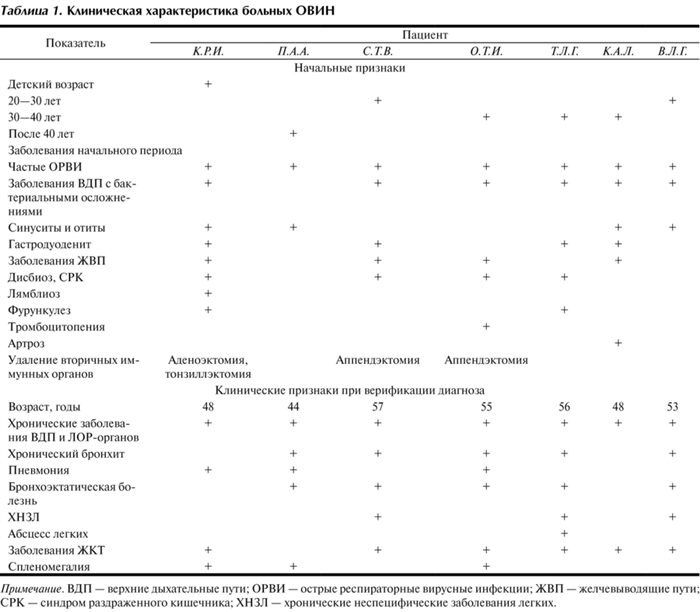
Таблица 1. Клиническая характеристика больных ОВИН Примечание. ВДП — верхние дыхательные пути; ОРВИ — острые респираторные вирусные инфекции; ЖВП — желчевыводящие пути; СРК — синдром раздраженного кишечника; ХНЗЛ — хронические неспецифические заболевания легких.
Как считают, первые клинические признаки ОВИН могут проявляться в любом возрасте, но диагностическое значение имеют 3 пика: в детском возрасте с началом развития симптомов в 2—7 лет и у взрослых — в 25—30 и 50—60 лет [1, 5—7]. Поэтому следует остановиться на этих временны́х интервалах и особенностях клинической симптоматики в анализируемых случаях (см. табл. 1). У всех больных ОВИН верифицирован в возрасте старше 40 лет. Однако у 6 человек начальные признаки заболевания в форме часто рецидивирующих инфекций дыхательных путей и желудочно-кишечного тракта (ЖКТ) выявлены в более ранний период. Это, учитывая возраст, свидетельствует о возможных нарушениях иммунной системы [2, 5, 7]. Однако, по-видимому, у большинства больных прогрессирование клинических проявлений заболевания связано с началом возрастных изменений иммунной и эндокринной систем. Ухудшение состояния, возможно, способствовало частым визитам к врачам и как следствие явилось причиной дальнейшего обращения к иммунологу. Констатируя возраст верификации диагноза ОВИН, в каждом отдельном случае мы можем только предполагать время появления первых симптомов иммунодефицита (ИД). Поэтому, с нашей точки зрения, отнесение время начала проявлений ОВИН у пациента к тому или иному пику более важно для статистики и создания регистра больных ПИД. Гораздо важнее своевременно предположить наличие ИД у часто болеющего человека молодого возраста (до 40 лет) и провести первичный дифференциальный диагноз на основании клинико-анамнестических данных. В целом, как свидетельствуют данные табл. 1, клинические особенности пациентов совпадают с описаниями ОВИН в литературе [1—11]: типичны частые и различающиеся по тяжести и длительности течения инфекционно-воспалительные заболевания носоглотки, нередко осложняющиеся синуситами и отитами, а в этиологии этих нозологий преобладает бактериальная микробиота. Инфекции плохо поддаются традиционной антибиотикотерапии, что, как правило, обусловлено резистентностью бактерий или присоединением грибов. При этом не всегда учитывается, что выделенные возбудители не относятся к облигатным патогенам. В результате заболевания ВДП, синуситы и отиты приобретают хроническое течение. У 5 больных быстро развивались бронхиты, склонные к хроническому течению и образованию ателектазов. У 3 больных на момент верификации имелись часто рецидивирующие пневмонии, трудно поддающиеся лечению, вплоть до абсцессов, обусловливающих необходимость хирургического вмешательства (1 пациентка). У 1 пациента в течение длительного времени диагностировали различные виды хронической патологии ЖКТ, включая упорный лямблиоз, а также рецидивирующий фурункулез. У 7 больных выявлены в единичных случаях артрит, тромбоцитопеническая пурпура, чаще — дисбиозы кишечника с СРК, заболевания ЖВП. В литературе отмечаются также аутоиммунная гемолитическая анемия, мальабсорбция или колиты бактериальной этиологии. Все заболевания ЖКТ сочетаются с поражениями респираторного тракта [1, 3—5, 7—11]. Течение ОВИН характеризовалось во всех случаях отсутствием острого начала, постепенностью развития симптомов, но склонностью заболеваний к затяжному и хроническому течению, быстрым присоединением осложнений и неэффективностью традиционных методов лечения. Именно эти особенности течения заболевания свидетельствуют о наличии ИД [1, 2], который должен быть подтвержден результатами исследования иммунитета, что и сделано неоднократно у наших пациентов (табл. 2, 3). При этом должна быть исключена ВИЧ-инфекция.
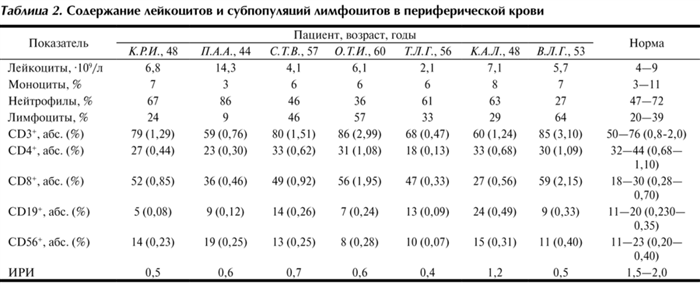
Таблица 2. Содержание лейкоцитов и субпопуляций лимфоцитов в периферической крови

Таблица 3. Показатели фагоцитоза и синтез интерферонов у больных ОВИН Примечание. С — спонтанный; И — индуцированный.
Как известно, ОВИН характеризуется разнообразными иммунными нарушениями, которые, как считают, обусловлены генетическими причинами [1, 3—5, 7]. Генетические нарушения в большинстве случаев затрагивают рецессивные гены, детерминирующие формирование и функционирование В-лимфоцитов (ICOS, CD19+, CD81+, CD20+, BAFF-R, TACI), а также вариации генов репарации ДНК (MSH2, RAD50, RAD52, MLH1, NBS1, MSH5). Только в 15% случаев генетические нарушения считают доказанными, среди них мутации генов В-лимфоцитов (CD19+, TACI) и Т-лимфоцитов (ICOS), а оставшиеся 85% причин возникновения ОВИН считают возможными. В большей степени их связывают с генами, ответственными за функции дендритных клеток и Т-лимфоцитов. При этом более 70% диагностированных случаев ОВИН рассматривают как спорадические [1, 3, 4, 7]. В любом случае в разной степени снижены уровни иммуноглобулинов основных классов IgA, IgM, IgG.
Уже при первичном обследовании во всех анализируемых случаях у больных выявлена гипогаммаглобулинемия: IgG (0,20—3,58 при норме 7—15 г/л), IgM (0,03—0,14 при норме 0,4—2,6 г/л) и IgA (0,06—0,17 при норме 0,7—4 г/л). Результаты подтверждены неоднократно в процессе наблюдения и лечения и являются патогномоничным признаком ОВИН, а также исключают другой ПИД — селективный дефицит синтеза IgA. Однако и на этом этапе обследования приходится исключить возможность вторичного ИД. В нашей практике их причинами служили аспленический синдром, «синдром исчезающих иммуноглобулинов» у профессиональных спортсменов и при психогенной анорексии у молодых женщин [2], что выявлено клинико-анамнестически. У всех 7 обследованных пациентов содержание CD19 + В-клеток превышало 1%, в связи с чем они могут быть отнесены к типу В (В+) по классификация ESI (European Society for Immunodeficiencies). В соответствии с ней ОВИН разделен на 2 типа: тип, А (В–), когда число циркулирующих В-клеток составляет менее 1% (недифференцированный); тип В (В+), когда определяется более 1% циркулирующих В-лимфоцитов. Однако у 4 больных содержание В-лимфоцитов оказалось ниже нормы.
Признано, что у больных ОВИН имеются нарушения и в Т-клеточном звене иммунитета. У обследованных пациентов не выявлено существенных отклонений количества Т-клеток CD3 + (см. табл. 2), но в 6 случаях соотношение CD4 + /CD8 + значительно ниже 1 за счет повышения относительного числа цитотоксических Т-лимфоцитов CD8 + и умеренного снижения Т-хелперов CD4 + . Эти сдвиги также считаются одними из клинически значимых иммунологических признаков ОВИН [1, 3, 4, 7], что связывают с нарушением передачи сигнала через мембрану Т-хелперов CD4 + (дефекты генов СD40L, цитокинов, главного комплекса гистосовместимости) [1, 2]. Это согласуется с полученными нами данными о повышении спонтанной продукции IFN-γ у 2 обследованных больных и отсутствии выраженного снижения индуцированной продукции этого цитокина (см. табл. 3). Это указывает на потенциальное сохранение способности лимфоцитов к продукции IFN-γ, что также считается отличительным признаком ОВИН [1, 2—4, 7]. Получены весьма неоднородные результаты исследования функциональной активности нейтрофилов (см. табл. 2). Тем не менее у 71% обследованных больных установлено снижение киллерной активности нейтрофилов. По-видимому, дефицит антимикробной защиты в большей мере зависит от уменьшения синтеза антител. Снижение способности клеток крови к продукции IFN-α в ответ на стимуляцию (у 4 человек) свидетельствует о дефиците одного из механизмов противовирусной защиты [1, 2]. Это могло предрасполагать к рецидивирующим вирусным инфекциям с повреждением слизистых оболочек дыхательных путей, что способствует усилению патогенных свойств биоты и развитию осложнений в условиях дефицита синтеза антител.
В учреждениях практического здравоохранения часто отсутствует возможность иммунологического мониторинга. Однако исследование уровня иммуноглобулинов является вполне доступным методом для своевременной верификации диагноза ОВИН, хотя дополнительным критерием могут быть исследования уровней антител к прививочным материалам, если вакцинации были качественными [1, 3—5, 7, 8]. Более подробные иммунологические исследования, как показывают приведенные результаты, у конкретного больного могут мало отличаться от среднестатистических. Поэтому следует отметить еще раз, что прежде всего анамнестические и клинические особенности заболевания у часто болеющих и имеющих несколько очагов инфекционно-воспалительной патологии пациентов могут и должны стать основанием для обобщения всех симптомов и направления на консультацию к иммунологу с целью уточнения вида ИД. С этой точки зрения возрастает необходимость участия в диагностике клинического иммунолога в учреждениях практического здравоохранения.
Описание двух случаев общего вариабельного иммунодефицита
И.М. Островский1, к.м.н., доцент кафедры педиатрии,Л.Д. Никонец2, внештатный областной детский иммунолог, Е.А. Бельская1, к.м.н., доцент кафедры педиатрии,Е.А. Толстикова1, к.м.н., доцент кафедры педиатрии,Ю.В. Зиборова2, врач-ординатор,1Донецкий национальный медицинский университет имени М. Горького,2Областная детская клиническая больница, г. Донецк
Общий вариабельный иммунодефицит (Common variable immunodeficiency – CVID) – это термин, использующийся для обозначения группы не до конца дифференцированных синдромов, характеризующихся дефектом синтеза антител и клеточного иммунитета [5].
При CVID, как правило, снижены концентрации иммуноглобулинов трех основных классов, реже – только двух, например IgA и IgG, или даже одного – IgG. Причиной снижения концентрации сывороточных иммуноглобулинов у большинства пациентов с CVID являются нарушения функций Т-лимфоцитов, и, как следствие, дефекты регуляции антителогенеза [6].
Частота встречаемости CVID – от 1:50 000 до 1:70 000. Пути наследования CVID не выяснены. Клинически заболевание характеризуется нарушением антителопродукции, повышенной склонностью к инфекциям, злокачественными новообразованиями. Примерно у 50% таких больных отмечаются аутоиммунные проявления [2].
Первые клинические симптомы CVID могут обнаружиться в любом возрасте, обычно CVID выявляют в возрасте 20-40 лет. У детей CVID чаще встречается в подростковом периоде, но не исключено появление первых симптомов заболевания в раннем возрасте [1].
Спектр клинических проявлений, на основании которых можно заподозрить CVID, очень широк: у одних пациентов первыми симптомами являются повторные пневмонии с образованием бронхоэктазов, у других – синуситы с тенденцией к быстрому переходу в хроническую форму, артрит, тромбоцитопеническая пурпура, аутоиммунная гемолитическая анемия, мальабсорбция или колит. Инфекционные осложнения при CVID представлены в основном бактериальными поражениями респираторного и пищеварительного трактов, гнойными менингитами, лямблиозом [3].
Больные с CVID, также как и с другими формами агаммаглобулинемии, высокочувствительны к энтеровирусам. Энтеровирусные энцефаломиелиты протекают крайне тяжело и представляют серьезную угрозу для жизни, возможны энтеровирусные полиомиелито- и дерматомиозитоподобные заболевания, поражения кожи и слизистых оболочек [3]. Частота цитомегаловирусной инфекции среди пациентов с CVID не отличается от таковой у здоровых.
Аутоиммунные проявления протекают тяжело и могут определять прогноз заболевания. Иногда именно аутоиммунные нарушения являются первыми клиническими симптомами CVID. Это могут быть артрит, неспецифический язвенный колит, склерозирующий холангит и др. [1, 3].
Диагноз CVID считается вероятным у пациентов, имеющих более 2 SD (стандартных отклонений) от возрастной нормы двух или трех основных изотипов иммуноглобулинов (IgA, IgG, IgM) и три следующих критерия:
• начало заболевания – в возрасте старше 2 лет;
• отсутствие изогемагглютининов и/или плохой ответ на вакцинацию;
• исключение других хорошо известных причин агаммаглобулинемии.
Диагноз CVID считается предположительным, если отмечается значительное снижение уровня одного из основных классов иммуноглобулинов и существуют все три вышеперечисленных критерия.
Основой лечения данной патологии, так же как и других форм агаммаглобулинемии, является заместительная терапия. Ранее для этого использовалась нативная плазма, сейчас – внутривенный или подкожный иммуноглобулины в дозе 0,4-0,5 г/кг 1 раз в 3-4 нед или чаще, если этого требует состояние больного. Для терапии инфекций используются антибактериальные препараты широкого спектра действия, при аутоиммунных осложнениях – иммуносупрессивные препараты, однако эта терапия не решает всех проблем, возникающих при CVID. С 1992 г. в ряде центров начато экспериментальное применение цитокинов (IL-2) в виде подкожных инъекций. По предварительным данным, получены положительные клинический и лабораторный эффекты [1, 3].
Литература
1. Кондратенко И.В., Бологов А.А. Первичные иммунодефициты. – М.: Медпрактика, 2005. – 231 с.
2. R.M. Aspalter, M.M. Eibl, H.M. Wolf. Defective. T-cell activation due to impairment of the TNF-R2 co stimulatory pathway in common variable immunodeficiency // 12-th Meeting of the European Society for Immunodeficiencies (ESID). – Budapest, 2006. – Р. 100.
3. Cunningham – Rundles C, Bodian C. Common variable immunodeficiency: Clinical and immunological features of 248 patients // Clin Immunol. – 1999. – V. 92. – P. 34-48.
4. Hermaszevski RA, Webster AD. Primery hypogammaglobulinaemia: A survey of clinical manifestations and complications // Q J Med. – 1993. – V. 86. – P. 31-42.
5. Mechanie LJ, Dicman S, Cunninham–Rundles C. Granulomatous disease in common variable immunodeficiency // Ann Intern Med. – 1997. – V. 127. – P. 613-617.
6. L. Schejbel, H. Marquart, H. Permin, A. Svejgard. Low frequency of TNFRSFB – mutations among 43 unrelated Danish Patients with Common Variable Immunodeficiency (CVID) // 12-th Meeting of the European Society for Immunodeficiencies (ESID). – Budapest, 2006. – P. 139.
Читайте также:
