Операция при трахеопищеводном свище
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Государственное бюджетное учреждение здравоохранения
Тюменской области "Областная клиническая больница №1"
Нам доверяют самое ценное!
К врачам «ОКБ № 1» за помощью едут со всей страны! Торакальные хирурги провели сложнейшую операцию на трахее жительнице Свердловской области.
К врачам «ОКБ № 1» за помощью едут со всей страны! Торакальные хирурги провели сложнейшую операцию на трахее жительнице Свердловской области.

30 Марта 2018
Центр торакальной хирургии «Областной клинической больницы № 1» Тюменской области является одним из ведущих в Российской Федерации с широким спектром лечебных и диагностических хирургических вмешательств. Специалисты - торкальные хирурги Центра успешно оперируют пациентов с заболеваниями органов грудной клетки как «открытым» способом, так и «миниинвазивно» - с применением видеоторакоскопической техники.
В январе 2018 года за помощью к тюменским специалистам обратилась жительница Свердловской области по поводу ухудшения состояния своей матери на фоне трахеопищеводного свища. Восстановительные операции на трахее и пищеводе относятся к категории сложных вмешательств и только несколько клиник нашей страны владеют этой технологией. Специалисты «ОКБ № 1» и медицинской организации Свердловской области на онлайн консилиуме определили показания к хирургическому лечению и 80- летняя пациентка была оперативно доставлена в Тюмень.
Реконструктивную операцию с использованием современного эндоскопического оборудования выполнил Игорь Аркадьевич Бродер, торакальный хирург, заместитель главного врача «ОКБ № 1» по медицинской части. Во время операции необходимо тщательно, не повредив стенки, разделить трахею и пищевод, а затем восстановить их целостность. Важно для профилактики рецидива свища места пластики трахеи и пищевода укрепить мышечным лоскутом на сосудистой ножке. Также важно не допустить ранения сосудов, идентифицировать и сохранить возвратный нерв, обеспечивающий функционирование дыхательной системы, речевого аппарата и акта глотания. Кроме этого, важным является обеспечить стабильное состояние больного во время операции, учитывая возраст и сопутствующую патологию, организовать раннюю послеоперационную реабилитацию. Благодаря опыту многопрофильной бригады врачей операция прошла успешно!
«В декабре прошлого года, у мамы после трахеостомы ухудшилось состояние. Она не могла ни есть, ни дышать нормально. Человек просто тихонько умирал. Врачи нашей больницы подсказали обратиться в Тюмень. Я очень благодарна хирургам и всем врачам «ОКБ № 1» за то, что спасли мою маму, за внимание и отношение к ней!», - написала дочь.
«Трахеопищеводные свищи – это довольно редкая патология. Лечение их исключительно хирургическое, поскольку консервативная тактика абсолютно бесперспективна. Проведение реконструктивных операций на трахее и пищеводе возможно только в многопрофильной клинике, обладающей современным оборудованием, в составе которой есть опытная команда торакальных хирургов, анестезиологов-реаниматологов, диагностов. Именно такой клиникой является «Областная клиническая больница № 1», - рассказал Сергей Евгеньевич Ярцев, главный врач ГБУЗ ТО «ОКБ № 1».
Операция при трахеопищеводном свище
Методика и этапы операции при трахеопищеводном свище
а) Показания к операции при трахеопищеводном свище. Большинство приобретённых трахеопищеводных свищей возникает как пролежни, появляющиеся вследствие давления на стенку трахеи манжетки трахеостомической трубки. К более редким причинам относят закрытую и пенетрирующую травму, гранулематозные инфекции, инородные тела или осложнения от предыдущих операций на позвоночнике, шее и пищеводе.
Такие свищи редко закрываются сами по себе, а у адекватно подобранных больных оперативное лечение очень эффективно. Чтобы операция была успешной, больной должен быть «отлучён» от механической вентиляции лёгких, его гемодинамика должна быть стабильной, степень питания адекватной, а пищеводно-желудочный рефлюкс должен быть минимальным. При таких поражениях, расположенных на расстоянии не менее 3 см выше трахейной шпоры, применяют шейный доступ.
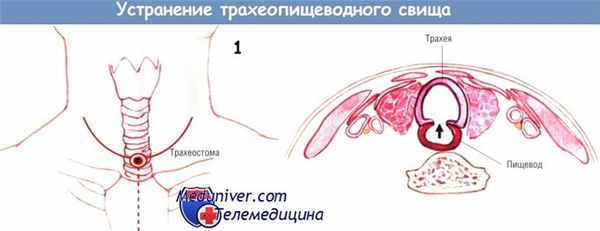
б) Техника и этапы операции устранения трахеопищеводного свища. Больного укладывают на спину с небольшим валиком под плечами, обеспечивающим гиперэкстензию шеи. Для определения высоты расположения фистулы проводят эзофагоскопию гибким аппаратом и бронхоскопию.
Первоначально выполняют поперечный криволинейный доступ, включающий трахеостому, заканчивающийся на 2 см выше вырезки грудины. Трахеостому иссекают вместе с эллиптическим участком кожи. Иногда необходимо расширить первоначальный разрез в виде буквы «Т», вертикальная линия которой спускается по средней линии над рукояткой грудины.
При необходимости такой разрез позволяет выполнить верхнюю парциальную стернотомию. Разрез углубляют через подкожную мышцу шеи, после чего отслаивают лоскуты: верхний — до щитовидного хряща, нижний — до грудины и ключицы. Грудино-ключично-сосцевидные мышцы оттягивают латерально, рассекают лопаточно-подъязычную и претрахеальные мышцы. Среднюю щитовидную вену и нижнюю щитовидную артерию перевязывают и пересекают. В результате достигают прекрасной экспозиции всех структур в операционном поле, позволяющей найти фистулу при перемещении этих структур.
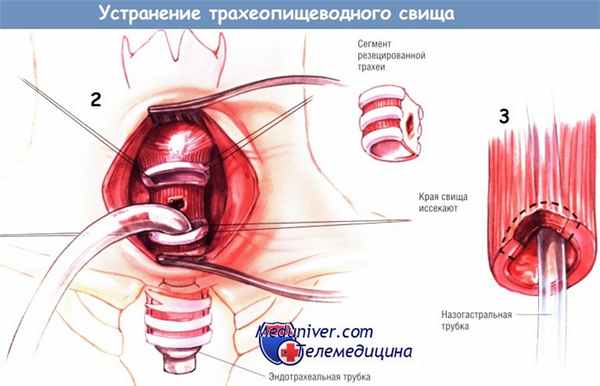
Возвратный гортанный нерв идентифицируют, но не выделяют. Нередко локальный воспалительный процесс мешает выявить локализацию свища и нерва. Однако он же помогает определить уровень свища. Необходимо выделить трахею по окружности. После того, как свищ найден, хирург выполняет резекцию короткого сегмента трахеи выше и ниже свищевого хода, чтобы обнажить дефект на пищеводе.
Не следует иссекать больше трёх колец трахеи. Изредка удаётся рассечь трахеопищеводный свищ и выполнить пластику дефектов обоих органов без резекции трахеи. Дистальную часть трахеи интубируют гибкой эндотрахеальной трубкой, проведённой через стерильное поле.
Проводят обработку краёв пищевода. Слизистую оболочку зашивают одиночными узловыми швами синтетической рассасывающейся нитью № 3/0, а мышечный слой — отдельными ламберовскими швами шёлком № 3/0. Трахею реанастомозируют «конец в конец» при помощи множества одиночных швов синтетическими монофиламентными нерассасывающимися нитями № 2/0, проводимыми сверху и снизу прилегающих колец трахеи.
Чтобы предупредить рецидив свища, между местами пластики трахеи и пищевода прокладывают лоскут из мышцы шеи на питающей сосудистой ножке, фиксируемый на месте шёлковыми нитями № 3/0. К месту пластики подводят малый дренаж Пенроуза, промывают полость шеи и послойно зашивают операционную рану.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Трахеопищеводный свищ ( Трахеоэзофагеальная фистула )
Трахеопищеводный свищ – это патологическое соустье, соединяющее просвет дыхательного горла с пищеводом. Может являться аномалией развития или приобретенной патологией. Трахеопищеводный свищ проявляется приступами кашля во время приема пищи, которые сопровождаются удушьем, цианозом, выделением пенистой мокроты с кусочками пищи. Часто развивается аспирационная пневмония. Подтверждающая диагностика проводится с помощью эндоскопических методов (эзофагоскопии, трахеобронхоскопии), рентгенографии пищевода. Лечение исключительно оперативное – закрытие трахеопищеводного свища, нередко с одномоментной трахеопластикой, циркулярной резекцией трахеи, эзофагопластикой.
МКБ-10
Общие сведения
Причины
Врожденный трахеопищеводный свищ образуется к 4-6-й неделе эмбриогенеза при неполном разделении первичной кишки и дыхательной трубки. При рождении дети с данной аномалией обычно имеют массу тела менее 2500 г.
Природа происхождения приобретенных трахеоэзофагеальных фистул может быть различной. Чаще всего с такой патологией приходится сталкиваться онкологам, а сами свищи возникают в результате далеко зашедшего рака пищевода или трахеи, лимфом, лимфогранулематоза. Второй по распространенности причиной служат травмы пищеварительной и дыхательной трубки (в том числе их ятрогенные повреждения), полученные при проведении эзофагоскопии, бужировании пищевода, перфорации пищевода или трахеи инородными телами, вследствие химических ожогов пищевода, при закрытых и проникающих ранениях шеи и груди. Возможно непреднамеренное повреждение трахеи и пищевода при операционных вмешательствах в этой области.
В анестезиолого-реанимационной практике отмечены случаи образования пролежней от трахеостомической или интубационной трубки, приводящие к формированию трахеопищеводного свища. К числу редких причин относят перфорацию дивертикула пищевода в трахею. Трахеопищеводный свищ может явиться осложнением неспецифической бактериальной инфекции (эмпиемы плевры, абсцесса легкого, гнойного медиастинита) или специфических воспалительных процессов (туберкулеза внутригрудных лимфатических узлов, сифилиса, актиномикоза).
Классификация
По своему происхождению трахеопищеводные свищи могут быть врожденными или приобретенными в процессе жизни. Различают 5 типов врожденных трахеопищеводных свищей, обозначаемых римскими знаками:
По наличию/отсутствию клапанного механизма трахеопищеводные свищи подразделяются на клапанные и бесклапанные. При единственном дефекте говорят об изолированном свище, при сочетании с другими патологическими процессами трахеи или пищевода – о сочетанном. Клиническое течение трахеопищеводных свищей может быть неосложненным, гладким или осложненным различными состояниями (аспирационной пневмонией, нутритивной недостаточностью и кахексией, бактериальной деструкцией легких, пневмогенным сепсисом и т. д.).
Симптомы трахеопищеводного свища
Клиническая картина, ее выраженность и особенности зависят от времени возникновения, размеров, типа, направления хода свища. Большинство детей с данной аномалией рождаются недоношенными, а доношенные новорожденные имеют признаки внутриутробной гипотрофии. Во время гестации у беременных отмечается многоводие.
Признаки врожденного трахеопищеводного свища с атрезией пищевода появляются уже через несколько часов после рождения. Возникает кашель, приступы удушья, вздутие живота. Во время первого же кормления диагноз становится очевиден. Каждый глоток молока или воды сопровождается приступом кашля, выделением пенистой слизи из носа и рта ребенка. Дыхание затрудняется, развивается резкий цианоз и аритмия, в легких выслушиваются обильные крупнопузырчатые хрипы. Рано присоединяется аспирационная пневмония и ателектазы легких. Состояние ребенка прогрессивно ухудшается.
Наиболее выражены перечисленные признаки при широком и коротком трахеопищеводном свище. При наличии узкого и длинного свищевого хода аномалия долгое время нередко остается нераспознанной. Изредка при кормлении возникает поперхивание и несильный кашель, однако изменение позы кормления избавляет ребенка от приступов, поэтому родители не придает этому факту должного значения. Такие дети страдают частыми пневмониями.
У 40% новорожденных с трахеопищеводным свищом выявляются сопутствующие врожденные пороки сердца, аномалии развития кишечника и мочевыводящих путей. В литературе описан синдром VATER, включающий в себя аномалии развития позвоночника (клиновидные позвонки), атрезию заднего прохода, трахеопищеводный свищ, гипоплазию лучевой кости и дисплазию почек.
Приобретенный трахеопищеводный свищ манифестирует кашлем, удушьем, цианозом, связанными с приемом пищи. В откашливаемом секрете можно обнаружить кусочки еды. При клапанной трахеоэзофагеальной фистуле кашель может отсутствовать. Нередко у больных отмечаются боли в груди и эпигастрии, кровохарканье, рвота с примесью крови, одышка, нарушение фонации, снижение массы тела. Во всех случаях трахеопищеводный свищ сопровождается периодическими подъемами температуры, рецидивирующими легочными инфекциями.
Диагностика
При подозрении на трахеопищеводный свищ пациент нуждается в консультации торакального хирурга, гастроэнтеролога, детского хирурга, эндоскописта, рентгенолога. На первичном этапе используется зондирования пищевода с помощью резинового катетера: если продвижению катетера мешает сопротивление слепого конца пищевода, а при введении в катетер жидкости, окрашенной метиленовым синим, она при кашле выделяется через рот или нос, вероятность трахеопищеводного свища оценивается как очень высокая.
Лучевое исследование включает выполнение рентгеноскопии и рентгенографии легких, эзофагографии, МСКТ грудной клетки. Контрастное исследование пищевода проводят очень осторожно, используя водорастворимые или масляные вещества, которые вводятся через зонд (применение сульфата бария в этих случаях недопустимо). Трахеопищеводный свищ требует проведения тщательной дифференциальной диагностики с изолированной атрезией и стенозом пищевода, гастроэзофагеальным рефлюксом, ахалазией кардии, дисфагией различного генеза.
Эндоскопическая диагностика трахеопищеводного свища остается основной. Для лучшей визуализации патологического соустья и получения максимальной информации о его особенностях, выполняется эзофагоскопия и трахеобронхоскопия. При критическом стенозе трахеи диагностическая трахеоскопия может быть трансформирована в лечебную процедуру путем эндоскопического восстановления просвета трахеи или стентирования стенозированного участка.
Лечение трахеопищеводного свища
Лечение проводится хирургическим путем, консервативная терапия малоперспективна и используется только на этапе подготовки к оперативному вмешательству. С целью удаления скапливающегося секрета производится установка катетера в слепо заканчивающийся конец пищевода, выполняются санационные бронхоскопии. В рамках лечения аспирационной пневмонии назначается оксигенотерапия, антибактериальная и инфузионная терапия, УВЧ на грудную клетку. Для предотвращения попадания пищи в трахеобронхиальное дерево полностью прекращается кормление через рот, осуществляется гастростомия, нутритивная поддержка, витаминотерапия.
Варианты радикального хирургического устранения трахеопищеводного свища могут быть различны. Операция обычно производится из шейного доступа или заднебоковой торакотомии. Длинный свищевой ход выделяют и пересекают между двумя наложенными лигатурами. Дефекты в стенках пищевода и трахеи ушивают погружными швами. При коротком и широком свищевом ходе трахею отсекают от пищевода, после чего на оба дефекта накладывают непрерывный двухрядный шов. Для закрытия дефекта могут использоваться аутоткани (сальник или стенка желудка).
В тех случаях, когда трахеопищеводный свищ сочетается со стенозом трахеи либо атрезией пищевода, производится разобщение свища с одномоментной циркулярной резекцией или пластикой трахеи и/или одномоментной пластикой пищевода. Если имеется большой диастаз между проксимальным и дистальным сегментами пищевода, не позволяющий наложить анастомоз «конец-в конец», верхний отдел пищевода выводят на шею, свищ разобщают и на этом операцию заканчивают.
В межоперационный период питание больного осуществляют через гастростому. На втором этапе производят пластику пищевода желудочным или тонкокишечным трансплантатом. При трахеопищеводных свищах, обусловленных распадом раковой опухоли, ограничиваются паллиативной гастростомией. В послеоперационном периоде продолжается активная противопневмоническая терапия. В первые сутки осуществляется парентеральное питание, затем – кормление через зонд, который оставляют на 7-10 суток.
Прогноз
Из послеоперационных осложнений возможны стенозы в области пищеводных анастомозов, которые подлежат бужированию, и рецидивы свища, требующие повторной операции. Летальность при оперативном лечении трахеопищеводного свища составляет 10-15% и связана, главным образом, с исходно тяжелым состоянием пациента. В то же время при отказе от операции показатели летальности возрастают до 80-90%.
Операция при трахеопищеводном свище
Атрезия пищевода относится к тяжелым порокам развития. Эта патология часто сочетается с другими пороками: врожденными пороками сердца, желудочно-кишечного тракта, мочеполовой системы и другими. В данной статье приводится результат опыта лечения 123 новорожденных с атрезией пищевода. Атрезия пищевода с нижним трахеопищеводным свищом диагностирована у 109 детей (88,6 %), атрезия с нижним и верхним свищами-3 (2,4 %), бессвищевая форма атрезии выявлена у 11 (9 %). В 42 наблюдениях атрезия пищевода сочеталась с другими пороками. Хирургическое вмешательство выполнено у 115 новорожденных (93,5 %). Всем детям проводилась сопутствующая поддерживающая терапия. 8 детей умерло от тяжелой сопутствующей патологии без оперативного лечения. Из числа оперированных новорожденных умерло 12 детей (9,8 %).
2. Атлас детской оперативной детской хирургии под редакцией П. Пури, М. Говарта. Пер. проф. Т.К. Немиловой. – Москва: МЕДпресс-информ, 2009. – С.43-62.
3. Детская хирургия. Учебник под редакцией Ю.Ф. Исакова, А.Ю. Разумовского. –Москва: ГЭОТАР-Медиа, 2014. – С.216-221.
4. Пренатальная эхография / под редакцией М.В. Медведева. Реальное время. – Москва, 2005. – С.439-442.
5. Разумовский А.Ю., Мокрушина О.Г., Ханвердиев Р.А. Торакоскопическая коррекция атрезии пищевода и трахеопищеводного свища из внеплеврального доступа // Детская хирургия. – 2011. – № 2. – С. 4-6.
6. Разумовский А.Ю., Мокрушина О.Г., Ханвердиев Р.А. и др. Эволюция метода торакоскопической коррекции атрезии пищевода у новорожденных // Российский вестник детской хирургии, анестезиологии и реаниматологии. – 2012. – № 1. – С. 92-98.
7. Фокер Дж., Козлов Ю.А. Процедура Foker – стратегия индукции роста пищевода путем его вытяжения. // Российский вестник детской хирургии, анестезиологии и реаниматологии. – 2016. – № 1. – С. 51-57.
Атрезия пищевода относится к тяжелым порокам развития. Эта патология часто сочетается с другими пороками: врожденными пороками сердца, желудочно-кишечного тракта, мочеполовой системы и другими. Атрезия пищевода входит в ассоциации VATER, VACTER и VACTERL. Ассоциации образованы из первых букв соответствующих английских терминов (Vertebraldefects, Analatresia, Tracheoesophagealfistula, Esophagealatresia, Rendysplasy, Radialdysplasy, Cardiacmalformations, Limbanomalies – врожденные пороки развития позвонков, атрезия ануса, трахеопищеводный свищ, или атрезия пищевода, пороки развития почек или дефекты лучевой кости, пороки сердца, аномалии конечностей). Если у новорожденного диагностирована одна из перечисленных аномалий, входящая в названные ассоциации, следует искать и другие пороки [3].
Несмотря на то, что благодаря совершенствованию оперативной техники и внедрению новых технологий достигнуты определенные успехи в лечении атрезии пищевода [5, 6], хирургическое лечение новорожденных с данным пороком по-прежнему остается сложной задачей [2,4]. Летальность при атрезии пищевода даже при оптимальной организации перинатальной помощи остается около 10 %, а при сочетании с другими аномалиями, особенно при пороках сердца, летальность может быть значительно выше [1].
Цель исследования – проведение анализа результатов лечения новорожденных с атрезией пищевода.
Материалы и методы исследования
В исследование были включены новорожденные с атрезией пищевода и сопутствующей патологией (123 ребенка), находившиеся на лечении в ГБУЗ СО ДГКБ № 1 им. Н.Н. Ивановой за период с 1996 по 2015 год.
В программу исследования входило: анализ пренатальной диагностики порока, первичный осмотр детей в родильном доме, клиническое исследование в специализированном лечебно-профилактическом учреждении, диагностика атрезии пищевода и сопутствующей патологии, определение длительности и качества предоперационной подготовки, определение объема оперативного вмешательства при коррекции порока, оценка результатов лечения, в том числе и отдаленных. В работе использовались клинические, рентгенологические, эндоскопические, ультразвуковые и лабораторные методы исследования.
Результаты исследования и их обсуждения
Все новорожденные с атрезией пищевода (123) поступали в отделение реанимации новорожденных ДГКБ № 1 им. Н.Н. Ивановой г. Самары из родильных домов и родильных отделений города и области в сроки от нескольких часов после рождения до 3-х суток. Следует отметить, что в Самарской области хирургическая помощь новорожденным с врожденной и приобретенной патологией оказывается только в этом лечебно-профилактическом учреждении.
По данным М.В. Медведева (2005), пренатальная диагностика атрезии пищевода основывается на таких косвенных признаках, как многоводие, связанное со снижением оборота околоплодных вод вследствие непроходимости пищевода, отсутствие эхографического изображения желудка или микрогастрия. При этом чувствительность эхографии в диагностике этого порока не превышает 40–50 %. В наших наблюдениях вышеназванные признаки атрезии пищевода выявлены пренатально лишь в 40 % при скрининговом обследовании беременных, родивших детей с атрезией пищевода. При выявлении пренатально косвенных признаков атрезии пищевода у плодов родоразрешение беременных, проживающих в г. Самаре и Самарской области, проводилось только в родильных домах г. Самары, что способствовало сокращению времени транспортировки новорожденных с атрезией пищевода в специализированное ЛПУ (ДГКБ № 1 им. Н.Н. Ивановой г. Самары).
При выявлении в родильном доме в первые часы после рождения ребенка признаков атрезии пищевода (появление обильных пенистых выделений изо рта и носовых ходов) проводилась аспирация содержимого рото- и носоглотки, которая повторялась каждые 15–20 минут, полностью исключалось кормление через рот, начиналась оксигенотерапия. Транспортировка новорожденного с атрезией пищевода в ДГКБ № 1 им. Н.Н. Ивановой г. Самары осуществлялась реаниматологом-неонатологом специализированным автотранспортом. Дети транспортировались в кювезе, во время транспортировки проводилась аспирация слизи из рото- и носоглотки.
Новорожденных доставляли в отделение реанимации новорожденных, где наряду с диагностическими методами, направленными на подтверждение диагноза атрезии пищевода и выявление сопутствующих пороков, начиналась предоперационная подготовка.
Для уточнения диагноза атрезии пищевода проводилась катетеризация пищевода рентгенконтрастным катетером с закругленным концом (уретральным катетером). Катетер вводили через нос на глубину до 8 см. Катетер или упирался в слепой конец пищевода или выходил через рот новорожденного. Через катетер отсасывали слизь, а затем проводили пробу Элефанта (при введении воздуха в слепой конец пищевода из носоглотки с шумом выделяется воздух). В некоторых наблюдениях выполнялась эзофагография с водорастворимым контрастом, который вводился в слепой конец пищевода в количестве не более 1 мл.
Атрезия с нижним трахеопищеводным свищом диагностирована в 112 (91 %) наблюдениях, бессвищевая форма – в 11 (9 %).
Из сопутствующих аномалий развития у 18 (14,6 %) новорожденных диагностирована атрезия двенадцатиперстной кишки, у 12 (9,8 %) – врожденные пороки сердца, у 12 (9,8 %) – атрезия прямой кишки, у 13 (10,6 %) – патология мочевыводящей системы. В 9 (7,3 %) наблюдениях диагностирован синдром Дауна.
Предоперационная подготовка проводилась длительностью от одних до четырех суток в зависимости от состояния ребенка, сроков поступления, наличия сопутствующей патологии. Ребенок обязательно помещался в кювез. В предоперационном периоде выполнялась аспирация слизи изо рта и носа ребенка, оксигенотерапия. При имеющемся нарушении дыхания, пневмонии, ателектазах, вызванных аспирацией слизи, проводилась ларингоскопия для санации дыхательных путей. Если предпринятые меры оказывались неэффективными, обязательным являлось выполнение бронхоскопии с тщательной аспирацией содержимого трахеи и бронхов. При состояниях, требующих респираторной поддержки, проводилась интубация трахеи и искусственная вентиляция легких. При этом эндотрахеальную трубку проводили ниже трахеопищеводного свища, что позволяло избежать такого тяжелого осложнения, как разрыв желудка за счет инсуффляции воздуха в желудок.
Всем детям назначалась инфузионная, антибактериальная и симптоматическая терапия.
Из 123 новорожденных с атрезией пищевода оперативное вмешательство выполнено у 115 пациентов. 8 неоперированных детей умерли в связи с наличием у них тяжелой сопутствующей патологии.
Метод хирургической коррекции атрезии пищевода зависел от формы порока. У пациентов с наиболее частой формой атрезии, при которой имелся дистальный трахеопищеводный свищ, с диастазом между отрезками пищевода не более 2,5 см, ликвидировался свищ и накладывался прямой анастомоз.
При большом диастазе прямой анастомоз наложить сложно. Для осуществления этой цели используются такие хирургические подходы, как циркулярная или спиральная миотомия, расширение отверстия в диафрагме и перемещение части желудка в грудную клетку. Кроме того, в настоящее время появились работы, в которых описывается опыт применения процедуры Фокера, индуцирующей рост пищевода путем вытяжения отрезков пищевода [7]. Но все же чаще всего при большом диастазе между отрезками пищевода накладывается шейная эзофагостома и гастростома. При бессвищевой форме порока, сопровождающейся большим диастазом, также первым этапом выполняется наложение шейной эзофагостомы и гастростомы [3, 5].
В наших наблюдениях прямой анастомоз наложен у 112 пациентов с атрезией пищевода при наличии нижнего трахеопищеводного свища. При этом у двух новорожденных при диастазе между отрезками пищевода от 2,5 до 3,5 см использовано удлинение проксимального отрезка пищевода в виде циркулярной миотомии по Livaditis [2].
Перед операцией проводилась периоперационная антибиотикопрофилактика. Оперативное вмешательство выполнялось под интубационным наркозом с вентиляцией мануально низким давлением на вдохе и небольшими объемами. Это позволяло избежать гипервентиляции, раздувания желудка, а также способствовало стабилизации трахеи. Для облегчения поиска хирургом верхнего отрезка пищевода в последний обязательно вводился зонд. Доступ – правосторонняя экстраплевральная торакотомия. Полунепарная вена по возможности не пересекалась. Выделение отрезков пищевода проводилось тщательно, чтобы избегать даже малейшей травмы его стенки и сохранить все волокна блуждающего нерва, сопровождающие нижний сегмент пищевода. После отведения трахеи обнаруживался трахеопищеводный свищ. После наложения швов-держалок на трахеальный и эзофагеальный концы свища свищ отсекался от трахеи, и дефект трахеи ушивался отдельными швами в один ряд мононитью 6/0. На верхний сегмент пищевода накладывалось два тракционных шва, служащих для облегчения его мобилизации. Далее трахея отделялась от пищевода. После мобилизации верхнего отрезка пищевода сегменты органа сближались и накладывался анастомоз конец-в-конец. Наложению анастомоза предшествовало рассечение верхушки верхнего отрезка точно над концом продвинутого в сегмент зонда. Анастомоз формировался отдельными рассасывающимися швами мононитью 6/0. Во всех наблюдениях проводился назогастральный зонд и выполнялось дренирование средостения.
У двух детей с большим диастазом сегментов, как уже было сказано, применена циркулярная миотомия по Livaditis, которая позволила удлинить проксимальный отрезок пищевода и наложить анастомоз конец-в-конец.
После операции продолжалась интенсивная терапия. При благоприятном течении послеоперационного периода кормление через зонд начиналось через 3–5 суток после операции. На 8–9 сутки проводилась эзофагография с целью определения состоятельности анастомоза. Для этого под контролем рентгеновского экрана через рот ребенку вводилось 1–2 мл водорастворимого контрастного вещества. Оценивалась проходимость анастомоза пищевода, исключались затеки контрастного вещества в средостение. При отсутствии осложнений ребенок начинал кормиться через рот.
Несостоятельность анастомоза выявлена у 6 детей (4,9 %). Ранним диагностическим признаком несостоятельности анастомоза являлось появление слюны по плевральному дренажу. У 3 новорожденных несостоятельность была частичной. На фоне консервативной терапии на 16–20 день наступило заживление зоны несостоятельности, что было подтверждено рентгенконтрастным исследованием пищевода. В этой группе больных в последующем сформировались стенозы пищевода с явлениями дисфагии, что потребовало бужирования пищевода. В трех наблюдениях отмечена несостоятельность анастомоза, при которой пришлось накладывать верхнюю эзофагостому и гастростому.
У 26 детей в послеоперационном периоде отмечались явления дисфагии, обусловленные мобилизацией сегментов пищевода. При рентгенологическом и эндоскопическом исследованиях анастомоза не выявлено сужения зоны. На фоне проведенной консервативной терапии явления дисфагии полностью купировались.
7-ми новорожденным с бессвищевыми формами атрезии пищевода (из 11 детей с бессвищевыми формами 4 умерли без операции в связи с тяжелой сочетанной патологией) выполнены шейная эзофагостомия и гастростомия. Этим детям через 10–12 месяцев была произведена загрудинная эзофагопластика левой половиной толстой кишки на левой ободочной артерии. Трансплантат располагали в изоперистальтической позиции. Операция завершалась дренированием средостения. После операции дети получали интенсивную терапию в отделении реанимации. Дренаж из плевральной полости удалялся через 2–3 дня. Через 7–10 дней проводилось рентгенконтрастное исследование для исключения несостоятельности анастомозов, и при отсутствии осложнений назначалось кормление через гастростому. Гастростомическая трубка удалялась через 3 месяца. Один ребенок оперирован повторно в связи с выявлением избыточных петель трансплантата.
Данный вид пластики пищевода был выполнен и у 3 пациентов, которым были наложены эзофаго- и гастростома в связи с полной несостоятельностью пищеводного анастомоза.
После операции по поводу атрезии пищевода умерло 12 детей. Следует отметить, что у всех умерших новорожденных отмечались сочетанные аномалии.
Таким образом, летальность составила 9,8 %. Стенозы пищевода, потребовавшие длительного бужирования, выявлены у 11 пациентов.
Атрезия пищевода
Атрезия пищевода – неполное формирование пищевода, часто ассоциированное с трахео-пищеводным свищем. Диагноз подозревается при невозможности постановки назогастрального или орогастрального зонда. Лечение подразумевает проведение восстановительной операции.
Атрезия пищевода – наиболее распространенная желудочно-кишечная атрезия. Частота составляет приблизительно 1 случай на 3500 живорожденных. Другие врожденные аномалии составляют до 50% случаев. Два синдрома специфически связаны с атрезией пищевода:
VACTERL (от англ Vertebral anomalies, Anal аtresia, Cardiovascular malformations, Tracheoesophageal fistula, Esophageal atresia, Renal anomalies, Radial aplasia, Limb anomalies – аномалии позвоночника, атрезия ануса, пороки сердца, трахеопищеводный свищ с атрезией пищевода, аномалии почек, гипоплазия лучевой кости, дефекты конечностей)
Симптомокомплекс CHARGE (от англ Coloboma – колобома, Heart defects – пороки сердца, Atresia of the choanae – атрезия хоан, Retardation of mental and/or physical development – задержка роста и развития, Genital hypoplasia – гипоплазия наружных половых органов, Ear abnormalities – аномалии ушей)
Приблизительно у 19% детей с атрезией пищевода наблюдаются симптомы VACTERL.
Выделяют 5 основных типов атрезии пищевода ( Типы и относительные частоты атрезии пищевода и трахеопищеводного свища Типы и относительные частоты атрезии пищевода и трахеопищеводного свища ). Большинство типов также ассоциировано со свищом между трахеей и пищеводом.
У большинства младенцев симптомы проявляются в неонатальном периоде, однако у детей с трахеопищеводной фистулой Н-типа симптомы могут проявляться значительно позже.
Характерными признаками избыточной секреции являются кашель и цианоз после попыток кормления, аспирационная пневмония. Эзофагальная атрезия с дистальным свищом приводит к вздутию живота, поскольку во время плача ребенка, воздух из трахеи нагнетается через фистулу в нижние отделы пищевода и желудка.
Типы и относительные частоты атрезии пищевода и трахеопищеводного свища
Относительные частоты основаны на компиляции из различных источников.
Диагностика атрезии пищевода
Постнатальная: установка назогастрального или орогастрального зонда и рентгенография
Рутинное пренатальное УЗИ может предположить наличие атрезии пищевода. Многоводие может присутствовать, но не является диагностическим признаком, поскольку может развиваться при многих других заболеваниях. Желудочный пузырь у плода может отсутствовать, но только в < 50% случаев. Реже встречается дилятированный верхний мешок пищевода, но обычно пободное характерно для плодов с многоводием и отсутствием желудочного пузыря.
После родов, при подозрении на атрезию пищевода, заподозренную при проведении пренатального ультразвукового исследования, или при наличии клинических показаний, вводится назогастральный или орогастральный зонд; на диагноз атрезии пищевода наталкивает невозможность продвижения зонда в желудок. Рентгеноконтрастный катетер определяет местоположение атрезии на рентгеновском снимке. В атипичных случаях небольшое количество водорастворимого контрастного вещества может быть необходимо для определения анатомии при рентгеноскопии. Контрастное вещество должно быть быстро аспирировано обратно, поскольку может вызвать химический пневмонит при попадании в легкие. Эту процедуру должен выполнять только опытный рентгенолог в центре, где новорожденному будет проведена операция.
Лечение атрезии пищевода
Цель предоперационного ведения – привести младенца в оптимальное состояние для операции и предотвратить аспирационную пневмонию, которая делает хирургическую коррекцию более опасной. Отказ от перорального кормления. Непрерывное отсасывание через назогастральный зонд из верхнего отдела пищевода предотвращает аспирацию проглоченной слюны. Ребенок должен находиться с приподнятой на 30–40 ° головой и на правом боку для облегчения опорожнения желудка и минимизации риска аспирации желудочного секрета через свищ. Если окончательная коррекция откладывается из-за глубокой недоношенности, аспирационной пневмонии или других врожденных пороков развития, то для декомпрессии желудка проводят наложение гастростомической трубки. Кормление через гастростому уменьшает риск заброса содержимого желудка через фистулу в трахео-бронхиальное дерево.
Восстановительная операция
При стабильном состоянии ребенка возможно проведение экстраплевральной хирургической коррекции атрезии пищевода и закрытие трахео-пищеводного свища. Замеченный свищ нуждается в лигировании. В приблизительно 90% случаев может быть выполнен первичный анастомоз пищевода. В оставшихся случаях, при существовании чрезвычайно длинного разрыва, существуют варианты выполнения операции по транспозиции желудка или толстокишечной интерпозиции.
Некоторые детские хирурги выполняют операцию по Фокеру. При этой операции вытяжные швы расположены на концах пищеводных мешков, выведенных чрескожно, и зафиксированных силиконовыми кнопками. Вытяжение постепенно воздействует на швы, что стимулирует удлинение пищевода от 1 до 2 мм/день. После того, как концы пищевода сходятся или максимально сближаются, выполняется первичный анастомоз ( 1 Справочные материалы по лечению Атрезия пищевода – неполное формирование пищевода, часто ассоциированное с трахео-пищеводным свищем. Диагноз подозревается при невозможности постановки назогастрального или орогастрального зонда. Прочитайте дополнительные сведения Наиболее распространенные острые осложнения – подтекание в месте анастомоза и формирование стриктуры. Сложности с кормлением после успешного хирургического вмешательства в 85% случаев возникают из-за плохой подвижности дистального сегмента пищевода. Этот дефект обусловливает желудочно-пищеводный рефлюкс примерно у 50% детей. Всем новорожденным с атрезией пищевода рекомендуется: лечение рефлюкса кислотно-супрессивной терапией Медикаментозное лечение Гастроэзофагеальный рефлюкс - это перемещение желудочного содержимого в пищевод. Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) - это рефлюкс, который вызывает осложнения, такие как раздражительность. Прочитайте дополнительные сведения ( 2 Справочные материалы по лечению Атрезия пищевода – неполное формирование пищевода, часто ассоциированное с трахео-пищеводным свищем. Диагноз подозревается при невозможности постановки назогастрального или орогастрального зонда. Прочитайте дополнительные сведенияСправочные материалы по лечению
1. Shieh HF, Jennings RW: Long-gap esophageal atresia. Semin Pediatr Surg 26(2):72–77, 2017. doi: 10.1053/j.sempedsurg.2017.02.009
2. Krishnan U, Mousa H, Dall’Oglio L, et al: ESPGHAN-NASPGHAN guidelines for the evaluation and treatment of gastrointestinal and nutritional complications in children with esophageal atresia-tracheoesophageal fistula. J Pediatr Gastroenterol Nutr 63(5):550–570, 2016. doi: 10.1097/MPG.0000000000001401
Основные положения
Выделяют 5 видов атрезии пищевода; все из них, кроме одного, сопровождаются трахео-пищеводным свищом.
Иногда диагноз предполагают на основании данных пренатального УЗИ.
Клинические проявления включают избыточную секрецию, кашель и цианоз после попыток кормления и аспирационную пневмонию.
Диагностику проводят с помощью назогастрального или орогастрального зонда.
Лечится проводится путём хирургического вмешательства или кислотоподавляющей терапии.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Читайте также:
