Осложнения пункции артерий. Секция артерий
Добавил пользователь Skiper Обновлено: 27.01.2026
Матчин Ю.Г., Басинкевич А.Б., Орлова Я.А., Кузьмина А.Е., Агеев Ф.Т.
НИИ кардиологии им. А.Л. Мясникова ФГУ РКНПК Минздравсоцразвития России
Количество выполняемых инвазивных исследований сердца и сосудов в мире постоянно растет. За последние 10 лет общее количество коронароангиографий (КАГ) в Европе увеличилось в 3 раза [1]. Общее количество КАГ в России значительно меньше по сравнению со средне - европейскими и среднемировыми данными [2]. Это в значительной степени обусловлено отсутствием материально-технической базы и ангиографических установок во многих лечебных учреждениях, имеющих кардиологические и инфарктные отделения, а также длинные листы ожидания для проведения КАГ в специализированных кардиологических клиниках.
В последнее время в связи с усовершенствованием катетерных технологий, введением в клиническую практику методики проведения КАГ через лучевой артериальный доступ [3] стало возможным проведение диагностической КАГ в амбулаторных условиях. Это может позволить значительно расширить количество выполненных КАГ и более полноценно использовать имеющиеся ангиографические установки, а также снизить стоимость исследования.
Целью нашего исследования было оценка возможности и безопасности проведения КАГ в амбулаторных условиях.
Материал и методы.
В исследование было включено 133 больных, которым с апреля 2004 г. по август 2007 г. на базе поликлиники научно-диспансерного отдела Института клинической кардиологии им. А.Л. Мясникова амбулаторно проводилась КАГ. В группу сравнения вошли 187 больных, которым КАГ проводилась в стационарных условиях в рамках программы по краткосрочной госпитализации РКНПК. Клиническая характеристика больных представлена в таблице 1. В группу амбулаторной КАГ вошли 110 (83%) мужчин, в группу контроля- 149 (79%). Средний возраст больных в группе амбулаторной КАГ был достоверно меньше, составив 53±1,9 года по сравнению с 58,8±10 годами в группе стационарной КАГ (p<0,0001). Распределение основных факторов риска ИБС было одинаковым по группам. Основными показаниями к проведению КАГ в обеих группах были наличие положительного результата при проведении пробы с дозированной физической нагрузкой и наличие болей в грудной клетке по типу типичной или вероятной стенокардии (табл. 1).
Определение показаний для выполнения КАГ проводилось врачами-кардиологами поликлиники после клинического осмотра и проведения в амбулаторных условиях стандартного обследования, включавшего ЭКГ, пробы с дозированной физической нагрузкой или холтеровское мониторирование ЭКГ, ЭХОКГ, ультразвуковое исследование лучевых артерий и подключичных сегментов с обеих сторон, клиническое и биохимическое исследования крови. Из исследования исключались больные с явлениями выраженной сердечной недостаточности (фракция выброса левого желудочка по данным ЭХОКГ менее 40%), нестабильной стенокардией, со сложными нарушениями ритма и проводимости сердца. Всем больным для оценки степени развития коллатерального кровообращения между лучевой и локтевой артериями проводилась проба Аллена [4] на обеих руках. Утром в день исследования больной осматривался лечащим врачом, перед переводом в ангиографическую лабораторию проводилась съемка ЭКГ, в левую руку устанавливался катетер для внутривенных вливаний.
КАГ проводилась в лаборатории рентгеноангиографии лучевым артериальным доступом. Исследование выполнялось специальными наборами для пункции лучевой артерии «Radial kit» фирмы Кордис, Джонсон и Джонсон (США). После местной анестезии 2-3 мл 1% раствора лидокаина проводилась пункция и катетеризация лучевой артерии, в нее устанавливался интродъюсер длиною 23 см. В интродъюсер для профилактики спазма лучевой артерии внутриартериально медленно вводилась смесь, состоящая из 3 мг изокета и 2,5 мг изоптина. Внутривенно вводился гепарин в дозе 5000 ЕД. КАГ проводилась катетерами 4 F фирмы Кордис Джонсон и Джонсон, (США). Стандартно для проведения левой КАГ использовался левый катетер Джадкинса. JL 3,5, для поведения правой КАГ стандартно использовался правый катетер Джадкинса JR5. После исследования накладывалась давящая повязка на 12-14 ч.
После окончания исследования больного на сидячей каталке переводили в палату наблюдения на базе поликлиники РКНПК, где в течение 2-4 ч проводился контроль клинического состояния, показателей гемодинамики, диуреза, давалось обильное питье. Больным сразу разрешалось ходить самостоятельно в пределах комнаты наблюдения.
На второй день утром больной приходил на прием к врачу поликлиники НКО где проводился клинический осмотр и оценка пульсации лучевой артерии.
Исследование было успешным у 130 (98%) больных в группе амбулаторной КАГ. У 3 (2%) больных в связи с безуспешной пункцией бедренной артерии процедура была завершена после перехода к альтернативному артериальному доступу: у 2 больных исследование проводилось после пункции левой лучевой артерии, у 1 больного исследование проводилось правым бедренным доступом. Осложнений у этих больных не было. В группе контроля исследование проводилось через бедренный доступ и было успешным у всех больных. При проведении КАГ в амбулаторных условиях серьезных осложнений у наших больных не наблюдалось. Окклюзия лучевой артерии на второй день после исследования наблюдалась у 3 (2%) больных и не сопровождалась значимыми клиническими проявлениями. У 2 (1,5%) больных во время пункции лучевой артерии наблюдалась ваготоническая реакция в виде урежения частоты сердечных сокращений менее 45 уд. в мин. и гипотонии (полностью были устранены после внутривенного введения атропина и в/венной инфузии физиологического раствора). Необходимости в госпитализации больных в связи с проведением исследования в амбулаторных условиях также не было. В группе амбулаторной КАГ общая продолжительность исследования было достоверно меньше по сравнению с группой контроля, составив 20,8 мин. против 22,2 мин (p=0,02), при этом среднее время флюороскопии было несколько выше в группе амбулаторной КАГ (4,3 мин против 3,8 мин., p=0,03) (табл. 2).
При анализе ангиограмм в группе больных с амбулаторной КАГ гемодинамически значимое поражение ствола левой коронарной артерии наблюдалось значительно реже по сравнению с группой стационарной КАГ (3% против 12%, p=0,007). Количество пораженных магистральных коронарных артерий было одинаковым в обеих группах (табл. 3). По результатам КАГ больным в группе амбулаторного исследования несколько чаще проводилось эндоваскулярное лечение коронарных артерий (35% против 25%, p=0,07). Частота проведения коронарного шунтирования и медикаментозного лечения в обеих группах достоверно не отличалась (рис.1).
При проведении диагностических и лечебных эндоваскулярных процедур через бедренный артериальный доступ в настоящее время применяются специальные закрывающие устройства, позволяющие активизировать больного через 1-2 часа после окончания процедуры и выписать из клиники в день проведения исследования 10. Однако, при их применении риск периферических осложнений выше чем при лучевом артериальном доступе, составляя около 2%. При этом увеличивается стоимость процедуры (особенно диагностических исследований).
Заключение: Проведение коронарографии в амбулаторных условиях через лучевой артериальный доступ является безопасной и эффективной методикой с низким риском осложнений у больных со стабильным течением ИБС без выраженных явлений сердечной недостаточности. Проведение коронарографии в амбулаторных условиях может снизить стоимость исследования за счет затрат, связанных с необходимостью госпитализации.
Осложнения пункции артерий. Секция артерий
Коронарография – инвазивный метод рентгенографической визуализации коронарных (венечных) артерий сердца (собственно, их просвета) после селективного интракоронарного введения рентгеноконтрастного вещества. Коронарография остается «золотым стандартом» в диагностике ИБС, так как на сегодняшний день это единственный из существующих методов исследований, позволяющий определить точные детали анатомического строения всего коронарного русла.
Показания к коронарографии
В большинстве случаев в нашей стране показания к проведению селективной коронарографии определяются кардиологами, непосредственно обследующими и курирующими пациентов. Кардиолог может порекомендовать вам коронарографию, если у вас:
• Симптомы ишемической болезни сердца, такие как боль в груди (стенокардия);
• Боль в груди, проводящаяся в челюсть, шею или руки, которые не могут быть объяснены другими причинами;
• Впервые возникшая или усиливавшаяся боль в сердце;
• Предстоящая операция на сердце.
Вам также может понадобиться коронарография, если вы собираетесь делать операцию, не связанную с сердцем, но имеется высокий риск наличия проблем с сердцем при операции.
В целом, коронарография применяется в трех клинических ситуациях:
• во-первых, чтобы установить наличие (если диагноз неточен, и ИБС нельзя исключить на основании данных неинвазивных методов исследований) ишемической болезни сердца и степень выраженности и распространенности обструкции коронарного кровотока (при установленном диагнозе ИБС);
• во-вторых, при выборе методов прямой реваскуляризации миокарда;
• в-третьих, для оценки результатов лечения (медикаментозного или оперативного, включая рентгеноэндоваскулярное), прогрессирования или регрессирования коронарного атеросклероза.
Противопоказания к коронарографии
Абсолютных противопоказаний к коронарографии нет. Относительные противопоказания к коронарографии: острая почечная недостаточность, хроническая почечная недостаточность, продолжающееся желудочно-кишечное кровотечение, лихорадка неясного генеза возможно инфекционного, нелеченный активный инфекционный процесс, острый инсульт, тяжелая форма анемии, злокачественная неконтролируемая артериальная гипертензия, выраженные электролитные нарушения, отсутствие контакта с пациентом в связи с психологическим состоянием или тяжелым заболеванием, тяжелая сопутствующая патология, при которой коронарография может осложнить течение заболевания, отказ пациента от необходимого дальнейшего лечения (коронарная ангиопластика, аорто-коронарное шунтирование, протезирование клапана), дигиталисная интоксикация, документированная анафилактическая реакция на контрастное вещество, тяжелые заболевания периферических сосудов, затрудняющие доступ в сосудистое русло, декомпенсированная застойная сердечная недостаточность или отек легких, тяжелая коагулопатия, эндокардит аортального клапана.
Следует учитывать, что большинство относительных противопоказаний к проведению коронарографии может носить временный или обратимый характер. Поэтому, если проведение коронарографии можно отсрочить, тем самым можно значительно уменьшить риск развития осложнений.
Возможные осложнения коронарографии
Несмотря на низкую частоту осложнений, коронарография является инвазивной манипуляцией, и ее проведение сопряжено с определенным риском. Суммарная частота осложнений, по данным ряда крупных исследований, составляет менее 2%. Основные осложнения, встречающиеся при проведении коронарографии, — это инфаркт миокарда (0,05%), цереброваскулярные осложнения (0,07%), нарушения ритма (0,38%), сосудистые осложнения (0,43%), летальный исход (0,11%), реакция на контрастное вещество (0,37%).
С учетом небольшого риска осложнений, как правило, перед исследованием проводиться ряд неинвазивных тестов, такие как ЭКГ (электрокардиография), эхокардиография и ЭКГ пробы с дозированной физической нагрузкой.
Как подготовиться к коронарографии
В некоторых случаях коронарография проводится в экстренном порядке. Чаще она запланирована заранее, давая вам время, чтобы подготовиться. Исследование проводится в рентген-операционной. Общие принципы включают в себя:
• Последний прием пищи вечером накануне ангиографии. Коронарографии часто запланирована в утренние часы.
• В месте установки катетера (паховая область или предплечье) должны быть выбриты волосы.
• В ночь перед исследование проводиться очищение кишечника.
• Спросите своего врача, следует ли вам принимать обычные лекарства утром.
• Если у вас сахарный диабет, спросите своего врача, следует ли Вам принимать инсулин или другие сахароснижающие пероральные препараты перед исследованием.
Как проводится коронарография
Перед процедурой устанавливается внутривенный доступ, налаживается мониторинг жизненно-важных функция (ЭКГ, измерения АД, частоты дыхания и насыщение крови кислородом), за 30 мин вводят седативное лекарственное средство. Для проведения процедуры, вы ложитесь на спину на рентгеновский стол. Рентгеновские камеры могут перемещаться над и вокруг вашей головой и грудной клеткой, снимать с разных позиций. Вы будете бодрствовать во время процедуры, так чтобы вы могли следовать инструкциям. На протяжении процедуры вам может быть предложено сделать глубокий вдох, задержать дыхание, повернуть голову. Область катетеризации обрабатывают и дезинфицируют, а затем вы почувствуете онемение в связи с введением местного анестетика. Для выполнения коронарографии применяются трансфеморальный доступ (через общую бедренную артерию ниже паховой складки) или трансрадиальный доступ (через лучевую артерию предплечья).
После пункции артерии через иглу проводится проводник, по которому проводится диагностический катетер, система доводится до восходящей аорты. Продвижение катетера не должно вызывать боль, и вы не будете чувствовать его перемещения. Скажите врачу, если у вас дискомфорт. Затем под контролем рентеноскопии и введений контрастного вещества приступают к селективной коронарографии. Введение контрастного вещества может сопровождаться кратковременным ощущением тепла или покраснение.
Рекомендации после процедуры коронарографии
После исследования катетер удаляется из паха или руки и накладывается тугая давящая повязка. Вас переводят в отделение и назначают постельный режим в положении на спине на несколько часов (в некоторых случаях до суток) с целью предупреждение кровотечения из места пункции. На место пункции накладывается холод, затем груз.
Пейте много жидкости, чтобы помочь вашему организму вывести контрастное вещество, вводимое во время исследования. Если вы проголодались, спросите лечащего врача, когда вы можете принять пищу. Уточните у врача время возобновления приема лекарственных препаратов, особенно если Вы принимаете сахароснижающие средства.
Наблюдение в стационаре от одного дня. После выписки избегайте напряженной деятельности и тяжелой физической работы несколько дней. Место пункции, скорее всего, останется напряженным на некоторое время. Оно может быть слегка припухлым иметь небольшие кровоподтеки.
Обратитесь к врачу, если:
— Вы заметили кровотечение, новые кровоподтеки или сильную припухлость в области пункции и установки катетера;
— Вы чувствуете нарастающую боль или дискомфорт в области пункции и установки катетера;
— В области пункции и установки катетера появилось покраснение и возникла лихорадка;
— Изменилась температура или цвет ноги / руки, через которую была проведена процедура;
— Вы чувствуете боль в груди или одышку.
Результаты коронарографии
Коронарография позволяет получить следующую информацию:
• анатомическое строение коронарных артерий и степень обструкции их просвета;
• локализация и анатомический вариант коронарных артерий;
• наличие и степень обструкции просвета коронарных артерий;
• точная локализация сужений, протяженность и диаметр просвета (неизмененный и в месте сужения) артерии;
• морфологический характер поражения;
• наличие и степень выраженности коллатеральных сосудов.
Источник:
Алекян Б.Г., Стаферов А.В., Закарян Н.В. В кн.: Бокерия Л.А., Голухова Е.З. (ред.) Клиническая кардиология: диагностика и лечение. М.: Издательство НЦССХ им. А.Н. Бакулева; 2011
Осложнения пункции артерий. Секция артерий
Осложнения пункции артерий. Секция артерий
Гематома. Практически всегда возникает небольшой синяк, но его проявление можно уменьшить, прижав артерию во время извлечения иглы в течение 4—5 минут (не меньше). Если соблюдать это правило, то гематома не образуется.
Тромбоз. При однократной пункции полная закупорка просвета артерии встречается крайне редко. Однако при нахождении канюли в артерии в 10% случаев на один-два дня исчезает пульсация артерии дистальнее места пункции. При достаточном развитии коллатерального кровообращения последствий не наблюдается.
При проведении манипуляций на крупных артериях осложнения могут быть более серьезными, поэтому, если есть возможность, желательно использовать лучевую артерию.
Воздушная эмболия артерий. Чаще всего возникает при мониторинге артериального давления прямым методом. Попавший в артериальную систему воздух быстро изгоняется из левого желудочка с закупоркой коронарных, мозговых и др. артерий, что иногда чревато развитием тяжелых неврологических поражений и внезапной смертью. Эти осложнения редко встречаются при проведении манипуляций на периферических артериях. Однако при промывании катетеров возможно попадание пузырьков воздуха из шприца.
Больного необходимо уложить головой вниз на левый бок, что уменьшает вероятность попадания воздуха в коронарные артерии. Проводят гипербарическую терапию и ингаляцию кислородом, что способствует уменьшению размера пузырьков воздуха.
Секция артерии
Ход манипуляции:
• Оперативным путем обнажается артерия.
• Артерия берется на 2 лигатуры.
• Периферический отдел пережимается марлевым или резиновым жгутом.
• Для предотвращения спазма артерии в нее вводится 10—15 мл 0,5 %-ного раствора новокаина.
• Пунктируется артерия.
• Фиксируют лигатурой иглу.

Кровь подогревается до температуры тела. Скорость подачи 100—150 мл/мин под давлением 200—250 мм рт. ст. Инфузия прекращается при быстром улучшении состояния больного и увеличении артериального систолического давления до 80— 90 мм рт. ст., что позволяет перейти к внутривенному доступу.
Катетеризация артерий
Данная манипуляция позволяет осуществлять непрерывный мониторинг частоты сердечных сокращений и артериального давления в отделениях реанимации, частый забор проб крови для определения ее газового состава. Внутриоперационный мониторинг проводят больным при высоком риске развития осложнений со стороны сердечно-сосудистой системы. По частоте использования некоторые авторы располагают артериальные доступы в следующем порядке:
• лучевой;
• бедренный;
• тыл стопы;
• подмышечный.
Эти же авторы предпочитают использовать лучевую артерию и артерии тыла стопы для катетеризации «быстрыми» катетерами или внутривенными ангиокатетерами, а бедренную и подмышечную артерии канюлировать по методике Сельдингера.
Для катетеризации рекомендуется использовать неконический тефлоновый катетер (размер 20). Маленький диаметр катетера способствует адекватной перфузии дистальных по отношению к месту введения участков. Введение конических катетеров чаще вызывает нарушение перфузии дистальных отделов. Использование катетеров большего диаметра часто ведет к такому осложнению, как образование тромбов.
Побледнение участков кожи в этих местах и отсроченное заполнение капилляров является показанием к удалению катетера. В ряде случаев для улучшения перфузии используют лекарственные препараты или прибегают к хирургическим методам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Пункционная биопсия почки
Данная манипуляция выполняется с применением местной анестезии, под контролем УЗД-наблюдения, в условиях стационара. Пункционная биопсия впервые была проведена в 1944 году, но в широкое использование вошла только в начале 60-х годов ХХ века. Пункционная биопсия почки является очень важной составляющей частью дифференциальной диагностики патологических изменений органа. Почти 45% нефрологических больных нуждаются в поведении данного исследования. Безопасность данного анализа зависит от учета противопоказаний, правильного отбора пациентов и последующего наблюдения.
Показания и противопоказания к пункционной биопсии почек
Современная медицина уже имеет достаточно внушительный багаж из опыта проведения пункционных биопсий. Существует четкое определение показаний и противопоказаний к данному исследованию. Основным принципом назначения данного исследования является неинформативность других лабораторных и инструментальных исследований. Показаниями к выполнению пункционной биопсии почек может быть определение наиболее рациональной терапии, а также важность исследования при протеинурии неясного происхождения для разделения ГН, при нефротическом синдроме, диабетической нефропатии, амилоидозе, пиелонефрите, интерстициальном нефрите, при гематурии неясного генеза (перед этим должен быть исключен урологический источник кровотечения — нефроптоз, новообразования, коагулопатии и др.). Также показана дифференциальная диагностика при синдроме Гудпасчера, различных диффузных пролиферативных гнойных нефритах, lga-нефропатии, наследственного нефрита и тубулопатии неясного генеза.
Показания
Проведение данного исследования также необходимо для оценки прогноза и определения тактики лечения при: выраженных склеротических модификациях в почечной ткани, при хроническом гнойном нефрите с ярко выраженной протеинурией (не меньше 2 раз в сутки), при быстропрогрессирующем нефрите, для оценки активности при волчаночном нефрите с умеренным мочевым синдромом, при начальных признаках почечной недостаточности (для исключения выраженных фибробластических патологий, для оценки активности, которые делают неэффективной иммунодепрессивную терапию), для определения уровня загруженности почечных клубочков во время амилоидоза.
При гнойных нефритах и амилоидозе рекомендован морфологический контроль за эффективностью лечения, для этой цели необходимо проведение повторной биопсии.
Противопоказания
Противопоказаниями к проведению биопсии почки являются: нарушения системы свертывания крови (тромбоцитопения, гипокоагуляция, лечение антикоагулянтами), узелковый перитонит, аневризма почечной артерии, тяжелая диастолическая гипертония, сердечная декомпенсация с повышением давления в большем круге кровообращения, туберкулез почки, новообразования (доброкачественные и злокачественные), гидро и пионефроз.
Абсолютным противопоказанием принято считать непереносимость анестетика, терминальную почечную недостаточность (креатинин крови свыше 0,88 ммоль/л), наличие у пациента единственной функциональной почки.
Техническим препятствием к проведению данной манипуляции может быть патологическая подвижность, опущение почки, тяжелый отечный синдром (массивный гидроторакс, анасарка), а также ожирение больного.
Подготовка к пункционной биопсии почки
Перед проведением данного исследования производится анализ лабораторных показателей крови, анализ крови на группу и резус фактор, особое внимание уделяется системе свертываемости (количество тромбоцитов, время свертываемости). Определяется физиологическое расположение почек, их функциональные способности и подвижность. Проводится учет всех противопоказаний относительно каждого конкретного пациента. Необходима коррекция анемии (Ht более 35%) и нормализация артериального давления.
Процедура пункционной биопсии почки
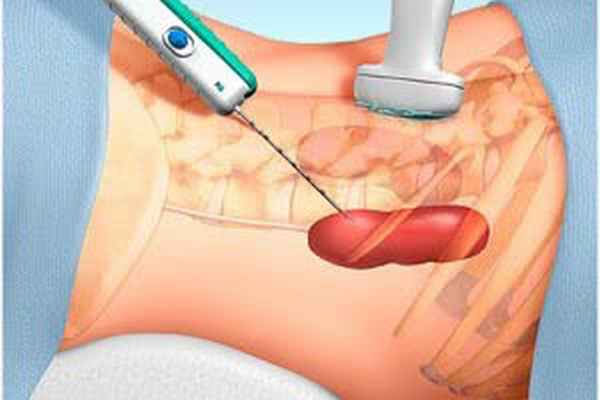
Как правило, правая почка расположена ниже, относительно левой, это делает её более доступной для биопсии. Если правая почка подвижна, целесообразным является проведение пункции левой почки. Для определения глубины и места биопсии используется расчет урограммы по Kark, на котором происходит измерение расстояния от нижнего края почки до осевой линии позвоночника и от нижнего края почки до края подвздошной кости.
Пациент укладывается на живот, на спине пациента отмечают три точки: линию, которая соединяет остистые отростки позвонков, нижний край седьмого ребра и гребень подвздошной кости, затем отмечают два размера (а и в). Для того чтобы установить глубину расположения нижнего края почки, используется поисковая игла. Поиск выполняется под местной анестезией после предварительной пробы на анестетик, как правило используют 0,25% раствор новокаина (50-70 мл). После определения ряда косвенных признаков (ощущение прокола почечной капсулы, связные с дыханием маятникообразные движения иглы, выделение крови из иглы), которые свидетельствуют об обнаружении почки, выполняют взятие биоптата. В процессе биопсии пациента просят задержать дыхание.
Осложнения пункционной биопсии почки
Как и при любых манипуляциях, связанных с взятием биологических образцов, пункционная биопсия почки также имеет риск развития осложнений. Самым распространенным осложнением данного исследования является кровотечение (в почку или мышцу), воспалительные процессы кожи, как следствие инфицирования, в месте введения иглы, травмирование крупных кровеносных сосудов, что может повлечь за собой кровотечение. Реже встречаются следующие осложнения: пневмоторакс (при аномальном расположении почек), разрыв нижнего полюса почки, артериальная внутрипочечная фистула, гнойный паранефрит (гнойное воспаление околопочечной жировой клетчатки), повреждение близлежащих органов (селезенки, печени, мочеточников, поджелудочной железы, двенадцатиперстной кишки, плевры и легких, нижней полой вены).
Частота возникновения нежелательных явлений равна около 0,4%, с внедрением УЗИ-контролируемых пункционных биопсий, риск осложнений значительно снизился.
Данная статья размещена исключительно с целью ознакомления в познавательных целях и не является научным материалом или профессиональным медицинским советом. За диагностикой и лечением обратитесь к врачу.
Осложнения пункции артерий. Секция артерий
Катетеризация центральных вен под контролем ультразвука. Современные рекомендации и директивы
По материалам статьи Julie A.Gayle, MD, Allan David Kaye, MD, PhD Ultrasound guided central veins cannulation. Anesthesiology News, June 2012 (5)
Julie A.Gayle, MD Старший преподаватель кафедры клинической анестезиологии медицинского факультета Государственного Университета штата Луизиана, Новый Орлеан, Луизиана
Allan David Kaye, MD, PhD Профессор, глава отделения анестезиологии медицинского факультета Государственного Университета штата Луизиана, Новый Орлеан, Луизиана
Оригинал статьи на английском языке
Данная статья не спонсирована никакими медицинскими компаниями.
Ультразвук в настоящее время все больше и больше входит в ежедневную практику в анестезиологии. Из большого количества его возможных применений следует выделить установку центральных венозных, артериальных и периферических катетеров, а также нервные блокады. До недавнего времени не существовало ни национальных, ни неких общепринятых стандартов относительно обучения постановке центрального венозного катетера (ЦВК) под контролем ультразвука. За последние годы сразу несколько обществ и ассоциаций, включая Американское Общество Анестезиологов (ASA), Американское Общество Эхокардиографии (ASE), Общество Кардиоваскулярных Анестезиологов (Society of Cardiovascular Anaesthesiologists) и Центры Контроля и Предотвращения Распространения Заболеваний (Centers for Disease Control and Prevention (CDC) опубликовали рекомендации по проведению катетеризации под контролем ультразвука.
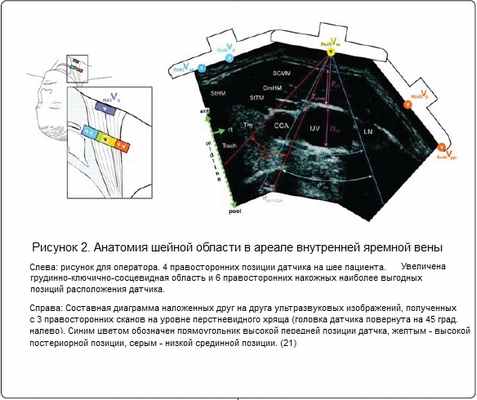
Катетеризация центральных вен позволяет клиницисту начать гемодинамический мониторинг, введение лекарственных препаратов, жидкостей и парентерального питания, введение периферических внутривенных устройств и проведение гемодиализа. Внутренняя яремная вена, подключичная и бедренная вены - наиболее часто катетеризируемые сосуды при выполнении сосудистого доступа. Многие анестезиологи для катетеризации выбирают внутреннюю яремную вену (IJV). Использованию внутренней яремной вены способствует возможность визуализации и пальпации определенных анатомических ориентиров. Дополнительные вспомогательные методики включают в себя использование иглы меньшего диаметра для локации IJV, а затем стандартной иглы для канюляции; применение предварительной ультразвуковой локации, во время которой врач помечает на теле пациента расположение вены перед пункцией, и, наконец, ультразвуковую навигацию в реальном времени, сопровождающую пункцию [1].
Согласно исследованиям [2], риск осложнений во время катетеризации центральных сосудов варьируется от 2 до 15%. Эти показатели во многом зависят от опытности медицинского персонала и общего состояния пациента [3,4]. Наиболее часто встречающиеся осложнения катетеризации – это пневматоракс (0-6.6%), прокол сонной артерии (6%), прокол подключичной артерии (0,5%-4%) и гематоракс (1%) [1]. Общий процент неудачных попыток катетеризации IJV составляет 12% [5].
Ранние работы в этой области показали, что использование ультразвука может снизить число травматических осложнений и повысить процент удачных попыток катетеризации [6]. Более современные публикации подтверждают, что применение ультразвуковой навигации во время установки ЦВК увеличивает процент успешных первых попыток катетеризации и снижает опасность повреждения близлежащих артерий [7].
В 2011 году Центр по контролю заболеваний (Center of Disease Control, CDC) рекомендовал применение ультразвуковой навигации при установке ЦВК для снижения количества попыток канюляции и механических осложнений. В продолжение тематики в публикации «Руководство по профилактике инфекционных осложнений, связанных с внутрисосудистым катетером» (Guidelines for the Prevention of Intravascular Catheter- Related Infections) Центр по контролю заболеваний (Center of Disease Control, CDC) постановил, что ультразвуковая навигация должна использоваться только теми клиницистами, которые прошли соответствующее обучение [12].
Статическая и динамическая визуализация
Статическая или непрямая ультразвуковая визуализация во время центрального венозного доступа дает оператору возможность определить точку вкола на коже перед стерильной обработкой места катетеризации. Она позволяет выявить и принять во внимание различия анатомических структур пациентов. По сравнению с традиционным слепым методом с анатомическими метками использование статической ультразвуковой визуализации для маркировки поверхности кожи перед канюляцией IJV увеличивает успешность проводимой процедуры [13]. Динамическая или прямая ультразвуковая визуализация в реальном времени во время установки ЦВК позволяет визаулизировать иглу при продвижении ее к искомому сосуду.
Динамическая или прямая ультразвуковая визуализация при проведении катетеризации дает возможность отслеживать продвижение иглы к искомому сосуду. В дополнение к тому, что ультразвуковая навигация более часто позволяет выполнить катетеризацию удачно с первой попытки, возможность наблюдать канюляцию IJV в реальном времени позволяет сократить время, требующееся для выполнения процедуры, частоту прокола близлежащих артерий и имеет более высокую долю успешных попыток 15.
Обучение
Доказательства явно свидетельствуют о том, что использование ультразвуковой навигации во время катетеризации центральных вен, в особенности, внутренней яремной вены (IJV) позволяет проводить ее более безопасно и успешно. Однако техника ультразвукового контроля требует прохождения определенного обучения. Обязательным является знание анатомии сосудов и окружающих тканей. Интерпретация двухмерных изображений сосудов и окружающих их структур, полученных на ультразвуковом аппарате, требует практики. Кроме того, намного больше практики требуется для выполнения катетеризации при одновременном отслеживании взаимного расположения датчика и иглы с тем, чтобы визуализация иглы была наиболее четкой.
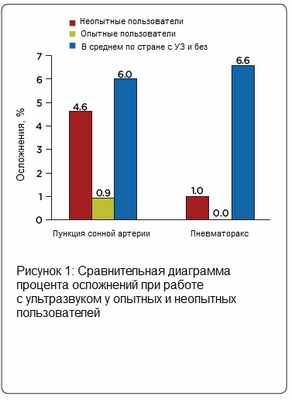
Несмотря на то, что медицинский персонал осваивает необходимые знания и навыки с разной скоростью, было предложено считать единицей контроля 10 выполненных под наблюдением профессионала ультразвуковых процедур [7]. Kaye et al предложил критическое количество установок ЦВК под ультразвуковым контролем для того, чтобы отличать опытного пользователя ультразвука от новичка. Авторы опытным путем определили, что анестезиологи, выполнившие, по меньшей мере, 20 катетеризаций с использованием ультразвуковой навигации, потенциально создавали существенно меньшее количество осложнений по сравнению с неопытными докторами (Рисунок 1) [1].
Обучение технике установки ЦВК с помощью фантомов зарекомендовало себя в качестве эффективного тренировочного инструмента для получения навыков катетеризации под контролем УЗИ. Результатом работы на фантомах является увеличение скорости нахождения искомых сосудов при использовании ультразвука, нежели чем при работе слепым методом; кроме того, даже неопытный персонал с помощью ультразвука достигает более высокого процента успешных попыток катетеризации при общем более высоком уровне безопасности проводимых манипуляций [17, 18]. Исследования, рассматривающие обучение с использованием симуляторов и последующие результаты проведенных с помощью ультразвука катетеризаций, выполненных обучившимися, позволяют признать предварительную работу на фантомах эффективным методом обучения медицинского персонала. Этот метод дает следующие результаты: значительно более высокая доля успешных канюляций с первой попытки, меньшее количество введений иглы, успешная установка катетера и меньше количество осложнений в виде пневматоракса [19, 20].
Выбор доступа
При выборе оптимального венозного доступа рекомендуется принимать во внимание риск возникновения катетерной туннельной инфекции, тромбоза, гематомы, пневматоракса и артимий. Для минимизации риска возникновения туннельной инфекции и тромбоза предпочтительнее устанавливать ЦВК во внутреннюю яремную вену, подключичную вену и другие доступы верхней части тела, нежели чем использовать бедренный доступ. Место пункции должно быть свободным от воспаления и иметь самый низкий потенциал заражения по сравнению с другими возможными доступами. При выборе доступа и места пункции следует обходить участки тела с близко расположенными ранами, ожогами, а также избегать попадания слюны, экскрементов и инфекции на место пункции.
Подключичный доступ имеет преимущества перед яремным доступом в случае длительного нахождения катетера в центральной вене и характеризуется наиболее низким процентом возникновения катетерной туннельной инфекции и тромбоза. Однако в отличие от катетеризации IJV под контролем ультразвука, пользующейся всеобъемлющей поддержкой как в публикациях, так и у пользователей, работа с ультразвуком при канюляции подключичной вены является более технологичной. Ключица затрудняет визуализацию сосуда, тем самым усложняя динамическую визуализацию канюляции. Тем не менее, для работы с пациентами, у которых затруднено распознавание поверхностных ориентиров (тучные больные, пациенты с послеоперационными и постлучевыми рубцовыми изменениями области шеи), применение статического ультразвука перед манипуляцией может упростить визуализацию сосуда и исключить наличие тромбоза [7].
Бедренная вена — доступ выбора в кардиологии, неотложной медицине и в других случаях, требующих осуществления краткосрочного доступа к сосуду. Ясные анатомические ориентиры, относительно быстрое проведение катетеризации и безопасность являются преимуществами при канюляции бедренной вены. Исследование области прокола перед пункцией позволяет уточнить расположение сосудов и окружающих структур. Однако данных в пользу того, что ультразвуковой контроль в реальном времени во время катетеризации бедренной вены позволяет улучшить или ускорить процесс катетеризации, недостаточно. Исследования свидетельствуют о том, что рутинное использование ультразвука во время процедуры не имеет влияния на ее проведение.7
Подтверждение положения катетера
Во избежание случайной дилатации артерии во время катетеризации необходимо подтвердить расположение проводника перед дилатацией сосуда. Ультразвуковая навигация в реальном времени — надежный способ определить местонахождение проводника (в вене или артерии) [22]. Использование ультразвука дает возможность избежать дилатации сонной артерии при попытке катетеризации IJV (Рисунок 2).
Визуализация проводника по длинной оси дает более четкое представление о его местоположении, чем поперечный срез (Рисунки 3, 4). Позиционирование ультразвукового датчика для получения наиболее четкого изображения центральной вены и проводника в ней занимает у большинства пользователей менее минуты, но является самым быстрым и наглядным подтверждением отсутствия опасности повреждения артерий во время процедуры [7]. Манометрия, трансэзофагеальная эхокардиография, трансдукция прямого давления, анализ газов крови, флуороскопия и электрокардиография могут также помочь подтвердить локализацию проводника в вене [23].
В случае если эти методы доступны в лечебном учреждении, они дают более определенное подтверждение расположения проводника. Однако они занимают существенно больше времени, за которое при ошибке катетеризации у пациента могут произойти негативные изменения. Для подтверждения расположения кончика катетера после проведения процедуры необходимо проводить радиографию или флуороскопию.
Попытка удаления катетера после непреднамеренной катетеризации артерии может привести к серьезным осложнениям, таким как инсульт, гематоракс и артериовенозная фистула. В такой ситуации катетер следует оставить на месте и получить немедленную консультацию общего или кардиохирирурга для оптимального удаления катетера [24].
Инфекционный контроль
В рекомендациях по предотвращению катетерассоциированных инфекций особое внимание уделяется обучению и тренингу медицинского персонала, устанавливающего ЦВК и следящего за состоянием катетера в вене и доступа в целом. Темы для обучения – асептические приемы, поддержание стерильности поля во время установки катетера, использование спиртового раствора хлоргексидина для дезинфекции места вкола, а также манипуляции с уже установленным катетером [12]. Для снижения риска инфицирования следует избегать рутинной установки ЦВК пациентам отделения, а ставить катетер только при наличии показаний. Рекомендуется первым делом оценить доступы, расположенные в верхней части тела, и только при невозможности их осуществления рассматривать возможность использования бедренного и других доступов, расположенных на нижних конечностях.
С целью минимизации риска инфекционных осложнений предпочтительнее выбирать подключичный доступ. По завершении процедуры установки катетера рекомендуется использовать био-окклюзивные повязки. Любые манипуляции с уже установленным катетером (извлечение и замена, обработка катетера) должны выполняться специально обученным медицинским персоналом [12]. В случае возникновения катетерассоциированной инфекции необходимо установить новый катетер в новый доступ. Производить замену катетера в том же доступе не рекомендуется [24]. Как только необходимость наличия катетера в вене исчезает, необходимо немедленно извлечь ЦВК. Согласно публикациям, использование ультразвуковой навигации во время катетеризации не приводит к инфицированию места установки катетера. Использование стерильных проводников и чехлов для датчиков дает возможность сохранить полную стерильность рабочего поля при установке ЦВК.
Стоимость внедрения методики, соотношение затраты-польза
Подавляющее большинство исследователей свидетельствуют о том, что применение ультразвуковой навигации во время катетеризации позволяет повысить безопасность пациента, улучшить клинический исход и увеличить скорость процедуры. Однако технология должна быть не только полезной, она также должна оправдывать затраты лечебного учреждения на ее внедрение и использование. Стандартная стоимость ультразвукового аппарата составляет от 20000 до 30000 долларов США в зависимости от количества датчиков. Таким образом, важно принимать во внимание затраты при использовании ультразвука для контроля установки ЦВК. Ультразвуковая навигация при катетеризации внутренней яремной вены всегда обеспечивает более высокий процент успешных канюляций, снижение частоты осложнений и неудачных попыток, а также уменьшение количества времени, затрачиваемого на процедуру [25]. Ориентировочная стоимость лечения пневматоракса, полученного больным во время установки ЦВК слепым методом с помощью меток, составляет 134 доллара США на одного пациента. На основе данных о количестве пневматораксов (1,5 на 100 пациентов) при использовании техники поверхностных ориентиров это осложнение приводит к расходам в диапазоне от 5 до 10 миллионов долларов США в год в государственных масштабах [26].
Снижение процента неудачных катетеризаций и количества попыток установки ЦВК повышают профессионализм и помогают продемонстрировать экономическую выгоду применения ультразвука. Более того, ультразвуковые исследования играют большую роль также и в других процедурах. Эта технология отлично зарекомендовала себя как средство контроля при выполнении регионарной анестезии и катетеризации артерий [27, 28]. Снижение расходов в результате применения методики возможно отследить путем регистрации снижения количества осложнений, повышения скорости выполнения процедур и профессионализма медицинского персонала, а также безопасности пациента.
Будущее технологии
В последнее время много обсуждается возможность потери медицинским персоналом наработанных навыков и квалификации для работы слепым методом, а также развития зависимости от использования ультразвука в работе. Выдвигались предположения о том, что в случае если ультразвуковая навигация станет стандартом при установке ЦВК, слепой метод с использованием анатомических ориентиров может быть забыт. Вследствие этого медицинский персонал потеряет навыки, а молодые специалисты вообще не научатся работать методом поверхностных ориентиров. В этих случаях при недоступности ультразвукового аппарата, или выходе его из строя может существенно увеличиться доля неудачных катетеризаций и сопутствующих осложнений. Сторонники слепого метода с использованием анатомических ориентиров заявляют о том, что анестезиолог должен уметь устанавливать ЦВК без помощи ультразвука и при этом иметь достаточный уровень успешных попыток и малое количество осложнений.
Некоторые авторы пытались примирить два с первого взгляда противоположные методики, предлагая обучать медицинский персонал слепому методу с использованием поверхностных ориентиров наряду с ультразвуковыми методиками контроля манипуляций. Но реалистичным ли выглядит требование к учащимся овладевать слепой методикой, в то время как априори ясно, что она не будет использоваться в достаточной мере для наработки навыка, или хотя бы для того, чтобы учащиеся считались компетентными в применении методики? [30] В современном мире ультразвуковая навигация в реальном времени стала уже стандартной практикой при катетеризации IJV, и она постепенно приобретает все большую важность при работе с другими доступами. В публикациях постоянно подчеркивается важность прохождения врачами обучения для развития навыков работы с ультразвуком во время катетеризации для улучшения клинических исходов в целом. Таким образом, можно заключить, что время, выделенное на обучение, разумнее потратить не на овладение методикой поверхностных ориентиров, а на изучение основ и техники катетеризации под контролем ультразвука.
Заключение Современные публикации и научные труды всецело поддерживают использование ультразвуковой навигации в реальном времени при катетеризации внутренней яремной вены для увеличения доли успешных попыток установки катетера и снижения количества осложнений. Доказательства также свидетельствуют о том, что для повышения безопасности пациента и улучшения клинического исхода операторам необходимо пройти соответствующий тренинг.
Читайте также:
