Осложнения в послеоперационном периоде сочетанной травмы.
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Послеоперационные осложнения развиваются как минимум в 10% случаев всех операций. Для этого есть несколько причин.
Во-первых, ситуация, которая сделала необходимым оперативное вмешательство, не исчезает в момент операции. Больному предстоит долгое восстановление нормального функционирования организма.
Во-вторых, само по себе хирургическое вмешательство является нефизиологическим воздействием, нарушающим многие циклические процессы в организме. Здесь и введение наркотического вещества, нагружающего печень и почки, и изменение сердечного и дыхательного ритма, кровопотеря, болевые ощущения. Экстренные и длительные операции являются закономерными факторами возникновения осложнений. В норме на 3-4-е сутки организм справляется с неожиданными обстоятельствами, и самочувствие больного улучшается.
Лечение послеоперационных осложнений требует квалифицированного подхода со стороны врачей и медицинского персонала.
Местные осложнения
В зоне операционной раны могут возникнуть следующие неприятности:
- кровотечение из-за нарушения свёртываемости крови, соскальзывания шовного материала с сосуда или недостаточного восстановления гемостаза в ходе операции. Для устранения кровотечения накладывают швы, делают повторное лигирование, помещают холод на рану или вводят гемостатические препараты;
- гематома из-за кровоточащего сосуда. Гематому вскрывают, удаляют пункцией. При небольших размерах она рассасывается при УФО или наложении компресса;
- инфильтрат - отёк тканей в пределах 10 см от краёв шва вследствие инфицирования раны или образования некроза в подкожно-жировой клетчатке. В зависимости от причины для его рассасывания применяются физиотерапевтические процедуры или хирургическая обработка;
- нагноение ― инфильтрат с выраженным воспалением. Чтобы ликвидировать его, снимают швы, раскрывают края раны, промывают и устанавливают дренаж;
- эвентрация ― выпадение внутренних органов наружу из-за нагноения, непрочного ушивания краев раны, увеличения внутрибрюшного давления при кашле или метеоризме или сниженной регенерации (заживлении) тканей. Необходимо вправление органов с соблюдением асептики, строгий постельный режим и ношение тугого бандажа.
- Лигатурный свищ ― возникает при образовании абсцесса вокруг шовного материала. Требуется его иссечение вместе с шовным материалом.
Общие осложнения
В результате операционного вмешательства в организме возникают системные нарушения, которые рассматриваются как послеоперационные осложнения:
- болевые ощущения. Их снимают анальгетиками, спазмолитиками и десенсибилизирующими средствами в разных комбинациях;
- расстройства нервной системы. Если больного мучает бессонница, то ему назначают снотворные и успокоительные препараты;
- послеоперационные бронхиты и пневмонии чаще появляются у курильщиков. В таких случаях назначаются антибиотики и симптоматическая терапия;
- острая сердечная недостаточность считается самым опасным осложнением, требующим проведения мероприятий по спасению больного;
- острые эмболии и тромбозы при сердечно-сосудистых патологиях, повышенной свёртываемости крови, варикозной болезни. Для предупреждения таких осложнений необходимо помещать прооперированные конечности выше уровня тела, стягивать стопы и голени эластичными бинтами, назначать терапию антикоагулянтами и дезагренантами;
- осложнения ЖКТ в виде стоматитов и сиалоаденитов (воспаления слюнных желёз) или более серьёзные последствия операции ― парез (отсутствие тонуса и перистальтики) желудка и кишечника;
- со стороны мочевого пузыря часто наблюдаются затруднение и задержка мочеиспускания. Может помочь катетеризация;
- пролежни образуются при длительном нахождении больного в одной позе в лежачем положении. Для их предупреждения нужен хороший уход за больным. При появлении пролежней их обрабатывают антисептическими растворами и ранозаживляющими средствами.
Лечение осложнений после операции является очень важным пунктом в программе реабилитации хирургического больного. Этому уделяется должное внимание со стороны врачей-хирургов в клинике «Санмедэксперт». В результате количество послеоперационных осложнений сведено к минимуму.
Осложнения в послеоперационном периоде сочетанной травмы.
Выявленные во время лапаротомии очаговые изменения печени и селезенки независимо от их локализации и размеров требуют комплексного инструментального обследования в динамике.
Для уточнения характера жидкостных объемных образовании печени и их связи с сосудами у всех больных необходимо проводить УЗ-допплерографию. Признаки повреждения внут-рипеченочных артериальных ветвей с формированием ложной аневризмы при допплеровском исследовании выявляются на 2—5-й неделе после травмы. Наряду с наличием артериальной аневризмы возможно также формирование артериовенозного шунта между артерией и печеночной веной. Развитие травматической, ложной аневризмы, артериовенозного шунта служит показанием к ангиографии и эндоваскулярному гемостазу.
При ушибах органов ангиографическая картина крайне скудна и сводится к диффузному спазму артерий, усиливающемуся по периферии. Иногда контрастирование артерий третьего порядка по периферии отсутствует. Артерии в зоне ушиба втянуты, расправлены в результате отека и регионарного увеличения печени.
При образовании гематом в артериальной фазе на ангиограммах видна аваскулярная зона с дугообразным смещением артерии вокруг этой зоны, со спазмом и неравномерностью контрастирования паренхимы. В случае расположения гематомы подкапсульно печень или селезенка увеличены, а по периферии органа определяется бессосудистая зона.
В случае выявления ложной артериальной аневризмы наблюдают спазм приводящей артерии и выход из сосудистого русла контрастного вещества различной формы, размера и локализации. При обнаружении ложной аневризмы выполняют суперселективную катетеризацию приводящего сосуда и эмболизацию введением микроэмболов фтористого вольфрама, спиралей Гиантурка или микроэмболов гидрогеля. При наличии множественных сосудов, питающих аневризму, эмболизируют несколько артерии.
Больным с нагноением гематомы печени показано дрениро вание под УЗ-наведением. Неэффективное дренирование, на личие в печени очагов некроза или угроз, возможного кровотечения являются показанием к оперативному лечению.
Независимо от величины повреждения и характера операции пострадавшие нуждаются в контроле содержания в сыворотке крови так называемых индикаторных ферментов (ACT АЛТ\ ЛДГ) и в проведении радиосцинтиграфии, УЗИ, УЗ-допплерографии, рентгеноконтрастной томографии (РКТ). Эти исследования выполняются в динамике.
Умеренное повышение уровня ферментов печени (ACT, АЛТ в 2,5 раза, ЛДГ в 6—10 раз) отмечается в течение ближайшего послеоперационного периода у подавляющего большинства пострадавших с травмой печени и свидетельствует о наличии цитолиза гепатоцитов; по данным радиосцинтиграфии в эти сроки наблюдаются неравномерность распределения радиофармпрепарата в сегментах печени и резкое снижение его накопления в зоне травмы. Обычно к концу 2-й недели показатели ферментативной активности и радиосцинтиграфии имеют тенденцию к нормализации.
Продолжительная и высокая ферментемия, стойкое очаговое нарушение накопления радиофармпрепарата свидетельствуют о выраженном цитолитическом процессе, деструкции ткани. В таких случаях обнаружение клинических признаков интоксикации (общая слабость, бледность и желтушность кожи и склер, тахикардия, субфебрилитет, сдвиг лейкоцитарной формулы влево), отсутствие кровотока поданным УЗ-допплерографии и появление по результатам УЗИ неоднородности печеночной паренхимы диктуют необходимость дренирования этих он под контролем УЗ-наведения или путем лапаротомии.
Рентгеновскую компьютерную томографию в послеоперационном периоде проводят с целью определения величины и характера изменений печени, уточнения локализации очаговых изменений, установления связи с желчными структурами, оценки состояния селезенки и других органов, а также для выявления свободной жидкости в брюшной полости.
Успех послеоперационного течения пострадавших с травмой двенадцатиперстной кишки и поджелудочной железы в значительной мере зависит от ранней диагностики несостоятельности швов, часто возникающей при этом виде повреждений.
Наружный панкреатический свищ развивается, по данным J.H. Patton и соавт. (1977), у 15 % пострадавших с травмой поджелудочной железы.
Свищ поджелудочной железы обычно не приводит к тяжелым последствиям и в большинстве наблюдений самостоятельно закрывается, особенно при применении соматостатина (октреотида). Дуоденальные свищи протекают гораздо тяжелее и без хорошо налаженного парентерального и энтерального питания быстро приводят больного к истощению и гибели.
Для того чтобы убедиться в адекватном дренировании зоны несостоятельности, необходимо периодически выполнять фистулографию путем заполнения хода свища через дренажную трубку водорастворимым контрастным веществом. Контрастный раствор необходимо вводить осторожно под контролем рентгеновского экрана и с минимальным давлением, чтобы не вызвать повреждения клеток поджелудочной железы и вспышки панкреатита.
Абсцессы поджелудочной железы у пострадавших с сочетанной травмой возникают под влиянием грамотрицательной микрофлоры и в 65 % случаев являются следствием сопутствующих повреждений полых органов. Эти абсцессы подлежат простому дренированию под УЗ-наведением, однако в 35 % случаев абсцессы развиваются вследствие некроза ткани поджелудочной железы и требуют хирургического лечения. В таких случаях методом выбора является забрюшинный доступ с резекцией XII ребра [Patton J.H. et al, 1997].
- Вернуться в оглавление раздела "Неотложная хирургия."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Контроль лечения в послеоперационном периоде ранений - выявление осложнений
Общее состояние пострадавших после перенесенных множественных и сочетанных ранений может меняться очень быстро, особенно в раннем послеоперационном периоде. Данные клинического осмотра важны, но недостаточны для объективной оценки динамики патологического процесса. При таких условиях главное значение приобретают лучевые и инструментальные методы диагностики.
Все диагностические исследования в послеоперационном периоде можно разделить на запланированные — для периодической оценки динамики посттравматического процесса в целом — и срочные, показания к которым возникают при внезапном ухудшении состояния пациента, появлении осложнений.
После выполнения хирургического вмешательства в пределах первых двух часов с целью оценки эффективности выполненной операции и получения исходных данных для последующего анализа течения послеоперационного периода необходимо выполнить комплекс контрольных исследований и прежде всего рентгенографию шеи, груди и живота. Более подробно диагностическая ценность лучевых и инструментальных методов представлена в следующей главе, посвященной специальной диагностике и лечению осложнений.
Здесь подчеркнем лишь, что обзорная рентгенография груди и живота, несмотря на появление более точных и специфических методов, остается основным скрининговым методом динамического контроля, в первую очередь состояния плевральной полости и легочной ткани.
Патологическое содержимое плевральной полости, ателектаз или геморрагическое пропитывание, воспалительная инфильтрация, абсцедирование возникают у наших пациентов в различные сроки после операции, поэтому при тяжелом состоянии пострадавшего правилом является ежедневная прямая рентгенограмма груди, выполнять которую следует строго в одном и том же «легочном» режиме.
Контрольная обзорная рентгенограмма живота остается единственной в том случае, когда состояние органов брюшной полости и забрюшинного пространства не вызывает опасений. Однако при появлении вздутия живота, изменении перистальтических шумов и других признаков неблагополучия со стороны брюшной полости производится обзорная рентгенография живота, данные которой можно сравнить с контрольной исходной рентгенограммой.
В неясных случаях прибегают к исследованию пассажа рентгеноконтрастного вещества по желудочно-кишечному тракту. Для оценки топографии свищей пищевода, кишечника, поджелудочной железы, мочевого пузыря, их протяженности, отношения к серозным полостям выполняют фистулографию.
Таким же скрининговым методом диагностики является ультразвуковое исследование, спектр возможностей которого несколько иной. По нашим данным, начиная с первых суток после операции УЗИ позволяет у 94,3% пострадавших оценить состояние плевральных полостей. Неинформативным это исследование было у 5,7 % пациентов, у которых имелась обширная эмфизема мягких тканей грудной стенки [Абакумов М. М. и др.]. Этот метод позволяет также оценивать в динамике изменения структуры легких при их ранениях.
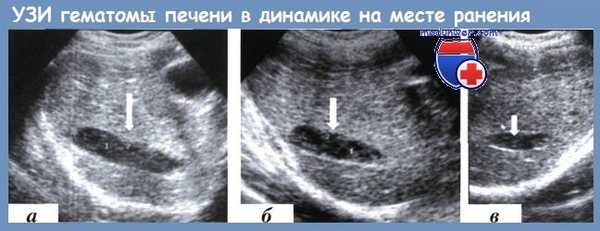
Данные УЗИ при гематоме печени в области раневого канала в динамике:
а — 3-й сутки после ранения; б — 7-е сутки; в — 17-е сутки
Незаменим метод УЗИ для контроля за изменениями структуры гематом паренхиматозных органов в области раневых каналов, в выявлении в этих зонах кровотока, что играет ключевую роль в предупреждении вторичного кровотечения в послеоперационном периоде.
Изменения, обнаруженные при УЗИ, уточняют во время спиральной компьютерной томографии. Ограничения в применении СКТ не позволяют использовать этот метод у крайне тяжелых пациентов. Однако при стабильной гемодинамике и массе тела менее 120 кг СКТ в динамике дает четкую информацию о локализации, размерах (в см3) патологического содержимого в серозных полостях (плевральной, брюшной, полости перикарда), его характера (плотности в единицах Хаунсфилда), смещаемости.
Оценка в динамике локализации, объема и плотности кровоизлияний как в паренхиматозных органах (легкие, печень, селезенка, поджелудочная железа, почки, надпочечники), так и в клетчатке шеи, средостения, забрюшинного пространства — является основой ведения пациентов с ранениями шеи, груди и живота в послеоперационном периоде.
СКТ позволяет уточнить локализацию инородных тел при огнестрельных ранениях, определить в динамике распространеность гематомы средостения и эмфиземы медиастинальной клетчатки.
Использование реконструкции изображения в различных режимах наглядно демонстрирует характер повреждения.
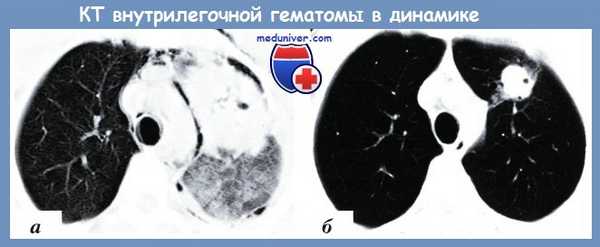
Данные КТ при внутрилегочной гематоме в результате огнестрельного торакоабдоминалыюго ранения:
а — 2-е сутки после ранения. Обширная гематома в области раневого канала с трифокальной травматической инфильтрацией;
б — 12-е сутки. Резкое уменьшение объема гематомы, исчезновение травматической инфильтрации
В целом комплекс методов лучевой диагностики позволяет своевременно предпринимать меры профилактики осложнений, что в значительной мере влияет и на возникновение этих осложнений, и на длительность стационарного лечения, и на уровень летальности.
Радиоизотопные методы в послеоперационном периоде используются для дополнительной информации о характере кровоснабжения поврежденных паренхиматозных органов (легких, печени, селезенки, почек), степени нарушений их функций и для оценки центральной гемодинамики.
Из эндоскопических методов исследования чаще всего приходится использовать трахеобронхоскопию и эзофагогастродуоденоскопию. Неоднократная санационная трахеобронхоскопия является самым эффективным методом не только диагностики состояния дыхательных путей, но и лечения гнойного трахеобронхита, часто сопутствующего длительной интубации трахеи.
Эзофагогастродуоденоскопия необходима, во-первых, для оценки в динамике состояния слизистых оболочек пищевода, желудка и двенадцатиперстной кишки при длительном стоянии назогастрального или назоеюнального зонда и, во-вторых, для эндоскопической остановки кровотечения в случае возникновения осложненных стрессовых язв.
Показания к ангиографии возникают редко, при объективных данных, указывающих на наличие сосудистых осложнений (окклюзия сосуда, наличие ложных аневризм, артериовенозных соустий, гемобилии).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Цель исследования: улучшение результатов хирургического лечения травматических повреждений печени. Исследовано 190 пациентов в возрасте от 18 до 73 лет с закрытой травмой живота, повреждением печени, которым выполнены ушивание ран печени в период с 2001 по 2015 г. Значительная часть (90,7 %) больных трудоспособного возраста от 18 до 60 лет. Всем больным выполнена лапаротомия, ушивание ран печени по поводу закрытой травмы живота и разрыва печени. Из ранних послеоперационных осложнений у больных с повреждением печени при закрытой травме живота чаще наблюдали посттравматический гепатит – 34,2 %, гнойно-воспалительные осложнения послеоперационной раны – 12,6 %. Послеоперационная летальность составила – 0,5 %. Диагноз посттравматический гепатит может быть выставлен раньше видимой механической желтухи, при повышении общего билирубина > 32 мкмоль/л, активности трансаминаз в 1,5 раза, что позволяет провести своевременную адекватную терапию.
1. Вишневский В. А. Операции на печени / В. А. Вишневский, В. А. Кубышкин, А. В. Чжао, Р. З. Икрамов // Руководство для хирургов. – М., 2003. – С. 86–90.
2. Владимирова Е. С. Хирургическая тактика при закрытых повреждениях печени / Е. С. Владимирова, М. М. Абакумов // Хирургия. – 1997. – № 3. – С. 53–58.
3. Литвин А. А. Местный гемостаз в хирургии повреждений печени и селезенки / А. А. Литвин, Г. И. Цыбуляк // Хирургия. – 2000. – № 4. – С. 74 –76.
4. Рагимов Г. С. Дифференцированный выбор способа гемостаза и тактики хирургического лечения травматических повреждений печени и селезенки (экспериментально-клиническое исследование): автореф. дис. … д-ра мед. наук / Г. С. Рагимов. – Махачкала, 2010. – С. 37.
5. Сабиров Ш. Р. Органосохраняющие принципы гемостаза при повреждениях паренхиматозных органов (печени, селезенки и почек): автореф. дис. … д-ра мед. наук / Ш. Р. Сабиров. – М., 2006. – С. 35.
6. Тимербулатов М. В. Совершенствование хирургического лечения повреждений и заболеваний селезенки с позиций профилактики постспленэктомического синдрома: автореф. дис. д-ра мед. наук / М. В. Тимербулатов. – Уфа, 2004. – С. 43.
7. Фаязов Р. Р. Оптимизация методов диагностики, хирургического лечения и профилактика осложнений травм абдоминальных повреждений (клинико-экспериментальное исследование): автореф. дис. … д-ра мед. наук / Р. Р. Фаязов. – Уфа, 2000. – С.42.
8. Чалык Ю. В. Высоко-низкоинтенсивные лазеры в хирургии паренхиматозных органов живота: автореф. дис. … д-ра мед. наук / Ю. В. Чалык. – Саратов, 1993. – С.38.
10. Шапкин В. С. Закрытые и открытые повреждения печени: монография / В. С. Шапкин, Ж. Ф. Гриненко. – М., 1977. – С. 176.
11. Feliciano D. V. Hepatic trauma revisited / D. V. Feliciano, L. Pachter // Current probl. surg. – 1989. – Vol. 266, № 7. – Р. 455–524.
12. Hanna S. S. Blunt live trauma and Sunnybrook medical centra a 13 year experirience / S. S. Hanna // Surgery. – 1991. – Vol. 4. – № 1. – Р. 49–58.
13. Mischinger H. L., Liver Trauma/ H. L. Mischinger, H. Bacher, Ct. Werkgartuer et al. // Acta Chir. Austr. – 1999. – № 2. – Р. 80–84.
14. Mooney D. P. Multiple trauma: liver and spleen injury / D. P. Mooney // 19: Curr Opin Pediat. – 2002. – Vol. 14. – № 4. – Р. 482–485.
15. Charyshkin A. L. Results of surgical treatment of patients with liver laceration from blunt abdominal trauma / A. L. Charyshkin, M. R. Gafiullov, V. P. Demin // International Journal of Biomedicine. – New York, USA, 2012; 2(3):169-173.
В настоящее время травматические повреждения органов брюшной полости являются актуальной проблемой абдоминальной хирургии. Среди которых закрытые и открытые травмы печени занимают второе место по частоте и достигают 20 %, а летальность до 26 % [1,2,3,5,7].
Наибольшие диагностические сложности возникают при закрытых травмах печени [1,6,7,9,10].
Высокая активность трансаминаз является важным диагностическим критерием при повреждениях печени [6,7,9,11,12].
Распространенным скрининговым методом диагностики травм печени и их осложнений является ультразвуковое исследование [1,2,7,9,13].
Компьютерная томография позволяет точно определить тактику лечения пострадавших [1,2,7,9,14].
Лапароскопия позволяет в 99 % случаев поставить достоверный диагноз [1,2,7,9,15]. Применение лапароскопии сокращает число диагностических лапаротомий в сомнительных случаях. Но она противопоказана при нестабильной гемодинамике, острой дыхательной недостаточности, предположении о возможном разрыве диафрагмы
По данным литературы осложнения в послеоперационном периоде у больных с колото-резаными ранами печени возникают у 26 %, с огнестрельными ранениями – 35 %, с закрытой травмой печени – 45 %, при сочетанной травме – 40 % [1,2,4,6,7,8].
Осложнения у больных после первичной операции по поводу повреждений печени в раннем послеоперационном периоде чаще множественные и достигают 50 %, причем часто они [3,4,6,7,9,15].
Недостаточно изученным осложнением раннего послеоперационного периода травм печени является посттравматический гепатит. Данное осложнение вызвано ишемией ткани печени, нарушением ее микроциркуляции, желчной гипертензией. Диагностические маркеры: гипербилирубинемия, субфебрильная температура, повышение показателей трансаминаз, лейкоцитоз. Посттравматический гепатит наблюдается у более 4 % больных, впоследствии возможно развитие гемобилии и склерозирующего холангита [3,4,6,7,9,14].
В доступной литературе вопросы диагностики и лечения данного осложнения мало изучены.
Целью нашего исследования явилось улучшение результатов хирургического лечения травматических повреждений печени.
Материалы и методы исследования
Работа выполнена в соответствии с основными направлениями программы научных исследований ФГБОУ ВПО «Ульяновский государственный университет», на кафедре факультетской хирургии. Исследование ретроспективное, проспективное, поисковое. Сроки проведения исследования 2001–2015 гг.
Критерии включения в исследование: возраст 18 лет и старше, пол мужской и женский, наличие закрытой травмы живота, повреждения печени, хирургическое лечение ушивание ран печени.
Критерии исключения из исследования: возраст младше 18 лет, сочетанные травмы живота, инфаркт миокарда, острые нарушения мозгового кровообращения, хирургическое лечение атипичные резекции печени.
Для решения поставленных задач нами было проведено клиническое обследование 190 пациентов в возрасте от 18 до 73 лет с закрытой травмой живота, повреждением печени, которым выполнено ушивание ран печени в хирургических отделениях МУЗ УГКБСМП г. Ульяновск, в период с 2001 по 2015 г.
Всем больным выполнена лапаротомия, ушивание ран печени по поводу закрытой травмы живота и разрыва печени.
Для решения поставленных задач были использованы клинико-лабораторные, рентгенологический, эндоскопический, УЗИ, гистологический методы исследования.
В лабораторных исследованиях определяли общий анализ крови, биохимию крови (АлАТ, АсАТ, биллирубин). Лейкоцитарный индекс интоксикации (ЛИИ) определяли по формуле В. К. Островского.
При поступлении в стационар всем больным проводилось общеклиническое обследование. Изучили клинические и биохимические показатели крови: общий анализ крови, эритроциты (калометрический метод), гемоглобин (гемоглобинцианидный метод), лейкоциты с развернутой формулой, СОЭ, общий белок и фракции (биуретовый метод), трансаминазы, индекс де Ритиса (АСТ/ АЛТ), билирубин и его фракции, определялась активность амилазы крови и мочи (метод Каравея).
Ультразвуковое исследование органов брюшной полости проводилось с помощью аппарата «SIM-5000» (Япония) по стандартной методике.
Для изучения отдаленных результатов хирургического лечения проводили клинический контрольный осмотр и опрос. На основе полученных данных проводили трехбалльную систему оценки:
1 балл – хороший результат лечения: отсутствие осложнений за период наблюдения и отсутствие жалоб, связанных с операцией.
2 балла – удовлетворительный результат лечения: отсутствие осложнений за период наблюдения, связанных с операцией, но наличие каких-либо жалоб, связанных со стороны органов брюшной полости (боли, дискомфорт, диспептические явления, неудовлетворенность косметическим эффектом послеоперационного рубца, хронические запоры).
3 балла – неудовлетворительный результат лечения: наличие осложнений за период наблюдения и жалобы, связанные с операцией.
Статистическая обработка результатов производилась с помощью пакета программ Statistica 6. При сравнении полученных параметров нами использовался t-критерий Стьюдента для независимых парных выборок и х2-тест. Статистически значимыми признавались различия с уровнем доверительной вероятности не менее 95 % с учетом поправки Бонферрони для множественных сравнений.
Результаты и обсуждение
В исследование были включены 190 больных (таб. 1) с диагнозом закрытая травма живота, разрыв печени. Среди больных мужчин было 77,4 %, женщин 22,6 %. Значительная часть (90,5 %) больных трудоспособного возраста от 18 до 60 лет.
Работа описывает случай успешной одновременной костной аутопластики ложного сустава в средней трети плечевой кости и аутопластики дефекта лучевого нерва у больного с сочетанной травмой. У больных, перенесших сочетанную травму, велика вероятность развития осложнений на фоне развития травматической болезни и её декомпенсации. Возможны, как инфекционные осложнения, так и нарушение остеогенеза на фоне угнетения иммунитета и нарушения микроциркуляции. Вместе с тем малоинвазивные методы хирургического лечения и окончательной стабилизации костных отломков создают условия для ранней реабилитации, улучшают прогноз последующих необходимых реконструктивных операций. Оригинальность предложенной методики заключается в том, что у больного с сочетанной травмой, осложненной невропатией лучевого нерва, стабилизация костных отломков выполнена с применением малоинвазивных методов остеосинтеза. Реконструктивная операция одновременной костной аутопластики ложного сустава в средней трети плечевой кости и аутопластики дефекта лучевого нерва проведена у больного, перенесшего сочетанную травму в более благоприятных для регенерации лучевого нерва условиях, в окружении жизнеспособных кровоснабжаемых тканей.
1. Афанасьев Д.С. Лечение больных с закрытыми костно-суставными травмами плеча, осложненными повреждениями нервных стволов: автореф. дис. … канд. мед. наук. – М., 2004. – 18с.
2. Васильев М.В. Хирургическое лечение больных с изолированным повреждением лучевого нерва и в сочетании с переломом плечевой кости: автореф. дис. … канд. мед. наук. – Казань, 2010. – 19с.
4. Гуманенко Е.К. Политравма. Актуальные проблемы и новые технологии в лечении // Новые технологии в военно-полевой хирургии и хирургии повреждений мирного времени. – Междунар. конф. 26–28.10.2006. – СПб., 2006. – С. 4-14.
5. Гуманенко Е.К., Немченко Н.С., Гончаров А.В., Пашковский Э.В. Патогенетические особеннос¬ти острого периода травматической болезни. Травматический шок – частное проявление ост¬рого периода // Вестн. хирургии. – 2004. – Т. 163, № 1. – С. 52-56.
6. Никитин Г.Д., Грязнухин Э.Г. Множественные переломы и сочетанные повреждения. – 2-е изд. – Л.: Медицина, 1983. – С. 41.
9. Травматический шок: Оценка тяжести, прогнозирование исхо¬дов / под ред. С.А. Селезнёва. – Кишинёв: Штиинца, 1986. – 176 с.
10. Чистиченко С.А. Диагностика и хирургическое лечение переломов плечевой кости с повреждением лучевого нерва: автореф. дис. … канд. мед. наук. – Уфа, 2005. – 18с.
11. Ejstrud P., Sorensen J.V. Early osteosynthesis of fractures of the lower extremities in patients with multiple trauma // Ugeskr Laeger. – 1993. – Vol. 155, NS 16. – P. 1202-1206.
12. Osier T. International classification of disease – 9 based injury severity score // J. Trauma. –1996. – Vol. 41. – P.380-388.
13. Pape H.C., Giannoudis P., Krettek C. The timing of fracture treat¬ment in polytrauma patients: relevance of damage control orthope¬dic surgery // Am. J. Surg. – 2002. – Vol. 186, No. 6. – P. 622-629.
Одной из задач при лечении пострадавших с сочетанной травмой является выбор тактики лечения переломов длинных трубчатых костей. Цель исследования – представить возможности применения новых технологий лечения переломов длинных трубчатых костей верхних конечностей у пострадавших с сочетанными травмами в многопрофильных городских стационарах и их влияние на ближайшие исходы и окончательные результаты реконструктивных операций.
Больной С., 40 лет, госпитализирован в городскую больницу 24.12.2012 с сочетанной травмой после ДТП: закрытой черепно-мозговой травмой, сотрясением головного мозга, разрывом стенок толстой кишки, открытым переломом правой плечевой кости на границе ср/3 и н/3 со смещением отломков, травматической невропатией лучевого нерва. В экстренном порядке больному выполнены жизнеспасающие операции на органах брюшной полости. Первичный остеосинтез плечевой кости аппаратом внешней фиксации. Затем аппарат был демонтирован и выполнен окончательный реостеосинтез интрамедуллярным стержнем с блокированием. Послеоперационный период протекал без осложнений.
Через 4 мес. на контрольных рентгенограммах правой плечевой кости выявлен ложный сустав в зоне перелома. В неврологическом статусе – клиника полного нарушения проводимости правого лучевого нерва на уровне средней трети плеча. Активные разгибательные движения в правом лучезапястном суставе, пальцах правой кисти отсутствуют. По ЭНМГ выявлена грубая сенсомоторная дисфункция проведения по правому лучевому нерву.
Пациент госпитализирован в клиническую больницу № 122 им. Л.Г. Соколова, где 05.06.2013 г. выполнена операция – одновременная костная аутопластика ложного сустава правой плечевой кости и аутопластика большого дефекта лучевого нерва в средней трети плеча.
Под общим обезболиванием по старому послеоперационному рубцу, в средней трети, по наружной поверхности правого плеча, осуществлен доступ к плечевой кости, где обнаружен ложный сустав в месте перелома. Края кости обработаны, в них образован паз, куда был помещен отмоделированный фрагмент аутокости, предварительно взятый из гребня правой подвздошной кости. Костный аутотрансплантат фиксирован пластиной и 4 винтами.
С техническими трудностями в зоне перелома плечевой кости выделен центральный и периферический концы лучевого нерва. Центральный конец заканчивался невромой. После обработки концов нерва до отчетливых пучков, диастаз между ними составил 6 см. Выполнение состоятельного шва нерва с таким диастазом – не представлялось возможным. Для восполнения дефекта лучевого нерва решено произвести аутопластику. Для этого с правой голени из разреза длинной 2 см в области наружной лодыжки специальным инструментом взят икроножный нерв с образующими его ветвями. Между концами лучевого нерва, с использованием микрохирургической техники, вшито 4 аутотрансплантата из икроножного нерва, длинной по 7 см. Периферический конец лучевого нерва перекрыт полностью, а центральный на 3/4. Причем трансплантаты пришлось укладывать на металлическую пластину (рис. 1) и закрывать мягкими тканями.
Рис. 1. Внешний вид аутопластики лучевого нерва на уровне выполненной костной аутопластики плечевой кости с фиксацией металлической пластиной
Послеоперационное течение гладкое. Заживление раны первичное.
Через 16 месяцев после операции у больного восстановились активные движения в разгибателях правой кисти и пальцев до 3–4 баллов (рис. 2).
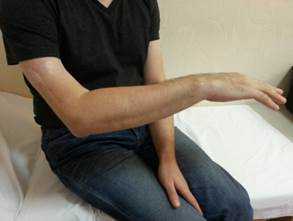
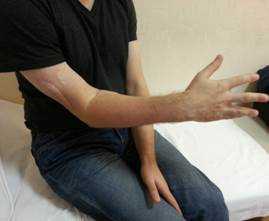
Рис. 2. Восстановление функции лучевого нерва через 16 мес. После операции
На контрольных рентгенограммах правой плечевой кости – сросшийся перелом плечевой кости (рис. 3).
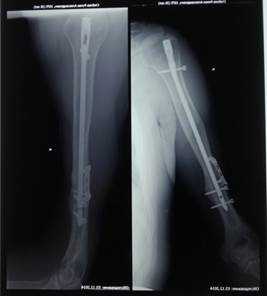
Рис. 3. На рентгенограмме больного С. сросшийся перелом плечевой кости
Результаты исследования и их обсуждение. Работами последних десятилетий доказана отчётливая зависимость исходов лечения пострадавших с тяжёлыми сочетанными травмами от срока, объёма и качества оказанной медицинской помощи. При этом на ближайшие исходы максимальное влияние оказывают мероприятия, выполняемые в 1-м и 2-м периодах ТБ. Основными из них являются: устранение жизнеугрожающих последствий травмы (кровотечение и острые нарушения дыхания), травматического шока и его последствий, а также ликвидация очагов эндотоксикоза и массивной антигенемии путём жёсткой фиксации переломов длинных трубчатых костей аппаратами наружной фиксации (АНФ).
В то же время на отдалённые результаты лечения влияют мероприятия, выполняемые в 4-м периоде ТБ и направленные на достижение оптимального анатомического и функционального результата. Это прежде всего ранние малоинвазивные оперативные вмешательства, которые мы оцениваем как хирургическую реабилитацию, направленные на точное сопоставление отломков сломанной кости и их жёсткую фиксацию для раннего функционирования суставов, активизации пострадавших, полноценной и быстрой реабилитации.
На этапе определения тактики лечения перелома хирурги часто сталкиваются с проблемой выбора наиболее оптимального варианта иммобилизации костных отломков из большого количества существующих в настоящее время. Постоянный рост требований к качеству жизни часто заставляет отказаться от консервативных методов лечения (будь то скелетное вытяжение или гипсовая иммобилизация). Постоянно разрабатываются и внедряются в практику новые типы фиксаторов, но (несмотря на большое количество публикаций) отсутствуют чётко определённые показания к каждому из них. Различные авторы высказывают несхожие между собой мнения о применении тех или иных вариантов остеосинтеза костей плеча (штифты с блокированием, титановые эластичные штифты, пластины, аппараты наружной фиксации). Одни отдают предпочтение малоинвазивными фиксаторам, так как при их установке дополнительное повреждение окружающих мягких тканей (в том числе – нервов) минимально. Другие рекомендуют при закрытых переломах диафиза плеча применять пластины и винты, так как в этом случае фиксация более стабильна, меньше процент несращений, а, следовательно, редко возникает необходимость в повторных операциях.
Результаты лечения повреждений периферических нервов при костно-суставных травмах плеча часто бывают неудовлетворительными. Не реализуются имеющиеся возможности для реабилитации подобных пострадавших. Причин этому несколько. В стационарах, где отсутствует дежурная нейрохирургическая служба, первичное вмешательство на нервных стволах либо своевременно не применяется, либо его производят дежурные хирурги, которые не участвуют в послеоперационном лечении больных. Нарушается преемственность в наблюдении и дальнейшей терапии пострадавших. У определённого числа больных вследствие недостаточно целенаправленного восстановительного лечения после оказания первой помощи возникают тяжёлые осложнения: контрактуры и тугоподвижность суставов, формируются порочные положения кисти, которые могут носить стойкий характер, а порой оказываются необратимыми.
Описанный случай демонстрирует эффективность одномоментной аутопластики большого дефекта нервного ствола и костной аутопластики, после предварительно проведённой хирургической реабилитации в рамках тактики Orthopedic damage control.
Тактика ЗМХЛ (Orthopedic damage control) и малоинвазивный остеосинтез являются новыми и перспективными направлениями в лечении переломов длинных трубчатых костей у пострадавших с тяжёлой сочетанной травмой. Тактика ЗМХЛ в значительной мере влияет на улучшение ближайших исходов, в то время как технологии малоинвазивного остеосинтеза – на улучшение отдалённых результатов лечения пострадавших с сочетанной травмой. Благодаря предварительно проведённой хирургической реабилитации в рамках тактики Orthopedic damage control улучшаются возможности и исходы реконструктивно-восстановительных операций по поводу осложнений у пострадавших с сочетанной травмой. На фоне восстановленного кровообращения, микроциркуляции, необходимых для профилактики некроза свободных аутотрансплантатов. В результате хирургической реабилитации трансплантаты были окружены жизнеспособными, хорошо кровоснабжаемыми мягкими тканями, для адекватного питания межтканевой жидкостью и профилактики рубцевания.
Читайте также:
- Нарушение метаболизма мочевины на МРТ головного мозга
- Крестцово-копчиковая тератома. Диагностика и лечение крестцово-копчиковых тератом.
- Рожа. Возбудитель и механизмы развития рожи
- Влияние алкалоидов барвинка на плод беременной
- Лечение возрастной макулярной дегенерации. Лекарства для устранения косоглазия
