Острый нелимфобластный лейкоз вследствие терапии - диагностика
Добавил пользователь Владимир З. Обновлено: 10.01.2026
Острый лимфобластный лейкоз чаще поражает детей. Его пик приходится на 2-4 года. Среди взрослых эта форма острого лейкоза встречается у 10-15% больных.
Патогенез (что происходит?) во время Острого лимфобластарного лейкоза:
К моменту диагностирования острого лимфобластного лейкоза опухоль уже достаточно велика, и ее масса достигает, как правило, 1 1012 клеток на 1 м2 поверхности тела и составляет около 3–4% его массы тела. Такое число лейкозных клеток может образоваться за 1-3 месяца болезни при удвоении числа лейкозных клеток в костном мозге за 4-10 дней. К моменту наступления улучшения от преднизолона и винкристина содержание лейкозных клеток снижается до 1 Ч 108 - 1 Ч 109 на 1 м2.
Симптомы Острого лимфобластарного лейкоза:
Особенность клинической картины данного лейкоза у детей заключается в частом увеличении лимфатических узлов и селезенки. В зависимости от места преимущественного увеличения лимфатических узлов меняются и признаки заболевания. При их локализации в области грудной клетки у больных появляется сухой кашель, одышка; увеличенные мезентериальные узлы могут вызывать боли в животе. Характерны боли в голенях. Однако начало острого лимфобластного лейкоза у детей достаточно редко сопровождается глубоким угнетением кроветворения, обычно отмечаются лишь нормохромная анемия и умеренная лейкопения.
Диагностика Острого лимфобластарного лейкоза:
Клиническое начало болезни может совпадать с алейкемической и лейкемической фазой. Нередко появляются неспецифические изменения в крови, связанные с нарушением структуры костного мозга: единичные эритрокариоциты, миелоциты, промиелоциты – признаки миелемии. Пункция костного мозга, выявляющая бластные клетки в большом проценте, разрешает все диагностические трудности.
Морфология бластных клеток имеет некоторые особенности: ядро с нежной сетью хроматина, как у всех бластов, обычно круглое, имеет 1-2 крупные нуклеолы во многих ядрах, цитоплазма зернистости не содержит. Как и при всех острых лейкозах, форма ядра в процессе болезни меняется: оно становится неправильным, его размеры растут; также увеличивается и ободок цитоплазмы.
Специфические гистохимические особенности этого лейкоза: бластные клетки не обнаруживают пероксидазы, фосфолипидов, эстераз, а гликоген, выявляемый PAS-реакцией, распределяется в цитоплазме глыбками в виде ожерелья вокруг ядра.
Изучение Т– и В-маркеров на бластных клетках острого лимфобластного лейкоза показало, что он представляет собой неоднородную группу. Имеются по крайней мере 3 формы этого лейкоза, выявляемые по антигенным маркерам: острый лимфобластный лейкоз с бластными клетками, имеющими маркеры В-лимфоцитов, маркеры Т-лимфоцитов и не имеющими маркеров Т– или В-лимфоцитов.
К В-форме острого лимфобластного лейкоза относятся лейкемизирующиеся стадии лимфосарком, лимфосаркомы Беркитта, очень редкие бластные кризы хронического лимфолейкоза. Лейкозным клеткам при этой форме свойственна высокая плотность IgM на их поверхности.
Клинически более четко изучены особенности Т-формы острого лимфобластного лейкоза. Вышеописанная форма наиболее часто выявляется у детей старшей возрастной группы, при этом средний возраст больных составляет 10 лет. Согласно большинству данных средняя продолжительность жизни больных с этой формой острого лейкоза составляет менее 24 месяцев, обострение в половине случаев начинается с экстрамедуллярного роста - чаще с поражения нервной системы.
Бластные клетки по своей антигенной структуре скорее напоминают тимоциты и претимоциты, чем периферические Т-клетки. Также данные клетки сохраняют некоторые функциональные свойства супрессоров. Цитохимической особенностью Т-бластов является высокая активность кислой фосфатазы, ее локализованность в цитоплазме.
Общая характеристика острого лимфобластного лейкоза относится преимущественно к его ни Т-, ни В-форме, включающей около 70% случаев.
По антигенным и энзиматическим особенностям представляющие ни Т– ни В-форму клетки лишены детерминант периферических Т- и В-лимфоцитов. Однако такие клетки имеют черты предшественников тимоцитов: реагируют с антисывороткой к тимусным антигенам, с некоторыми антисыворотками хронического лимфолейкоза, содержат много дезоксинуклеотидилтрансферазы. Следующей особенностью данных клеток является то, что они имеют много Ia-антигена, свойственного В-клеткам.
В остром лимфобластном лейкозе, кроме 3 основных выделенных по антигенным маркерам лимфоцитов форм (Т-острый лимфобластный лейкоз, В-острый лимфобластный лейкоз и ни Т– ни В-острый лимфобластный лейкоз), определено еще несколько.
Новые формы в основном отделились от ни Т– ни В-формы. Так, выделена пре-В-форма острого лимфобластного лейкоза: представляющие его бласты относятся к ранним клеткам - предшественницам В-лимфоцитов, так как они содержат цитоплазматический иммуноглобулин - тяжелую цепь IgM - и не имеют иммуноглобулинов на поверхности. Вышеописанная форма острого, по существу, В-клеточного лейкоза отличается значительно более благоприятным течением чем В-форма.
От ни Т– ни В-формы отделился лейкоз, представленный лимфобластами с теми же антигенными маркерами, но содержащими Ph'-хромосому. Эта форма острого лимфобластного лейкоза встречается у детей старшего возраста – после 10 лет; она течет неблагоприятно, давая короткое улучшение.
В небольшом проценте случаев встречается острый лимфобластный лейкоз, бласты которого относятся по иммунологической характеристике к пре-Т-лимфоцитам, к клеткам-предшественницам Т-лимфоцитов. В отличие от пре-В-формы острого лимфобластного лейкоза пре-Т, как и другие Т-клеточные острые лейкозы, относится к неблагоприятным по течению формам.
Т-клеточные формы острого лимфобластного лейкоза могут сопровождаться высокой эозинофилией. В крови при этом бывает лейкоцитоз, эозинофилия достигает 80-90%, а бластные клетки могут отсутствовать. Высокая эозинофилия требует пункции костного мозга, при которой в случае лейкоза находят высокий процент бластных клеток. В ремиссии эозинофилия исчезает и появляется вновь, иногда как первый признак рецидива.
У детей увеличение подчелюстных лимфатических узлов встречается часто из-за хронического тонзиллита, а увеличение селезенки - обычная реакция на инфекцию. Лейкозная инфильтрация лимфатических узлов придает им плотность (узлы обычно безболезненны), чаще увеличиваются надключичные лимфатические узлы, а не подчелюстные, как при тонзиллите. В сомнительных случаях всегда показана пункция органа: особенно это касается селезенки, так как в ней может быть местный рецидив с почти сплошным содержанием бластов в пунктате. Своевременная диагностика острого лимфобластного лейкоза как «быстрого» лейкоза имеет важнейшее значение не только из-за стремительности самого процесса, но и из-за заноса патологических клеток в мозговые оболочки.
По клинической картине, способности оставлять сохранными нормальные ростки кроветворения, частоте первой ремиссии острый лимфобластный лейкоз у взрослых похож на детский вариант.
Селезенка и лимфатические узлы при остром лимфобластном лейкозе увеличиваются большей частью одновременно с процессом в костном мозге. В отличие от острого миелобластного лейкоза это увеличение при данном лейкозе не есть новый этап прогрессии. Лейкемические клетки, инфильтрирующие лимфатические узлы и селезенку, оказываются, как правило, чувствительными к тем же цитостатическим препаратам, что и клетки в костном мозге.
Как правило, улучшение достигается применением комплекса цитостатических средств. Дальнейшее непрерывное лечение цитостатическими препаратами удерживает улучшение месяцы или годы. Однако у взрослых часто возникают обострения болезни. Обострение может быть либо только местным: появление нейролейкемии, инфильтрации нервных корешков или инфильтрации яичка, лейкемического эписклерита (воспаление наружной оболочки глазного яблока), либо костномозговым. Местное обострение определяется при спинномозговой пункции, либо у больных появляются боли, обусловленные инфильтрацией корешков. Костномозговое обострение может не сопровождаться выходом бластных клеток в кровь, поэтому грудную пункцию врач проводит регулярно: ежемесячно в первый год улучшения, а затем – 1 раз в 3 месяца. Кроме того, грудную пункцию делают при появлении бластов в крови и цитопении, не зависящей от цитостатиков.
Безусловным показанием к исследованию костного мозга должны быть явные клинические признаки обострения: увеличение лимфатических узлов, появление болей в костях, корешковый синдром, субфебрилитет, просто немотивированное ухудшение общего состояния. Признаки заболевания в период обострения острого лимфобластного лейкоза сильнее, чем при его первом приступе. Каждое последующее обострение развивается более злокачественно, чем предыдущие, и имеет худший прогноз.
Метастазирование процесса в яички и мозговые оболочки, наиболее частое при остром лимфобластном лейкозе детей, представляет собой новый этап опухолевой прогрессии.
процесс узлов средостения, раннее поражение центральной нервной системы и возраст моложе 1 года и старше 10 лет.
Лечение Острого лимфобластарного лейкоза:
Частота улучшений у детей при этой форме лейкоза составляет 94%, у лиц старше 15 лет - около 80%. Частота выздоровления у детей - более 50%. Прогностически неблагоприятными факторами, которые влияют на продолжительность жизни больных острым лимфобластным лейкозом, являются распространенность процесса к моменту постановки диагноза, лейкоцитоз выше 15 Ч 103 в 1 мкл, увеличение селезенки, вовлечение в процесс узлов средостения, раннее поражение центральной нервной системы и возраст моложе 1 года и старше 10 лет.
Проводится немедленное лечение цитостатическими препаратами и только по специальным программам.
Целью лечения острых лейкозов является достижение и максимальное продление улучшения или выздоровление.
Острые лимфобластный и недифференцируемый лейкозы у детей. Лечение проводится по программам (разработанным различными авторами), которые позволяют более чем у 50% детей сохранять улучшение дольше 5 лет.
Улучшение достигается за 4-6 недель с помощью одной из 3 схем, следует отметить, что данные схемы были внедрены еще в 1980-1990 гг. и до сих пор не потеряли свою актуальность.
Винкристин по 1,4 мг/м2 1 раз в 7 дней внутривенно, преднизолон по 40 мг/м2 в день (в схемах, рассчитанных на 4-6 недель, преднизолон отменяют в течение 6-8 дней).
Винкристин по 1,4 мг/м2 1 раз в 7 дней внутривенно, преднизолон по 40 мг/м2 в день, рубомицин по 60 мг/м2 2 дня подряд на 2-й неделе терапии (на 10-й и 11-й дни курса).
Винкристин по 1,4 мг/м2 1 раз в 7 дней внутривенно, преднизолон по 40 мг/м2 в день, L-аспарагиназа в течение 10 дней по 100 ЕД/кг в день внутривенно после 4-6 недель применения винкристина и преднизолона (если нет полного эффекта).
При неэффективности лечения по схеме 1 в течение 4-6 недель (у лиц моложе 10 лет) назначают лечение по схеме 2 или 3.
При отсутствии эффекта от лечения по схемам врач назначает комбинации с онковином или с винбластином.
Закрепляющие курсы проводят 1-3 раза, в зависимости от значительности нарушения условий выполнения лечения в период улучшения, протяженности этого периода, распространенности лейкемического процесса в начале лечения, полноты полученного улучшения. Если врач обнаруживает селезенку в глубине подреберья, то это может послужить основанием для повторения курса закрепляющего лечения. Если селезенка увеличена, то врач ее пунктирует и в случае ее лимфоцитарного состава назначает лечение, направленное на поддержание улучшения.
Сразу после установления диагноза проводят спинномозговую пункцию с введением в спинномозговой канал метотрексата в дозе 12,5 мг/м2; во время улучшения и курса, закрепляющего улучшение, регулярно 1 раз в 2 недели повторяют спинномозговые пункции с введением метотрексата в дозе 12,5 мг/м2. В случае обнаружения любого числа бластных клеток в спинномозговой жидкости начинают лечение нейролейкемии, профилактическое облучение головы отменяется.
Достижение улучшения обязательно подтверждается контрольной пункцией костного мозга; первую после диагностической пункцию костного мозга в период улучшения производят через 7 дней после начала лечения (уменьшение бластоза в этом пунктате на 50% от исходного и более означает хороший прогноз), затем через 4 недели от начала лечения.
Пролиферативная активность лейкозных клеток резко возрастает после периода улучшения, как и после любого цитостатического курса. В связи с этим непосредственно после достижения улучшения врач назначает поддерживающее лечение.
В комбинации в период поддерживания улучшения дозы цитостатических препаратов, исключая винкристин и преднизолон, уменьшают вдвое.
Развитие полиневрита (снижение сухожильных рефлексов, мышечного тонуса, онемение в пальцах рук и ног и в дальнейшем развитие пареза конечностей с атрофией мышц), обусловленное токсическим действием винкристина, требует снижения дозы этого препарата вдвое, а при выраженности или нарастании изменений - замены его винбластином (через несколько недель после отмены препарата полиневрит проходит). Лечение цитостатическими препаратами отменяется при уровне лейкоцитов ниже 1 Ч 103 (1000) в 1 мкл, язвенном стоматите, диарее, тяжелой рвоте, при высокой температуре, сохраняющейся более 2 дней.
Профилактику нейролейкемии при острых лимфобластном и недифференцируемом лейкозах у детей проводят при цитологически нормальном составе спинномозговой жидкости (бластных клеток нет, цитоз менее 10 в 1 мкл) с первой недели улучшения.
Первая схема профилактики: облучение головы в суммарной дозе 24 Гр и параллельно 5 введений метотрексата эндолюмбально. Профилактику можно проводить в основном амбулаторно.
Профилактика Острого лимфобластарного лейкоза:
Дозу 24 Гр на голову дают на 3 недели по 1,5 Гр за сеанс с двух латеральных полей.
Одну из двух инъекций метотрексата, вводимого 2 раза в неделю в спинномозговой канал, во время облучения головы целесообразно производить в субботу, так как в этот день, как правило, не бывает лучевой терапии, другую - в один из первых дней недели
после сеанса облучения головы; в день эндолюмбального введения метотрексата больной остается в стационаре.
В период профилактики нейролейкемии с помощью как облучения, так и введения метотрексата и цитозара, больные получают внутрь 6-меркаптопурин ежедневно в дозе 25 мг/м2 и циклофосфамид в дозе 100 мг/м2 1 раз в неделю.
После окончания профилактики нейролейкемии делают пункцию костного мозга, и если признаков рецидива нет, то начинают поддерживающую терапию.
Вторым методом профилактики нейролейкемии является эндолюмбальное введение метотрексата и цитозара. Препараты вводят с интервалом 3-4 дня, при плохой переносимости 1 раз в неделю.
Оба метода профилактики нейролейкемии надежны и позволяют отказаться от поддерживающих интралюмбальных введений метотрексата.
Непрерывное поддерживающее лечение в период улучшения острых лимфобластного и недифференцируемого лейкозов детей проводится амбулаторно, в течение 5 лет до полного улучшения. Начинают лечение сразу после достижения полного улучшения или после курсов, закрепляющих достигнутое улучшение.
Дети получают непрерывное лечение тремя препаратами по следующей схеме: 6-меркаптопурин внутрь ежедневно; метотрексат внутрь на 6-й день недели; циклофосфамид внутрь на 7-й день недели, в эти дни 6-меркаптопурин не отменяют.
Для «группы риска» в период непрерывного поддерживающего лечения тремя препаратами каждые 1,5-2 месяца проводится курс СО АР. Во время данного курса в течение недели после него поддерживающее лечение тремя препаратами отменяется, а затем в течение недели проводится половинными дозами. После этого поддерживающее лечение проводится полными дозами.
Условия проведения непрерывного лечения:
1) анализ крови с определением тромбоцитов и ретикулоцитов 1 раз в неделю;
2) при снижении уровня лейкоцитов до 1 Ч 103 - 2 Ч 103 (1000-2000) в 1 мкл врач снижает дозу цитостатических препаратов вдвое, при последующем его повышении более 2,5 Ч 103 (2500) в 1 мкл восстанавливают прежнюю дозу;
3) лечение прерывают на любом этапе при падении уровня лейкоцитов в крови ниже 1000 в 1 мкл, при значительном повышении температуры, стоматите, диарее;
4) пункцию костного мозга в первый год улучшения производят 1 раз в месяц; на 2-5-м году улучшения - 1 раз в 3 месяца.
Лечение острого лимфобластного лейкоза усиливается, когда речь идет о процессе Т-клеточной природы. По программе американских педиатров-онкологов для устранения проявлений болезни при Т-лимфобластном остром лейкозе начинают с внутривенного введения циклофосфана по 1200 мг/м2 в 1-й день лечения или между 2-м и 5-м днем (при уровне лейкоцитов более 5 Ч 104 (50 000) в 1 мкл и значительной органомегалии, требующих предварительного назначения аллопуринола из-за высокого уровня мочевой кислоты в сыворотке и опасности развития мочекислого диатеза). С 3-4-го дня (или в 1-й день, если введение циклофосфана отсрочено) еженедельно (1 раз в неделю) по этой программе, как и по программе Aur, вводится винкристин в течение 4 недели, а также
применяют преднизолон и рубомицин в дозах и в сроки, соответствующие схеме 2 лечения острого лимфобластного лейкоза.
При достижении ремиссии проводится курс ее консолидации, включающий 5-дневное непрерывное введение цитозара по 100 мг/(м2/сут.), прием тиогуанина (или 6-меркаптопурина) по 50 мг/м2 каждые 12 ч в течение 5 дней введения цитозара. Проводят 3 курса лечения цитозаром и тиогуанином (6-меркаптопурин) с интервалом между курсами 14 дней.
Затем в течение 7-14 дней внутривенно капельно вводят L-acnapaгиназу по 200-300 ЕД/кг. В случае высокого уровня лейкоцитов и большой массы опухолевых лимфатических узлов спленомегалии или гепатомегалии терапию нужно проводить, назначая больному большое количество жидкости, щелочное питье, наряду с аллопуринолом для профилактики мочекислого диатеза.
Если при Т-клеточном остром лейкозе в средостении определяются увеличенные лимфатические узлы, плохо сокращающиеся от химиотерапии, то рекомендуется локальное облучение этой области в дозе 30 Гр; локальное облучение целесообразно и при значительном увеличении лимфатических узлов любой другой области.
Лечение в период улучшения при Т-клеточном лейкозе должно быть усилено: наряду с непрерывной терапией 6-меркаптопурином, метотрексатом, циклофосфаном.
К каким докторам следует обращаться если у Вас Острый лимфобластный лейкоз:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Острого лимфобластарного лейкоза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Острый нелимфобластный лейкоз вследствие терапии - диагностика
Острые лейкозы неясной линии дифференцировки - диагностика
К категории таких лейкозов относятся острые лейкозы, при которых ни морфологические, ни цитохимические, ни иммунофенотипические методы не позволяют установить дифференцировку бластов по какой-либо линии гемопоэза (острый недифференцированный лейкоз), а также наблюдения, когда морфологические и/или иммунофенотипические данные свидетельствуют о наличии признаков созревания по двум линиям гемопоэза: миелоидной и лимфоидной или В- и Т-лимфоидной (острый билинейный и острый бифенотипический лейкозы).
При остром недифференцированном лейкозе морфологические и цитохимические показатели бластов не имеют каких-либо характерных особенностей. Клетки реагируют только с МКА к ранним предшественникам гемопоэза — стволово-клеточным CD34, содержат фермент терминальную дезоксинуклеотидилтрансферразу (TdT), а также экспрессируют антигены CD38 и гистосовместимости II класса HLA-DR.
Первая Европейская группа по иммунологической классификации лейкозов (EGIL) рекомендовала провести дальнейшие исследования этого недифференцированного варианта для доказательства миелоидной или лимфоидной направленности дифференцировки клеток. Предложено использовать широкую панель из 33 иммунологических маркеров. По мнению авторов, исследование бластных клеток должно проводиться в 2 этапа. Сначала необходимо изучить линейно-неспецифические антигены TdT, CD34, HLA-DR и установить В-, Т- и миелоидную линейную направленность.
Затем следует определить стадию дифференцировки лейкемических клеток. Для уточнения диагноза предлагается исследовать реаранжировку генов иммуноглобулинов и Т-клеточных рецепторов.
Особую группу составляют острые лейкозы, при которых клетки проявляют одновременно миелоидную и лимфоидную направленность дифференцировки. При этом могут определяться два субклона клеток, каждый из которых экспрессирует маркеры, характерные для какой-либо одной линии. Эти лейкозы получили название биклональных. В других случаях бласты коэкспрессируют одновременно антигены миелоидной и лимфоидной или В- либо Т-лимфоидной направленности. Этот вариант заболевания получил название бифенотипического острого лейкоза (BAL).
Миелоидную направленность дифференцировки устанавливают по наличию в бластах пероксидазы, эстеразы и/или экспрессии миелоидных (CD13, CD33 и CD65) антигенов. В-лимфоидная дифференцировка выявляется экспрессией антигенов CD79a, цитоплазматического CD22, цитоплазматического IgM , CD19, CD10 и CD20. Для Т-лимфобластов характерны реакции с МКА к CD3, TCR , CD2, CD5, CD8.
Для постановки диагноза бифенотипического лейкоза необходимо, чтобы позитивный результат наблюдался не менее чем с двумя МКА одной линии. Следует учесть, что некоторые антигены (Т-линейный CD7, CDla и В-линейный CD24) часто присутствуют на миелоидных клетках и не могут служить маркерами бифенотипа. В связи с трудностями трактовки результатов появилась необходимость унификации диагноза гибридного лейкоза. По системе BAL острый лейкоз считается бифенотипическим, если сумма клеток, имеющих миелоидные и лимфоидные маркеры, превышает 120. Наличие смешанной дифференцировки иногда обнаруживается только на молекулярно-биологическом уровне.
Показано, что при ОНЛЛ могут выявляться перестройки генов цепей иммуноглобулинов или генов Т-клеточного рецептора.
Бифенотипические лейкозы характеризуются высокой частотой цитогенетических аномалий. В трети случаев В-лимфоидной/миелоидной пролиферации определяется филадельфийская хромосома — t(9;22), в отдельных наблюдениях —1(4; 11 )(q21;q23) и аномалии llq23. У больных с Т-лимфоидным/миелоидным бифенотипическим лейкозом часто находят сложные аномалии кариотипа.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Острый лимфобластный лейкоз
Острый лимфобластный лейкоз - это группа гетерогенных злокачественных новообразований из клеток - лимфоидных предшественников (лимфобласты), имеющих определенные генетические и иммунофенотипические характеристики.
Острые лимфобластные лейкозы самые распространённые лейкозы в детском и юношеском возрасте. Пик заболеваемости приходится на возраст от 1 года до 6 лет. Протекают с поражением костного мозга, лимфатических узлов, селезёнки, вилочковой железы, а также других органов.
Что провоцирует / Причины Острого лимфобластного лейкоза:
В генетической основе развития острого лимфобластного лейкоза лежат изменения в структуре хромосом, т.е. хромосомные аберрации. При лейкозах выделяют специфические или первичные и неспецифические хромомомнве аберрации. К первичным принято относить транслокации, делеции, инверсии, амплификации участков хромосом, содержащих онкогены, гены клеточных рецепторов, гены ростовых факторов. Подобные изменения способны образовывать новые последовательности ДНК и появление новых свойств у клетки, образование специфического клона. Вторичные хромосомные аберрации появляются на стадии опухолевой прогрессии в результате изменений сформировавшегося клона. Причем схожие аберрации могут наблюдаться при различных вариантах лейкозов. Так, филадельфийская хромосома может выявляться как при острых, так и при хронических лейкозах.
Причины развития острого лимфобластного лейкоза у детей до сих пор точно не установлены, однако имеются данные о большом значении инфекционных заболеваний в младенческом возрасте, воздействию различных физических (например, рентгенодиагностика, лучевая терапия, ионизирующая радиация) , действие химических мутагенов . при воздействию бензола, среди больных, получавших цитостатические иммунодепрессанты ( имуран , циклофосфан , лейкаран, сарколизин , мустарген и др.), биологических (вирусных) мутагенов на организм матери во время беременности. Доказана также связь между многими врожденными хромосомными аномалиями и развитием острого лейкоза.
Патогенез (что происходит?) во время Острого лимфобластного лейкоза:
В костном мозге, периферической крови и в других органах обнаруживаются опухолевые клетки типа лимфобластов с ШИК-положительными гранулами в цитоплазме, не дающие реакций на пероксидазу, эстеразы и не содержащие липиды.
В 2/3 случаев в опухолевых клетках обнаруживаются цитогенетические нарушения в виде полиплоидии, филадельфийской хромосомы и реципрокной транслокации между хромосомами.
Цитогенез острого лимфобластного лейкоза связан с предшественниками T- и B-лимфоцитов. На T-клеточные лейкозы в странах Европы приходится 10-15 % наблюдений. Преобладают B-клеточные лейкозы.
Руководствуясь иммунологическими фенотипами опухолевых клеток, выделяют несколько форм лимфобластного лейкоза, что имеет значение для выбора терапии и прогноза. Преобладающие B-лимфобластные лейкозы представлены ранним, промежуточным и поздним вариантами, отличающимися по экспрессии параглобулина CD10, поверхностного иммуноглобулина и активности терминальной диоксинуклеотидтрансферазы. Маркерами T-лимфобластного лейкоза являются антигены CD7 и T-рецепторов.
Симптомы Острого лимфобластного лейкоза:
Различают два типа течения острого лимфобластного лейкоза: В-линейный и Т-линейный, в зависимости от типа клеток - лимфоидных предшественников.
Все лейкоциты в организме человека делятся на 2 типа - гранулоцитарные и агранулоцитарные (зернистые и незернистые), эти две группы, в свою очередь, подразделяются на эозинофилы, базофилы, нейтрофилы (гранулоцитарные), и лимфоциты (В- и Т-типа) и моноциты (агранулоцитарные). В процессе созревания и развития (дифференцировки) все клетки проходят несколько этапов, первым из которых является бластный этап (лимфобласты). Из-за поражения костного мозга опухолью, лимфоциты не успевают достаточно развиться для того, чтобы полноценно исполнять свои защитные функции. По большей части, при остром лимфобластном лейкозе поражаются В-лимфоциты (примерно в 85% случаев), отвечающие за образование антител в организме.
Клинические признаки острого лимфобластного лейкоза
- Синдром интоксикации - слабость, лихорадка, недомогание, потеря веса. Лихорадка может быть связана и с наличием бактериальной, вирусной, грибковой или протозойной (реже) инфекцией, особенно у детей с нейтропенией (менее 1500 нейтрофилов в 1 мкл).
- Гиперпластический синдром - увеличение всех групп периферических лимфоузлов. Инфильтрация печени и селезенки приводит к их увеличению, что может проявляться болями в животе. Могут появиться боль и ломота в костях из-за лейкемической инфильтрации надкостницы и суставной капсулы и опухолевого увеличения объема костного мозга. При этом на рентгенограммах можно обнаружить характерные для лейкемической инфильтрации изменения, особенно в трубчатых костях, возле крупных суставов.
- Анемический синдром - бледность, слабость, тахикардия, кровоточивость слизистых полости рта, геморрагический синдром на коже, бледность. Слабость возникает в результате анемии и интоксикации.
- Геморрагический синдром связан как с тромбоцитопенией, так и с внутрисосудистым тромбозом (особенно при гиперлейкоцитозе) и приводит к появлению петехий, экхимозов на коже и слизистых, кровоизлияниям, мелене, рвоте с кровью.
- У мальчиков может обнаруживаться инициальное увеличение яичек ( 5-30% случаев первичного ОЛЛ). Это безболезненные, плотные, одно- или двусторонние инфильтраты. Особенно часто это бывает при гиперлейкоцитозе и Т-клеточном варианте ОЛЛ.
- Дыхательные нарушения, связанные с увеличение лимфоузлов средостения, которые могут привести к дыхательной недостаточности. Этот признак характерен для Т-линейного ОЛЛ.
- Могут появиться кровоизлияния в сетчатку глаза, отек зрительного нерва. При офтальмоскопии могут обнаруживаться лейкемические бляшки на глазном дне.
- Из-за сильно сниженного иммунитета любое повреждение кожи является очагом инфекции, могут появиться паронихии, панариции, инфицированные укусы насекомых и следы инъекций.
Достаточно редкими осложнениями могут являться поражения почек в результате инфильтрации (клинические проявления могут и отсутствовать) и выпотной перикардит из-за нарушения лимфооттока между эндокардом и эпикардом.
Диагностика Острого лимфобластного лейкоза:
Для постановки диагноза острого лимфобластного лейкоза содержание бластных клеток в костном мозге должно быть больше 30%. Если содержание бластных клеток в крови превышает 30%, диагноз может быть поставлен и без исследования костного мозга.
Лечение Острого лимфобластного лейкоза:
Существует несколько различных способов лечения пациентов с взрослым ОЛЛ.
Некоторые способы лечения являются стандартными (применяются в настоящее время), а некоторые новые способы лечения проходят клинические испытание. Клиническое испытание - это исследовательское изучение, целью которого является улучшение стандартного способа лечения или получение информации о результатах новых способов лечения онкобольных. Если клинические испытания показывают, что новый способ лечения лучше, чем стандартный, новый способ лечения может впоследствии стать стандартным способом лечения. Пациенты также могут принимать участие в клинических испытаниях. В некоторых клинических испытаниях могут принимать участия только пациенты, которые не проходили никакого лечения.
Лечение взрослого острого лимфобластного лейкоза обычно проходит в два этапа.
Этапы лечение взрослого острого лимфобластного лейкоза:
Ремиссионо-индукционная терапия. Цель данного этапа лечения – уничтожить лейкозные клетки в крови и костном мозгу и достичь ремиссии.
Постремиссионная терапия. Это второй этап лечения. Начинается сразу, как только удается достичь ремиссии. Цель постремиссионной терапии – уничтожить оставшиеся лейкозные клетки, которые могут быть и не активными, но впоследствии могут начать расти и это приведет к рецидиву. Этот этап называется также продолжением ремиссионнной терапии.
Лечебно-профилактическая терапия центральной нервной системы обычно проводится на каждом этапе лечения. Из-за того, что химиотерапевтические препараты принимаются перорально или делаются инъекции внутривенно, лекарственное вещество часто не может уничтожить лейкозные клетки, попавшие в ЦНС – центральную нервную систему (мозг и спинной мозг). Лейкозные клетки находят «убежище» (прячутся) в центральной нервной системе. Интратекальная химиотерапия и радиационная терапия могут уничтожить лейкозные клетки, попавшие в ЦНС, и тем самым предотвратить рецидив заболевания. Такой вид лечения называется лечебно-профилактическая терапия ЦНС.
На сегодняшний день существует четыре стандартных способа лечения:
Химиотерапия
Химиотерапия – способ лечения онкологических заболеваний сильнодействующими химиотерапевтическими препаратами. Химиотерапевтические препараты способны остановить и уничтожить рост раковых клеток, предотвратить их отделение и проникновение в другие ткани и органы. При химиотерапии лекарства могут приниматься перорально (в виде таблеток, капсул) или вводятся внутривенные или внутримышечные инъекции. Лекарственное вещество попадает в кровоток, распространяется по организму и поражает раковые клетки (систематическая химиотерапия). Если химиотерапевтические препараты вводятся непосредственно в позвоночник (интратекальная химиотерапия), орган или полость (например, брюшную), лекарственное вещество поражает главным образом раковые клетки в данных участках (региональная химиотерапия). Комбинированная химиотерапия – лечения, при котором используется более одного противоракового химиотерапевтического препарата. Способ применения химиотерапии зависит от вида и стадии онкологического заболевания.
Интратекальная химиотерапия может применяться при лечении взрослого ОЛЛ, который имеет тенденцию к распространению в мозг и спинной мозг. Терапия, применяемая во избежание распространения раковых клеток в организме и их проникновения в мозг или спинной мозг, называется лечебно-профилактическая терапия ЦНС. Интратекальная химиотерапия проводится в сочетании с обычной химиотерапией, при которой лекарственные препараты принимаются перорально или в виде инъекций.
Интратекальная химиотерапия. Противоопухолевые средства вводятся в интратекальную полость позвоночного канала, где находится цереброспинальная жидкость (ЦСЖ показана голубым на рисунке). Существует два разных способа введения химиотерапевтических препаратов. Первый способ, изображен в верхней части рисунка, лекарственный препарат вводиться в резервуаре Оммайя. (Выпуклый контейнер, который вводят в желудочки мозга. Контейнер удерживает основную часть лекарственного препарата, чтобы лекарственное вещество могло медленно поступать в мозг через маленькие трубочки). Другой метод, показан в нижней части рисунка, лекарственный препарат вводится непосредственно в цереброспинальную жидкость в позвоночный столб на уровне поясницы. Процедура проводиться под местным наркозом.
Лучевая терапия
Лучевая терапия – это способ лечения онкозаболевания, при котором используются жесткое рентгеновское излучение или другие виды радиационных излучений для уничтожения раковых клеток или предотвращения роста раковых клеток. Существует два вида лучевой терапии. Лучевая внешняя терапия – специальный аппарат фокусирует радиационное излучение в области опухоли. Лучевая внутренняя терапия – применение радиоактивных веществ, герметично запакованных в иголки, капсулы, стержни или катетеры, которые размещаются непосредственно в или возле опухоли. Лучевая внешняя терапия может применяться для лечения взрослого ОЛЛ, который имеет тенденцию к распространению в мозг и спинной мозг. Это называется лечебно-профилактическая терапия ЦНС.
Химиотерапия с последующей трансплантацией стволовых клеток
Перед трансплантацией стволовых клеток проводят химиотерапию. Трансплантация стволовых клеток применятся для замещения аномальных кровообразующих клеток полноценными. Стволовые клетки (незрелые клетки крови) берутся из крови или костного мозга пациента или донора, замораживаются и сохраняются. По завершении курса химиотерапии сохраненные стволовые клетки размораживают и вводят пациенту в виде инфузий стволовых клеток. Пересаженные стволовые клетки приживаются и помогают восстановить клетки костного мозга, продуцирующие клетки крови.
Терапия ингибитором тирозин киназы
Противораковые лекарственные препараты, называемые ингибиторами тирозин киназы, используются для лечения некоторых видов взрослого ОЛЛ. Препарат блокирует фермент, тирозин киназа, который способствует развитию из стволовых клеток большого количества лейкоцитов (гранулоцитов или бластных клеток). На сегодняшний день применяются два таких препарата Иматиниб (Гливек) (imatinib mesylate) (Gleevec) и Дасатиниб.
Некоторые новые способы лечения проходят клинические испытания.
Этот раздел описывает виды лечения, которые находятся на стадии клинических испытаний. Невозможно рассказать обо всех новых способах лечения, которые изучаются. Информация о клинических испытаниях доступна на сайте NCI
Биологическая терапия
Биологическая терапия – это способ лечения, который задействует иммунную систему пациента в борьбе с онкологическим заболеванием. Вещества, которые вырабатываются в организме или которые синтезируются в лаборатории, используются для стимулирования или восстановления природных механизмов защиты и борьбы с онкозаболеваниями. Такой вид лечения онкозаболевания также называется биотерапией или иммунотерапией.
Пациенты также могут принимать участие в клинических испытаниях.
Для некоторых пациентов участие в клинических испытаниях - это наилучший выбор. Клинические испытания являются частью исследовательского процесса. Цель проведения клинических испытаний установить: является ли новый способ лечения безопасным и эффективным или более лучшим, чем стандартный способ лечения.
Многие из нынешних стандартных способов лечения основаны на результатах раннее проведенных клинических испытаний. Пациенты, принимающие участие в клинических испытаниях, могут получать стандартное лечение или проходить курс нового способа лечения.
Пациенты, которые принимают участие в клинических испытаниях, вносят большой вклад в исследования и помогают улучшить способ лечения рака в будущем. Даже, если результаты клинических испытаний не свидетельствуют об эффективности нового способа лечения, но они часто дают ответы на очень важные вопросы и помогают продвигать исследования на шаг вперед.
Пациенты могут участвовать в клинических испытаниях перед, во время и после того, как они начали проходить курс лечения.
В некоторых клинических испытаниях могут принимать участие только пациенты, которые не проходили никакого лечения. Пациенты, у которых заболевание не поддается лечению, также могут участвовать в клинических испытаниях. Существуют также клинические испытания, которые исследуют новые способы предотвращения рецидива или устранения побочных эффектов, возникающих вследствие лечения рака.
Проведение повторного обследования.
Некоторые анализы, которые были сделаны для диагностики рака или стадии или формы заболевания могут быть сделаны повторно. Иногда анализы проводятся повторно, чтобы проследить за эффективностью лечения. Решение о продолжении, изменении или прекращении лечения основывается на результатах этих анализов.
Некоторые анализы необходимо делать время от времени и после окончания лечения. Результаты анализов могут показать изменение состояния пациента или наличие рецидива заболевания. Иногда такие анализы называют контрольными.
Профилактика Острого лимфобластного лейкоза:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Острого лимфобластного лейкоза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
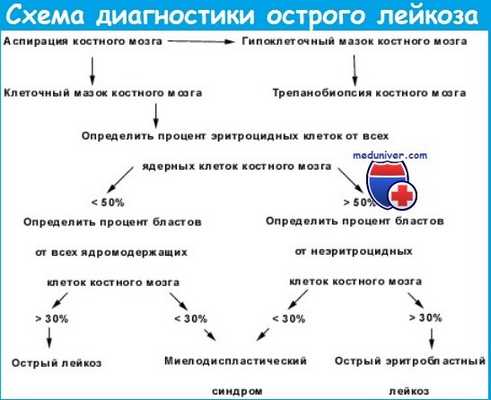
Алгоритм диагностики острых лейкозов
Как отмечалось, современный алгоритм диагностики вариантов острых лейкозов включает морфологический, цитохимический, иммунологический и цитогенетический, а иногда и молекулярно-биологический подходы. В то же время следует подчеркнуть, что морфологическая оценка состава пунктата является базовой при диагностике острых лейкозов.
Без подсчета миелограммы и анализа морфологических и цитохимических особенностей клеток лейкемического субстрата нельзя интерпретировать данные иммунологического и цитогенетического исследований.
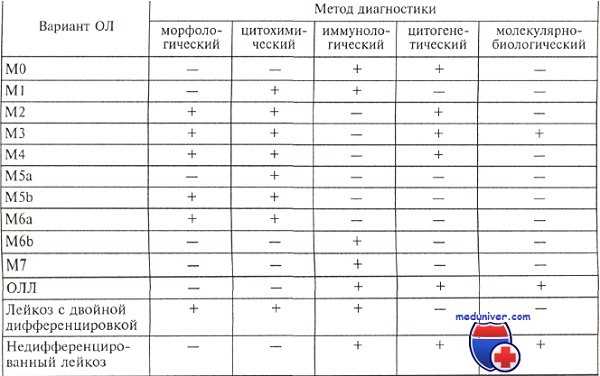
Диагностическая ценность каждого метода для разных вариантов различна. Так, морфоцитохимическими методами можно охарактеризовать большинство вариантов (до 90 %) M1—М5 острого нелимфобластного лейкоза. Однако М0, М7 и часть случаев М6 диагностируются только иммунологическим методом, так же как и острый лимфобластный лейкоз.
Применение иммунофенотипирования для диагностики острых лейкозов с помощью панели МКА позволяет определить линейную направленность и/ или этап дифференцировки бластов начиная с уровня стволовых предшественников до зрелых форм. Оно производится с помощью проточных анализаторов или на мазках костного мозга пероксидазно-антипероксидазным (РАР) или фосфатазно-антифосфатазным (АРАР) методом.
Каждый из методов имеет свои преимущества. Использование проточного анализатора позволяет получить данные о десятках тысяч клеток в лейкемической популяции, исследование клеток на мазках дает возможность сочетать иммунологическое исследование с морфологическим и цитохимическим.
Методические подходы при острых лейкозах
Широко принятый в настоящее время иммунологический подход расширяет наше понимание биологии бластных клеток при острых лейкозах. Появление новых МКА позволяет выделять дополнительные субтипы бластов. В частности, применение нового антимоноцитарно-макрофагального МКА D11 (CD68) дало возможность выявить миелоидную дифференцировку в клетках, расцениваемых ранее как недифференцированные. Данные, полученные при исследовании механизмов апоптоза, сыграли важную роль в изучении прогноза острого лимфолейкоза.
Существует точка зрения, что вариант лейкоза можно установить только на основании иммунологических критериев, не используя морфоцитохими-ческие данные. Этот подход в настоящее время не нашел поддержки, так как определяющей специфичностью обладают только МКА к миелоперокси-дазе и лизоциму, а все остальные антигены не столь специфичны.
Все большее значение в изучении патогенетических механизмов острого лейкоза приобретают молекулярно-биологические методы. Ряд наблюдений уже используется в практической медицине для диагностики вариантов острого лейкоза. Исследование перестройки генов иммуноглобулинов и Т-клеточных рецепторов играет важную роль в дифференциальной диагностике лимфопролиферативных заболеваний.
Характеристика аномалий кариотипа при остром промиелоцитарном и миеломонобластном с эозинофилией лейкозах с учетом данных цитогенетического исследования и PCR-реакции позволяет установить субвариант лейкоза и определить прогноз заболевания.
Острый миелоидный лейкоз
Острый миелоидный лейкоз – злокачественное заболевание системы крови, сопровождающееся неконтролируемым размножением измененных лейкоцитов, снижением количества эритроцитов, тромбоцитов и нормальных лейкоцитов. Проявляется повышенной склонностью к развитию инфекций, лихорадкой, быстрой утомляемостью, потерей веса, анемией, кровоточивостью, образованием петехий и гематом, болями в костях и суставах. Иногда выявляются изменения кожи и припухлость десен. Диагноз устанавливается на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, трансплантация костного мозга.
МКБ-10
Общие сведения
Острый миелоидный лейкоз (ОМЛ) – злокачественное поражение миелоидного ростка крови. Неконтролируемая пролиферация лейкозных клеток в костном мозге влечет за собой подавление остальных ростков крови. В результате количество нормальных клеток в периферической крови уменьшается, возникают анемия и тромбоцитопения. Острый миелоидный лейкоз является самым распространенным острым лейкозом у взрослых. Вероятность развития болезни резко увеличивается после 50 лет. Средний возраст пациентов составляет 63 года. Мужчины и женщины молодого и среднего возраста страдают одинаково часто. В старшей возрастной группе наблюдается преобладание лиц мужского пола. Прогноз зависит от вида острого миелоидного лейкоза, пятилетняя выживаемость колеблется от 15 до 70%. Лечение осуществляют специалисты в области онкологии и гематологии.
Причины острого миелоидного лейкоза
Непосредственной причиной развития ОМЛ являются различные хромосомные нарушения. В числе факторов риска, способствующих развитию таких нарушений, указывают неблагоприятную наследственность, ионизирующее излучение, контакт с некоторыми токсическими веществами, прием ряда лекарственных препаратов, курение и болезни крови. Вероятность возникновения острого миелоидного лейкоза увеличивается при синдроме Блума (низкий рост, высокий голос, характерные черты лица и разнообразные кожные проявления, в том числе гипо- или гиперпигментация, кожная сыпь, ихтиоз, гипертрихоз) и анемии Фанкони (низкий рост, дефекты пигментации, неврологические расстройства, аномалии скелета, сердца, почек и половых органов).
Острый миелоидный лейкоз достаточно часто развивается у больных с синдромом Дауна. Прослеживается также наследственная предрасположенность при отсутствии генетических заболеваний. При ОМЛ у близких родственников вероятность возникновения болезни повышается в 5 раз по сравнению со средними показателями по популяции. Самый высокий уровень корреляции выявляется у однояйцевых близнецов. Если острый миелоидный лейкоз диагностируется у одного близнеца, риск у второго составляет 25%. Одним из важнейших факторов, провоцирующих ОМЛ, являются заболевания крови. Хронический миелоидный лейкоз в 80% случаев трансформируется в острую форму болезни. Кроме того, ОМЛ нередко становится исходом миелодиспластического синдрома.
Ионизирующее излучение вызывает острые миелоидные лейкозы при превышении дозы 1 Гр. Заболеваемость увеличивается пропорционально дозе облучения. На практике имеет значение пребывание в зонах атомных взрывов и аварий на атомных электростанциях, работа с источниками излучения без соответствующих защитных средств и радиотерапия, применяемая при лечении некоторых онкологических заболеваний. Причиной развития острого миелоидного лейкоза при контакте с токсическими веществами является аплазия костного мозга в результате мутаций и поражения стволовых клеток. Доказано негативное влияние толуола и бензола. Обычно ОМЛ и другие острые лейкозы диагностируются спустя 1-5 лет после контакта с мутагеном.
В числе лекарственных средств, способных провоцировать острые миелоидные лейкозы, специалисты называют некоторые препараты для химиотерапии, в том числе ингибиторы ДНК-топоизомеразы II (тенипозид, этопозид, доксорубицин и другие антрациклины) и алкилирующие средства (тиофосфамид, эмбихин, циклофосфамид, хлорамбуцил, кармустин, бусульфан). ОМЛ также может возникать после приема хлорамфеникола, фенилбутазона и препаратов мышьяка. Доля лекарственных острых миелоидных лейкозов составляет 10-20% от общего количества случаев заболевания. Курение не только повышает вероятность развития ОМЛ, но и ухудшает прогноз. Средняя пятилетняя выживаемость и продолжительность полных ремиссий у курильщиков ниже, чем у некурящих.
Классификация острого миелоидного лейкоза
Классификация острого миелоидного лейкоза по версии ВОЗ очень сложна и включает в себя несколько десятков разновидностей заболевания, разделенных на следующие группы:
- ОМЛ с типичными генетическими изменениями.
- ОМЛ с изменениями, обусловленными дисплазией.
- Вторичные острые миелоидные лейкозы, возникшие в результате лечения других заболеваний.
- Болезни с пролиферацией миелоидного ростка при синдроме Дауна.
- Миелоидная саркома.
- Бластная плазмацитоидная дендритноклеточная опухоль.
- Другие виды острого миелоидного лейкоза.
Тактика лечения, прогноз и продолжительность ремиссий при разных видах ОМЛ могут существенно различаться.
Симптомы острого миелоидного лейкоза
Клиническая картина включает в себя токсический, геморрагический, анемический синдромы и синдром инфекционных осложнений. На ранних стадиях проявления острого миелоидного лейкоза неспецифичны. Отмечается повышение температуры без признаков катарального воспаления, слабость, утомляемость, потеря веса и аппетита. При анемии присоединяются головокружения, обморочные состояния и бледность кожных покровов. При тромбоцитопении наблюдаются повышенная кровоточивость и петехиальные кровоизлияния. Возможно образование гематом при незначительных ушибах. При лейкопении возникают инфекционные осложнения: частые нагноения ран и царапин, упорные повторные воспаления носоглотки и т. д.
В отличие от острого лимфобластного лейкоза при остром миелоидном лейкозе отсутствуют выраженные изменения со стороны периферических лимфатических узлов. Лимфоузлы небольшие, подвижные, безболезненные. Иногда выявляется увеличение лимфатических узлов в шейно-надключичной области. Печень и селезенка в пределах нормы или незначительно увеличены. Характерны признаки поражения костно-суставного аппарата. Многие больные острым миелоидным лейкозом предъявляют жалобы на боли различной степени интенсивности в области позвоночника и нижних конечностей. Возможны ограничения движений и изменения походки.
В числе экстрамедуллярных проявлений острого миелоидного лейкоза – гингивит и экзофтальм. В отдельных случаях наблюдаются припухлость десен и увеличение небных миндалин в результате инфильтрации лейкозными клетками. При миелоидной саркоме (составляет около 10% от общего количества случаев острого миелоидного лейкоза) на коже пациентов появляются зеленоватые, реже – розовые, серые, белые или коричневые опухолевидные образования (хлоромы, кожные лейкемиды). Иногда при поражениях кожи обнаруживается паранеопластический синдром (синдром Свита), который проявляется воспалением кожных покровов вокруг лейкемидов.
В развитии острого миелоидного лейкоза выделяют пять периодов: начальный или доклинический, разгара, ремиссии, рецидива и терминальный. В начальном периоде острый миелоидный лейкоз протекает бессимптомно или проявляется неспецифической симптоматикой. В периоде разгара токсический синдром становится более выраженным, выявляются анемический, геморрагический и инфекционный синдромы. В период ремиссии проявления острого миелоидного лейкоза исчезают. Рецидивы протекают аналогично периоду разгара. Терминальный период сопровождается прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика и лечение острого миелоидного лейкоза
Решающую роль в процессе диагностики играют лабораторные анализы. Используют анализ периферической крови, миелограмму, микроскопические и цитогенетические исследования. Для получения образца тканей выполняют аспирационную биопсию костного мозга (стернальную пункцию). В анализе периферической крови больного острым миелоидным лейкозом обнаруживается снижение количества эритроцитов и тромбоцитов. Количество лейкоцитов может быть как повышенным, так и (реже) пониженным. В мазках могут выявляться бласты. Основанием для постановки диагноза «острый миелоидный лейкоз» становится обнаружение более 20% бластных клеток в крови либо в костном мозге.
Основой лечения острого миелоидного лейкоза является химиотерапия. Выделяют два этапа лечения: индукцию и консолидацию (постремиссионную терапию). На этапе индукции выполняют лечебные мероприятия, направленные на уменьшение количества лейкозных клеток и достижение состояния ремиссии. На этапе консолидации устраняют остаточные явления болезни и предотвращают рецидивы. Лечебную тактику определяют в зависимости от вида острого миелоидного лейкоза, общего состояния больного и некоторых других факторов.
Наиболее популярная схема индукционного лечения – «7+3», предусматривающая непрерывное внутривенное введение цитарабина в течение 7 дней в сочетании с одновременным быстрым периодическим введением антрациклинового антибиотика в течение первых 3 дней. Наряду с этой схемой в процессе лечения острого миелоидного лейкоза могут применяться другие лечебные программы. При наличии тяжелых соматических заболеваний и высоком риске развития инфекционных осложнений в результате подавления миелоидного ростка (обычно – у больных старческого возраста) используют менее интенсивную паллиативную терапию.
Программы индукции позволяет добиться ремиссии у 50-70% пациентов с острым миелоидным лейкозом. Однако без дальнейшей консолидации у большинства больных наступает рецидив, поэтому второй этап лечения рассматривается, как обязательная часть терапии. План консолидационного лечения острого миелоидного лейкоза составляется индивидуально и включает в себя 3-5 курсов химиотерапии. При высоком риске рецидивирования и уже развившихся рецидивах показана трансплантация костного мозга. Другие методы лечения рецидивных ОМЛ пока находятся в стадии клинических испытаний.
Прогноз острого миелоидного лейкоза
Прогноз определятся разновидностью острого миелоидного лейкоза, возрастом больного, наличием или отсутствием миелодиспластического синдрома в анамнезе. Средняя пятилетняя выживаемость при разных формах ОМЛ колеблется от 15 до 70%, вероятность развития рецидивов – от 33 до 78%. У пожилых людей прогноз хуже, чем у молодых, что объясняется наличием сопутствующих соматических заболеваний, являющихся противопоказанием для проведения интенсивной химиотерапии. При миелодиспластическом синдроме прогноз хуже, чем при первичном остром миелоидном лейкозе и ОМЛ, возникшем на фоне фармакотерапии по поводу других онкологических заболеваний.
Читайте также:
- Первичная аменорея при синдроме Лоренса — Муна — Бидля, болезни Хенда — Шюллера — Крисчена
- Недостаточное питание
- Лучевые признаки расширения и тромбоза межворсинчатого пространства плаценты
- Дермолипома конъюнктивы и глазницы: признаки, гистология, лечение, прогноз
- Лицевой нерв эмбриона. Слуховой нерв плода
