Парентеральное питание в хирургии. Принципы парентерального питания
Добавил пользователь Дмитрий К. Обновлено: 22.01.2026
Для цитирования: Снеговой А.В., Сельчук В.Ю., Салтанов А.И. Парентеральное питание. Аминокислоты. РМЖ. 2007;14:1110.
Введение Название протеина произошло от греческого слова «proteno» – первый. Первоначальную идентификацию белка как класса осуществил Mulder в 1838 году, а Ф. Энгельс определил жизнь, как форму существования белковых тел, так как каждая клетка в организме частично состоит из белков, играющих важную роль в постоянном цикле обмена веществ. Известно, что белки состоят из больших молекул весом от 1 тыс. Дальтон до более чем 1 млн. Дальтон. Они могут быть расщеплены с помощью гидролиза на простые элементы – аминокислоты, которые являются пластическим материалом для «строительства» белков.
Название протеина произошло от греческого слова «proteno» – первый. Первоначальную идентификацию белка как класса осуществил Mulder в 1838 году, а Ф. Энгельс определил жизнь, как форму существования белковых тел, так как каждая клетка в организме частично состоит из белков, играющих важную роль в постоянном цикле обмена веществ. Известно, что белки состоят из больших молекул весом от 1 тыс. Дальтон до более чем 1 млн. Дальтон. Они могут быть расщеплены с помощью гидролиза на простые элементы – аминокислоты, которые являются пластическим материалом для «строительства» белков.
Аминокислоты состоят из карбоксильной (СООН) группы с кислотными свойствами и аминогруппы (NH2) с основными свойствами. В биологических материалах обнаружено 20 аминокислот:
1. Аланин
2. Валин
3. Изолейцин
4. Лейцин
5. Метионин
6. Пролин
7. Триптофан
8. Фенилаланин
9. Аргинин
10. Теронин
11. Лизин
12. Гистидин
13. Цистеин
14. Глутаминовая кислота
15. Глицин
16. Серин
17. Аспарагиновая кислота
18. Тирозин
19. Аспарагин
20. Глутамин.
В молекуле белка аминокислоты связаны друг с другом пептидной связью, в которой аминогруппа одной аминокислоты связывается с карбоксильной группой другой аминокислоты.
Биосинтез аминокислот
В ходе эволюции млекопитающие утратили способность к синтезу примерно половины из 20 протеиногенных аминокислот. Эти аминокислоты были названы незаменимыми аминокислотами и должны поступать с пищей. К ним относятся валин и изолейцин, а также лейцин, треонин, метионин и лизин. Вокруг гистидина и аргинина ведутся споры, являются ли они незаменимыми для человека. Питательная ценность белков решающим образом зависит от содержания незаменимых аминокислот. Растительные белки зачастую бедны лизином или метионином. В то же время животные белки содержат все аминокислоты в сбалансированных соотношениях.
Деградация аминокислот
Деградации подвергаются углеродные скелеты белковых аминокислот. В итоге образуются метаболиты (рис. 1) [1]:
1. Оксалоацетат
2. Фумарат
3. Сукцинил–Ко–А
4 2–Оксоглутарат
5. Пируват
6. Ацетил–Ко–А
7. Ацетоацетат
2–оксоглутарат, сукцинил–Ко–А, фумарат, оксалоацетат и пируват являются предшественниками в процессе глюконеогенеза и участвуют в цитратном цикле. Аминокислоты, при деградации которых образуется один из пяти метаболитов, называются глюкогенными аминокислотами (кроме лизина и лейцина).
Два других продукта распада (ацетоацетат и ацетил–КоА) не могут включаться в глюконеогенез. Они используются для синтеза кетоновых тел, жирных кислот. Следовательно, если при деградации аминокислот образуется ацетил–КоА или ацетоацетат, это кетогенные аминокислоты. К ним относятся лейцин и лизин. Есть аминокислоты, которые являются одновременно и кетогенными, и глюкогенными – это фенилаланин, тирозин, триптофан и изолейцин.
Биологические функции аминокислот [1]
1. Стpуктуpные элементы пептидов и белков
В состав белков входят 20 протеиногенных аминокислот, которые кодиpyютcя генетическим кодом и определяются в белках. Некоторые из них мoгyт быть фocфopилиpовaны, aцилиpoваны или гидpoксилирoваны.
2. Структурные элeмeнты дpyгих природных соeдинeний
Аминoкиcлoты и их производные входят в cocтaв антибиотиков, коферментов, желчных кислот.
3. Пepeнoсчики сигналов
Некоторые являются нейромедиаторами или предшественниками медиаторов и гормонов.
4. Метаболиты
Аминoкиcлоты — важнейшие, а некоторые из них жизненно необходимые компоненты питания. Аминoкиcлoты участвуют в обмене веществ (нaпpимep, являются донорами азота).
Синтез и обмен белка
В организме белки образуются из смеси аминокислот. Количество синтезируемого белка за сутки зависит от потребностей в нем организма, образования пищеварительных и других ферментов и прочих причин. Так, известно, что альбумин плазмы крови синтезируется со скоростью 10 г в сутки, а общее количество белка у человека массой тела 70 кг составляет 10 кг. При этом большая его часть находится в мышцах. Общий обмен белка в организме определяется понятием «азотистого баланса». Это разница между поступлением азота и его выделением. Важность понятия азотистого баланса обусловлена тем, что позволяет правильного судить о характере метаболических изменений, происходящих в организме больного (потеря с мочой 20 г азота соответствует распаду 125 г белка). В организме здорового человека азотистый баланс в целом сбалансирован, то есть количества поступающего и выделяемого белкового азота примерно равны. При заболевании азотистый баланс – отрицательный.
Полученные с пищей белки подвергаются полному гидролизу в желудочно–кишечном тракте до аминокислот, которые всасываются и кровотоком распределяются в организме. Через кишечник и в небольшом объеме также через почки организм постоянно теряет белок. В связи с этими неизбежными потерями ежедневно необходимо получать с пищей не менее 30 г белка.
Аминокислоты не запасаются в организме, при избыточном поступлении аминокислот в печени они окисляются. Содержащийся в них азот превращается в мочевину и в этой форме выделяется с мочой, а углеродный скелет используется в синтезе углеводов, липидов или окисляется с образованием АТФ [1].
Высокий оборот белка в организме необходим потому, что многие белки относительно недолговечны: они начинают обновляться спустя несколько часов после синтеза, а биохимический полупериод составляет 2–8 дней. Ключевые ферменты являются еще более короткоживущими: они обновляются спустя несколько часов после синтеза. Это постоянное разрушение и ресинтез позволяют клеткам быстро приводить в соответствие с метаболическими потребностями уровень и активность наиболее важных ферментов. В противоположность этому особенно долговечны структурные белки, гистоны, гемоглобин или компоненты цитоскелета [1].
Почти все клетки способны осуществлять биосинтез белков (рис. 2) [1]. Построение пептидной цепи происходит путем трансляции на рибосоме. Однако активные формы большинства белков возникают только после ряда дальнейших шагов. Прежде всего при помощи вспомогательных белков шаперонов должна сложиться биологически активная конформация пептидной цепи (свертывание). При посттрансляционном созревании у многих белков удаляются части пептидной цепи или присоединяются дополнительные группы (например, олигосахариды или липиды). Эти процессы происходят в эндоплазматическом ретикулуме и в аппарате Гольджи. Наконец, белки должны транспортироваться в соответствующую ткань или орган [1].
Некоторые общие особенности белкового
метаболизма больных, находящихся
в различных критических состояниях
(онкологические заболевания, травмы,
операции, ожоги и др.)
Общая схема метаболизма построена на двух основных состояниях. Это анаболизм, когда преобладают процессы синтеза и катаболизм, когда преобладают процессы распада. Наиболее известным гормоном, активирующим анаболизм, является инсулин. В противоположность этому адреналин, кортизол, глюкагон усиливают катаболизм.
Катаболическая фаза обмена характеризуется преобладанием распада белка над его синтезом и прогрессирующим нарастанием отрицательного азотистого баланса. Если выраженный отрицательный азотистый баланс продолжается более 2–3 недель, это может привести к развитию полиорганной недостаточности и смерти больного. Важно отметить, что отрицательный азотистый баланс возникает на фоне недостаточного поступления азота (белка) извне.
Интенсивность распада белка обусловливается изменениями, происходящими в метаболизме больных, находящихся в критических состояниях. Во–первых, быстро истощаются запасы углеводов в организме (запасы гликогена в печени 150–200 г, в мышцах до 600 г, т.е. суммарно около 800 г = 3.200 ккал). Во–вторых, максимальная возможная утилизация жирных кислот из депо составляет не более 500 ккал/сут. Таким образом, если представить, что больному человеку в сутки требуется около 2500–3000 ккал, то, начиная со 2–3–х суток «вынужденного голодания», нарастает отрицательный азотистый баланс, что может привести к развитию полиорганной недостаточности.
В том случае, если больной не получает адекватной нутритивной поддержки, происходит интенсивная утилизация белков (протеолиз) из депо (висцеральных органов, мышц – гладких, межреберных, сердечной, поперечно–полосатой) плазмы крови. Образующиеся аминокислоты используются печенью для глюконеогенеза (рис. 3) [2].
Процесс этот обычно напрямую зависит от тяжести состояния пациента и длительности заболевания. Поскольку поступление белка в организм больного, находящегося в критическом состоянии, ничтожно мало или вообще отсутствует, становится очевидным «аутоканибализм». Его основными «чертами» являются:
1. Гиперметаболизм (белковый катаболизм).
2. Неадекватное потребление энергосубстратов и пластического материала.
3. Резистентность к натуральным питательным веществам.
Необходимо отличать простое голодание от нутритивной (питательной, белково–энергетической) недостаточности. Основные отличия представлены на рисунке 4 и в таблице 1 [3].
На рисунке 4 видно, что при простом голодании (когда человек здоров) происходит снижение энергетических потребностей и количества поступающих ккал/с и азота (белка)/с, то есть не формируется отрицательный азотистый баланс. В критическом состоянии у пациента практически всегда есть дисбаланс между энергетическими потребностями и количеством поступающих ккал и белка, что приводит к формированию отрицательного азотистого баланса и нарастающий нутритивной недостаточности. Эти данные подтверждаются отличиями, представленными в таблице 1.
Вывод. Необходимо понимать, что все изменения в метаболизме больного, находящегося в критическом состоянии, могут рассматриваться, как защита от белкового истощения, направленная на выживание больного. Однако эти процессы, как видно из вышеизложенного, небезграничны. Поэтому задачей врача является адекватная, своевременная диагностика этих изменений и терапия с помощью нутритивной поддержки и/или нутритивной терапии.
Нутритивная поддержка
К данному виду терапии относится энтеральное и парентеральное питание. Наиболее часто, особенно в первые двое суток лечения больного, в структуре нутритивной поддержки преобладает парентеральное питание. Препараты для парентерального питания делятся на энергетические (углеводы и жировые эмульсии) и пластические донаторы (аминокислотные препараты). Рекомендации по мониторингу пациентов, получающих нутритивную поддержку, представлены в таблице 2.
Аминокислотные препараты (АКп)
Современные препараты, содержащие аминокислоты для парентерального питания, отвечают постоянно меняющимся данным о патофизиологии нутритивной недостаточности. Одним из важнейших требований к АКп является наличие в их составе незаменимых аминокислот. В современных АКп процент незаменимых аминокислот к общему числу составляет 45–46% [4]. В последнее время важным аспектом является обязательное включение в состав АКп заменимых аминокислот, так как это способствует более эффективному синтезу белка. Сегодня доказано, что определенные аминокислоты способны к специфической фармакодинамике, т.е. обладают определенной «тропностью, сродством» [4]. Цистеин – производное для синтеза глутамина, регулирует синтез глутатиона, активного внутриклеточного антиоксиданта, защищающего печень в норме и особенно при ее патологии. Таурин – метаболит цистеина. Стабилизирует мембранный потенциал, участвует в передаче нервного импульса и регуляции обмена желчных кислот. Фенилаланин – источник тирозина, который является предшественником синтеза катехоламинов, гормонов щитовидной железы, меланина. Триптофан – предшественник НАД и НАДН. Лизин и серин – особенно необходимы для синтеза белка. Пролин – компонент коллагена. Гистидин – является нейромедиатором. Аргинин – может улучшать иммунный статус, способствовать заживлению ран. Глутаминовая кислота – фактор для синтеза трансмиттеров. Аланин – субстрат для глюконеогенеза. Аспарагиновая кислота – основа пиримидина, входящего в состав нуклеиновых кислот.
Следующим важным требованием к АКп является включение в их состав электролитов для профилактики возможных электролитных расстройств (снижение уровней калия, кальция, фосфатов, магния в плазме).
Осмолярность – важный показатель при выборе АКп. Если осмолярность менее 950 мосм/л, препарат можно вводить в периферические вены, что очень удобно в амбулаторно–поликлинической практике; если осмолярность АКп более 1000 мосм/л, препараты должны вводиться в центральные вены. Необходимо отметить, что при проведении «центрального» или «периферического» парентерального питания аминокислоты обязательно вводятся параллельно с углеводными растворами +/– жировые эмульсии, для предотвращения протеолиза. При в/в введении АКп в «центральную» вену необходимо соблюдать скоростной режим введения, т.е. длительная инфузия (не менее 3–4 часов).
Всем этим требованиям удовлетворяют препараты Инфезол 40 и Инфезол 100 (фармацевтическая компания «Берлин–Хеми»). АКп полностью сбалансированы. Инфезол 40 может использоваться для «периферического и центрального» парентерального питания, а Инфезол 100 – только для введения в «центральные вены».
Состав аминокислот:
Инфезол® 40 – 1 л, L–аланин – 4 г, глицин – 7 г, L–аргинин – 4,55 г, L–аспарагиновая кислота – 2 г, L–глутаминовая кислота – 5 г, L–гистидин – 1,35 г, L–изолейцин – 2,1 г, L–лизина гидрохлорид (что соответствует 2 г L–лизина) – 2,5 г, L–метионин – 1,75 г, L–лейцин – 2,75 г, L–фенилаланин – 3,15 г, L–треонин – 1,6 г, L–триптофан – 0,5 г, L–валин – 2,25 г, ксилит – 50 г, натрия дисульфит, максимум (что соответствует 12,5 мг SO2) – 0,02 г, натрия ацетат – 3,4 г, калия хлорид – 1,86 г, магния хлорид – 0,51 г, натрия гидроксид – 0,6 г, вода для инъекций – до 1000 мл.
Инфезол® 100 – 1 л, L–аланин – 15,5 г, глицин – 7,55 г, L–аргинин – 9,66 г, L–аспарагиновая кислота – 1,91 г, L–глутаминовая кислота – 5 г, L–гистидин – 3,3 г, L–изолейцин – 5,85 г, L–лизина моноацетат (что соответствует 7,1 г L–лизина) – 10,02 г, L–метионин – 4,68 г, L–лейцин – 6,24, L–фенилаланин – 5,4 г, L–треонин – 5 г, L–триптофан – 2 г, L–валин – 5 г, L–ацетилцистеин (что соответствует 0,5 г L–цистеина) – 0,673 г, L–ацетилтирозин (что соответствует 1,62 г L–тирозина) – 2 г, L–орнитина гидрохлорид (что соответствует 1,9 г L–орнитина) – 2,42 г, L–пролин – 7,5 г, L–серин – 4,3 г, яблочная кислота – 3 г, натрия ацетат – 3,456 г, натрия хлорид – 0,625 г, натрия гидроксид – 1,324 г, калия хлорид – 3,355 г, кальция хлорид – 0,735 г, магния хлорид – 1,017 г, вода для инъекций – 921,735 г.
Электролиты:
Инфезол®40: содержание калия – 25 ммоль, натрия – 40,2 ммоль, магния – 2,5 ммоль, хлорида – 43,6 ммоль, ацетата – 25 ммоль, pH – 5,7–7, титруемой кислотности – макс. +11,6 ммоль, теоретической осмолярности – 801,8 мОсм, количества энергии – 1551 кДж, общего азота – 6,3 г.
Инфезол® 100: содержание натрия – 69 ммоль, калия – 45 ммоль, кальция – 5 ммоль, магния – 5 ммоль, хлорида – 90 ммоль, ацетата – 74 ммоль, малата – 22,4 ммоль, аминокислот – 100 г, общего азота – 15,6 г, количества энергии – 1700 кДж/400 ккал, pH – 5,9–6,3, теоретической осмолярности – 1145 мОсм.
Противопоказания для введения АКп:
• Возможность проведения энтерального питания
• Гипоксия – раО2 < 50 мм рт.ст.
• Дыхательный и метаболический ацидоз с раН < 7,2 ммоль/л; раСО2 >80 мм рт.ст.
• Шоковое состояние
• Непереносимость АКп
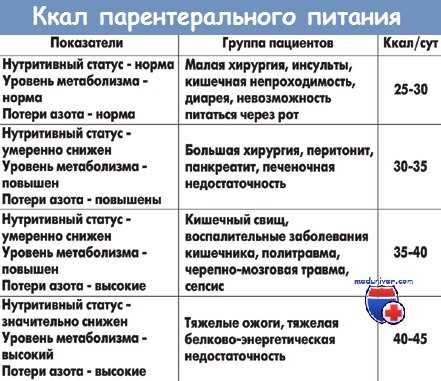
Определение потребностей для проведения нутритивной поддержки:
1 этап:
Потребность в энергии – 35 ккал/кг или 2200–2500 ккал/сут.
Потребность в белке – 1,5 г/кг/сут. или 80–100 г/сут.
2 этап:
Расчет истинных потерь белка по экскреции азота с мочой.
Потребность в белке (г) = экскреция азота с мочой (г) + 4 г (внепочечных потерь) + 2–4 г на анаболические процессы.
Потребность в энергии (ккал/сут.)=(потребность в белке (г) : 6,25) х 130
Таким образом, парентеральное питание с использованием АКп является неотъемлемой частью терапии больных, находящихся в критических состояниях. Важность и необходимость применения АКп обусловлены изменениями метаболизма и нарастающим дефицитом белка в организме больных, что может вызвать развитие полиорганной недостаточности.
Литература
1. Наглядная биохимия (эл.учебник) / Под. ред. Марри Р.
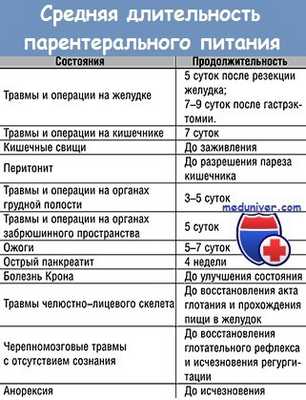
2. Искусственное питание в неотложной хирургии и травматологии / Под ред. А.С. Ермолова, М.М. Абакумова. Москва, 2001.
3. Презентация И.Н. Лейдермана «Клиническое питание–2004».
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Парентеральное питание в хирургии. Принципы парентерального питания
В зависимости от способа доставки питательных компонентов различают:
• центральное парентеральное питание — через магистральные сосуды;
• периферическое парентеральное питание — через периферические вены.
Выбор режимов парентерального питания диктуется имеющейся ситуацией и состоянием больного. При подготовке больного к хирургическому вмешательству в зависимости от его питательного статуса может быть использовано ВПП или ЧПП, которые при относительно небольших сроках проведения могут осуществляться через периферические сосуды. Послеоперационное ПП пациентов, находящихся в отделениях реанимации либо интенсивной терапии, подразумевает ППП и проводится через центральные вены; при небольших сроках использования этого метода возможно ЧПП.
При выборе способа доставки питательных компонентов следует помнить, что введение препаратов в периферические вены является только временной мерой у больных, которых в ближайшие 3—5 дней планируется перевести на энтеральное питание. При абсолютной невозможности питаться естественным путем (нарушение акта глотания, непроходимость кишечника, отсутствие полноценного усвоения, кишечные фистулы, несостоятельность анастомоза, резекции тонкой кишки, т. е. все варианты длительного ПП) используется только ППП через центральные вены. Полное периферическое ПП по сравнению с центральным требует существенно большего объема жидкости, ухудшает венозный кровоток и чревато тромбозом вен конечностей, как правило, не давая при этом адекватного белкового и калорийного обеспечения. ППП предъявляет наиболее высокие требования как к персоналу, так и к материальному обеспечению лечебного учреждения.
При этом любой из выбранных режимов подразумевает прежде всего адекватность обеспечения питательными компонентами, поэтому весьма важным процессом является определение потребности больного в питательных компонентах.
Вретлиндом и Суджяном выдвинуты три основных принципа ИЛП, не зависящих от метода доставки питательных ингредиентов:
• своевременность начала проведения ИП, ибо предупредить кахексию легче, чем ее лечить;
• оптимальность срока проведения ИП, что означает, что проводить его следует до момента стабилизации основных параметров трофического статуса — метаболических, антропометрических, иммунологических;
• адекватность проведения ИП, т. е. полноценное обеспечение пациента всеми питательными компонентами (белки, жиры, углеводы, витамины, минеральные вещества).
Парентеральное питание — метод введения питательных компонентов непосредственно в сосудистое русло и далее в печень связан с довольно большой водной нагрузкой, нарушением осмолярности и кислотно-щелочного состояния крови, вмешательством в метаболические процессы на уровне биологически активных веществ (свободные аминокислоты и жирные кислоты, триглицериды, простые сахара и т. п.). Для успешного усвоения и метаболизма вводимых основных питательных компонентов (белков, жиров, углеводов) требуется достаточное обеспечение кислородом, фосфором и другими веществами, активно влияющими на метаболические процессы. Поэтому ПП противопоказано при шоке, остром кровотечении, гипоксемии, дегидратации и гипергидратации, декомпенсации сердечной деятельности, острой почечной и печеночной недостаточности, значительных нарушениях осмолярности, кислотно-щелочного состояния (КЩС) и ионного баланса.
В то же время в практике интенсивной терапии весьма значительное и частое явление — циркуляторный шок. Независимо от этиологии шока общим для всех форм является остро наступающее уменьшение кровотока тканей с нарушением кровоснабжения клеток различных органов и расстройством микроциркуляции. Критическое уменьшение кровотока означает недостаточное снабжение кислородом тканей и нарушение притока продуктов обмена веществ и оттока шлаков. Следствием этого является нарушение или утрата нормальной функции клеток, а в крайних случаях — гибель самой клетки. Патофизиологически это означает расстройство капиллярной перфузии с недостаточным снабжением кислородом и нарушением обмена веществ клеток различных органов. Нормальное снабжение органов и тканей кислородом и питательными веществами не может поддерживаться в условиях критического падения периферического кровоснабжения. Истощается энергоснабжение, накапливаются патологические продукты обмена веществ, развиваются гипоксия и ацидоз. В отсутствие своевременного и адекватного лечения первоначально поправимые нарушения переходят в необратимые повреждения клеток и органов.
В основе нарушений гемодинамики лежат снижение объема циркулирующей крови или ее патологическое перераспределение, уменьшение внутрисосудистого давления и сердечного выброса, сочетающиеся с увеличением сопротивления току крови в периферических сосудах и сосудах легких, как следствие централизации кровообращения. Гиповолемические состояния сопровождаются нарушениями макро- и микроциркуляции.
Нарушения микроциркуляции в различных органах характеризуются изменениями реологии крови: повышается вязкость крови и плазмы, увеличивается агрегационная способность эритроцитов, возрастает уровень фибриногена. Помимо этого повышается агрегационная способность тромбоцитов и свертываемость крови, что сопровождается увеличением проницаемости сосудов.
В целом, основной проблемой при шоке является несоответствие между потребностью и возможностью обеспечения тканей и органов кислородом и другими питательными компонентами, транспортируемыми системой кровообращения.
В связи с этим собственно парентерального питания должны предшествовать ряд лечебных мероприятий, направленных на поддержание нормальной гемодинамики и реологических свойств крови, коррекцию нарушений водно-солевого и кислотно-щелочного состояний, ликвидацию гипоксемии. Критериями длительности введения кристаллоидных и плазмозамещающих растворов могут служить увеличение диуреза, коррекция гематокрита, нормализация кислотно-щелочного состояния.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Советы по парентеральному питанию
1. Что такое парентеральное питание?
Парентеральное питание — это обеспечение организма аминокислотами (4 ккал/г), глюкозой (3,4 ккал/г), жирами (20% жировая эмульсия, содержащая 2 ккал/мл), витаминами, минералами, микроэлементами, жидкостью и иногда инсулином путем внутривенной инфузии. Хлорид и ацетат поступают в организм в виде солей натрия и калия и оказывают влияние на кислотно-щелочное состояние. Во избежание образования нерастворимых фосфатов введение кальция и фосфора ограничено.
2. Каковы показания к полному парентеральному питанию (ППП)?
Полное парентеральное питание (ППП) проводится в тех случаях, когда желудочно-кишечный тракт полностью не функционирует. Это бывает при широких резекциях кишечника, синдроме “короткой кишки”, тонкокишечных свищах, непроходимости кишечника и тяжелой упорной диарее.
3. Каковы способы введения парентеральных растворов?
Растворы для центрального парентерального питания — высококонцентрированы. Их осмолярность достигает 3000 мосмоль/л, и они должны вводиться в центральную вену (обычно в подключичную и реже в бедренную). При использовании многоканального катетера один из каналов предназначается только для питательных растворов. Если парентеральное питание планируется проводить длительно, то лучше использовать специальные катетеры (например, типа Hickman или Broviac).
Однако в них нет необходимости, если центральный венозный катетер ставится в стерильных условиях, а сам больной и члены его семьи детально ознакомлены с правилами ухода за ним.
4. Что такое периферическое парентеральное питание?
Периферическое парентеральное питание осуществляется в тех случаях, когда искусственное питание планируется менее чем на 10 дней, а катетеризация центральной вены противопоказана. Растворы должны иметь низкую осмолярность (менее 800 мосмоль/л), чтобы избежать тромбоза в устье катетера. Применение близких к изотоническим растворам жировых эмульсий способствует снижению общей осмолярности растворов наряду с повышением их калорийности.
При использовании разбавленных растворов для обеспечения полноценного питания требуется введение большого объема жидкости. Поэтому периферическое парентеральное питание нежелательно проводить больным, которым показано ограничение жидкости (например, больным с сердечной недостаточностью).
5. Что такое диализное парентеральное питание (ДПП)?
Иногда ограниченное количество парентеральных растворов переливается больному во время стандартного гемодиализа. Эта методика позволяет обеспечить больному парентеральное питание при одновременном выведении из организма жидкости и мочевины. Метод можно применять у ограниченного числа больных, находящихся па гемодиализе, которые страдают кахексией и не в состоянии получить адекватное количество пищи через рот или энтерально.
6. Когда назначаются концентрированные растворы аминокислот и глюкозы?
Концентрация аминокислот в стандартных растворах обычно 8,5% (8,5 г/100мл) или 10%. Концентрированные растворы содержат 15%. Максимальная концентрация глюкозы составляет 70%, хотя в стандартных растворах для ППП чаще используется 50%-глюкоза. Максимально концентрированные растворы ППП показаны больным с сердечной недостаточностью, а также при острой почечной и печеночной недостаточности.
7. Нужно ли добавлять железо к растворам парентерального питания?
При интенсивной терапии больных острый дефицит железа возникает редко. С каждой единицей крови при гемотрансфузии больные получают 250 мг молекулярного железа. При длительном ППП может понадобиться назначение препаратов железа. В идеале железо должно поступать в организм энтеральным путем, поскольку существует высокий риск развития анафилактического шока при его внутривенном или внутримышечном введении.
8. Какие осложнения связаны с парентеральным питанием?
9. Какие факторы влияют на развитие "катетерного" сепсиса?
Все профилактические мероприятия можно разделить на 3 категории: мероприятия при:
(1) введении катетера;
(2) уходе за катетером и
(3) удалении катетера.
Во время катетеризации центральной вены кожу лучше обрабатывать хлоргекседином, а не спиртом или повидон-йодом, и использовать максимальное количество стерильных салфеток. Принято считать, что многоканальный катетер повышает риск развития сепсиса по сравнению с одноканальным катетером. Однако при рандомизированных исследованиях со строгим соблюдением протокола катетеризации вены были получены сопоставимые результаты.
Уход за катетером включает следующие компоненты:
(1) замена повязок и инфузионных систем каждые 72 часа;
(2) использование антибактериальных мазей (это спорный вопрос, по обычно мази применяются);
(3) использование марлевых повязок, которые имеют преимущества перед прозрачными стерильными наклейками, и в заключение — удаление катетера в установленные сроки заметно снижает риск катетерного сепсиса.
Однако польза от удаления катетера должна превышать риск механических осложнений при новой катетеризации вены. Замена катетера по проводнику является эффективным методом ранней диагностики инфицированности катетера или нагноения.
10. Почему на фоне парентерального питания часто развивается гипергликемия?
Сильный стресс (выброс катехоламинов), воспалительная реакция, ограниченная подвижность, сопутствующая терапия кортикостероидами и чрезмерная калорийность пищи способствуют развитию гипергликемии. Скорость инфузии глюкозы не должна превышать 5 мг/кг/мин. Для повышения иммунитета, поддержания нормальной гидратации тканей и ускорения заживления ран концентрация глюкозы в крови должна быть менее 7 ммоль/л.
11. Как лечить гипергликемию?
При повышении уровня глюкозы по сравнению с исходным, резистентности к инсулину или инсулинопении может потребоваться введение простого инсулина. Дополнительные потребности в инсулине необходимо оценивать ежедневно до начала нового сеанса ППП. Нейтральный протамин-инсулин Хагедорна применяется у больных, которые принимают пищу с равными интервалами, и не подходит для непрерывного внутривенного кормления.
12. Зачем нужны внутривенные жировые эмульсии? В каких случаях они противопоказаны?
Теоретически жировые эмульсии предназначены для предотвращения дефицита незаменимых жирных кислот. В действительности дефицит развивается редко и проявляется только спустя несколько недель. Для обеспечения потребностей в незаменимых жирных кислотах необходимо получать в виде липолевой кислоты всего 3-4% калорий (или 10% калорий в виде стандартных жировых эмульсий). Жировые эмульсии также используются в качестве дополнительного источника энергии, когда скорость инфузии глюкозы достигает 5 мг/кг/мипуту. На практике жиры расфасовываются в контейнеры по 100, 250 и 500 мл.
Жировые эмульсии противопоказаны больным с панкреатитом, вызванным гипергликемией (редкие случаи панкреатита) и при значительном повышении уровня триглицеридов в сыворотке крови (выше 500 мг/дл). В составе полноценной питательной смеси (растворы “три в одном”) жировые эмульсии остаются стабильными в течение 24 часов. Продолжительность вливания такой смеси не должна превышать 12 часов из-за возможного в ней роста бактерий.
13. Что такое синдром докармливания?
Синдром докармливания развивается при умеренных или тяжелых нарушениях питания и ограниченном запасе питательных веществ в организме. Это характерно для хронического алкоголизма, нервной анорексии или хронического голодания. При большой питательной нагрузке у больных быстро происходит клинически существенное снижение концентрации калия, фосфора, кальция и магния в крови. В основе этих изменений лежит распределение электролитов между различными средами организма. Гипергликемия обычно обусловлена угнетением секреции инсулина ниже границы нормы.
14. Как избежать синдрома докармливания?
Растворы парентерального питания должны содержать достаточное количество калия, фосфора, кальция и магния. Вначале калорийность растворов должна быть снижена на 25% за счет глюкозы. В течение 5 дней после начала парентерального питания необходимы ежедневные исследования глюкозы (до 3-4 раз в день), калия, фосфора, кальция и магния в крови.
15. Как проводится мониторинг парентерального питания?
У тяжелых больных в первые дни парентерального кормления необходимо ежедневно исследовать натрий, калий, хлор, магний, фосфор, кальций и РСО2 крови. Экспресс-анализ глюкозы крови нужно проводить каждые 6 часов. После стабилизации водно-электролитного баланса частота исследований сокращается до 1 раза в педелю. При амбулаторном полном парентеральном питании биохимические исследования крови выполняются 1 раз в месяц. Об адекватности режима питания свидетельствует хорошее заживление ран, стабильный вес тела и своевременное повышение концентрации в крови “строительных” белков (альбумина, трансферрина). На перекармливание указывает развитие резистентности к инсулину, гипертриглицеридемия, повышенные значений функциональных проб печени и гиперкапния.
16. В каком инфузионном режиме осуществляется полное парентеральное питание (ППП)?
Полное парентеральное питание чаще всего осуществляется в режиме непрерывной инфузии. В амбулаторных условиях и на дому можно проводить кормление циклами или в ночное время, если удается поддерживать нормальный уровень гидратации. При таком режиме инфузия продолжается в течение 12-18 часов.
17. Как нужно отменять полное парентеральное питание?
Если ППП нужно прекратить, скорость инфузии снижают в 2 раза в течение двух часов, затем еще в 2 раза в течение последующих двух часов, и после этого питание можно отменить. Такая “пошаговая отмена” предотвращает реактивную гипогликемию.
18. Какова стоимость парентерального питания?
Стоимость растворов парентерального питания широко варьирует в зависимости от составных компонентов. Стоимость компонентов для ППП вместе со стоимостью изготовления рецептуры готовой смеси в 10 раз превышает стоимость стандартных растворов для энтерального питания. Большинство страховых компаний не возмещают больницам разницу в стоимости парентерального и энтерального питания.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Энтеральное или парентеральное питание после операции. Энтеральное питание.
Алиментарная поддержка может быть обеспечена энтеральным (через ЖКТ) или парентеральным (внутривенным путем) питанием. Преимущества энтераль-ного питания заключаются в том, что оно менее дорого, сопряжено с меньшим количеством осложнений, с улучшением иммунного статуса и меньшей вероятностью бактериального заражения.
Преимущество парентерального питания заключается в возможности его применения при функциональной несостоятельности ЖКТ. Спорных вопросов больше не существует: если кишки работают, используйте их! Совершенно ясно, что энтеральное питание безопаснее, дешевле и более физиологично, чем парентеральное!
Энтеральное питание
Вкусная пища, принимаемая естественным путем, — идеальная ситуация для пищеварения. Пероральное питание требует, чтобы у пациента были сохранены глотательный механизм и нормальная перистальтика. У пациентов в бессознательном состоянии, находящихся на ИВЛ, главная проблема заключается не в глотании, а в том, что после абдоминальных операций желудок становится более ленивым, чем кишечник. Иными словами, после лапаротомии перистальтика кишечника восстанавливается раньше, чем желудка: кишка готова абсорбировать питание уже в первый послеоперационный день, а в желудке сохраняется замедленное опорожнение по крайней мере еще несколько дней. Поэтому ясно, что при необходимости в раннем послеоперационном питании (или если пероральный прием пищи неадекватен) пища должна поступать, минуя пищевод и желудок.

Пути энтерального питания
Когда питание через рот недоступно, остаются следующие возможности для энтерального питания:
• Назогастральный и назоэнтеральный зонд. Первый из них не используют, если желудок не функционирует. Второй доставляет пищу непосредственно в двенадцатиперстную или тощую кишку. Трансназальное введение даже узкой и мягкой трубки весьма некомфортно, может привести к травме носа, придаточных пазух, в редких случаях — к травме бронхов с последующим попаданием пищевого содержимого в плевральную полость.
• Гастростомия и трансгастроеюнальный зонд. Питательный зонд вводится оперативным путем в желудок и проводится через привратник в тощую кишку.
Это — хирургическая процедура, она связана с нарушением целостности стенки желудка. Основным осложнением, которое встречается редко, но потенциально опасно, является подтекание содержимого мимо трубки наружу или непосредственно в брюшную полость.
• Еюностомический зонд. Питательный зонд (или катетер) вводят непосредственно в проксимальную часть тощей кишки, как это изложено выше. Ясно, что введение пищи прямо в тощую кишку (а не в желудок) чревато меньшей опасностью аспирации.
Должен ли я сам устанавливать еюнальный питательный зонд?
Об этом вы должны спросить себя в конце экстренной лапаротомии. Гораздо удобнее установить зонд на этом этапе, вместо того чтобы делать это в послеоперационном периоде. Вам нужно ответить на 3 поставленных выше вопроса: какова вероятность того, что пациент сможет самостоятельно питаться через 7—10 дней; достаточно ли он упитан; какова тяжесть болезни?
Если пациент — истощенный алкоголик, которому требуется тотальная гастрэктомия с эзофагоеюноанастомозом по поводу массивного желудочно-кишечного кровотечения, это классический повод для установления питательного зонда в тощую кишку. Другой подобный пример — политравма с вовлечением грудной клетки, таза и длинных трубчатых костей и необходимостью лапа-ротомии по поводу повреждения печени. В то же время у хорошо упитанного пациента после резекции желудка введение еюнального питательного зонда не показано — потенциальный риск манипуляции превышает ее преимущества. Вы ведь не хотите вводить зонд пациенту, который в этом вовсе не нуждается?!
Парентеральное питание в хирургии
Для цитирования: Мамонтова О.А., Мартынов А.Н., Гельфанд Е.Б. Парентеральное питание в хирургии. РМЖ. 2002;4:172.
П роблема парентерального искусственного питания и в настоящее время не утратила своего значения, несмотря на возможность проведения сбалансированного энтерального питания, благодаря успехам развития медицинской фармации. Наиболее актуально парентеральное питание в хирургии, где оно является предметом пристального внимания врачей, занимающихся интенсивной терапией, так как без применения нутритивной поддержки не может быть преодолен стресс, вызванный болезнью и операцией.
Основными целями парентерального питания являются:
- обеспечение организма энергией (углеводы и липиды) и пластическим материалом (аминокислоты);
- поддержание активной белковой массы;
- восстановление имеющихся потерь;
- коррекция гиперметаболических потерь.
Среди показаний к парентеральному питанию в хирургическом стационаре выделяют:
1. гастроэнтерологические (по ряду причин невозможно питаться через желудочно–кишечный тракт, болезнь Крона, непроходимость пищеварительного тракта);
2. метаболические (перитонит, сепсис, полиорганная недостаточность);
3. предоперационная подготовка у больных для улучшения результатов хирургического вмешательства в тех случаях, когда собственные белково–энергетические резервы ограничены.
Так запасы глюкозы в виде гликогена находятся в печени и скелетных мышцах, но при голодании истощаются через 24–36 часов, и тогда глюкоза начинает синтезироваться из аминокислот, что приводит к быстрому снижению мышечной массы. Доказано, что больной с сепсисом теряет в сутки до 1 кг массы тела.
В организме взрослого человека главным фактором, определяющим нормальный баланс процессов обмена веществ, является уровень соотношения между поступлением пищи и расходом энергии. Если человека лишить пищи, сразу же снижается содержание глюкозы в крови, и как следствие – снижается секреция анаболического гормона инсулина, а вместе с повышением секреции катаболического гормона глюкагона, стимулирующего гликогенолиз в печени, запасы гликогена в ней истощаются. Начиная со 2–х суток, глюкагон активирует гормоночувствительную липазу, благодаря чему высвобождается больше жирных кислот, при окислении которых возрастает уровень кетоновых тел. Однако если уровень их образования превосходит скорость утилизации, развивается метаболический ацидоз. Если голодание продолжается, то источниками энергии становятся тканевые белки. Первыми мобилизуются лабильные белки желудочно–кишечного тракта и циркулирующей крови. Затем распадаются белки внутренних органов и функциональных мышц и последними – белки нервной системы. Таким образом, голодание в известном смысле можно рассматривать как состояние, при котором организм для удовлетворения своих энергетических потребностей «пожирает сам себя».
Для назначения нутритивной поддержки необходимо ответить на вопрос: «Как рассчитать и удовлетворить белково–энергетические потребности организма?»
В клинической практике широко пользуются так называемым массо–ростовым индексом (МРИ).
МРИ= МТ(кг)/ м 2 (рост)
В норме МРИ равен 21–25 кг/м2; отчетливое снижение менее 20 кг/м2; значительное снижение – 17 кг/м2, предельное истощение – менее 16 кг/м2.
Основной обмен (ОО) в покое можно рассчитать по уравнению Харриса–Бенедикта – 66,5 + (13,75 x М) + (5 x Р) – (6,7 x В), где М – масса тела, Р – рост в см, В – возраст.
Расчет действительной энергетической потребности больного (ДПЭ) может быть произведен по формуле –
ДПЭ = ОО x ФА x ФУ x ТФ x ДМТ
ФА – фактор активности: постельный режим – 1,1 полупостельный – 1,2 ходячий – 1,3
ТФ – температурный фактор: 38,0°С –1,1 39,0°С – 1,2 40,0°С – 1,3 41,0°С – 1,4.
ФУ (увечья, повреждения): после небольших операций – 1,1 большие операции – 1,3 перитонит – 1,4 сепсис – 1,5 множественная травма – 1,6 черепно–мозговая травма – 1,7.
С целью ориентировочной характеристики отклонения питательного статуса введено понятие о так называемой идеальной массе тела (ИМТ).
ИМТ= Рост (см) – 100
Отношение фактической массы тела (ФМТ) к идеальной массе тела (ИМТ) выражается в %. Снижение ФМТ/ИМТ до 80% – слабая степень белково–энергетической недостаточности (БЭНП); снижение в пределах 80–70% – умеренная недостаточность; снижение до 70% и менее – тяжелая степень БЭНП.
Среди множества лабораторных показателей, необходимых для оценки питательного статуса, особое место занимают исследования показателей белкового обмена. Некоторые из них, такие как содержание сывороточного альбумина, трансферрина, преальбумины и протеинов, связанных с ретинолом, отражают запасы висцеральных протеинов. Протеиновые маркеры питательного статуса представлены в таблице 1.
Снижение концентрации этих протеинов в сыворотке происходит в результате повышенного катаболизма и снижения синтеза белков. Наибольшую информативность содержат лабильные белки с коротким периодом полужизни – преальбумины.
Одним из наиболее полезных биохимических показателей в оценке питательного статуса, эффективности проводимой нутритивной терапии считается креатинин, 98% которого содержится в скелетных мышцах, преимущественно в виде креатининфосфата. Для расчета мышечной массы современные клиницисты используют индекс креатинина (ИК).
ИК – это отношение суточной экскреции креатинина (г) к росту (см). В норме ИК = 10,5. При слабой степени белково–энергетической недостаточности ИК = 9,5–8,4.
Определение энергопотребности
Суточные потребности в энергии определяют по суточной потребности белка. Для этого в суточном количестве мочи определяют общее количество мочевины. Общее количество выделившегося азота за сутки в граммах = мочевина суточной мочи х 0,466 (фактор пересчета в азот мочевины). 1 г мочевины содержит 0,466 г азота. Среднее количество азота в белке составляет 16% или в 6,25 г белка содержится 1 г азота. Исходя из этого находим количество распавшего белка за сутки. Количество распавшегося белка за сутки в граммах = общий азот мочи х 6,25. На окисление 1 грамма белка требуется от 150 до 180 ккал энергии.
Основные составляющие парентерального питания
Энергию организм получает за счет углеводов и жиров. Обычное соотношение углеводов и жиров 70 и 30% соответственно. Но при ограниченных резервах дыхания это соотношение может быть изменено – 60–40% или 50–50% соответственно.
Углеводы представлены глюкозой, фруктозой, сорбитолом и ксилитолом.
Суточная потребность в глюкозе от 2 г/кг (не менее, иначе глюкоза начинает синтезироваться из аминокислот) до 6 г/кг. Скорость инфузии растворов глюкозы – 0,5 г/час или не более 100 мл 20% глюкозы в час. Инсулин показан из расчета 1 ЕД на 4–6 г глюкозы.
Дозировка сорбитола, ксилитола и фруктозы до 3 г/кг в сутки, максимальная скорость введения 0,25 г/кг в час.
Жировые эмульсии являются самым выгодным источником энергии, 1 г жира дает 9,3 ккал энергии. Жировые эмульсии обычно применяют в долговременных программах нутритивной поддержки, особенно в тех случаях, когда парентеральное питание продолжается более 5 дней и возникает необходимость в покрытии дефицита незаменимых жировых кислот.
Кроме нутритивного эффекта, жировые эмульсии осуществляют еще по крайней мере 3 важных аспекта:
- жировые эмульсии подавляют избыточную липаземию при деструктивном панкреатите в фазу эндогенной интоксикации, так как жировые эмульсии разрушаются сывороточной липазой (В.К. Гостищев и соавт., 1998 г.);
- жировые эмульсии с гепарином используются для реституции легочных сурфактантов при остром повреждении легких;
- исследования, проведенные в США (1996) доказали взаимодействие липопротеидов крови с микробныи эндотоксином, и была установлена возможность использования экзогенных липопротеидов для дезинтоксикации организма больного при сепсисе.
Доза и скорость введения: суточная доза – до 2 г/кг в сутки, при печеночной недостаточности, энцефалопатии – до 1,5 г/кг в сутки. Скорость введения до 0,15 г/кг/час.
Жировые эмульсии противопоказаны при нарушении жирового обмена; расстройствах в системе гемостаза; беременности; остром инфаркте миокарда; эмболии; нестабильном диабетическом обмене веществ; шоке.
Побочные действия: повышение температуры тела, ощущение жара или холода. Озноб, покраснение кожи, потеря аппетита, тошнота, рвота, головная боль, боли в костях.
Однако нельзя рассматривать жировые эмульсии только как источник энергии. При их применении решается вопрос снабжения организма такими незаменимыми инградиентами, как ненасыщенные жирные кислоты (линолевая и линоленовая) и жирорастворимые витамины. Построение клеточной мембраны возможно только при участии линоленовой кислоты, из которой строится арахидоновая кислота. Жирные кислоты участвуют в образовании фосфолипидов и простагландинов, метаболизме митохондрий.
Растворы аминокислот
Важнейшей составной частью организма человека являются белки, которые, помимо структурного элемента, несут функцию регуляции многих метаболических и ферментативных процессов.
Основными источниками аминного азота при парентеральном питании являются растворы кристаллических аминокислот. Их суточные дозы представлены в таблице 2. Главное требование, предъявляемое к данному классу инфузионных сред – обязательное содержание всех незаменимых аминокислот, синтез которых не может осуществляться в организме человека. Это 8 незаменимых аминокислот: изолейцин, лейцин, фенилаланин, треонин, лизин, триптофан, метионин, валин. 6 аминокислот синтезируется в организме из углеводов: аланин, глицин, серин, пролин, глутаминовая, аспарагиновая. 4 аминокислоты могут быть синтезированы в достаточном количестве, в связи с чем их относят к полузаменимым: аргинин, гистидин, тирозин и цистин. К растворам, содержащим сбалансированный состав 8 незаменимых аминокислот, относится Аминосол КЕ, который выпускается во флаконах по 500 мл. Помимо аминокислот, препарат содержит витамины (в 500 мл содержится примерно половина суточной потребности человека в витаминах группы В), сорбит и микроэлементы.
При печеночной недостаточности, вследствие нарушения метаболизма аминокислот происходит накопление в крови ароматических аминокислот (фенилаланина, триптофана, тирозина, гистидина) и снижение содержания аминокислот с разветвленной цепью (лейцин, изолейцин, валин). Многие конечные продукты способствуют развитию энцефалопатии. Риск прогрессирования процесса может быть уменьшен при снижении количества вводимых в организм белков и изменения их состава, в частности, при парентеральном применении специальных аминокислотных растворов с высоким содержанием аминокислот с разветвленной цепью и низким содержанием ароматических аминокислот (Аминостерил Н– Гепа 10%).
У больных с почечной недостаточностью наряду с азотемией наблюдается повышение в сыворотке крови калия, фосфора и магния, что необходимо учитывать при проведении парентерального питания. Ограничивается вводимый извне белок и увеличивается отношение небелковых калорий к азоту до 300:1, что способствует анаболизму и утилизации избыточного содержания в крови азотистых метаболитов. Для парентерального питания больных с почечной недостаточностью применяют растворы, содержащие только незаменимые аминокислоты.
Для парентерального питания применяются обычные растворы моновитаминов, а также специальные поливитаминные смеси для парентерального питания: Виталипид Н взрослый, солувит.
Виталипид – смесь из 4 жирорастворимых витаминов (А, Д, Е, К) для парентерального введения (вводится вместе с жировыми эмульсиями).
Солувит – сухая смесь всех водорастворимых витаминов для парентерального питания. Вводится внутривенно вместе с растворами глюкозы и жировыми эмульсиями.
Аддамел, содержащий микроэлементы хром, медь, железо, селен, магний, молибден, фтор, йод цинк, добавляют к аминокислотным смесям.
В качестве контроля эффективности терапии оценивают параметры:
- Клинические: кожа (цвет, температура, тургор, влажность)
- Гемодинамические (стабильность АД, ЧСС, ЦВД)
- Длительность пребывания
- Заживление послеоперационной раны
- Динамика веса относительно идеальной массы тела
- Динамика индекса масса/рост
- Азотистый баланс.
- Лабораторные данные. Анализ крови: глюкоза, гемоглобин, гематокрит, лейкоциты, тромбоциты, лимфоциты, КЩС, электролиты, креатинин, мочевина, альбумин, триглицериды, билирубин, осмолярность; анализ мочи: глюкоза, мочевина, осмолярность.
Читайте также:
