Переносчики лекарств и их функции
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Использование цельной крови (часто неоправданное) оказывает на организм больного сложный комплекс воздействий, последствия которых зависят от многих показателей. Один из методов, альтернативных применению аллогенной крови - использование кровезаменителей, обладающих функцией переноса газов крови. О своем опыте применения отечественных растворов кровезаменителей рассказывают директор РНИИ гематологии и трансфузиологии, член-корр. РАМН Евгений Алексеевич Селиванов, руководитель лаборатории перфторуглеродов ВМедА академик РАМН Генрих Александрович Софронов, заместитель зав. кафедрой неотложной хирургии ВМедА, профессор Михаил Дмитриевич Ханевич.
Кровь и ее компоненты по-прежнему остаются опасными биологическими продуктами, способными быть источником гемотрансмиссивных болезней, причиной развития различных посттрансфузионных реакций и осложнений.
Заготовленная на консервирующих растворах кровь в процессе хранения подвергается существенным изменениям. В ней повышается содержание натрия, калия, аммиака, фосфатов и глюкозы, нарушается кислотно-щелочное равновесие,увеличивается сродство гемоглобина к кислороду, изменяются морфофункциональные свойства эритроцитов и происходит частичный их гемолиз, появляются микроагрегаты из клеточных элементов и др.
Период хранения крови, даже при использовании самых современных гемоконсервантов, небольшой. Уже в течение первых 10 суток хранения способность крови к транспорту кислорода существенно уменьшается. Во всем мире наблюдается сокращение числа доноров, что создает проблемы с обеспечением кровью и ее дериватами. Часто кровь и ее компоненты могут быть недоступны, особенно в экстремальных ситуациях. Альтернативой цельной крови могут быть кровезаменители-переносчики кислорода (КЗПК). В настоящее время интенсивно разрабатываются два направления в их создании:
o растворы модифицированного гемоглобина (МГ),
o эмульсии перфторуглеродов (ПФУ). Эти вещества, замещая основную функцию крови - кислородтранспортную, имеют ряд преимуществ:
o не требуют изосерологического подбора,
o практически безопасны в отношении переноса инфекций,
o имеют длительный срок годности,
o их можно накапливать в больших количествах и применять немедленно.
Малый размер частиц ПФУ и молекул МГ обеспечивает доставку кислорода к клеткам ишемизированных тканей через резко суженные капилляры в условиях нарушенного микрокровотока. Существует несколько областей возможного клинического применения КЗПК:
o при обширных операциях в сердечно-сосудистой хирургии, в травматологии, ортопедии и пр., для уменьшения потребности в аллогенной крови;
o в экстренных ситуациях при восполнении острой кровопотери, когда нет времени и возможности серологического подбора крови или вообще нет доступа к ее запасам;
o в качестве компонента программы лечения апластической и гемолитической анемии;
o при нарушениях микроциркуляции, уменьшающих эффективность трансфузии эритроцитных компонентов;
o при консервировании органов и тканей;
o у пациентов, отказывающихся по религиозным соображениям от переливания крови и ее компонентов.
Препараты на основе МГ
Единственным в мире КЗПК на основе МГ, успешно прошедшим клинические испытания и разрешенным к медицинскому применению (декабрь 1998), является российский препарат "Геленпол" на основе полимеризованного гемоглобина человека. Препарат создан сотрудниками Российского НИИ гематологии и трансфузиологии МЗ РФ и НИИ высокомолекулярных соединений РАН.
С июня 1997 года в клинике неотложной хирургии ВМедА проводится клиническое изучение Геленпола. К настоящему времени препарат использован у 79 больных при лечении геморрагического шока, для коррекции интраоперационной кровопотери, до- и послеоперационной анемии. Геленпол вводили внутривенно, струйно или капельно, в объеме 1-5 доз препарата в до-, послеоперационном периоде, а также во время хирургического вмешательства. У ряда больных подобные инфузии повторяли в течение лечения 4-6 раз. Проводимый мониторинг показал, что Геленпол
o хорошо переносится и не вызывает побочных эффектов,
o обеспечивает нормализацию гемодинамических показателей,
o улучшает работу сердца,
o уменьшает степень анемии,
o увеличивает степень насыщения гемоглобина артериальной и венозной (с 32 до 44 мм рт.ст.) крови О2,
o улучшает микроциркуляцию.
Геленпол
o Молекулярная масса 150-260 кД,
o рО2 равняется 28 торр,
o одна лечебная доза кровезаменителя (в лиофильно высушенной форме) содержит 4 г гемоглобина; в качестве стабилизаторов и антиокислителей используются глюкоза и аскорбиновая кислота.
Инфузия Геленпола увеличивала содержание гемоглобина в циркулирующей крови (в среднем, с 68 до 88 г/л) и ретикулоцитов. Применение препарата позволило в 1.5-2 раза уменьшить объем трансфузии крови и эритрокомпонентов.
Перспективными направления дальнейших разработок препаратов на основе МГ являются:
o создание комплексов МГ с ферментами ангиоксидангной защиты (каталазой и супероксиддисмутазой) для предупреждения реперфузионного синдрома;
o моделирование эритроцита - изыскание стабильных форм инкапсулированного гемоглобина, заключенного вместе с компонентами своего естественного микроокружения в липосомы либо в проницаемые для продуктов метаболизма нанокапсулы из биодеградируемого материала.
Препараты на основе ПФУ
В отличие от гемоглобина, ПФУ не образуют химических соединений с кислородом, а растворяют его и другие газы согласно закону Генри. Эта связь - линейная, и степень растворения кислорода в ПФУ прямо пропорциональна его парциальному давлению (в отличие от сигмоидной кривой диссоциации оксигемоглобина).
История изучения ПФУ, как основы КЗПК, ведет свое начало от экспериментов Clark и Gollan. В 1960-х годах эти ученые показали возможность поддержания жизни мышей в жидкой перфторорганической среде, насыщенной кислородом.
ПФУ не метаболизируются в организме и считаются биологически инертными. Частицы внутривенно введенной эмульсии ПФУ быстро (в течение 4-12 часов) удаляются из сосудистого русла ретикуло-эндотелиальной системой, накапливаются в легких и селезенке с последующей экскрецией через дыхательные пути. Инфузии ПФУ в условиях кровопотери и гиповолемии:
o обеспечивают ткани кислородом,
o оказывают положительный эффект на центральную и периферическую гемодинамику, микроциркуляцию, кислотно-щелочное состояние, иммунную систему,
o обладают дезинтоксикационным, противовоспалительным свойствами и мембраностабилизирующим действием.
Перфторан широко используется в различных областях клинической практики. Был апробирован в военной медицине при лечении боевой травмы.
Наш опыт применения Перфторана для восполнения кровопотери (внутривенное введение на фоне ингаляции смеси, обогащенной кислородом) показывает, что препарат:
o увеличивает напряжение кислорода в смешанной венозной крови, что можно рассматривать как признак уменьшения гипоксии тканей (значения рvO2,не превышали физиологической нормы - 40-45 мм рт.ст., - при которой осуществляется полноценный газообмен между эритроцитами и тканями),
o улучшает микроциркуляцию и реологические свойства крови;
o улучшает состояние антиоксидантной
Использование Перфторана уменьшает расход донорской крови и ее компонентов в 1.5-2 раза.
Сравнительный анализ препаратов
Наш опыт применения в условиях одной клиники различных КЗПК - раствора полигемоглобина (Геленпол) и эмульсии ПФУ (Перфторан) позволяет сравнить возможность и эффективность их применения.
Перфторан чаще использовали по неотложным показаниям (72.8%), а Геленпол - в плановом порядке (58.3%). Это связано, в первую очередь, с тем, что препарат искусственного гемоглобина способен стимулировать гемопоэз и таким образом эффективен при лечении больных с хроническими анемиями и при подготовке больных к операции. В то же время Перфторан начинали вводить во время оперативного вмешательства после устранения источника кровотечения и убежденности в надежности гемостаза. Это касалось как экстренных, так и плановых оперативных вмешательств. Чаще всего возникала необходимость в инфузиях Перфторана и Геленпола при острой кровопотере, сопровождавшейся геморрагическим шоком. В таких случаях Перфторан был перелит 32.1 % больных, а Геленпол - 31.2%. Нередким показанием к применению КЗПК явилась интраоперационная кровопотеря. В ряде случаев препараты оказались эффективными для предупреждения декомпенсации функции жизненно важных органов и систем организма (например, при наличии постинфарктного кардиосклероза, хронических неспецифических заболеваниях легких, диффузных поражениях печени, а также при патологических изменениях мочевыделительной системы).
Имеющиеся у нас данные позволяют дифференцировать Перфторан и Геленпол по влиянию на функции различных систем организма (таблица). Установлено выраженное воздействие Перфторана на газотранспортную функцию крови, ее реологические свойства и микроциркуляцию. Отмечена достаточно высокая эффективность его влияния на гемодинамику, иммунологическую реактивность организма, процессы перекисного окисления липидов. В то же время Перфторан был нейтрален в отношении гемопоэза и свертывающей системы крови, мало участвовал в нормализации кислотно-основного состояния крови. Геленпол наибольший эффект оказывал на гемодинамику, усиливал гемопоэз и газотранспортную функцию крови. Однако Геленпол не влиял на иммунную реактивность организма, КОС крови, ее реологические свойства и микроциркуляцию.
Таблица. Сопоставление эффектов геленпола и перфторана
+++ - сильный эффект, ++ - средний эффект, + - слабый эффект, - - отсутствие эффекта
Клинические наблюдения, данные экспериментальных исследований и анализ литературы позволяют предполагать следующие механизмы лечебного действия КЗПК.
Геленпол:
o моделирует дыхательную функции эритроцитов и функции плазменных белков;
o повышает содержание гемоглобина в циркулирующей крови и его синтез;
o усиливает транспорт оксида азота (N0) и S-нитрозотиолов (SNO),
Перфторан:
o пассивный переносчик кислорода и углекислого газа пропорционально перепаду парциального давления соответствующего газа;
o усилитель потока кислорода и углекислого газа за счет увеличения их массопереноса, обусловленного повышенной растворимостью газов в ПФУ и возможностью свободного прохождения газов через частицы;
o демпфер (за счет образования дополнительной емкости для газов крови в плазме), создающий подпор для кислорода при его потреблении.
Препараты имеют как общие свойства, так и различия в действии, поэтому могут применяться раздельно и вместе, дополняя лечебный эффект друг друга. В условиях контролируемой интраоперационной кровопотери и возможности ведения пациента на смеси, обогащенной кислородом, эмульсии ПФУ, очевидно, предпочтительнее растворов МГ. В то же время для коррекции анемии в дооперационном и послеоперационном периодах целесообразно использовать Геленпол. Состояние исследований по проблеме создания КЗПК на основе МГ и эмульсий ПФУ создает уверенность в том, что эти инфузионные среды, моделирующие самую главную, кислородтранспортную функцию крови, уже в начале XXI века займут достойное место в различных программах, альтернативных применению донорской крови.
Переносчики лекарств и их функции
Лишь небольшое число молекул может проникать через клеточную мембрану без помощи специализированных белков-переносчиков.Как минимум 5% всех человеческих генов кодируют белки, участвующие в транспорте. Эти транспортные белки имеют большое значение в фармакологии, т. к. без них невозможно распределение, действие и выделен нелекарственных средств.
Группа переносчиков ABC обеспечивает активный транспорт веществ из внутренней среды функционально поляризованных клеток во внеклеточное пространство (наружные переносчики). Эти транспортные белки содержат участки, которые используют АТФ в качестве источника энергии для переноса (ATP-binding cassettes, АВС).
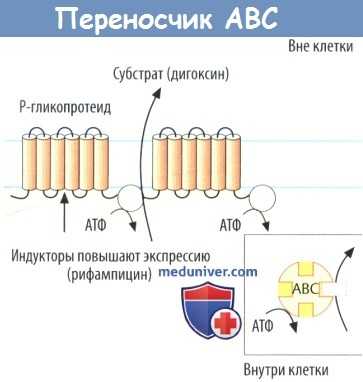
Первым в данной группе белков был открыт Р-гликопротеид (сокращения: P-gp, MDR1, ABC В1). Он может транспортировать цитостатики из культуры опухолевых клеток, тем самым снижая чувствительность к действию цитостатиков. Однако Р-гликопротеид и другие представители данной группы экспрессированы не только на опухолевых клетках, но и на клетках всего организма.
В щеточной каемке кишечного эпителия, например, он гарантирует выведение лекарственных средств и снижает биодоступность дигоксина. На стороне просвета эндотелиальных клеток капилляров головного мозга Р-гликопротеид может транспортировать лекарственные средства (антидиарейный препарат лоперамид) в кровеносное русло, тем самым ограничивая его поступление в головной мозг.
В желчных путях печени и апикальных мембранах почечных канальцев Р-гликопротеид и другие белки множественной лекарственной резистентности (MRP2, MRP3) стимулируют выделение лекарственных средств и конъюгатов. Множество лекарственных взаимодействий происходит под влиянием модуляции Р-гликопротеида и переносчиков АВС.
Ингибиторы Р-гликопротеида, например итраконазол или аторвастатин, могут увеличить биодоступность транспортируемых лекарственных средств. Такие индукторы, например рифампицин или зверобой обыкновенный, повышают экспрессию Р-гликопротеида и других белков биотрансформации (ферментов CYP450, глюкуронилтрансферазы).
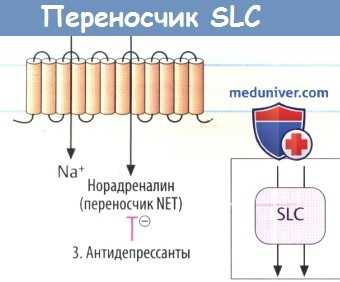
Различные транспортные процессы обусловлены белками-переносчиками растворенных веществ (SLC). Эти белки транспортируют свои субстраты как путем облегченной диффузии, так и путем активных вторичных процессов за счет градиентов веществ, создаваемых АТФазами. Например, для обмена Na + /Ca 2+ в сердце используется градиент Na + , созданный Na + /K + -АТФазой для наружного транспорта Са 2+ .
Переносчики растворенных веществ принимают большое участие в проникновении лекарственных средств и их метаболитов через поляризованные клетки. Более того, эти переносчики также являются местами действия лекарственных средств; так, например, антидепрессанты в нейронах ингибируют переносчики серотонина и/или норадреналина, которые принадлежат к группе SLC.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Проникновение лекарств через мембрану клетки
Способность проникать сквозь двойные липидные слои является условием для всасывания лекарственных средств, проникновения в клетки или в клеточные органеллы и прохождения через ГЭБ и плацентарный барьер. Благодаря амфифильной природе фосфолипиды образуют двойные слои, характеризующиеся гидрофильной поверхностью и гидрофобной внутренней частью. Вещества могут проникать через такую мембрану тремя разными способами.
а) Диффузия. В зависимости от степени липофильности вещества могут диффундировать непосредственно через двойной липидный слой по градиенту концентрации через мембрану (красные точки). В то же время мембрана практически непроницаема для высокогидрофильных веществ (норадреналина).
б) Пассивный транспорт. Во многих тканях есть транспортные системы для переноса через мембрану веществ, которые самостоятельно не могут через нее пройти. Проникая сквозь мембраны, вещества попадают внутрь клеток и в клеточные отделы, где имеется потребность в них. Эти транспортные системы расположены в мембранах и являются более или менее специфичными для определенной группы веществ.
Пассивный транспорт через мембрану не требует энергии. Каналы или белки-переносчики обеспечивают возможность гидрофильным веществам проникать через мембраны. Примерами являются потенциал- или лиганд-контролируемые ионные каналы (потенциалзависимые Na + -каналы, Са 2+ -каналы) и аквапорины.
Аквапорины — специальные транспортные белки, которые обеспечивают прохождение воды через гидрофобную клеточную мембрану во многих тканях организма.
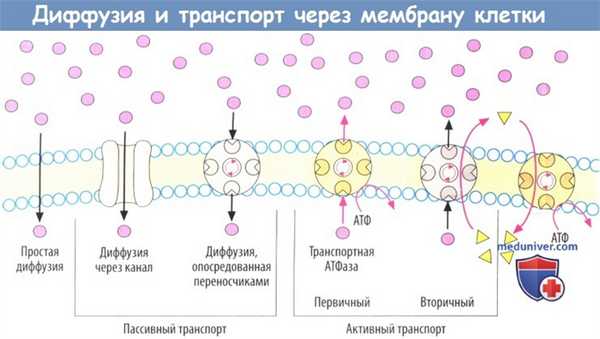
в) Активный транспорт. Многие транспортные процессы в организме осуществляются с прямым или непрямым использованием энергии аденозинтрифосфата (АТФ). Энергия АТФ особенно необходима, когда транспорт веществ через клеточную мембрану осуществляется против градиента концентрации, т. е. с затратой энергии.
В первичном активном транспорте участвуют белки, которые самостоятельно расщепляют АТФ (АТФазы) и таким образом обеспечивают транспорт веществ. Примерами являются Na + /K + -АТФаза или H + /K + -АТФаза.
Некоторые белки первичного активного транспорта выступают в роли мишеней для лекарственных средств; так, гликозиды наперстянки ингибируют Na + /K + -АТФазы] Ингибиторы протонной помпы снижают продукцию кислоты в желудке за счет ингибирования действия H + /K + -АТФазы.
г) При вторичном активном транспорте необходимо функциональное взаимодействие котранспортера с первичным АТФ-зависимым транспортером, В таком случае источником энергии, необходимой для транспорта вещества, служит движение ионов по градиенту концентрации. Градиент Na + обычно служит донором энергии. За поддержание градиента данного иона отвечает, в свою очередь, Na + /К + -АТФаза.
Многие нейромедиаторы и анионные или катионные переносчики используют клеточные градиенты Na + в качестве источника энергии.
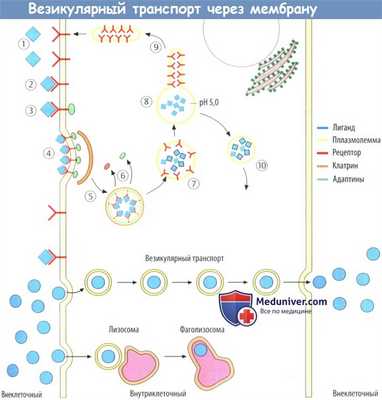
д) Трансцитоз (везикулярный транспорт). Вновь образованные везикулы захватывают растворенные во внеклеточной жидкости вещества и затем переносят их через цитоплазму. В некоторых случаях везикулы (фагосомы) сливаются с лизосомами дообразования фаголизосом, а переносимые вещества метаболизируются.
е) Эндоцитоз, опосредованный рецепторами. Лекарственное средство связывается в первую очередь с рецепторами на поверхности мембраны, а цитозольные участки рецепторов взаимодействуют со специальными белками (адаптины). Комплексы лекарственного вещества с рецептором мигрируют вдоль мембраны и соединяются с другими комплексами на основе клатринзависимого процесс. Область поврежденной мембраны инвагинирует и в конце концов отслаивается до образования обособленной везикулы.
Везикула охватывает клатрин и адаптин, что приводит к образованию ранней эндосомы. Внутри нее повышается концентрация протонов, вызывая диссоциацию комплекса «лекарственное средство-рецептор». Далее участки несущей рецептор мембраны отделяются от эндосомы. Они возвращаются обратно в плазмолемму в то время как эндосома направляется в органеллы мишени.
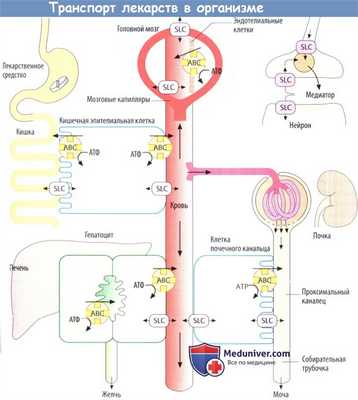
Механизмы распределения лекарств в организме
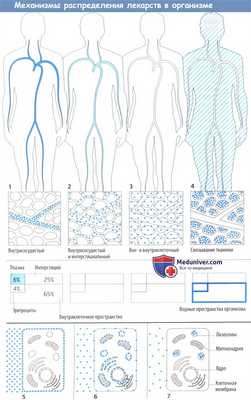
Лекарственное средство после захвата организмом распределяется в кровь и через нее в различные ткани организма. Распределение может ограничиваться внеклеточным пространством (плазма + интерстициальное пространство) или может включать и внутриклеточное пространство.
Некоторые лекарственные средства активно связываются тканевыми структурами, поэтому их концентрации в плазме значительно падают еще до начала выделения.
После распределения в кровь макромолекулы остаются в основном в сосудистом пространстве, т. к. они не могут проникнуть через гистогематический барьер или даже фенестрированный эндотел ий капилляров. Это свойство используется при потере крови, когда необходимо восполнить объем циркулирующей крови, например, путем инфузии растворов с декстраном.
Более того, в сосудистом пространстве преимущественно находятся вещества, обладающие высоким аффинитетом к белкам плазмы (определение объема плазмы с помощью связанных с белком красителей). Несвязанное (свободное) лекарственное средство покидает кровоток, но с различной скоростью, т. к. гистогематический барьер имеет неодинаковое строение в сосудах различных органов. Эти локальные отличия не показаны на приведенных рисунках.
Распределение в организме определяется свойством проникать сквозь мембранные барьеры. Гидрофильные вещества (инулин) не захватываются клетками и не связываются структурами клеточной поверхности, поэтому могут использоваться для определения внеклеточного объема жидкости. Липофильные вещества диффундируют сквозь клеточную мембрану; в результате достигается равномерное распределение в жидкостях организма.
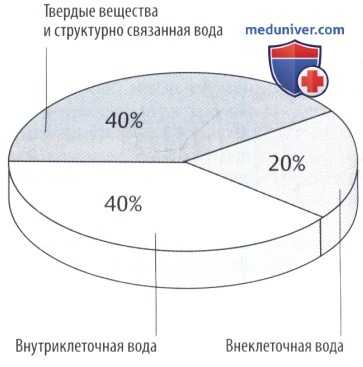
Масса тела может снизиться, как показано на секторной диаграмме. Другие подразделы указаны на рисунке ниже.
Отношение объема интерстициальной/внеклеточной жидкости варьирует в зависимости от возраста и массы тела. В процентном отношении объем интерстициальной жидкости высокий у недоношенных детей или у здоровых новорожденных (до 50% массы тела) и снижается при ожирении и старении.
Концентрация (с) раствора соответствует количеству (D) вещества, растворенного в объеме (V); из этого следует, что с = D/V. Если известна доза лекарственного препарата (D) и его концентрация в плазме (с), то можно вычислить объем распределения (V) по формуле: V=D/c. Тем не менее это кажущийся (теоретический) объем распределения (Vapp), т. к. при расчете предполагается равномерное распределение в организме.
Равномерное распределение нехарактерно при связывании лекарственных средств клеточными мембранами или мембранами внутриклеточных органелл либо при накоплении внутри органелл. В таких случаях концентрация в плазме уменьшается и Vapp может превысить фактическую величину имеющегося объема жидкости. Наоборот, если значительная часть молекул лекарственного вещества связана с белками плазмы, то с увеличивается, а вычисляемый Vapp может быть меньше, чем биологическое значение.
1.1.1. Пути введения лекарств
Лекарственные средства могут быть введены в организм различным путем в зависимости от их свойств и цели терапии. Путь введения в значительной степени определяет скорость наступления длительность и силу действия лекарств, спектр и выраженность побочных эффектов.
Различают энтеральные (через желудочно-кишечный тракт) и парентеральные (минуя желудочно-кишечный тракт) пути введения лекарств. Энтеральные: через рот (орально), под язык (сублингвально) и через прямую кишку (ректально).
Введение лекарств через рот - наиболее удобный и естественный для больного путь. Всасывание лекарств, принятых через рот, происходит преимущественно путем простой диффузии неионизированных молекул в тонкой кишке, реже - в желудке. При этом до поступления в общий кровоток лекарства проходят два активных в биохимическом отношении барьера - кишечник и печень, где на них воздействуют соляная кислота, пищеварительные (гидролитические) и печеночные (микросомальные) ферменты, и где большинство лекарств разрушаются (биотрансформируются). Скорость и полнота всасывания лекарств из желудочно-кишечного тракта зависит от времени приема пищи, ее состава и количества. Так, натощак кислотность меньше, и это улучшает всасывание алкалоидов и слабых оснований, в то время как слабые кислоты усваиваются лучше после еды. Лекарства, принятые после еды, могут взаимодействовать с компонентами пищи, что влияет на их всасывание. Например, кальция хлорид, принятый после еды, может образовывать с жирными кислотами нерастворимые кальциевые соли, ограничивающие возможность всасывания его в кровь.
Прием натощак влияет и на проявление побочного эффекта. Например, никотиновая кислота может вызвать ангионевротический синдром, антибиотиков линкомицина и фузидина-натрия - осложнения со стороны желудочно-кишечного тракта и т.д. При оральном пути введения побочное действие лекарств нередко проявляется в полости рта (аллергические стоматиты и гингивиты, раздражение слизистой оболочки языка - "пенициллиновый глоссит", "тетрациклиновые язвы языка" и т.д.). Иногда этот путь введения невозможен из-за состояния пациента (заболевания желудочно- кишечного тракта, бессознательное состояние больного, нарушение акта глотания и т.д.). Некоторые лекарства при введении внутрь разрушаются в кислой среде желудка (пенициллины, инсулины). Масляные растворы (например, препараты жирорастворимых витаминов) всасываются только после эмульгирования, что требует жирных и желчных кислот. Поэтому при заболеваниях печени и желчного пузыря введение их внутрь малоэффективно.
Быстрое всасывание лекарств из подъязычной области (при сублингвальном введении) обеспечивается богатой васкуляризацией слизистой оболочки полости рта. При таком способе введения лекарственный препарат не разрушается желудочным соком и ферментами печени, действие наступает быстро (через 2-3 мин). Это позволяет вводить сублингвально некоторые препараты неотложной, ургентной помощи (нитроглицерин - при болях в сердце; клофелин - при гипертонических кризах и др.) или лекарства, разрушающиеся в желудке (некоторые гормональные препараты). Иногда для быстрого всасывания препараты применяют за щеку (буккально) или на десну в виде пленок (тринитролонг).
Ректальный путь введения используют реже (слизи, суппозитории): при заболеваниях желудочно-кишечного тракта, при бессознательном состоянии больного. Всасывание из прямой кишки происходит быстрее, чем при введении внутрь. Около 1/3 лекарственного препарата поступает в общий кровоток, минуя печень, поскольку нижняя геморроидальная вена впадает в систему нижней полой вены, а не в портальную. Скорость и сила действия при этом способе введения выше, чем при введении через рот.
Парентеральные пути введения: на кожу и слизистые оболочки, инъекции, ингаляции.
При наружном применении (смазывание, ванночки, полоскания) лекарственный препарат образует комплекс с биосубстратом на месте введения - местное действие (противовоспалительное, анестезирующее, антисептическое и т.д.), в отличие от резорбтивного, развивающегося после всасывания.
Инъекционно вводят лекарственные вещества, которые не всасываются или разрушаются в желудочно-кишечном тракте. Этот путь введения используется также в экстренных случаях для оказания неотложной помощи. При подкожном введении лекарство всасывается через капилляры и попадает в общий кровоток. Эффект развивается через 10-15 мин, величина его больше, а длительность меньше, чем при введении через рот.
Еще более быстрое всасывание и, следовательно, эффект имеет место при внутримышечном введении. Эти инъекции менее болезненны, чем подкожные.
При внутривенном введении лекарство сразу попадает в кровь (всасывание как составляющая фармакокинетики отсутствует). При этом эндотелий контактирует с высокой концентрацией препарата. Во избежание токсических проявлений сильнодействующие препараты разводят изотоническим раствором или раствором глюкозы и вводят, как правило, медленно. Внутривенные инъекции часто используются в неотложной помощи. Если внутривенно лекарство ввести не удается (например, у обожженных), для получения быстрого эффекта его можно ввести в толщу языка или в дно полости рта.
Для создания высокой концентрации (например, цитостатиков, антибиотиков) в определенном органе, препарат вводят в приводящие артерии. Эффект будет выше, чем при внутривенном введении, а побочное действие меньше. При менингитах и для спинномозговой анестезии используется субарахноидальное введение лекарств. При остановке сердца адреналин вводят внутрисердечно. Иногда лекарства вводят в лимфатические сосуды.
Ингаляцию лекарств (бронхолитики, противоаллергические средства и т.д.) используют для воздействия на бронхи (местное действие), а также для получения быстрого (сопоставимого с внутривенным введением) и сильного резорбтивного эффекта, поскольку в легочных альвеолах имеется большое количество капилляров, и здесь происходит интенсивное всасывание лекарств. Этим путем можно вводить летучие жидкости, газы, а также жидкие и твердые вещества в виде аэрозолей.
Читайте также:
