Пероксисомные болезни
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
Основным лабораторным тестом для диагностики пероксисомных болезней (ПБ) является анализ концентрации очень длинноцепочечных кислот (ОДЦЖК), их соотношения, а также концентраций фитановой и пристановой кислот в плазме крови. До начала 2017 г. для диагностики ПБ в лаборатории наследственных болезней обмена веществ (НБО) проводилось только определение ОДЦЖК и анализ нескольких генов: ABCD1, PEX1, PEX6 . Целью работы являлось расширение спектра биохимических и ДНК-тестов для повышения эффективности диагностики ПБ. В рамках работы был апробирован анализ одновременного определения ОДЦЖК, фитановой и пристановой кислот методом газовой хромато-масс-спектрометрии (ГХ-МС), что позволяет проводить подтверждающую биохимическую диагностику. Для молекулярно-генетической верификации диагноза была создана таргетная панель, которая включает 15 генов пероксинов, а также гены, ответственные за Х-сцепленную адренолейкодистрофию, болезнь Рефсума и дефект бифункционального белка пероксисом. С применением данного подхода у 13 пациентов были выявлены изменения в концентрации данных метаболитов и на основании клинических данных и результатов ДНК-диагностики были верифицированы диагнозы: недостаточность D-бифункционального белка (n = 1), синдром Целлвегера (n = 1), Х-сцепленная адренолейкодистрофия (n = 11). У 2 пациентов биохимические тесты применялись для подтверждения патогенности выявленных в ходе ДНК-диагностики мутаций: синдром Целлвегера (n = 1), Х-сцепленная адренолейкодистрофия (n = 1). На клинических примерах показана важность комплексного подхода к диагностике ПБ при неклассическом клиническом фенотипе.
Ключевые слова
Об авторах
Ленинградское областное государственное бюджетное учреждение здравоохранения «Детская клиническая больница»
Россия
Ленинградское областное государственное бюджетное учреждение здравоохранения «Детская клиническая больница»
Россия
ФГБОУ ВО «Российский Национальный Исследовательский Медицинский Университет имени Н.И. Пирогова»
Россия
ФГБОУ ВО «Российский Национальный Исследовательский Медицинский Университет имени Н.И. Пирогова»
Россия
ФГБНУ «Медико-генетический научный центр»; ФГБОУ ВО «Российский Национальный Исследовательский Медицинский Университет имени Н.И. Пирогова»
Россия
Список литературы
1. Кульпанович А.И., Наумчик И.В. Наследственные болезни обмена веществ: пероксисомные болезни // Медицинская панорама. - 2009 г.- №2. - С. 51-53.
2. Klouwer FC, Huffnagel IC, Ferdinandusse S et al. Clinical and Biochemical Pitfalls in the Diagnosis of Peroxisomal Disorders. // Neuropediatrics. - 2016. - №47(4). - P. 205-220.
3. Захарова Е.Ю., Михайлова С.В., Руденская Г.Е. и др. Дифференциальная диагностики лейкодистфрофий детского возраста с установленным первичным дефектом // Мед. генетика. - 2004. - С. 453 - 459.
4. Taras Y. Nazarko. Pexophagy is responsible for 65% of cases of peroxisome biogenesis disorders. // Autophagy. - 2017. - 13(5). - P. 991-994.
5. Renaud M, Guissart C, Mallaret M et al. Expanding the spectrum of PEX10-related peroxisomal biogenesis disorders: slowly progressive recessive ataxia. // J Neurol. - 2016. - 263(8). - P. 1552-8.
6. Краснопольская К.Д., Шехтер О.В., Руденская Г.Е. и др. Полиморфизм клинической манифестации детской церебральной формы Х-сцепленной адренолейкодистрофии // Неврол. журн. - 2000. - №1. - С. 9-14.
8. Folch J., Lees M., Sloane-Stanley G.H. A simple method for the isolation and purification of total lipides from animal tissues. // J. Biol. Chem. - 1957. - 226. - P. 497-505.
9. Knapp D. R Handbook of analytical derivatization reactions. - 1979.
12. Braverman N.E., Raymond G.V., Rizzo W.B. et al. Peroxisome biogenesis disorders in the Zellweger spectrum: An overview of current diagnosis, clinical manifestations, and treatment guidelines. // Mol Genet Metab. - 2016. - 117(3). - P. 313-21.
13. Matsumoto N., Tamura S, Furuki S. et al. Mutations in novel peroxin gene PEX26 that cause peroxisome-biogenesis disorders of complementation group 8 provide a genotype-phenotype correlation. // Am J Hum Genet. - 2003. - 73(2). - P. 233-46.
14. Furuki S., Tamura S., Matsumoto N. et al. Mutations in the peroxin Pex26p responsible for peroxisome biogenesis disorders of complementation group 8 impair its stability, peroxisomal localization, and interaction with the Pex1p x Pex6p complex. // J Biol Chem. - 2006. - 281(3). - P. 1317-23.
15. Mоller G., Leenders F., van Grunsven E.G. et al. Characterization of the HSD17B4 gene: D-specific multifunctional protein 2/17beta-hydroxysteroid dehydrogenase IV. // J Steroid Biochem Mol Biol. - 1999. - 69(1-6). P. 441-6.
17. Protein structure analysis of mutations causing inheritable diseases. An e-Science approach with life scientist friendly interfaces. BMC Bioinformatics. 2010 Nov 8;11(1):548. DOI: 10.1186/1471-2105-11-548. PubMed: 21059217.
Рецензия
Для цитирования:
For citation:
Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Пероксисомные болезни: трудности диагностики у ребенка в раннем периоде заболевания
Авторы: Шишкина Е.В. 1 , Бархатов М.В. 2, 3 , Денисова Г.В. 4 , Носырев А.В. 4 , Базилевская Т.Н. 5 , Новикова И.В. 5 , Маисеенко Д.А. 1
1 ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России, Красноярск, Россия
2 ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России, Красноярск
3 КГБУЗ КККЦОМД, Красноярск
4 КГБУЗ КККЦОМД, Красноярск
5 КГБУЗ «КМДКБ № 1», Красноярск, Россия
Пероксисомные болезни относятся к классу наследственных метаболических заболеваний, вариабельны по клиническому течению и проявлениям, очень часто приводят к летальному исходу. Манифестируют в возрасте от 2 до 10 лет, при этом смерть может наступить в первые 2 года от начала болезни. Не исключено, что при удачном лечении (операция по пересадке костного мозга) может наблюдаться продление жизни пациентов до нескольких десятилетий. Современная классификация выделяет 3 класса пероксисомных болезней, среди которых отличается злокачественным течением сцепленная с Х-хромосомой адренолейкодистрофия у детей. Это редкое наследственное заболевание имеет Х-сцепленный рецессивный тип наследования и характеризуется прогрессирующим течением с сочетанным поражением центральной, периферической нервной системы и надпочечников. При заболеваниях с Х-сцепленным рецессивным наследованием подавляющее большинство больных — мальчики, т. к. у них есть только одна Х-хромосома. Наиболее типичная ситуация — заболевание детей, рожденных от здорового мужчины и женщины-носительницы гена. При этом вероятность заболевания для сыновей — 50% и вероятность носительства болезни у дочерей — также 50%. В этой статье мы описываем клиническое наблюдение за развитием и течением Х-сцепленной адренолейкодистрофии у трехлетнего мальчика. Диагностика затруднялась нетипичной манифестацией болезни. Только обнаружение типичных маркеров: повышенной концентрации очень длинноцепочечных жирных кислот и мутации в гене АBCD1 позволило нам установить правильный диагноз.
Ключевые слова: пероксисомные болезни, Х-сцепленная адренолейкодистрофия, ген ABCD1, очень длинноцепочечные жирные кислоты.
E.V. Shishkina 1 , M.V. Barkhatov 1,2 , G.V. Denisova 2 , A.V. Nosyrev 2 , T.N. Bazilevskaya 3 , I.V. Novikova 3 , D.A. Maiseenko 1
1 V.F. Voino-Yasenetsky Krasnoyarsk State Medical University
2 Krasnoyarsk Territorial Clinical Center of Protection for Motherhood and Childhood
3 Krasnoyarsk Regional Children Clinical Hospital No. 1
Peroxisomal disorders belonging to a group of hereditary metabolic disorders vary in their clinical course and manifestations and are often fatal. These disorders manifest at the age of 2 to 10 years and can lead to death within the first two years. If treatment (i.e., bone marrow transplantation) is successful, life can be prolonged to several decades. Currently, there are three classes of peroxisomal disorders. Among them, X-linked adrenoleukodystrophy is characterized by the dramatic course. This rare X-linked recessive hereditary disorder is characterized by the progressive course and affects both central and peripheral nervous system and adrenal glands. X-linked disorders are observed primarily in male patients (since they have only one X-chromosome). Typically, a healthy man and a woman who is a carrier have a son with X-linked adrenoleukodystrophy. A c hance of having X-linked adrenoleukodystrophy in sons as well as a chance of being a carrier in daughters is 50%. This paper describes in detail the development of a 3-year old boy with X-linked adrenoleukodystrophy. Non-typical disease manifestation has made the diagnosis challenging. The diagnosis was verified by characteristic markers only, i.e., elevated concentrations of very long-chain fatty acids and mutations in the АBCD1 gene.
Keywords: peroxisomal disorders, X-linked adrenoleukodystrophy, АBCD1 gene, very long-chain fatty acids.
For citation: Shishkina E.V., Barkhatov M.V., Denisova G.V. et al. Peroxisomal disorders: challenging diagnosis in a child with early disease. RMJ. Medical Review. 2019;8:48–51.
В статье описывается клиническое наблюдение за развитием и течением Х-сцепленной адренолейкодистрофии у трехлетнего мальчика.
Актуальность
Наследственные метаболические заболевания (НМЗ) в педиатрической практике — это огромный класс моногенных наследственных заболеваний, обусловленных мутациями генов, кодирующих ферменты, транспортные или сигнальные белки. НМЗ на сегодняшний день являются одной из ведущих проблем в клинике, они насчитывают более 500 нозологических форм, и это число постоянно увеличивается. Ранняя диагностика НМЗ дает врачу возможность применять эффективные методы лечения, которые малорезультативны или безуспешны на более поздних стадиях патологического процесса. Кроме того, правильный окончательный диагноз необходим для проведения грамотного медико-генетического консультирования семьи. Одну из групп НМЗ составляют пероксисомные заболевания.
Цель настоящей работы — осветить проблемы, с которыми сталкивается практический врач при ранней диагностике пероксисомных заболеваний.
Пероксисомные болезни возникают в результате нарушения функции пероксисом. Согласно современной классификации их подразделяют на 3 большие группы [1]:
С нарушением биогенеза пероксисом (их полное отсутствие или нарушение их функциональной активности): синдром Цельвегера, неонатальная адренолейкодистрофия, инфантильная болезнь Рефсума, точечная хондродисплазия тазобедренного сустава; синдром, подобный синдрому Цельвегера).
С дефицитом одного пероксисомного фермента, включающим дефекты бета-окисления (псевдоадренолейкодистрофия новорожденных, X-сцепленная адренолейкодистрофия, псевдосиндром Цельвегера, дефицит бифункционального фермента).
С дефицитом одного пероксисомного фермента без дефекта бета-окисления (болезнь Рефсума, псевдохондродисплазия тазобедренного сустава, ди-(три-)гидрохолестановая ацидемия; мевалоновая ацидурия).
Х-сцепленная адренолейкодистрофия
Х-сцепленная адренолейкодистрофия (Х-АЛД) является одной из пероксисомных болезней. По данным различных источников, заболеваемость лиц мужского пола составляет 1:21 000, а в целом заболеваемость мужчин и женщин оценивается как 1:16 800 (США) и 1:22 000 (Франция) [2]. В среднем у новорожденных Х-АЛД встречается с частотой 1 на 17 000 случаев [3–5]. Согласно Международной классификации болезней 10-го пересмотра это заболевание имеет шифр «Е71.33» и характеризуется разрушением жирового покрытия (миелина) нервов в головном и спинном мозге и повреждением наружного слоя надпочечников (коры надпочечников), что приводит к дефициту некоторых гормонов (надпочечниковая недостаточность). Надпочечниковая недостаточность может вызвать слабость, потерю веса, изменения кожи, рвоту и кому. На основании клинических проявлений, возраста дебюта, скорости нарастания неврологических симптомов заболевание подразделяется на 7 фенотипов у мужчин (детская, юношеская и взрослая церебральные, адреномиелоневропатия, оливопонтомозжечковая, изолированная надпочечниковая недостаточность, асимптомная) и 5 фенотипов у женщин (бессимптомная, легкая миелопатия, от умеренной до тяжелой миелонейропатия с вовлечением надпочечников или с церебральным участием) [2]. Церебральная форма является наиболее тяжелой и частой (встречается у 35–40% лиц мужского пола в возрасте до 20 лет), с манифестацией чаще после 4-летнего возраста жизни (в среднем в 7 лет) и приводит к летальному исходу в 95% случаев в течение нескольких лет от начала клинических проявлений [6].
Причинами данного заболевания являются мутации в гене ABCD1, локализованном на 28 локусе Х-хромосомы. Ген ABCD1 кодирует белок — мембранный переносчик, который участвует в транспортировке некоторых жиров в пероксисомы [7]. Мутации в гене ABCD1 соответственно вызывают дефицит транспортера, что приводит к аномальному повышению уровней некоторых жиров очень длинноцепочечных жирных кислот (ОДЦЖК) в организме. Накопление этих жиров и ОДЦЖК может быть токсичным для коры надпочечников и миелина. Исследования показывают, что накопление жиров вызывает воспалительную реакцию в мозге и, соответственно, разрушение миелина.
Поскольку мужчины имеют только одну Х-хромосому, мутация в гене ABCD1 проявляется у них выраженной клинической картиной. У женщин-носителей, как правило, не наблюдаются наиболее тяжелые проявления заболевания и манифестировать болезнь у них может в более позднем возрасте [2].
Особенности течения и диагностики Х-АЛД
Современные знания о патогенезе болезни пока не могут объяснить различия в возникновении фенотипических проявлений Х-АЛД. Несмотря на то, что при этом заболевании избыток ОДЦЖК обнаруживается практически во всех тканях организма, симптоматика проявляется в основном со стороны нервной системы и надпочечников [2]. Вместе с тем нормализация концентрации ОДЦЖК при лечении заболевания не влияет на прогрессирование болезни и фатальный исход [8].
Трудности диагностики заболевания связаны с многообразием клинических проявлений. Так, детская церебральная форма длительное время может проявляться лишь эмоциональной лабильностью, синдромом гиперактивности и дефицитом внимания у мальчиков [8]. По истечении короткого времени болезнь прогрессирует, нарастает церебральная демиелинизация с выраженной картиной воспаления в белом веществе мозга, что заканчивается каскадной нейродегенерацией и летальным исходом до пубертатного периода [2, 9]. При подозрении на Х-АЛД у мальчиков и мужчин инициальная диагностика начинается с тандемной масс-спектрометрии на плазменную концентрацию ОДЦЖК. Эта методика подтверждает заболевание на 100% у лиц мужского пола, но у женщин в 15–20% случаев результаты могут быть ложноотрицательными [10]. Следующий этап диагностики — секвенирование экзома на наличие мутации гена ABCD1. На начало 2017 г. известно более 750 мутаций в этом гене. В обязательный алгоритм диагностики пероксисомных болезней входит проведение магнитно-резонансной томографии (МРТ) головного мозга. В 1994 г. нейрорадиолог Daniel J. Loes предложил шкалу оценки степени тяжести Х-АЛД с диапазоном значений от 0 до 34, основанную на местоположении и выраженности визуализируемых атрофических изменений в головном мозге, позволяющую оценить степень прогрессирования заболевания и эффективность терапии [11].
Вопросы терапии Х-АЛД
Вопрос о превентивной терапии Х-АЛД стоит особенно остро, т. к. диагноз можно поставить за многие годы до появления клинических симптомов заболевания. Поиски эффективного лечения продолжаются. В настоящее время в экспериментах на культуре кожных фибробластов удалось получить снижение синтеза дексадеканоевой кислоты при добавлении олеиновой кислоты. На этом основании прежде для лечения больных с Х-АЛД использовали глицеротриолеатное масло, при применении которого отмечалось снижение уровня ОДЦЖК на 30–40%. Следующим этапом стало открытие масла Лоренцо, которое синтезировали родители мальчика Lorenzo Odone, больного Х-АЛД. Использование масла Лоренцо, содержащего смесь ненасыщенных жирных кислот (глицерин, триолеат и глицерил трирукат в соотношении 4:1) позволяет нормализовать концентрацию ОДЦЖК, что, однако, не влияет на прогноз заболевания и не улучшает функцию надпочечников и нервной системы [8, 12–14]. В настоящее время основным методом лечения Х-АЛД и стандартом терапии является трансплантация костного мозга [15, 16]. Однако для эффективности этой методики процедура должна быть проведена на ранней стадии заболевания, т. е. практически сразу после рождения [17]. В противном случае трансплантация может ускорить прогрессирование болезни и увеличить степень риска тяжелых инфекционных осложнений в раннем посттрансплантационном периоде [12]. Генная терапия с экспрессией генов ABCD1 и АВСD2 (ближайшего гомолога ABCD1) при помощи векторов лентивирусов является, по всей видимости, терапией будущего, и в нескольких наблюдениях применение генной терапии было успешным и предотвратило процесс демиелинизации на 2 года [18]. Также терапией будущего может стать использование антиоксидантов, нейропротективная терапия с использованием таких препаратов, как бутираты и вальпроаты [12, 14, 18–24]. Пренатальная диагностика Х-АЛД проводится с использованием как биохимических (определение уровня ОДЦЖК), так и молекулярно-генетических методов.
Мы приводим собственный клинический опыт постановки у ребенка раннего возраста диагноза X-АЛД, т. к. уверены, что описание клинического случая пероксисомного заболевания у ребенка представляет несомненный интерес для практических врачей — неврологов и педиатров.
Клиническое наблюдение
Больной О.К., мальчик, 3 года 2 мес. Из анамнеза жизни известно, что ребенок родился от второй доношенной беременности, протекающей на фоне цитомегаловирусной инфекции (ЦМВ). При рождении был выставлен диагноз: внутриутробная ЦМВ-инфекция, генерализованная форма, с преимущественным поражением печени. Холестатический гепатит. Гипоксически-геморрагическое поражение головного мозга.
В острый период получил лечение ЦМВ-инфекции: цитотек № 5. В возрасте 2 нед. выявлена атрезия желчевыводящих путей, по поводу чего был прооперирован. Послеоперационный период протекал без осложнений.
Ребенок наблюдался в кабинете катамнеза, где отмечались нарушения в неврологическом статусе, в возрасте одного года была оформлена инвалидность с диагнозом: детский церебральный паралич, атактическая форма, сенсомоторная тугоухость.
В возрасте 2 лет и 5 мес. проведена плановая МРТ, в результате которой визуализированы: выраженная внутренняя неокклюзионная гидроцефалия; множественные, диффузно расположенные очаги и сливные зоны глиоза в белом веществе полушарий головного мозга лобных, теменных, затылочных, височных долей, а также в области колена мозолистого тела, перивентрикулярные зоны глиоза; мелкая гетеротопия серого вещества.
В 2 года 10 мес. ребенок был госпитализирован в инфекционное отделение с жалобами на повышение температуры тела до 39,5 °C, однократную рвоту и развившийся однократный тонико-клонический приступ, продолжавшийся в течение 10–15 мин. Развился правосторонний гемипарез. Клинический диагноз при выписке из стационара: шигеллез, гастроэнтероколитная тяжелая форма. Токсико-метаболическая энцефалопатия. Судорожный синдром.
Повторная госпитализация — через 1,5 мес. (3 года жизни) с жалобами на нарастающий гемипарез справа. Заключение по результатам МРТ головного мозга при госпитализации: картина структурных изменений тканей головного мозга, более вероятно дистрофического, глиального и воспалительного характера, в левой лобной области с распространением на мозолистое тело, базальные ядра слева, левую ножку мозга, левые отделы ствола головного мозга. Изменения в правой лобной области и правой гемисфере мозжечка.
Клинический и биохимический анализы крови в пределах нормы. По результатам тандемной масс-спектрометрии исключены: болезнь Нимана — Пика, болезнь Помпе, митохондриальные энцефалопатии. Выставлен клинический диагноз при выписке: подострый лейкоэнцефалит.
В 3 года 1 мес. — госпитализация в связи с повторными тонико-клоническими приступами. С учетом данных анамнеза заподозрено обострение ЦМВ-инфекции: тяжелая генерализованная форма с поражением центральной нервной системы (ЦНС) (склерозирующий панэнцефалит, внутренняя гидроцефалия) и печени (гепатит с переходом в фиброз), хроническое прогредиентное течение, фаза реактивации.
В стационаре проведены исследования: полимеразная цепная реакция ликвора, мочи, крови, слюны: ЦМВ не обнаружена; воспалительных изменений в ликворе нет, общий белок 627 мг/л.
Последняя госпитализация в КГБУЗ «Красноярский краевой клинический центр охраны материнства и детства» через 1 мес. после предыдущей выписки (3 года 2 мес. жизни ребенка) с приступом двукратной рвоты, нарушением сознания и дыхания (искусственная вентиляция легких в течение 2 сут). В клиническом анализе ликвора при поступлении: цитоз 4, белок 1416 мг/л, глюкоза 3,5 ммоль/л. В динамике через 10 дней: цитоз 3, белок 325 мг/л, лактат 1,4.
При переводе ребенка из реанимационного отделения состояние тяжелое. Реакция на осмотр резко негативная, задержка формирования высших корковых функций, речи нет, произносит отдельные звуки. Глоточный рефлекс снижен, гиперсаливация. Гипертонус по гемитипу справа, гиперрефлексия с клонусом, патологические кистевые и стопные знаки, походка гемипаретичная. Судорог не отмечалось.
Проведена МРТ головного мозга с контрастом: отмечается отрицательная динамика в сравнении с предыдущей МРТ в виде увеличения зоны дистрофических и глиальных изменений в головном мозге: в левой лобной доле с распространением на прилежащие отделы левой теменной доли, базальные структуры слева, левую ножку мозга и передние отделы моста мозга, а также через передние отделы мозолистого тела на перивентрикулярные отделы правой лобной доли, в левой гемисфере мозжечка определяются зоны неоднородно гиперинтенсивного сигнала в Т2 режиме, без четких контуров масс-эффекта на прилежащие структуры, с умеренно выраженным перифокальным отеком. Киста прозрачной перегородки. После введения контраста определяются участки повышения сигнала в области лобной доли, передних отделах мозолистого тела и в базальных структурах слева.
Проведена МРТ спинного мозга: в спинном мозге шейного и грудного отделов позвоночника, в боковых отделах определяются симметричные участки повышенного сигнала в режиме Т2 и изогипоинтенсивного сигнала в режиме Т1 с явлениями умеренного перифокального отека. Не исключается миелит или глиоматоз.
При проведении позитронно-эмиссионной томографии (ПЭТ) картина не укладывается в представление об опухолевой природе поражения суб- и супратенториальных структур головного мозга. Более вероятным является воспалительный процесс с возможным аутоиммунным компонентом и активной метаболической реакцией. На основании заключения ПЭТ диагноз «глиоматоз» снят.
Исходя из гендерной принадлежности ребенка, клинических и анамнестических особенностей, быстрого прогрессирования симптоматики, данных нейровизуализации заподозрено наличие пероксисомного заболевания. Исследование на ОДЦЖК показало повышение их концентрации, что свидетельствовало о наличии пероксисомного заболевания.
По результатам проведенного молекулярно-генетического тестирования выявлена мутация в гене ABCD1, что подтвердило диагноз Х-АЛД.
Таким образом, постановка диагноза через 8 мес. от начала проявлений первых симптомов говорит о сложности диагностики и неспецифичности клинических проявлений пероксисомных заболеваний в детской практике. Ранний дебют на фоне уже имеющихся органических нарушений со стороны ЦНС, полиморфизм клинических проявлений: обязательное поражение ЦНС (бульбарные нарушения, поражение пирамидного пути), деменция, судороги — могут клинически затруднить дифференциальную диагностику, и окончательный диагноз возможно выставить только при помощи современных методов: тандемной масс-спектрометрии, молекулярно-генетического тестирования, МРТ.
Заключение
К сожалению, в российской практической медицине пренатальная и ранняя натальная диагностика пероксисомных заболеваний на сегодня затруднительна. В нашем случае поздняя постановка диагноза не позволяет провести ребенку трансплантацию костного мозга, что утяжеляет прогноз заболевания. Эффективная терапия Х-АЛД в будущем возможна с использованием генной инженерии и новых эффективных лекарственных средств.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Пероксисомные болезни
Пероксисомные болезни — группа заболеваний, обусловленных нарушением структуры и функции пероксисом, - внутриклеточных органелл, присутствующих в каждой клетке организма за исключением зрелых эритроцитов. Около 50 ферментов пероксисом обеспечивают Р-окисление очень длинноцепочечных жирных кислот (ОДЦЖК), дикарбоновых кислот, пипеколиновой кислоты, простагландинов. В пероксисомах происходят начальные этапы биосинтеза плазмалогенов, входящих в структуру миелина и составляющих от 5% до 20% фосфолипидов клеточных мембран. Одна из важнейших функций пероксисом — зашита клетки от образующегося в ней атомарного кислорода с помощью химических превращений, в которых участвуют пероксисомные каталазы.
Возникновение пероксисомных болезней обусловлено нарушением сложных ферментативных реакций внутри органелл, процессов транспорта белков через мембраны органелл и функции их рецепторов. Белки, вовлеченные в биогенез пероксисом, называют пероксинами. В настоящее время определены функции более 20 пероксинов, для 9 из которых установлена хромосомная локализация кодирующих генов, обозначаемых РЕХ. В большинстве случаев патогенетические механизмы пероксисомных болезней связаны с нарушением четырех основных биохимических процессов — синтеза плазмалогенов, окисления ОДЦЖК и фитановой кислоты и деградации пипеколиновой кислоты. Особенностью пероксисомных болезней является возникновение нескольких заболеваний при мутациях в одном и том же гене, или появление одного клинического фенотипа, при наличии мутаций в разных генах пероксинов. Среди наиболее распространенных пероксисомных болезней гепато-церебро-ренальный синдром Цельвегера, ризомелическаяточечная хондродиетрофия, синдром Рефсума и адренолейкодистрофия. Частота пероксисомных болезней составляет ): 25000-1:50000 новорожденных. На основании двух важных критериев — количества пероксисом в печени и степени нарушения их функций - эти болезни принято делить на три основные группы. К первой группе относятся пероксисомные болезни, при которых количество пероксисом в печени значительно снижено, а биохимические процессы в них нарушены. Во вторую группу входят заболевания, характеризующиеся нарушением лишь нескольких биохимических процессов в пероксисомах и нормальным их количеством в печени. При заболеваниях третьей группы биологическая функция пероксисом полностью подавлена, но их количество в печени соответствует норме.
Клиническая картина пероксисомных заболеваний включает: 1) черспно-лицевые аномалии; 2) патологию органов зрения (нарушение пигментации сетчатки, побледнение дисков зрительных нервов); 3) неврологические симптомы (мышечная гипотония, судороги, задержка раннего психомоторного развития); 4) гепатомегалию; 5) аномалии скелета (ризомелический тип укорочения конечностей).
Для демонстрации особенностей проявления пероксисомных болезней приводим клинико-генетические характеристики церебро-гепато-ренального синдрома Цельвегера, относящегося к первой группе.
Синдром Цельвегера объединяет группу генетически гетерогенных состояний. К клиническим проявлениям синдрома Цельвегера могут приводить мутации в генах пероксинов 1,2,3,5,6 и 12. Все варианты СЦ наследуются по аутосомно-рецессивному типу.
Первые симптомы отмечаются с рождения. Для больных характерна внутриутробная гипотрофия (вес при рождении не превышает 2500 г), дисморфизм в строении лица и черепа — увеличение размеров лба, монголоидный разрез глаз, периорбитальная полнота тканей, короткий вздернутый нос, микрогнатия. Среди наиболее типичных признаков: резкая мышечная гипотония, доходящая до атонии, и поликистоз почек. У всех больных отмечаются полиморфные пороки развития головного мозга. Часто диагностируется полимикрогирия, лизэнцефалия, агенезия мозолистого тела, очаги демиелинизации в белом веществе мозга, гидроцефалия. В ряде случаев выявляется патология глаз в виде врожденных катаракт и глауком, а также пороки сердца и наружных половых органов. Для заболевания характерна длительная желтуха и симптомы надпочечниковой недостаточности в первые месяцы жизни. У всех детей отмечается грубая задержка раннего психомоторного развития и снижение продолжительности жизни. Большинство больных погибает в течение первого года.
Пероксисомные болезни
Пероксисомы — это крошечные компоненты внутри клетки. В некотором смысле они похожи на органы клетки (органеллы). Пероксисомы содержат химические вещества под названием ферменты, такие, как каталаза и пероксидаза, которые помогают организму расщеплять (преобразовывать) жирные кислоты Жирные кислоты Углеводы, белки и жиры обеспечивают 90% сухой массы входящих в рацион продуктов и 100% их энергии. Все эти три вида питательных веществ дают энергию (измеряемую в калориях), но количество энергии. Прочитайте дополнительные сведения и перекись водорода. Когда ферменты не работают надлежащим образом, жирные кислоты и перекись водорода накапливаются, вызывая повреждение многих отделов организма.
Существуют различные типы наследственных заболеваний Наследование моногенетических заболеваний Гены представляют собой сегменты дезоксирибонуклеиновой кислоты (ДНК) и содержат код для определенного белка, функционирующего в одном или нескольких типах клеток в организме. Хромосома состоит. Прочитайте дополнительные сведения . При большинстве пероксисомных болезней оба родителя больного ребенка являются носителями копии патологического гена. Поскольку для возникновения этого нарушения необходимы две копии патологического гена, обычно ни один из родителей не страдает таким заболеванием. Некоторые пероксисомные болезни сцеплены с X-хромосомой Х-сцепленные рецессивные заболевания . Это означает, что у мальчиков заболевание может быть вызвано только одной копией патологического гена.
Сцепленная с Х-хромосомой адренолейкодистрофия
Это наиболее распространенная пероксисомная болезнь. Она поражает главным образом головной и спинной мозг, а также надпочечники. Поскольку дефектный ген находится на Х-хромосоме (одной из половых хромосом), болезнь возникает почти исключительно у мальчиков (см. рисунок Сцепленные с Х-хромосомой рецессивные заболевания Х-сцепленные рецессивные заболевания ).
Церебральная форма сцепленной с Х-хромосомой адренолейкодистрофии возникает в возрасте от 4 до 12 лет. У детей присутствуют симптомы проблем с концентрацией внимания, которые со временем прогрессируют в тяжелые поведенческие проблемы, деменцию, а также проблемы со зрением, слухом и движением. Эта форма приводит к полной инвалидности и смерти через несколько лет после диагностики. Также диагностировались более легкие подростковые и взрослые формы болезни.
Адреномиелонейропатия (АМН) — это более легкая форма болезни, которая возникает у людей на третьем или четвертом десятилетии жизни. У людей отмечаются симптомы скованности, слабости и боли в ногах, которые прогрессивно усугубляются с течением времени. Проблемы с нервами приводят к тому, что сфинктер мочевого пузыря (мышечное кольцо, которое удерживает мочу в мочевом пузыре до момента мочеиспускания) и половые органы прекращают работать надлежащим образом. У некоторых из этих людей также развиваются симптомы церебральной формы.
У людей, страдающих любой из форм сцепленной с Х-хромосомой адренолейкодистрофии, также может развиваться снижение функции надпочечников (располагающиеся на почках железы, вырабатывающие гормоны). У некоторых людей развивается болезнь Аддисона Болезнь Аддисона При болезни Аддисона происходит снижение функции надпочечников, в результате чего развивается дефицит гормонов надпочечников. Болезнь Аддисона может возникнуть в результате аутоиммунной реакции. Прочитайте дополнительные сведения Врачи ставят диагноз сцепленной с Х-хромосомой адренолейкодистрофии с помощью магнитно-резонансной томографии Визуализирующие исследования Для подтверждения диагноза, предполагаемого на основании медицинского анамнеза и неврологического обследования, может понадобиться выполнение диагностических процедур. Электроэнцефалография. Прочитайте дополнительные сведенияНекоторым людям может помочь трансплантация костного мозга или пересадка стволовых клеток Трансплантация стволовых клеток Трансплантация стволовых клеток — это изъятие стволовых клеток (недифференцированных клеток) у здорового человека и их введение путем инъекции человеку, у которого имеется серьезное заболевание. Прочитайте дополнительные сведения . Людям, у которых есть проблемы с надпочечниками, назначают кортикостероиды. Добавка, представляющая собой смесь из глицерина триолеата и глицерина триэруката (масло Лоренцо), может вернуть уровень жирных кислот в крови к норме и помочь некоторым людям, но его изучение все еще продолжается.
Синдром Цельвегера (СЦ), адренолейкодистрофия новорожденных и инфантильная болезнь Рефсума (ИБР)
Эти три болезни принадлежат к группе заболеваний, называемых болезнями спектра синдрома Цельвегера, у которых есть перекрывающиеся симптомы и которые поражают многие отделы организма. Синдром Цельвегера — это самая тяжелая форма, а инфантильная болезнь Рефсума — наименее тяжелая форма.
Синдром Цельвегера (СЦ) и адренолейкодистрофия новорожденных возникают в младенческом возрасте. Болезнь Рефсума возникает позже, у некоторых людей даже во взрослом возрасте. Симптомы этой болезни могут включать характерные черты лица, дефекты головного и спинного мозга, разрушение тканей, окутывающих нервы (демиелинизация), судорожные припадки Судорожные припадки у детей Судорожные припадки — это периодические нарушения электрической активности головного мозга, которые приводят к временной дисфункции головного мозга в той или иной степени. Когда у более. Прочитайте дополнительные сведения (у новорожденных), а также слабый мышечный тонус (гипотония). У детей может быть увеличение печени и кисты в почках. Также у детей могут быть короткие конечности, специфическая аномалия костей, называемая эпифизарной точечной хондродисплазией (которая влияет на рост длинных костей), катаракта, аномальный рост кровеносных сосудов в глазу (ретинопатия), потеря слуха, а также слабость, онемение и боль в кистях рук и стопах. Физическая активность, например, движение и речь, замедлена.
Врачи ставят диагноз этого заболевания, проводя анализы крови для выявления некоторых жирных кислот. Также имеется генетический анализ.
Болезнь Рефсума
При этой болезни в тканях накапливается фитановая кислота, которая является продуктом метаболизма жиров. Накопление фитановой кислоты приводит к повреждению нервов и сетчатки, потере слуха, потере обоняния (аносмия), спастическим движениям и изменениям в костях и коже. Симптомы обычно появляются на третьем десятилетии жизни, но могут начаться и в более позднем возрасте.
Врачи диагностируют болезнь Рефсума, выполняя анализ кровь, чтобы установить, повышен ли уровень фитановой кислоты.
Лечение болезни Рефсума предполагает избегание употребления пищи, содержащей фитановую кислоту, включая молочные продукты, говядину и баранину, а также жирную рыбу, такую, как тунец, треска и морской окунь. Может быть полезен плазмаферез, при котором из крови удаляется фитановая кислота.
Ризомелическая точечная хондродисплазия
Симптомы ризомелической точечной хондродисплазии начинаются в младенческом возрасте и включают втянутость средней части лица, поразительно короткие конечности, выпуклый лоб, маленькие ноздри, катаракту, мелко- и крупночешуйчатое шелушение кожи ( ихтиоз Ихтиоз Ихтиоз — это заболевание кожи, сопровождающееся шелушением кожи и образованием чешуек, варьирующихся от легкой, но беспокоящей больного, сухости кожи до тяжелого заболевания кожи, изменяющего. Прочитайте дополнительные сведенияВрачи ставят диагноз ризомелической точечной хондродисплазии по результатам рентгенологического исследования и анализов крови.
Эффективное лечение ризомелической точечной хондродисплазии отсутствует. Тем не менее, детям, у которых имеются высокие уровни фитановой кислоты, следует употреблять пищу с низким ее содержанием.
Дополнительная информация
Международный фонд пероксисомных болезней (Global Foundation for Peroxisomal Disorders, GFPD)
ПРИМЕЧАНИЕ: Это — пользовательская версия ВРАЧИ: Нажмите здесь, чтобы перейти к профессиональной версии
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Международный неврологический журнал 2(2) 2005
Пероксисомные нарушения — это группа генетически детерминированных заболеваний, понятых за последние 20 лет. Они подразделяются на две основные группы: 1. Нарушения пероксисомного биогенеза; 2. Недостаточности одиночных пероксисомных ферментов.
Нарушения пероксисомного биогенеза
В этой группе больных пероксисома нормально не образуется. Сейчас выявлено 13 таких нарушений. Их основным дефектом является аномалия в процессах, которые контролируют белки в пероксисоме. Это сложный процесс, он включает в себя более 30 отдельных генов, которые сейчас называются пероксинами (РЕХ).
Сейчас показано, что дефекты в 13 из этих РЕХ генов связаны с болезненными состояниями человека. Эти нарушения даны в табл. 1.
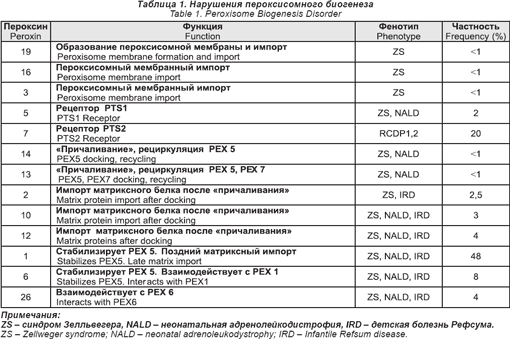
Клинические фенотипы этих нарушений подразделяются на две основные категории:
1) Спектр болезней Зелльвегера (ZS), неонатальный ALD (NALD), детской болезни Рефсума (IRD). Эти нарушения были описаны и названы задолго до того, как стали известны их основная природа и связь с пероксисомой. Сейчас считается, что они образуют клинический спектр, который изменяется в отношении тяжести заболевания, где ZS — самая тяжелая, а IRD — самая легкая (хотя его все еще связывают с большими дефицитами), а NALD — промежуточная. Больные с ZS получают тяжелые поражения при рождении и имеют характерные черты лица, тяжелую гипотонию, трудности при кормлении, глубокую задержку психомоторного развития, пигментарную дегенерацию сетчатки глаза, потерю слуха, увеличенную печень, многие умирают до двух летнего возраста. У больных с IRD более легкие аномалии, психомоторная дегенерация различной степени, пигментарная дегенерация и нарушения слуха. Большую пользу может принести им специальное общение, физическая и трудовая терапия, слуховые аппараты. Они могут дожить до взрослого возраста. Больные с NALD напоминают больных с IRD, за тем исключением, что у них может развиться прогрессивная лейкодистрофия. Чаще всего проявляется в возрасте от 2-х до 6-ти лет, но у одного больного она появилась только на 40-м году жизни.
В табл. 1 показано, что 12 из дефектов PЕХ могут быть связаны с каждым их трех фенотипов (ZS, NALD, IRD). Пока полного понимания этого еще нет, проведенные исследования выращенных фибробластов показали, что клеточные линии от больных с более легкими фенотипами сохранили некоторое их количество, чтобы импортировать пероксисомный белок.
2) Дефекты PЕХ 7 связаны с клиническим фенотипом ризомелических хондродисплазийных пятен (RCDP). При полной экспрессии — это тяжелое заболевание, которое включает укорачивание конечностей, глубокую задержку психомоторного развития, катаракту, характерные черты лица, ихтиоз и сильную зернистость эпифизов и корональные щели тел позвонков на рентгенограмме. Большинство детей умирают в течение первых пяти лет.
Недавно было показано, что у некоторых больных с дефицитом РЕХ 7 синдром намного слабее. У этих больных мутации слабее, и сохраняются некоторые функции РЕХ 7. Некоторые их этих больных имеют катаракты без укорачивания конечностей. Клинические признаки других похожи на таковые болезни Рефсума с развитием периферической невропатии и пигментарной дегенерации сетчатки глаз в подростковом возрасте или ранней юности.
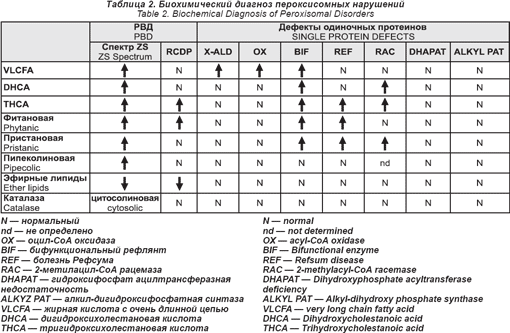
Все эти нарушения пероксисомного биогенеза имеют аутосомный рецессивный способ наследования. Их общая заболеваемость, по оценкам, составляет 1: 50 000. Их можно диагностировать при помощи серии биохимических анализов плазмы крови и эритроцитов (см. табл. 2). Перинатальный диагноз возможен для всех. Для определения молекулярных дефектов необходимы специальные анализы. Стейнберг и его сотрудники недавно разработали алгоритм, позволяющий определить большинство из них.
Специальной терапии пероксисомных нарушений нет. Некоторым легко больным очень помогла мультидисциплинарная поддерживающая и реабилитационная терапия.
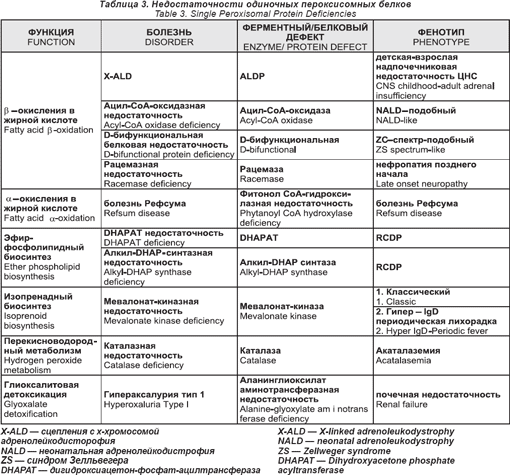
Нарушения одиночного пероксисомного белка
Эти нарушения даны в таб. 3
Сцепленная с X-хромосомой адренолейкодистрофия
Сцепленная с X-хромосомой адренолейкодистрофия — самое распространенное пероксисомное заболевание. По всему миру заболеваемость его составляет 1:17 000. Дефектный ген, который сейчас называется ABCD1, был картирован на Xq28. Он является геном надсемейства белков АВС транспорта. Он кодирует пероксисомный белок или мембраны, ALDP. Скопление насыщенных жирных кислот с очень длинными цепями (VLCFA), в основном гексакосаноиновой кислоты (С26:0), является основной биохимической аномалией, а определение избытка VLCFA в плазме — наиболее часто применяемый диагностический анализ.
Х-ALD имеет 3 основных фенотипа:
2) Адреномиелоневропатия (AMN). AMN представлена у молодых людей как медленно прогрессирующий парапарез, нарушенное чувство вибрации и положения и нарушения функции сфинктера. Она прогрессирует медленно, на это уходят десятки лет. В большинстве случаев интеллект сохраняется, но примерно у 20% больных также развивается церебральное поражение, когда это случается, болезнь прогрессирует быстрее. Приблизительно у 50% женщин, гетерозиготных к Х-ALD, AMN развивается в среднем возрасте или позже, но она обычно легче, чем у мужчин.
3) Фенотип «Аддисон только»: эти больные страдают первичной адренокортикальной недостаточностью, их нельзя отличить от больных с болезнью Аддисона, за тем исключением, что уровни VLCFA в плазме крови у них возрастают. Чаще всего этот фенотип проявляется в детстве. У большинства Х-ALD больных с фенотипом «Аддисон только» также в дальнейшем развивалось церебральное поражение или AMN. У женщин, гетерозиготных к Х-ALD, недостаточность надпочечников встречается редко.
Диагноз
У мужчин Х-ALD надежно диагностируется анализом VLCFA в плазме. Результаты теста не соответствуют норме уже в день рождения. Однако ложноотрицательные результаты встречаются примерно у 20% женщий, обязательно имеющих гетерозиготы к Х-ALD. Анализ мужчин точно определяет гетерозиготы. Возможен пренатальный диагноз, когда проводится анализ VLCFA или анализ мутации.
МРТ выявляет характерное нарушение у большинства мальчиков с Х-ALD. Наиболее тяжелым это нарушение является в теменно-затылочной областях. Могут также иметь место необычные формы: поражение лобной доли или односторонние поражения. У больных с AMN МРТ мозга обычно показывает норму. В то время как МРТ изменения в церебральной форме часто имеют довольно характерные особенности, диагноз должен быть подтвержден биохимическим анализом или анализом мутации.
Лечение
Если функция надпочечников нарушена, то у всех больных с Х-ALD необходимо проверить функцию надпочечников и назначить им стероидную заместительную терапию надпочечников. Это может спасти им жизнь. Как кажется, гормональное замещение в надпочечниках не действует на неврологическую прогрессию. Было показано, что трансплантация кроветворных клеток полезна для мальчиков с церебральным ALD, но только в том случае, когда она еще легкая (IQ выше 80, а баллов по шкале МРT Лeса меньше 9). Это важная причина, по которой диагностировать Х-ALD следует рано, до наступления тяжелого поражения.
Профилактика
Рекомендуется, чтобы все родственники больных с Х-ALD, которые подвергаются риску заболеть, прошли анализ на VLCFA в плазме крови. Это позволит выявить женщин-носительниц Х-ALD. Они должны получить генетические рекомендации. Этот скрининг позволит выявить бессимптомных или слабосимптомных мальчиков в то время года, когда трансплантация все еще может принести пользу. Пренатальный диагноз Х-ALD точен.
Болезнь Рефсума
Только недавно было продемонстрировано, что болезнь Рефсума — пероксисомное нарушение. Оно диагностируется по анализу уровней фитановой кислоты, ферментному анализу или анализу мутаций. Эффективны терапия детей с ограниченным количеством фитановой кислоты и плазматический обмен.
D-Бифункциональная энзимопатия
D-бифункциональная энзимопатия — заболевание часто встречающееся. Клинически оно напоминает адренолейкодистрофию Зелльвегера или неонатальную. Удивительно, что 15% больных с этими фенотипами болеют скорее D-бифункциональной энзимопатией, чем нарушением пероксисомного биогенеза.
1. Weller S., Gould S.J., Valle D. Peroxisome biogenesis disorders. Annu Rev Genomics Hum Genet 2003;4:165-211.
2. Gould S.J., Raymond G.V., Valle D. The Peroxisome Biogenesis Disorders. In: Scriver C.R., Beaudet A.L., Sly W.S., Valle D., eds. The Metabolic and Molecular Bases of Inherited Diseases. Eighth Edition ed. New York: McGraw Hill, 2001:3181-3217.
3. Braverman N., Chen L., Lin P. et al. Mutation analysis of PEX7 in 60 probands with rhizomelic chondrodysplasia punctata and functional correlations of genotype with phenotype. Hum Mutat 2002;20:284-297.
4. Steinberg S., Chen L., Wei L. et al. The PEX gene screen: Molecular diagnosis of peroxisome biogenesis disorders in the Zellweger syndrome spectrum. Molecular Genetics and Metabolism 2004; in press.
5. Moser H.W., Smith K.D., Watkins P.A., Powers J., Moser A.B. X-linked adrenoleukodystrophy. In: Scriver CR, Beaudet AL, Sly WS, Valle D, eds. The Metabolic and Molecular Bases of Inherited Disease. Eighth Edition ed. New York: McGraw Hill, 2001:3257-3301.
6. Moser A.B., Kreiter N., Bezman L. et al. Plasma very long chain fatty acids in 3,000 peroxisome disease patients and 29,000 controls. AnnNeurol 1999;45:100-110.
7. Bezman L., Moser A.B., Raymond G.V. et al. Adrenoleukodystrophy. incidence, new mutation rate, and results of extended family screening. AnnNeurol 2001;49:512-517.
Читайте также:
