Питание при постгастррезекционной дистрофии. Смеси Нутрихим
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Питание при постгастррезекционной дистрофии. Смеси Нутрихим
После определения реабилитационного потенциала и в случае выбора консервативной тактики восстановительного лечения целесообразно в структуру индивидуальной реабилитационной программы пациентов для коррекции пищеварительно-транспортных нарушений и повышения качества жизни использовать нутриционную поддержку специальными отечественными рационами из натуральных продуктов типа Нутрихим.
Все смеси типа Нутрихим представляют собой порошкообразные сухие смеси натуральных продуктов с диаметром частиц до 150 мкм. Нутрихим — серия питательных смесей, единственных в мире подобных по составу эталонной эн-теральной среде — химусу, формирующемуся в естественных условиях пищеварения, благодаря чему обеспечивается их интенсивное и пропорциональное всасывание в тонкой кишке больных.
Базовые смеси Нутрихим изготовляются нескольких типов:
1. Нутрихим-1А и Нутрихим-1Б— нативные смеси из натуральных продуктов, различающиеся только соотношением массы белков, жиров и углеводов. В смеси Нутрихим-1Ас преимущественным энергообеспечением за счет липидного компонента эти соотношения составляют соответственно 1 : 2 : 2, а в смеси Нутрихим-1Б с преимущественным энергообеспечением за счет углеводного компонента — 1:1:2.
2. Нутрихим-2 — это смесь Нутрихим-1 А, подвергнутая частичному предварительному ферментативному гидролизу панкреатином.
Электролитный состав во всех смесях Нутрихим одинаков и приближается к электролитному составу химуса. В них содержится натрия 1415—1430 мг/л, калия — 1536-1600мг/л, кальция— 582—386мг/л, хлора— 1705—1700мг/л. Большинство этих электролитов, как и всех основных микроэлементов, содержится в натуральных продуктах, из которых готовят смеси Нутрихим.
Все типы смесей Нутрихим составлены из высокосортных отечественных продуктов и содержат белки, жиры, углеводы, электролиты и витамины. 450— 500 г сухой смеси Нутрихима (в зависимости от возможностей желудочно-кишечного тракта) удовлетворяют суточные потребности больного с массой тела 70 кг.
Во всех перечисленных смесях белки и жиры животного происхождения составляют соответственно 87 и 58% от их общего содержания в смеси. Такие соотношения удовлетворяют нормам сбалансированного питания, обеспечивают потребности организма больного в незаменимых аминокислотах и полиненасыщенных жирных кислотах.
Углеводы смесей представлены в продуктах, содержащих клетчатку, крахмал, олиго- и моносахара.
В нативных базовых смесях Нутрихим-1 А, Нутрихим-1 Б основные питательные вещества представлены в большей степени полимерами, чем в смесях, подвергнутых предварительному гидролизу, соотношения поли-, олиго- и мономеров в которых приближаются к наблюдаемым в химусе в естественных условиях пищеварения.
Тактика применения смесей различна в зависимости от степени тяжести алиментарной дистрофии.
При легкой степени синдрома целесообразно рекомендовать в структуре реабилитационной программы использование в качестве дополнительной диетологической коррекции Нутрихим-1 по 50 г во время еды 2—3 раза в день. При этом на I этапе (около 1,5—2 месяцев) показано применение Нутрихима-1А с превалированием липидного компонента. Спустя 2 месяца переходят на Нутрихим- 1Б — переходную смесь перед переводом пациентов на обычную диету.
При средней тяжести синдрома рекомендуют смесь Нутрихим-2 с частично гидролизованными питательными веществами, что обеспечивает более интенсивное всасывание и последующее усвоение пищевых субстратов.
Тяжелый синдром требует использования не только традиционной реабилитационной тактики с дополнительным использованием состава Нутрихима-2, но и периодической госпитализации для проведения инфузионно-алиментационной коррекции (с использованием парентерального и смешанного путей введения специализированных растворов) и определения показаний к реконструктивным операциям.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
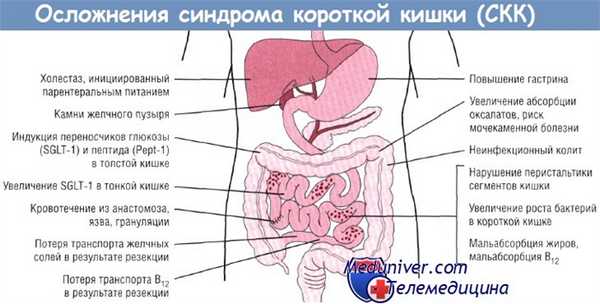
Лечение синдрома короткой кишки. Принципы
Метаболическая и нутриционная поддержка при синдроме короткой кишки (СКК) проводится в три этапа:
- инфузионно-нутриционная коррекция раннего послеоперационного периода;
- инфузионно-нутриционная коррекция периода адаптации;
- инфузионно-нутриционная коррекция последствий обширных резекций кишечника (длительное лечение).
В раннем послеоперационном периоде лечение синдрома короткой кишки направлено на борьбу с метаболическим стрессом: возмещение потерь электролитов и водных разделов; коррекция КОС (применение антацидных, антисекреторных препаратов), регуляция моторной активности, коррекция пищеварительных и стимуляция всасывательных процессов кишечника, иммунокоррекция и иммуностимуляция, симптоматическая фармкоррекция и парентерально-энтеральная алиментация.
В первые часы (сутки) до восстановления какой-то активности пищеварительного канала начинают традиционную внутривенную инфузионную терапию. При отсутствии значительного угнетения пищеварительного канала использование энтерального компонента возможно через 3—4 часа после операции, начиная с введения электролитных растворов.
Затем переходят (под контролем биологического тестирования) к применению сред для энтеральной алиментации по принципу постепенного нагнетания нагрузки на пищеварительно-транспорный аппарат и обменные процессы: переходная смесь, аналогичная химусу — сбалансированная смесь в разведении 1:2—1:1 — сбалансированный состав— сипинговое питание— диетический рацион в сочетании с дополнительной нутриционной поддержкой (сочетанная нутриционая поддержка парентеральным или сипинговым путем).
Иными словами, лечение проводится соответственно принципам терапии энтеральной недостаточности с нутриционной поддержкой парентерально-энтеральным путем. При этом программу коррекции белково-энергетического гомеостаза определяют индивидуально, опираясь на адаптивные возможности тонкой кишки и состояние лимитирующих органов.
Препараты, замедляющие моторику, используются для лечения диареи и улучшения всасывания. Используют мотилиум, пищевые волокна в зонд; для стимуляции всасывания годятся также солевые растворы в зонд и др. известные способы.
При сохранении тяжелой диареи на фоне полной парентеральной алиментации применяют кодеин, опиаты (кодеин в/м по 60 мг каждые 4 часа до получения клинического эффекта). При переходе на энтеральную алиментацию (при положительной биопробе на всасывание и снижении частоты стула) в случаях сохраненяющейся тенденции к диарее назначают лоперамид (имодиум) внутрь 5 мг каждые 6 часов до получения клиническое эффекта. В рефрактерных случаях показана настойка опиума.
Наиболее сложны случаи сочетанной колэктомии и резекции подвздошной кишки с сохранением не более 1 м тощей кишки. В подобных ситуациях помогают соматостатин подкожно или октреотид (100 мкг, п/к, 3 р/сут). Иногда для связывания желчных кислот и предупреждения диареи дается холестирамин.
Для предотвращения выраженной белково-энергетической недостаточности, значительной потери массы тела и отрицательного азотистого баланса следует начинать парентеральное питание в соответствии с рассчитанными потребностями.
В структуре алиментационной коррекции доля энтерального компонента должна увеличиваться постепенно. Объем энтерального компонента можно наращивать под контролем биопробы или в зависимости от объема стула (он не должен превышать 30—40 мл/кг/день).
Энтеральную алиментацию начинают со смесей, близких химусу по составу, как наиболее адекватных для всасывания в кишечнике (например, нутрихим, нутрозим, витазим). Несмотря на адаптивные возможности кишки и поддерживающую терапию у пациентов с сохранением менее 60 см тонкой кишки, удаленными подвздошной, илеоцекальным клапаном и толстой кишкой в сочетании с парентеральной нутриционной поддержкой целесообразно введение соматотропина (п/к 0,03—0,14 мг/кг/сут в течение 4 недель). Рекомендуется также применение глутаминовой кислоты (п/к 0,16 г/кг/сут или внутрь 30 г/сут). Показаны анаболические стероиды. После выработки некоторых приспособительных реакций можно попробовать перейти к применению для энтеральной алиментации сбалансированных составов.
В случае медленной адаптации переход от химусоподобных смесей к сбалансированным отсрочивается до момента, когда биопроба покажет темп усвоения не менее 50 мл разведенной до 20%-й концентрации смеси в течение не более 1 часа.
После развития приспособительных реакций к сбалансированным составам (исчезновения интолерантности к ним) нутриционную поддержку расширяют введением сипинговой составляющей. При этом используют легко усвояемые в кишечнике стандартные составы (например, препараты фортимель, тонексис — Франция, нутрихим в качестве сипинга — Россия и др.). При хорошей адаптации пациента переводят на диетические рационы (блюда по диетам группы столов № 4) с возможностью расширения употребляемого ассортимента.
По литературным данным, вероятность осложнений при парентеральном питании в домашних условиях — 0,7—1,1 случаев на 100 человек в год. Однако наибольшего эффекта все же удается достичь при периодической плановой госпитализации не реже 2-х раз в год.
Благодаря современной нутриционной поддержке достигается длительное выживание пациентов с СКК, которые ранее погибали в отдаленные сроки после обширных резекций кишечника. Парентеральное питание (в т.ч. сочетанное) и энтеральная дополнительная алиментация смесями, аналогичными химусу, — основные составляющие нутриционной поддержки у такого контингента больных. Однако вследствие высокой стоимости сред полного парентерального и энтерального питания до настоящего времени возникали сложности в ведении пациентов с тяжелыми формами СКК на дому. Поэтому ни один из составов не является в достаточной степени эффективным для того, чтобы рекомендовать его в качестве рутинного метода. Таким пациентам показана более частая госпитализация для коррекции белково-энергетической недостаточности в зависимости от состояния.
Трансплантация тонкой кишки — вполне доступный современный метод лечения. Но вследствие некоторых причин (противопоказания, отсутствие донорской базы, экономического риска) этот метод не может быть рекомендован в качестве альтернативы пациентам, хорошо приспособившимся к домашнему парентеральному питанию.
Питание после гастрэктомии. Поддержка при постгастррезекционной дистрофии
Развитие хирургической техники привело в последние годы к выполнению в широких масштабах сложных оперативных вмешательств, к которым относятся и различные виды резекций желудка. Одновременно с этим увеличился и процент таких последствий хирургического лечения, которые надолго выводят из строя оперированных пациентов и в ряде случаев приводят к инвалидности.
Среди отдаленных последствий операций на желудке, приводящих к инвалидизации, вполне определенное место занимает синдром постгастррезекционной (и как крайнее проявление, постгастрэктомической) дистрофии. По данным ряда исследователей, эта патология встречается как сопутствующий синдром в отдаленном послеоперационном периоде при рефлюкс-эзофагитах, пептической язве анастомоза, гипогликемическом и демпинг-синдроме.
В 0,6 ± 0,08% — 0,9 ± 0,03% случаев постгастррезекционная дистрофия встречается как самостоятельный синдром.
Снижение веса после гастрэктомии наблюдается у 75% больных (Ю.К. Квашнин, Ю.К. Панцырев). Несмотря на некоторые различия в механизмах и клинических проявлениях данного типа патологии (после гастрэктомии, например, в 25% встречаются различной выраженности дисфагические расстройства, эзофагальный рефлюс после резекций встречается реже в сравнении с гастрэктомиями; диарея после гастрэктомии отмечается у 15—20% больных и др.), изменения метаболизма и, в частности, нарушения трофологического гомеостаза в подобных ситуациях носят главным образом однонаправленный характер.
Больные с постгастрэктомической дистрофией имеют метаболические нарушения, без адекватной коррекции которых резко снижается качество жизни.
Существует достаточно много рекомендаций по восстановлению организма в таких ситуациях (L.H. Moyes, R.F. МсКее, A. Thomson).
В настоящее время появились два принципиально новых фактора, обусловливающих внесение корректив в сложившиеся реабилитационные схемы. Один из этих факторов — новые принципы и критерии инвалидности, другой — появившиеся в последние годы фундаментальные разработки по оценке трофологического статуса и возможностям его коррекции на основе современных достижений в области изучения особенностей всасывания питательных веществ в измененном желудочно-кишечном тракте.
При выполнении скопии пищеварительного канала через сравнительно большой промежуток времени после гастрэктомии (1,5— 10 лет) с анализом биопсийного материала в 18% случаев установлены признаки рефлюкс-эзофагита, в 11% — анастомозита, в 4% — язв анастомоза, в 3,4% — рецидива опухоли.

При этом при более детальном изучении восстановления функциональной активности кишечного канала и выяснения состояния приспособительных реакций в отдаленном периоде после оперативного лечения выявлялись особенности его двигательной функции, снижение переваривающей (в т.ч. в системе полостного гетерофазного гидролиза нутриентов) и всасывательной активности, секреторной.
Данные обзорного ультразвукового исследования органов живота брюшной полости, почек позволили выявить в отдаленном периоде после гастрэктомии (без указаний в анамнезе о предсуществующей патологии этих органов) диффузные изменения в поджелудочной железе у пациентов с дистрофией в зависимости от степени ее выраженности в 9—11 % случаев, в печени — в 4— 18%, признаки желчно-каменной болезни — в 3—4%, мочекаменную болезнь — в 1,5—1,7%.
В лабораторных параметрах выявляются снижение концентрации белка, изменения в электролитном обмене, билирубиновом метаболизме и выраженные признаки агастральной анемии, нарушенного витаминообмена.
Выявленные нарушения функций пищеварительного канала проявляются также на интегральных характеристиках, отражающих трофологический гомеостаз (сниженный ИМТ, КЖСТ, ОП, ОМП, лабораторно-нутриционные показатели). На основании изучения метаболитов кишечной микрофлоры четко выявляются эффекты ее транслокации после различных по объему операций на желудке.
В целом пациенты в отдаленном периоде после операции (если не было показаний для релапаротомии) постепенно расширяли диету, снижая дозы вводимых ферментных препаратов в соответствии с приспособительными ферментными процессами, однако всегда у них сохранялись нарушения, обусловленные изменениями в системе полостного гетерофазного гидролиза. В связи с этим основная нагрузка по гидролизу питательных компонентов приходилась на пристеночный сектор пищеварения и кишечную микрофлору. Поэтому важным моментом реабилитационной нутриционной поддержки являлся подбор заместительной терапии, учитывающей перечисленные особенности (отсутствие формирования флокулярных структур гетерофазного гидролиза в полости кишки, изменения микробиоценоза).
При этом тактика этого вида коррекции продолжает дискутироваться. В последнее время появились новые данные о возможности совершенствования нутритивной поддержки рассматриваемого контингента, опираясь на механизмы позитивных функций микробиоты кишечника, в частности, на данные об эффектах короткоцепочечных жирных кислот, выделяемых микрофлорой, на состояние эпителия кишечника, обеспечивающего поступление нутриентов из энтеральной во внутреннюю среду (В.М. Бондаренко, Л.И. Шапошникова, Кузьмина Т.Н.). На основании этих данных рекомендуется в структуру алиментационно-волемического диагноза вносить и критерий состояния микробиоценоза.
В зависимости от тяжести состояния Т.Н. Кузьминой предлагается в структуру терапии белково-энергетической недостаточности вводить фармкорректоры микрофлоры кишечника, мукофальк. В этом случае при отсутствии показаний к оперативному лечению постгастррезекционного синдрома нутритивная поддержка может осуществляться по схемам, определяемым степенью скомпенсированности функций пищеварительного аппарата.
При средней степени тяжести ПГРС показана парентеральная коррекция с постепенным переходом на нутритивную поддержку по сипинговой схеме: солевой энтеральный раствор — химусоподобная смесь (например, нутрихим) — сбалансированные специальные продукты (например, типа клинутрен) с добавлением строго расчетных количеств мукофалька — клинутрен без добавок мукофалька — стандартные диетстолы — естественное питание в зависимости от адаптивных возможностей кишечника).
При легкой степени выраженности последствий операций на желудке можно сразу начинать корригирующую алиментацию по сипинговой схеме без предварительного парентерального ее компонента.
Оценка пациентов с постгастррезекционной дистрофией. Классификация трофологической недостаточнoсти
Для уточнения реабилитационного потенциала у больных с постгастррезекционной дистрофией используют количественные характеристики электрической, двигательной и пищеварительно-транспортной активности тонкой кишки, а также биохимические методы оценки белково-синтетической функции печени.
Количественная и качественная оценка реабилитационного потенциала иногда представляет значительные трудности. Особенно это относится к пациентам с постгастррезекционной алиментарной дистрофией. Это связано с отсутствием четких стандартов при определении степени тяжести синдрома.
Существовавшая до настоящего времени схема определения степени тяжести синдрома алиментарной дистрофии предполагала, что при легкой степени больные отмечают повышенную утомляемость, слабость, дефицит массы не превышает 10 кг. При средней степени утомляемость и слабость становятся более выраженными, появляются анемия, гипопротеинемия, а дефицит массы тела составляет 10—20 кг. При тяжелой степени больные бледны, адинамичны, крайне истощены. У них отмечаются массивные безбелковые отеки, признаки гиповитаминоза, дефицит массы тела превышает 20 кг.
При углубленном исследовании состояния желудочно-кишечного тракта, параметров количественной оценки статуса питания более точно устанавливается реабилитационный потенциал.
Адекватная оценка степени сохранности функций желудочно-кишечного тракта при синдроме постгастррезекционной алиментарной дистрофии должна включать электроэнтерографическое исследование, оценку состояния его переваривающей активности (при возможности с учетом степени сохранности полостного гетерофазного пищеварения) и белково-синтетической функции печени.
Такая объективная оценка функционального состояния желудочно-кишечного тракта с помощью комплекса современного электроэнтерографического, рентгенструктурного и биохимического методов исследования, с одной стороны, дает возможность научно обосновать клинический прогноз, степень компенсации и стабилизации процесса; с другой стороны, позволяет определить адекватность реакций желудочно-кишечного тракта к различным условиям в ходе выполнения профессиональной деятельности (возможность длительных перерывов в приеме пищи, нуждаемость в медицинской коррекции, психоэмоциональные стрессорные факторы и др.), правильно оценить трудовые резервы и исключить возможность ошибок в трудовых рекомендациях контингенту лиц с рассматриваемой патологией, в т.ч. с учетом возраста.
Наиболее информативные методы оценки трофологического статуса:
- соматометрические исследования: масса тела, окружность живота, шеи, плеча, толщина кожно-жировых складок в стандартных точках, индекс массы тела;
- комплекс клинико-лабораторных исследований: альбумин, транстиретин, лимфоциты, креатининово-ростовой индекс, дефициты циркулирующих белка гемоглобина и электролитов, прогностический нутриционный индекс;
- функциональные исследования: электрокардиография, ультразвуковое исследование печени, электрогастроэнтерография, гастродуоденоскопия.
Наиболее доступны для уточнения реабилитационного потенциала индекс массы тела по В. М. Луфту (ИМТ), рассчитываемые параметры дефицитов массы тела, объема циркулирующей крови (ОЦК), количества циркулирующего белка (КЦБ), альбумин-глобулиновый коэффициент, объем циркулирующих натрия и калия. Эти параметры позволяют количественно определить в динамике степень выраженности синдрома постгастррезекционной дистрофии. Кроме того, они позволяют наблюдать и более достоверно оценивать эффективность проводимой программы реабилитации.
Углубленный анализ параметров, определяющих трофологический статус пациентов, в сопоставлении с общими клиническими проявлениями (повышенная утомляемость, слабость, адинамия и др.) и учетом сохранности функций пищеварительной системы позволяет рассчитывать в каждом конкретном случае на момент осмотра потребности пациента в белках, липидах и углеводах, точно определять дефицит белка в плазме и организме, стандартизовать глубину дистрофии в балльной системе.
Современный корреляционный анализ показал, что легкая степень синдрома постгастррезекционной алиментарной дистрофии у пациентов, оперированных по поводу язвенной болезни желудка 1 -го типа, соответствует, как правило, трофологической недостаточности (ТН) I—II степени (в среднем более 11 баллов), средняя — ТН II степени (более 7 баллов), тяжелая — ТН II—III степени (более 3 баллов).
При сопоставлении переваривающей, всасывательной, электрической активности желудочно-кишечного тракта и белково-синтетической функции печени с параметрами трофологического статуса, как правило, выявляется, что ТН I степени практически не снижает качества жизни пациента.
У пациентов с ТН II степени отмечается угнетение активности желудочно-кишечного тракта при сохраненной белково-синтетической функции печени. Это выражается в интолерантности к ряду продуктов, снижении параметров электрической активности ЖКТ и качества жизни пациентов и приводит к умеренным ограничениям жизнедеятельности, необходимости рационального трудоустройства, в ряде случаев — к инвалидности III группы. Реабилитационный потенциал у таких больных, как правило, оценивается как средний.
При угнетении функций ЖКТ и угнетении белково-синтетической функции печени в сочетании с ТН II степени больные имеют низкий реабилитационный потенциал. Как правило, это инвалиды II группы, требующие корригирующего лечения.
При ТН III степени пациенты чаще имеют I группу инвалидности. Прогноз сомнителен. Реабилитационный потенциал крайне низкий или отсутствует. В этом случае следует после интенсивной предоперационной подготовки прибегать к реконструктивным вмешательствам.
Лечебный стол №1 при хроническом гастрите

Хронический гастрит – это длительно протекающий воспалительный процесс, локализующийся в слизистой оболочке желудка.
В 2017 году ученые из Пермского государственного медицинского университета им. акад. Е.А. Вагнера опубликовали работу, по результатам которой было установлено, что распространенность хронического гастрита составляет 15-30% в общей популяции и 80-85% среди всех заболеваний желудка.
Данное заболевание может сопровождаться как повышением, так и снижением желудочной секреции. Основу лечения при хроническом воспалении желудка составляет диета. В том случае, если такая болезнь протекает с повышенной кислотностью, назначается лечебный стол №1. В этой статье мы поговорим об особенностях лечебного стола №1 при гастрите.
Основные принципы питания

Как мы уже сказали, при хроническом гастрите с повышенной кислотностью назначается лечебный стол №1. Такой же тип питания показан людям с язвенным поражением желудка, а также при остром воспалительном процессе в период выздоровления.
Для начала заметим, что заниматься самодеятельностью при хроническом гастрите не стоит. Лечебное питание, о котором мы поговорим ниже, может быть назначено только врачом.
В чем же основные принципы диеты №1? Прежде всего, она направлена на нормализацию кислотности желудочного сока, максимальное механическое, химическое и термическое щажение желудка.
Таким образом, больному человеку рекомендуется исключить из своего рациона продукты, способные стимулировать желудочную секрецию, а также трудноперевариваемые блюда.
Суточная калорийность должна составлять до 2800-3000 килокалорий. За сутки рекомендуется потреблять до 100 грамм белков, примерно до 100 грамм жиров и до 400-420 грамм углеводов.
Питаться необходимо дробно (по 5 или 6 приемов еды за сутки), небольшими порциями. Под запретом находятся чрезмерно холодная и очень горячая пища. Допускается употребление протертых, сваренных, запеченных без грубой корочки блюд.
Также следует несколько ограничить потребление поваренной соли (примерно до 10-12 грамм в сутки). Еще один важный момент – это потребление достаточного количества жидкости (около 1,5 литров).
Список разрешенных и запрещенных продуктов
Что можно употреблять при диете №1?
В рацион могут быть введены супы на овощном бульоне или молоке с овощами или крупами (предварительно перетертыми или разваристыми). Также можно употреблять несвежий или подсушенный хлеб из пшеничной муки, галетное печенье.
Также допускаются нежирные сорта мяса и рыбы. Однако их нельзя жарить, можно только отварить или приготовить на пару. Молочные продукты, некислый творог и кефир, омлет на пару – все это разрешено к приему.
Из круп предпочтение следует отдать гречке, овсянке, манке или рису. Кроме этого, можно включить в свой рацион некоторые виды овощей, например, картофель или морковь, фрукты и ягоды сладкий сортов (предварительно перетертые или запеченные).
Читайте также:
- Профилактика зубочелюстных деформаций. В чем заключается профлактика деформации зубов?
- Почки. Строение почек. Нефрон. Функции и строение нефрона.
- Опухоль почечной лоханки - клиника, лечение
- Введение в лучевую диагностику травм плеча
- Влияние коронарного кровотока на сердечный выброс. Влияние на сердечный выброс комплекса факторов
