Показания и методика операции при лейомиоме пищевода
Добавил пользователь Валентин П. Обновлено: 29.01.2026
Лейомиома — доброкачественная опухоль, исходящая из гладкой мускулатуры с наиболее частой локализацией в желудочно-кишечном тракте [1]. Частота встречаемости лейомиом 0,005—7,9% [2—4], они составляют 2/3 всех доброкачественных опухолей пищевода. Чаще всего их обнаруживают у пациентов в возрасте от 30 до 59 лет, в 2 раза чаще у мужчин, чем у женщин. Опухоль характеризуется медленным ростом, как правило, ее случайно обнаруживают при проведении диагностических исследований. Лейомиомы размером более 10 см считают гигантскими [5]. Редкими жалобами являются дисфагия, боль в грудной клетке или животе при размере опухоли не менее 5 см [6, 7]. Основой метод лечения — радикальное удаление хирургическим путем (энуклеация). Малоинвазивные вмешательства возможны при небольших размерах образования с применением внутрипросветной эндоскопии, торако- или лапароскопии [7—9]. Публикации по диагностике и лечению пациентов с большими и гигантскими лейомиомами пищевода, как правило, носят описательный характер. Представляем свой опыт диагностики и лечения пациентов с гигантской лейомиомой пищевода. С 2016 по 2018 г. в клинике кафедры госпитальной хирургии находились на лечении 2 больных в возрасте 26 и 28 лет. Приводим оба клинических примера.
Пример 1. Пациент 27 лет впервые обратился в клинику в апреле 2016 г. с жалобами на незначительный дискомфорт в грудной клетке. Из анамнеза: в марте 2016 г. во время прохождения медицинского осмотра при флюорографии органов грудной клетки выявлено новообразование в средостении. По данным эндоскопического исследования (ФЭГДС), просвет пищевода в верхней и средней трети деформирован и сужен из-за субэпителиального образования. Слизистая оболочка над образованием не изменена. При трахеобронхоскопии со средней трети трахеи на протяжении 5—6 см (до бифуркации трахеи) также определяется ее сдавление извне. Рентгенография пищевода и желудка (рис. 1): Рис. 1. Рентгенограмма пищевода до лечения: определяется сужение просвета пищевода в верхней и средней трети из-за подслизистого новообразования (указано стрелкой). в верхней и средней трети пищевода на уровне ThII—VI визуализируется сужение просвета со сдавлением извне на протяжении 11,6 см с неровным нечетким контуром. Заключение: сужение пищевода в верхней и средней трети из-за сдавления извне. МРТ органов грудной клетки (12.05.16) (рис. 2): Рис. 2. Магнитно-резонансные томограммы органов грудной клетки. В верхней и средней трети пищевода в толще стенки определяется образование с неровными контурами (указано стрелкой). в средостении (верхний и средний этаж заднего средостения) выявлено образование с бугристыми контурами 145×38×50 мм. 16.05.16 выполнена торакотомия справа, удалена опухоль пищевода. Выполнена боковая правосторонняя торакотомия по пятому межреберью. В заднем средостении определяется опухоль, исходящая из пищевода, плотно-эластической консистенции, распространяющаяся до верхней апертуры грудной клетки размером 15×8 см. Опухоль удалена. Дефект слизистой оболочки 12 см ушит проленом 3/0. Плевральная полость дренирована. В послеоперационном периоде частичная несостоятельность швов стенки пищевода с формированием ограниченной эмпиемы плевры, которая потребовала дренирования заднего верхнего средостения. Дефект закрылся на фоне консервативного лечения. При рентгеноскопии пищевода и желудка (рис. 3, а, Рис. 3. Рентгенограммы пищевода после хирургического лечения. а — при выписке (проходимость пищевода не нарушена, визуализируется умеренная деформация просвета пищевода); б — через 1 год после вмешательства (проходимость органа не нарушена, определяется деформация просвета пищевода, не препятствующая прохождению контрастного вещества). б) накануне выписки и через 1 год после операции акт глотания не нарушен. Пищевод деформирован, но свободно проходим для бариевой взвеси. По результатам патоморфологического исследования — лейомиома (рис. 4, а). Рис. 4. Микрофотограммы удаленной опухоли. a — окраска гематоксилином и эозином, ув. 200; б, в — иммуногистохимическое исследование удаленной опухоли (окрашивание на виментин, ув. 200). При патоморфологическом (31368/16) и ИГХ-исследовании (см. рис. 4, б, в): малоклеточная опухоль, построенная из вытянутых клеток с овальными, вытянутыми и полиморфными ядрами, эозинофильной цитоплазмой. Collgen IV (Clone CIV 22, Monosan) +; S-100 (Polyclonal, Ventana) -/+; Vimetin (Clone 9, Ventana) +; Ki-67 (Clone 30−9, Ventana) менее 1%; SM Actin (Clone 1A4, Cell Marque) +; NSE (Polyclonal Antobody, Spring Bioscience) −/+; Desmin (Clone De-R-11, Ventana) +; EMA (Clone E 29, Ventana) -/+. Лейомиома. Выписан из стационара 05.07.16.
Пример 2. Пациент 26 лет поступил в клинику 21.08.18 с жалобой на периодически возникающие затруднения при глотании. Из анамнеза: в 2012 г. при ФЭГДС выявлено подслизистое новообразование в нижней трети пищевода. При повторном исследовании в 2015 г. образование не обнаружено. Жалобы появились около 5 мес назад. При эндоскопическом исследовании (рис. 5, а): Рис. 5. Результаты обследования больного до операции. а — на эндофотограмме сужение просвета пищевода из-за подслизистого новообразования (указано стрелкой); б, в — на эндосонограммах определяется гипоэхогенная опухоль с гиперэхогенными включениями (указано стрелкой). в нижней трети пищевода с 35 до 40 см просвет деформирован из-за образования, выбухающего в просвет пищевода и занимающего не менее ½ его полуокружности. При эндоУЗИ (см. рис. 5, б, в), в нижней трети пищевода выявлена негомогенно гипоэхогенная с гиперэхогенными включениями опухоль с умеренной васкуляризацией, с четкими границами, распространяющаяся на 4/5 окружности и на глубину до 3 см, с ровными контурами, исходящая из собственного мышечного слоя органа, не выходя за его пределы. При мультиспиральной томографии органов грудой клетки (21.08.18) (рис. 6) Рис. 6. Мультиспиральные компьютерные томограммы органов грудной клетки в аксиальной (а), сагиттальной (б) и корональной (в) проекциях. В нижней трети пищевода определяется образование (указано стрелкой). выявлено новообразование в нижней трети пищевода на уровне тел ThIX—XI длиной около 8 см, доходящее до кардиальной части желудка. 10.09.18 произведена лапаротомия, удалена опухоль нижней трети пищевода, выполнена фундопликация по Ниссену. В нижней трети пищевода выше уровня диафрагмы плотная опухоль размером 10×5 см, незначительно смещаемая. Опухоль выделена тупым и острым путем и удалена. Дефект слизистой оболочки ушит непрерывным швом (викрил 4/0), мышца ушита одиночными швами (викрил 3/0). Фундопликация по Ниссену с дополнительным укреплением зоны ушивания пищевода. Макропрепарат: опухоль 10×5,5×3 см на разрезе серого цвета, дольчатого строения (рис. 7). Рис. 7. Послеоперационная фотография удаленной подслизистой оболочки опухоли нижней трети пищевода. Патоморфологическое исследование: хаотично переплетающиеся пучки вытянутых клеток с палочковидными или овальной формы ядрами без митозов, что соответствует лейомиоме. Послеоперационный период без особенностей. Р-скопия пищевода 17.09.18: пищевод свободно проходим для бариевой взвеси, задержки контрастного вещества нет. Питание восстановлено. Выписан 20.09.18.
Наиболее частой (60%) локализацией лейомиомы является нижняя треть пищевода, реже она локализуется в средней (30%) и верхней (10%) трети пищевода [1]. Чаще всего заболевание диагностируют при рентгеноскопии пищевода, эндоскопическом исследовании, рентгеновской спиральной компьютерной томографии и эндоУЗИ. Мнения по поводу проведения биопсии при эндоскопическом исследовании неоднозначны, поскольку лейомиома способствует формированию фиброза в слизистой оболочке, увеличивая риск перфорации при выделении опухоли в процессе хирургического вмешательства. Кроме того, тонкоигольная аспирационная биопсия не позволяет дать заключение из-за малого количества материала и частых некрозов в центре опухоли [6—8]. Эндоскопическое удаление опухоли с использованием гибкой эндоскопии возможно при размерах образования не более 2—4 см [10]. При размерах опухоли от 5 до 8 см возможно применение видеоторако- или лапароскопии в зависимости от локализации образования. При размерах образования более 8 см использование малоинвазивных технологий требует определенных навыков и технически сложно выполнимо. Существует также высокий риск осложнений в виде кровотечения при выделении опухоли, несостоятельности швов стенки пищевода и нарушения его моторики в послеоперационном периоде [11, 12]. Тоннельные вмешательства в таком случае не показаны, хотя могут быть полезны при выделении опухоли [12]. В такой ситуации чаще прибегают к экстирпации пищевода с эзофагогастропластикой, что может значительно ухудшить качество жизни пациентов. В наших наблюдениях при размере опухоли 10 см и более выполнены органосохраняющие операции с хорошим клиническим эффектом. Основаниями для выполнения таких вмешательств послужили опыт операций на пищеводе и возраст пациентов. Оба пациента не имеют нарушений при приеме пищи, физически активны, без признаков нарушения трудоспособности.
Таким образом, современные возможности мультидисциплинарного подхода в диагностике и лечении пациентов с гигантской лейомиомой пищевода позволяют выполнять удаление опухоли без резекции или экстирпации органа, что, безусловно, отражается на уровне качества жизни пациентов.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Показания и методика операции при лейомиоме пищевода
Показания и методика операции по удалению лейомиомы пищевода
а) Показания к операции при лейомиоме пищевода. Лейомиомы исходят из мышечного слоя пищеводной стенки. Слизистая оболочка не остаётся интактной над доброкачественной опухолью. Поэтому при рентгенографии пищевода выявляемый дефект заполнения имеет ровные контуры, полукругом вдаваясь в просвет пищевода.
Эти поражения легко дифференцировать от более частых злокачественных поражений слизистой оболочки. Если лейомиома большая, её можно увидеть на обзорной рентгенограмме груди или при рентгеновской КТ. Если опухоль настолько большая, что вызывает дисфагию, то её характерные рентгенологические признаки почти всегда позволяют поставить верный диагноз.
При эзофагоскопии видна интактная слизистая оболочка над местом поражения, выбухающая в просвет пищевода. Не следует проводить биопсию слизистой оболочки над опухолью, поскольку от этого возникнет рана слизистой, которая превратится в дефект пищеводной стенки во время последующего удаления лейомиомы. Если рентгенологические находки характерны для лейомиомы, а дисфагия незначительна или отсутствует, тогда некоторые хирурги предпочитают тактику наблюдения за больным и удаляют опухоль только при нарастании симптоматики.
Однако большинство специалистов считают, что лейомиомы нужно удалять сразу же, чтобы предупредить или облегчить их проявления, а сделать это легче, когда опухоли небольшие и более податливые. Резекция пищевода необходима очень редко.
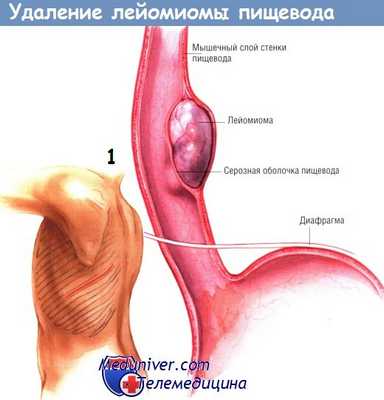
б) Техника удаления лейомиомы пищевода. После введения в наркоз больному необходимо выполнить эзофагоскопию гибким аппаратом, чтобы определить локализацию опухоли и контролировать герметичность слизистой оболочки после удаления лейомиомы. Больного укладывают в положение для боковой торакотомии. Большинство лейомиом пищевода можно удалить через правую половину груди.
Однако опухоли, лежащие в зоне соединения пищевода с желудком, необходимо удалять из левостороннего доступа. На иллюстрациях представлена именно такая операция. В грудную клетку входят через шестое межреберье.
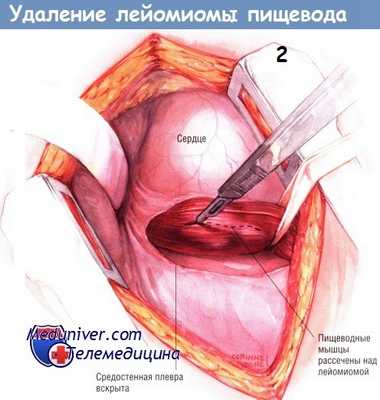
Рассекают плевру средостения, идентифицируют пищевод и выделяют его по окружности. Патологический участок без труда пальпируется в стенке пищевода. У него плотная консистенция, напоминающая резину, легко отличающаяся от злокачественной неоплазмы. Иногда обнаружить опухоль помогает фиброэзофагоскопия. После того, как пищевод будет мобилизован и обведён дренажем Пенроуза, скальпелем рассекают его наружный продольный мышечный слой.
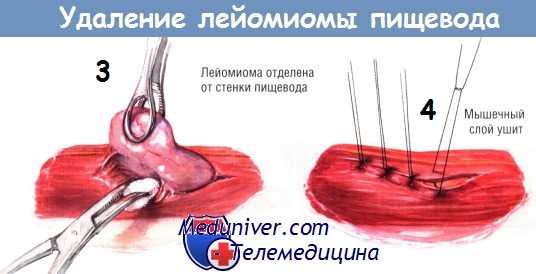
Путём острой и тупой диссекции лейомиому обычно удаётся легко удалить из стенки пищевода, не вскрывая его просвет. Если в пищеводе ещё находится эзофагоскоп, целостность стенки органа проверяют, нагнетая воздух в его просвет. После удаления опухоли мышцы пищевода соединяют серией одиночных узловых швов шёлком № 3/0. Плевральную полость дренируют трубчатым дренажем и зашивают рану на грудной стенке.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Показания и методика торакоскопического удаления лейомиомы пищевода
а) Показания к торакоскопическому удалению лейомиомы пищевода. Показания к удалению лейомиомы пищевода с использованием техники торакальной хирургии с видеоподдержкой не отличаются от тех, что были перечислены ранее применительно к открытым операциям.
Кроме них, следует иметь в виду ограничения, свойственные торакальной хирургии с видеоподдержкой: невозможность перенести вентиляцию одного лишь лёгкого и предыдущие большие операции в плевральной полости со стороны доступа.
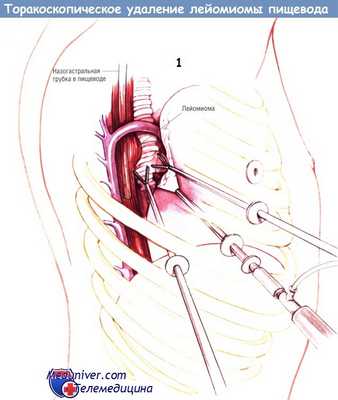
б) Техника торакоскопического удаления лейомиомы пищевода. После введения больного в наркоз ему вводят двухпросветную эндотрахеальную трубку и убеждаются в её правильном расположении путём бронхоскопии и аускультации. К большинству опухолей можно подойти через правую плевральную полость.
Исключение составляют дистальные опухоли, их следует удалять через левосторонний доступ. На иллюстрациях представлена операция через правосторонний доступ. После эзофагоскопии гибким аппаратом эндоскоп оставляют на месте. Больному придают положение на левом боку. Устанавливают, как минимум, три порта шириной 1 см в четвёртом, шестом и седьмом межреберьях.
Если необходима тракция пищевода, устанавливают дополнительный 5-миллиметровый порт в третьем межреберье. Вокруг пищевода проводят дренаж Пенроуза и выводят через этот порт. Торакоскоп вводят через средний порт.
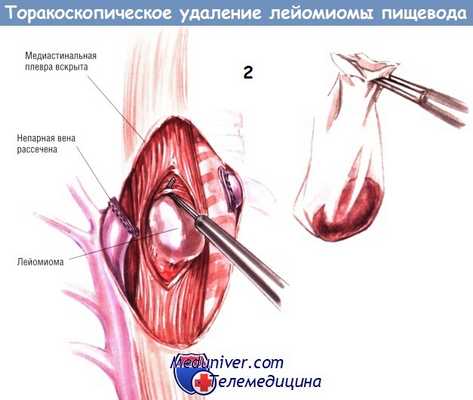
Лёгкое отводят вперёд и рассекают медиастинальную плевру над той секцией пищевода, где расположена опухоль. На рисунке опухоль расположена на уровне непарной вены, в этом случае вену мобилизуют и рассекают эндоскопическим линейным резаком/сосудистым степлером. Миотомию пищевода над опухолью в продольном направлении выполняют крючком-коагулятором, током низкого напряжения.
Энуклеацию лейомиомы выполняют тупым путём. После отделения её помещают в эндоскопический мешок, чтобы уменьшить диссеминацию опухоли при её извлечении через канал от одного из торакопортов.
Целостность слизистой оболочки оценивают путём инсуффляции воздуха через эзофагоскоп при одновременной окклюзии дистального отдела пищевода тампоном. В последнюю очередь сшивают разрез мышечного слоя пищевода отдельными узловыми швами шёлком № 4/0. Плевральную полость дренируют небольшой трубкой, введённой через место, где стоял самый низкий порт. Места установки других портов закрывают.

Алтайский государственный медицинский университет, кафедра общей хирургии, городская больница №12, Барнаул
Кафедра общей хирургии ГБОУ ВПО «Алтайский государственный медицинский университет» Минздрава России, Барнаул
Кафедра общей хирургии ГБОУ ВПО «Алтайский государственный медицинский университет» МЗ РФ, Россия
Отделение общей хирургии
Эндовидеохирургическое удаление лейомиом пищевода
Журнал: Эндоскопическая хирургия. 2015;21(2): 3‑7
С использованием эндовидеохирургических технологий оперированы 13 больных лейомиомой пищевода. Опухоль пищевода маскировалась клиническими проявлениями сопутствующих заболеваний (гастроэзофагеальная рефлюксная болезнь — ГЭРБ, явления гастрита и пр.). Лишь у 3 больных имелась дисфагия I степени. Для подтверждения диагноза проводились эндоскопическое исследование с ультразвуковым сканированием пищевода, контрастная рентгеноскопия пищевода. Щипковую биопсию слизистой оболочки пищевода над опухолевым новообразованием проводили не менее чем за 10 дней перед предстоящим хирургическим вмешательством с учетом эпителизации дефектов слизистой оболочки. У 9 пациентов с локализацией опухоли в грудном отделе выполнено ее удаление торакоскопически, а у 4 с лейомиомой нижнегрудного отдела пищевода, сочетанной с грыжей пищеводного отверстия диафрагмы и ГЭРБ, — видеолапароскопическая энуклеация опухоли с формированием фундопликационной манжеты. В раннем послеоперационном периоде перфорация нижнегрудного отдела пищевода возникла у 2 больных после видеоторакоскопической энуклеации опухоли, что потребовало видеолапаротрансхиатального дренирования заднего средостения, видеоассистированной еюностомии по Майдлю. В 1 случае через 7 мес после операции развился рубцовый стеноз нижней трети пищевода, который устранен путем ортоградного бужирования пищевода.
Доброкачественные подслизистые опухоли пищевода обычно протекают бессимптомно, являясь случайной находкой при рентгенологическом или эндоскопическом исследовании пищевода [1—3]. Из подслизистых опухолей пищевода чаще всего выявляется лейомиома, значительно реже — киста пищевода, нейрофиброма, опухоли сосудистого происхождения, а также эктопия поджелудочной железы [3, 4], гастроинтестинальные стромальные опухоли — GIST [5, 6].
Дооперационная дифференциальная диагностика подслизистых новообразований пищевода затруднена. Наиболее информативным методом является эндоскопическое ультразвуковое исследование (УЗИ), которое позволяет определить, из какого слоя стенки пищевода исходит новообразование [4, 5, 7], без достаточно достоверных признаков характера заболевания. Согласно данным П.Л. Щербакова [3], тонкоигольная пункция с аспирационной биопсией при эндоскопическом ультразвуковом сканировании повышает точность диагностики до 94%. Вместе с тем, согласно данным литературы, для подтверждения диагноза GIST необходим забор большей массы биопсийного материала с последующим гистохимическим исследованием, которое проводится в течение нескольких дней [8, 9]. Проведение щипковой биопсии слизистой оболочки (СО) пищевода при подслизистых новообразованиях не позволяет получить ткань опухоли и создает опасность перфорации СО во время удаления опухоли со стороны мышечного слоя. В связи с этим в отсутствие видимых изменений СО над опухолью некоторые авторы [2, 8] рекомендуют воздержаться от проведения этого исследования. Однако без ее выполнения без эндоУЗИ трудно доказать, что опухоль расположена в подслизистом слое пищевода. Изложенное указывает на отсутствие достоверных методов морфологического подтверждения характера опухолевого процесса до операции и интраоперационно.
Общепринятой тактикой при доброкачественных подслизистых опухолях и GIST пищевода является удаление этих образований без резекции органа [5, 9—12].
Ю.Л. Шевченко [2], А.П. Уханов [10] для этого рекомендуют трансторакальный доступ. М.Ф. Черкасов [11, 12] удаление лейомиомы пищевода в нижнегрудном отделе выполнял из торакоскопического доступа, а в абдоминальном отделе пищевода — лапароскопически.
По мнению Ю.Г. Старкова [5], при выборе хирургического доступа необходимо руководствоваться размером опухоли, ее распространенностью за пределы органа и наличием признаков злокачественности. При локализации опухоли в мышечной пластинке СО или подслизистом слое предпочтение следует отдавать эндоскопическим методам лечения. Если опухоль исходит из мышечного слоя, необходимо выполнять эндовидеохирургическое вмешательство.
Цель исследования — изучить целесообразность использования эндовидеохирургических технологий для удаления доброкачественных подслизистых опухолей пищевода.
Материал и методы
По поводу лейомиомы пищевода оперированы 13 пациентов. Большинство из них находились в наиболее трудоспособном возрасте, женщин было в 1,6 раза больше, чем мужчин.
Лейомиома пищевода маскировалась клиническими проявлениями сопутствующих заболеваний (гастроэзофагеальная рефлюксная болезнь — ГЭРБ, явления гастрита и пр.). Лишь у 3 больных имелась дисфагия I степени.
Эндоскопически отмечалось выбухание стенки пищевода в его просвет круглой или овальной формы с неизмененной, подвижной относительно опухоли С.О. Нарушения проходимости пищевода для фиброскопа в области опухоли не было ни у одного больного. У 4 пациентов ниже опухоли были выявлены признаки грыжи пищеводного отверстия диафрагмы в виде циркулярного сужения просвета желудка дистальнее зубчатой линии, хронический эзофагит.
Наиболее часто опухоль располагалась в нижнегрудном отделе пищевода, в 32,8±1,5 см от верхних резцов. В 2 случаях выбухание стенки пищевода было расположено непосредственно над зубчатой линией, локализация новообразования в средней трети грудного отдела пищевода (25 см от резцов) была у 1 пациента.
Размеры выбухания СО пищевода всегда были меньше истинных размеров опухоли и колебались от 0,8 см в диаметре до 3,0×4,0 см, в среднем 2,1±0,4×2,3±0,4 см. Щипковую биопсию СО пищевода над опухолевым новообразованием проводили не менее чем за 10 дней перед предстоящим хирургическим вмешательством с учетом эпителизации дефектов С.О. При гистологическом исследовании биоптатов у всех больных выявлены фрагменты многослойного плоского эпителия без подлежащих тканей, в 2 случаях — с признаками хронического воспаления, что указывало на локализацию опухоли вне СО.
При ультразвуковом сканировании пищевода на уровне подслизистого выпячивания лоцировалось образование пониженной эхогенности с четкими контурами, неоднородной структуры, с участками более низкой эхогенности, исходящее из собственной мышечной пластинки СО (если четко прослеживался мышечный слой) или мышечного слоя пищевода.
Рентгенологически у 8 (61,5%) больных опухоль локализовалась в нижнегрудном отделе пищевода, у 1 (7,7%) дефект наполнения с четкими контурами располагался на уровне V грудного позвонка (рис. 1, а, б).
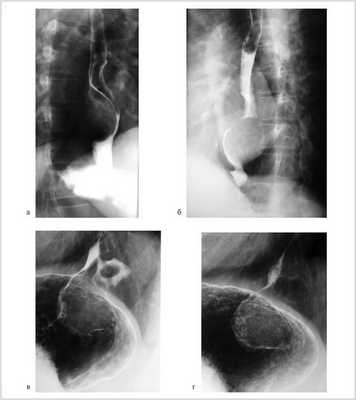
Рис. 1. Рентгенограммы пищевода больных с лейомиомой пищевода (а, б) и пациента с лейомиомой пищевода, сочетанной с кардиальной грыжей пищеводного отверстия диафрагмы (в, г).
У 3 (23,1%) пациентов кардиальный отдел желудка, у 1 (7,7%) больного — кардия и дно желудка были смещены в заднее средостение. Дефект наполнения пищевода у этих пациентов был расположен непосредственно выше области пищеводно-желудочного перехода (см. рис. 1, в, г).
Все пациенты оперированы с использованием эндовидеохирургических технологий. Преимущественно — у 8 (61,5%) больных — выполнялась видеоторакоскопическая энуклеация лейомиомы пищевода из правостороннего доступа. Основанием для видеоторакоскопического вмешательства через левую плевральную полость у 1 (7,7%) пациентки послужили большие размеры опухоли (8×10 см) и ее пролабирование в левую плевральную полость. У 4 (30,8%) пациентов при сочетании лейомиомы пищевода с аксиальной грыжей пищеводного отверстия диафрагмы была произведена видеолапароскопическая энуклеация лейомиомы пищевода с последующей разработанной нами дозированной эзофагофундопликацией (см. таблицу).

Характер выполненных хирургических вмешательств
У 6 (66,7%) больных, оперированных торакоскопически, опухоль контурировалась через медиастинальную плевру или становилась доступной после ее рассечения (рис. 2, а, б).
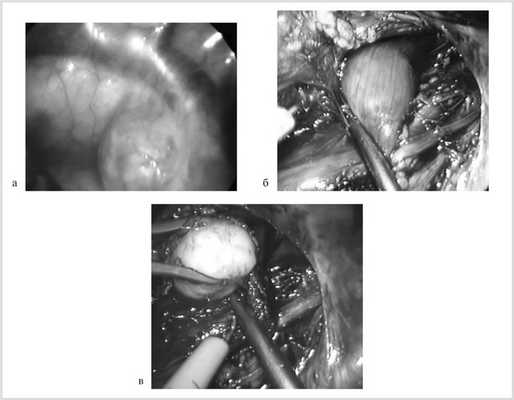
Рис. 2. Фрагмент операции: лейомиома пищевода контурируется через медиастинальную плевру (а), после медиастинотомии (б); внеслизистое выделение лейомиомы пищевода (в).
У 3 (33,3%) пациентов для интраоперационного позиционирования опухоли, диаметр которой не превышал 1 см, выполнена фиброэзофагоскопия с эффектом трансиллюминации. В 1 случае визуализация опухоли стала возможной после клипирования и пересечения непарной вены.
На уровне опухоли производили мобилизацию пищевода на протяжении 4—5 см до ½ его полуокружности. Эндокрючком с использованием монополярной диатермокоагуляции над опухолью выполняли продольную миотомию. Опухоль в капсуле выделяли из окружающих тканей без повреждения СО (см. рис. 2, в).
Края рассеченной мышечной оболочки сшивали непрерывным интракорпоральным швом неабсорбирующейся нитью на атравматичной игле. Целостность С.О. пищевода визуально контролировали посредством интраоперационной фиброэзофагоскопии, а герметичность швов — путем пневмопрессии.
Размеры удаленных опухолей колебались от 0,5 см в диаметре до 8,0×10,0 см, в среднем составили 2,8±0,6×2,6±0,5 см (рис. 3). В 1 случае были удалены 2 рядом расположенные опухоли диаметром 0,5 и 1,5 см, создававших на рентгенограмме единый дефект наполнения 2,0×2,0 см.
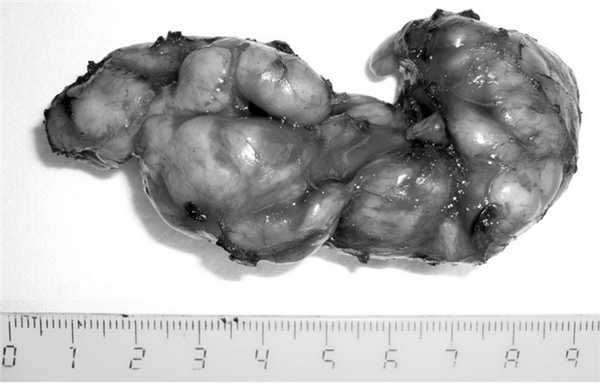
Рис. 3. Лейомиома пищевода (макропрепарат).
При гистологическом исследовании макропрепаратов у всех оперированных больных была подтверждена доброкачественная опухоль из гладкомышечной ткани (лейомиома).
Интраоперационное осложнение (повреждение СО пищевода) возникло у одной пациентки, которое было диагностировано на операционном столе. Дефект С.О. зашит интракорпоральным непрерывным швом абсорбирующейся нитью с восстановлением целостности мышечной оболочки. На 2-е сутки после операции наступила несостоятельность швов нижней трети пищевода, что проявилось рентгенологической картиной левостороннего гидроторакса. После видеолапароскопического зашивания перфоративного отверстия пищевода, видеолапаротрансхиатального дренирования заднего средостения, видеоассистированной еюностомии по Майдлю, дренирования левой плевральной полости достигнуто рубцевание перфоративного отверстия.
У второго больного перфорация нижней трети грудного отдела пищевода возникла на 7-е сутки после правосторонней видеоторакоскопической энуклеации лейомиомы пищевода. Для устранения осложнения были выполнены этапные санационные видеоторакоскопии справа с дренированием заднего средостения, в последующем — видеолапаротрансхиатальное дренирование заднего средостения, видеоассистированная еюностомия по Майдлю.
Летальных исходов не было. Средняя продолжительность послеоперационной реабилитации больных составила 18,2±7,8 дня, продолжительность стационарного лечения — 26,4±8 дня. В 1 случае через 7 мес после операции развился рубцовый стеноз нижней трети пищевода. После исключения рецидива заболевания проходимость пищевода восстановилась после однократного ортоградного бужирования пищевода по направителю. Рецидива заболевания не отмечено ни у одного из больных в течение от 1 года до 15 лет после операции.
Заключение
При лейомиоме в грудном отделе пищевода показана правосторонняя видеоторакоскопическая ее энуклеация, у больных с локализацией новообразования в абдоминальном отделе или на уровне диафрагмы, а также при сочетании с аксиальной грыжей пищеводного отверстия диафрагмы необходима видеолапароскопическая энуклеация опухоли с укрытием дефекта мышечной оболочки пищевода фундопликационной манжетой.
Использование интраоперационной эзофагоскопии позволяет определить локализацию опухолей малого диаметра, осуществить контроль целостности СО пищевода после удаления опухоли и провести пробу на герметичность швов.
Читайте также:
- Лейкопоэз на фоне острой лучевой болезни. Сепсис на фоне радиационной пневмонии
- Лечение пучковой головной боли. Лечение приступа головной боли.
- Синдром недостаточности тазовых органов. Синдром обструкции или анизма
- Лучевая диагностика периапикального рарефицирующего остеита зуба
- Симптомы и лечение атеросклероза сосудов
