Показания и методика торакоскопического удаления лейомиомы пищевода
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Алтайский государственный медицинский университет, кафедра общей хирургии, городская больница №12, Барнаул
Кафедра общей хирургии ГБОУ ВПО «Алтайский государственный медицинский университет» Минздрава России, Барнаул
Кафедра общей хирургии ГБОУ ВПО «Алтайский государственный медицинский университет» МЗ РФ, Россия
Отделение общей хирургии
Эндовидеохирургическое удаление лейомиом пищевода
Журнал: Эндоскопическая хирургия. 2015;21(2): 3‑7
С использованием эндовидеохирургических технологий оперированы 13 больных лейомиомой пищевода. Опухоль пищевода маскировалась клиническими проявлениями сопутствующих заболеваний (гастроэзофагеальная рефлюксная болезнь — ГЭРБ, явления гастрита и пр.). Лишь у 3 больных имелась дисфагия I степени. Для подтверждения диагноза проводились эндоскопическое исследование с ультразвуковым сканированием пищевода, контрастная рентгеноскопия пищевода. Щипковую биопсию слизистой оболочки пищевода над опухолевым новообразованием проводили не менее чем за 10 дней перед предстоящим хирургическим вмешательством с учетом эпителизации дефектов слизистой оболочки. У 9 пациентов с локализацией опухоли в грудном отделе выполнено ее удаление торакоскопически, а у 4 с лейомиомой нижнегрудного отдела пищевода, сочетанной с грыжей пищеводного отверстия диафрагмы и ГЭРБ, — видеолапароскопическая энуклеация опухоли с формированием фундопликационной манжеты. В раннем послеоперационном периоде перфорация нижнегрудного отдела пищевода возникла у 2 больных после видеоторакоскопической энуклеации опухоли, что потребовало видеолапаротрансхиатального дренирования заднего средостения, видеоассистированной еюностомии по Майдлю. В 1 случае через 7 мес после операции развился рубцовый стеноз нижней трети пищевода, который устранен путем ортоградного бужирования пищевода.
Доброкачественные подслизистые опухоли пищевода обычно протекают бессимптомно, являясь случайной находкой при рентгенологическом или эндоскопическом исследовании пищевода [1—3]. Из подслизистых опухолей пищевода чаще всего выявляется лейомиома, значительно реже — киста пищевода, нейрофиброма, опухоли сосудистого происхождения, а также эктопия поджелудочной железы [3, 4], гастроинтестинальные стромальные опухоли — GIST [5, 6].
Дооперационная дифференциальная диагностика подслизистых новообразований пищевода затруднена. Наиболее информативным методом является эндоскопическое ультразвуковое исследование (УЗИ), которое позволяет определить, из какого слоя стенки пищевода исходит новообразование [4, 5, 7], без достаточно достоверных признаков характера заболевания. Согласно данным П.Л. Щербакова [3], тонкоигольная пункция с аспирационной биопсией при эндоскопическом ультразвуковом сканировании повышает точность диагностики до 94%. Вместе с тем, согласно данным литературы, для подтверждения диагноза GIST необходим забор большей массы биопсийного материала с последующим гистохимическим исследованием, которое проводится в течение нескольких дней [8, 9]. Проведение щипковой биопсии слизистой оболочки (СО) пищевода при подслизистых новообразованиях не позволяет получить ткань опухоли и создает опасность перфорации СО во время удаления опухоли со стороны мышечного слоя. В связи с этим в отсутствие видимых изменений СО над опухолью некоторые авторы [2, 8] рекомендуют воздержаться от проведения этого исследования. Однако без ее выполнения без эндоУЗИ трудно доказать, что опухоль расположена в подслизистом слое пищевода. Изложенное указывает на отсутствие достоверных методов морфологического подтверждения характера опухолевого процесса до операции и интраоперационно.
Общепринятой тактикой при доброкачественных подслизистых опухолях и GIST пищевода является удаление этих образований без резекции органа [5, 9—12].
Ю.Л. Шевченко [2], А.П. Уханов [10] для этого рекомендуют трансторакальный доступ. М.Ф. Черкасов [11, 12] удаление лейомиомы пищевода в нижнегрудном отделе выполнял из торакоскопического доступа, а в абдоминальном отделе пищевода — лапароскопически.
По мнению Ю.Г. Старкова [5], при выборе хирургического доступа необходимо руководствоваться размером опухоли, ее распространенностью за пределы органа и наличием признаков злокачественности. При локализации опухоли в мышечной пластинке СО или подслизистом слое предпочтение следует отдавать эндоскопическим методам лечения. Если опухоль исходит из мышечного слоя, необходимо выполнять эндовидеохирургическое вмешательство.
Цель исследования — изучить целесообразность использования эндовидеохирургических технологий для удаления доброкачественных подслизистых опухолей пищевода.
Материал и методы
По поводу лейомиомы пищевода оперированы 13 пациентов. Большинство из них находились в наиболее трудоспособном возрасте, женщин было в 1,6 раза больше, чем мужчин.
Лейомиома пищевода маскировалась клиническими проявлениями сопутствующих заболеваний (гастроэзофагеальная рефлюксная болезнь — ГЭРБ, явления гастрита и пр.). Лишь у 3 больных имелась дисфагия I степени.
Эндоскопически отмечалось выбухание стенки пищевода в его просвет круглой или овальной формы с неизмененной, подвижной относительно опухоли С.О. Нарушения проходимости пищевода для фиброскопа в области опухоли не было ни у одного больного. У 4 пациентов ниже опухоли были выявлены признаки грыжи пищеводного отверстия диафрагмы в виде циркулярного сужения просвета желудка дистальнее зубчатой линии, хронический эзофагит.
Наиболее часто опухоль располагалась в нижнегрудном отделе пищевода, в 32,8±1,5 см от верхних резцов. В 2 случаях выбухание стенки пищевода было расположено непосредственно над зубчатой линией, локализация новообразования в средней трети грудного отдела пищевода (25 см от резцов) была у 1 пациента.
Размеры выбухания СО пищевода всегда были меньше истинных размеров опухоли и колебались от 0,8 см в диаметре до 3,0×4,0 см, в среднем 2,1±0,4×2,3±0,4 см. Щипковую биопсию СО пищевода над опухолевым новообразованием проводили не менее чем за 10 дней перед предстоящим хирургическим вмешательством с учетом эпителизации дефектов С.О. При гистологическом исследовании биоптатов у всех больных выявлены фрагменты многослойного плоского эпителия без подлежащих тканей, в 2 случаях — с признаками хронического воспаления, что указывало на локализацию опухоли вне СО.
При ультразвуковом сканировании пищевода на уровне подслизистого выпячивания лоцировалось образование пониженной эхогенности с четкими контурами, неоднородной структуры, с участками более низкой эхогенности, исходящее из собственной мышечной пластинки СО (если четко прослеживался мышечный слой) или мышечного слоя пищевода.
Рентгенологически у 8 (61,5%) больных опухоль локализовалась в нижнегрудном отделе пищевода, у 1 (7,7%) дефект наполнения с четкими контурами располагался на уровне V грудного позвонка (рис. 1, а, б).
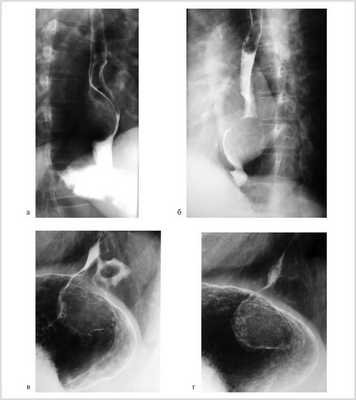
Рис. 1. Рентгенограммы пищевода больных с лейомиомой пищевода (а, б) и пациента с лейомиомой пищевода, сочетанной с кардиальной грыжей пищеводного отверстия диафрагмы (в, г).
У 3 (23,1%) пациентов кардиальный отдел желудка, у 1 (7,7%) больного — кардия и дно желудка были смещены в заднее средостение. Дефект наполнения пищевода у этих пациентов был расположен непосредственно выше области пищеводно-желудочного перехода (см. рис. 1, в, г).
Все пациенты оперированы с использованием эндовидеохирургических технологий. Преимущественно — у 8 (61,5%) больных — выполнялась видеоторакоскопическая энуклеация лейомиомы пищевода из правостороннего доступа. Основанием для видеоторакоскопического вмешательства через левую плевральную полость у 1 (7,7%) пациентки послужили большие размеры опухоли (8×10 см) и ее пролабирование в левую плевральную полость. У 4 (30,8%) пациентов при сочетании лейомиомы пищевода с аксиальной грыжей пищеводного отверстия диафрагмы была произведена видеолапароскопическая энуклеация лейомиомы пищевода с последующей разработанной нами дозированной эзофагофундопликацией (см. таблицу).

Характер выполненных хирургических вмешательств
У 6 (66,7%) больных, оперированных торакоскопически, опухоль контурировалась через медиастинальную плевру или становилась доступной после ее рассечения (рис. 2, а, б).
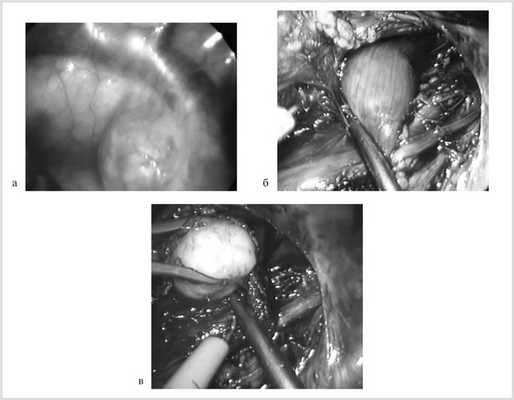
Рис. 2. Фрагмент операции: лейомиома пищевода контурируется через медиастинальную плевру (а), после медиастинотомии (б); внеслизистое выделение лейомиомы пищевода (в).
У 3 (33,3%) пациентов для интраоперационного позиционирования опухоли, диаметр которой не превышал 1 см, выполнена фиброэзофагоскопия с эффектом трансиллюминации. В 1 случае визуализация опухоли стала возможной после клипирования и пересечения непарной вены.
На уровне опухоли производили мобилизацию пищевода на протяжении 4—5 см до ½ его полуокружности. Эндокрючком с использованием монополярной диатермокоагуляции над опухолью выполняли продольную миотомию. Опухоль в капсуле выделяли из окружающих тканей без повреждения СО (см. рис. 2, в).
Края рассеченной мышечной оболочки сшивали непрерывным интракорпоральным швом неабсорбирующейся нитью на атравматичной игле. Целостность С.О. пищевода визуально контролировали посредством интраоперационной фиброэзофагоскопии, а герметичность швов — путем пневмопрессии.
Размеры удаленных опухолей колебались от 0,5 см в диаметре до 8,0×10,0 см, в среднем составили 2,8±0,6×2,6±0,5 см (рис. 3). В 1 случае были удалены 2 рядом расположенные опухоли диаметром 0,5 и 1,5 см, создававших на рентгенограмме единый дефект наполнения 2,0×2,0 см.
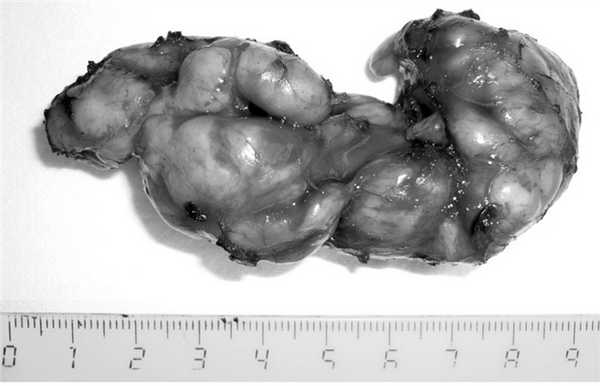
Рис. 3. Лейомиома пищевода (макропрепарат).
При гистологическом исследовании макропрепаратов у всех оперированных больных была подтверждена доброкачественная опухоль из гладкомышечной ткани (лейомиома).
Интраоперационное осложнение (повреждение СО пищевода) возникло у одной пациентки, которое было диагностировано на операционном столе. Дефект С.О. зашит интракорпоральным непрерывным швом абсорбирующейся нитью с восстановлением целостности мышечной оболочки. На 2-е сутки после операции наступила несостоятельность швов нижней трети пищевода, что проявилось рентгенологической картиной левостороннего гидроторакса. После видеолапароскопического зашивания перфоративного отверстия пищевода, видеолапаротрансхиатального дренирования заднего средостения, видеоассистированной еюностомии по Майдлю, дренирования левой плевральной полости достигнуто рубцевание перфоративного отверстия.
У второго больного перфорация нижней трети грудного отдела пищевода возникла на 7-е сутки после правосторонней видеоторакоскопической энуклеации лейомиомы пищевода. Для устранения осложнения были выполнены этапные санационные видеоторакоскопии справа с дренированием заднего средостения, в последующем — видеолапаротрансхиатальное дренирование заднего средостения, видеоассистированная еюностомия по Майдлю.
Летальных исходов не было. Средняя продолжительность послеоперационной реабилитации больных составила 18,2±7,8 дня, продолжительность стационарного лечения — 26,4±8 дня. В 1 случае через 7 мес после операции развился рубцовый стеноз нижней трети пищевода. После исключения рецидива заболевания проходимость пищевода восстановилась после однократного ортоградного бужирования пищевода по направителю. Рецидива заболевания не отмечено ни у одного из больных в течение от 1 года до 15 лет после операции.
Заключение
При лейомиоме в грудном отделе пищевода показана правосторонняя видеоторакоскопическая ее энуклеация, у больных с локализацией новообразования в абдоминальном отделе или на уровне диафрагмы, а также при сочетании с аксиальной грыжей пищеводного отверстия диафрагмы необходима видеолапароскопическая энуклеация опухоли с укрытием дефекта мышечной оболочки пищевода фундопликационной манжетой.
Использование интраоперационной эзофагоскопии позволяет определить локализацию опухолей малого диаметра, осуществить контроль целостности СО пищевода после удаления опухоли и провести пробу на герметичность швов.
Показания и методика торакоскопического удаления лейомиомы пищевода
Показания и методика операции по удалению лейомиомы пищевода
а) Показания к операции при лейомиоме пищевода. Лейомиомы исходят из мышечного слоя пищеводной стенки. Слизистая оболочка не остаётся интактной над доброкачественной опухолью. Поэтому при рентгенографии пищевода выявляемый дефект заполнения имеет ровные контуры, полукругом вдаваясь в просвет пищевода.
Эти поражения легко дифференцировать от более частых злокачественных поражений слизистой оболочки. Если лейомиома большая, её можно увидеть на обзорной рентгенограмме груди или при рентгеновской КТ. Если опухоль настолько большая, что вызывает дисфагию, то её характерные рентгенологические признаки почти всегда позволяют поставить верный диагноз.
При эзофагоскопии видна интактная слизистая оболочка над местом поражения, выбухающая в просвет пищевода. Не следует проводить биопсию слизистой оболочки над опухолью, поскольку от этого возникнет рана слизистой, которая превратится в дефект пищеводной стенки во время последующего удаления лейомиомы. Если рентгенологические находки характерны для лейомиомы, а дисфагия незначительна или отсутствует, тогда некоторые хирурги предпочитают тактику наблюдения за больным и удаляют опухоль только при нарастании симптоматики.
Однако большинство специалистов считают, что лейомиомы нужно удалять сразу же, чтобы предупредить или облегчить их проявления, а сделать это легче, когда опухоли небольшие и более податливые. Резекция пищевода необходима очень редко.
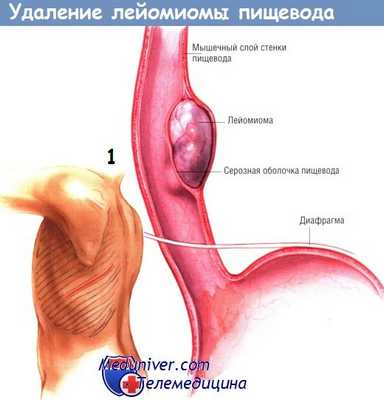
б) Техника удаления лейомиомы пищевода. После введения в наркоз больному необходимо выполнить эзофагоскопию гибким аппаратом, чтобы определить локализацию опухоли и контролировать герметичность слизистой оболочки после удаления лейомиомы. Больного укладывают в положение для боковой торакотомии. Большинство лейомиом пищевода можно удалить через правую половину груди.
Однако опухоли, лежащие в зоне соединения пищевода с желудком, необходимо удалять из левостороннего доступа. На иллюстрациях представлена именно такая операция. В грудную клетку входят через шестое межреберье.
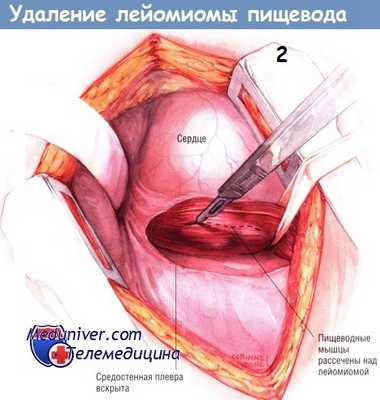
Рассекают плевру средостения, идентифицируют пищевод и выделяют его по окружности. Патологический участок без труда пальпируется в стенке пищевода. У него плотная консистенция, напоминающая резину, легко отличающаяся от злокачественной неоплазмы. Иногда обнаружить опухоль помогает фиброэзофагоскопия. После того, как пищевод будет мобилизован и обведён дренажем Пенроуза, скальпелем рассекают его наружный продольный мышечный слой.
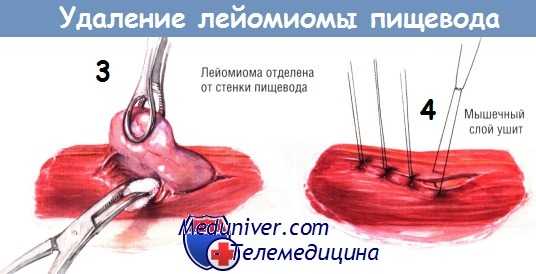
Путём острой и тупой диссекции лейомиому обычно удаётся легко удалить из стенки пищевода, не вскрывая его просвет. Если в пищеводе ещё находится эзофагоскоп, целостность стенки органа проверяют, нагнетая воздух в его просвет. После удаления опухоли мышцы пищевода соединяют серией одиночных узловых швов шёлком № 3/0. Плевральную полость дренируют трубчатым дренажем и зашивают рану на грудной стенке.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Кафедра и клиника хирургии Института последипломного образования Самарского государственного медицинского университета и Самарской областной клинической больницы им. М.И. Калинина
Торакоскопическое удаление гигантской бессимптомной лейомиомы нижнегрудного отдела пищевода
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2015;(3): 90‑92
В настоящее время детально разработаны многие миниинвазивные операции на пищеводе — от удаления небольших доброкачественных новообразований до торакоскопической эзофагэктомии при раке и других заболеваниях [1, 2, 11]. Клинический интерес могут представлять наблюдения редких заболеваний пищевода или больших по размеру опухолей, излеченных торакоскопическим методом [3, 4, 6, 14]. Парадокс заключается в том, что зачастую эндоскопическое выделение и удаление крупных доброкачественных опухолей пищевода, располагающихся большей частью за пределами органа, бывают менее трудоемки, чем поиск малого новообразования, локализованного, как правило, интрамурально, когда имеется необходимость тактильных манипуляций [7, 8, 10]. Лейомиома пищевода — наиболее часто встречающаяся доброкачественная опухоль этого органа [7, 9, 13]. В сериях научно-практических исследований, посвященных хирургии лейомиом пищевода, отчетливо прослеживается эволюция оперативных доступов, реализующаяся в виде экспансии торакоскопических методик [5, 9, 12]. Иллюстрацией этой тенденции является наше наблюдение.
Больная Ш., 50 лет, госпитализирована в отделение торакальной хирургии областной больницы в плановом порядке 27.09.11. Жалоб, характерных для заболеваний пищевода, не предъявляла. Из анамнеза известно, что около 1 мес назад при прохождении ежегодной флюорографии были выявлены изменения в органах грудной клетки, послужившие основанием для дальнейшего обследования. При компьютерной томографии органов грудной клетки определялось опухолевое образование в наддиафрагмальном сегменте пищевода, овоидной формы, размером 12×7 см, исходящее из мышечной стенки органа, с включениями кальцинатов, большей частью располагающееся в левой плевральной полости. Морфоденситометрические характеристики образования наиболее соответствовали гигантской лейомиоме пищевода (рис. 1). Больная консультирована торакальным хирургом и направлена на госпитализацию с целью оперативного лечения.
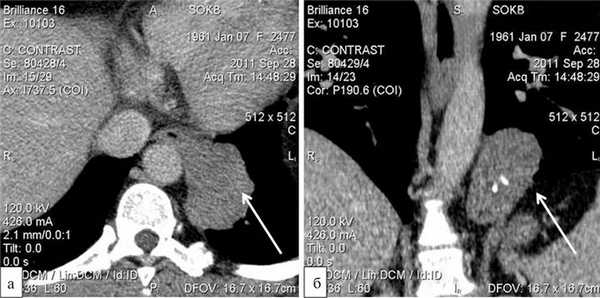
Рис. 1. Компьютерные томограммы органов грудной клетки в аксиальном (а) и фронтальном (б) срезах. Стрелками указана гигантская лейомиома наддиафрагмального сегмента пищевода.
При поступлении общее состояние больной удовлетворительное. Отмечено нормостеническое телосложение с некоторой избыточностью массы тела. При физикальном обследовании патологических изменений внутренних органов не выявлено. Пульс 72 в 1 мин. Артериальное давление 120/85 мм рт.ст.
При рентгеноскопии выявлены пролабирование левого контура пищевода и девиация органа вправо. При ФЭГДС изменений слизистой не определяется. Клинический диагноз: гигантская лейомиома нижнегрудного отдела пищевода. При выборе способа оперативного вмешательства было отдано предпочтение торакоскопии с возможным переходом на открытую операцию.
29.09.11 выполнено оперативное вмешательство под эндотрахеальным наркозом с раздельной вентиляцией легких. В положении больной на правом боку установлено 4 торакопорта: в пятом, седьмом и восьмом межреберьях слева. При торакоскопии выявлено опухолевидное образование в проекции нижней легочной связки, оттесняющее нижнюю долю легкого кверху и диафрагму книзу. Образование округлой формы, диаметром до 13 см. С помощью гармонического скальпеля рассечены нижняя легочная связка и медиастинальная плевра над образованием, которое представляло собой опухоль в капсуле и имело плотную дольчатую структуру (рис. 2). С использованием прецизионной техники выполнена энуклеация новообразования с отделением его от слизистой пищевода без вскрытия просвета органа. После удаления опухоли образовался дефект мышечной оболочки пищевода ромбовидной формы длиной 2 см с выбухающей слизистой. На мышечную стенку пищевода в области дефекта наложены узловые швы рассасывающимися нитями. Линия швов дополнительно укреплена лоскутом медиастинальной плевры. С целью контроля качества швов и состояния слизистой пищевода выполнена интраоперационная фиброэзофагоскопия, повреждений не выявлено. Опухоль удалена из плевральной полости через расширенный до 6 см разрез в восьмом межреберье (рис. 3).
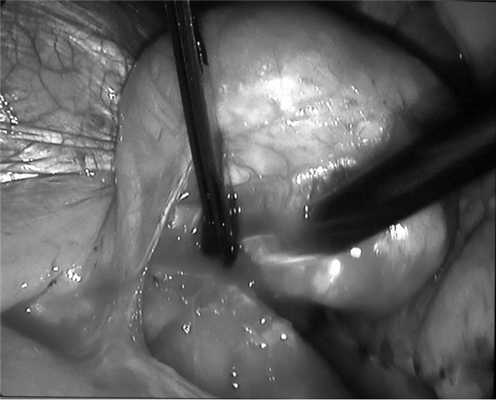
Рис. 2. Интраоперационная фотография. Этап мобилизации лейомиомы пищевода.
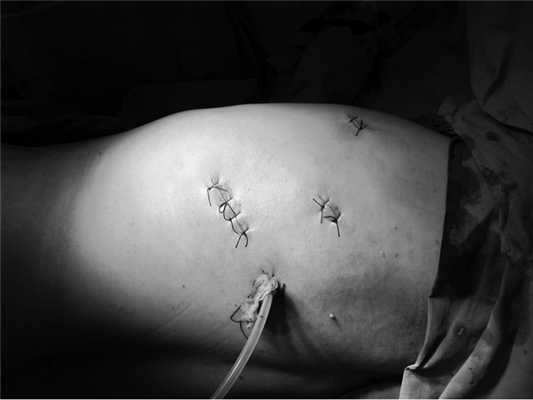
Рис. 3. Вид операционного поля после завершения торакоскопической операции.
Макроскопически лейомиома представляла собой дольчатую опухоль с перетяжкой посередине, размером 12×7 см, плотной хрящевой консистенции, с включениями кальцинатов в глубине тканей (рис. 4).
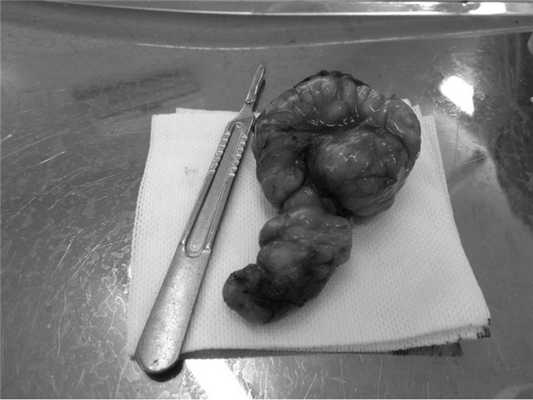
Рис. 4. Макропрепарат. Гигантская лейомиома пищевода размером 12×7 см.
Послеоперационный период протекал без осложнений. Больная рано активизировалась. Со 2-х суток начала питаться. Каких-либо дисфагических нарушений не отмечено. Дренаж удален на 2-е сутки, швы сняты на 7-е сутки после операции. Заживление послеоперационных ран по типу первичного натяжения. Контрольные рентгенологические и ультразвуковые исследования подтвердили отсутствие патологических изменений в левой плевральной полости и в средостении. При плановом гистологическом исследовании клинический диагноз подтвержден — выявлена лейомиома пищевода. Больная выписана в удовлетворительном состоянии через 8 дней после оперативного вмешательства.
В отдаленном периоде больная осмотрена дважды, через 1 и 2 года после операции. Жалоб не предъявляет. Пассаж пищи удовлетворительный. Пищеварение в норме. На контрольных компьютерных томограммах 12.12.13 патологических изменений органов грудной клетки не выявлено.
В представленном наблюдении для удаления гигантской бессимптомной лейомиомы нижнегрудного отдела пищевода успешно применен торакоскопический метод. Особенностями наблюдения являются длительное бессимптомное течение заболевания, большие размеры доброкачественного новообразования, возможности торакоскопии в лечении подобных опухолей.
а) Показания к торакоскопическому удалению лейомиомы пищевода. Показания к удалению лейомиомы пищевода с использованием техники торакальной хирургии с видеоподдержкой не отличаются от тех, что были перечислены ранее применительно к открытым операциям.
Кроме них, следует иметь в виду ограничения, свойственные торакальной хирургии с видеоподдержкой: невозможность перенести вентиляцию одного лишь лёгкого и предыдущие большие операции в плевральной полости со стороны доступа.
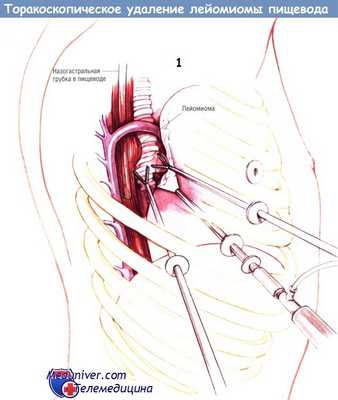
б) Техника торакоскопического удаления лейомиомы пищевода. После введения больного в наркоз ему вводят двухпросветную эндотрахеальную трубку и убеждаются в её правильном расположении путём бронхоскопии и аускультации. К большинству опухолей можно подойти через правую плевральную полость.
Исключение составляют дистальные опухоли, их следует удалять через левосторонний доступ. На иллюстрациях представлена операция через правосторонний доступ. После эзофагоскопии гибким аппаратом эндоскоп оставляют на месте. Больному придают положение на левом боку. Устанавливают, как минимум, три порта шириной 1 см в четвёртом, шестом и седьмом межреберьях.
Если необходима тракция пищевода, устанавливают дополнительный 5-миллиметровый порт в третьем межреберье. Вокруг пищевода проводят дренаж Пенроуза и выводят через этот порт. Торакоскоп вводят через средний порт.
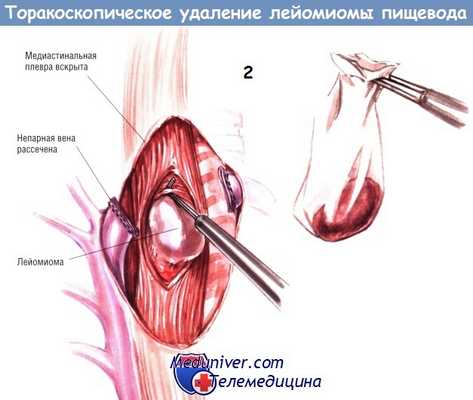
Лёгкое отводят вперёд и рассекают медиастинальную плевру над той секцией пищевода, где расположена опухоль. На рисунке опухоль расположена на уровне непарной вены, в этом случае вену мобилизуют и рассекают эндоскопическим линейным резаком/сосудистым степлером. Миотомию пищевода над опухолью в продольном направлении выполняют крючком-коагулятором, током низкого напряжения.
Энуклеацию лейомиомы выполняют тупым путём. После отделения её помещают в эндоскопический мешок, чтобы уменьшить диссеминацию опухоли при её извлечении через канал от одного из торакопортов.
Целостность слизистой оболочки оценивают путём инсуффляции воздуха через эзофагоскоп при одновременной окклюзии дистального отдела пищевода тампоном. В последнюю очередь сшивают разрез мышечного слоя пищевода отдельными узловыми швами шёлком № 4/0. Плевральную полость дренируют небольшой трубкой, введённой через место, где стоял самый низкий порт. Места установки других портов закрывают.

Читайте также:
- Оральное положение зубов. Вестибулярное положение зубов.
- Случай эмфизематозного пиелонефрита у пациентки с сахарным диабетом, потребовавший нефрэктомии
- Обсессивно-компульсивные расстройства (ОКР) - причины, клиника
- Гипоэхогенные изменения поджелудочной железы. Изоэхогенные изменения поджелудочной железы.
- Моноклональность и гетерогенность онкологических заболеваний - рака
