Предоперационная подготовка при ранениях: катетеризация магистральных вен и инфузионная терапия
Добавил пользователь Евгений Кузнецов Обновлено: 30.01.2026
Пункции и катетеризации вен, в частности центральных, относятся к широко распространенным манипуляциям в практической медицине. Опыт свидетельствует, что эта манипуляция не является достаточно безопасной. Поэтому чрезвычайно важно знание топографической анатомии подключичной вены, техники выполнения этой манипуляции.
За один год в мире устанавливается более 15 миллионов центральных венозных катетеров. Среди доступных для пункции венозных притоков наиболее часто катетеризируют подключичную вену.
Впервые пункция подключичной вены была осуществлена в 1952 году Aubaniac. Им была описана методика пункции из подключичного доступа. Wilson et al. в 1962 году применили подключичный доступ для катетеризации подключичной вены, а через нее – и верхней полой вены. С этого времени чрескожная катетеризация подключичной вены стала широко использоваться для диагностических исследований и лечения. Yoffa в 1965 году внедрил в клиническую практику надключичный доступ для введения катетера в центральные вены через подключичную вену. В дальнейшем были предложены различные модификации надключичного и подключичного доступов в целях повышения вероятности успешной катетеризации и уменьшения риска осложнений. Таким образом, в настоящее время подключичная вена считается удобным сосудом для центральной венозной катетеризации.
Пункционная катетеризация центральных сосудов — это врачебная манипуляция. Пунктироваться могут подключичная вена, яремная и бедренная вены, как слева, так и справа. Центральный венозный катетер может функционировать и быть неинфицированным в течение многих недель. Это достигается путём строго соблюдения правил ухода за катетером, включая соблюдение правил асептики во время его установки, предосторожности при выполнении инфузии и инъекций.
Общий вид набора для катетеризации центральных вен:
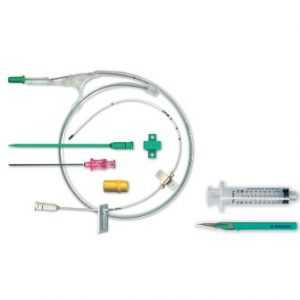
Показания и противопоказания
Выделяют следующие показания для катетеризации центральных вен:
- Сложные операции с возможной массивной кровопотерей
- Операции на открытом сердце с АИК и вообще на сердце
- Необходимость интенсивной терапии
- Парентеральное (внутривенное) питание
- Возможность измерения ЦВД (центрального венозного давления)
- Возможность многократного взятия проб крови для контроля
- Введение электростимулятора сердца
- Рентгено – контрастные исследование сердца
- Зондирование полостей сердца
Противопоказаниями для катетеризации центральных вен служат:
- Нарушение свертываемости крови
- Воспалительные в месте пункции
- Травма ключиц
- Двухсторонний пнемоторакс и некоторые другие
Однако, нужно понимать, что противопоказания являются относительными, т.к. если катетер необходимо поставить по жизненным показаниям, то это будет сделано при любых обстоятельствах, т.к. для спасения жизни ребенка в экстренной ситуации нужен венозный доступ.
Для катетеризации центральных (магистральных) вен может быть выбран один из следующих методов:
- Через периферические вены верхней конечности, чаще локтевого сгиба. Преимущество в данном случае является простота исполнения, катетер проводится до устья верхней полой вены. Недостаток, что катетер может стоять не более двух – трех дне
- Через подключичную вену справа или слева
- Через внутреннюю яремную вену так же справа или слева
Для пункционной катетеризации центральных вен: яремной, подключичной (и, кстати, артерий) используется метод Сельдингера (с проводником), суть которого заключается в следующем:
- Иглой пунктируется вена, через нее проводится проводник на глубину 10 – 12 см
- Далее игла убирается, по проводнику проводится катетер
- После этого проводник убирается, катетер фиксируют к коже пластырем
При длительном нахождении катетера могут возникнуть следующие осложнения:
- тромбирование вены
- тромбирование катетера
- тромбо- и воздушная эмболии
- инфекционные осложнения (5 — 40%), такие как нагноение, сепсис (общее воспаление) и т.д
Именно поэтому катетеризация центральных вен требует тщательного соблюдения правил ухода и наблюдения за катетером:
Предоперационная подготовка при ранениях: катетеризация магистральных вен и инфузионная терапия
Методика катетеризации вен хорошо известна и останавливаться на ней не имеет смысла. Необходимо лишь подчеркнуть, что при ранениях третьей и второй зон шеи возможна катетеризация подключичной вены со стороны, противоположной ранению, хотя концентрация на небольшом пространстве операционного поля эндотрахеальной трубки и ее коннекторов, а также наличие в этой зоне внутривенного катетера — создает достаточно большие неудобства.
Поэтому при ранениях первой зоны шеи, цервикоторакальных и торакоцервикальных ранениях приходится использовать катетеризацию бедренной вены. При сочетанных ранениях груди и живота такой необходимости нет.
У пострадавших с ранениями груди следует избегать установки венозных катетеров со стороны большого гемоторакса, так как обычные признаки правильности установки катетера (поступление венозной крови, наличие ее дыхательных движений в просвете катетера) при большом гемотораксе будут иметь место и при положении катетера в плевральной полости, что введет врача в заблуждение и создаст угрозу жизни пациента, поскольку инфузионная терапия будет неэффективной.
К настоящему времени в зарубежной литературе опубликован ряд статей с анализом подобного рода ошибок [Brister N. W. et al., Wiklund D. U. et al.]. При этом авторы отмечают, что контрольная рентгенограмма груди не является достаточно информативной и единственным надежным методом контроля положения катетера является УЗИ.
С целью быстрого восполнения большого дефицита объема циркулирующей крови инфузионную терапию начинают с высокообъемной инфузии (200 мл/мин) плазмозамещающих растворов. Реанимационные мероприятия должны предусматривать введение теплых растворов. Наиболее распространены м методом является введение 10% раствора глюкозы с калием и инсулином.
При стойкой гипотонии для поддержания магистрального артериального давления выше критических значений (70-80 мм рт. ст.) применяют 60-90 мг преднизолона, а в критических случаях — введение препаратов инотропного действия — дофамина (в дозе 10 мг/кг в минуту).
Как крайнюю меру анестезиологу приходится использовать адреналин (в дозе 0,1 мкг/кг массы тела в минуту) или норадреналин. Следует, однако, подчеркнуть, что все эти меры неэффективны без остановки кровотечения.
Поэтому мы не можем разделить точку зрения некоторых авторов, что при нестабильной гемодинамике подготовку пострадавших с огнестрельными торакоабдоминальными ранениями следует проводить в реанимационном отделении [Нечаев Э.А., Бисенков Л. Н.]. Более того, с нашей точки зрения, внутривенная инфузия больших объемов кровезаменяющих и кровосодержащих растворов в течение короткого времени может привести к повышению артериального давления до такой степени, что прикрывавший дефект сосуда мягкий сверток крови может оторваться и начнется смертельное кровотечение.
Мы считаем, что принцип поддержания невысокого артериального давления и ограничения объема вводимых внутривенно растворов до начала хирургического вмешательства, являющийся общепринятым в отношении разрывов и расслоений аорты, должен быть распространен и на ранения крупных сосудов шеи, груди и живота.
При нестабильной гемодинамике, декомпенсированном метаболическом ацидозе (рН артериальной крови менее 7,2, лактат более 5 м/моль/л), коагулопатии (содержание тромбоцитов менее 50%, дефицит свертываемости) и гипотермии (температура тела ниже 34 °С) в инфузионную терапию необходимо включить гемотрансфузии, введение трисамина, свежезамороженной плазмы, тромбоцитарную массу, фактор свертывания VIIa, согревание пострадавшего.
При продолжающемся массивном кровотечении эти мероприятия проводятся одновременно с осуществлением гемостаза хирургическим путем.
Видео техники катетеризации центральной вены - установки подключичного катетера
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Техника передней продольной коллотомии при ранениях шеи
Техника выполнения передней продольной коллотомии. Пострадавшему под лопатку подкладывают валик, голову поворачивают в сторону, противоположную локализации раны, обрабатывают шею, область плеча и переднюю поверхность грудной стенки. Если кровотечения в этот момент нет, обработку в зоне ранения производят осторожно, «красящими» движениями, избегая надавливания на кожу, снятия тупферами фиксированных свертков крови. В случае кровотечения, остановленного прижатием пальцем крупного сосуда, операционное поле обрабатывают вместе с кистью врача.
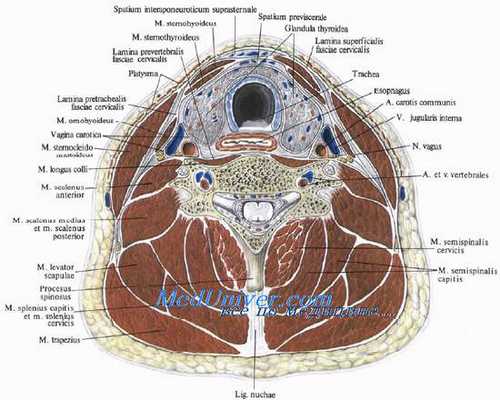
Кожный разрез длиной 12 см производят продольно по переднему краю грудино-ключично-сосцевидной мышцы, доходя до яремной ямки. После рассечения подкожной мышцы шеи и гемостаза рассекают вдоль переднего края грудино-ключично-сосцевидной мышцы фасцию и мышцу отодвигают пластинчатым крючком Фарабефа кнаружи.
Обнажается доля щитовидной железы с подходящими к ней сосудами и идущая косо вниз и латералыю лента лопаточно-подъязычной мышцы. Ширина ее колеблется от 1 до 2,5 см. Мышцу пересекают электроножом без наложения зажимов, либо обычными ножницами между предварительно наложенными кровоостанавливающими зажимами. В таких случаях на пересеченные концы мышцы накладывают лигатуры, после чего зажимы снимают.
Вводя второй пластинчатый крючок с медиальной стороны раны, отодвигают долю щитовидной железы — при этом натягивают сосуды, идущие к железе. Если они ограничивают возможность дальнейших манипуляций, их следует пересечь между зажимами с лигированием викрилом 2/0. Непосредственно под долей щитовидной железы на большом протяжении видна переднебоковая стенка трахеи, далее в бороздке между трахеей и пищеводом — ветвь возвратного нерва и, наконец, пищевод, лежащий на предпозвоночной фасции.
Стенка пищевода выглядит как серо-розовый мышечный тяж с продольным расположением волокон. При операции под местной анестезией видны глотательные движения глотки и пищевода. После введения в пищевод толстого желудочного зонда пищевод легко определяется пальпаторно и визуально. При необходимости его обходят большим диссектором или пальцем и берут на полиэтиленовые держалки.
Что касается симпатического ствола, лежащего на предпозвоночной фасции, то он расположен намного латеральнее глотки и пищевода и при правильной экспозиции раны пластинчатыми крючками он в нашей практике ни разу не был травмирован (при опыте хирургического лечения не только ранений, но и перфораций глотки и пищевода инородными телами и инструментами).
Без особых последствий могут быть лигированы и пересечены поверхностные вены шеи, в том числе и наружная яремная вена, допускается пересечение лопаточной и подъязычной мышц и нижней щитовидной артерии.
Обнаружение ран глотки и пищевода облегчается при использовании интраоперационной эзофагоскопии, ран трахеи — бронхоскопии. Ориентирование в пропитанных кровью тканях облегчается при наличии в пищеводе толстого зонда.
Ширина доступа может быть увеличена медиально за счет продольного рассечения сухожильной части внутренней порции грудино-ключично-сосцевидной мышцы, а латерально — за счет отсечения от ключицы сухожилия наружной порции этой мышцы.
Необходимо помнить, что кпереди от места деления общей сонной артерии проходит крупная лицевая вена и ее ветви: их можно перевязать и пересечь без каких-либо последствий. Во время ревизии необходимо щадить стволы блуждающих нервов (идущих справа и слева в составе сосудистых пучков), избегая захватывания их хирургическим пинцетом и тем более кровоостанавливающим зажимом.
Что касается расширения коллотомического доступа вверх, в третью зону шеи, здесь необходимо соблюдать предельную осторожность, так как в этой зоне снаружи от начала внутренней и наружной сонных артерий проходит ствол подъязычного нерва, а примерно на уровне нижнего края ушной раковины наружная сонная артерия делится на две конечные ветви — височную и внутреннюю челюстную артерии, здесь также расположены тесно прилежащие друг к другу внутренняя сонная артерия и внутренняя яремная вена и IX-XII пары черепно-мозговых нервов.
Доступ к сосудам и структурам шеи в третьей зоне крайне неудобен, так как ограничен сверху нижним краем горизонтальной ветви нижней челюсти и основанием черепа, а сзади — телами шейных позвонков. Узкий угол операционного действия в значительной мере затрудняет быстрое и надежное выделение дистальных отделов сосудов, поэтому в таких случаях для спасения жизни пострадавшего хирургу приходится идти на перевязку сосудов с риском развития нарушений мозгового кровообращения, если только кровоснабжение мозга не будет обеспечено за счет перетока по виллизиеву кругу и по глазничной артерии.
Что касается рекомендаций некоторых авторов расширять доступ к структурам третьей зоны шеи путем пересечения грудино-ключично-сосцевидной мышцы под сосцевидным отростком [Wilson R.Т. et al.], то при этом следует помнить, что в толще этой мышцы, на 3 см ниже сосцевидного отростка проходят ветви добавочного нерва.
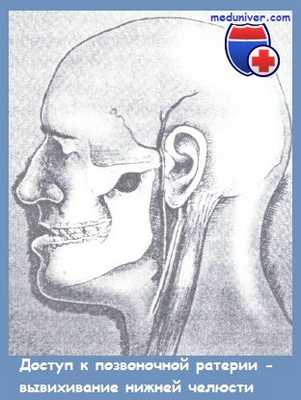
Для увеличения угла операционного действия ряд хирургов — D. F. Ficher и соавт., D.B. Hoyt и соавт. — предлагают использовать сравнительно простой прием, заключающийся в вывихивании нижней челюсти в височно-пижнечелюстном суставе путем оттягивания ее вниз и смещения кпереди. С необходимостью выполнения такого калечащего доступа, как резекция ветви нижней челюсти [Wilson R. Т. et al.], мы не встречались.
Особо следует остановиться на особенностях хирургического доступа к позвоночной артерии, которая на границе первой и второй зоны шеи уже входит в костно-фиброзный канал позвоночника. Для достижения артерии в месте отхождения ее от подключичной артерии выше уровня ключицы используют переднюю продольную коллотомию. Однако для достижения более дистальных отделов (а это необходимо в любом случае для дотирования периферического отдела поврежденного сосуда) приходится использовать заднюю продольную коллотомию — по латеральному краю грудино-ключично-сосцевидной мышцы.
При рассечении кожи, платизмы и поверхностной фасции в верхнем углу раны можно случайно повредить располагающуюся здесь наружную яремную вену — при необходимости ее следует выделить диссектором, дотировать и пересечь. На границе верхней и средней трети грудино-ключично-сосцевидной мышцы в поле зрения попадает крупная ветвь добавочного нерва, идущая к трапециевидной мышце, которую желательно сохранить. Кроме того, вдоль грудино-ключично-сосцевидной мышцы идут несколько кожных ветвей шейного сплетения, повреждения которых следует избегать.

При выполнении передней продольной коллотомии эти ветви остаются в стороне, что свидетельствует в пользу менее травматичного доступа, которым является передняя продольная коллотомия. При задней коллотомии грудино-ключично-сосцевидную мышцу вместе с сосудисто-нервным пучком отводят пластинчатыми крючками Фарабефа медиально, после чего пальпаторно отыскивают бугристый выступ поперечного отростка шестого шейного позвонка (бугорок Шассеньяка). Эта манипуляция облегчается, если голову пациента временно расположить прямо и наклонить ее кпереди. Позвоночная артерия пульсирует медиально от этого бугорка, располагаясь на позвонках между передней лестничной мышцей и длинной мышцей шеи.
Одноименная вена располагается латеральнее артерии. Для дотирования позвоночной артерии в отверстии поперечного отростка CVI хирургу приходится расширять это отверстие путем осторожного скусывания кусачками передней стенки костно-фиброзного канала.
Если при выполнении передней продольной коллотомии выясняется, что раневой канал распространяется ниже уровня ключицы и верхней грудной апертуры, возникает необходимость расширения доступа вниз. Такая же необходимость возникает и при явной картине цервикоторакального ранения с наличием гемоторакса.
Предоперационная подготовка при ранениях: подготовка операционного поля, временный гемостаз
При наличии фиксированного в теле пострадавшего холодного оружия все перечисленные выше реанимационные, анестезиологические и диагностические мероприятия выполняются так, чтобы не извлечь случайно, еще до начала операции, этот предмет, особенно при расположении его в проекции крупного сосуда или в области сердца.
Если нет иной необходимости, доступы при ранениях груди и живота осуществляются в положении пострадавшего на спине, при ранениях шеи -также на спине, но с валиком под лопатками, так чтобы шея находилась в разогнутом положении и голова была повернута в сторону, противоположную доступу.
При подозрении на ранения крупных вен во избежание воздушной эмболии некоторые авторы рекомендуют придавать пострадавшему положение Тренделенбурга (с поднятием ножного конца операционного стола на 10°-15°).
Следует считать абсолютно необоснованными и опасными предложения некоторых авторов [Завражнов А. А.] прибегать к зондированию раны шеи металлическим зондом и разведению ее краев крючками в условиях перевязочной с целью выяснения характера повреждений. При наличии сведений о массивном наружном кровотечении снимать повязки, наложенные на догоспитальном этапе, следует только на операционном столе и только после введения пострадавшего в наркоз, так как в любой момент кровотечение может возобновится.

Схема временного гемостаза при ранениях шеи:
а — правильное положение баллона катетера; б — положение баллона катетера проксимальнее раны сосуда; в — положение баллона катетера дистальнее раны сосуда
Если все же такое произошло, а локализация колотой раны в первой зоне шеи может потребовать сложного и не очень быстро выполнимого доступа, в условиях стационара можно использовать такой эффективный и надежный метод временного гемостаза, как установка в раневом канале стерильного баллон-катетера Фолея [Gilroy D. et al.]. Методика заключается в том, что катетер осторожно проводят в раневой канал на всю возможную глубину, после чего баллон катетера наполняют изотоническим раствором хлорида натрия в объеме 50 мл.
Из рисунка, взятого из диссертационной работы В. В. Иофика, видно, что такой объем позволяет полностью прикрыть дефект стенки артерии. Поступление крови по катетеру свидетельствует, что баллон находится поверхностнее места повреждения сосуда. В таком случае раствор из баллона надо убрать и продвинуть катетер глубже, после чего вновь наполнить баллон.
Поступление крови из раны мимо катетера свидетельствует о том, что катетер продвинут слишком далеко и баллон не закрывает дефект стенки сосуда. В таком случае катетер с баллоном осторожно подтягивают до прекращения кровотечения.
Данные литературы и клинический опыт показывают, что этот способ временного гемостаза эффективен именно при цервикоторакальных ранениях. В то же время установлено, что при колотых ранениях иногда слои мышц шеи в области раневого канала смещаются до такой степени, что провести мягкий и эластичный катетер Фолея на необходимую глубину не удается. Применение этого метода не имеет смысла при зияющих резаных ранах и при повреждении поверхностно расположенных крупных сосудов шеи.
Каждый случай ранения подлежит судебно-медицинской экспертизе, поэтому врач обязан не только четко изложить в истории болезни внешний вид и локализацию каждой раны, но и указать, имеются ли клинические признаки алкогольного или наркотического опьянения. Для подтверждения алкогольного опьянения врач должен взять кровь из вены и мочу для определения содержания алкоголя в промилле, а при отсутствии такой возможности — засвидетельствовать наличие алкогольного опьянения подписью двух врачей.
Обработка кожи при сочетанных ранениях груди производится от нижней челюсти до лобка с захватом боковых поверхностей шеи, груди и живота.
Современная инфузионная терапия. Достижения и возможности
Инфузионная терапия является неотъемлемой частью лечения различных категорий больных. О возможностях применения ее достижений в клинической практике рассказывает профессор-консультант Центра экстракорпоральной детоксикации (ВМедА), д-р мед. наук Альфред Львович Костюченко.
История
В начале 30-х годов XIX столетия английский врач Т. Latta в журнале "Lancet" опубликовал работу о лечении холеры внутривенным вливанием растворов соды.
10 июля 1881 года Landerer успешно провел вливание больному "физиологического раствора поваренной соли", обеспечив бессмертие этой инфузионной среде, с которой мировая медицинская практика вошла в XX век - век становления и развития инфузионной терапии.
1915 год - использован на практике кровезаменитель на основе желатины (Hogan) - первый из коллоидных кровезаменителей;
1940 год - внедрен в практику "Перистой", первый из кровезаменителей на основе синтетического коллоида поливинилпирролидона (Reppe, Weese и Несht);
1944 год - разработаны кровезаменители на основе декстрана (Gronwall и Ingelman). Последующие четверть века были эрой безраздельного господства декстрановых кровезаменителей;
1962 год - началось клиническое внедрение растворов гидроксиэтидированного крахмала (Thompson, Britton и Walton), однако настоящий расцвет эры ГЭК происходит только к концу 20-го столетия.
В 60-х годах, одновременно в США (Rabiner) и СССР в ЛИПКе (академик АН. Филатова с сотр.) ведутся работы по созданию кровезаменителей на основе очищенного от стромы человеческого гемоглобина. В результате в нашей стране создается клинически доступный препарат "Эригем", успешно использованный для кровезамещения во время операций на легких (ВМедА, академик И.С. Колесникова с сотр.).
1966 год - первые публикации по перфторуглеродам (ПФУ) как возможным искусственным переносчикам кислорода в организме человека (L.Clark, LF. Gollan).
1979 год - В СССР создан первый в мире, в последующем клинически апробированный, кровезаменитель на основе ПФУ - "Перфторан" (ГР. Граменицкий, ИЛ. Кунъянц, Ф.Ф. Белоярцев).
1992 год - введен в клиническую практику оригинальный кровезаменитель на основе полиэтиленгликоля - "Полиоксидин" (Петербургский НИИГПК, Л А Седова, ЛГ. Михайлова и др.).
1997 год - прошел клинические испытания созданный в Петербургском НИИГПК полимеризированный человеческий гемоглобин "Геленпол" (ЕА Селиванов с сотр.). Разрешен к медицинскому применению с 1998 года.
Сегодня повсеместно для лечения больных используется инфузионная терапия - вливание в организм больного больших количеств различных жидкостей в течение значительного времени.
Цели проведения инфузионной терапии разнообразны: от психологического воздействия на пациента (как же - ведь "ставится капельница!") и разведения до безопасного уровня необходимых сильнодействующих лекарственных средств до решения ряда задач реанимации и интенсивной терапии.
Именно последние - задачи реанимации и интенсивной терапии, возникающие перед врачом в конкретных клинических ситуациях - и определяют основные направления инфузионной терапии:
- волюмокоррекция - востановление адекватного объема циркулирующей крови (ОЦК) и нормализация ее состава при кровопотере;
- гемореокоррекция - нормализация гомеостатических и реологических свойств крови;
- инфузионная регидратация - поддержание нормальной микро- и макроциркуляции (в частности - при клинически отчетливой дегидратации);
- нормализация электролитного баланса и кислотно-основного равновесия;
- активная инфузионная дезинтоксикация;
- обменкорригирующие инфузии - прямое воздействие на тканевой метаболизм за счет активных компонентов кровезаменителя.
Волюмокоррекция
При кровопотере и для востановления адекватного ОЦК могут быть использованы инфузионные среды с различным волемическим эффектом.
Изотонические и изоосмотические электролитные растворы моделируют состав внеклеточной жидкости, обладают малым непосредственным волюмическим эффектом (не более 0.25 от объема введенной среды, даже при отсутствии гипопротеинемии), но являются предпочтительными при сочетании кровопотери и дегидратации.
В настоящее время из группы коллоидных кровезаменителей все большую популярность приобретают растворы гидроксиэтилкрахмала (ГЭК) - инфукол, рефортан, стабизол, ХАЭС-стерил. Они обладают высоким непосредственным волемическим эффектом (1.0 и более) и большим периодом полувыведения при относительно небольшом количестве побочных реакций.
Сохраняют свои клинические позиции волюмокорректоры на основе декстрана (полиглюкин, реополиглюкин, реоглюман, лонгастерил, реомакродекс, неорондекс) и желатины (желатиноль, модежель, гелофузин). Все больше внимания привлекает новый препарат на основе полиэтиленгликоля - полиоксидин. В интенсивной терапии для восстановления адекватного ОЦК используются препараты крови. Однако применение донорской плазмы значительно ограничено редкостью препарата, побочными реакциями, опасностью переноса вирусной инфекции. Поданным некоторых авторов, при внутривенном использовании человеческого сывороточного альбумина (ЧСА), из-за повышенной проницаемости эндотелия для альбумина, препарат быстро выходит из кровеносного русла в интерстициальное пространство, усиливая отек, в том числе в органах жизнеобеспечения (легкие, тонкая кишка).
Появляется все больше публикаций о преимуществах терапии острого дефицита ОЦК и шока так называемой низкообъемной гиперосмотичной волюмокоррекцией (НГВ). Она заключается в последовательном внутривенном введении гипертонического электролитного раствора (например, 7.5% раствора NaCl из расчета 4 мл/кг массы тела (МТ) больного) с последующей инфузией коллоидного кровезаменителя (например, 250 мл полиглюкина или рефортана) для закрепления эффекта перемещения в сосуды интерстициальной жидкости.
- рациональный доступ к сосудистой системе с помощью канюлирования или катетеризации сосудов или в целом к внутренней среде организма больного;
- техническое обеспечение - применение пассивного, гравитационного инфузионного тракта (системы) или активного - на основе насосов-инфузоров;
- медицинскими и коммерческими возможностями выбора инфузионной среды, соответствующей конкретной клинической задаче;
- контролем достигнутого эффекта с помощью клинико-лабораторных критериев, а в трудных случаях - с помощью мониторного наблюдения, позволяющего оценивать on line центральную гемодинамику, состояние жидкостных пространств организма больного, изменение микроциркуляции крови.
Вариантами подобной волюмокоррекции, кроме указанных веществ, могут быть гипертонический раствор смеси хлорида и ацетата натрия, реополиглюкин с добавлением маннитола (реоглюман) или гипертоническая плазма, донорская или аутологичная, заготовленная в ходе аппаратного плазмафереза во флаконы с лиофилизированным сорбитолом. Методами доказательной медицины установлено, что НГВ способствует:
быстрому и стойкому повышению АД и сердечного выброса на фоне шока;
Гемореокоррекция
Одновременно с волюмокоррекцией или без нее может использоваться инфузионная гемореокоррекция. В ее основе может лежать изоволемическая гемодилюция с извлечением части крови или без нее.
Для решения этой задачи ранее получили признание декстраны, особенно низкомолекулярные, а в настоящее время - растворы ГЭК. Значимые для клинического применения результаты получены при использовании кислородпереносящего кровезаменителя на основе фторированных углеродов перфторана. Его гемореокорригирующее действие определяется не только эффектом гемодилюции и повышением электрического распора между клетками крови, но и изменением вязкости крови и восстановлением микроциркуляции в отечных тканях.
Регидратация
Для инфузионной регидратации используются сбалансированные по основным электролитам и гипоосмотичные или изоосмотичные электролитные растворы: натрия хлорида, Рингера, ацесоль, лактосол и другие. При проведении регидратации можно использовать различные пути введения жидкости:
сосудистый (в условиях функциональной сохранности сердца и легких - лучше внутривенно, при перегрузке правого сердца и синдроме острого легочного повреждения (ОЛП) -предпочтительно внутриаортальный путь);
Для быстрой нормализации электролитного баланса и купирования внутриклеточных электролитных расстройств созданы специальные инфузионные среды (калия-магния аспарагинат, ионостерил, раствор Хартмана).
Для инфузионной коррекции некомпенсированных метаболических расстройств кислотно-основного равновесия применяют:
- ри ацидозе - растворы бикарбоната илилактата натрия, трисаминол, трометамоп:
- при алкалозе - разведенный на растворе глюкозы 1н. раствор HCl (например, при сочетании алкалоза и гипохпоремии), алкамин.
Детоксикация
Различают интракорпоральный способ активной детоксикации с применением инфузионной терапии и экстракорпоральный
(сорбционные и аферезные методы), который также не обходится без инфузионного сопровождения. Для интракорпоральной детоксикации используют:
- растворы глюкозы и/или кристаллоидов, обеспечивающие гемодилюцию (уменьшение повреждающего действия экзогенных и эндогенных токсических субстанций за счет их разведения) и улучшение кровоснабжения тканей и органов, что вызывает ускоренное вымывание токсических веществ;
При применении обеих групп инфузионных детоксикационных средств целесообразно использовать инфузионно-форсированный или медикаментозно-форсированный диурез, обеспечивающий высокий темп мочевыделения (оптимально 4-5 мл/кг МТ в час) на протяжении часов и суток.
Обменкорригирующая инфузия
Обменкорригирующая инфузия - прямое воздействие на тканевой метаболизм за счет активных компонентов кровезаменителя; по сути дела - направление инфузионной терапии, пограничное с медикаментозной терапией.
Первой в ряду обменкорригирующих инфузионных сред следует считать так называемую поляризующую смесь, предложенную французским патофизиологом А. Лабори как среду стрессовых ситуаций. Ее основу составлял раствор глюкозы с инсулином с добавлением солей калия и магния, что позволяло предотвращать развитие микронекрозов миокарда на фоне гиперкатехоламинемии.
Другим направлением следует считать полиионные среды, содержащие субстратные антигипоксанты - фумарат (мафусол, полиоксифумарин) и сукцинат (реамберин).
К обменкорригирующим инфузиям можно относить вливание перфторана и кислородпереносящих кровезаменителей на основе модифицированного гемоглобина - геленпола и гелевина, которые оптимизируют энергетический обмен в органах и тканях за счет повышения доставки к ним кислорода.
Благоприятная коррекция нарушенного обмена веществ достигается применением инфузионных гепатопротекторов. Они нормализуют не только метаболизм в поврежденных гепатоцитах, но и связывают маркеры летального синтеза при гепатоцеллюлярной несостоятельности, в частности, аммиак (гепастерил А). В некоторой степени к обменкорригирующим инфузиям можно отнести парентеральное искусственное питание. Купирование персистирующей белково-энергетической недостаточности и нутриционная поддержка больного достигается инфузиями специальных питательных сред.
Другие возможности
Определенное значение в интенсивной терапии имеют ситуации, в которых используют не плазмозамещающие свойства кровезаменителей. Например:
- использование перфторана для купирования ОЛП при травматической жировой эмболии или в остром периоде черепно-мозговой травмы, что позволяет уменьшить выраженность отека и набухания головного мозга;
- предотвращение капиллярной утечки внутрисосудистой жидкости при генерализованной инфекции средами на основе ГЭК;
- внутрисосудистое связывание воспалительных медиаторов и свободных радикалов (например, N0) растворами модифицированного гемоглобина.
Все это показывает, как далеко шагнула медицинская наука за 100 лет планомерного использования инфузионной терапии в клинической практике.
Читайте также:
