Прогноз синдрома Бругада. Катехоламинергическая полиморфная желудочковая тахикардия (KПЖТ)
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Что такое синдром Бругада? Какова его распространенность? Какие лекарственные средства применяются при синдроме Бругада? Внезапная смерть — наиболее грозное проявление заболеваний сердечно-сосудистой системы. Основными причинами внезапной сердечной
Что такое синдром Бругада?
Какова его распространенность?
Какие лекарственные средства применяются при синдроме Бругада?
Внезапная смерть — наиболее грозное проявление заболеваний сердечно-сосудистой системы. Основными причинами внезапной сердечной смерти у взрослых можно считать ишемическую болезнь сердца и инфаркт миокарда, однако в последние годы все большую остроту приобретает проблема внезапной смерти в отсутствие явных заболеваний миокарда или коронарных сосудов, особенно в молодом возрасте.
Сегодня накоплено достаточное количество данных о природе заболеваний, сопряженных с риском внезапной смерти. Определено, что многие из них генетически детерминированы, а это представляет особую опасность, так как под угрозой находится не только больной, у которого выявили заболевание, но и его дети и близкие родственники. Данные заболевания пока крайне редко выявляются в обычной клинической практике. Больные умирают, как правило, не в специализированных стационарах, а дома или на улице, и врачу поликлиники или бригаде скорой помощи остается констатировать смерть. При этом ставится достаточно неопределенный диагноз: острая сердечно-сосудистая недостаточность. При аутопсии не выявляется поражений мышцы сердца или коронарных сосудов. У детей, как ни парадоксально, чаще всего посмертно диагностируется острая респираторная вирусная инфекция, минимальными проявлениями которой пытаются объяснить внезапную смерть. Все это дает основание утверждать, что в крупных российских клиниках отсутствует достаточный опыт наблюдения и выявления данных больных. Внимание специалистов-кардиологов нередко привлекают только первые симптомы заболевания, прежде всего синкопе и приступы сердцебиения. Однако нередко первым и последним проявлением заболевания является внезапная смерть.
В современной клинической медицине выделен ряд заболеваний и синдромов, тесно ассоциированных с высоким риском внезапной смерти в молодом возрасте. К ним относятся синдром внезапной смерти младенцев (sudden infant death syndrome), синдром удлиненного интервала QT, синдром внезапной необъяснимой смерти (sudden unexplained death syndrome), аритмогенная дисплазия правого желудочка, идиопатическая фибрилляция желудочков и ряд других. Одно из наиболее «загадочных» заболеваний в этом ряду — это синдром Бругада (CБ). Несмотря на то что во всем мире опубликованы сотни работ, посвященных данному заболеванию, а на крупнейших международных кардиологических конгрессах регулярно проводятся тематические секции, в отечественной литературе имеются лишь единичные описания синдрома, далеко не всегда полностью отражающие типичную картину заболевания. Вместе с тем именно СБ является, по мнению многих специалистов, «ответственным» за более чем 50% внезапных, некоронарогенных смертей в молодом возрасте.
Официальная дата открытия синдрома — 1992 год. Именно тогда испанские кардиологи, братья П. и Д. Бругада, работающие в настоящее время в различных клиниках мира, впервые описали клинико-электрокардиографический синдром, объединяющий частые семейные случаи синкопальных состояний или внезапной смерти вследствие полиморфной желудочковой тахикардии, и регистрацию специфического электрокардиографического паттерна.
Преимущественный возраст клинической манифестации СБ — 30-40 лет, однако впервые данный синдром был описан у трехлетней девочки, имевшей частые эпизоды потери сознания и впоследствии внезапно погибшей, несмотря на активную антиаритмическую терапию и имплантацию кардиостимулятора. Клиническая картина заболевания характеризуется частым возникновением синкопе на фоне приступов желудочковой тахикардии и внезапной смертью, преимущественно во сне, а также отсутствием признаков органического поражения миокарда при аутопсии.
Кроме типичной клинической картины, при СБ выделяют специфический электрокардиографический паттерн. Он включает блокаду правой ножки пучка Гиса, специфический подъем сегмента ST в отведениях V1-V3, периодическое удлинение интервала PR, приступы полиморфной желудочковой тахикардии во время синкопе. Выделяются следующие клинико-электрокардиографические формы синдрома Бругада:
- Полная форма (типичная электрокардиографическая картина с синкопе, пердсинкопе, случаями клинической или внезапной смерти вследствие полиморфной желудочковой тахикардии).
- Клинические варианты:
- типичная электрокардиографическая картина у асимптоматичных больных без семейной истории внезапной смерти или синдрома Бругада;
- типичная электрокардиографическая картина у асимптоматичных больных, членов семей больных с полной формой синдрома;
- типичная электрокардиографическая картина после проведения фармакологических тестов у асимптоматичных обследуемых, членов семей больных с полной формой синдрома;
- типичная электрокардиографическая картина после проведения фармакологических тестов у больных с повторными синкопе или идиопатической фибрилляцией предсердий.
- типичная электрокардиографическая картина с явной блокадой правой ножки пучка Гиса, элевацией сегмента ST и удлинением PR-интервала;
- типичная электрокардиографическая картина с элевацией сегмента ST, но без удлинения PR-интервала и блокады правой ножки пучка Гиса;
- неполная блокада правой ножки пучка Гиса с умеренной элевацией сегмента ST;
- изолированное удлинение интервала PR.
Характерно, что типичный ЭКГ-паттерн чаще регистрируется у больных в период перед развитием фибрилляции желудочков, что свидетельствует о необходимости динамического наблюдения за больными с подозрением на СБ. При пробе с дозированной физической нагрузкой и лекарственной пробе с симпатомиметиками (изадрин) ЭКГ-проявления СБ уменьшаются, в то время как при пробе с медленным внутривенным введением антиаритмических препаратов, блокирующих натриевый ток, увеличиваются. Согласно стандартному протоколу обследования больных с подозрением на СБ, рекомендуется использовать для проб следующие антиаритмические препараты: гилуритмал (аймалин) в дозе 1 мг/кг, новокаинамид (прокаинамид) в дозе 10 мг/кг или флекаинид в дозе 2 мг/кг. Необходимо учитывать, что при введении указанных препаратов у больных с СБ могут развиваться опасные желудочковые тахиаритмии, вплоть до фибрилляции, поэтому проводиться такие пробы должны при условии полной готовности к оказанию экстренной помощи. Но, несмотря на это, пробы на сегодняшний день — наиболее достоверный критерий выявления опасного, угрожающего жизни заболевания, требующего постоянного наблюдения и многолетней антиаритмической терапии. При проведении инвазивного электрофизиологического исследования (ЭФИ) у больных с СБ часто индуцируются желудочковые аритмии, однако ЭФИ вряд ли можно считать «золотым стандартом» диагностики полной клинической формы синдрома. До 1992 года нередко описывались случаи наблюдения молодых больных с типичным ЭКГ-паттерном СБ, синкопальными состояниями и нормальными показателями ЭФИ. В дальнейшем такие больные, оставленные без лечения, внезапно погибали (Mandell W., 1985).
В последние годы в диагностике больных с риском опасных желудочковых аритмий, особенно «микроаномалий ЭКГ», значительно возросла роль стандартной электрокардиографии. Так, у пациентов с СБ, по нашим наблюдениям, нередко регистрируется эпсилон-волна — eW, характеризующая замедленную деполяризацию в области выводного тракта правого желудочка. Данный признак представляет собой «большой» диагностический критерий другого заболевания, сопряженного с высоким риском внезапной смерти, — аритмогенной дисплазии правого желудочка. Однако, учитывая единый источник возникновения аритмии при обоих заболеваниях — выводной тракт правого желудочка, его можно отнести и к диагностически значимым ЭКГ-проявлениям СБ. У больных с риском внезапной смерти большое внимание уделяется удлинению интервала QT как фактору риска желудочковых аритмий. Однако ряд наблюдений, проводившихся в последнее время, показал, что проаритмогенную роль играет и укорочение QT, наблюдаемое именно у больных с СБ и идиопатической фибрилляцией желудочков. Предлагается даже термин «синдром укороченного интервала QT» (Gussak I., 2000). Наши наблюдения свидетельствуют о том, что у всех больных с СБ отмечены значения интервала QT менее 50 процентили, а у наиболее тяжелых больных — менее 5. Эти изменения могут быть связаны с особенностями электрофизиологии кардиомиоцита при СБ — значительным укорочением 2-й фазы потенциала действия в эпикарде правого желудочка (при удлинении интервала QT задействован противоположный электрофизиологический механизм). Очевидно, асинхронизм реполяризации любой природы повышает аритмогенную готовность миокарда. При холтеровском мониторировании может отмечаться высокий циркадный индекс (ЦИ — отношение средней дневной к средней ночной ЧСС) — более 1,45 (норма от 1,24 до 1,44).
Степень распространенности синдрома пока неясна. Так, в одной из областей Бельгии распространенность СБ составила 1 на 100 000 жителей (Brugada P., 1999). По данным японских исследователей, проанализировавших 22 027 электрокардиограмм из популяции, распространенность ЭКГ-паттерна СБ в этой стране составила 0,05-0,6% у взрослых и 0,0006% (анализ 163 110 электрокардиограмм) у детей (Tohyou J. и соавт., 1995; Hata Y. и соавт., 1997).
Еще одна интересная особенность СБ заключается в том, что заболевание не регистрируется у афро-американцев; с другой стороны, в Европе СБ чаще выявляется у представителей так называемого «кавказского» этнического типа, к которому, согласно международным градациям, относятся и выходцы из стран Восточной Европы. Характерно, что и первый из описанных случаев заболевания братья Бругада выявили у польской девочки. Это свидетельствует о том, что распространенность СБ в российской популяции может оказаться достаточно высокой.
Предполагается, что при СБ имеет место аутосомно-доминантный путь наследования с поражением гена SCN5a в 3-й хромосоме. Этот же ген поражен у больных с третьим молекулярно-генетическим вариантом синдрома удлиненного интервала QT (LQT3) и при синдроме Ленегра — заболеваниях, также сопряженных с высоким риском внезапной аритмогенной смерти.
В 93,3% случаев приступы при СБ возникают в вечернее и ночное время (с 18 до 06 часов), причем чаще во второй половине ночи. Это, несомненно, подтверждает роль усиления вагусных влияний в возникновении фибрилляции желудочков при СБ. Данный циркадный паттерн свидетельствует также о различиях в патогенезе возникновения фатальных аритмий у пациентов с СБ и ишемической болезнью сердца, когда основной циркадный пик внезапной смерти приходится на ранние утренние часы (Deedwania P., 1998).
Необходимо проводить дифференциальную диагностику СБ с рядом заболеваний, которые могут стать причиной схожих электрокардиографических проявлений: аритмогенной дисплазией правого желудочка, миокардитами, кардиомиопатиями, болезнью (миокардитом) Чагаса (Chagas), болезнью Steinert, опухолями средостения.
Для предупреждения фибрилляции желудочков при СБ используются классические антиаритмические препараты, обеспечивающие эффект в 60% случаев. Генетически детерминированное поражение натриевых каналов теоретически предполагает меньшую эффективность препаратов 1-й группы, а также возможность проявления проаритмогенного эффекта при их использовании. Согласно алгоритму формирования антиаритмической терапии, известному под названием «сицилианский гамбит» (Europ Heart J, 1991; 12), антиаритмическими препаратами, обеспечивающими активную блокаду натриевых каналов, являются новокаинамид, дизопирамид, хинидин, ритмонорм, гилуритмал, флекаинид, энкаинид. Менее выраженное блокирующее действие отмечено у лидокаина, мексилетина, токаинида, бепридила, верапамила, кордарона и обзидана. Можно предположить, что при СБ более безопасно применять препараты, не блокирующие натриевые каналы, — дилтиазем, бретилиум, соталекс, надолол (коргард). Однако целенаправленных исследований в этой области пока не проводилось. Наиболее эффективным методом предотвращения развития жизнеугрожающих аритмий у больных СБ на сегодняшний день является имплантация кардиовертеров-дефибрилляторов.
Мировая статистика свидетельствует о широком распространении СБ в мире. Вместе с тем низкая его выявляемость в настоящее время в России, очевидно, связана с меньшей ориентацией врачей на весь клинико-электрокардиографический симптомокомплекс, часто не имеющий особенностей в отдельных составляющих, позволяющих уверенно поставить диагноз. Поэтому у всех больных с синкопальными состояниями неясной этиологии, ночными пароксизмами удушья, случаями внезапной смерти в семье (особенно в молодом возрасте и в ночное время), типичным ЭКГ-паттерном необходимо исключить синдром Бругада. Для этого таким пациентам следует проводить фармакологические пробы, динамическое ЭКГ-обследование как самого больного, так и его родственников, холтеровское мониторирование. Кроме того, одним из наиболее достоверных методов диагностики СБ является молекулярно-генетическое исследование.
Московский НИИ педиатрии и детской хирургии Минздрава РФ совместно с Международным фондом синдрома Бругада и P. Бругада начиная с 1999 года проводит исследование распространенности синдрома Бругада в российской популяции. Все российские специалисты, у которых наблюдаются больные с подозрением на синдром Бругада, могут их бесплатно заочно проконсультировать на основании данных ЭКГ и проведенных обследований. Выявленные больные будут включены в единый Международный регистр, что обеспечивает возможность проведения молекулярно-генетических исследований.
Прогноз синдрома Бругада. Катехоламинергическая полиморфная желудочковая тахикардия (KПЖТ)
Прогноз синдрома Бругада
Об идентичном показателе остановок сердца сообщено в результатах когортпого исследования с участием 212 пациентов с ЭКГ типа I; большинство пациентов с синдромом Brugada, вероятно, бессимптомно. Однако, поскольку эффективное медикаментозное лечение остается недоступным, а ИКД — единственный выбор для пациентов с высоким риском, стратификация риска становится вяжным условием в клиническом велении больных.
Пациенты, которые пережили остановку сердца, являются кандидатами на установку ИКД (вторичная профилактика). Между исследователями достигнуто согласие о том, что спонтанно аномальная ЭКГ (т.е. имеются диагностические признаки при отсутствии пробы с препаратами класса IС) с обмороками в анамнезе служит показанием для установки ИКД. И няоборот, пациенты, у которых ЭКГ типа I регистируют только после тестя с флекаипидом/аймалином, имеют более низкий риск.
Менее ясной остается стратегия ведения больных при спонтанно аномальной ЭКГ с промежуточным риском сердечных событий, угрожающих жизни. Результаты регистра показали, что ни семейный анамнез ВС в юности, ни наличие поздних потенциалов желудочков не являются надежными прогностическими признаками риска ВС у этих пациентов.
Точно так же прогностическая ценность программированной электрической стимуляции (ПЭС) все еще остается темой дискуссий. Brugada и коллеги предположили, что ПЭС — весьма чувствительный метод для прогноза риска главных сердечных событий. Однако другие исследователи не подтвердили этого положения. Эти разночтения, вероятно, вызваны плохой воспроизводимостью результатов ПЭС при синдроме Brugada при краткосрочном или среднесрочном исследовании. Полученные результаты были включены в Рекомендации Task Force on Sudden Cardiac Death of the European Society of Cardiology.
To же самое было предложено в объединенных Рекомендациях ACC/AHA/ESC с классом IIb для ПЭС при синдроме Brugada. В настоящее время использование ПЭС для стратификации риска окончательно не определено. Только продолжающиеся проспективные клинические исследования дадут ясный ответ на этот вопрос.
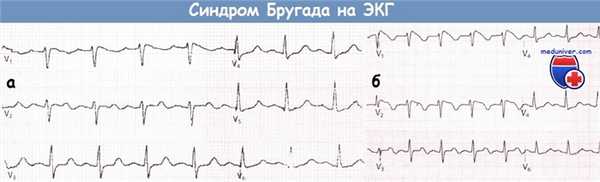
![Синдром Бругада на ЭКГ]()
ЭКГ, записанная в грудных отведениях у пациента с подозрением на синдром Бругада (а).
После введения аймалина регистрируется ЭКГ, типичная для синдрома Бругада I типа (б).Учебное видео ЭКГ при синдроме Бругада
Катехоламинергическая полиморфная желудочковая тахикардия (KПЖТ)
Катехоламинергическая полиморфная желудочковая тахикардия (KПЖТ) была первоначально описана Соumel Р. и Leenhardt A.. Волезнь характеризуется адренергически индуцированной ЖТ и приводит к обмороку и ВС при отсутствии структурных изменений со стороны сердца. КПЖТ считается генетически детерминированной аритмогенной болезнью; ее на гофизиологические механизмы в настоящее время изучаются.
ЭКГ в покое больных с КПЖТ ничем ни примечательна, за исключением синусовой брадикардии у некоторых пациентов. Физическую активность и/или резкие эмоции рассматривают как специфические пусковые механизмы аритмий. При дозируемой физической нагрузке у пациентов с КПЖТ возникают желудочковые экстрасистолы при пороговой частоте сердечных сокращений 100-120 уд/мин, с последующим прогрессивным увеличением их по мере возрастания ФН.
Если пациенты продолжают нагрузку, сначала возникает неустойчивая ЖТ, затем она переходит в стойкую ЖТ. Частым проявлением КПЖТ является тахикардия с альтернацией оси QRS во фронтальной плоскости на 180 градусов от сокращения к сокращению (так называемая двунаправленная ЖТ), хотя у некоторых пациентов может быть нерегулярная полиморфная ЖТ. Во время ФН у пациентов с КПЖТ могут возникать наджелудочковые аритмии, например пробежки наджелудочковой тахикардии.
Обморок, вызванный ФН или острым психоэмоциональным напряжением, — типичный признак КПЖТ. Почти у 50% пациентов первым проявлением может стать ВС или прерванная остановка сердца. Средний возраст начала симптомов — 12 лет. О семейном анамнезе юношеских ВС (возраст < 40 лет) сообщают в 30% случаев.
В 2002 г. было показано, что КПЖТ ответственна за некоторые случаи остановки сердца или ВС, развивающиеся у лиц с очевидно нормальным сердцем, что классифицируют как идиоматическую ФЖ (ИФЖ).
Другие исследования впоследствии подтвердили эти положения, поэтому мутации Ry R2 или С ASQ2 всегда должны рассматриваться среди причин ИФЖ, возникающей при ФН или остром эмоциональном стрессе. У пациентов, не получавших лечения, существует высокий риск сердечных событий (обморок или ВС); как показал анамнез, 80% пациентов имели по крайней мере одно событие в возрасте
Синдром Brugada. Генетические основы синдрома Бругада
В 1992 г. Brugada P. и Brugada R. описали пациентов с подъемом сегмента ST в правых прекорлиальных отведениях (V1-V3) (в отсутствие острого коронарного синдрома), с блокадой правой ножки пучка Гиса, со склонностью к желудочковым тахиаритмиям при структурно нормальном сердце. Сообщалось о семейном наследовании по аутосомно-доминантному типу, предполагая генетическое происхождение болезни. Эта болезнь в настоящее время носит название «синдром Brugada». Частота ее распространения неизвестна, но болезнь чаще встречается в дальневосточных странах.
Типичная аритмия при синдроме Brugada — быстрая полиморфная ЖТ, которая часто переходит в ФЖ; задокументирован также переход в фибрилляцию предсердий. Несмотря на то что синдром Brugada — генетически обусловленное заболевание, клинические проявления (обморок или остановка сердца) в детском возрасте редки и появляются в третьей и четвертой декадах жизни в соотношениях 8 : 1 (мужчины/женщины). Причины таких возрастных и тендерных различий неизвестны. Сердечные события развиваются во время сна или в покое.
Лихорадка, трициклические антидепрессанты и употребление кокаина могут быть пусковыми механизмами сердечных событий у некоторых пациентов.Диагноз синдрома Brugada затруднен из-за преходящих изменений па электрокардиограмме. Скрытые формы могут быть обнаружены во время пробы с антиаритмиками класса 1С: аймалином (1 мг/кг), флекаинидом (2 мг/кг) или прокаинамидом (15 мг/кг). Автономная модуляция нервной системы может изменить проявления синдрома: внутривенное введение изопротеренола уменьшает ЭКГ-признаки синдрома Brugada, а анетилхолина увеличивает.
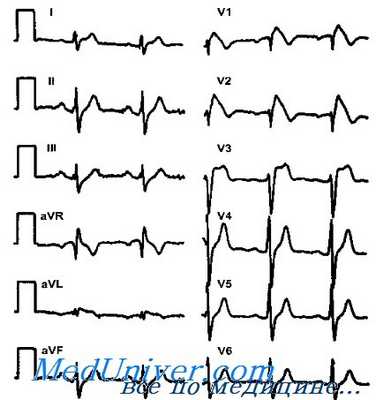
Эта особенность согласуется с тем, что сердечные события при синдроме Brugada наступают главным образом и покое или во время сна. Диагностические критерии синдрома Brugada уточнялись в течение нескольких лет. Выли установлены три типа ЭКГ, однако диагностическим критерием считается только «выпуклая» элевация сегмента ST (тип I). Опасные для жизни сердечные события могут развиться у пациентов с ЭКГ типа «спинка седла» (тип II) с генетически подтвержденным диагнозом.
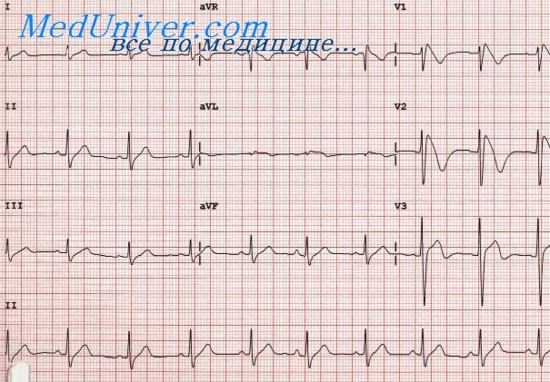
![синдром бругада]()
Генетические основы синдрома Бругада
Первый ген был идентифицирован в 1998 г. как сердечный теп ионного канала натрия (SCN5A). Этот же теп ответственен за генетический вариант LQT3. Хотя синдром Brugada и LQT3 вызваны мутациями в одном и том же гене, существует противоположный эффект этих мутации на ионный ноток натрия: «потеря функции» при синдроме Brugada и усиление функции при LQT3.
Интересно, что о пересечении фенотипов между LQT3 и синдромом Brugada сообщили независимые исследователи, которые подчеркнули функциональную сложность сердечной «болезни ионного канала». Недавно была обнаружена связь мутации SCN5A с ДКМП, что предполагает возникновение структурных нарушений сердца как прямого следствия генетически измененных электрофизиологических свойств кардиомиоцитов. Особенно это относится к пациентам с синдромом Brugada, поскольку наличие структурных нарушений является частью фенотипа.
Было высказано предположение, что вирусная инфекция может служить частью пускового механизма, который сопровождает развитие структурных нарушении у пациентов с синдромом Brugada с мутацией SCN5A или без нее.В связи с этим при клиническом ведении пациентов необходимо осторожно оценивать ЭКГ у всех пациентов с синдромом Brugada.
Недавно о втором генетическом варианте синдрома Brugada сообщили на примере одной большой семьи с мутацией гена GPD1-L, кодирующего белок, похожий на глицерол-3-фосфат-дсгидрогеназу-1. Функция этого белка в сердце полностью не изучена, по предварительные экспериментальные данные показывают, что мутация гена GPD1-L. уменьшает экспрессию ионного потока натрия.Несмотря на то что клиническое значение генетического тестирования при синдроме Brugada ограничено, в случаях, когда оно доступно, эта информация полезна для идентификации «немых носителей» и для доклинической диагностики у членов семьи пробанда.
Аутосомно-доминантная форма катехоламинергической полиморфной желудочковой тахикардии. Аутосомно-рецессивная KПЖТ
Картирование генов привело Priori S.G. и соавт. к первой идентификации мутации сердечного рианодинового рецептора (RyR2) при аутосомно-доминантной КПЖТ.
RyR2 — большой четырехмерный белок, охватывающий мембрану саркоплазматического ретикулума. Белок играет главную роль к регулировании внутриклеточного потока кальция и сокращения/возбуждения. Он локализуется в непосредственной близости с L-типом Са2+-каналов в Т-трубочках и высвобождает ионы Са2+ в ответ на вход Са2+ через каналы L-типа во второй фазе потенциала действия (ПД).Идентификация мутаций RyR2 у пациентов с КПЖТ является первой демонстрацией участия внутриклеточных ионных каналов в наследственных аритмиях и подчеркивает основную роль внутриклеточного Са2+ в аритмогенезе. В литературе сообщается более чем о 60 мутациях RyR2 при КПЖТ. Некоторые экспериментальные исследования показали, что дефектные каналы RyR2 приводят к безудержной утечке Са2+ из саркоплазматического ретикулума в цитозоль, которая ухудшается при адренергической активации.
Недавно была создана трансгенная модель мыши с КПЖТ с мутацией R4496C в гене RYR2. У мышей возникала двунаправленная ЖТ в ответ на адреналин и кофеин, и их изолированные кардиомиоциты отвечали на бета-адренергичсскую стимуляцию, привода к задержке после деполяризации и триггерной активности, что позволило предположить возможный подобный аритмогенный механизм у пациентов с КПЖТ.
![аутосомно-рецессивная кпжт]()
Аутосомно-рецессивная катехоламинергической полиморфной желудочковой тахикардии (КПЖТ)
В 2001 г. Lahat H. и соавт. определили, что аутосомно-рецессивная форма КПЖТ связана с хромосомой 1р23-21. Впоследствии они идентифицировали CASQ2 как ген этого варианта КПЖТ. CASQ2 кодирует сердечную изоформу калсеквестрина. Он является главным Са2+-связывающим белком, расположенным в концевой цистерне саркоплазматического ретикулума, где физически и функционально связан с каналом RyR2. Затем были обнаружены дополнительные мутации CASQ2 у пациентов различных этнических групп.
Молекулярный скрининг этого гена показан при сопоставлении аутосомпо-рецессивного наследования с клиническими данными. Мутации (ASQ2 разрушают хранение Са2+ в саркоплазматическом ретикулуме и изменяют функции из-за уменьшения, приводя к дестабилизации взаимодействия CASQ2 и RyR2 на уровне макромолекулярного комплекса, сформированного рианодиновым рецептором, калсекветрином, кальциевыми каналами L-типа Са2* и другими регулирующими белками.
Мутации RyR2 найдены у 60% пациентов с КПЖТ, тогда как мутации CASQ2 редки (1-2%). Таким образом, болезнь является генетически гетерогенной, а нехватка современных знаний ограничивает применение ген-специфичных терапевтических стратегий и схем стратификации риска. Тем не менее высокий процент успешно генотипированных пациентов делает целесообразным генетический скрининг как метол предсимптоматического диагноза и первичной профилактики.
Некоторые авторы полагают, что у пациентов без генетических дефектов RyR2 начало болезни отсрочено по сравнению с носителями мутации RyR2 и что ЧСС покоя у больных с КПЖТ ниже нормы, особенно среди носителей мутации RyR2. Предполагают, что носители мутации CASQ2 имеют умеренное удлинение интервала QT и тенденцию к развитию полиморфной формы ЖТ вместо двунаправленной ЖТ.
KПЖТ характеризуется воспроизводимыми признаками возникновения аритмии при дозированной ФН, которые позволяют титровать дозу бета-АБ и контролировать эффективность лечения. Хотя бета-АБ эффективны, у некоторых пациентов возникает устойчивая ЖТ, которая может наблюдаться во время пробы с ФН или при мониторированиии ЭКГ, несмотря на высокие дозировки бета-АВ. В этих случаях показана установка ИКА.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.Катехоламинергическая полиморфная желудочковая тахикардия
Это редкое наследственное аритмогенное заболевание, характеризующееся адренергически-индуцируемой двунаправленной и полиморфной ЖТ. Заболеваемость имеет предполагаемую распространенность 1 на 10 000. Были идентифицированы два генетических типа КПЖТ: доминантный вариант из-за мутаций в гене, кодирующем ген рецептора кардиального рианодина (RyR2), и редкий рецессивный вариант, вызванный мутацией в гене кардиального кальсеквестрина (CASQ2). Клинические проявления КПЖТ обычно возникают в первом десятилетии жизни и вызваны физической активностью или эмоциональным стрессом. Диагностика является сложной задачей, поскольку пациенты с КПЖТ имеют нормальную ЭКГ и эхокардиограмму; для установления диагноза рекомендуется холтеровское мониторирование и/или тест с физической нагрузкой, во время которого появляются предсердные и желудочковые аритмии (двунаправленная или полиморфная ЖТ).
Независимыми прогностическими факторами для аритмических событий в случае КПЖТ являются выявление заболевания в детском возрасте, отсутствие терапии бета-адреноблокаторами и персистирующие сложные аритмии. Считается, что первая линия терапии КПЖТ включает неселективные бета-адреноблокаторы (без внутренней симпатомиметической активности) и модификацию образа жизни с ограничением физических нагрузок.
Левосторонняя симпатическая денервация сердца оказывает определенный эффект при КПЖТ у пациентов, которые не переносят бета-адреноблокаторы, однако необходимы дополнительные данные и более длительное наблюдение для количественной оценки этого эффекта. Пациентам, пережившим остановку сердца, рекомендованы прием бета-адреноблокаторов и ИКД***-терапия; если такое лечение по результатам стресс-теста не позволяет достичь полного контроля аритмии, следует рассмотреть комбинированную антиаритмическую терапию.
Имплантация ИКД*** возможна у пациентов с КПЖТ, которые не отвечают на лечение бета-адреноблокаторами. При программировании ИКД*** увеличивают продолжительность детекции ЖТ, поскольку нанесение разрядов может быть болезненным и способствовать повышению симпатического тонуса и провоцировать повторные эпизоды аритмии, что в конечном итоге ведет к возникновению порочного круга с рецидивирующими ЖА, вплоть до смертельного исхода.
- Всем пациентам с диагностированной катехоламинергической полиморфной желудочковой тахикардией рекомендуется избегать соревновательных видов спорта, силовых тренировок и стрессовых ситуаций [248, 249, 469, 470, 471].
ЕОК IC (УУР C, УДД 4).
- Прием бета-адреноблокаторов рекомендован для лечения аритмии и профилактики ВСС всем пациентам с диагностированной катехоламинергической полиморфной желудочковой тахикардией, учитывая наличие документированной спонтанной или стресс-индуцированной ЖА [247, 468, 469, 470, 471].
- Имплантация ИКД*** дополнительно к приему бета-адреноблокаторов в сочетании или без антиаритмическими препаратами I или III класса рекомендована для лечения аритмии и профилактики ВСС пациентам с диагностированной катехоламинергической полиморфной желудочковой тахикардией, пережившим остановку сердца, имеющим в анамнезе повторные синкопальные состояния или эпизоды полиморфной/двунаправленной ЖТ, несмотря на оптимальную медикаментозную терапию [247, 248].
- Терапия бета-адреноблокаторами рекомендована родственникам пациента для профилактики ВСС при выявлении генетических мутаций, даже при отрицательном результате нагрузочного тестирования [248, 469].
ЕОК IIa C (УУР C, УДД 4).
- Выполнение грудной левосторонней симпатической денервации сердца рекомендовано у пациентов с диагностированной катехоламинергической полиморфной желудочковой тахикардией и повторными синкопальными состояниями, полиморфной/двунаправленной ЖТ, несколькими мотивированными срабатываниями ИКД*** с нанесением разрядов на фоне изолированного приема бета-адреноблокаторов или в сочетании с антиаритмическими препаратами I или III класса, а также при наличии непереносимости или противопоказаний к их приему [471, 472].
Читайте также: