Поведение при иммобилизационном стрессе. Изменение психики при иммобилизационном стрессе
Добавил пользователь Morpheus Обновлено: 24.01.2026
ФГБУ "Российский научный центр медицинской реабилитации и курортологии" Минздравсоцразвития России, Москва
ФГБУ "Российский научный центр медицинской реабилитации и курортологии" Минздрава РФ, Москва
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Кафедра патологической анатомии Российского научно-исследовательского медицинского университета им. Н.И. Пирогова;
Консультативно-диагностическое общество Института общей и клинической патологии РАЕН, Москва
Сочетанное действие питьевой минеральной воды и низкоинтенсивного электромагнитного излучения в условиях иммобилизационного стресса (экспериментальное исследование)
Журнал: Вопросы курортологии, физиотерапии и лечебной физической культуры. 2015;92(6): 37‑41
В экспериментах на белых крысах-самцах с помощью биохимических, радиоиммунологических и электронно-микроскопических методов исследования было установлено, что сочетанное применение питьевой минеральной воды (МВ) и низкоинтенсивного электромагнитного излучения (НИЭМИ) сверхвысокой частоты (плотность потока мощности — ППМ меньше 1 мкВт/см2, частота около 1000 МГц) способствовало активации метаболических и внутриклеточных регенеративных процессов в печени и семенниках. Преимущество сочетанного применения МВ и НИЭМИ перед монофакторами проявлялось в ослаблении стрессорных реакций, усилении ряда пластических процессов, более гармоничном развитии разных форм внутриклеточной регенерации. Результаты исследования расширяют представления о механизмах сочетанного действия МВ и НИЭМИ и обосновывают возможность их использования для защиты организма и его репродуктивной системы от стрессогенных нарушений.
Для стимуляции регенерации и повышения способности организма приспосабливаться к негативным стрессогенным воздействиям целесообразно использовать лечебные физические факторы. В этом плане особый интерес представляет сочетанное применение природных и искусственных физических факторов, в частности питьевой минеральной воды (МВ) и низкоинтенсивного электромагнитного излучения (НИЭМИ) сверхвысокой частоты. Как показали наши предыдущие исследования, каждый из этих факторов обладает стимулирующим влиянием на регенеративные процессы, однако по своей эффективности и особенностям развития они имеют существенные различия [1—3]. В частности, было показано, что действие НИЭМИ оказывает более выраженное влияние на развитие процессов внутриклеточной регенерации, чем действие МВ, особенно проявлявшееся в повышении активности биоэнергетических и белоксинтезирующих ультраструктур. С другой стороны, питьевые МВ также способны усиливать гиперплазию внутриклеточных органелл, активизировать синтез РНК и белка, вызывать адаптационные сдвиги в нейрогуморальном статусе организма [4, 5]. Поэтому постановка вопроса о сочетанном действии двух различных по своей природе факторов — МВ и НИЭМИ — представляется актуальной как в плане изучения и уточнения механизмов их сочетанного действия, так и с целью дальнейшей разработки способов их практического применения для санаторно-курортного лечения.
Цель настоящего исследования — выявить особенности сочетанного действия питьевой МВ и НИЭМИ на развитие метаболических и внутриклеточных регенеративных процессов на модели иммобилизационного стресса.
Эксперименты выполнены на 28 белых беспородных крысах-самцах массой 180—220 г. Работу с животными проводили в соответствии с правилами, принятыми Европейской конвенцией по защите животных, используемых для экспериментальных целей (Страсбург, 1968). Животные содержались в обычных условиях вивария и свободного доступа к воде и пище. Все крысы были разделены на 5 групп:
— 1-я группа — сочетанное применение питьевой сульфатной магниево-кальциевой МВ с концентрацией сульфат-ионов 2,35 г/л и минерализацией 4,3 г/л и процедур НИЭМИ с последующим действием иммобилизационного стресса;
— 2-я группа — применение той же питьевой МВ с последующим действием иммобилизационного стресса (группа сравнения);
— 3-я группа — применение процедур НИЭМИ с последующим действием иммобилизационного стресса (группа сравнения);
— 4-я группа (контроль) — применение водопроводной воды и мнимых процедур НИЭМИ с последующим действием иммобилизационного стресса;
— 5-я группа (интактная) — животные никаким воздействиям не подвергались.
МВ и водопроводную воду крысам вводили внутрижелудочно 1 раз в день по 3 мл через иглу с оливой на конце, всего 12 процедур. Курс воздействий НИЭМИ (10 процедур) проводили от аппарата Акватон-2 (ООО «Телемак», Саратов), плотность потока мощности меньше 1 мкВт/см 2 , частота около 1000 МГц. Всего на курс 8 процедур, время воздействия 2 мин. Животные облучались с расстояния 2—3 см от поверхности кожи поясничной области. Иммобилизационный стресс осуществляли по методике Г. Селье однократным привязыванием крыс в течение 6 ч в положении на спине. Забой животных проводили через 1 день после действия стресса. Объектом исследования являлись органы репродуктивной системы (семенники), печень и кровь.
Для исследования антиокислительной активности (АОА) в семенниках и печени использовали модельную систему в виде суспензии липопротеинов желтка куриного яйца [6]. Уровень перекисного окисления липидов (ПОЛ) определяли по конечному продукту ПОЛ — малоновому диальдегиду [7]. Содержание белка определяли биуретовым методом [8], содержание нуклеиновых кислот (РНК и ДНК) — двухволновым спектрофотометрическим методом в модификации [9]. В плазме крови радиоиммунологическим методом определяли кортикостерон (фирма «ИБОХ», Беларусь).
Для электронно-микроскопических исследований семенники фиксировали в 4% параформальдегиде, приготовленном на фосфатном буфере (pH 7,4), постфиксировали в 1% OsO 4 . После обезвоживания образцы заключали в смесь эпон-аралдит. Исследование образцов проводили на электронном микроскопе Libra 120 (Германия) с программой Carl Zeiss STM Nano Texnology system Division, которая включает в себя как режим трансмиссионного исследования, так и математическую обработку внутриклеточных структур. Проводили морфометрический анализ митохондрий (Мх) в клетках Сертоли (количество, средняя и суммарная площади), а также подсчитывали число этих клеток с различным уровнем содержания белоксинтезирующих органелл — гранулярной эндоплазматической сети, рибосом, полисом, а также секреторного аппарата Гольджи. Статистическую значимость различий оценивали с помощью критерия Стьюдента для независимых выборок, межгрупповые различия качественных признаков проводили с использованием критерия χ 2 . Различия считали достоверными при р
У животных контрольной группы действие иммобилизационного стресса вызывало в печени и семенниках выраженное снижение содержания РНК, ДНК и уровня АОА, которые развивались на фоне усиления процессов дистрофии и деструкции. Уровень кортикостерона в крови возрастал в 3 раза по сравнению с интактными животными. В клетках Сертоли обнаруживались явления отека, гранулярная эндоплазматическая сеть часто выглядела фрагментированной и дегранулированной, содержание свободнолежащих рибосом и полисом значительно снижалось. Мх становились мелкими, их средняя и суммарная площадь уменьшалась практически в 2 раза, что свидетельствовало о выраженном ослаблении клеточной биоэнергетики. Местами обнаруживались деструктивно измененные Мх в виде миелиноподобных структур, что может быть связано с усилением ПОЛ в их мембранах. Нарушения структуры органелл местами сопровождались признаками внутриклеточной регенерации, однако она была обычно выражена в слабой форме.
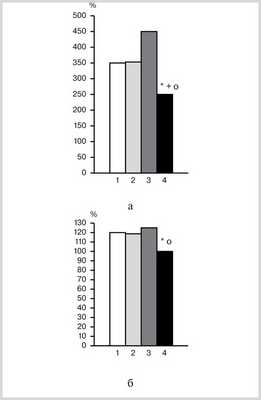
Рис. 1. Содержание кортикостерона в крови (а) и относительная масса надпочечников (б) при иммобилизационном стрессе (1), действии МВ (2), НИЭМИ (3), сочетанном применении МВ + НИЭМИ (4). * — р
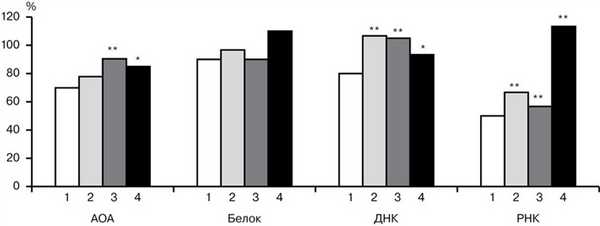
Рис. 2. Метаболические процессы в печени крыс при иммобилизационном стрессе (1), действии МВ (2), НИЭМИ (3) и сочетанном применении МВ + НИЭМИ (4). * — р
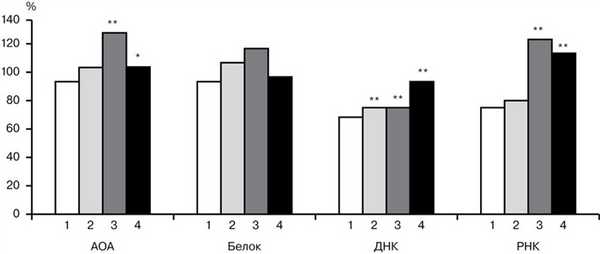
Рис. 3. Метаболические процессы в семенниках крыс при иммобилизационном стрессе (1), действии МВ (2), НИЭМИ (3) и сочетанном применении МВ + НИЭМИ (4). * — р

Морфометрическая характеристика митохондрий клеток Сертоли при применении МВ, НИЭМИ, МВ + НИЭМИ в условиях иммобилизационного стресса Примечание. + — р
Усиление регенерации проявлялось также и со стороны белоксинтезирующих органелл — рибосом, полисом и гранулярной эндоплазматической сети в клетках Сертоли. В отдельных клетках обнаруживались зоны активной регенерации, в которых скопления этих органелл в тесном контакте с Мх проявлялись особенно заметно. Чаще такие зоны определялись при действии НИЭМИ и сочетанном применении факторов. Характерной особенностью сочетанного действия являлась гиперплазия секреторного аппарата Гольджи, который чаще имел небольшие размеры и содержал цистерны с умеренно расширенными просветами. Число клеток с этой органеллой достигало 59,0%. При действии монофакторов аппарат Гольджи обнаруживался значительно реже (до 15,5%, контроль — 7,9%).
Таким образом, при действии всех использованных факторов выявлено повышение интенсивности адаптационных метаболических и регенеративных процессов при иммобилизационном стрессе. Среди монофакторов наибольшую эффективность на развитие этих процессов оказывало НИЭМИ, однако при этом в организме повышался уровень стрессорных реакций, что являлось негативным моментом в их действии. Сочетанное применение МВ и НИЭМИ имело определенное преимущество перед действием монофакторов, что проявлялось главным образом в ослаблении стрессорных реакций, в выраженной стимуляции ряда пластических процессов, в более гармоничном (сбалансированном) развитии обоих структурных уровней (форм) внутриклеточной регенерации, в расширении внутриклеточных связей. В механизмах сочетанного действия существенную роль сыграла МВ, которая препятствовала усилению стрессорных реакций, проявлявшихся при действии НИЭМИ. На основании полученных данных можно предположить, что при сочетанном действии факторов осуществляется более тонкое регуляторное воздействие на различные механизмы адаптации, что приводит к развитию в организме более адекватных физиологических реакций. Результаты исследования расширяют представления о механизмах сочетанного использования МВ и НИЭМИ и раскрывают перспективы для практического их использования с целью профилактики и лечения стрессогенных нарушений в организме и его репродуктивной системе.
Поведение при иммобилизационном стрессе. Изменение психики при иммобилизационном стрессе
Иммобилизационный стресс. Признаки иммобилизационного стресса
Иммобилизационный стресс вызывали у обезьян, содержавшихся в нормальных клетках стабилизированными группами. Рассмотрим действие стресса этого типа на поведение обезьян в разные периоды эксперимента.
До эксперимента поведенческие показатели и состав сфер активности у исследуемых животных были такими же, как у группы самцов, содержащихся в клетке, в норме.
В группе самцов павианов-гамадрилов, содержащихся вместе в одной клетке, была отмечена четко выраженная линейная иерархия, проявляющаяся в целом ряде показателей — направленности и частоте подставлений, подходов-уходов, грумингов, агрессивных действий. Агрессивное поведение проявлялось редко, так как группа была стабильной, в основном наблюдались агрессивные предупредительные и конфликтные элементы. Показатели манипуляционнои активности были несколько ниже средних видовых, что, возможно, связано с неестественным составом группы.
Но в целом показатели манипуляционнои активности находились в пределах нормы. Распределение форм активности особей также почти не отличалось от нормы, за исключением сферы репродуктивного поведения. На первом этапе эксперимента (во время иммобилизации) отмечались подергивания телом и головой, сопровождающиеся вокализацией. Интенсивность проявления этих элементов была прямо пропорциональна рангу животного.
Частота различных патологических элементов поведения (например, судорожные подергивания) была наименьшей у наиболее подчиненной особи z и низкой у самца а. Максимальные частоты проявления патологии поведения отмечали у промежуточных по рангу особей р и у.
На втором этапе (в течение первых 2 ч после иммобилизации) выявлены резкие нарушения индивидуального и группового поведения. Особенно сильно они проявлялись в 1-й час после стресса. Животные в основном сидели, опираясь на окружающие предметы, или лежали в неестественных аморфных позах. Отмечали подергивания, дрожание конечностей, замедленность движений, вялость, нарушения координации. У самцов павианов-гамадрилов на этом этапе эксперимента выявлены элементы, сходные с таковыми у особей, содержащихся в индивидуальных метаболических клетках: полуоскал со смещением челюсти, оскал с трясением челюсти, некоординированные движения передних конечностей, движения нижней челюстью вверх-вниз.

Элементы агрессивного поведения были направлены и представлены набором замещающих элементов. Смешанная активность проявлялась частым облизыванием, сменой поз, раскачиванием туловища. По отношению к пищевым объектам отмечалось затрудненное поднимание пищи: вначале объект животные поднимали ртом, не могли удержать его на весу у рта, часто роняли, отсутствовали движения отдельных пальцев, объект захватывался всей кистью.
В сфере комфортного поведения отмечали попытки совершить отдельные элементы, например, пытались почесать шею, но проводили рукой по воздуху. Отсутствовал интерес к непищевым объектам. Частота проявления агрессии была понижена. Отмечались скорее попытки оскала, полуоскала и других элементов.
В сфере дружелюбного поведения отсутствовал груминг, были редкие подставления. Не были выделены подходы-уходы. Мы отмечали смещенную активность, например, раскачивание, беспорядочные нашаривающие движения передних конечностей, захватывание частей собственного тела (например, захватывает рукой нос и держит его),
К концу 2-го часа появились элементы агрессивного и дружелюбного поведения, связанные с восстановлением ранговой системы, подставления, подходы-уходы, груминг. По-видимому, в это время имеется тенденция к тесному контакту между особями. Животные, например самцы Р и у, часто сидели, прижавшись друг к другу. Появились первые агрессивные реакции на людей. Появляется интерес к пище у всех особей группы, хотя движения остаются некоординированными, нечетко выраженными.
Через 2 ч появляются дифференцированные движения пальцев. Интерес к непищевым объектам в манипулятивных тестах отсутствовал.
Таким образом, через 2 ч после иммобилизационного стресса началось восстановление важных поведенческих систем. Вначале восстанавливалась сфера индивидуального поведения — пищевого, комфортного, локомоторного; затем, на исходе 2-го часа, начала восстанавливаться иерархическая система доминирования (подчинения). В групповом поведении дружелюбные элементы восстанавливались раньше, чем агрессивные. Вероятно, агрессивное поведение требовало больше энергетических затрат и поэтому после стресса восстанавливалось позднее, чем дружелюбные и нейтральные взаимодействия особей.
Возможно, сходное направление изменений в соотношении агрессивных и дружелюбных действий в стрессовых ситуациях имело место и у протогоминид: снижалась внутригрупповая агрессия и преобладало дружелюбное поведение, тенденция к сближению особей. Таким образом, стресс мог оказывать положительное влияние как фактор, тормозящий агрессию (особенно ее контактные формы) и способствующий развитию дружелюбного поведения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Первые 2 ч после стресса у самцов I группы отмечали ряд отклонений от нормального поведения. Значительно возросла частота индивидуального стационарного поведения, несколько снизилась локомоторная активность. Самцы лежали на животе, на боку, принимали иногда неестественные позы — ложились на спину, запрокинув голову, сидели, опираясь на руки, брали еду в лежачем положении.
Следует отметить, что у макак-резусов не выявлено таких резких нарушений локомоторных функций, хватательных функции конечностей, тремора конечностей, аморфных поз, характерных для павианов-гамадрилов, после стресса. В первые 2 ч после стресса у макак-резусов из I группы не отмечали проявлений манипуляционной активности. У всех особей этой группы, кроме у, возрасла частота пищевого поведения.
Отсутствовало дружелюбное поведение. Частота агрессивного предупредительного поведения понизилась у а- и z-особей и несколько возросла у бета и гамма самцов.
Животные II группы перенесли стресс легче. Индивидуальное стационарное поведение по частоте практически не отличалось от нормы. Несколько повысилась частота локомоторного и пищевого поведения. У а- и у-особей возросла частота дружелюбного дистантного стационарного поведения, у всех особей увеличилась частота дружелюбного контактного поведения.
Частота агрессивных форм поведения снижалась. У бета- и у-самцов возрастала манипулятивная активность. Следует отметить, что никаких нарушений и отклонений от нормального поведения у самцов этой группы в первые 2 ч после стресса не отмечалось.

Через 5,5 ч после стресса поведение самцов из I группы почти полностью нормализовалось. У 3 самцов отмечали даже некоторое повышение двигательной активности по сравнению с нормой. А у гамма-самцов отмечали в это время преобладание стационарного поведения. Частота пищевого поведения оставалась высокой.
У а- и бета-самцов отмечали агрессивное предупредительное поведение, но по частоте оно было ниже, чем в норме. Повышалась частота дружелюбных дистантных стационарных элементов у а- и z-самцов (по сравнению с нормой). Мы отмечали у всех самцов, кроме гамма, повышение частоты манипулятивной активности.
Через 24 ч после стресса поведение самцов макак-резусов из I группы полностью нормализовалось. Агрессивное предупредительное и конфликтное поведение отмечали тольу а-самца. У всех особей повышалась частота дружелюбного поведения.
Индивидуальные особенности перенесения иммобилизационного стресса. Мы отмечали различия в динамике восстановления поведенческих показателей у исследованных самцов павианов-гамадрилов. По-видимому, скорость восстановления поведения и особенности ее связаны с иерархическим статусом особей. Наиболее устойчивыми к стрессу оказались а- и z-особи, причем наиболее ярко это проявилось у z-особей.
При иммобилизации у этих особей отмечали меньшее число патологических и большее — агрессивных элементов. В первые часы после стресса у z-особей отмечено преобладание пищевой активности, в отличие от других особей, у которых преобладал отдых. Уже через 11 мин после окончания иммобилизации z-самец начал есть и ел не переставая в течение 1 ч. После стресса этот самец стал более активным. У него повысилась частота агрессивного поведения, которое теперь направлялось на высокоранговых особей. Изменилось его положение в иерархичео кой системе.
Z-самец первым подходил к еде, интенсивнее манипулировал непищевыми объектами. У него быстрее восстанавливались сферы индивидуального поведения. Наиболее тяжело перенесли стресс промежуточные по рангу особи р и у.
Публикации в СМИ
Головной мозг – основной орган, реагирующий на стресс. Эта реакция является комплексным, очень сложным процессом, в котором происходит как активация, так и подавление различных мозговых структур, связанных с формированием памяти, осуществлением двигательных, эмоциональных и когнитивных функций.
Мозг определяет, какие ситуации и события могут оказаться для человека стрессорными, и его ответ на стресс может быть как адаптивным, так и маладаптивным (адекватным либо неадекватным). Хронический стресс приводит к депрессии, которая в свою очередь вызывает повреждения нейронных сетей. Стресс, производимый окружающей средой (стресс на работе, в семье) и в особенности стрессирующие события в жизни, такие как психологические травмы – наиболее распространенные факторы, вызывающие депрессию. Поскольку разработка новых подходов к созданию антидепрессантов и их применению базируется на более глубоком понимании нейробиологических основ этого процесса, необходимо изучение влияния стресса и депрессии на клеточном уровне.
Депрессия является хроническим, рецидивирующим, имеющим множественную этиологию и опасным для здоровья и жизни состоянием, которая представляет из себя набор психологических, нейроэндокринных, физиологических и поведенческих симптомов. Выраженность этих симптомов определяет степень депрессии, которой в те или иные моменты жизни подвергаются до 20% людей во всем мире. Около 20-50% населения земного шара страдают от депрессии, но часто это состояние неверно диагностируют (Wittchen, 2000).
Депрессивные психические расстройства – наиболее распространенное заболевание в мире, провоцирующее серьезные социоэкономические проблемы (WHO, 2001). По прогнозам, к 2015 году депрессия окажется второй после сердечнососудистых заболеваний причиной недееспособности среди европейцев.
Зоны мозга, наиболее сильно страдающие от депрессии – это зоны, отвечающие за формирование эмоций, за процессы обучения и памяти, а именно префронтальная кора, базальные ядра и гиппокамп. Изменения, происходящие в них, включают уменьшение объема структур, размеров нейронов и их плотности, что связано с нарушениями гемодинамики и метаболизма глюкозы. Также снижается количество клеток глии, которые играют ключевую роль в передаче нервного импульса.
Так называемая «стресс-гипотеза» аффективных психических расстройств подтолкнула разработку моделей депрессии на животных. Эти модели стали незаменимы в доклинических исследованиях по психопатологии, патофизиологии депрессии и специфических реакций на антидепрессанты. Открытие того, что в дефинитивной нервной системе продолжаются процессы нейрогенеза, привлекло в свое время большой интерес научного сообщества, так как до этого нейрональные сети взрослого мозга считались неизменными и неспособными к регенерации. Эта аксиома была в 1928 году высказана известным испанским нейрофизиологом Сантъяго Рамоном и Кайялом (Santiago Ramon y Cajal), который в одной из работ написал про нервную ткань: «здесь все может погибнуть, но ничто не способно восстанавливаться» (Cajal, 1928). Современные исследования опровергли этот взгляд, продемонстрировав формирование новых нейронов (нейрогенез) во взрослом мозге. При этом процессы нейрогенеза могут усиливаться позитивными регуляторами и подавляться негативными, такими как острый и хронический стресс.
В то время как стресс ингибирует нейрогенез в гиппокампе, антидепрессанты имеют противоположный эффект. Более того, пациенты с расстройствами эмоциональной сферы в среднем имеют гиппокамп с меньшими средними размерами, чем у здоровых людей. Когда об этом стало известно, это привело к возникновению «нейрогенной гипотезы» депрессии, которая гласит, что нейрогенез в гиппокампе, а точнее его нарушения, могут оказаться первопричиной развития депрессивных расстройств. Однако, согласно сегодняшнему взгляду на эту проблему, нейрогенез в гиппокампе не играет ключевой роли в патогенезе депрессии, хотя и может быть ответственен за некоторые поведенческие эффекты антидепрессантов (Sahay & Hen, 2007).
Также растет количество данных о том, что, помимо воздействия на нейрогенез, стресс и антидепрессанты оказывают влияние на формирование специфических клеток нервной ткани – глии (глиогенез), необходимых для выживания нейронов. Нервная ткань содержит примерно в 100 раз больше глиальных клеток, чем нейронов. Глия выполняет трофическую функцию и принимает участие в регуляции передачи нервных импульсов через синапсы (контакты между отростками нервных клеток). Глиальные клетки также обладают рецепторами к нейротрансмиттерами и стероидным гормонам и способны к генерации электрических импульсов. По этой причине структурные изменения в глиальных клетках могут быть существенны для обмена информацией между нейронами, а также между нейронами и глией.
Во взрослом мозге терапия различными антидепрессантами может стимулировать не только нейрогенез, но и глиогенез. Более того, исследования на животных показали, что хронический стресс подавляет деление клеток не только в гиппокампе, но также и в префронтальной коре, и что этот эффект может быть отменен антидепрессантами (Czeh et al., 2007). Результаты эти были подтверждены исследованиями пациентов с расстройствами эмоций. С помощью компьютерной томографии было показано, что префронтальная кора, несомненно, вовлечена в патофизиологические процессы. В дальнейшем была проведена оценка состояния тканей умерших пациентов, показавшая, что число глиальных клеток в образцах мозга от пациентов, в анамнезе которых была указана тяжелая депрессия, существенно снижено.
В последние два десятилетия представления о мозге сильно изменились. Теперь ясно, что нейрональные и глиальные сети не неизменны, и находятся под контролем множества факторов, таких как факторы внешней среды (например, обучение), и внутренние факторы: нейротрофины, глюкокортикоиды, половые гормоны, и проч. Антидепрессанты стимулируют нейро- и глиогенез, поэтому структурные повреждения, вызванные стрессом и депрессией, не являются необратимыми.
Сегодня считается, что нейрогенез во взрослом мозге ограничен несколькими зонами: гиппокампом и областями, прилегающими к латеральным мозговым желудочкам. Однако появляется все больше данных о том, что образование новых нейронов происходит также в неокортексе. Несмотря на небольшое число этих клеток, они имеют важное значение для функционирования неокортекса. Взаимосвязь психических заболеваний и цитогенеза в дефинитивном неокортексе пока не ясна, но уже ведутся ее доклинические исследования. Возможно, на основе этих работ будут созданы более эффективные подходы к лечению депрессии.
Wittchen HU, Hoefler M, Meister W. Depressionen in der Allgemeinpraxis. Die bundesweite Depressionsstudie. Stuttgart: Schattauer, 2000
Moussavi S, Chatterji S, Verdes E, et al. Depression, chronic diseases, and decrements in health: results from the World Health Surveys. Lancet 2007;370:851-858
Sahay A, Hen R. Adult hippocampal neurogenesis in depression. Nature Neuroscience 2007;10:1110-1115
Ramon y Cajal, SR. Degeneration and regeneration of the nervous system. London, Oxford University Press, 1928
Czeh B, Mueller-Keuker JIH, Rygula R, et al. Chronic social stress inhibits cell proliferation in the adult medial prefrontal cortex: hemispheric asymmetry and reversal by fluoxetine treatment. Neuropsychopharmacology 2007;32:1490-1503
Код вставки на сайт
Нейрогенез во взрослом мозге: влияние стресса и депрессии
Применение низкоинтенсивного электромагнитного излучения в условиях иммобилизационного стресса (экспериментальное исследование)
Журнал: Вопросы курортологии, физиотерапии и лечебной физической культуры. 2014;91(4): 47‑52
Королев Ю.Н., Бобровницкий И.П., Никулина Л.А., Михайлик Л.В., Гениатулина М.С., Бобкова А.С. Применение низкоинтенсивного электромагнитного излучения в условиях иммобилизационного стресса (экспериментальное исследование). Вопросы курортологии, физиотерапии и лечебной физической культуры. 2014;91(4):47‑52.
Korolev IuN, Bobrovnitskiĭ IP, Nikulina LA, Mikhaĭlik LV, Geniatulina MS, Bobkova AS. The application of low-intensity electromagnetic radiation under immobilization stress conditions (an experimental study). Voprosy kurortologii, fizioterapii, i lechebnoi fizicheskoi kultury. 2014;91(4):47‑52. (In Russ.).
В экспериментах на нелинейных белых крысах самцах с помощью светооптических, электронно-микроскопических, биохимических и радиоиммунологических методов исследования было установлено, что применение низкоинтенсивного электромагнитного излучения (НИ ЭМИ; плотность потока мощности меньше 1 мкВт/см2, частота около 1000 МГц) в режиме как первичной профилактики, так и лечебно-профилактического воздействия ограничивало развитие постстрессорных нарушений в семенниках, печени и тимусе и способствовало активации адаптационно-защитных и компенсаторных процессов. Полученные данные обосновывают возможность использовать НИ ЭМИ для защиты организма и его репродуктивной системы от негативного действия стрессогенных факторов.
Проблема защиты организма от действия стресса является одной из наиболее актуальных проблем современной медицины. В качестве средств, способных повысить адаптационные возможности и защитить организм от действия стресса, целесообразно использовать различные виды электромагнитных излучений (ЭМИ) как в виде монофактора, так и при сочетанных воздействиях [1, 2]. Особый интерес представляют низкоинтенсивные ЭМИ (НИ ЭМИ) сверхвысоких частот, эффекты которых еще мало изучены. Предполагается, что механизм биологического действия НИ ЭМИ, в отличие от микроволн высоких интенсивностей, связан с поглощением определенных (резонансных) частот водной средой организма, в том числе молекулами воды биомембран, с последующим модулирующим влиянием этого взаимодействия на развитие метаболических процессов, в том числе адаптационного характера [3, 4]. В частности, было показано, что НИ ЭМИ влияет на внутриклеточные механизмы регуляции гомеостаза и межклеточные контакты, активирует органы иммунной системы, повышает противоопухолевую резистентность организма, снижает уровень перекисного окисления липидов (ПОЛ) за счет конформационных изменений в структуре мембран 4. Поэтому при использовании НИ ЭМИ можно ожидать усиления процессов адаптации на клеточном и ультраструктурном уровнях и повышения общей резистентности организма к действию стресса.
Цель настоящей работы - определить влияние НИ ЭМИ на снижение уровня постстрессорных нарушений при остром иммобилизационном стрессе у крыс.
Исследования были проведены на 27 белых беспородных крысах-самцах массой 180-220 г. Работу с животными проводили в соответствии с правилами, принятыми Европейской конвенцией по защите животных, используемых для экспериментальных целей (Страсбург, 1986). Крысы были разделены на 5 групп: 1-я группа (опытная) - предварительное применение НИ ЭМИ (первичная профилактика) с последующим воздействием иммобилизационного стресса; 2-я группа (контроль к 1-й группе) - воздействие иммобилизационного стресса и ложных процедур НИ ЭМИ (без включения аппарата); 3-я группа (опытная) - воздействие иммобилизационного стресса с последующим применением НИ ЭМИ (лечебно-профилактическое применение); 4-я группа (контроль к 3-й группе) - воздействие иммобилизационного стресса и ложных процедур НИ ЭМИ (без включения аппарата); 5-я группа (интактная) - животные никаким воздействиям не подвергались.
Иммобилизационный стресс осуществляли по методике Г. Селье однократным привязыванием крыс в течение 6 ч в положении на спине. Процедуры НИ ЭМИ проводили от аппарата Акватон-2 (ООО «Телемак», Саратов), плотность потока мощности меньше 1 мкВт/см 2 , частота около 1000 МГц. Всего на курс 8 процедур, время воздействия 2 мин. Животные облучались с расстояния 2-3 см от поверхности кожи поясничной области. Забой животных проводили через 1 день после действия стресса при первичной профилактике и через 9 дней - при лечебно-профилактическом применении НИ ЭМИ. Объектом исследования являлись органы репродуктивной системы (семенники), а также печень, тимус, кровь.
Для светооптических исследований семенники фиксировали в жидкости Буэна, оценка состояния сперматогенеза проводилась по общепринятой методике [7]. Подсчитывали количество извитых семенных канальцев (ИСК) с различным числом генераций половых клеток (от 4 до 0), определяли индекс сперматогенеза. Для электронно-микроскопических исследований семенники фиксировали в 4% параформальдегиде, приготовленном на фосфатном буфере (рН 7,4), постфиксировали в 1% ОsО 4 . После обезвоживания образцы заключали в смесь эпон-аралдит. Исследование ультратонких срезов проводили на электронном микроскопе Libra 120 (Германия). Для исследования антиокислительной активности (АОА) в семенниках и печени использовали модельную систему в виде суспензии липопротеинов желтка куриного яйца [8]. Уровень ПОЛ определяли по конечному продукту перекисного окисления липидов - малоновому диальдегиду [9]. Содержание белка определяли биуретовым методом [10], содержание нуклеиновых кислот (РНК и ДНК) - двухволновым спектрофотометрическим методом в модификации [11]. В плазме крови радиоиммунологическим методом определяли кортизол и тестостерон (фирма «ИБОХ», Беларусь). Статистическую значимость различий оценивали с помощью парного критерия Стьюдента и непараметрического U-критерия Манна-Уитни. Различия считали достоверными при р≤0,05.
После действия иммобилизационного стресса у животных контрольной группы через 1 сут определялось отчетливое снижение АОА в семенниках и печени, наличие выраженных признаков дистрофии и дегенерации со стороны сперматогенных клеток, снижение индекса сперматогенеза, активация процессов ПОЛ и снижение АОА, нарушение белоксинтезирующих процессов, уменьшение массы тимуса. В дальнейшем, к 9-м суткам последействия стресса, отмечалось как усиление ряда негативных явлений, особенно в семенниках (развитие процессов деструкции в сперматогенном эпителии, повышение уровня ПОЛ, снижение содержания общего белка), так и тенденция к активации некоторых ответных адаптационных реакций (АОА в печени, функциональной активности тимоцитов). Электронно-микроскопически обнаруживались нарушения во всех слоях собственной оболочки ИСК, являющейся частью гематотестикулярного барьера. Это проявлялось, в частности, в неравномерном утолщении оболочки в 1,5-2 раза, разрыхлении и местами истончении базальной мембраны, набухании ее неклеточных слоев. Нарушения барьерных структур ИСК вызывали усиление процессов вакуолизации с образованием как мелких, так и крупных локальных отеков, которые нарушали контакты между собственной оболочкой и сперматогенными клетками. Все это свидетельствовало о существенных нарушениях процессов микроциркуляции, что приводило к расстройствам трофики и метаболизма в эпителии семенных канальцев.
Предварительное применение НИ ЭМИ повышало устойчивость организма крыс к последующему действию острого иммобилизационного стресса. При этом через сутки после стресса защитный эффект в семенниках проявлялся в лучшей сохранности клеток сперматогенного эпителия, что выражалось, в частности, в более сбалансированном количестве ИСК с 4 и 3 генерациями половых клеток по сравнению с контролем (см. таблицу). На ультраструктурном уровне явно слабее, чем в контроле, проявлялись признаки отечности собственной оболочки ИСК, реже встречались и были менее выражены локальные отеки и межклеточные расширения в сперматогенном эпителии. На этом фоне происходило усиление АОА на 22,2% (р<0,05) и повышение содержания РНК и ДНК [соответственно на 17,3% (р=0,05) и 20,6% (р<0,05) по сравнению с контролем (рис. 1, a)]. Рисунок 1. Метаболические процессы в семенниках крыс при иммобилизационном стрессе и действии НИ ЭМИ. Здесь и на рис. 2 и 3: а - первичная профилактика; б - лечебно-профилактическое воздействие; светлые столбики - контроль; темные - опыт; * - ррр<0,01) (рис. 2, a) и снижение интенсивности процессов ПОЛ на 92,6% (р<0,01), что приводило к выраженному уменьшению (более чем в 2 раза; р <0,01) окислительного потенциала в ткани печени (ПОЛ/АОА). Рисунок 2. Метаболические процессы в печени крыс при иммобилизационном стрессе и действии НИ ЭМИ. Вместе с тем на фоне повышения АОА отмечалось снижение содержания общего белка на 22,1% (р<0,01). В тимусе наблюдалась тенденция к уменьшению абсолютной и относительной массы, но при этом удельная активность генома тимоцитов возрастала на 39,6% (р<0,01) по сравнению с контролем и на 79,2% (р<0,01) по сравнению с интактными животными (рис. 3, a), что указывает на усиление функции этих клеток и иммунокорригирующее действие НИ ЭМИ. Рисунок 3. Функциональная активность тимуса крыс при иммобилизационном стрессе и действии НИ ЭМИ. 1 - масса тимуса; 2 - число ядер тимоцитов (ТМ); 3 - связывание АО в ядре ТМ; 4 - удельная активность генома ТМ. Параллельно с выявленными адаптационными сдвигами во внутренних органах в сыворотке крови обнаруживались в виде тенденции изменения стрессорного характера - содержание кортизола превышало контрольный уровень (на 11,4%), а содержание тестостерона снижалось (на 22,3%).
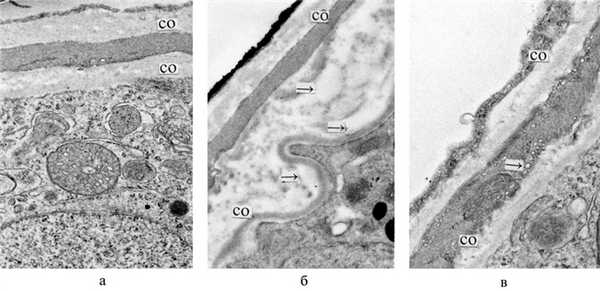
Лечебно-профилактическое применение НИ ЭМИ после действия стресса также вызывало ослабление ряда постстрессорных нарушений и усиление адаптационно-компенсаторных реакций. В семенниках это проявлялось в улучшении процессов сперматогенеза к 9-м суткам после стресса: число ИСК с 4 генерациями клеток возрастало на 48,0% (р<0,05), а число ИСК с 3 генерациями уменьшалось на 18,6% (р<0,05), что приближало эти показатели к уровню интактных животных (см. таблицу). Следует также отметить, что в отличие от контроля у животных опытной группы отсутствовали ИСК с 1 и 2 генерациями, что указывало на снижение уровня деструктивных процессов в сперматогенных клетках. Положительные изменения отмечались со стороны гематотестикулярного барьера, при этом уменьшалась толщина собственной оболочки ИСК и ее отдельных слоев, отчетливо ослаблялись локальные отеки, которые не были столь выражены, как у животных контрольной группы (рис. 4). Рисунок 4. Ультраструктурные изменения собственной оболочки ИСК при иммобилизационном стрессе и действии НИ ЭМИ. а - интактная крыса. Собственная оболочка ИСК; б - иммобилизационный стресс. Контроль. Утолщение собственной оболочки ИСК, в основном за счет выраженного отека ее внутреннего неклеточного слоя, видны мелкие локальные скопления отечной жидкости (стрелки); в - иммобилизационный стресс. Влияние НИ ЭМИ после действия стресса. Улучшение ультраструктуры собственной оболочки ИСК-ослабление явлений отека, уменьшение общей ее толщины. На данном участке собственной оболочки сохраняются процессы повышенного везикулообразования (стрелка). ×18 000. СО - собственная оболочка. Местами выявлялась активация процессов регенерации в миоидных клетках собственной оболочки в виде увеличения белоксинтезирующих органелл. Все эти благоприятные сдвиги свидетельствовали о снижении проницаемости барьерных структур и об улучшении процессов микроциркуляции. На этом фоне АОА повышалась на 24,2% (р<0,01), а содержание общего белка на 44,1% (р<0,01) (см. рис. 1, б). В печени усиление АОА на 45,4% (р<0,05) (рис. 2, б) сочеталось с повышенным уровнем ПОЛ на 61,1% (р<0,01), при этом окислительный потенциал (ПОЛ/АОА; р=0,05) становился ниже уровня контроля.
Результаты проведенного исследования свидетельствуют о том, что применение НИ ЭМИ в режиме как профилактики, так и лечебно-профилактического воздействия ограничивало развитие постстрессорных нарушений и способствовало активизации ряда адаптационно-защитных и компенсаторных процессов. Эти эффекты были обусловлены в основном антиоксидантным, а также иммуномодулирующим влиянием НИ ЭМИ на местные и общие механизмы регуляции. Среди выявленных сдвигов в первую очередь следует отметить усиление АОА, которая проявлялась как в семенниках, так и в печени в условиях профилактики и лечебно-профилактического воздействия. Активация антиокислительной системы, усиление ее мощности под влиянием НИ ЭМИ являлась важным регуляторным механизмом в защите организма от стресса, в повышении устойчивости мембранных структур сперматогенных клеток и снижении уровня деструктивных процессов. Этот антиоксидантный и цитопротекторный эффект сопровождался усилением ряда пластических процессов, которые более отчетливо проявлялись в семенниках, а также повышением функциональной активности тимуса, особенно в условиях первичной профилактики. Полученные данные показывают, что применение НИ ЭМИ может быть весьма перспективным в свете разработки новых подходов к способам усиления адаптационно-защитных и компенсаторных реакций организма при действии стресса. С целью оптимизации этих процессов, особенно с учетом недостаточного их развития в печени, следует использовать более адекватные режимы воздействия НИ ЭМИ, в том числе в комплексе с другими лечебными физическими факторами.
Читайте также:
