Прогрессирующая глухота с атаксией и атрофией зрительных нервов
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Зрительный нерв является частью зрительного анализатора, обеспечивает передачу информации от сетчатки, воспринимающей изображение и преобразующей световую энергию в электрическую, к коре головного мозга, где формируется окончательное изображение.
Для атрофии характерным является снижение остроты зрения, очки и контактные линзы не корректируют зрение, наблюдается изменение в полях зрения, нарушение цветоощущения, начиная с зеленого и красного цветов, при осмотре - побледнение диска зрительного нерва.
Среди наследственной атрофии выделяют аутосомно-доминантную ( в сочетании с глухотой — синдром Ушера); и аутосомно-рецессивную (атрофия Бера, Йенсена и др.), а также митохондриальную (атрофия Лебера).
Синдром Ушера - это наследственная болезнь, характеризующаяся ухудшение слуха и прогрессирующим снижением зрения. Изменения зрения происходят из-за пигментного ретинита - дегенеративного заболевания сетчатки глаза, которое обычно проявляется в юности или на ранней стадии взросления. Иногда заболевание оказывает влияние и на вестибулярные функции человека. Проявления болезни могут меняться индивидуальным образом, а его прогресс может идти с различной скоростью.
Различают три различных формы синдрома Ушера. Первый тип связан с врожденной значительной тугоухостью и нарушением вестибулярных функций. Первые признаки пигментного ретинита - ночная слепота и ухудшение периферийного зрения - обычно наступают еще в юном возрасте.
При синдроме Ушера второго типа новорожденные дети отличаются средним или существенным нарушением слуха. Симптомы пигментного ретинита обычно начинают проявляться вскоре после периода отрочества. Ухудшение зрения происходит не так быстро, как в случае синдрома Ушера первого типа, а тугоухость обычно остается на стабильном уровне и не прогрессирует.
Более редкий синдром Ушера третьего типа - дети с этим заболеванием обычно рождаются с нормальным слухом или лишь с небольшим его нарушением. Прогрессирующее ухудшение слуха и зрения начинается лишь в возрасте полового созревания. Во многих случаях начинаются и вестибулярные нарушения.
Нарушения слуха при синдроме Ушера возникают из-за генетической мутации, оказывающей влияние на нервные клетки в ушной улитке, которая отвечает за слуховую часть внутреннего уха, воспринимающего и распознающего звуки. Тот же самый генетический дефект негативно влияет и на клетки фоторецепторов в сетчатке, что приводит к ухудшению зрения.
Синдром Ушера наследуется от родителей к их детям как аутосомно-рецессивная характеристика. При таком типе наследования каждый из родителей является носителем мутировавшего гена, но у них самих это никак не проявляется, поскольку каждый из них несет в себе только одну копию поврежденного гена. Ребенок имеет 25%-вероятность унаследовать мутировавший ген и заболеть.
Во всем мире синдром Ушера является одной из основных причин возникновения комбинированной слепоты и глухоты. Примерно 30% людей с пигментным ретинитом отмечают у себя частичную потерю слуха, и примерно половина из них имеет синдром Ушера. Чтобы оценить свое состояние и риск для других членов семьи или будущих детей заболеть синдромом Ушера, можно пройти молекулярно-генетическое тестирование на поиск мутаций в "горячих" участках гена ОРА1.
В состав гена ОРА1 входит 28 экзонов. Мутируют два экзона - 14 и 18. Мутации этих экзонов вызывают не только атрофию зрительного нерва с глухотой, но и миопатию и офтальмоплегию. Экзоны кодируют белок ОРА1.
Заболевание носит прогрессирующий характер и может привести к тяжелой потере зрения. Процент больных с потерей зрения составляет от 13 до 46 %. Важно вовремя диагностировать заболевание, так как у 25% больных оно протекает бессимптомно. Это затрудняет раннюю постановку диагноза.
Показания к назначению:
- подтверждение диагноза «атрофия зрительного нерва с глухотой»
- планирование беременности в семье, имеющей родственника с заболеванием атрофия зрительного нерва с глухотой
Метод исследования: секвенирование
Процедура взятия биоматериала оплачивается отдельно и зависит от типа материала:
Прогрессирующая глухота с атаксией и атрофией зрительных нервов
Прогрессирующая глухота с атаксией и атрофией зрительных нервов
Синдром, характеризущийся прогрессирующей атрофией зрительных нервов, прогрессирующей нейросенсорной глухотой и атаксией, был описан Silvester в 1958 г. у отца и у 6 из 9 его детей. Так как синдром наследовался по аутосомно-доминантному типу, было ясно, что он не является атаксией Фридрейха.
Клинические данные. Орган зрения. Потеря зрения выявилась. между 2,5 и 9 годами жизни и в дальнейшем прогрессировала. Обследование полей зрения, произведенное у 2 сибсов, обнаружило периферическое сужение их без центральной скотомы. Световые рефлексы были нормальными.
Нервная система. Сибсы были умственно отсталыми и были или возбужденными, или апатичными. У 4 из 6 больных детей отмечался нистагм: у 2 — горизонтальный, у 1—ротаторный и еще у 1 — в разных направлениях. У 3 детей была обнаружена слабость конечностей, а у 4 — неустойчивая походка. У отца походка была нормальной, по имелось укорочение одной ноги, развившееся вследствие перенесенного полиомиелита. Общий мышечный тонус у 2 детей был сниженным, у 2 — повышенным в ногах и у 2 — нормальным. У 4 детей наблюдались, мышечные атрофии, охватывающие дельтовидные мышцы, мышцы лопаток и собственные мышцы кисти.
У 3 детей в дельтовидных мышцах, мышцах спины и четырехглавых мышцах отмечались фибриллярные подергивания. Глубокие сухожильные рефлексы были повышены у 1 ребенка и снижены у 3 остальных, особенно коленные и голеностопные. У 3 больных наблюдался разгибательный подошвенный рефлекс.
Костная система. Аномалии включали кифоз грудного отдела позвоночника, лордоз, сколиоз, полую стопу и «когтистую» руку.
Орган слуха. Степень нейросенсорной глухоты варьировала от легкой у 3 больных до средней у 1 сибса и до резко выраженной у 2 остальных детей. Хотя у отца отмечалась глубокая глухота, доказательств прогрессирования потери слуха не имелось. Аудиометрпческие данные не описаны.
Вестибулярная система. Патологических изменений со стороны вестибулярного аппарата не выявлено.
Лабораторные данные. Электрокардиографическое, электромиографическое исследования и анализ спинномозговой жидкости патологии не обнаружили. Другие рутинные лабораторные анализы также были нормальными.
Патология. Гистопатологичсское исследование мозга у одного из больных показало значительную утрату миелиновых волокон в дорсальном и вентральном спиномозжечковом тракте, а также в заднем пучке. Чувствительные пробы этому ребенку не производились. Кортикоспинальный тракт и зрительный нерв также были демиелииизированы. Разрез мозжечка был недоступен.
Биопсия мышц была нормальной.
Наследственность. Так как заболевание выявилось у отца и у 6 (3 мальчиков и 3 девочек) из 9 его детей, можно думать об аутосомно-доминантном наследовании.
Диагноз. Атрофия зрительных нервов и глухота встречаются при синдромах: прогрессирующей атрофии зрительных нервов с нейросенсорной глухотой, атрофии зрительных нервов с ювенильным диабетом и нейросенсорной глухотой и атрофии зрительных нервов с полинейропатией и нейросенсорной глухотой. При первых двух заболеваниях наследование аутосомно-рецессивное, при втором наблюдается ювенильный диабет. Последнее заболевание наследуется по аутосомно-рецессивному типу и характеризуется полннейропатией, которая включает достоверные расстройства чувствительности. При атаксии Фридрейха, наследующейся по аутосомно-рецессивному типу, нарушения зрения и глухота не встречаются.
Лечение. Ничего другого, кроме слуховых аппаратов, при глухоте предложить нельзя.
Прогноз. Отмечаются варианты в возрасте выявления симптомов. У отца медленное ирогрессированне расстройств привело к глубокой глухоте и резко выраженным расстройствам зрения к середине жизни. Возраст выявления болезни у его детей находился в пределах 2,5—9 лет со смертельным исходом через 8 мес—4 года после выявления заболевания.
Выводы. Главная характеристика включает:
1) аутосомно-доминантное наследование с варьирующим возрастом выявления;
2) прогрессирующую потерю зрения вследствие начавшейся в детстве атрофии зрительных нервов; 3) различные степени атаксии, особенно в ногах;
4) слабость и атрофии мышц, главным образом плечевого пояса и рук;
5) прогрессирующую нейросенсорную глухоту, начинающуюся в детстве, от умеренной до резко выраженной степени.
Прогрессирующая глухота с атаксией и атрофией зрительных нервов
ФГБУ "НИИ глазных болезней" РАМН
ФГБУ "НИИ глазных болезней" РАМН
ФГБУ "Медико-генетический научный центр" РАМН, Москва
ФГБУ "Медико-генетический научный центр" РАМН, Москва
Медико-генетический научный центр РАМН, Москва
Наследственные оптические нейропатии: клинические и молекулярно-генетические характеристики
Журнал: Вестник офтальмологии. 2013;129(6): 82‑88
Ханакова Н.А., Шеремет Н.Л., Логинова А.Н., Чухрова А.Л., Поляков А.В. Наследственные оптические нейропатии: клинические и молекулярно-генетические характеристики. Вестник офтальмологии. 2013;129(6):82‑88.
Khanakova NA, Sheremet NL, Loginova AN, Chukhrova AL, Poliakov AV. Hereditary optic neuropathies: clinical and molecular genetic characteristics. Vestnik Oftalmologii. 2013;129(6):82‑88. (In Russ.).
ФГБУ "НИИ глазных болезней" РАМН
В статье представлен обзор данных литературы о наследственных заболеваниях зрительного нерва: митохондриальной наследственной оптической нейропатии Лебера, аутосомно-доминантной и аутосомно-рецессивной оптических нейропатий, X-сцепленной атрофии зрительного нерва. Рассмотрены клинические, молекулярно-генетические характеристики заболеваний. Описаны изолированные формы оптической нейропатии, а также наследственные заболевания зрительного нерва, являющиеся частью сложного синдромного заболевания.
ФГБУ "НИИ глазных болезней" РАМН
ФГБУ "НИИ глазных болезней" РАМН
ФГБУ "Медико-генетический научный центр" РАМН, Москва
ФГБУ "Медико-генетический научный центр" РАМН, Москва
Медико-генетический научный центр РАМН, Москва
Наследственные оптические нейропатии (ОН) — группа генетически гетерогенных заболеваний, приводящих к поражению ганглиозных клеток сетчатки и их аксонов, составляющих зрительный нерв. Наследственные ОН встречаются с частотой 1 на 10 000 населения и являются важной причиной двустороннего поражения зрительного нерва и снижения зрительных функций [47, 63, 78].
Наследственные заболевания зрительного нерва классифицируют в зависимости от типа их наследования, выделяя четыре основные группы: аутосомно-доминантные (АДОН), митохондриальные, аутосомно-рецессивные и X-сцепленные ОН [78]. Возможность генетического анализа и выявления мутаций митохондриальной и ядерной ДНК в настоящее время позволяет систематизировать заболевания, используя более детализированную молекулярно-генетическую классификацию наследственных ОН.
Все наследственные ОН характеризуются несколькими общими клиническими симптомами: двусторонним симметричным снижением остроты зрения с образованием центральной или центроцекальной скотомы, дисхроматопсией, атрофией зрительного нерва (АЗН) с преимущественным истончением волокон папилломакулярного пучка. Тем не менее они различаются по характеру потери зрения, степени АЗН, течению заболевания и обратимости зрительных функций [51]. Эта патология зрительного нерва может протекать как изолированная форма ОН или быть частью сложного синдромного заболевания.
Среди всех наследственных ОН наиболее часто встречаются АДОН, возникающая в результате мутаций в ядерной ДНК (яДНК), и наследственная ОН Лебера (НОНЛ), связанная с мутациями в митохондриальной ДНК (мтДНК).
Аутосомно-доминантная оптическая нейропатия. АДОН — наследственное заболевание зрительного нерва, которое передается от одного из родителей и встречается у мужчин и женщин с одинаковой частотой 1:12 000—1:50 000 населения [42, 72]. В литературе употребляют различные синонимы этой патологии: аутосомно-доминантная атрофия зрительного нерва, ювенильная атрофия зрительного нерва, болезнь Кьера, атрофия зрительного нерва, тип 1.
Впервые клинически заболевание было описано F. Batten [12] в 1896 г. в одной британской семье. В 1959 г. датский офтальмолог P. Kjer [38] представил клинические характеристики и особенности АДОН на примере 19 семей из Дании. Но только в 2000 г. идентифицированы мутации гена OPA1 яДНК, ответственные за АДОН [22, 70].
Для АДОН характерно двустороннее и симметричное постепенное безболезненное снижение остроты зрения, начало которого в большинстве случаев выявляют в первые два десятилетия жизни, в среднем в 6—10 лет. По сравнению с НОНЛ Лебера при АДОН отмечают умеренное снижение показателей визометрии, около 25% пациентов сохраняют высокие зрительные функции [27, 39].
В таких случаях заболевание часто является незаметным для пациента, бессимптомным и идентифицируется как наличие двусторонней ОН только в случае тщательного обследования у офтальмолога. АДОН свойственна широкая внутри- и межсемейная вариабельность тяжести заболевания с разбросом показателей остроты зрения от 1,0 до движения руки у лица. У части пациентов умеренная потеря остроты зрения стабилизируется в юности, однако у 50—75% пациентов отмечено медленное прогрессирование заболевания в течение всей жизни с развитием в половине случаев практической слепоты (острота зрения 0,1 и ниже) [24, 80].
Мутации, выявленные в гене OPA1 у пациентов с различной клинической картиной, позволили расширить спектр вариантов начала и течения заболевания, включая тяжелые формы врожденной ОН [11], ОН с острым началом заболевания, подобным НОНЛ [6], ОН с поздним началом [57] и ОН с самопроизвольным восстановлением остроты зрения [21].
У большинства пациентов с АДОН выявляют нарушение цветового зрения в виде генерализованной дисхроматопсии и только в 10% случаев отмечают тританопию — частичную цветовую слепоту, характеризующуюся отсутствием цветовых ощущений в сине-фиолетовой области спектра, которую ранее считали патогномоничной особенностью этой ОН [13].
В связи с преимущественным поражением папилломакулярного пучка зрительного нерва типичным признаком АДОН является изменение поля зрения в виде центроцекальных, центральных, реже парацентральных скотом с сохранением периферических границ поля зрения [52]. Как и при НОНЛ, в отличие от ОН другой этиологии, при АДОН сохраняются живые реакции зрачка на свет вследствие относительной сохранности ретинотектальных волокон [17].
При осмотре глазного дна выявляют диффузную бледность или деколорацию височной половины диска зрительного нерва (ДЗН), офтальмоскопически плохо дифференцируемую в субклинических случаях заболевания. По данным А. Cohn и соавт. [20], у 1 /3 пациентов с АДОН ДЗН не имеет видимых изменений. В некоторых случаях наблюдается глубокая расширенная экскавация, более 0,5 по отношению к диаметру ДЗН, перипапиллярная атрофия, что приводит к необходимости дифференциальной диагностики с нормотензивной глаукомой [79].
До 20% пациентов с АДОН, связанной с мутациями гена OPA1, могут иметь синдромальную форму заболевания, так называемую АДОН + , что характеризует патологию гена OPA1 как мультисистемную болезнь.
Самым частым внеглазным проявлением АДОН + является нейросенсорная глухота, которая обычно манифестирует на втором и третьем десятилетии жизни. Другие неврологические нарушения — атаксия, миопатия, периферическая нейропатия и хроническая прогрессирующая наружная офтальмоплегия — могут возникать у пациентов после 30 лет по мере прогрессирования заболевания. Некоторые пациенты с АДОН + могут иметь клинические проявления, трудно дифференцируемые с другими нейродегенеративными заболеваниями, такими как рассеянный склероз, наследственная спастическая параплегия, наследственная спиноцеребеллярная дегенерация [65, 75].
Несмотря на то что заболевание имеет наследственную природу, часто оно представлено спорадическими случаями. Так, M. Ferré и соавт. [23] выявили, что из 309 пациентов с АДОН 44% не имели родственников с АЗН. Подобные результаты обусловлены неполной пенетрантностью заболевания, в результате чего доля лиц, у которых обнаруживают проявление мутантного гена среди всех лиц, унаследовавших этот ген, значительно варьирует. Пенетрантность при АДОН варьирует от 43% (3 больных из 7 членов семьи) и 62% (8 из 13) при исследовании 2 семей [72] до 82,5% (130 из 157) и 90% (27 из 30) при обследовании 17 и 10 семей соответственно [20]. Неполная пенетрантность обусловлена, по-видимому, генетическими и экологическими факторами. Это подтверждает необходимость изучения известных мутаций при АДОН в случаях двусторонней АЗН даже без выявленного семейного анамнеза.
Наследственная оптическая нейропатия Лебера. НОНЛ — наследственное заболевание зрительного нерва, которое передается по материнской линии и встречается с частотой 1:31 000—50 000 населения [59, 66]. В литературе можно встретить несколько синонимов заболевания: оптическая атрофия Лебера, атрофия зрительного нерва Лебера, синдром Лебера.
Заболевание впервые было описано в 1871 г. немецким офтальмологом Теодором Лебером, который сообщил о клинических особенностях потери зрения на примере 15 пациентов из 4 семей [29, 35]. Дальнейшие клинические исследования выявили существенные особенности НОНЛ, включая передачу заболевания по материнской линии, преимущественное поражение мужчин. Неменделеевский митохондриальный тип наследования был полностью объяснен в 1988 г. D. Wallace и соавт., идентифицировавшими первую точковую мутацию мтДНК — G11778A в гене ND4. Вскоре были обнаружены еще две мутации — G3460A в гене ND1 и Т14484С в гене ND6 [18, 31, 44, 46]. Эти точковые мутации мтДНК являются первичными, не сочетаются друг с другом, не встречаются у здоровых людей и обусловливают развитие НОНЛ в 90—95% всех случаев. Самая распространенная мутация в Северной Европе, Австралии, на Дальнем Востоке — m.11778G>А [45, 48] во Франции, Канаде — m.14484T>C (87% случаев).
В России наиболее часто встречается мутация m.11778G>А [1, 4], которая, по данным Н.Б. Повалко [2], составляет 77,3% случаев, на втором месте находится мутация m.3460 G>A — 15,9%, наиболее редкой является мутация m.14484T>C — 6,8% .
В настоящее время известно еще около 10 первичных, но более редких мутаций (m.3635 G>A, m.3733 G>A, m.4171 C>A, m.10663 T>C, m.14459 G>A, m.14482 C>A, m.14482C>G, m.14495 A>G, m.14568 C>T), а также большое число условно-патогенных мутаций мтДНК, патогенность которых в настоящее время не доказана окончательно в силу единичных случаев наблюдения [28, 61].
Заболевание передается по материнской линии и развивается преимущественно у лиц мужского пола. В связи с неполной пенетрантностью НОНЛ развивается у 50—60% мужчин и 8—32% женщин в течение их жизни [54].
Клиническая картина НОНЛ характеризуется острым или подострым безболезненным снижением зрения на одном глазу с последующим (через 2—4 мес) вовлечением в процесс другого глаза. Одновременное двустороннее снижение зрения встречается в 25% случаев, однако некоторые пациенты затрудняются четко ответить на вопрос о бинокулярном или одностороннем характере начала снижения зрения. Некоторые авторы сообщают об одностороннем поражении зрительного нерва при НОНЛ, однако такие наблюдения очень редки [69].
Заболевание развивается, как правило, в возрасте 18—30 лет. Однако возрастной диапазон может варьировать от 3 до 80 лет, показатели дебюта составляют в среднем 25—26 лет у мужчин и 27—29 лет у женщин [19]. Острота зрения при НОНЛ ухудшается в течение 4—6 нед до 0,1 и ниже с формированием центральной или центроцекальной скотомы, ухудшением цветового зрения. Сохранность зрачковых реакций на свет при низких зрительных функциях является важным клиническим критерием для дифференциальной диагностики с поражениями зрительного нерва другой этиологии [33].
Офтальмоскопическая картина в острой стадии в большинстве случаев достаточно специфична, характеризуется гиперемией, умеренным отеком ДЗН и перипапиллярного слоя нервных волокон, извитостью ретинальных сосудов, перипапиллярными телеангиэктазиями, отсутствием ликеджа при флюоресцентной ангиографии [24]. Однако многие авторы отмечают, что приблизительно в 20% случаев НОНЛ ДЗН имеет нормальную офтальмоскопическую картину [26, 56]. В хронической стадии заболевания формируется частичная АЗН с бледностью височной половины ДЗН в результате преимущественной потери папилломакулярного пучка. В дальнейшем в связи с продолжающейся потерей аксонов ганглиозных клеток сетчатки может формироваться диффузная бледность ДЗН с развитием патологической экскавации.
Зрительный прогноз при НОНЛ неблагоприятен, итоговая острота зрения варьирует от 0,1 до 0,01. В наиболее тяжелых случаях зрение снижается до движения руки у лица, правильной светопроекции, причем такие зрительные функции чаще наблюдаются при мутации m.11778G>A как наиболее неблагоприятной. Острота зрения у некоторых больных с НОНЛ может частично восстанавливаться, что определяется главным образом типом мутации. Самая высокая вероятность восстановления зрения отмечается у пациентов с мутацией m.14484T>C, самая небольшая — с m.11778G>A; мутация m.3460G>A имеет промежуточный прогноз восстановления зрения [78].
Помимо зрительных нарушений, которые являются основными проявлениями НОНЛ, заболевание в некоторых случаях может протекать как НОНЛ + и сопровождаться аритмией сердца и неврологическими отклонениями, такими как периферическая нейропатия, миопатия, дистония и миоклония, которые, как отмечают многие авторы, более распространены среди носителей мутаций НОНЛ по сравнению с контрольной группой [16, 41, 49, 55, 74]. В редких случаях отмечают более тяжелые внеглазные проявления НОНЛ + , при которых ОН сочетается с психиатрическими расстройствами, ювенильной энцефалопатией. Кроме того, идентифицированы мутации m.3376G>A и m.3697G>A, которые приводят к случаям НОНЛ + , имеющим перекрестные клинические проявления с MELAS-синдромом, характеризующимся митохондриальной энцефаломиопатией, лактатацидозом и инсультоподобными эпизодами [15, 67].
В 1992 г. A. Harding и соавт. выявили ассоциацию между первичными митохондриальными мутациями, связанными с НОНЛ, и демиелинизирующими заболеваниями у женщин. После снижения зрения у этих пациентов развивались клинические и МРТ признаки, типичные для рассеянного склероза, с перивентрикулярными изменениями белого вещества головного мозга и олигоклональными скоплениями в спинномозговой жидкости [34, 74]. В дальнейшем появились новые доказательства связи митохондриальных заболеваний и демиелинизирующих расстройств. В настоящее время показано, что демиелинизирующие изменения у носителей мутаций, характерных для НОНЛ, встречаются у 1 из 20 человек [58], что в 50 раз выше, чем распространенность рассеянного склероза у населения [40].
Аутосомно-рецессивная оптическая нейропатия (АРОН). В литературе встречается синоним: аутосомно-рецессивная атрофия зрительного нерва.
S. Hanein и соавт. [25] в 2009 г. описали 4 семьи из Северной Африки, в которых дети от близкородственных браков имели изолированную форму АРОН, и определили связь заболевания с мутацией в гене TMEM126A на хромосоме 11. Та же мутация была выявлена у двух сибсов в алжирской семье, у которых АРОН сочеталась со слуховой нейропатией, проявляющейся медленно прогрессирующей потерей слуха [50].
Однако в большинстве случаев АРОН является частью мультисистемного заболевания с поражением нервной системы и других органов, манифестирует в младенчестве и быстро прогрессирует в дальнейшем. Описано большое число аутосомно-рецессивных синдромов, в которых АЗН является одним из клинических проявлений (синдром Бера, оптикокохлеарный синдром, инфантильная АЗН Вента, оптикоакустическая атрофия с деменцией Йенсена и т.д.) [7, 71]. Для некоторых синдромов идентифицированы гены.
Метилглютаконовая ацидурия ІІІ типа (синдром АЗН Костеффа — Costeff optic atrophy syndrome) является аутосомно-рецессивным заболеванием, характеризующимся ранней двусторонней АЗН, спастичностью, экстрапирамидной дисфункцией и когнитивными нарушениями, повышенной экскрецией с мочой 3-метилглютаконовой и 3-метилглютаровой кислот [64]. Ген, отвечающий за развитие этого заболевания, ОРА3, идентифицирован в локусе 19q13.2-q13.3 [7]. При синдроме Вольфрама, для которого характерно сочетание АРОН с несахарным и сахарным диабетом, нейросенсорной глухотой, идентифицированы гены WFS1 (MIM 606201) и WFS2 в локусе 4q22-q24 (MIM 604928) [10]. АЗН выявляется при атаксии Фридрейха и врожденной спастической параплегии, тип 7, обусловленных мутациями в генах яДНК FXN и SPG7 соответственно [80].
Х-сцепленная атрофия зрительного нерва. Заболевание встречается крайне редко, в литературе описаны лишь единичные случаи Х-сцепленной АЗН, для которой характерно поражение только лиц мужского пола.
Впервые J. Lysen и C. Oliver [43] в 1947 г. описали 8 мужчин с АЗН в четырех поколениях, у некоторых из пациентов авторы отмечали наличие нистагма, катаракты, косоглазия. Следующее описание семьи с Х-сцепленной нейропатией зрительного нерва появилось в 1967 г. R. Rosenberg и А. Chutorian [60] обследовали двух братьев и их племянника с прогрессирующей АЗН, нейросенсорной тугоухостью и полинейропатией. В 1981 г. P. Jensen [30] описал похожий семейный случай, при этом наряду с нейросенсорной тугоухостью прогрессирующая АЗН сопровождалась деменцией.
Исходя из данных литературы, можно отметить некоторые особенности, характерные для Х-сцепленной АЗН: начало снижения зрения в детском возрасте, фенотипические различия заболевания внутри одной семьи, что связывают с влиянием на проявление признаков факторов внешней среды или других генетических факторов, в большинстве случаев сочетание Х-сцепленной АЗН с дополнительными неврологическими симптомами [32].
Таким образом, наследственные ОН — большая генетически гетерогенная группа заболеваний, которые имеют несколько паттернов наследования и обусловлены различными мутациями мтДНК и яДНК. Однако генетически разнородные ОН могут характеризоваться схожими клиническими проявлениями. В то же время ОН, возникающая в результате одного генетического дефекта, даже в пределах одной семьи может иметь различные фенотипические проявления. Изучение семейного анамнеза пациента помогает в оценке возможного наследственного генеза ОН, а также в формировании адекватной стратегии молекулярно-генетического анализа. Однако наследственный характер ОН по данным семейного анамнеза не представляется возможным подтвердить в случаях заболеваний с низкой пенетрантностью или у пациентов с небольшой родословной. Вместе с тем многие пациенты не знают об имеющихся в семье заболеваниях, а родственники с субклиническими проявлениями болезни не предполагают об имеющейся у них патологии зрительного нерва. Это приводит к тому, что наследственный характер заболевания в некоторых случаях может не учитываться при оценке генеза ОН, и при исключении всех возможных причин ОН этиология заболевания часто обозначается как неясная. Проведение молекулярно-генетического обследования пациента с двусторонней ОН даже в отсутствие известного семейного анамнеза во многих случаях позволяет выявлять генез заболевания зрительного нерва. Для улучшения диагностики наследственных ОН необходимо разрабатывать алгоритмы ДНК-диагностики наследственных форм ОН, оптимальные для различных этнических групп, проживающих на территории РФ, повышать уровень информированности окулистов. Определение основных генетических отклонений будет помогать генетическому консультированию. Кроме того, идентификация генного дефекта должна улучшить наше понимание патофизиологических механизмов дисфункции зрительного нерва с учетом развития направленных методов лечения.
Публикации в СМИ
Наследственные заболевания сетчатки и зрительного нерва — обширная гетерогенная группа заболеваний, приводящих к снижению или полному отсутствию зрения. В зависимости от преимущественного поражения сетчатки или зрительного нерва выделяют следующие подгруппы.
• Амавроз врождённый — наследуемая абиотрофия палочек и колбочек сетчатки и атрофия зрительных нервов, проявляющиеся быстрым развитием двусторонней центральной скотомы. Наблюдают преимущественно у мужчин, может развиться в любом возрасте (многие формы врождённые — амавроз врождённый Лебера: • тип 1: 204000, GUC2D, GUCSD, LCA1, 600179 [гуанилат циклаза 2D], 17p13; • тип 2: 204100, RPE65 [белок пигментного эпителия сетчатки], 180069, 1p31). Характеризуется прогрессирующим ухудшением зрения. В основе лежат наследуемые заболевания (мутации митохондриального и ядерного геномов). Известно, как минимум, 18 мутаций митохондриальной ДНК и не менее 6 локусов ядерной ДНК. Большую частоту заболевания у мужчин объясняют влиянием андрогенов (например, описан случай резкой потери зрения больным с мутацией MTND4*LHON11778А после терапии андрогенами).
• Атрофия зрительного нерва — часто компонент наследственных синдромов •• Атаксия Фридрайха с атрофией зрительного нерва и нейросенсорной тугоухостью (136600, Â ) •• Болезнь ван Бухема: иногда первое проявление этой патологии — атрофия зрительного нерва за счёт его сдавления гиперостозными разрастаниями костей черепа •• Атрофия зрительного нерва, глухота и дистальная нейрогенная амиотрофия (258650, r ) •• Метафизарная дисплазия, анетодермия (фокальная атрофия кожи) и атрофия зрительного нерва (250450, r ) •• Атрофия зрительного и слухового нервов с деменцией (311150, À ).
• Дегенерация сетчатки пигментная — прогрессирующая атрофия нейроэпителия с атрофией и пигментной инфильтрацией внутренних слоёв сетчатки. Часто применяемый термин «пигментный ретинит» не совсем точно отражает суть процесса, поскольку воспалительной реакции как таковой не возникает. Основные проявления обусловлены утратой палочек сетчатки. В основе лежит множество мутаций в ряде локусов (например, гены периферина [179605], родопсина [180380], цГМФ управляемого канала фоторецепторов [123825] и др.). Пигментная дегенерация сетчатки, не ассоциированная с другими нарушениями, наиболее часто наследуется как r (268000) и реже как À рецессивная (312600) признак. Доминантное наследование отмечают в 3–4% случаев. Кроме того, атипичный пигментный ретинит наблюдают при множестве других состояний, включая такие рецессивные нарушения, как абеталипопротеинемия (200100), синдромы Альстрема (203800), Рефсума (266500), Барде–Бидла (209900), Лоуренса–Муна (245800), Ашера (276900), Коккейна (216400), паллидарная дегенерация (260200).
• Дегенерация сетчатки коллоидная (сотовидный хориоидит Дойна, *126600, 2p16, ген DHRD, Â ). Множественные очаги округлой формы беловатого цвета, расположенные у диска зрительного нерва и в зоне между верхней и нижней височными артериолами.
• Дистрофия жёлтого пятна кистозная (*153880, 7p21–p15, ген MDDC, Â ). Клинически: кистозный отёк жёлтого пятна, беловатые точечные отложения в стекловидном теле, дальнозоркость, косоглазие, снижение остроты зрения, перицентральный пигментный ретинит.
• Дистрофия палочек и колбочек, типы и гены: • тип 1, 600624, CORD1, CRD1, 18q21.1 q21.3; • тип 2, 120970, CRX, CORD2, CRD, 602225, 19q13.3
• Дистрофия пигментного эпителия сетчатки, 179605 (мутации гена периферина RDS, RP7), 6p21.1 cen
• Дистрофия сетчатки ранняя (аутосомно рецессивная): 180069, ген RPE65, 1p31
• Дистрофия хориоидеи центральная (215500, ген CACD, 17p)
Дифференциальная диагностика • Инфекционные ретинопатии — вирусные (краснуха) или бактериальные (сифилис) • Остаточные явления экссудативной отслойки сетчатки • Вторичные токсические ретинопатии (хлорохин или фенотиазины) • Другие патологические состояния (окклюзия глазной артерии, травмы).
Течение и прогноз • Прогноз наиболее неблагоприятный при врождённых формах • Течение в большинстве случаев хроническое, медленно прогрессирующее.
МКБ-10 • H31.2 Наследственная дистрофия сосудистой оболочки глаза • H35.5 Наследственные ретинальные дистрофии • Q14 Врождённые аномалии [пороки развития] заднего сегмента глаза
ПРИЛОЖЕНИЯ
Слепота ночная — резкое ухудшение зрения в условиях пониженной освещенности — возникает при дефиците ретинола (гемералопия алиментарная, гемералопия симптоматическая [заболевания сетчатки, сосудистой оболочки глаза, зрительного нерва, поражения печени]), а также при ряде врождённых состояний • Слепота ночная развивается при мутациях гена a -субъединицы трансдуцина палочек, b- субъединицы цГМФ фосфодиэстеразы, родопсина • Болезнь Огуши (258100, дефекты специфичных для зрительной сетчатки белков — аррестина (181031) и родопсин киназы (180381). Синонимы: гемералопия, никталопия, слепота куриная. МКБ-10. H53.6 Ночная слепота. OMIM • 310500 Слепота ночная врождённая стационарная с миопией • 139330 Слепота ночная врождённая стабильная • 300071 Слепота ночная врождённая стационарная, тип 2 • 163500 Слепота ночная врождённая стационарная, тип 3 • 180380 Слепота ночная, врождённая стационарная родопсин-связанная • 258100 Болезнь Огуши.
Слепота цветовая (ахроматопсия) — отсутствие цветового зрения. Возможность различать любые цвета (трихромазия, основы теории цветного зрения предложил в 1802 г. Томас Янг) определяется присутствием в сетчатке всех трёх зрительных пигментов (для красного, зелёного и синего — первичные цвета). Дихромазии — дефекты цветового восприятия (преимущественно у мужчин; например, разные дефекты у мужчин составляют 8% общей популяции) по одному из первичных цветов — подразделяют на протанопии, дейтанопии и тританопии (от греч. первый, второй и третий [имеются в виду порядковые номера первичных цветов: соответственно красный, зелёный, синий]) • Протанопия (страдает восприятие красного, примерно 25% случаев цветовой слепоты) • Дейтанопия (цветовая слепота по восприятию зелёного, около 75% всех случаев) • Тританопия (страдает преимущественно восприятие фиолетового цвета, дефектное зрение по синему и жёлтому) • Дальтонизм — нарушение цветового зрения — неспособность различать красный и зеленый цвета. МКБ-10. H53.5 Аномалии цветового зрения.
Слепота преходящая (amaurosis fugax) — острый эпизод полной или частичной потери зрения, длящийся обычно не более 10 мин. Причины: кратковременная ишемия в бассейне сонной артерии (как правило, эмболия артерий сетчатки). Лечение • Лекарственная терапия •• Антигипертензивные средства •• Фибринолитические средства •• Антиагреганты (ацетилсалициловая кислота, дипиридамол) • Хирургическое: эндартерэктомия сонной артерии. МКБ-10. G45.3 Преходящая слепота.
Хориоидеремия Х-сцепленная (*303100, ген CHM, Xq21.2; форма с глухотой и ожирением, 303110) — наследственная болезнь глаз, прогрессирующие понижение остроты зрения, сужение полей зрения, гемералопия и близорукость; характерные изменения глазного дна (почти полное отсутствие сосудистого рисунка, резкие контуры и красновато-коричневый цвет жёлтого пятна, нечёткость границ диска зрительного нерва). Синоним: атрофия сосудистой оболочки прогрессирующая. МКБ-10. H31.2 Наследственные дистрофии сосудистой оболочки глаза.
Код вставки на сайт
Заболевания сетчатки и зрительного нерва наследственные
Наследственные заболевания сетчатки и зрительного нерва — обширная гетерогенная группа заболеваний, приводящих к снижению или полному отсутствию зрения. В зависимости от преимущественного поражения сетчатки или зрительного нерва выделяют следующие подгруппы.
• Амавроз врождённый — наследуемая абиотрофия палочек и колбочек сетчатки и атрофия зрительных нервов, проявляющиеся быстрым развитием двусторонней центральной скотомы. Наблюдают преимущественно у мужчин, может развиться в любом возрасте (многие формы врождённые — амавроз врождённый Лебера: • тип 1: 204000, GUC2D, GUCSD, LCA1, 600179 [гуанилат циклаза 2D], 17p13; • тип 2: 204100, RPE65 [белок пигментного эпителия сетчатки], 180069, 1p31). Характеризуется прогрессирующим ухудшением зрения. В основе лежат наследуемые заболевания (мутации митохондриального и ядерного геномов). Известно, как минимум, 18 мутаций митохондриальной ДНК и не менее 6 локусов ядерной ДНК. Большую частоту заболевания у мужчин объясняют влиянием андрогенов (например, описан случай резкой потери зрения больным с мутацией MTND4*LHON11778А после терапии андрогенами).
• Атрофия зрительного нерва — часто компонент наследственных синдромов •• Атаксия Фридрайха с атрофией зрительного нерва и нейросенсорной тугоухостью (136600, Â ) •• Болезнь ван Бухема: иногда первое проявление этой патологии — атрофия зрительного нерва за счёт его сдавления гиперостозными разрастаниями костей черепа •• Атрофия зрительного нерва, глухота и дистальная нейрогенная амиотрофия (258650, r ) •• Метафизарная дисплазия, анетодермия (фокальная атрофия кожи) и атрофия зрительного нерва (250450, r ) •• Атрофия зрительного и слухового нервов с деменцией (311150, À ).
• Дегенерация сетчатки пигментная — прогрессирующая атрофия нейроэпителия с атрофией и пигментной инфильтрацией внутренних слоёв сетчатки. Часто применяемый термин «пигментный ретинит» не совсем точно отражает суть процесса, поскольку воспалительной реакции как таковой не возникает. Основные проявления обусловлены утратой палочек сетчатки. В основе лежит множество мутаций в ряде локусов (например, гены периферина [179605], родопсина [180380], цГМФ управляемого канала фоторецепторов [123825] и др.). Пигментная дегенерация сетчатки, не ассоциированная с другими нарушениями, наиболее часто наследуется как r (268000) и реже как À рецессивная (312600) признак. Доминантное наследование отмечают в 3–4% случаев. Кроме того, атипичный пигментный ретинит наблюдают при множестве других состояний, включая такие рецессивные нарушения, как абеталипопротеинемия (200100), синдромы Альстрема (203800), Рефсума (266500), Барде–Бидла (209900), Лоуренса–Муна (245800), Ашера (276900), Коккейна (216400), паллидарная дегенерация (260200).
• Дегенерация сетчатки коллоидная (сотовидный хориоидит Дойна, *126600, 2p16, ген DHRD, Â ). Множественные очаги округлой формы беловатого цвета, расположенные у диска зрительного нерва и в зоне между верхней и нижней височными артериолами.
• Дистрофия жёлтого пятна кистозная (*153880, 7p21–p15, ген MDDC, Â ). Клинически: кистозный отёк жёлтого пятна, беловатые точечные отложения в стекловидном теле, дальнозоркость, косоглазие, снижение остроты зрения, перицентральный пигментный ретинит.
• Дистрофия палочек и колбочек, типы и гены: • тип 1, 600624, CORD1, CRD1, 18q21.1 q21.3; • тип 2, 120970, CRX, CORD2, CRD, 602225, 19q13.3
• Дистрофия пигментного эпителия сетчатки, 179605 (мутации гена периферина RDS, RP7), 6p21.1 cen
• Дистрофия сетчатки ранняя (аутосомно рецессивная): 180069, ген RPE65, 1p31
• Дистрофия хориоидеи центральная (215500, ген CACD, 17p)
Дифференциальная диагностика • Инфекционные ретинопатии — вирусные (краснуха) или бактериальные (сифилис) • Остаточные явления экссудативной отслойки сетчатки • Вторичные токсические ретинопатии (хлорохин или фенотиазины) • Другие патологические состояния (окклюзия глазной артерии, травмы).
Течение и прогноз • Прогноз наиболее неблагоприятный при врождённых формах • Течение в большинстве случаев хроническое, медленно прогрессирующее.
МКБ-10 • H31.2 Наследственная дистрофия сосудистой оболочки глаза • H35.5 Наследственные ретинальные дистрофии • Q14 Врождённые аномалии [пороки развития] заднего сегмента глаза
ПРИЛОЖЕНИЯ
Слепота ночная — резкое ухудшение зрения в условиях пониженной освещенности — возникает при дефиците ретинола (гемералопия алиментарная, гемералопия симптоматическая [заболевания сетчатки, сосудистой оболочки глаза, зрительного нерва, поражения печени]), а также при ряде врождённых состояний • Слепота ночная развивается при мутациях гена a -субъединицы трансдуцина палочек, b- субъединицы цГМФ фосфодиэстеразы, родопсина • Болезнь Огуши (258100, дефекты специфичных для зрительной сетчатки белков — аррестина (181031) и родопсин киназы (180381). Синонимы: гемералопия, никталопия, слепота куриная. МКБ-10. H53.6 Ночная слепота. OMIM • 310500 Слепота ночная врождённая стационарная с миопией • 139330 Слепота ночная врождённая стабильная • 300071 Слепота ночная врождённая стационарная, тип 2 • 163500 Слепота ночная врождённая стационарная, тип 3 • 180380 Слепота ночная, врождённая стационарная родопсин-связанная • 258100 Болезнь Огуши.
Слепота цветовая (ахроматопсия) — отсутствие цветового зрения. Возможность различать любые цвета (трихромазия, основы теории цветного зрения предложил в 1802 г. Томас Янг) определяется присутствием в сетчатке всех трёх зрительных пигментов (для красного, зелёного и синего — первичные цвета). Дихромазии — дефекты цветового восприятия (преимущественно у мужчин; например, разные дефекты у мужчин составляют 8% общей популяции) по одному из первичных цветов — подразделяют на протанопии, дейтанопии и тританопии (от греч. первый, второй и третий [имеются в виду порядковые номера первичных цветов: соответственно красный, зелёный, синий]) • Протанопия (страдает восприятие красного, примерно 25% случаев цветовой слепоты) • Дейтанопия (цветовая слепота по восприятию зелёного, около 75% всех случаев) • Тританопия (страдает преимущественно восприятие фиолетового цвета, дефектное зрение по синему и жёлтому) • Дальтонизм — нарушение цветового зрения — неспособность различать красный и зеленый цвета. МКБ-10. H53.5 Аномалии цветового зрения.
Слепота преходящая (amaurosis fugax) — острый эпизод полной или частичной потери зрения, длящийся обычно не более 10 мин. Причины: кратковременная ишемия в бассейне сонной артерии (как правило, эмболия артерий сетчатки). Лечение • Лекарственная терапия •• Антигипертензивные средства •• Фибринолитические средства •• Антиагреганты (ацетилсалициловая кислота, дипиридамол) • Хирургическое: эндартерэктомия сонной артерии. МКБ-10. G45.3 Преходящая слепота.
Хориоидеремия Х-сцепленная (*303100, ген CHM, Xq21.2; форма с глухотой и ожирением, 303110) — наследственная болезнь глаз, прогрессирующие понижение остроты зрения, сужение полей зрения, гемералопия и близорукость; характерные изменения глазного дна (почти полное отсутствие сосудистого рисунка, резкие контуры и красновато-коричневый цвет жёлтого пятна, нечёткость границ диска зрительного нерва). Синоним: атрофия сосудистой оболочки прогрессирующая. МКБ-10. H31.2 Наследственные дистрофии сосудистой оболочки глаза.
Атрофия зрительного нерва: симптомы, причины, лечение.
Существуют заболевания, при которых спасти здоровье глаз сложно. Атрофия зрительного нерва — одно из них.
Часто проблемы со зрением можно решить при помощи корректирующих очков или операций. Тем не менее, существуют заболевания, при которых спасти здоровье глаз намного сложнее. Атрофия зрительного нерва — одно из них.
Под этим названием понимают медленное и систематическое отмирание нервных волокон с последующим замещением соединительной тканью. Как итог, поступающая в мозг информация искажается, а зрение человека падает все сильнее.
Можно ли вернуть зрение? Рассказывает наш доктор к.м.н., офтальмолог - хирург высшей категории Унгурьянов О.В.:
Что происходит со зрением?
Процесс атрофии всегда означает необратимую утрату функций тем или иным органом. Зрительный нерв — это своеобразная дорога для импульсов, направляющихся в мозг. Когда часть волокон истончается или отмирает, картинка становится дефектной, например — нечеткой, а с ростом количества повреждений и зрение становится хуже.
В зависимости от степени повреждения, различают атрофию начальную, частичную и полную. Кроме того, патология может быть и врожденной, т.е. проявиться при рождении или в ранние годы жизни.
Примечательно, что атрофия зрительного нерва зачастую бывает двусторонней, т.е. спустя какое-то время в процесс вовлекается и ранее здоровый глаз.
Симптомы
Учитывая необратимость повреждений, важно вовремя заметить тревожные симптомы заболевания, чтобы минимизировать последствия для зрения пациента.
Распознать атрофию зрительного нерва можно по следующим признакам:
- Снижение остроты зрения. Становится сложно (почти невозможно) сфокусироваться на предметах. Первоначально затуманивание становится легким и возникает периодически, но потом проявляется все чаще и сильнее. При этом, поскольку болезнь не связана со способностями глаза преломлять лучи света, использование очков не приносит никакого эффекта.
- Выпадение полей зрения — так, словно кто-то прикрыл часть глаза ладонью. На начальных стадиях атрофии этот симптом может не проявляться, т.к. здоровые нейроны стараются компенсировать работу погибших.
- Нарушение цветовосприятия. При этом чаще пациентам становится сложнее различать оттенки красного и зеленого.
- Туннельное зрение. У человека может пропасть периферический обзор, а поле зрения со временем сужается все сильнее.
- Скотома (слепое пятно), но только в том случае, если в процесс атрофии вовлечены центральные волокна нерва.
Кроме того, люди с атрофией зрительного нерва могут жаловаться на головные боли и болезненные ощущения при движениях глаз.
ВАЖНО: Поскольку заболевание относится к прогрессирующим и необратимым, а его проявления во многом совпадают с другими болезнями глаз, при обнаружении любого из вышеупомянутых симптомов следует немедленно обратиться к врачу. Своевременная диагностика играет ключевую роль в спасении зрения при атрофии зрительного нерва!
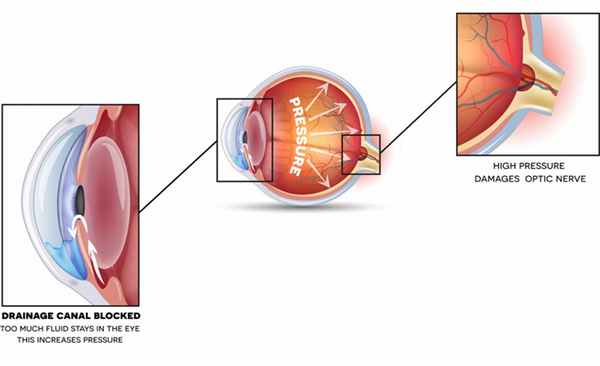
Причины
Причин развития болезни существует множество, поскольку атрофия развивается как следствие всевозможных патологических состояний, включая наследственные заболевания.
Чаще прочих причиной поражения нерва становятся:
тяжелые инфекции различной природы;
системные болезни, характеризующиеся нарушением кровоснабжения (например — анемия, гипертония, диабет);
рассеянный склероз и другие патологии ЦНС;
опухоли, сдавливающие глазной нерв;
травмы головы, особенно в области глаз;
отравления токсинами (включая лекарства и алкоголь).
Разумеется, вышеупомянутые болезни не всегда вызывают отмирание волокон зрительного нерва, однако при них рекомендуется особенно пристально следить за здоровьем глаз.
Лечение
Специалисты сходятся во мнении, что полностью вылечить атрофию невозможно, поскольку способность к регенерации у нервной ткани существенно ограничена. Обычно терапию начинают сразу после обращения пациента, даже в отсутствие итогов дополнительной диагностики. При этом специалист обязательно корректирует план лечения после уточнения причины, вызвавшей отмирание волокон.
Лечение должно носить систематический и комплексный подход, с учетом множества факторов:
возраста/общего состояния пациента;
длительности процесса отмирания волокон.
Комплексность проявляется в использовании следующих методов воздействия:
- Операция. Проводится, если требуется наладить процесс поступления полезных веществ в поврежденную область, например — удалить опухоль.
- Традиционная терапия. Может включать прием различных медикаментов (витамина B, сосудорасширяющих веществ), а также переливание крови.
- Физиотерапия. Дополняет основной комплекс методов, поскольку помогает улучшить общее состояние организма. Зачастую рекомендуют кислородотерапию, ультразвук и другие способы воздействия.
- Электростимуляция. В глазное яблоко и на кожу помещаются электроды, генерирующие электроимпульсы. Эта методика, при условии регулярного повторения, позволяет постепенно восстановить зрение.
- Магнитостимуляция. Воздействие переменным магнитным полем позволяет улучшить кровоснабжение и наладить обменные процессы. Этот метод особенно полезен на ранних стадиях атрофии и может помочь частично восстановить зрение.
Вовремя начатое лечение зачастую дает возможность затормозить или остановить процесс отмирания нейронов, а иногда и частично восстановить зрение. Однако, к сожалению, недостаточно просто пройти несколько курсов лечения — в случае атрофии терапия носит пожизненный характер.
Читайте также:
