Происхождение первично-множественных опухолей. Морфология первично-множественного рака
Добавил пользователь Владимир З. Обновлено: 29.01.2026
В статье представлен обзор по одной из наименее изученных проблем современной онкологии – первично-множественным злокачественным новообразованиям. Данные многочисленных исследований показывают, что за последние десятилетия во всем мире наблюдается увеличение и количества больных с первично-множественными злокачественными новообразованиями. В настоящее время первично-множественные злокачественные опухоли являются достаточно распространенной разновидностью онкологической патологии. Необходимо отметить, что увеличение числа случаев первично-множественных злокачественных опухолей у пациентов после лучевой терапии и химиотерапии первой опухоли уже стало главной проблемой двух последних десятилетий во всем мире. В настоящее время в литературе первично-множественными злокачественными опухолями или полинеоплазиями называют pазвитие двух или более независимых друг от друга новообразований. По мере накопления материалов по первичной множественности опухолей достаточно остро встал вопрос о критериях первичности опухолей, чтобы отличать их от вторично возникающих опухолей метастатического происхождения. В связи с этим вопрос критериев первичности опухолей является принципиально важным в теории и практике первично-множественного опухолевого роста. В обзоре представлены изменения представлений о критериях множественности злокачественных опухолей и изменения предлагаемых классификаций, происходивших по мере развития онкологии и накопления материалов по первичной множественности опухолей.
1. Абдурасулов Д.М., Никишин К.Е. Множественные опухолевые поражения. Первично-множественные опухоли. – Ташкент: Медицина, 1968. – 652с.
2. Важенин А.В., Бехтерева Е.И., Бехтерева С.А., Гюлов Х.Я. Очерки первичной множественности злокачественных опухолей. – Челябинск: Изд-во «Иероглиф», 2000. – 213с.
3. Герасимов А.Н. Случай первично-множественной опухоли // Мед. радиология. – 1971. – Т.16, № 9. – С. 43-45.
4. Друкин Э.Я. Первичная множественность рака легкого // Вопр. онкологии. – 1983. – Т. 29, № 1. – С.63-68.
5. Зисман И.Ф., Кириченко Г.Д. Клинические аспекты первичной множественности злокачественных новообразований. – Кишинев: Штиинца, 1978. – 148с.
6. Злокачественные новообразования в России в 2011 году (заболеваемость и смертность) / под ред. В.И. Чиссова, В.В. Старинского, Г.В. Петровой. – М.: ФГБУ «МНИОИ им. П.А. Герцена» Минздрава России, 2013. – 289с
7. Злокачественные новообразования в России в 2013 году (заболеваемость и смертность) / под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. – М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «ФМИЦ им. П.А. Герцена» Минздрава России, 2015. – 250 с.
9. Петров Н.Н. Первичная одиночность и первичная множественность злокачественных опухолей // Злокачественные опухоли. – Л.: Медгиз, 1947. – С. 260-263.
11. Ратнер Л.М., Воротилкин А.И. О первично-множественных опухолях // Проблемы онкологии. – Свердловск, 1939. – Т.4, вып. 2. – С.125-143.
13. Соркин В.М. К вопросу о регистрации и учете больных с первично-множественными новообразованиями // Онкология. – 2001. – № 3. – С.136-138.
15. Сусла П.А., Соколов А.М. О первично-множественных опухолях различной локализации // Вестн. хирургии. – 1979. – Т.122, № 6. – С.71-74.
16. Трахтенберг А.Х., Пирогов А.И., Гольдберт З.В. и др. Первично-множественный рак обоих легких // Вопр. онкологии. – 1984. – Т.30, № 1. – С.23-33.
17. Чиссов В.И., Старинский В.В., Ковалев Б.Н. Злокачественные новообразования в России: статистика, научные достижения, проблемы // Казан. мед. журн. – 2000. – Т.81. – С.241-248.
19. Bartkowiak D., Humble N., Suhr P., Hagg J., Mair K., Polivka B., Schneider U., Bottke D., Wiegel T. Second cancer after radiotherapy, 1981-2007 / D. Bartkowiak, N. Humble, P. Suhr et al. // Radiotherapy and Oncology. – 2012. – Vol. 105. – P. 122-126.
20. Berrington de Gonzalez A. Proportion of second cancers attributable to radiotherapy treatment in adults: a cohort study in the US SEER cancer registries / A. Berrington de Gonzalez, R.E. Curtis, S.F. Kry et al. // Lancet Oncol. – 2011. – Vol. 12. – P. 353-360.
22. Lund C.C. Second primari cancer in cases of buccal mucosa; mathematical study of susceptibility to cancer // N. Engl. J. Med. – 1933.
23. Moertel C.G., Dockerty M.B., Baggenstoss A.H. Multiple primary malignant neoplasms. I. Intradiction and presentation of data // Cancer. – 1961. – Vol.14, N 2. – P.221-248.
24. Shin D.W. Knowledge, attitudes, and practice on second primary cancer screening among cancer survivors: A qualitative study / D.W. Shin, Y.Ji. Baik, Y.W. Kim et al. // Patient Education and Counseling. – 2011. – Vol. 85. – P. 74-78.
25. Tubiana M. Can we reduce the incidence of second primary malignancies occurring after radiotherapy? A critical review // Radiotherapy and Oncology. – 2009. – Vol. 91. – P. 4-15.
По прогнозам Всемирной организации здравоохранения (ВОЗ), онкологическая заболеваемость во всем мире возрастет за период с 1999 по 2050 г. с 10 до 24 млн случаев, а смертность - с 6 до 16 млн регистрируемых случаев [28]. По данным официальной статистики [6,7], абсолютное число случаев возникновения злокачественных опухолей (ЗНО) в РФ за 1991-2011 гг. возросло в 1,37 раза, достигнув показателя 365,4 на 100 тысяч населения, к 2013 году - в 1,4 раза, достигнув показателя 373,4 на 100 тысяч населения, в УрФО в 1997 году показатель заболеваемости ЗНО составил 281,6 на 100 тысяч населения, к 2011 и 2013 году он вырос в 1,3 раза и составил соответственно 362,2 и 366,4 на 100 тысяч населения. По данным Росстата, число пациентов с впервые в жизни установленным диагнозом злокачественного новообразования возросло с 451 тысячи человек в 2001 году (311 на 100 000 населения) до 522 тысяч человек в 2011 году (365 на 100 000 населения), абсолютное число случаев возникновения ЗНО в РФ к 2013 году достигло показателя 373,4 на 100 тысяч населения [6,7].
Данные многочисленных исследований показывают, что за последние десятилетия во всем мире наблюдается увеличение и количества больных с первично-множественными злокачественными новообразованиями (ПМ ЗНО) [2,8,13,14,17,18]. В настоящее время ПМ ЗНО являются достаточно распространенной разновидностью онкологической патологии, по официальным данным, в 2011 году в России ПМ ЗНО отмечались у 4,7 % онкологических больных, в 2013 году - уже у 6,1 % больных [6,7]. Так, по данным В.В. Старинского и соавт. [14], абсолютное число случаев возникновения ПМ ЗНО в России за 1991-2000 гг. возросло в 2,8 раза, в 1991 г. по официальным данным было выявлено 2838 больных с этим диагнозом, что составило показатель заболеваемости 1,9 (на 100 000 населения), а в 2000 г. ПМ ЗНО были диагностированы у 7956 больных (5,5 на 100 000 населения) [14,17], в 2011 году число ПМ ЗНО составило уже 24774 (17,3 на 100 000 населения), а к 2013 году абсолютное число случаев возникновения ПМ ЗНО в России достигло показателя 32841 (22,9 на 100 000 населения) [6,7].
Необходимо отметить, что увеличение числа случаев первично-множественных злокачественных опухолей у пациентов после лучевой терапии и химиотерапии первой опухоли уже стало главной проблемой двух последних десятилетий во всем мире [2,18,25,20,24,19].
История изучения первично-множественных опухолей началась в ΧΙΧ веке - первое наблюдение первично-множественной опухоли у больной с раком молочной железы и матки датируется 1793 годом и принадлежит американскому врачу J. Pearson. В настоящее время в литературе первично-множественными злокачественными опухолями или полинеоплазиями называют pазвитие двух или более независимых друг от друга новообразований [2]. По мере накопления материалов по первичной множественности опухолей достаточно остро встал вопрос о критериях первичности опухолей, чтобы отличать их от вторично возникающих опухолей метастатического происхождения [12]. В связи с этим вопрос критериев первичности опухолей является принципиально важным в теории и практике первично-множественного опухолевого роста.
Основоположником изучения данной патологии по праву считается Т. Бильрот, который в 1869 году не только описал случай первично-множественной опухоли у больного с сочетанием рака желудка и наружного уха, но и ввел критерии (постулаты) первичной множественности опухолей, выдвинув такие требования для определения первичности возникновения новообразований: во-первых, опухоли должны располагаться в разных органах, во-вторых, они должны иметь различное гистологическое строение и, в-третьих, каждая опухоль должна давать самостоятельные метастазы [21]. Однако в дальнейшем, в связи с усовершенствованием микроскопа и накоплением знаний о закономерностях развития и метастазирования опухолей, требования Т. Бильрота подвергались пересмотру, первично-множественные опухоли явно не вписывались в узкие рамки прежних постулатов. Но в более поздние периоды другими авторами предлагались критерии, близкие к постулатам Бильрота. В 1932 году были опубликованы следующие критерии: каждая из опухолей должна иметь четкую картину злокачественности; опухоли должны располагаться отдельно; каждая из опухолей не должна быть метастазом другой [26].
С 1910 года к проблеме первичной множественности опухолей было привлечено внимание Н.Н. Петрова, который внес большой вклад в изучение и понимание этого вопроса. В 1947 году в первом советском руководстве по общей клинической онкологии Н.Н. Петров уточнил представления о критериях первичной множественности, что сделало возможным их использование в клинической практике [9]. Н.Н. Петров считал, что для утверждения первичности опухолей необходимо, чтобы каждая из них была действительно злокачественной, то есть обнаруживала бы признаки деструктивного роста и, но не обязательно, давала метастазы; чтобы опухоли были действительно первичными, но не были сами метастазами. В дальнейшем, пересмотрев и это положение, Н.Н. Петров пришел к выводу, что для доказательства самостоятельности возникновения опухолей можно считать достаточным один признак - доказанную первичность, а не метастатическое происхождение обнаруживаемых множественных опухолей, все равно синхронных или метахронных [9,10].
Практически аналогичные положения были выдвинуты и другими авторами. Так, одни авторы считают, что каждая опухоль должна иметь определенные признаки злокачественности и не быть метастазом по отношению к первой [23]. Другие авторы предложили следующие критерии: опухоли должны располагаться в различных органах, опухоли парных органов (синхронные и метахронные) являются проявлениями солитарной опухоли, множественность опухолей в одном органе определяется множественностью зачатков, для чего необходимо проведение серийных гистологических исследований органа [27]. Этих положений придерживаются и другие авторы [3]. Один из авторов считал, что критериями первичной множественности злокачественных опухолей являются: различная гистологическая структура опухолей, опухоли любых гистологических форм, если на границе со второй опухолью определяется преинвазивная карцинома, опухоли со значительным несовпадением темпов роста [4]. Вместе с тем автор указывает и на относительность этих достаточно четких критериев, поскольку известно, что злокачественные опухоли, особенно легких, о которых ведется речь в его работе, обладают выраженным полиморфизмом, поэтому в одной опухоли могут присутствовать различные гистологические структуры, а в случае генерализации метастазы могут также иметь иное гистологическое строение. Рядом исследователей на границе с опухолью обнаруживались участки плоскоклеточной метаплазии эпителия бронхов и карциномы in Situ, что может говорить о постепенности и многоступенчатости развития рака. Что касается темпов роста опухоли и интервала между их развитием, то этот критерий также относителен, поскольку, учитывая длительность периода развития опухоли от зачатка до диагностирования, метастаз, если он обладает темпом роста первичной опухоли, может проявиться через несколько лет и симулировать метахронную опухоль. Однако, несмотря на относительность вышеуказанных критериев, автор считает их вполне приемлемыми в клинике [4].
Дальнейшим развитием и детализацией данного вопроса применительно к первично-множественным опухолям представляются нам абсолютные (морфологические) и относительные (клинико-рентгенологические) критерии первичности, выдвинутые группой авторов в 1984 году [16].
В процессе накопления сведений о первично-множественных опухолях предпринимались и попытки их классифицировать [11,15,22,23]. Так, в 1933 году была предложена классификация [22], к которой позднее обратилась группа авторов [23]. По этой классификации множественные опухоли разделяются на три группы: первично-множественные злокачественные опухоли мультицентрического происхождения: а) одной и той же ткани или органа; б) ткани, общей для разных органов; в) двусторонних парных органов; первично-множественные злокачественные опухоли разных тканей или органов; первично-множественные злокачественные опухоли мультицентрического происхождения в сочетании с опухолями других органов или тканей [22, 23].
Классификация С.М. Слинчака [12] разделяет множественные злокачественные опухоли на две большие группы: синхронные и метахронные, в зависимости от очередности развития опухолей. Каждая из вышеуказанных групп содержит по три подгруппы: 1) множественные злокачественные опухоли, развивающиеся мультицентрически в одном органе; 2) системные множественные опухоли, развивающиеся в одной системе органов или в парных органах; 3) множественные несистемные опухоли. В 1978 году классификацию С.М. Слинчака дополнили группами синхронно-метахронных и метахронно-синхронных опухолей [5].
Мы считаем, что наиболее приемлемой нужно считать классификацию [1], систематизирующую опухоли в зависимости от времени их возникновения или по последовательности выявления отдельных опухолей. Кроме того, авторы классифицируют первично-множественные опухоли в зависимости от последовательности их развития и обнаружения, по тканевой принадлежности, гистоструктуре и локализации [1]. По последовательности развития опухоли делят на метахронные (опухоли, развивающиеся последовательно), синхронные (опухоли, развивающиеся одновременно), метахронно-синхронные (вначале развивается одна опухоль, а через интервал выявляются две одновременно возникшие опухоли), синхронно-метахронные опухоли (одновременно выявляются две злокачественные опухоли, а затем через интервал диагностируется еще одна злокачественная опухоль). Известно, что интервал между развитием метахронных опухолей колеблется в среднем в пределах 3-8 лет. Критерием метахронности большинство авторов считают интервал не менее 6 месяцев или одного года. Мы согласны с критериями метахронности, предложенными Н.Н. Петровым [9,10], и считаем, что более надежен и приемлем в клинике в качестве критерия метахронности интервал в 1 год, интервал в 6 месяцев может быть достоверен лишь для рака in situ [2].
Таким образом, нам представляется, что вышеописанные классификации [12,1,5] в наиболее полной степени отражают многообразие исследуемого явления и суть проблемы, а наиболее всеобъемлющим и приемлемым для клинициста является определение первичности опухолей, данное Петровым Н.Н. [9,10], который считает, что для утверждения первичности опухолей надо, чтобы каждая опухоль была злокачественной и достаточно показана ее первичность. В настоящее время большинство авторов, как и мы, в своей практической и научной деятельности пользуются этими критериями первичности опухолей, как наиболее универсальными, корректными и реалистичными.
Рецензенты:
Яйцев С.В., д.м.н., профессор, заведующий кафедрой онкологии ГБОУ ВПО ЮУГМУ, г. Челябинск;
Жаров А.В., д.м.н., профессор кафедры онкологии, лучевой диагностики и лучевой терапии ГБОУ ВПО ЮУГМУ, г. Челябинск.
Происхождение первично-множественных опухолей. Морфология первично-множественного рака
Свойства первично-множественных опухолей. Критерии первично-множественного рака
Еще Billroth (1889) указывал на эту трудность; именно ему приписывается формулировка трех обязательных условий дифференциальной диагностики первично множественных злокачественных опухолей, которые в отличие от вторично множественных (метастатических) должны иметь различную гистологическую структуру, располагаться в различных органах и каждая вызывать собственные метастазы. Некоторыми авторами делались попытки еще более усилить эти требования; например Mercanton (no Malmio, 1959) считал, что к первично множественным не могут причисляться случаи появления второй злокачественной опухоли после удаления первой; другие включают в группу первично множественных только те опухоли, которые располагаются в различных органах и системах.
Однако большинство авторов, подробно изучавших вопрос о необходимых критериях при установлении первичной множественности злокачественных опухолей, признали весь комплекс указанных требований необязательным. Каждый из указанных критериев не может считаться доказательным. Известно, например, что множественные раки кожи и кишечника гистологически идентичны, но независимое друг от друга возникновение их едва ли можно оспаривать.
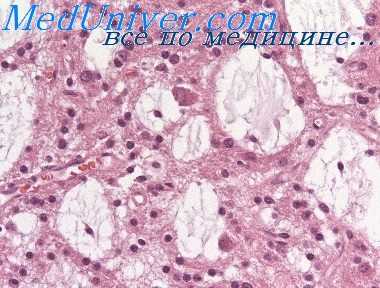
С другой стороны, не все раки с различной гистологической структурой являются независимыми, так как и метастазы в связи с метаплазией клеточных элементов гистологически могут значительно отличаться от первичной опухоли.
Еще более сомнительным является требование о наличии метастазов каждой опухоли; если лечение опухоли начато рано, то этот признак, естественно, отпадает; более того, в стадии метастазирования клиническая диагностика первичной множественности резко затрудняется. Этот критерий может иметь значение, главным образом, при патологоанатомических вскрытиях. Вместе с тем, в литературе обращено внимание и на целесообразность использования некоторых других критериев, в частности известного правила Вирхова о том, что органы, в которых возникают первичные раки, редко поражаются метастазами.
Moertel с соавторами (1961) утверждают, что сам Billroth (1889) таких строгих требований не выдвигал.
Следует согласиться с тем, что наиболее реалистическими критериями должны быть признаны те, которые, с одной стороны, не были бы столь неопределенными, чтобы диагностика двух или более самостоятельных злокачественных опухолей оказалась весьма сомнительной, и вместе с тем не настолько строгими, чтобы они потеряли всякое практическое и клиническое значение.
В настоящее время многие отечественные и зарубежные авторы придерживаются критериев, предложенных Warren и Gates (1932) и впоследствии подтвержденных Н. Н. Петровым (1947). Warren с соавтором (1932) считают, что для диагноза первичной множественности двух или более злокачественных опухолей требуется, чтобы каждая из опухолей имела ясную картину злокачественности, чтобы они располагались раздельно и была бы исключена возможность того, что одна является метастазом другой.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Первично-множественные опухоли
Первично множественные опухоли – неоплазии, возникающие одновременно или через определенный промежуток времени и не являющиеся метастазами друг друга. Могут быть доброкачественными или злокачественными, мультицентрически располагаться в одном органе, возникать в парных органах, локализоваться в пределах одной системы или нескольких систем. Возникают в результате соматических мутаций или наследственных генетических аномалий. Диагностируются на основании клинических симптомов, лабораторных и инструментальных исследований. Тактика лечения определяется типом, распространенностью, локализацией и степенью злокачественности новообразований.
Общие сведения
Первично множественные опухоли – две или более неоплазии различного генеза, одновременно либо последовательно развившиеся в одном или нескольких органах. В большинстве случаев диагностируются два новообразования. Три узла обнаруживаются у 5-8% пациентов. Случаи четырех и более неоплазий являются крайне редкими и рассматриваются как казуистические. В последние десятилетия отмечается резкое увеличение количества первично множественных опухолей, однако истинная частота их развития пока является предметом исследований.
Согласно статистическим данным, первично множественные опухоли выявляются у 13% пациентов с онкологическими заболеваниями, однако некоторые специалисты указывают, что эта цифра может быть заниженной из-за возможных диагностических ошибок (при определении независимого процесса, как метастаза первичного новообразования) и гибели некоторых больных до появления симптомов второй неоплазии. Лечение первично множественных опухолей осуществляют онкологи, гастроэнтерологи, эндокринологи, маммологи, гинекологи и специалисты в других сферах медицины (в зависимости от локализации новообразований).
Первое упоминание о множественных неоплазиях встречается в трудах Авиценны, который более тысячи лет назад описал двухсторонний рак молочных желез. В XIX веке описания первично множественных опухолей стали все чаще встречаться в специализированной литературе. Наиболее существенный вклад в определение понятия и изучение данной патологии внес немецкий хирург Бильрот. В частности, он первым дал определение подобным патологическим состояниям, отнеся к первично множественным опухолям новообразования различной структуры, локализующиеся в разных органах и дающие собственные метастазы.
В первой половине XX века формулировка Бильтота была пересмотрена. В настоящее время первично множественными опухолями считаются неоплазии, которые могут располагаться в одном или в разных органах. Основным условием отнесения заболеваний к этой категории является одновременное или последовательное появление в организме нескольких независимых друг от друга очагов трансформации клеток. Второе и последующие новообразования не должны возникать в результате контактного распространения, лимфогенного или гематогенного метастазирования.
Причины
Непосредственной причиной развития солитарных и первично множественных опухолей являются генетические мутации, обусловленные несколькими факторами. С учетом особенностей этиопатогенеза различают три основных типа неоплазий: возникшие в результате спонтанных соматических мутаций, образовавшиеся вследствие индуцированных соматических мутаций, являющиеся результатом передающихся по наследству генетических мутаций. Следует учитывать, что подобное разделение является достаточно условным. На практике, скорее, можно выделить преобладающую причину развития, которая сочетается с другими, менее значимыми факторами.
При первично множественных опухолях перечисленные мутации могут сочетаться. Возможны любые комбинации, например, первое новообразование развивается спонтанно, второе – в результате индукции; первое является наследственным, второе – индуцированным; оба рака имеют одну и ту же природу (наследственность, воздействие экзогенных факторов) и т. д. При этом у больных первично множественными опухолями отмечается преобладание индуцированных и наследственных мутаций.
В числе наиболее значимых факторов, индуцирующих развитие первично множественных опухолей, рассматривают курение, проживание в неблагоприятных экологических зонах, профессиональные вредности (контакт с химическими мутагенами на некоторых производствах, превышение установленных нагрузок у радиологов), многократные рентгенологические обследования, лучевую терапию и химиотерапию предшествующих онкологических заболеваний. Вероятность возникновения первично множественных опухолей также повышается при нарушениях питания, иммунодефицитных состояниях, гормональных расстройствах и некоторых эндемических заболеваниях.
В список наследственных синдромов, сопровождающихся облигатным развитием или повышенной вероятностью возникновения онкологических поражений, включают более 100 заболеваний. Первично множественные опухоли развиваются или могут развиться при трети таких заболеваний. Наиболее известными синдромами являются МЭН-1, МЭН-2 и МЭН-3, при которых выявляются множественные эндокринные неоплазии. Кроме того, первично множественные опухоли могут диагностироваться при синдроме Линча, синдроме Гарднера, болезни Гиппеля-Линдау, синдроме Пейтца-Егерса и других.
Классификация
Существует несколько классификаций, созданных на разных этапах изучения данной патологии. Современные специалисты обычно используют классификацию Бебякина, разработанную в 1974 году. Согласно этой классификации выделяют следующие типы первично множественных опухолей:
- С учетом сочетаний: все неоплазии имеют доброкачественный характер; выявляются доброкачественные и злокачественные новообразования; все опухоли протекают злокачественно.
- С учетом последовательности обнаружения: синхронные первично множественные опухоли (обнаруженные одновременно или практически одновременно), метахронные (диагностированные с интервалом 6 и более месяцев), метахронно-синхронные и синхронно-метахронные.
- С учетом функциональных взаимосвязей: гормональнозависимые, функциональнозависимые, несистематизированные.
- С учетом происхождения из определенной ткани: первично множественные опухоли одинакового происхождения и разного происхождения.
- С учетом гистологических особенностей: одинаковой гистологической структуры, разной гистологической структуры.
- С учетом локализации: расположенные в одном органе или парных органах; поражающие несколько органов одной системы; локализующихся в органах различных систем.
Диагностика
Основой успешной диагностики первично множественных неоплазий является комплексный подход, разработанный с учетом особенностей возникновения и течения этой группы заболеваний. Одной из наиболее распространенных проблем при обнаружении первично множественных опухолей является отсутствие четкой клинической картины, характерной для каждого новообразования. Проявления неоплазий могут накладываться друг на друга, симптомы одного из поражений могут быть слабо выраженными, маскироваться под неопухолевое заболевание или имитировать признаки отдаленных метастазов.
Хотя бы частично решить эту проблему позволяют продуманные планы первичного и последующих обследований, составленные с учетом возможности развития первично множественных опухолей. Так, при локализации солитарного новообразования в зоне молочной железы специалисты уделяют пристальное внимание состоянию второй молочной железы и внутренних женских половых органов, при расположении неоплазии в области желудка – состоянию толстого кишечника, кожи, яичников, матки и молочных желез и т. д. План обследования в каждом конкретном случае составляется индивидуально. Решающую роль при постановке диагноза обычно играют радиологические методики (рентгенография, КТ), УЗИ, МРТ и гистологические исследования.
Вероятность развития первично множественных опухолей у онкологических больных в 6 раз выше, чем в среднем по популяции. С учетом этого обстоятельства, все пациенты с такими заболеваниями после лечения должны находиться под диспансерным наблюдением и проходить регулярные обследования. Такая мера позволяет выявлять рецидивы первичной неоплазии и диагностировать метахронные первично множественные опухоли. Риск развития второго онкологического поражения увеличивается в возрасте 55-70 лет, что должно учитываться при планировании обследования пациентов.
Лечение первично множественных опухолей
Лечение синхронных неоплазий осуществляется одновременно. В зависимости от локализации новообразований и состояния больного хирургическое вмешательство может проводиться единовременно либо быть поэтапным. При планировании очередности операций при первично множественных опухолях учитывают степень распространенности каждого онкологического процесса. В ряде случаев по поводу одного новообразования может быть проведено радикальное лечение, по поводу другого – симптоматическое или паллиативное.
При выборе консервативных методик ориентируются на чувствительность каждой опухоли к радиотерапии и различным химиопрепаратам. Тактика лечения метахронных первично множественных опухолей соответствует тактике лечения солитарных новообразований аналогичных стадий и локализаций. Прогноз определяется видом, расположением, стадией и степенью злокачественности первично множественных опухолей. Отдаленные результаты лечения метахронных неоплазий примерно совпадают с результатами терапии одиночных образований. При синхронных процессах прогноз ухудшается.
Н. Н. Петров (1947) считал, что для признания первичной множественности злокачественных опухолей нет основания требовать, чтобы они исходили из различных органов, имели различное строение, или давали каждая свои метастазы, и единственным обязательным требованием следует признать, чтобы эти опухоли не были ни метастазами, занесенными по току лимфы или крови или по серозным полостям, ни отпечатками, развившимися от соприкосновения с другими опухолями, например, на соприкасающихся местах двух губ, или щеки и языка, или шейки матки и свода влагалища и т. п.
В некоторых случаях вопрос о действительной первичности тех или иных опухолей остается спорным, и тогда надежнее всего она устанавливается при наличии существенных различий в гистологическом строении отдельных опухолей.
Таким образом, современные критерии, необходимые для установления факта первичной множественности злокачественных опухолей, существенно упрощены по сравнению с требованиями, выдвинутыми в конце прошлого и начале настоящего столетия. Все же, как при анализе отдельных казуистических случаев, так и в особенности при больших статистических обобщениях необходимо проявлять должную строгость при рассмотрении каждого конкретного случая.
В этом отношении заслуживают внимания, например, две работы, обобщающие большие материалы о первично множественных злокачественных опухолях.
Malmio (1959) провел анализ собственного материала, накопленного в период с 1936 по 1956 г., позволивший выявить 666 случаев первично множественных злокачественных опухолей среди 28756 больных злокачественными новообразованиями. При отборе случаев первично множественных злокачественных опухолей автор соблюдал следующие правила. Включались в статистику только те случаи, которые подтверждались детальными данными о всех опухолях. Особенно это требовалось по отношению к больным, у которых первая опухоль была диагностирована в другом лечебном учреждении.
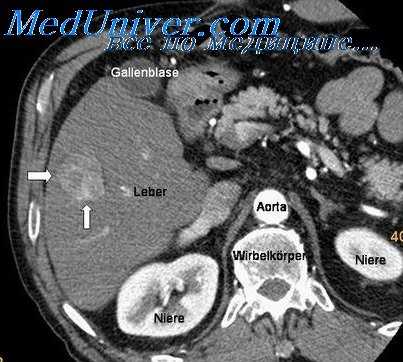
Диагноз первичной множественности в каждом случае устанавливался после тщательного изучения локализации опухолей, клинического течения заболевания, в частности с обращением внимания на наличие интервала, свободного от рецидива или метастазов, и результатов макро- и микроскопического изучения опухолей. Из указанных в литературе критериев автор использовал особенности гистологической картины опухолей, которая при первично множественных раках обычно должна соответствовать гистологической структуре солитарных раков, развивающихся в тех же тканях; обращалось внимание на необходимость исключения метастатической связи друг с другом отдельных узлов опухоли.
Moertel с соавторами (1961) представили подробный статистический анализ всех случаев первично множественных злокачественных опухолей, прошедших через клинику Мейо с 1944 по 1953 г. Для диагностики первично множественных злокачественных опухолей авторы использовали, в основном, критерии Warren и Gates (1932), но при включении в статистику каждого конкретного наблюдения строго придерживались следующих требований.
Патологоанатомическое исследование каждого опухолевого поражения было произведено в клинике. Наличие опухоли в анамнезе считалось обоснованным только в случаях представления специалисту клиники ранее удаленного препарата и его тщательного изучения. При этом придавалось значение только гистологической картине, а цитологический диагноз (по мазкам) не считался доказательным. Диагноз множественных мультицентрических опухолей при одновременном выявлении устанавливался лишь в случаях ясного разграничения их друг от друга нормальной тканью, а при последовательном появлении новая опухоль была отчетливо отделена нормальной тканью от места иссечения начальной опухоли.
В каждом случае тщательно оценивались клинические и оперативные данные, а также результаты аутопсии. Из статистики исключались все случаи, где оба поражения не располагались раздельно, и наблюдения, в которых злокачественность одного или обоих поражений была сомнительной (неясно выраженный рак in situ в аденоматозном полипе, смешанные опухоли слюнных желез). В статистике не учитывались также случаи, когда при повторном анализе нельзя было исключить возможность метастатической связи изучаемых опухолей, а также все множественные кожные раки (для устранения источника необоснованного завышения общей частоты множественного рака, поскольку большая частота множественного поражения кожи общепризнана и достаточно изучена).
Таким образом, хотя критерии для суждения о первичной множественности злокачественных опухолей в настоящее время упрощены, но установление их в практической работе представляет далеко не легкую задачу. Фактически требуется только одно условие — исключить, метастатическую связь опухолей; разрешение этой единственной и, казалось бы, простой задачи встречает большие, иногда непреодолимые трудности. Каждый из предлагаемых для этого признаков, взятый в отдельности, часто не может с полной убедительностью решить эту задачу; в совокупности они нередко приводят к правильным выводам.
Все же следует подчеркнуть, что этот вопрос должен разрабатываться и дальше для установления наиболее достоверных и простых критериев в дифференциальной диагностике первично множественных и метастатических злокачественных опухолей. На современном уровне наших знаний мы считаем необходимым подчеркнуть, что в первую очередь в подобных случаях следует отказаться от исторически установившейся, а ныне неосновательной традиции рассматривать два узла опухоли или более только как метастатически связанные друг с другом; в практической работе необходимо, прежде всего, думать о возможности первичной множественности в подобных случаях.
Тактика лечения больных с первично-множественными злокачественными новообразованиями (обзор клинического наблюдения)
Для цитирования: Поздняков С.В., Атрощенко А.О., Михайлянц Г.С. Тактика лечения больных с первично-множественными злокачественными новообразованиями (обзор клинического наблюдения). РМЖ. 2015;13:785.
Первично-множественные злокачественные новообразования (ПМЗНО) – это состояние, при котором у одного и того же человека выявляется два и более злокачественных новообразования одновременно или через определенный (любой по продолжительности) промежуток времени. ПМЗНО являются группой заболеваний, входящих в более обширную группу первично-множественных опухолей (ПМО), включающих и доброкачественные опухоли [1, 2, 7, 8].
Впервые случай ПМО в литературе был описан Авиценной у женщины с двусторонним поражением опухолями молочных желез. В последующем появлялись единичные описания одномоментного или последовательного возникновения опухолей у пациентов [1, 2].
Понятие первичной множественности опухолей впервые было введено в практику в 1869 г. Бильротом, который и считается основоположником изучения данной проблемы. Он определил 3 основных критерия первичной множественности опухолей:
1) опухоли располагаются в различных органах;
2) имеют различную морфологическую структуру;
3) каждая из опухолей дает собственные метастазы.
В дальнейшем данные положения были пересмотрены, и в 1932 г. S. Warren совместно с O. Gates установили, что единственным и обязательным условием постановки диагноза ПМО является доказанная первичность каждой из опухолей, т. е. они не должны являться метастатическими (лимфогенными, гематогенными или имплантационными метастазами).
В России вопросами ПМО занимались А.А. Серебряков (пионер в области изучения данной проблематики), Г.Г. Непряхин, Н.Н. Петров [2, 7].
В 1968 г. появилась одна из первых классификаций ПМО, предложенная С.М. Слипчаком (табл. 1).
Позднее был выявлен недостаток классификации С.М. Слипчака – отсутствие групп синхронно-метахронных и метахронно-синхронных опухолей. В 1974 г. вышла новая, дополненная классификация, предложенная В.Г. Бебякиным (табл. 2). Особенностью этой классификации является то, что в ней отражаются сочетания злокачественных, злокачественных и доброкачественных, множественных злокачественных и доброкачественных опухолей.
На сегодняшний день накоплен большой опыт в изучении ПМО, в их структуре выделена группа ПМЗНО, предложена их классификация Г.Г. Непряхиным (табл. 3).
Отмечено, что в последнее время частота встречаемости ПМЗНО возросла примерно в 9 раз [10, 11]. Причиной многих случаев ПМЗНО являются аберрации в определенных генах или группах генов (синдром Ли – Фраумени, для которого характерен целый спектр новообразований: остеосаркома, саркомы мягких тканей, опухоли мозга, лейкозы, рак молочной железы и др.; наследственный рак молочной железы и яичников; наследственный неполипозный рак толстой кишки (HNPCC, Hereditary nonpolyposis colorectal cancer) – синдром Линча; семейный аденоматоз толстой кишки (FAP, Familial adenomatosis coli)) [3–6, 8, 9]. В других случаях выяснить причину множественности опухолей не всегда представляется возможным.
Ниже представлено клиническое наблюдение первично-множественных метахронно-синхронных опухолей.
Больная Г., 68 лет. Поступила в гастроэнтерологическое отделение № 4 (ГЭО-4) ГБУЗ «Московский клинический научный центр» Департамента здравоохранения г. Москвы (МКНЦ) с жалобами на периодически возникающие боли в нижних отделах живота, правом подреберье умеренной интенсивности. Данные симптомы сопровождаются появлением небольшого количества примеси крови в кале. Пациентка также отмечала похудение на 15 кг за 5 мес. при сохраненном аппетите и периодически возникающие кровянистые выделения из влагалища в течение 3 мес.
Из анамнеза было установлено, что больная более 15 лет страдает запорами. Стул регулировала самостоятельно приемом слабительных средств. В 2011 г. проходила курс лечения антибактериальными препаратами по поводу хронического пиелонефрита, после чего запоры усилились, появились боли в животе. За помощью не обращалась, не обследовалась. В августе 2013 г. отметила появление примеси крови в кале. Однако за помощью в лечебные учреждения вновь не обратилась. В декабре 2013 г. появились выраженные боли в эпигастрии. Обратилась к врачу в поликлинику по месту жительства. 30.12.2013 г. выполнена гастроскопия, при которой выявлены недостаточность кардии, эрозивный гастрит, бульбит, формирующийся полип антрального отдела желудка. Проведен курс лечения, включающий антисекреторные препараты, препараты солей висмута. Контрольного эндоскопического исследования не проводилось. В феврале 2014 г. пациентка обратилась в поликлинику по месту жительства с жалобами на вздутие живота, запоры, боли в животе, наличие небольшой примеси крови в кале. Рекомендованы колоноскопия, ирригоскопия. 05.02.2014 г. сделана попытка проведения колоноскопии. При этом аппарат введен до средней трети сигмовидной кишки, далее ввиду выраженного болевого синдрома аппарат провести не удалось. На осмотренных участках толстой кишки органических изменений выявлено не было. 14.02.2014 г. сделана попытка проведения ирригоскопии. Однако ввиду того, что пациентка не удерживает бариевую клизму, осмотреть удалось только прямую кишку и начальные отделы сигмовидной кишки – изменений также не выявлено. В дальнейшем пациентка принимала ферментативные препараты (панкреатин). В апреле – мае 2014 г. вновь появились боли в животе, вздутие живота, кровь в кале. Обратилась в клинико-диагностическое отделение (КДО) МКНЦ. 06.05.2014 г. госпитализирована в ГЭО № 4 МКНЦ для обследования и определения тактики лечения.
Анамнез. Родилась в г. Москве, от сверстников в развитии не отставала. В 16 лет перенесла аппендэктомию по поводу острого флегмонозного аппендицита. В 2010 г. больной диагностирован базально-клеточный рак (базалиома) кожи лица, выполнено удаление опухоли. Длительное время страдает бронхиальной астмой (БА), наблюдается у кардиолога по поводу ишемической болезни сердца (ИБС), стенокардии напряжения и гипертонической болезни (ГБ), у эндокринолога по поводу сахарного диабета (СД) 2-го типа. Также у больной глаукома левого глаза, хронический пиелонефрит в течение 7 лет, хронический рецидивирующий цистит, полип тела матки (диагноз установлен в 2013 г.), остеохондроз поясничного отдела позвоночника, двухсторонний гонартроз I степени. Не курит, алкоголь и наркотические средства не употребляет. У близких родственников онкологических заболеваний официально не выявлялось. Менопауза в течение 17 лет.
Объективный статус. Больная в сознании, адекватна, в пространстве и времени ориентирована, критика не нарушена. Рост – 159 см, вес – 81 кг. Кожные покровы чистые. Имеется белесый рубец на коже щеки слева после удаления базалиомы в 2010 г. (рис. 1). Грудная клетка цилиндрической формы; перкуторно – умеренный коробочный звук. Аускультативно – везикулярное дыхание, несколько жесткое. Границы легких – в пределах нормы. Область сердца не изменена, границы сердца расширены влево на 1 см, АД – 130/80 мм рт. ст., пульс – до 80 уд./мин. Область почек не изменена, почки не пальпируются. Мочеиспускание не нарушено. Живот не вздут, мягкий. При пальпации болезненный незначительно в левой половине. Перитонеальных симптомов нет. Печень не пальпируется, объемные образования через переднюю брюшную стенку не определяются. Периферические лимфатические узлы не увеличены.
Данные клинического обследования пациентки. При колоноскопии в верхней трети сигмовидной кишки выявлена циркулярная бугристая опухоль, суживающая просвет кишки, кровоточащая при контакте (рис. 2), взята биопсия; в остальных отделах толстой кишки – без патологии.
При эзофагогастродуоденоскопии выявлены хронический гастрит с наличием эрозий в теле желудка, эрозивный бульбит, недостаточность кардии; в антральном отделе желудка определяются 2 полипа 0,2 и 0,5 см в диаметре соответственно (взята биопсия). Гистологическое исследование № 14610-11/14: слизистая оболочка желудка с картиной хронического выраженного неактивного гастрита. HP+.
Выполнено УЗИ органов брюшной полости, при котором диагностированы умеренная гепатомегалия, диффузные изменения печени, поджелудочной железы (хронический панкреатит).
По данным УЗИ органов малого таза установлено, что тело матки с ровным контуром, миометрий симметричной толщины, средней эхогенности с наличием очаговой неоднородности; по задней стенке интерстициально и субсерозно лоцируется узел 10х9 мм, по задней стенке интерстициально – аналогичные узлы 8х5 и 8,6х6 мм. По передней стенке ближе к перешейку гипоэхогенный узел 7,4х5 мм (рис. 3); шейка матки неоднородной плотности, в ее стенке определяются кисты до 3 мм в диаметре; эндометрий неоднородный, толщиной до 18 мм; полость матки расширена за счет жидкостного скопления и объемного образования размерами 27х19х25 мм, исходящего из эндометрия (рис. 4).
Выполнена мультиспиральная компьютерная томография (КТ) органов грудной клетки, брюшной полости и малого таза. Данных о метастатическом поражении легких не получено, выявлен диффузный пневмосклероз, признаки хронической обструктивной болезни легких (ХОБЛ), данных о наличии метастазов в печени не получено, имеются признаки жирового гепатоза печени, в проекции входа в малый таз в сигмовидной кишке определяется утолщение ее стенки до 19 мм на протяжении до 40 мм (рис. 5). В теле матки определяются обызвествленные округлые миоматозные узлы; забрюшинные лимфатические узлы и узлы малого таза не увеличены.
Исследование функции внешнего дыхания не выявило изменений в спирограмме.
По данным эхокардиографии выявлена умеренная гипертрофия миокарда левого желудочка (ЛЖ); полость правого желудочка на верхней границе нормы, отмечены признаки изменений стенок аорты, митрального и аортального клапанных колец возрастного характера; митральная регургитация I степени, признаки диастолической дисфункции ЛЖ по первому типу; нарушения локальной сократимости миокарда не выявлено; фракция выброса ЛЖ – достаточная (58,9%); перикард – без особенностей.
Больной выполнена ирригоскопия, при которой в проекции верхней трети сигмовидной кишки выявлено стойкое циркулярное сужение просвета до 1 см протяженностью около 3,5 см, в остальных отделах толстой кишки патологических изменений не выявлено.
Рентгенологическое исследование органов грудной клетки выявило картину пневмосклероза, отмечено расширение тени ЛЖ сердца, атеросклероз аорты.
Постановка диагноза и лечение. 15.05.2014 г. проведен консилиум в составе онколога, гинеколога, колопроктолога, анестезиолога-реаниматолога, гастроэнтеролога. Заключение: с учетом наличия у пациентки кровоточащего крупного полипа эндометрия, циркулярной опухоли сигмовидной кишки рекомендовано на первом этапе выполнить диагностическое выскабливание матки и резекцию полипа эндометрия. После получения заключения гистологических исследований (биоптатов из опухоли сигмовидной кишки и удаленного полипа эндометрия) решить вопрос о дальнейшей тактике лечения.
19.05.2014 г. больной выполнены диагностическое выскабливание матки и резекция полипа эндометрия.
Гистологическое исследование № 14612-17/14 (биопсия из опухоли сигмовидной кишки): аденокарцинома толстой кишки.
Гистологическое исследование № 17069-84/14 (полип миометрия): в соскобе фрагменты солидной злокачественной опухоли: недифференцированный рак.
На основании данных обследования, анамнеза, данных патоморфологического исследования установлен клинический диагноз.
Основное заболевание: ПМЗНО: рак сигмовидной кишки сT3N0M0 II стадия; синхронный рак тела матки с TхN0M0; метахронный базально-клеточный рак кожи лица. Состояние после хирургического лечения по поводу базально-клеточного рака кожи лица в 2010 г.
Сопутствующие заболевания: множественная миома матки. ИБС: стенокардия напряжения II функционального класса (ФК). Атеросклеротический кардиосклероз. ГБ III степени, II стадии, риск сердечно-сосудистых осложнений (ССО) – 4. СД 2-го типа, инсулинопотребный, средней степени тяжести, субкомпенсированный. БА смешанного генеза (аллергическая и инфекционно-зависимая), хроническое рецидивирующее течение, ремиссия. Диффузный пневмосклероз. ХОБЛ. Хронический пиелонефрит, ремиссия. Хронический, рецидивирующий цистит, ремиссия. Глаукома левого глаза II–III, начальная катаракта левого глаза, ангиосклероз сетчатки левого глаза. Остеохондроз поясничного отдела позвоночника. Двухсторонний гонартроз I степени.
С учетом данных полученного гистологического исследования было решено выполнить одномоментно резекцию сигмовидной кишки и экстирпацию матки с придатками.
30.05.2014 г. под комбинированным обезболиванием больной выполнена нижне- и среднесрединная лапаротомия. При ревизии в брюшной полости и малом тазу выявлен выраженный спаечный процесс. Спайки разделены острым путем. При дальнейшей ревизии в печени метастазов не выявлено, забрюшинные лимфатические узлы не увеличены, асцита нет. Сигмовидная кишка удлинена – долихосигма. В сигмовидной кишке в проекции ее средней трети определяется опухоль до 4 см протяженностью, циркулярно стенозирующая просвет кишки. Отделы толстой кишки выше опухоли до левого изгиба ободочной кишки раздуты до 6 см в диаметре, заполнены газом и плотным калом, стенка гипертрофирована, отечна. Ниже опухоли – сигмовидная кишка спавшаяся. Матка обычных размеров и формы с субсерозными узлами до 1,5 см в диаметре. Правый яичник – 2,5х2,0х1,5 см, не изменен, правая маточная труба длиной около 5 см, деформирована. Левый яичник – 2,5х2,0х1,5 см, не изменен, левая маточная труба длиной около 5 см. Передне- и позадиматочное пространство без патологии. Первым этапом операции выполнена экстирпация матки с придатками. Вторым этапом выполнена резекция сигмовидной кишки с опухолью. С учетом картины субкомпенсированной кишечной непроходимости решено сформировать концевую сигмостому в левой подвздошной области (рис. 6, 7).
Общая длительность оперативного вмешательства составила 210 мин. Общая кровопотеря – 150 мл.
В раннем послеоперационном периоде больной проводилось лечение в отделении реанимации и интенсивной терапии. На 2 сут после операции переведена в общую палату колопроктологического отделения. В день перевода больная была активирована. Еще в реанимационном отделении на 1 сут после операции больной было разрешено пить негазированную воду до 500 мл/сут. Пищу больная начала принимать на 2 сут после оперативного лечения. Отделяемое по сигмостоме появилось на 4 сут после операции.
В целом послеоперационный период протекал гладко. Рана зажила первичным натяжением. Швы сняты на 10 сут после операции.
Гистологическое исследование послеоперационного материала: в матке выявлена низкодифференцированная эндометриальная аденокарцинома, прорастающая более чем на половину толщины миометрия и устье левой маточной трубы; в клетчатке брыжеечной артерии лимфоидной ткани не обнаружено; в сигмовидной кишке выявлено разрастание умеренно дифференцированной аденокарциномы кишечного типа, прорастающей все слои стенки кишки и врастающей в брыжейку; в 12 исследованных лимфатических узлах опухолевого роста выявлено не было; края резекции – без опухолевого роста.
Таким образом, на основании данных патоморфологического заключения операционного материала выставлен окончательный клинический диагноз.
Основное заболевание: ПМЗНО: рак сигмовидной кишки рT3N0M0 II стадия; синхронный рак тела матки рT1сN0M0 IC стадия; метахронный базально-клеточный рак кожи лица. Состояние после хирургического лечения по поводу базально-клеточного рака кожи лица в 2010 г.
Осложнения основного заболевания: субкомпенсированная кишечная непроходимость.
Сопутствующие заболевания: миомы матки. ИБС: стенокардия напряжения ФК II. Атеросклеротический кардиосклероз. ГБ III степени, II стадии, риск ССО 4. СД 2-го типа, инсулинопотребный, средней степени тяжести, субкомпенсированный. БА смешанного генеза (аллергическая и инфекционно-зависимая), хроническое рецидивирующее течение, ремиссия. Диффузный пневмосклероз. ХОБЛ. Хронический пиелонефрит, ремиссия. Хронический, рецидивирующий цистит, ремиссия. Глаукома левого глаза II–III, начальная катаракта левого глаза, ангиосклероз сетчатки левого глаза. Остеохондроз поясничного отдела позвоночника. Двухсторонний гонартроз I степени.
Больная выписана из стационара на 11 сут после оперативного лечения в удовлетворительном состоянии.
В настоящий момент больная получает курс химиотерапии по схеме XELOX и гормонотерапию прогестинами.
Выводы
1. При наблюдении за пациентами с различными заболеваниями (тем более с ранее выявленными злокачественными опухолями) следует помнить о возможном возникновении 2-х и более злокачественных опухолей у одного и того же больного, причем как синхронно (одновременно), так и метахронно (с интервалом 6 мес. и более), и при возникновении жалоб, которые могут указывать на развитие опухолевого процесса, проводить им комплексное обследование.
2. Успешность лечения больных с ПМЗНО достигается выбором адекватной состоянию больного комплексной терапии, включающей в т. ч. специальные методы лечения.
3. Очень важным остается вопрос этапного наблюдения в группе лиц с уже установленными опухолями и получившими лечение по поводу них.
- Ганцев Ш.Х. Руководство к практическим занятиям по онкологии. М.: МИА, 2007. 416 с.
- Давыдов М.И., Ганцев Ш.Х. Онкология: Учебник для студентов медицинских вузов. М.: ГЭОТАР-Медиа, 2010. 920 с.
- Цуканов А.С. и др. Дифференциальный диагноз синдрома Линча от других форм неполипозного колоректального рака среди российских пациентов // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2014. Т. 24. № 2. С. 78–84.
- Имянитов Е.Н. Наследственный рак молочной железы // Практическая онкология. 2010. Т. 11. № 4. С. 258–266.
- Казубская Т.П. и др. Клинико-генетический анализ первично-множественных злокачественных новообразований // Российский онкологический журнал. 2007. № 2. С. 4–9.
- Цуканов А.С. и др. Наследственные раки желудочно-кишечного тракта // Практическая онкология. 2014. Т. 15. № 3. С. 126–133.
- Важенин А.В. и др. Очерки первичной множественности злокачественных опухолей. Челябинск, 2000. 170 с.
- Попова Т.Н., Федоров В.Э., Харитонов Б.С. Первично-множественные синхронные злокачественные новообразования пищеварительной системы // Медицинский альманах. 2011. № 5. С. 76–79.
- Логинов В.И. и др. Роль метилирования генов-супрессоров в ранней диагностике первично-множественного и солитарного рака молочной железы и яичников / // Русский медицинский журнал. Онкология. 2012. № 3 (1). С. 20–24.
- Статистика злокачественных новообразований в России и странах СНГ в 2010 г. / под ред. М.И. Давыдова, Е.М. Аксель. М., 2012. 307 с.
- Чиссов В.И., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2010 г. (заболеваемость и смертность). М., 2012. 260 с.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:
- Жалобы при инфекционных поражениях глаз
- Случай эмфизематозного пиелонефрита у пациентки с сахарным диабетом, потребовавший нефрэктомии
- Рентгенограмма, КТ при щечной бифуркационной кисте
- Профилактика атеросклероза. Первичная и вторичная профилактика атеросклероза.
- Диагностика ВИЧ-инфекции. Лечение ВИЧ инфекции
