Пуриновые антиметаболиты. Ингибиторы адениндезаминазы
Добавил пользователь Alex Обновлено: 27.01.2026
Проверка совместимости медикаментов при их совместном приёме производится на основании классификации медикаментов, их действующих веществ и осуществляется исходя из предупреждений и лекарственных взаимодействий, отраженных в инструкции по применению лекарственного средства.
Состав
Вспомогательные вещества: натрия хлорид 4,5 мг, 0,1 М раствор кислоты хлористоводородной или 0,1 М раствор натрия гидроксида для доведения значения pH до уровня 5,5-6,5 (среднее значение pH - 6,0), вода для инъекций до объема 1,0 мл.
Взаимодействие с другими медикаментами
Фармакодинамика
Неларабин является пролекарством 9-β-D-арабинофуранозилгуанина (ара-Г), аналога дезоксигуанозина. Под действием аденозиндезаминазы неларабинбыстро трансформируется в ара-Г, и затем, в результате фосфорилирования, образуется его 5-монофосфат и далее - ара- гуанозинтрифосфат (ара-ГТФ). В результате накопления ара-ГТФ в бластных клетках при лейкозе он конкурентно встраивается в цепь ДНК, что вызывает подавление синтеза ДНК и, следовательно, гибель клетки, In vitro было показано, что Т-клетки более чувствительны к цитотоксическим эффектам неларабина по сравнению с В-клетками.
Фармакокинетика
Максимальная концентрация (Сmах) ара-Г в плазме крови достигается по окончанию инфузии неларабина и в среднем выше, чем Сmах неларабина, что предполагает быструю и интенсивную трансформацию пролекарства в лекарство. После двухчасовой инфузии неларабина в дозе 1500 мг/м 2 взрослым больным средние значения Сmах неларабина и ара-Г составляли 13,9 мкмоль и 115 мкмоль, соответственно. Средние значения площадей под кривой "концентрация-время" (AUC) неларабина и ара-Г составляли 13,5 мкмоль/ч и 571 мкмоль/ч, соответственно, после инфузии 1500 мг/м 2 . Внутриклеточная Стах для ара-ГТФ достигается через 3-25 часов на первые сутки курсового лечения. Средние внутриклеточные значения Стах и AUC ара-ГТФ составляли 95,6 мкмоль и 2214 мкмоль/ч для указанной дозы.
Неларабин и ара-Г характеризуются большим объемом распределения. Объем распределения в равновесном состоянии (Vss) у взрослых и детей составлял, соответственно, 115 л/м 2 и 89,4 л/м 2 . Кажущийся объем распределения ара-Г (Vss/F) составляет 44,8 л/м 2 и 32,1 л/м 2 у взрослых и детей, соответственно.
Связывание неларабина и ара-Г с белками плазмы крови незначительно и составляет менее 25%, для обоих компонентов оно не зависит от концентрации в диапазоне до 600 мкмоль.
Внутриклеточные концентрации ара-ГТФ в лимфобластах определялись в течение продолжительного периода после инфузии неларабина. Отмечена кумуляция ара-ГТФ внутри клеток при повторных инфузиях неларабина по схеме "1, 3, 5" с увеличением значений Сmах и AUC(O-t) на третий день лечения на 50% и 30%, соответственно, по сравнению с аналогичными показателями для первого дня курса.
Основным путем биотрансформации неларабина является О-деметилирование аденозиндезаминазой с образованием ара-Г, далее метаболизирующегося до гуанина. Кроме того, неларабин частично гидролизуется до метилгуанина, который затем подвергается О- деметилированию с образованием гуанина. На следующем этапе происходит N- дезаминирование гуанина с образованием ксантина и его окислением до мочевой кислоты.
Неларабин и ара-Г быстро выводятся из плазмы крови, период полувыведения составляет, соответственно, 30 минут и 3 часа после инфузии в дозе 1500 мг/м 2 . Средний клиренс неларабина при введении в дозах от 104 до 2900 мг/ м 2 у взрослых и детей составлял, соответственно, 138 л/ч/м и 125 л/ч/м в день 1. Кажущийся клиренс ара-Г сравним в обеих возрастных группах и составляет 9,5 л/ч/м 2 у взрослых и 10,8 л/ч/м 2 у детей в день 1.
Неларабин и ара-Г выводятся частично почками. Среднее количество, выводимое почками, составляет для неларабина и ара-Г, соответственно, 5,3% и 23,2% от введенной дозы в течение 24 ч после инфузии неларабина в день 1. Почечный клиренс составляет в среднем 16,4 л/ч для неларабина и 4,9 л/ч для ара-Г.
В клинические исследования включались пациенты с клиренсом креатинина выше 80 мл/мин, с нарушением. функции почек слабой (клиренс креатинина 50-80 мл/мин) и умеренной (клиренс креатинина менее 50 мл/мин) степеней. Средний кажущийся клиренс ара-Г на 7% ниже у пациентов с умеренными нарушениями функции почек. Различий в эффективности и безопасности препарата не отмечено.
Неларабин показал клиническую эффективность в рекомендованной "взрослой" и "детской" дозе у пациентов в двух независимых клинических исследованиях - CALGB 19801 и COG Р9673. У взрослых с острым Т-клеточным лимфобластным лейкозом или Т-лимфомой после двух и более курсов индукции монотерапия неларабином привела к полной ремиссии (ПР) в 18% случаев (ДИ 95%: 6%-37%) при продолжительности полной ремиссии от 15 до 195+ недель; выживаемость через- I год составила 29%, что подтверждает клиническую эффективность препарата в этой группе пациентов, которым ранее проводилось интенсивное лечение. Близкие показатели были получены у детей и пациентов не старше 21 года с рецидивирующим или рефрактерным острым Т-клеточным лимфобластным лейкозом или Т- лимфомой после двух и более курсов индукции (группа 02): монотерапия неларабином вызывала полную ремиссию в 13% случаев (ДИ 95%: 4%-27%) при продолжительности ПР от 4,7 до 36,4 недель; выживаемость через 1 год составила 14%.
У некоторых пациентов после двух и более курсов неэффективной индукции, в период достигнутой на фоне ионотерапии неларабином полной ремиссии была произведена трансплантация стволовых клеток крови. На момент трансплантации продолжительность полной ремиссии составляла 1,6 - 9,3 недели у детей и 6,3 - 195,4+ недель у. взрослых. В исследовании PGAA2001 данные о восстановлении гематологических показателей были получены у 21 из 27 пациентов, которым после терапии неларабином выполнялась трансплантация гемопоэтических стволовых клеток. Из них у 20 пациентов (95%) было подтверждено восстановление уровня нейтрофилов. В исследовании PGAA2002 данные о восстановлении гематологических показателей получены у 6 из 7 пациентов, которым после терапии неларабином выполнялась трансплантация гемопоэтических стволовых клеток. У 3 из них (50%) отмечено восстановление уровня нейтрофилов.
Интересно, что у рефрактерных пациентов, после неэффективного курса индукции, терапия неларабином обеспечила впечатляющую частоту полной ремиссии - 18% у взрослых и детей после двух и более предшествовавших курсов индукции и 44% у детей после одного предшествовавшего курса индукции. Помимо пациентов, достигших полной ремиссии, у одного взрослого пациента и у трех детей с рефрактерным течением заболевания была достигнута полная ремиссия при необязательной нормализации гематологических параметров.
Материалы конгрессов и конференций
Принцип использования в химиотерапии злокачественных новообразований препаратов с антиметаболитным действием, как видно на примерах широкого применения антагонистов фолатов (метотрексата), пиримидинов (5-фторурацила, фторафура, фтордезоксиуридина, азацитидина, цитозинарабинозида), пуринов (6-меркаптопурина, 6-тиогуанина) и препарата из группы ингибиторов рибонуклеотид редуктазы - гидроксимочевины, не только оправдал себя на практике, но и послужил на протяжении последних лет источником для поисков новых эффективных противоопухолевых средств. Подобные поиски, базировавшиеся на общих для подавляющего большинства антиметаболитов механизмах - угнетении синтеза ДНК опухоли путем прямой инкорпорации подобных веществ (или продуктов их метаболизма как, в частности, у фторафура) в последнюю, либо в результате ингибирования ферментов, ответственных за репликацию и восстановление ДНК с преимущественным воздействием на S-фазу клеточного цикла - привели к существенному увеличению числа антиметаболитов с отличиями в спектре противоопухолевого действия и побочных эффектов.
В числе первых из новых антиметаболитов в группе антифолатов могут быть названы триметрексат и эдатрексат. Триметрексат обнаружил определенную активность при мезотелиоме, колоректальном раке и раке мочевого пузыря. Отличия триметрексата от метотрексата, очевидно, заключаются не только в показаниях к применению, но и механизмах, цитостатического действия. При том, что триметрексат подобно метотрексату способен подавлять активность дигидрофолатредуктазы, воздействие препарата на опухоль связано, в первую очередь, не с транзитом фолатов, а с пассивной диффузией через клеточные мембраны без образования полиглютаматов. Эти две особенности обуславливают отсутствие перекрестной резистентности между упомянутыми двумя препаратами. Эдатрексат, как и метотрексат, подавляет дигидрофолатредуктазу, но обладает большей способностью проникать в опухолевые клетки и воздействием на ключевой для цитостатического эффекта процесс полиглютамилизации. Клиническое изучение эдатрексата по I и П фазам, начатое около 10 лет назад, выявило противоопухолевую активность препарата при немелкоклеточном раке легкого (32% общего ответа), плоскоклеточных раках головы и шеи (общий ответ - 27%) и неходжкинских лимфомах, но до сих пор еще не определило его места в клинической химиотерапии и преимуществ по отношению к хорошо известным цитостатикам.
Более значимыми в практическом аспекте оказались разработки в области пуриновых антагонистов в результате чего были предложены для клинического применения пентостатин (dCF, нипент) и кладрибин (хлордезоксиаденозин, 2-СDА, леустатин). Пентостатин, необратимо подавляющий фермент аденозиндеаминазу и, соответственно, влияющий на процессы фосфорилирования, оказался весьма эффективным при лимфопролиферативных заболеваниях - хроническом лимфолейкозе, Т и В -клеточном пролимфоцитарном лейкозе, синдроме Сезари и, в особенности, волосатоклеточном лейкозе, в т.ч. в случаях, резистентных к терапии интерфероном.
Еще более выраженный терапевтический эффект (до 80% полных ремиссий после одного курса монохимиотерапии), включая случаи безуспешного применения пентостатина, обнаружен у кладрибина, проявившего активность также при остром миелолейкозе у взрослых и детей, макроглобулинемии Вальденстрема, индолентных формах неходжкинских лимфом (Т-клеточных кожных лимфомах).
Подтвержденная многолетним опытом эффективность цитозинарабинозида при острых лейкозах, бластных кризах хронического миелолейкоза и, в комбинированной химиотерапии - при некоторых вариантах неходжкинских лимфом - стимулировало поиск других нуклеотидных аналогов пиримидиновых антиметаболитов и, прежде всего, антагонистов цитидина с улучшенными свойствами и возможными отличиями по спектру противоопухолевого действия. Основанием для подобных изысканий послужил установленный факт быстрой дезактивации цитозинарабинозида в организме ферментом аденозиндезаминазой, ограничивающей цитостатический эффект препарата. В результате был получен новый препарат -флударабина фосфат (флудара), устойчивый к действию аденозиндезаминазы и быстро превращающийся под влиянием дезоксицитидинкиназы в активный метаболит, ингибирующий синтез ДНК и селективно, трансмембранным путем, внедряющийся в лимфоциты. Клиническое изучение по I/II фазам, применение в практике подтвердили особую "лимфотропность" флударабина, его эффективность в лечении хронического лимфолейкоза, в т.ч. у больных с изначально рефрактерными к лечению алкилирующими агентами и антрациклинами формами или приобретенной устойчивостью к стандартным режимам химиотерапии. Данные, накопленные на первом этапе преимущественно в М.Д.Андерсон раковом центре (США), показали, что частота полного ответа на флударабин первичных больных с хроническим лимфолейкозом доходит до 69% и существенно не отличается от достигаемой у ранее безуспешно леченных "классическими" методами (57%) при необычно высоком для указанной патологии проценте полных ремиссий. Близкие показатели получены при первом отечественном опыте использования флударабина и, кроме того, у больных неходжкинскими лимфомами низкой и промежуточной степени злокачественности Ш-IV стадии, рефрактерных к обычным методам химиотерапии. Представляет интерес, что наилучшие результаты лечения у больных неходжкинскими лимфомами отмечены в случаях применения флударабина в комбинации с лейкераном, циклофосфаном, доксорубицином, митоксантроном, цисплатином и даже с наиболее близким к нему цитозинарабинозидом за счет наблюдаемого на основе биохимической модуляции терапевтического синергизма. Имеются сведения об эффективности монохимиотерапии флударабином при макроглобулинемии Вальденстрема и грибовидном микозе.
К новым пиримидиновым антиметаболитам следует отнести лишь совсем недавно вошедшие в клиническую практику гемцитабин или 2' - 2' фтордезоксицитидин (гемзар), активность которого связана с метаболизмом в опухоли до 5' - трифосфат нуклеотида, и капецитабин (N4 - пентилоксил карбонил - 5' - дезокси - 5-фторцитидин) или кселода. Противоопухолевый эффект капецитабина зависит от превращения после его приема внутрь в результате последовательного действия трех ферментов (на последнем этапе - тимидин фосфорилазы, содержащейся в опухоли) в 5-фторурацил.
Фторпиримидиновый антиметаболит гемцитабин может рассматриваться, по-видимому, как единственный из существующих в настоящее время цитостатиков, способных вызвать достоверный объективный ответ (до 11%) при местнораспространенной и метастатической аденокарциноме поджелудочной железы. Монохимиотерапия гемцитабином дает до 27% объективного ответа у ранее не леченных больных мелкоклеточным раком легкого и до 20% - при немелкоклеточном раке той же локализации. Определенная активность гемцитабина отмечается при раке мочевого пузыря, головы и шеи (13%) и эпителиальных опухолях яичника, резистентных к цисплатину.
В отличие от гемцитабина, применяемого в практике в течение последних 1-2 лет, капецитабин пока еще является объектом клинического изучения, проводимого на уровне П фазы достаточно широко в группах больных диссеминированным раком молочной железы в качестве химиотерапии "первой линии" в сравнении с программой СМF, а также в фазе прогрессирования опухолевого процесса после применения таксола (паклитаксела) и антрациклинов. В первом случае установлено, что монохимиотерапия капецитабином у женщин в возрасте от 55 лет и старше настолько же эффективна, как и комбинация СМF (25% против 1б%). Во второй из упомянутых групп больных с исчерпанными возможностями применения таксола капецитабин в обычном режиме индуцировал объективный эффект в 20% случаев (в т.ч. в 2% - полную ремиссию). Применение препарата в интермиттирующем режиме у больных с прогрессированием процесса после химиотерапии антрациклинами привело к 36% общего ответа на лечение (в 14% - полным ремиссиям).
В рамках проблемы новых антиметаболитов внимание заслуживает идея биохимической модуляции действия фторпиримидинов с целью повышения их эффективности при помощи соединений, самих по себе не обладающих противоопухолевым действием. Эта идея, как известно, впервые была реализована в нашедших весьма широкое распространение комбинациях 5-фторурацила (5-ФУ) и лейковорина (фолината кальция), преимущественно при колоректальном раке. Использование указанной комбинации в различных режимах (в частности, в т.н. режиме клиники Мейо и по Машоверу) действительно привело к возможности повысить объективный ответ на химиотерапию в среднем с 11% при лечении одним 5-ФУ до 23% в случае сочетания. В дальнейшем принцип замедления метаболизма (пролонгации действия) 5-фторурацила через подавление участвующих в нем ферментов нашел применение в комбинации его с "нейтральным" РАLА (N-фосфонацетил - L- аспартатом), блокирующим биосинтез пиримидинов через подавление аспартаткарбомоил трансферазы. Практические результаты использования комбинации 5-ФУ+РАLА и даже РАLА+5-ФУ+лейковорин оказались скорее разочаровывающими при колоректальном раке и привлекают внимание лишь определенным эффектом при раке поджелудочной железы (14% общего ответа).
Более впечатляющими являются результаты лечения препаратом UFТ, представляющим собой комбинацию фторафура (тегафура) и урацила, в соотношении 1:2,24, рассчитанную на замедление последним "натуральным" метаболитом превращений фторафура в 5-ФУ с поддержанием его более высокого уровня в тканях. Наиболее высокие из показателей объективного ответа на UFТ при колоректальном раке составляют 42% . Есть основания полагать, на основании клинических материалов, что сочетание с лейковорином способно повысить эффективность UFТ. Установление роли тимидилат синтетазы в метаболизме, механизмах противоопухолевого действия и биохимической модуляции эффекта 5-ФУ привело к разработке и интенсивному клиническому изучению прямого и специфического ингибитора этого фермента - препарата из группы аналогов тетрагидрофолатного кофактора томудекса. Сравнение частоты объективного ответа на томудекс и ставшую своеобразным стандартом комбинацию 5-ФУ и лейковорина при колоректальном раке показало, что новый ингибитор тимидилат синтетазы в этом отношении, по меньшей мере, не уступает этому сочетанию (25-29%) и, вместе с тем, проявляет активность при распространенном раке молочной железы (25% общего ответа), поджелудочной железы (5-14%), резистентном к цисплатину раке яичников (10%) и немелкоклеточном раке легкого (б,5-10%). Томудекс не требует модуляции, как 5-ФУ, с другими агентами, может применяться последовательно после него из расчета на дальнейшее повышение эффективности лечения, рассматриваться, по-видимому, в качестве одного из средств химиотерапии колоректального рака "первой линии" и является примером перспективности изысканий в области специфических ингибиторов тимидилат синтетазы.
Среди новых антиметаболитов, клиническая перспектива которых еще далеко не ясна, изучению подвергаются ингибиторы L-глютаминоамидотрансферазы (ацивин), дигидроурацил дегидрогеназы (5 -бензилоксибензилурацил), дигидропиримидин дегидрогеназы (5-этинилурацил), ДНК - полимеразы (DМDС), фермента, участвующего в метаболизме фолиевой кислоты - глицинамид рибонуклеотид формилтрансферазы (лометрексол), а также соединения с другим механизмом действия, метаболизирующие до 5-ФУ, как например, доксифлуридин. Из перечисленных экспериментальных препаратов - антиметаболитов, возможно, наиболее достойным внимания в клиническом аспекте представляется доксифлуридин, дающий в комбинации с цисплатином необычно высокий процент регрессий опухоли при распространенном раке желудка.
Так или иначе, исследования и практика клинического применения новых антиметаболитов показывает, что это направление является одной из самых интенсивно развивающихся и перспективных областей химиотерапии опухолевых заболеваний в целом.
КЛОФАРАБИН (CLOFARABINE) ОПИСАНИЕ
Противоопухолевое средство, антиметаболит из группы антагонистов пурина.
Действие клофарабина обусловлено 3 механизмами:
- ингибирование ДНК-полимеразы α, приводящее к прекращению удлинения цепи ДНК и/или синтеза/репарации ДНК;
- ингибирование рибонуклеотидредуктазы с истощением клеточного запаса дезоксинуклеотидтрифосфата (дНТФ);
- нарушение целостности митохондриальной мембраны с высвобождением цитохрома С и других факторов апоптоза, что приводит к запрограммированной гибели клеток и даже лимфоцитов вне фазы деления.
Клофарабин сначала диффундирует или транспортируется в клетки-мишени, где последовательно фосфорилируется внутриклеточными киназами до моно- и дифосфата, после чего образуется активный конъюгат - клофарабин 5’-трифосфат. Клофарабин обладает высокой аффинностью к одному из ферментов, активирующих фосфорилирование - дезоксицитидинкиназе, которая превосходит аффинность естественного субстрата дезоксицитидинкиназы - дезоксицитидина.
Кроме того, клофарабин обладает более высокой устойчивостью к разрушению в клетках под воздействием аденозиндезаминазы и пониженной чувствительностью к фосфоролитическому расщеплению, по сравнению с другими активными веществами того же класса, тогда как степень сродства клофарабинтрифосфата с ДНК-полимеразой α и рибонуклеотидредуктазой одинакова или превышает таковую у дезоксиаденозинтрифосфата.
Исследования in vitro показали, что клофарабин замедляет клеточный рост и оказывает цитотоксическое действие на многие быстро пролиферирующие клеточные линии в опухолях кроветворных клеток и солидных опухолях. Также клофарабин проявлял активность в отношении лимфоцитов и макрофагов в состоянии покоя. Кроме того, клофарабин замедлял рост опухоли и, в некоторых случаях, вызывал регрессию ряда имплантированных мышам ксенотрансплантатов человеческих и мышиных опухолей.
Фармакокинетика
V d (в равновесном состоянии) составляет 172 л/м 2 . Связывание с белками плазмы крови составляет 47.1%, с альбумином сыворотки крови - 27.0%. T 1/2 клофарабина составляет 5.2 ч, T 1/2 клофарабинтрифосфата (метаболита клофарабина) составляет более 24 ч. Общий клиренс - 28.8 л/ч/м 2 почечный клиренс - 10.8 л/ч/м.
Клофарабин выводится как почками, так и внепочечным путем. Около 60% введенной дозы клофарабина через 24 ч выводится почками в неизмененном виде. Клиренс клофарабина значительно превышает клубочковую фильтрацию, что указывает на то, что основными механизмами почечной элиминации являются не только клубочковая фильтрация, но и канальцевая секреция. Однако, поскольку клофарабин практически не метаболизируется изоферментами CYP450, пути внепочечной экскреции в настоящее время остаются неизвестными.
Показания активного вещества КЛОФАРАБИН
Лечение острого лимфобластного лейкоза у детей старше 1 года с рецидивом или рефрактерностью к терапии после применения, по крайней мере, двух предшествующих схем химиотерапии и при отсутствии иных способов достижения стойкой ремиссии.
Режим дозирования
Лечение должно проводиться под контролем врача, имеющего опыт лечения пациентов с острыми лейкозами.
Вводят в/в путем инфузии по специальной схеме, в зависимости от клинической ситуации.
Рекомендуемая доза - 52 мг/м 2 . В зависимости от развития токсических реакций проводится коррекция дозы.
Побочное действие
Инфекционные и паразитарные заболевания: септический шок, сепсис, бактериемия, опоясывающий лишай, простой герпес, кандидоз слизистой оболочки полости рта, колит, вызванный Clostridium difficile.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): синдром лизиса опухоли.
Со стороны системы кроветворения: фебрильная нейтропения, нейтропения.
Аллергические реакции: гиперчувствительность.
Со стороны обмена веществ: дегидратация, гипонатриемия.
Психические нарушения: тревога, ажитация, беспокойство, изменения психического статуса.
Со стороны нервной системы: головная боль, сонливость, периферическая невропатия, парестезия, головокружение, тремор.
Со стороны органа слуха: гипоакузия.
Со стороны сердечно-сосудистой системы: перикардиальный выпот, тахикардия, "приливы" крови к кожным покровам, артериальная гипотензия; синдром повышенной проницаемости капилляров.
Со стороны дыхательной системы: респираторный дистресс-синдром, носовое кровотечение, одышка, тахипноэ, кашель, пневмония.
Со стороны пищеварительной системы: анорексия, снижение аппетита, тошнота, рвота, стоматит, язвы слизистой оболочки полости рта, кровотечение изо рта, кровоточивость десен, кровавая рвота, боли в животе, боли в эпигастрии, диарея, прокталгия, повышение активности амилазы и липазы в сыворотке крови на фоне панкреатита, энтероколит (включая нейтропенический колит, тифлит и колит, вызванный Clostridium difficile), гипербилирубинемия, желтуха, повышение активности АЛТ и ACT.
Со стороны мочевыделительной системы: гематурия.
Со стороны кожи и подкожных тканей: синдром ладонно-подошвенной эритродизестезии, зуд, макуло-папулезная сыпь, петехии, эритема, зудящая сыпь, отслоение рогового слоя эпидермиса, генерализованная сыпь, алопеция, генерализованная эритема, гиперпигментация кожи, эритематозная сыпь, сухость кожи, гипергидроз, синдром Стивенса-Джонсона, токсический эпидермальный некролиз.
Со стороны костно-мышечной системы: боли в конечностях, миалгия, боли в костях, боли в грудной клетке, артралгия, боли в области шеи и спины.
Прочие: повышенная утомляемость, раздражительность, повышение температуры тела, озноб, воспаление слизистых оболочек, полиорганная недостаточность, синдром системной воспалительной реакции, боль, отек, периферические отеки, чувство жара, чувство недомогания, вено-окклюзионная болезнь, гематомы, снижение массы тела, ушибы.
Противопоказания к применению
Почечная недостаточность тяжелой степени; печеночная недостаточность тяжелой степени; беременность; период лактации (грудного вскармливания); детский возраст до 1 года (отсутствие данных о безопасности и эффективности применения клофарабина в данной возрастной группе); повышенная чувствительность к клофарабину.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Т.к. влияние клофарабина на репродуктивную функцию у человека неизвестно, планирование зачатия ребенка должно обсуждаться с пациентами в каждом конкретном случае отдельно.
Женщины репродуктивного возраста и мужчины, ведущие половую жизнь, во время лечения должны использовать надежные методы контрацепции. Поскольку неизвестно, влияет ли терапия клофарабином на фертильность человека, при необходимости пациентам должна быть дана рекомендация по консервации спермы или яйцеклеток до начала курса лечения клофарабином.
Применение при нарушениях функции печени
С осторожностью следует применять препарат у пациентов с печеночной недостаточностью легкой или средней степени.
Противопоказано применение препарата у пациентов с печеночной недостаточностью тяжелой степени.
Применение при нарушениях функции почек
С осторожностью следует применять препарат у пациентов с почечной недостаточностью легкой или средней степени.
Противопоказано применение препарата у пациентов с почечной недостаточностью тяжелой степени.
Применение у детей
Противопоказано применение препарата у детей в возрасте до 1 года (отсутствуют данные о безопасности и эффективности применения клофарабина в данной возрастной группе).
Применение у пожилых пациентов
В настоящее время нет достаточно данных об эффективности и безопасности клофарабина у взрослых пациентов в возрасте старше 21 года (включая пациентов пожилого возраста).
Особые указания
С осторожностью: почечная недостаточность легкой или средней степени; печеночная недостаточность легкой или средней степени; трансплантация гемопоэтических стволовых клеток в анамнезе.
В период лечения следует тщательно контролировать:
- общий анализ крови с подсчетом количества тромбоцитов на регулярной основе; у пациентов, у которых развиваются цитопении, эти анализы следует повторять чаще;
- функции почек и печени до лечения, во время активного лечения и после лечения; при существенном повышении концентрации креатинина или билирубина, лечение клофарабином следует немедленно прекратить;
- дыхательную функцию, АД, водно-электролитный баланс и массу тела во время и сразу после завершения 5-дневной терапии клофарабином.
Следует ожидать подавление функции костного мозга, которое, как правило, является обратимым и дозозависимым. У пациентов, получавших терапию клофарабином, наблюдалась тяжелая супрессия костного мозга, в т.ч. нейтропения, анемия и тромбоцитопения. Кроме того, в клинических исследованиях в начале лечения у большинства пациентов имелись гематологические нарушения, являющиеся проявлениями лейкоза. Вследствие уже существующего ослабления иммунитета и длительной нейтропении, которая может развиваться при лечении клофарабином, пациенты имеют риск развития тяжелых сопутствующих инфекций, в т.ч. сепсиса с потенциально летальным исходом. Пациентов следует постоянного наблюдать на предмет наличия признаков и симптомов инфекции и проводить соответствующую терапию.
Во время лечения клофарабином сообщалось о случаях энтероколита, включая нейтропенический колит, тифлит и колит, вызванный Clostridium difficile, которые чаще всего развивались в течение 30 дней от начала лечения и при применении комбинированной химиотерапии. Эти заболевания могут приводить к развитию таких осложнений как некроз, перфорация кишечника или сепсис, которые могут иметь летальный исход. Поэтому пациентов следует наблюдать для своевременного выявления симптомов и признаков энтероколита.
При применении клофарабина сообщалось о развитии синдрома Стивенса-Джонсона и токсического эпидермального некролиза, включая случаи с летальным исходом. При развитии эксфолиативной или буллезной сыпи или при подозрении на развитие синдрома Стивенса-Джонсона и токсического эпидермального некролиза, терапию клофарабином следует прекратить. Применение клофарабина приводит к быстрому уменьшению количества периферических лейкозных клеток. Пациенты, получающие терапию клофарабином, должны постоянного наблюдаться на предмет возникновения у них проявлений и симптомов синдрома лизиса опухоли и высвобождения цитокинов (таких как тахипноэ, тахикардия, артериальная гипотензия, отек легких), которые могут привести к развитию синдрома системной воспалительной реакции (ССВР), синдрома повышенной проницаемости капилляров и/или органной дисфункции.
В случае ожидания развития гиперурикемии (возникающей при синдроме лизиса опухоли) необходимо рассмотреть вопрос о профилактическом применении аллопуринола.
Пациентам необходимо в/в введение жидкостей в течение всего 5-дневного периода лечения клофарабином для уменьшения эффектов лизиса опухоли и других осложнений.
Профилактическое применение ГКС (например, 100 мг/м 2 гидрокортизона с 1-го по 3-й день цикла терапии клофарабином) может быть полезным для предотвращения развития ССВР или синдрома повышенной проницаемости капилляров.
При появлении ранних признаков ССВР, синдрома повышенной проницаемости капилляров или выраженной органной дисфункции следует немедленно прекратить введение клофарабина и начать лечение этих тяжелых осложнений. Кроме того, лечение клофарабином следует отменить в случае снижения АД по любой из причин во время 5-дневного периода введения препарата. После стабилизации состояния пациента и восстановления функции органов до исходного состояния можно рассматривать вопрос о возобновлении терапии клофарабином, обычно в более низкой дозе.
Пациенты с заболеваниями сердца или получающие лекарственные препараты, влияющие на АД или функцию сердца, должны находиться под постоянным медицинским контролем во время терапии клофарабином.
У пациентов, получающих клофарабин, может наблюдаться рвота и диарея, поэтому пациентов необходимо предупредить о соответствующих мерах для профилактики обезвоживания. Пациентов следует проинструктировать о необходимости обращения за медицинской помощью при появлении головокружения, ощущения "легкости" в голове, обморочных состояний или уменьшения диуреза. Следует рассмотреть вопрос о профилактическом применении противорвотных препаратов.
Отсутствует опыт применения клофарабина у пациентов с нарушениями функции печени (при концентрации билирубина сыворотки крови >1.5×ВГН в сочетании с увеличением активности ACT и АЛТ >5×ВГН), однако печень является органом-мишеныо токсичности клофарабина. В связи с этим клофарабин должен применяться с осторожностью при легкой и умеренно выраженной печеночной недостаточности. Следует по возможности избегать одновременного применения гепатотоксичных лекарственных препаратов. Если у пациента развивается гематологическая токсичность в виде нейтропении 4 степени тяжести (АЧН < 0.5×10 9 /л), длившаяся >4 недель, то в следующем цикле следует снизить дозу клофарабина на 25%.
Всем пациентам, у которых развилась тяжелая негематологическая токсичность (3 степень тяжести по СТС NCI США) в третьем цикле, тяжелая токсичность, которая продолжалась более 14 дней (за исключением тошноты и рвоты), или угрожающая жизни или инвалидизирующая неинфекционная негематологическая токсичность (4 степень тяжести по СТС NCI США) лечение клофарабином следует прекратить.
У пациентов, перенесших ранее трансплантацию гемопоэтических стволовых клеток, может быть выше риск гепатотоксичности в виде развития веноокклюзионной болезни после лечения клофарабином (40 мг/м 2 ) в сочетании с этопозидом (100 мг/м 2 ) и циклофосфамидом (440 мг/м 2 ). У детей и взрослых пациентов отмечались нежелательные реакции серьезной гепатотоксичности в виде веноокклюзионной болезни, которые могли заканчиваться летально (см. раздел "Побочное действие"). В исследовании I/II фазы по комбинированной терапии клофарабином у пациентов детского возраста с рецидивирующим или рефрактерным к лечению острым лейкозом наблюдались тяжелые гепатотоксические осложнения.
Влияние на способность управлять транспортными средствами и механизмами
Возможно развитие нежелательных эффектов (головокружение, ощущения "легкости" в голове, обмороки) в период лечения, при появлении описанных нежелательных реакций не следует управлять транспортными средствами и механизмами.
Лекарственное взаимодействие
Ингибиторы или индукторы изоферментов CYP - взаимодействие маловероятно, т.к. клофарабин практически не метаболизируется ферментной системой цитохрома Р450. Кроме того, маловероятно, что клофарабин может ингибировать любой из 5 основных изоферментов CYP (1А2, 2С9, 2С19, 2D6 и 3А4) или индуцировать два из этих изоферментов (1А2 и 3А4) при концентрации в плазме крови, достигающейся после в/в инфузии в дозе 52 мг/м 2 /сут. Таким образом, ожидается, что клофарабин не будет влиять на метаболизм активных веществ, являющихся субстратами данных изоферментов.
Препараты, обладающие нефротоксическим действием и элиминирующиеся путем канальцевой секреции, такие как НПВС, амфотерицин В, метотрексат, аминозиды, препараты платины, фоскарнет натрия, пентамидин, циклоспорин, такролимус, ацикловир и валганцикловир - следует избегать одновременного приема, особенно во время 5-дневного периода введения клофарабина , т.к. клофарабин выводится в основном почками.
Препараты, обладающие гепатотоксическим действием - следует избегать одновременного применения, поскольку печень является потенциальным органом-мишенью для проявления цитотоксического действия.
Лекарственные препараты, влияющие на АД или функцию сердца - пациентов следует тщательно наблюдать.
Антиметаболиты
Антиметаболитами называют вещества, близкие по химической структуре к эндогенным продуктам метаболизма и ингибирующие, в результате конкурентных отношений, определенные биохимические процессы, что сопровождается нарушением функции клеток и торможением клеточного роста.
Противоопухолевую активность антиметаболитов обнаружили в начале 1960-х гг. Оказалось, что метотрексат, являющийся антиметаболитом фолиевой кислоты, эффективен при некоторых опухолях человека, особенно при хориокарциноме у женщин и при острой лейкемии. Позднее в медицинской практике появились и другие антиметаболиты — аналоги пурина и пиримидина.
К антиметаболитам, применяемым в качестве противоопухолевых средств, относят структурные аналоги фолиевой кислоты (метотрексат), пуринов (меркаптопурин, тиогуанин и др.), пиримидинов (фторурацил, тегафур, цитарабин и др.).
Цитостатическое действие всех этих соединений связано с нарушением синтеза нуклеиновых кислот (ДНК и РНК). Антиметаболиты являются фазоспецифичными средствами — они преимущественно действуют в S-фазе клеточного цикла.
Антагонистом фолиевой кислоты является метотрексат. Он связывается с активным каталитическим центром и ингибирует активность фермента дигидрофолатредуктазы, восстанавливающего дигидрофолат до активной формы — тетрагидрофолата, который является коферментом и играет роль переносчика одноуглеродных групп (метильная, метиленовая, метенильная и др.) во многих ферментативных реакциях. Нехватка тетрагидрофолата приводит к нарушению синтеза тимидилата, пиримидиновых нуклеотидов, аминокислот серина и метионина, в результате чего происходит ингибирование синтеза ДНК, РНК и белка. Поскольку метотрексат оказывает действие в S-фазе клеточного цикла, он наиболее активен в отношении тканей с высокой скоростью пролиферации клеток, таких как опухолевая ткань, костный мозг, клетки слизистой оболочки ЖКТ, мочевого пузыря и др. Метотрексат обладает широким спектром противоопухолевой активности. Основными показаниями к его назначению являются лейкозы, лимфомы, хорионэпителиома матки, рак молочной железы, рак легких, рак яичника, мочевого пузыря и др.
Аналоги пуринов (меркаптопурин, тиогуанин и др.) нарушают биосинтез пуриновых нуклеотидов, входящих в состав нуклеиновых кислот — аденозин−5'-монофосфата (АМФ) и гуанозин−5'-монофосфата (ГМФ).
Меркаптопурин — первый из тиопуринов, у которого была обнаружена противоопухолевая активность. По строению 6-меркаптопурин близок к аденину, гипоксантину, гуанину.
Цитотоксическая активность проявляется после активации в тканях и обусловлена конкуренцией с гипоксантином и гуанином за фермент гипоксантин-гуанинфосфорибозилтрансферазу. Трансформируется в меркаптопуринфосфорибозил, который под влиянием тиопуринметилтрансферазы превращается в метилмеркаптопурин. Оба они угнетают глутамин−5-фосфорибозилпирофосфатамидотрансферазу — первый фермент в синтезе пуриновых рибонуклеотидов de novo. В результате нарушается синтез нуклеиновых кислот (более выражено ингибирование синтеза ДНК, чем РНК), нарушается митотический цикл (S-фаза), особенно в быстро пролиферирующих клетках опухолей и костного мозга.
Наибольшее применение антагонисты пурина нашли при лейкозах.
Флударабин — фторированный аналог аденина (фторированный нуклеотидный аналог противовирусного агента видарабина). В организме быстро дефосфорилируется до 2-фтор-арабинофуранозиладенина, который захватывается клетками. Внутри клетки фосфорилируется дезоксицитидинкиназой до активного трифосфата. Этот метаболит ингибирует рибонуклеотидную редуктазу, ДНК-полимеразу (альфа, дельта и эпсилон), ДНК-праймазу, ДНК-лигазу и блокирует синтез ДНК. Кроме того, противоопухолеый эффект частично обусловлен связыванием РНК-полимеразы II и торможением синтеза белка. Широко применяется для лечения лимфопролиферативных заболеваний (в т.ч. В-клеточный хронический лимфолейкоз, неходжкинские лимфомы низкой степени злокачественности).
Структурные аналоги пиримидина (фторурацил, тегафур, цитарабин и др.) являются антиметаболитами пиримидиновых оснований (цитозин, тимин, урацил), входящих в состав нуклеотидов.
Противоопухолевое действие аналогов пиримидинов обусловлено их превращением в опухолевых клетках в активные ингибиторы ферментов — тимидилатсинтетазы (фторурацил и его аналоги, ралтитрексид и др.), ДНК-полимеразы (цитарабин), рибонуклеотидредуктазы (гидроксикарбамид и др.), участвующих в синтезе нуклеиновых кислот.
Фторурацил (антиметаболит урацила) был создан в 1962 г. Активность фторурацила обусловлена его биотрансформацией в тканях в активные формы. В процессе внутриклеточных превращений 5-фторурацила (5-ФУ) образуются цитостатически активные метаболиты (5-фтор−2'-дезоксиуридин монофосфат и 5-фторуридина трифосфат). Возможны два механизма повреждения клеток под действием активных метаболитов 5-фторурацила. Во-первых, 5-фтор−2'-дезоксиуридин монофосфат и фолатный кофактор N 5–10 метилентетрагидрофолат ковалентно связываются с тимидилатсинтетазой с образованием единого комплекса, что приводит к подавлению образования тимидилата — предшественника тимидина трифосфата, необходимого для синтеза ДНК. Во-вторых, в процессе синтеза РНК транскрипционные ферменты ядра могут ошибочно включить в нее 5-фторуридина трифосфат вместо уридина трифосфата, что приводит к нарушению процессинга РНК и синтеза белка.
Вводят фторурацил внутривенно, т.к. он плохо всасывается из ЖКТ. Он имеет высокую токсичность, проявляющуюся миелосупрессией, язвенным поражением слизистых оболочек пищеварительного тракта (в т.ч. язвенный стоматит, энтерит и др.). По спектру противоопухолевого действия фторурацил отличается от аналогов фолиевой кислоты (метотрексат) и пуринов (меркаптопурин и др.) и проявляет наибольшую активность при лечении колоректального рака, злокачественных опухолей молочной железы, желудка, поджелудочной железы и др.
Аналогичными фторурацилу свойствами обладает тегафур (пролекарство), фтористое производное пиримидина, который в организме гидролизуется с образованием фторурацила. По сравнению с фторурацилом тегафур является менее токсичным соединением.
Новой модификацией фторурацила является еще одно производное фторпиримидина — капецитабин, который, в отличие от фторурацила, применяется как пероральный цитостатик. В организме под влиянием тимидинфосфорилазы капецитабин превращается в 5-фторурацил (5-ФУ). Последовательная ферментная биотрансформация капецитабина в 5-ФУ создает более высокие его концентрации в тканях опухоли, чем в окружающих здоровых тканях.
Механизм противоопухолевого действия тегафура и капецитабина, таким образом, обусловлен образованием фторурацила и его последующей биотрансформацией.
Цитарабин после активации в тканях образует цитарабин−5'-трифосфат, который конкурентно ингибирует ДНК-полимеразу (фермент, катализирующий реакцию синтеза ДНК из предшественников — дезоксирибонуклеозид−5'-трифосфатов), что приводит к ингибированию синтеза ДНК. Кроме того, цитарабин незначительно влияет на синтез РНК (может встраиваться в ДНК и РНК). Цитарабин обладает противолейкозной активностью. Особенно активен в отношении миелобластов, лимфобластов, лимфоцитов, в меньшей степени — гранулоцитов, эритроцитов и тромбоцитов.
Гидроксикарбамид был синтезирован в 1869 г., но его противоопухолевая активность в клинических исследованиях была доказана только в 1980-х гг. Цитотоксическое действие гидроксикарбамида обусловлено ингибированием фермента рибонуклеотидредуктазы, в результате нарушается синтез ДНК при отсутствии эффекта на синтез РНК и белка.
К новым структурным аналогам антиметаболитов, полученным путем направленного химического синтеза принадлежат гемцитабин и ралтитрексид.
Гемцитабин является нуклеозидным (дезоксицитидин) аналогом. Имеет фазовую специфичность действия: останавливает жизнедеятельность клеток в S-фазе и блокирует опухолевую прогрессию клеток в G1/S-фазе. Гемцитабин подвергается внутриклеточному метаболизму под действием нуклеозидкиназ с образованием активных ди- и трифосфатного нуклеозидов. Цитотоксический эффект обусловлен комбинированным влиянием этих активных метаболитов. Дифосфатные нуклеозиды ингибируют рибонуклеотидредуктазу, катализирующую реакции образования дезоксинуклеозидтрифосфатов, необходимых для синтеза ДНК. Трифосфатные нуклеозиды активно конкурируют с дезоксицитидинтрифосфатом за встраивание в молекулы нуклеиновых кислот. После встраивания внутриклеточных метаболитов гемцитабина в цепь ДНК, к ее растущим нитям добавляется еще один дополнительный нуклеотид, что приводит к полному ингибированию дальнейшего синтеза ДНК и обусловливает невозможность репарации ДНК. Гемцитабин эффективен при раке поджелудочной железы, немелкоклеточном раке легких, раке мочевого пузыря и др.
Ралтитрексид специфически ингибирует тимидилатсинтетазу — ключевой фермент в синтезе тимидинтрифосфата (необходим для синтеза ДНК), вызывает фрагментацию ДНК и гибель клетки. Применяется при раке толстой кишки.
В целом, антиметаболиты обладают выраженным противоопухолевым действием и эффективны при ряде злокачественных новообразований. Некоторые из них обладают иммуносупрессивными свойствами (метотрексат, цитарабин и др.). В настоящее время уточняются клеточные механизмы действия известных антиметаболитов и ведется направленный поиск новых соединений этой группы.
Обмен нуклеотидов
Нуклеотиды являются вездесущими компонентами жизни, участвуя в большинстве биохимических реакций. АТФ является энергетической валютой клетки, производные аденина служат коферментами, циклические нуклеотиды цAMФ и цГМФ играют роль вторичных мессенджеров. Наконец, нуклеотиды — это мономерные звенья РНК и ДНК.
Пути биосинтеза нуклеотидов служат мишенью для противоопухолевых и некоторых антибактериальных препаратов, а нарушения в путях их катаболизма ловят ступни в капкан.
Строение нуклеотидов
Нуклеотиды состоят из трех компонентов: азотистого основания, пентозы и фосфата. Нуклеотид без фосфата называется нуклеозидом. Азотистые основания — это производные пурина и пиримидина (рис. 1).
Рисунок 1. | Главные азотистые основания. Некоторые названия отражают историю открытия этих соединений. Гуанин был выделен из перуанского гуано (птичьего помета), тимин — из тимуса быка, аденин — из поджелудочной железы. Урацил получил свое название от мочевой кислоты, из которой его пытались синтезировать. Б. Структурная формула нуклеотидов. В дезоксирибонуклеотидах OH-группа при 2’-углероде замещена на H.
В ДНК и РНК пуриновые основания одинаковые — аденин и гуанин, а пиримидиновые разные: в ДНК тимин, в РНК урацил и в обеих цитозин. Дезоксирибонуклеотиды, образующие ДНК, содержат 2’-дезокси-D-рибозу, а рибонуклеотиды РНК — D-рибозу. Термин «нуклеотид» может обозначать как рибо-, так и дезоксирибоформы.
Биосинтез пуринов
Синтез пуринов de novo сложен и энергозатратен, поэтому в физиологических условиях пул пуринов поддерживается в основном за счет путей их реутилизации (исключение составляют быстроделящиеся клетки). Всасывание нуклеотидов из пищи мало, так как почти все остатки нуклеиновых кислот катаболизируются эпителием тонкой кишки.
Аденин и гуанин образуются из общего предшественника — инозината (IMP). Пуриновое ядро постепенно собирается на остатке 5-Фосфорибозил-1-пирофосфата (PRPP). Все четыре атома азота происходят из аминокислот: два из глутамина, один из аспартата и один из глицина (рис. 2–4).
Рисунок 2. | Синтез пуриновых нуклеотидов de novo: часть 1, образование пуринового кольца инозината. После стадии ③ R обозначает 5-фосфо-D-рибозильную группу. Снизу изображено происхождение атомов пуринового кольца.
Зависимость синтеза пуринов от фолатов на стадиях 3 и 9 означает, что ингибиторы метаболизма фолиевой кислоты являются непрямыми ингибиторами синтеза пуринов, а значит, и ингибиторами деления клетки.
Рисунок 3. | Биосинтез AMP и GMP из IMP.
Регуляция этого пути сложна и мало изучена. Известно, что AMP, GMP и IMP ингибируют его по механизму отрицательной обратной связи. В недавних исследованиях [1] было показано, что шесть ферментов биосинтеза пуринов собираются в пуриносому, являющую собой новый уровень организации ферментов.
Рисунок 4. | Обзорная схема синтеза пуриновых нуклеотидов.
Реутилизация пуринов
Свободные пуриновые основания постоянно высвобождаются в клетке в процессе катаболизма нуклеотидов, и их большая часть повторно используется для синтеза нуклеотидов в более простом пути, нежели синтез de novo.
Один из таких путей настолько прост, что состоит из одной реакции, катализируемой аденозинфосфорибозилтрансферазой: Аденин + PRPP → AMP + PPi
Свободный гуанин и гипоксантин реутилизируются в похожем пути под действием гипоксантин-гуанин-фосфорибозилтрансферазы. Мутация гена вышеназванного фермента вызывает синдром Лёша — Нихена. Это сцепленное с мужским полом заболевание, манифестирующее в раннем возрасте и характеризующееся деформирующим артритом и неврологическими нарушениями. Мальчики с синдромом Лёша — Нихена плохо ориентируются в пространстве, очень враждебны и склонны к саморазрушению вплоть до откусывания себе пальцев.
Биосинтез пиримидинов
Если при синтезе пуриновых нуклеотидов азотистое основание кусочек за кусочком собирается на остатке рибозилфосфата, то при синтезе пиримидинов к рибозе оно присоединяется уже в готовом виде (рис. 5).
Рисунок 5. | Синтез пиримидиновых нуклеотидов. Стадия 1: Синтез карбамоилфосфата. 2: Конденсация аспартата и карбамоилфосфата с образованием N-карбамоиласпартата. 3: Внутримолекулярная конденсация, катализируемая дигидрооротазой с образованием шестичленного гетероцикла (дигидрооротата). 4: Окисление дигидрооротата до оротата. 5: присоединение к оротату рибозо-5-фосфата (PRPP). 6: Декарбоксилирование оротодилата до уридилата. Ферменты 5 и 6 стадий образуют комплекс и называются УМФ-синтазой.
Источник: Campbell M. K., Farell S. O. Biochemistry
Мутации гена UMPS, кодирующего УМФ-синтазу вызывают оротацидурию — редкое (описано лишь 20 случаев) аутосомно-рецессивное заболевание, проявляющееся тяжелой мегалобластной анемией, задержкой развития вследствие дефицита пиримидиновых нуклеотидов и повышенным содержанием оротовой кислоты в моче.
Нуклеозидмонофосфаты превращаются в нуклеозидтрифосфаты под действием нуклеозидмонофосфаткиназ и нуклеозиддифосфаткиназ. Последние необычны тем, что являются неспецифичными ни по основанию, ни по пентозе.
Цитидилатсинтетаза образует цитидилат из UTP.
Прежде чем описать синтез тимидилата, необходимо упомянуть об образовании дезоксирибонуклеотидов, так как его синтез de novo возможен только из дезоксирибонуклеотидного предшественника.
Образование дезоксирибонуклеотидов
Строительные блоки ДНК образуются из соответствующих рибонуклеотидов непосредственным восстановлением 2’-углеродного атома рибозы с образованием 2’-дезоксипроизводного. Реакция катализируется рибонуклеотидредуктазой, ее субстраты — нуклеозиддифосфаты, в ней также участвуют тиоредоксин и тиоредоксинредуктаза.
Рисунок 6. | Восстановление рибонуклеотидов до дезоксирибунклеотидов.
Регуляция рибонуклеотидредуктазы весьма необычна и служит для поддержания баланса четырех нуклеотидов, необходимых для синтеза ДНК. Каждая субъединица имеет 2 типа регуляторных центров: один центр регулирует активность (ATP +, dATP-), второй влияет на субстратную специфичность. Например, если со вторым центром связывается ATP или dATP, фермент начинает отдавать предпочтение восстановлению UDP или CDP, а когда UTP и СTP становится слишком много, возвращается к ADP. ATP выступает главным стимулятором восстановления всех рибонуклеотидов, а dATP в больших концентрациях выключает фермент.
Биосинтез тимидилата
Непосредственный предшественник тимидилата — dUMP. Превращение катализируется тимидилатсинтазой и сопряжено с окислением метилентетрагидрофолата до дигидрофолата (рис. 7).
Рисунок 7. | Синтез тимидилата.
Источник: Campbell M. K., Farell S. O. Biochemistry
Синтез тимидилата является мишенью некоторых противоопухолевых препаратов. Так, в химиотерапии используется ингибитор тимидилатсинтазы — фторурацил (вернее, его метаболит FdUMP), ингибитор дигидрофолатредуктазы — аминоптерин и структурный аналог фолата — метотрексат. Потребность раковых клеток в нуклеотидах гораздо выше, чем у нормальных клеток, поэтому они более чувствительны к ингибиторам биосинтеза тимидилата.
Катаболизм нуклеотидов
Катаболизм пиримидинов
С помощью нуклеотидазы и фосфорилазы от пиримидиновых нуклеотидов отщепляются фосфаты и рибоза, а оставшиеся свободные азотистые основания подвергаются дезаминированию и гидрированию (рис. 8).
Рисунок 8. | Катаболизм пиримидинов. Источник: Campbell M. K., Farell S. O. Biochemistry
Пути распада пиримидинов ведут главным образом к NH4+ и далее к мочевине.
Катаболизм пуринов
Пуриновые нуклеотиды теряют свои фосфаты под действием 5’-нуклеотидазы.
Аденилат превращается в аденозин, который дезаминируется аденозиндезаминазой (ADA) с образованием инозина, который гидролизуется нуклеозидазой до гипоксантина и рибозы. Ксантиноксидаза окисляет гипоксантин до ксантина и затем до мочевой кислоты. (рис. 9)
Рисунок 9. | Катаболизм пуриновых нуклеотидов. Общий метаболит катаболизма пуринов — ксантин. Превращение ксантина в мочевую кислоту катализирует ксантиноксидаза. В правом верхнем углу изображена аденозиндезаминаза (ADA)
У большинства млекопитающих мочевая кислота окисляется до более растворимого соединения — аллантоина, однако у человека, далматинов, приматов и птиц она является конечным экскретируемым продуктом катаболизма пуринов, и здесь время поговорить о подагре.
Заболевания, связанные с катаболизмом пуринов
1. Гиперурикемия и подагра.
Повышенное содержание мочевой кислоты в крови называется гиперурикемией (> 360 мкмоль/л для женщин и > 400 мкмоль/л для мужчин). У этого состояния может быть множество причин: дефект генов, отвечающих за экскрецию уратов почками и кишечником, богатая пуринами и/или фруктозой диета, низкоуглеводная диета, голодание, синдром лизиса опухоли, прием препаратов (диуретиков, аспирина, никотиновой кислоты и др.), синдром Лёша-Нихена, большие дозы алкоголя и другие, но всех их можно поделить на два типа: гиперпродукция уратов и снижение их экскреции. Гиперурикемия далеко не всегда сопровождается подагрой, но подагра гиперурикемией — всегда. Подагра — это метаболическое заболевание, характеризующееся отложением кристаллов уратов натрия преимущественно в плюснефаланговых суставах, поражением почек и приступами острого подагрического артрита.
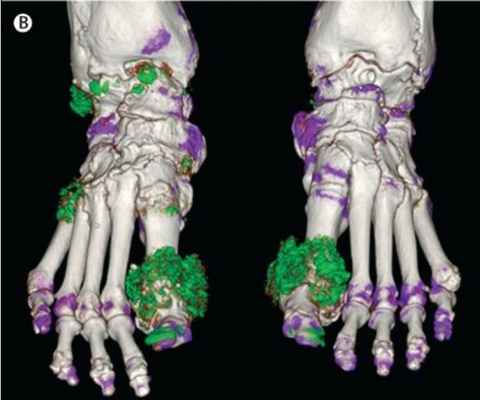
Рисунок 10. | Двухэнергетическая КТ стоп пациента с тофусной подагрой. Депозиты урата показаны зеленым цветом ( на ногтях – артефакт)
Этиология, патогенез и терапия подагры заслуживают отдельной статьи. Здесь я упомяну только о препаратах, влияющих на катаболизм пуриновых нуклеотидов, — ингибиторах ксантиноксидазы (фермента, превращающего ксантин в мочевую кислоту, см. рис. 9). Один из них — аллопуринол, структурный аналог гипоксантина, конкурентный ингибитор ксантиноксидазы. К неконкурентным ингибиторам относится фебуксостат. Оба препарата снижают уровень мочевой кислоты в крови и используются для предотвращения приступов подагры.
2. Дефицит аденозиндезаминазы ведет к одному из типов тяжёлого комбинированного иммунодефицита (SCID, синдром Глянцмана — Риникера, в 30 % случаев вызывается дефицитом ADA), характеризующемуся неспособностью T- и B- лимфоцитов к пролиферации и продукции антител.
Отсутствие аденозиндезаминазы ведет к значительному накоплению dATP, который ингибирует нуклеотидредуктазу, в результате чего возникает дефицит всех дезоксирибонуклеотидов (рис. 11). ADA является Zn-зависимым ферментом, поэтому нарушения в делении лимфоцитов возможны и при дефиците в организме цинка.
Рисунок 11. | Недостаточность аденозиндезаминазы приводит к нарушениям репликации ДНК
Читайте также:
