Радикальность резекции легкого. Трахеи и бронхи
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Несмотря на развивающиеся возможности мультимодальной терапии, хирургическое лечение в обозримом будущем останется ведущим методом увеличения продолжительности жизни пациентов с немелкоклеточным раком легкого (РЛ). Наиболее сложным в хирургии РЛ являются комбинированные вмешательства с резекцией и пластикой крупных сосудов и трахеобронхиального дерева [1, 5, 7, 12]. Особое место в онкохирургии занимают операции с резекцией карины трахеи, что обусловлено анатомическими соотношениями в этой зоне, техническими трудностями вентиляции легких и реконструкции дыхательных путей. Первую успешную резекцию бифуркации трахеи произвел в 1951 г. J. Mathey [8]. В настоящее время мировой опыт торакальных клиник насчитывает достаточное количество каринальных резекций, однако остается много нерешенных вопросов тактики, методологии и техники их выполнения. Эти операции нельзя считать рутинными в онкохирургии, и возможность их выполнения диктуется оснащенностью клиники, квалификацией и опытом хирургов, возможностями периоперационного сопровождения и анестезиологического пособия [1, 3, 4, 6, 10, 11].Частота послеоперационных осложнений и летальности после каринальных резекций превышает аналогичные показатели после стандартных торакальных операций [5, 9]. В настоящей работе мы проанализировали собственный 16-летний опыт операций с резекцией и реконструкцией бифуркации трахеи.
Материал и методы
За период с 1998 по 2014 г. в ФГБУ «НИИ онкологии им. Н.Н. Петрова" и краевом клиническом онкологическом диспансере Ставрополя одной хирургической бригадой прооперированы 82 пациента с циркулярной резекцией бифуркации трахеи (ЦРБТ). Средний возраст составил 56±1,1 (24-75) года. Мужчины - 75, женщины - 7. Морфологически опухоль представлена следующими типами: плоскоклеточный рак - 66, аденокарцинома - 9, диморфный рак - 1, карциноид - 3, аденокистозный рак - 1, мелкоклеточный рак - 1 и светлоклеточный рак почки - 1.
У 75 диагностирован центральный РЛ, у 5 - периферический, у 1 - опухоль нижней трети трахеи, у 1 - поражение бифуркационных лимфоузлов метастазами рака почки с врастанием в карину трахеи и правый главный бронх. По стадиям заболевания (TNM 7th ed.) больные РЛ распределены: IIB - 5 (6,2%), IIIA - 45 (56,3%), IIIB - 28 (35,%), IV - 2 (2,5%) пациентов. Регионарные метастазы обнаружены у 47 (58,7%) больных без существенных различий при первичной опухоли Т3 и Т4.
Все операции выполнены из боковой торакотомии в 4-м межреберье. Средняя продолжительность составила 278±27 мин, средний объем кровопотери - 485±33 мл. Средний послеоперационный койко-день составил 23±1,6. Всем пациентам выполнена циркулярная резекция (ЦР) и реконструкция бифуркации трахеи (БТ) с различными объемами вмешательства на легком. Удаляли от 1 до 4 полуколец главных бронхов и трахеи. Показаниями к выполнению ЦР карины на основании оценки уровня поражения трахеобронхиального дерева по данным фибробронхоскопии и интраоперационной ревизии были: поражение проксимальных двух колец главного бронха, трахеобронхиального угла или распространение опухоли на карину и противоположный главный бронх. Показанием к операции было как распространение первичной опухоли, так и инвазия метастатических лимфатических узлов бифуркационной или нижней паратрахеальной группы.
Оперированы после эксплоративной торакотомии в других лечебных учреждениях 3 больных.
В 2 случаях выявлены микроскопически позитивные края резекции (R1).
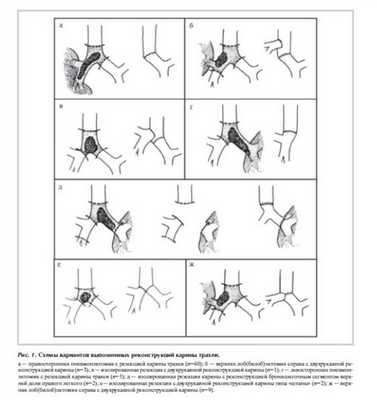
В 60 (73,1%) случаях выполнена правосторонняя пневмонэктомия (ПЭ) с ЦР трахеи и левого главного бронха (ЛГБ), в 5 (6,1%) - левосторонняя ПЭ с ЦР трахеи и правого главного бронха (ПГБ), в 12 (14,6%) - правосторонняя верхняя лобэктомия (ВЛЭ) с ЦР трахеи, ЛГБ и промежуточных бронхов, причем в 3 случаях реконструкция выполнена с формированием 2 анастомозов, а в 9 - по типу «штаны" (рис. 1 ). В 3 случаях выполнена изолированная резекция карины с ее реконструкцией в
1 случае с формированием двух анастомозов, а у
2 пациентов произведена реконструкция по типу «штаны". В 2 случаях при значительном поражении ЛГБ выполнена его резекция с резекцией БТ с ее реконструкцией бронхолегочным сегментом верхней доли правого легкого.
Местно-распространенный рост центральной опухоли нередко приводит к инвазии смежных экстрапульмональных анатомических структур [12]. Интраоперационное определение границ истинной опухолевой инвазии в окружающие органы не всегда возможно, поэтому резекцию смежных структур выполняли и при параканкрозных изменениях, и при интимном подрастании опухоли. У 42 пациентов наряду с бифуркацией трахеи производили сочетанную резекцию анатомических структур грудной полости: обширную резекцию перикарда - 36, левого предсердия - 4, легочной артерии - 3 (1 циркулярная), верхней полой вены - 14 (4 с протезированием), мышечного слоя пищевода - 5, адвентиции аорты - 4, легочного ствола - 1. Патогистологическое исследование подтвердило факт опухолевой инвазии в резецированном экстрапульмональном органе в 19 (45,2%) случаях.
Этап формирования ТБА выполняли при помощи высокочастотной инжекционной вентиляции.
Комбинированное лечение проведено 47 (57,3%) пациентам. Неоадъювантная платиносодержащая химиотерапия от 2 до 4 циклов - 28 (34,1%) пациентам, предоперационный курс лучевой терапии - 8 (9,8%), химиолучевая терапия - 5 (6,1%). В послеоперационном периоде 23 (28%) больным с категорией рN2 проведен послеоперационный курс лучевой терапии, 15 (18,3%) - курс адъювантной химиотерапии.
Статистическую обработку материала проводили на ПК с помощью cтандартного пакета Statistica 8.0. Использовали параметрические и непараметрические методы статистического анализа. Непосредственные результаты лечения оценивали по частоте и структуре осложнений, госпитальной летальности и их причин. Отдаленные результаты лечения оценивали по медиане выживаемости безрецидивного периода, 3- и 5-летней общей выживаемости.
Результаты
Непосредственные результаты. Послеоперационные осложнения развились у 26 (31,7%) пациентов. Госпитальная летальность составила 9 (10,9%) случаев. В табл. 1 представлена характеристика осложнений и причин послеоперационной летальности. Осложнения нехирургического характера наблюдали у 14 больных, хирургического - у 12. У 9 пациентов встречались сочетанные осложнения в различных вариантах (от 2 до 4 видов; в табл. 1 сгруппированы наиболее тяжелые). НБШ анастомозов развилась у 9 (10,1%) пациентов, что стало причиной смерти 4 из них. Все пациенты перенесли правостороннюю ПЭ с ЦРБТ. Обращает внимание отсутствие осложнений со стороны анастомозов при лоб(билоб)эктомиях и изолированной резекции карины с двухрукавной реконструкцией. В период с 1998 по 2002 г. область ТБА дополнительно не укрепляли или укрывали только лоскутом плевры.
В 2 случаях при развитии несостоятельности выполнена вторичная бронхомиопластика, ставшая эффективной в отношении герметичности швов, но вызвавшая в послеоперационный период осложнение - развитие закрытой эмпиемы плевры. С 2003 г. (2-й период) после внедрения комплексной профилактики НБШ выявлено развитие микронесостоятельности (диаметром 2-3 мм) у 3 пациентов. Данное осложнение купировалось самостоятельно под прикрытием мышечного лоскута в течение 5, 8 и 11 сут без развития бронхоплевральной фистулы (БПФ) и эмпиемы плевры. Несостоятельность швов ТБА в период с 2003 по 2014 г. осложнилась летальным исходом лишь в одном случае (табл. 2 ). Частота развития бронхоплевральной БПФ во 2-м периоде работы была достоверно ниже по сравнению с первым - 1,8% против 22,2% (p<0,02). Показатель летальности в этот период также был достоверно ниже по сравнению с первым периодом - 5 (7,8%) против 3 (16,7%), χ2=4,7; p
Осложнений, связанных с резекцией соседних экстрапульмональных структур, в том числе с сосудистыми анастомозами, в нашей клинике отмечено не было.
Наиболее важным в хирургии трахеобронхиального дерева считается возможность выполнения резекции и реконструкции карины без выполнения ПЭ [5]. Техническая возможность выполнения различных вариантов двухрукавных реконструкций карины создается при следующих клинических ситуациях:
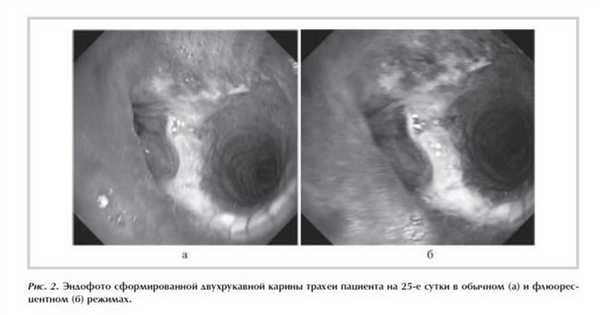
- верхней лоб(билоб)эктомии и резекции карины трахеи при перибронхиально-узловатом росте рака верхнедолевого бронха с переходом на боковую стенку главного до его проксимальной части и/или трахеобронхиального угла (рис. 2 );
- изолированной резекции бифуркации при опухолях с эндобронхиальным ростом в устье главных бронхов или дистального отдела трахеи. Подобные вмешательства выполнены 17 пациентам. Все они выписаны из стационара без осложнений. Лишь в 1 случае сформировался рубцовый стеноз в области устья промежуточного бронха, потребовавший эндоскопической реканализации бронха через 6 мес после оперативного вмешательства.
Отдаленные результаты лечения. Срок наблюдения за оперированными пациентами составил от 6 до 148 мес. Медиана наблюдения составила 42 мес. Живы без прогрессирования 32 пациента, с прогрессированием - 6. Всего летальных исходов - 30, из них 21 - по причине основного заболевания, 9 - по другим причинам. С 6 пациентами связь утеряна. Прогрессирование опухолевого процесса происходило преимущественно за счет гематогенного метастазирования. Внутригрудные рецидивы в области ТБА или в тканях гемиторакса диагностированы у 2 пациентов.
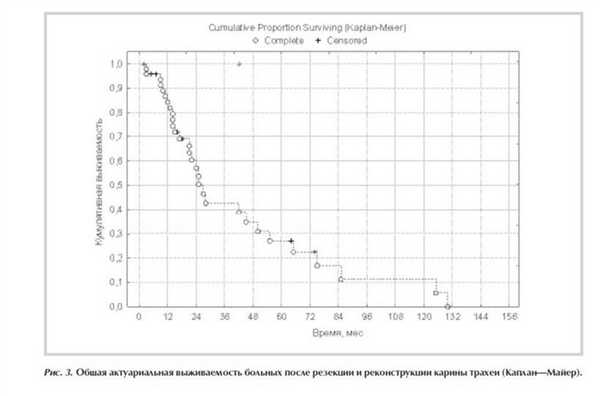
Общая актуариальная 3-летняя выживаемость пациентов составила 43,4%, 5-летняя - 27,2% (рис. 3 ). Медиана жизни прослеженных больных составила 25,4±2,6 мес, медиана безрецидивного периода - 22,3±3,5 мес.
При многофакторном регрессионном анализе (Proportionalhazard Coxratio) из наиболее ожидаемых факторов прогноза (пол, возраст, объем операции, гистотип опухоли, вид лечения, сторона поражения, критерий Т, критерий N) достоверно значимым оказалось состояние регионарных лимфатических узлов - критерий N (beta=0,24, р=0,006). Пол и объем операции имели тенденцию к достоверному влиянию (р=0,06 и р=0,09 соответственно). Однофакторный анализ выживаемости выявил различия в 3- и 5-летних результатах лечения в зависимости от критериев T и N, а также объема операции и вида лечения. Сравнительная оценка 5-летней выживаемости в зависимости от критерия T выявила существенные различия при увеличении его значения: при Т4 - 26,3%, при Т3 - 43,1% (р<0,05). Достоверные различия в 5-летней выживаемости выявлены при сравнении подгрупп без регионарных метастазов и с их наличием N+ (41,2% против 16,8%, Сox-Ftest, р<0,05). При сравнении подгрупп пациентов без метастазов или с поражением прикорневых и бронхопульмональных лимфоузлов (N0/N1) с подгруппой, где имелись метастазы в медиастинальном коллекторе (N2/N3), сохранялись практически такие же различия, как в 3, так и в 5-летней выживаемости (37,2% против 14,3%, log-ranktest, р<0,05).
Общеизвестно прогностическое значение интенсивности метастатического компонента (количество пораженных лимфоузлов) при РЛ. Одиночное метастазирование наблюдали только у 8 из 43 (18,6%) больных с N+, (N1 - в 3 случаях, N2 - в 5). У остальных пациентов с N+ среднее количество метастатических лимфоузлов составило 4,6±0,9
Сопоставление результатов лечения в зависимости от объема вмешательства на легком выявило достоверные различия 5-летней выживаемости после ПЭ и органосохраняющих операций. Худшие результаты после ПЭ в сравнении с лоб(билоб)эктомиями (21% против 63,7%, р<0,05) могут быть обусловлены большей степенью распространенности опухолевого процесса у данной группы пациентов.
Общая актуариальная 5-летняя выживаемость, хотя и без достоверности различий, была выше после комбинированной терапии по сравнению с чисто хирургическим лечением (40,3% против 18,1%, р=0,07).
Выполнение комбинированных хирургических вмешательств при НМРЛ с ЦР карины трахеи целесообразно и обосновано удовлетворительными отдаленными результатами лечения больных с распространением опухоли преимущественно по бронхиальной стенке на проксимальный отдел главных бронхов и карину трахеи. Хирургический эффект подобных операций необходимо дополнить комбинированной терапией с включением по индивидуальным показаниям как пре-, так и послеоперационной химио- и/или лучевой терапии. Основным отрицательным фактором прогноза при НМРЛ IIIA и IIIB стадий остается интенсивность и уровень поражения внутригрудных лимфатических узлов. Резекция и реконструкция трахеобронхиального дерева чреваты высокими цифрами послеоперационных осложнений и летальности [4, 7]. Последняя в половине случаев связана с осложнениями со стороны ТБА. Разработанная нами методология их формирования и укрепления позволяет свести частоту осложнений и летальности практически к таковой после стандартных торакальных операций. Выполнение двухрукавных реконструкций трахеи с лоб(билоб)эктомией или изолированной резекцией карины трахеи позволяет обеспечить радикальность вмешательства, сохранив легочную паренхиму. Это приводит к уменьшению частоты осложнений и летальности, обеспечивает лучшее качество жизни по сравнению с ПЭ с ЦРБТ. Отдаленные результаты лоб(билоб)эктомий с циркулярной резекцией и двухрукавной реконструкцией трахеи также преобладают над результатами ПЭ. Первичная бронхомиопластика является надежным способом укрепления ТБА и позволяет в некоторых случаях избежать фатальных осложнений даже при развитии микронесостоятельности трахеобронхиальных швов.
Вывод
1. Выполнение резекции и реконструкции бифуркации трахеи при злокачественных поражениях бронхов сопряжено с высоким риском послеоперационных осложнений и летальности.
2. Выполнение первичной бронхомиопластики и приведение головного конца в раннем послеоперационном периоде позволяют значительно снизить риск развития НБШ.
3. Радикальное оперативное вмешательство с резекцией и реконструкцией карины трахеи сопровождается удовлетворительными отдаленными результатами.
4. Предпочтителен для данного вида оперативного вмешательства отбор пациентов с N0-1 или с одиночным поражением лимфоузлов группы N2.
Радикальность резекции легкого. Трахеи и бронхи
Б. Э. Линберг в торакальной хирургии. Резекция легких Ю. Ю. Джанелидзе и А. Н. Бакулевым
В Советском Союзе одним из первых систематически начал применять резекцию как метод лечения ряда заболеваний легких ученик С. И. Спасокукоцкого Б. Э. Линберг. В 1935 г. он произвел с благоприятным результатом 2 лобэктомии по поводу бронхэктазий, применив турникет собственной модификации. В журнале «Хирургия» № 1 за 1937 г. он подробно излагает показания и методику операции.
В 1938 г. на заседании Московского хирургического общества и на Международном съезде хирургов в Брюсселе он сделал доклад о 13 лобэктомиях, произведенных по поводу рака легкого. Все больные благополучно перенесли] операцию, но погибли от метастазов в сроки от 5 до 16 месяцев после нее. Это дало право автору считать, что лобэктомия при раке легкого — операция недостаточная, что при этом заболевании надо удалять все легкое.
В 1937 г. Ю. Ю. Джанелидзе произвел лобэктомию по поводу туберкулеза легких, приняв за эхинококк имевшийся в верхушке легкого инфильтрат. Он сделал передний У-образный разрез с пересечением хрящей III и IV ребер. В верхушке легкого была обнаружена опухоль. На один палец ниже ее хирург наложил крепкий кохеровский зажим. Под жомом на легкое наложил сначала матрацные, а затем, после отсечения опухоли, погружные швы. Больной поправился. Отдаленный результат нам не известен.
Много и упорно работает над развитием отечественной легочной хирургии А. Н. Бакулев. Первая лобэктомия по поводу хронического абсцедирования нижней доли легкого была произведена им в феврале 1937 г. с применением зажима С. И. Спасокукоцкого на корень доли и лигатуры en masse. Больной погиб на второй неделе от гнилостной эмпиемы.
В 1938 г. А. Н. Бакулев произвел лобэктомию по поводу хронического абсцесса с благоприятным результатом, а в 1939 г. также с благоприятным результатом сделал лобэктомию при актиномикозе.
Среди советских хирургов, производивших лобэктомию до 1941 г., надо отметить, помимо указанных, В. Р. Брайцева, Н. Н. Бурденко, С. П. Федорова, А. В. Вишневского, А. А. Вишневского, Л. К. Богуша, Б. Е. Франкенберга и др. Отечественная война приостановила дальнейшую разработку этого раздела хирургии в нашей стране. Однако с первых же дней мирного периода многие советские хирурги принялись за дальнейшую разработку этой сложной проблемы.
Над ней сейчас работают в клиниках Б. Э. Линберга, А. Н. Бакулева, П. А. Куприянова, Н. Н. Петрова, Б. В. Петровского, В. И. Казанского, А. А. Вишневского, Н. Г. Стойко, Н. В. Антелава (Тбилиси), В. А. Фейгельман (Одесса), Ю. А. Ратнера (Казань), А. Г. Киселева (Харьков), А. И. Савицкого, Б. Э. Панкратьева (Киев) и др.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Операция при повреждении трахеи и бронхов. Техника
Иногда будут обнаружены повреждения, не требующие хирургического восстановления. Они включают небольшие повреждения, прежде всего, слизистой оболочки, которые не связаны со значительной продолжающейся утечкой воздуха или дистальной обструкцией. Эти поражения обычно занимают меньше трети окружности и не сопровождаются девитализацией ткани. Однако при них потребуется последующее наблюдение, так как могут развиться поздние стриктуры и связанные с ними осложнения.
Одним из наиболее необычных проявлений является частичное «выдувание» слизистой, при котором нет ее четкого разрыва, а эндоскопически мембрана выглядит «растянутой». Это может, особенно если есть воспаление, создать «шаровой клапан», который приводит к прогрессирующей обструкции и/или удерживанию воздуха дистально, что требует отсроченного оперативного лечения.
Лечение определяется местоположением, степенью повреждения и сочетанными повреждениями. К проксимальной половине-двум третям трахеи лучше всего подходить через низкий воротниковый разрез на шее, который также обеспечивает превосходное обнажение повреждений сосудов и пищевода на шее.
Выполнение Т-образного разреза над рукояткой грудины и разделение рукоятки вниз до второго межреберного промежутка открывает вход в грудную клетку, и обеспечивает более широкое обнажение средней трети трахеи, а также проксимальный контроль безымянной артерии или вен. Полная срединная стернотомия не обеспечивает значительной дополнительной экспозиции дыхательных путей, кроме специфических обстоятельств, которые обсуждаются ниже.
К дистальной трети трахеи, килю и правому главному бронху легче всего подойти через правостороннюю торакотомию, которая также обеспечивает хороший доступ к непарной вене, верхней полой вене, правому предсердию, а также ко всему внутригрудному пищеводу. К повреждениям левого главного бронха легче всего подойти через левостороннюю торакотомию, которая также обеспечивает хорошую экспозицию дистальной части дуги аорты, нисходящей грудной аорты и проксимальной левой подключичной артерии.
Однако доступ к проксимальной части левого главного бронха, килю, дистальной трахее или правому главному бронху чрезвычайно труден через левостороннюю торакотомию по причине вышележащей дуги аорты. Адекватная проксимальная экспозиция может быть получена мобилизацией дуги с ретракцией латерально и в цефалическом направлении и разделением ligamentum arteriosum.
Эти подходы могут быть недостаточны для лечения потенциальных сочетанных повреждений. Из-за близости сердца и крупных сосудов спереди от дистальной трахеи, киля и проксимальных главных бронхов, проникающие повреждения груди, вероятно, будут сочетаться с опасными для жизни сердечно-сосудистыми повреждениями.
Для обеспечения оптимального доступа к сердцу или крупным сосудам часто требуется срединная стернотомия, но она дает намного менее удовлетворительную экспозицию трахеи, киля и бронхов, чем это делают соответствующие торакотомии, как описано выше. Однако можно получить доступ к передним отделам дыхательных путей у киля, позволяющий выполнить передний шов или ограниченную первичную резекцию и реконструкцию.
Это требует мобилизации верхней полой вены с отведением вправо, ретракции восходящей аорты влево и продольного рассечения заднего листка перикарда выше правой легочной артерии и каудальнее безымянной вены.
К сожалению, это не обеспечивает экспозиции задних отделов дыхательных путей, где часто происходят тупые повреждения. Это также не обеспечивает соответствующего доступа для ликвидации сопутствующего повреждения пищевода.
Двусторонний торакостернотомический разрез или разрез в виде «раковины моллюска» через четвертый межреберный промежуток обеспечивает хороший доступ к обеим половинам грудной клетки и переднему средостению, и может рассматриваться как доступ при сочетанных повреждениях. Однако этот доступ обеспечивает лишь небольшое дополнительное обнажение дыхательных путей по сравнению с описанными ранее разрезами.
Простые, чистые разрывы без нарушения кровоснабжения дыхательных путей могут быть восстановлены первично простыми одиночными рассасывающимися швами. Мы предпочитаем 4-0 Vicryl (Ethicon, Цинциннати, Огайо), хотя другие успешно использовали нерассасывающиеся или рассасывающиеся моноволокна. В случаях, когда есть значительное трахеобронхиальное повреждение, всю омертвевшую ткань нужно удалить, максимально возможно сохранив жизнеспособную.
В этих случаях круговая резекция и анастомоз «конец в конец» почти всегда предпочтительны для частичных клиновидных резекций травмированных дыхательных путей в качестве попытки первичного восстановления. Принципы резекции дыхательных путей и реконструкции сходны при повреждениях трахеи, киля или бронхов, хотя анатомия реконструкции индивидуальна для хирургического доступа, местоположения и протяженности резекции. Это особенно верно, когда должна быть резецирована или восстановлена часть киля, потому что для достижения реконструкции в этой области может потребоваться большое разнообразие методов.
У большинства пациентов может быть резецировано и первично восстановлено до половины трахеи, так что самые значительные трахеальные повреждения должны без труда допускать первичную резекцию и реконструкцию. Оба главных бронха могут быть полностью резецированы с первичной реконструкцией без натяжения во всех случаях. Обширные повреждения киля более проблематичны и должны быть зашиты, а не резецированы, если это вообще возможно.
Только 3-4 см дыхательных путей, включающих киль, могут быть резецированы и подвергнуты первичной реконструкции. Для наложения анастомоза без натяжения использовалось множество способов мобилизации трахеи и бронхов. Для самых ограниченных резекций трахеи необходима только тупая диссекция бессосудистой передней претрахеальной плоскости в сочетании со сгибанием шеи. Для более обширных проксимальных резекций трахеи надподъязычное выделение гортани может дать 1-2 см дополнительной проксимальной мобилизации.
Для резекций главных бронхов или киля, рассечение перикарда вокруг нижней части ворот обеспечивает дополнительные 1-2 см дистальной мобилизации дыхательных путей.
Сочетанные повреждения пищевода должны быть восстановлены двухрядным швом. При работе через передний шейный доступ пищевод может быть лучше всего обнажен путем полного пересечения трахеи через область ее планируемого восстановления. Между швами трахеи и пищевода должен быть проложен лоскут мышцы или мягкой ткани на питающей ножке, чтобы минимизировать риск послеоперационного трахеоэзофагеального свища.
Внутригрудную линию трахеобронхиального шва также предпочтительно обертывать лоскутом перикарда на ножке, межреберной мышцей или плеврой, чтобы отделить анастомоз дыхательных путей от лежащих сверху кровеносных сосудов. В случаях, когда часть трахеи или киля была резецирована и восстановлена, большая часть подвижности дыхательных путей обеспечивается сгибанием шеи. Это положение поддерживается в послеоперационном периоде путем наложения «защитного шва» между подбородком и грудиной. Как обсуждалось выше, пациенты с изолированными повреждениями дыхательных путей обычно экстубируются в операционной, даже после сложных реконструкций.
В тех случаях, когда диагноз не был поставлен, а у пациентов развивается постоянный ателектаз, пневмония и/или медиастинит, лечение определяется жизнеспособностью паренхимы. Если развился обширный некроз легкого, лечение включает резекцию. В противном случае могут быть возможны попытки реконструкции дыхательных путей или в конкретных случаях временного стентирования.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
По данным некоторых авторов, почти в 80% случаев вместе с нижней долей левого легкого поражается и лингула, и они в ряде случаев с успехом производили сегментарную пневмэктомию вместо того, чтобы удалять всю верхнюю долю.
Однако в подобных случаях излишний консерватизм также опасен. А. Н. Бакулев указывал, что в первое время потерял нескольких больных только потому, что не был достаточно радикален, удаляя две доли там, где надо было убрать все легкое. Как показал опыт многих хирургов, в частности Б. Э. Линберга, при злокачественном поражении легкого требуется тотальное его удаление.
Очень важно дооперационное распознавание локализации заболевания с помощью сегментарной бронхографии, над техникой которой нам предстоит еще много поработать.
Касаясь выраженности анатомических долей, необходимо сказать, что действительно полных междолевых щелей у человека Почти не существует. Всегда имеется некоторая степень слияния тканей соседних долей около долевого гилюса. По данным Кента И Блэдса, из 227 посмертно исследованных легких щель между Правой средней и верхней долями отсутствовала в 21%, а неполная щель была в 67%. Между верхней и нижней долями отсутствие щели не было обнаружено, но неполной она была в 30% случаев на каждой стороне. Неполная щель между правой средней и нижней долями была только в 12,5% случаев. Это обстоятельство надо учитывать при лобэктомиях. В некоторых случаях, как об этом сообщали П. А. Куприянов и др., приходится удалять вместе с нижней и смежные доли, если мощные спайки не дают возможности их разделить.

Трахеи и бронхи
Трахея распространяется от уровня VI—VII шейного позвонка до ее бифуркации, т. е. до IV—V грудного, что соответствует II—III реберным хрящам. Она лежит впереди пищевода, который слегка отклоняется вправо и под бифуркацией касается правого легкого. Аорта огибает левый главный бронх на этом же уровне, и ниже располагается слева от пищевода.
Правый главный бронх отклоняется от трахеи только на 25° и практически является продолжением трахеи. На расстоянии 2 см от бифуркации от главного бронха отделяется первая верхняя долевая ветвь. Таким образом, длина правого главного бронха не превышает 2—2,5 см (по А. В. Мельникову — от 2 до 3,5 см), что при тотальном удалении легкого имеет большое практическое значение.
Левый главный бронх отходит от трахеи под углом около 75°. До своей первой верхнедолевой ветви он имеет длину около 5 см, что почти вдвое превышает длину правого бронха.
Правое бронхиальное дерево. Бронх правой верхней доли начинается от правого бронха в виде короткого ствола, который почти сразу делится на 3 сегментарных бронха (к переднему, боковому и заднему сегментам). Каждый из этих сегментарных бронхов делится на 2 или 3 ветви (рис. 3, 4, 5, 6, 7).
Бронх средней доли начинается самостоятельно от главного бронха или изредка является ветвью верхнедолевого. Среднедолевой бронх отходит от передне-внутренней поверхности главного бронха на 0,5—1,5 см ниже верхнедолевого. Обычно он отходит выше отверстия вторичного бронха задней зоны, иногда, наоборот, — ниже его. Поэтому зачастую при операции возникают трудности для ампутации нижней доли с помощью лигатуры en masse. Как правило, бронх средней доли делится на 2 сегментарных бронха.
Бронхи правой нижней доли. Первая бронхиальная ветвь в нижней доле есть заднесегментарный бронх или бронх к задней зоне. Он возникает сзади или на задне-боковой поверхности правого бронха, у начала нижней доли. Этот сегмент легкого иногда отделен от остальной части нижней доли щелью и является местом возникновения абсцессов легкого. Между задним и остальными сегментарными бронхами нижней доли правый бронх идет одним общим стволом на расстоянии 1—1,5 см, а затем делится на 2 (по Б. Э. Линбергу), а по некоторым авторам, — на 4—5 сегментарных бронхов.
Опухоли бронхов
Опухоли бронхов – различные в морфологическом отношении новообразования, растущие в просвет бронха (эндобронхиально) или вдоль его стенки (перибронхиально). Признаками опухоли бронха могут служить: раздражающий кашель, кровохарканье, одышка, свистящее дыхание, рецидивирующие пневмонии. При раке бронха названная симптоматика развивается на фоне общего нарушения самочувствия (слабости, похудания и пр.). В целях диагностики и верификации типа опухоли бронха проводится рентгенография и томография легких, бронхоскопия с эндоскопической биопсией и гистологическим исследованием материала. Удаление опухолей бронхов (с учетом их локализации и гистотипа) может производиться эндоскопически, путем резекции бронха или легкого.
МКБ-10
Общие сведения
Опухоли бронхов – новообразования, различные по происхождению, клеточному составу, характеру роста, течению и прогнозу, исходящие из тканей бронхиального дерева. Прежде всего, все опухоли бронхов подразделяются на доброкачественные и злокачественные. Первая группа новообразований более многочисленна, хотя составляет всего 5-10% от общего числа опухолевых процессов в бронхах. Большая часть опухолей бронхов представлена различными гистологическими вариантами бронхогенного рака. Доброкачественные опухоли легких и бронхов чаще развиваются у лиц молодого возраста (30-40 лет), в одинаковой степени поражают мужчин и женщин; злокачественные новообразования в большинстве случаев выявляются у мужчин старше 50 лет.
Причины
В большинстве случаев опухоли бронхов возникают на фоне хронических воспалительных процессов, токсических воздействий, механических повреждений бронхиального дерева. Известно, что формированию злокачественных опухолей часто предшествуют бронхит курильщика, хронический бронхит другой этиологии, пневмокониозы, туберкулез. Наибольшей канцерогенностью обладает табачный дым, токсические соединения которого способствуют метаплазии бронхиального эпителия, а высокая температура нарушает процессы клеточного деления. Наиболее значимыми факторами являются стаж курения, ежедневная «норма» выкуриваемых сигарет, качество табачных изделий. Не следует забывать, что одинаково опасно как активное, так и пассивное курение.
Наиболее подвержены возникновению опухолей бронхов работники вредных производств, контактирующие с углем, асбестом, мышьяком, хромом, никелем, аэрогенными поллютантами. Отмечена связь некоторых опухолей бронхов с определенными вирусными агентами (например, ассоциация плоскоклеточных папиллом бронхов с вирусом папилломы человека). Папилломы бронхов часто сочетаются с папилломатозом гортани и трахеи.
Классификация
По типу роста опухоли легких подразделяются на центральные (произрастающие из крупных бронхов - главных, долевых, сегментарных, субсегментарных) и периферические (развиваются из мелких бронхиальных ветвей 5-го, 6-го порядка). Центральные опухоли с эндобронхиальным ростом доступны визуализации через бронхоскоп, часто обтурируют просвет бронха, вызывая при этом ателектаз сегмента или доли легкого. Периферические опухоли длительное время не вызывают клинически значимых изменений и протекают бессимптомно.
Доброкачественные опухоли могут развиваться из различных элементов бронха, на основании чего выделяют:
- опухоли из эпителия и бронхиальных желез (папилломы (плоскоклеточные, железистые, смешанные), аденомы бронхов (карциноидные, цилиндроматозные, мукоэпидермоидные, смешанные)
- опухоли из мезодермальной ткани (лейомиомы, фибромы, гемангиомы, неврогенные опухоли)
- дисэмбриологические опухоли (гамартомы, гамартохондромы)
Опухоли бронхов следует отличать от эндобронхиальных процессов неопухолевой природы. К последним в пульмонологии относятся инородные тела бронхов, воспалительная гиперплазия бронхов, бациллярный ангиоматоз легкого, амилоидные опухоли, эндометриоз и т. п.
По мере развития доброкачественных опухолей бронхов выделяют фазу бессимптомного течения, начальных клинических проявлений и развернутой клинической картины. С учетом выраженности нарушения бронхиальной проходимости различают стадию частичного стеноза бронха, клапанного стеноза бронха и полной окклюзии бронха. В некоторых случаях доброкачественные опухоли бронхов подвергаются малигнизации и приобретают злокачественное течение (например, малигнизация аденомы бронха с переходом в аденокарциному отмечается у 5–10% больных).
Злокачественные опухоли бронхов (рак бронхов) дифференцируют в зависимости от гистологического типа опухоли (мелкоклеточный, крупноклеточный, плоскоклеточный рак, аденокарцинома, карциносаркома, рак бронхиальных желез, карциноидные опухоли и др.). При этом все формы рака легкого проходят в своем развитии три периода: биологический (от момента зарождения опухоли до появления рентгенологических признаков), доклинический (имеются только рентгенологические признаки опухоли; симптомы отсутствуют) и клинический (выражена клиническая симптоматика). Исчерпывающая классификация стадий рака легкого по TNM-системе представлена в обзоре «Злокачественные опухоли легких».
Симптомы опухолей бронхов
Наиболее яркая клиническая симптоматика развивается при эндобронхиальном росте опухоли, вызывающей нарушение бронхиальной проходимости. На стадии частичного бронхостеноза диаметр просвета бронха практически не изменен, пациента может беспокоить раздражающий кашель с небольшим количеством мокроты, изредка – кровохарканьем. Общее самочувствие не страдает. Рентгенологические признаки опухолевого роста отсутствуют; выявление новообразования возможно только с помощью КТ легких или бронхоскопии.
На стадии клапанного стеноза бронха опухоль уже в значительной мере перекрывает просвет воздухоносных путей. Больного беспокоит постоянный кашель с выделением слизисто-гнойной мокроты, кровохарканье, одышка, свистящее дыхание. Во время выдоха под давлением опухоль может полностью закрывать бронх, в связи с чем на этом этапе возникают признаки нарушения легочной вентиляции, воспалительные изменения. Рентгенологически обнаруживаются сегментарные инфильтраты, опухоль бронхов подтверждается эндоскопически или с помощью линейной томографии.
Полная обтурация бронха опухолью приводит к формированию ателектаза, нагноительных процессов в невентилируемом участке легочной ткани. Клиническая картина соответствует обтурационной пневмонии: лихорадка, кашель с гнойной мокротой, общая слабость, потливость. При аррозии бронхиальных сосудов могут возникать массивные легочные кровотечения.
Карциноидные аденомы бронхов могут продуцировать биологически активные вещества, поэтому при опухолях данного типа нередко развивается карциноидный синдром: бронхоспазм, головокружения, покраснение кожи, чувство жара, аллергические высыпания на коже и т. п.
Опухоли с перибронхиальным ростом, как правило, не вызывают полной обтурации бронха, поэтому симптоматика не выражена. Также малосимптомно и течение периферических опухолей. Обычно клиническая манифестация связана с аррозией сосуда (кровохарканье), сдавлением или прорастанием бронхов (кашель, одышка, повышение температуры и т. д.). При раке бронха, кроме респираторных проявлений, выражены общие нарушения: раковая интоксикация, слабость, кахексия, анемия, болевой синдром.
Диагностика
Беспричинный или длительный надсадный кашель, кровохарканье, одышка, затрудненный выдох и другие признаки неблагополучия со стороны дыхательных путей должны стать поводом для безотлагательного посещения пульмонолога. После оценки аускультативных и других физикальных данных определяется алгоритм диагностического обследования.
Как правило, первым шагом на пути выявления опухоли бронха является рентгенография легких в двух проекциях и томографическое исследование. В большинстве случаев рентгенологически определяется гиповентиляция или ателектаз части легкого; на томограммах - "ампутация" обтурированного опухолью бронха. Для оценки васкуляризации опухоли бронха целесообразно выполнение бронхиальной артериографии или ангиопульмонографии.
Наибольшей ценностью при эндобронхиальных новообразованиях обладает фибробронхоскопия с эндоскопической биопсией. Гистологический анализ биоптата позволяет окончательно определить морфологический тип опухоли. Бронхоскопия может быть информативна и при периферических опухолях – в этом случае эндоскопист фиксирует косвенные признаки опухолевого роста (сужение и деформацию контуров бронха за счет внешнего сдавления, изменение угла отхождения бронхиальных ветвей и пр.). При такой локализации также возможна трансбронхиальная биопсия опухоли. С целью оценки степени нарушения проходимости бронхов выполняется спирометрия.
В плане дифференциальной диагностики наиболее важным представляется разграничение доброкачественных и злокачественных опухолей бронхов. Определение гистотипа, локализации и степени распространенности опухоли бронха позволяет грамотно спланировать последующее лечение.
Лечение опухолей бронхов
Доброкачественные опухоли бронхов с внутрипросветным ростом могут быть удалены различными путями. Так, при одиночных полипах на узкой ножке в качестве метода выбора может рассматриваться эндоскопическое удаление полипа через бронхоскоп с коагуляцией ложа. В остальных случаях, как правило, производится торакотомия с бронхотомией и удалением опухоли, окончатая или циркулярная резекция бронха; а при наличии необратимых изменений в легком (бронхоэктазов, пневмосклероза) – различные виды резекции. Перибронхиальные и периферические доброкачественные опухоли, как правило, удаляются в процессе краевой или сегментарной резекция легкого, лобэктомии.
Совсем иной подход используется в отношении злокачественных опухолей бронхов. Исходя из требований радикальности, объем резекции увеличивается до лобэктомии и даже расширенной пневмонэктомии. Эндобронхиальное удаление (лазерная деструкция, криодеструкция, радиочастотная или аргоноплазменная коагуляция, ФДТ), как альтернатива хирургической операции, применяется лишь на стадии TisN0M0 или при функциональной неоперабельности пациента в крупных центрах торакальной хирургии, где имеется соответствующее техническое оснащение и опыт. Хирургическое лечение рака бронхов дополняется химиотерапией или лучевой терапией; в запущенных случаях эти методы служат единственно возможным способом продления жизни пациента.
Прогноз
После удаления доброкачественные опухоли бронхов могут рецидивировать, особенно в случае продолжающегося воздействия причинно значимых факторов. Эндобронхиальное удаление опухоли может осложниться рубцовым стенозом бронха. Отказ от лечения чреват возникновением жизнеугрожающего кровотечения, развитием необратимых изменений легочной ткани, озлокачествлением опухоли бронха. Прогноз злокачественных опухолей бронхов зависит от стадии онкопроцесса, радикальности проведенного лечения, гистологической формы рака, наличия метастазов на момент установления диагноза.
2. Эндоскопическая хирургия при стенозирующий опухолях трахеи и крупных бронхов: Автореферат диссертации/ Телегина Л.В. – 2017.
3. Современные виды хирургического лечения доброкачественных и карциноидных опухолей трахеи и бронхов: Автореферат диссертации/Мосин И.В. – 1990.
Читайте также:
- Расхождение брюшной стенки. Причины расхождения брюшной стенки.
- Ганглий стопы: атлас фотографий
- Рентгенологические изменения при плече-лопаточном периартрите и его эпидемиология. Артрит плечевого сустава
- Диагностика столбняка. Лечение столбняка
- Нарушение проводимости при инфаркте миокарда. Тромбоэмболии при инфаркте миокарда. Синдром Дресслера.
