Радиобиология лучевой терапии: структурные изменения клеток
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Клетки представляют собой основные ячейки жизни, в которых формируются начальные эффекты лучевых воздействий, приводящие к поражениям, проявляющимся позднее на более высоких уровнях биологической организации - тканевом, органном, системном, организменном. Поэтому в радиобиологии уделяют особое внимание процессам, развивающимся после облучения именно в клетках.
В живой клетке постоянно осуществляется обмен веществ с внешней средой, между отдельными внутриклеточными структурами. Молекулярные повреждения, возникшие в клетках на начальных стадиях действия ионизирующих излучений, изменяют ход обменных процессов, осуществляющихся при участии поврежденных структур. Поскольку локализация и характер первичных повреждений в той или иной молекулярной структуре клетки носит в значительной степени вероятностный характер, весьма разнообразны и связанные с ними изменения метаболизма.
Нарушение метаболических процессов, в свою очередь, приводит к увеличению выраженности молекулярных повреждений в клетке. Этот феномен получил наименование "биологического усиления" первичного радиационного повреждения. Однако, наряду с этим, в клетке развиваются и репарационные процессы, следствием которых является полное или частичное восстановление структур и функций.
Биологическое усиление радиационного поражения
Наиболее значимы для судьбы облученной клетки, изменения нуклеинового обмена, белкового обмена, окислительного фосфорилирования.
Практически сразу после облучения в делящихся клетках замедляется синтез ДНК. Активируются эндо- и экзонуклеазы, вследствие чего повышается ферментативный гидролиз молекул ядерной ДНК; увеличение проницаемости внутриклеточных мембран способствует поступлению ферментов во внутриядерное пространство, повышает доступность ядерной ДНК для ферментативной атаки. Распад ДНК приводит к повышению содержания в тканях полидезоксинуклеотдов. В крови и моче облученных нарастает количество нуклеотидов и продуктов их разрушения - азотистых оснований, нуклеозидов, мочевой кислоты и др.
Синтез РНК снижается в меньшей степени, чем ДНК. Отчасти нарушение синтеза РНК зависит от повреждения матричных структур ДНК.
Повреждение мембран лизосом и выход за их пределы протеаз способствуют в ранние сроки после облучения активации процессов протеолиза. Эта активация проявляется повышением уровня свободных аминокислот и других аминосоединений в тканях и жидкостях организма, аминоацидурией, развитием отрицательного азотистого баланса. Повышается активность протеолитических ферментов в крови, тканях, моче. Нарушается активность ингибиторов протеаз. Активация протеолиза не всегда является выражением процессов, происходящих в сохранивших жизнеспособность клетках. Она может отражать завершение деструкции уже погибших клеток.
Биосинтез белка нарушается мало. Однако, продолжающийся синтез белка в сочетании с глубоким снижением или даже прекращением синтеза ДНК может привести к серьезным нарушениям структуры и пространственной организации нуклеопротеидных комплексов. Распад комплекса ДНК- гистон облегчает доступ мутагенов к освобожденным от связей с белком участкам ДНК.
Интенсивность потребления кислорода существенно не изменяется. Однако, в первые часы после облучения иногда наблюдаются признаки тканевой гипоксии. В высоко радиочувствительных клетках уже после облучения в сравнительно невысоких дозах отмечается нарушение окислительного фосфорилирования, проявляющееся снижением коэффициента Р/О.
В клетках кроветворных тканей угнетение окислительного фосфорилирования выявляется уже через 2-4 ч после облучения, параллельно с глубоким распадом ДНК. По мнению ряда исследователей, нарушение синтеза АТФ является пусковым звеном в послелучевой деградации ДНК. Нарушение синтеза макроэргов может сказаться и на развитии восстановительных процессов, в частности, на работе системы ферментов репарации ДНК. Таким образом, подавление окислительного фосфорилирования играет заметную роль в радиационном поражении генетических структур клетки.
Тканевое дыхание и окислительное фосфорилирование в клетках перенесшего облучение организма, как правило, довольно быстро восстанавливается.
Радиобиология лучевой терапии: структурные изменения клеток
Лечебного облучения основано на избирательном повреждении тканей. Злокачественные клетки погибают от радиации в большем количестве, чем клетки окружающих нормальных тканей, преимущественно вследствие разной способности к репарации. Именно различие в радиочувствительности между нормальными и опухолевыми тканями лежит в основе лучевой терапии (ЛТ).
Терапевтическое отношение — это отношение дозы, необходимой для гибели опухоли, к дозе, которая вызывает повреждение нормальных тканей; современная лучевая терапия (ЛТ) стремится увеличить этот показатель.
Депонирование энергии излучения в клетке приводит к ряду изменений, которые нарушают ее нормальную жизнедеятельность. Разрушение или распад на более мелкие фрагменты и перекрестные сшивки — примеры структурных повреждений белков, ферментов и нуклеиновых кислот. Начальные химические изменения происходят за долю секунды; их редко можно обнаружить прямыми методами. Репарация некоторых изменений протекает практически мгновенно, а других — никогда.
В облученных клетках происходят различные морфологические и функциональные нарушения. Существует множество прямых и косвенных доказательств того, что эти нарушения обусловлены повреждениями ДНК. Например, было подсчитано, что для инактивации клеточной системы цитоплазматических ферментов необходима доза 10 000 Гр, а для повреждения мембраны клетки — 10 Гр. В то же время хромосомные аберрации и мутации могут быть вызваны очень низкими дозами облучения.
Поскольку только несколько Грей необходимо для достижения высокой летальности клеток в культуре ткани, то логично предположить, что за эту гибель ответственны изменения в ядрах клеток.
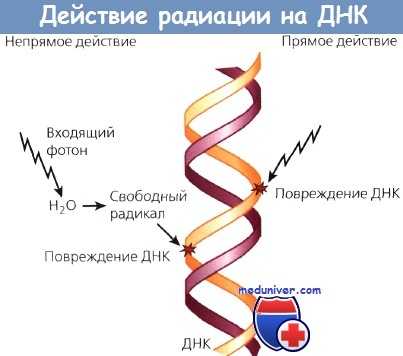
Прямое и непрямое действие радиации.
ДНК -мишень излучения, поражение которой наиболее часто приводит к летальному исходу, схематично показана в центре.
При прямом воздействии фотон отрывает электрон от молекулы-мишени (ДНК).
При непрямом механизме другая молекула, например вода, ионизируется, свободный электрон приближается к мишени и повреждает ДНК.
Разрушение клетки вследствие радиационных повреждений ДНК происходит благодаря одному из нескольких механизмов.Клетка может вступить в апоптоз — процесс, называемый интерфазной смертью, который можно выявить с помощью нескольких методов, включая световую микроскопию и вестерн-блоттинг. Радиация может вызвать митотическую гибель клетки, при которой она внешне кажется нормальной, но в действительности значительно повреждена и не может делиться.
Моментальная гибель клетки не происходит: она живет до попытки деления. Этим объясняется, почему опухоль продолжает уменьшаться после окончания курса облучения.
Облучение вызывает множество изменений ДНК, включая повреждение нуклеиновых оснований, поперечные сшивки ДНК—белок, разрывы одной и двух цепей. Восстановление структуры даже одного нуклеотида требует работы многих генов и представляет многоступенчатый процесс. Самое опасное повреждение, вызываемое ионизирующей радиацией, — это разрыв двух нитей ДНК. Известно, что эффективность репарации двойных разрывов коррелирует с летальностью, вызванной облучением.
Восстановление двунитевых разрывов ДНК происходит несколькими путями. Сшивание комплементарных концов ДНК, или гомологичная рекомбинация, — эффективный механизм, при котором клетка обычно выживает. Обладающий нуклеазной активностью, белок Mrell первый обнаруживает двойные разрывы ДНК и вступает в процесс репарации, раскручивая ДНК или удаляя ее петли-«шпильки». Если окончания разрывов не комплементарны друг другу, происходит репарация по механизму негомологичного воссоединения концов, что может осложниться небольшими делениями или вставками (инсерциями) небольших участков ДНК. Эти ошибки могут привести к гибели или мутации клетки.
Для воссоединения негомологичных концов необходимы белки Ku70, Ku80, ДНК лигаза IV и XRCC4. Комплекс Ku70/Ku80 соединяется с ДНК в месте двойного разрыва и раскручивает цепочку, а комплекс ДНК лигазы IV/XRCC4 осуществляет репарацию. В клетках млекопитающих репарация чаще происходит по механизму негомологичного воссоединения концов, чем посредством гомологичной рекомбинации.
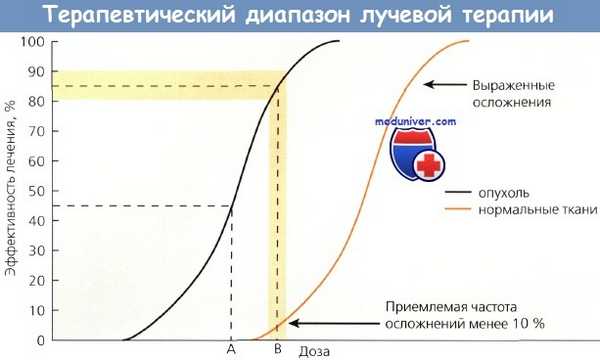
Терапевтический диапазон.
Графическое представление параллельных кривых ответа опухоли и толерантности нормальных тканей, показывающее отношение между увеличением дозы, повышением эффективности лечения и возрастанием числа осложнений.
В идеальных условиях (В) эффективность лечения на уровне 80-90 % может быть достигнута с 5-10 % осложнений.
Смещение эффективности лечения влечет за собой увеличение количества осложнений.
С другой стороны, попытки избежать каких бы то ни было осложнений (А) значительно снижают вероятность излечения.
Хотя форма этих кривых отличается для различных типов опухолей и уровней дозы, основная концепция лучевой терапии (ЛТ) злокачественных опухолей сохраняется.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Радиочувствительность опухоли и ее факторы
Радиочувствительность — это ответ опухоли на облучение, который измеряется степенью регрессии, скоростью ее наступления и длительностью. Радиочувствительность зависит от ряда факторов: способности клеток устранять повреждение, гипоксии, периода клеточного цикла и доли растущих клеток. Кроме того, возможность ликвидации опухоли определяется ее начальным объемом.
Важно понимать, что термины «радиочувствительность» и «способность излечить лучевой терапией» имеют разные значения. Относительно радиорезистентпые новообразования, доступные для локального подведения высоких доз облучения, могут быть излечены, но радиочувствительные метастатические опухоли излечить с помощью одной лучевой терапией (ЛТ) нельзя: может быть достигнут только местный эффект.
Прекрасный пример относительно радиорезистентного новообразования — плоскоклеточный рак шейки матки (РШМ). Эта опухоль остается одной из самых излечиваемых, что объясняется возможностью подведения к ней высоких доз излучения и ее происхождением из тканей, которые также относительно радиорезистентны. Ключ к успешному лечению — хорошие условия для расположения радия или цезия в непосредственной близости к опухоли без превышения дозы на окружающие нормальные ткани выше переносимой.
Множество попыток было предпринято, чтобы найти способ определения радиочувствительности опухоли. Однако в настоящее время не существует надежного метода прогнозирования результата лечения данной конкретной опухоли. Не исключено, что опухоли состоят из нескольких популяций клеток с различной чувствительностью к XT и ЛТ. Чувствительные клетки погибают, а резистентные — продолжают расти. Это объясняет, почему вначале ответившие на лечение опухоли в конечном счете не излечиваются.
Для прогнозирования и изучения радиочувствительности опухолевых клеток разработаны модели in vitro. Клеточная радиочувствительность определяется в основном потерей репродуктивной способности, которую показывает кривая выживаемости, характеризующаяся начальным наклоном а и конечным b, причем а отражает невосстановимые повреждения клетки, а b — восстановимые. Отношение а/b — доза, при которой вклад от а эквивалентен вкладу от и, и есть показатель радиочувствительности.
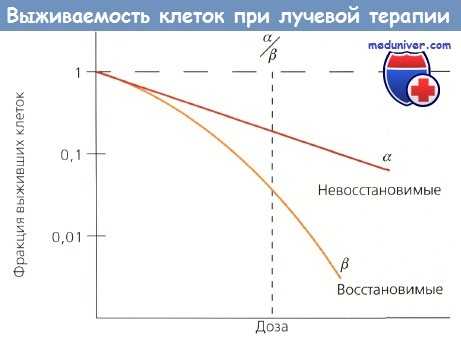
Кривая выживаемости клеток.
Начальный наклон (а) отражает невосстановимые повреждения, а конечный наклон (b) - восстановимые.
Отношение а/b — это точка на кривой, где два значения равны
Большие значения отношения характерны для быстроделящихся клеток, они помогают предсказать ответ опухолей и оценить раннюю эффективность облучения. Низкие значения характеризуют поздно реагирующие ткани.
Размер плеча кривой выживаемости дает важную информацию, т. к. отражает величину репарации сублетальных повреждений. Широкие плечи имеют низкие отношения а/b и хорошую репарацию сублетальных повреждений, которая занимает 2—6 ч. Способность клеток восстанавливать сублетальные повреждения служит основанием для фракционирования дозы ЛТ, при котором используются различия между способностью нормальных и опухолевых тканей к репарации.
Различная способность к репарации также служит основой для ускоренного фракционирования и гиперфракционирования, при которых доза подводится 2 раза в день. Такой подход дает хорошие результаты при быстро растущих опухолях. Лечение 2 раза в сутки оставляет достаточный срок нормальным тканям для репарации, тогда как опухолевые, менее организованные ткани погибают в силу нехватки времени для восстановления.
Некоторые клетки почти не имеют плеча на графике, что говорит об их ограниченной способности к репарации сублетальных повреждений; эти клетки погибают от относительно небольших доз радиации. Например, дисгерминомы излечиваются сравнительно невысокими дозами облучения (20—30 Гр) по сравнению с опухолями шейки матки, к которым необходимо подвести более 70 Гр для получения полного эффекта.
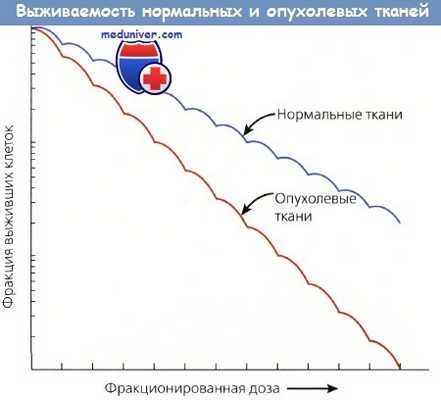
Различная выживаемость нормальных и опухолевых тканей зависит от разной их способности накапливать и репа-рировать сублетальные повреждения, полученные от фракционированных доз.
Нормальные ткани восстанавливаются быстрее и эффективнее
Доступ кислорода также имеет большое значение для радиочувствительности клетки. Излучение в клетке взаимодействует с органическими молекулами (ДНК). ДНК может восстановиться, если молекула кислорода не присоединится к ней, «фиксируя» повреждение. Надо отметить, что кислород усиливает эффект излучения с низкой ЛПЭ (фотоны), но не оказывает аналогичного действия при облучении пучком с высокой ЛПЭ.
Способность кислорода усиливать излучение, или коэффициент кислородного усиления, вычисляется как отношение дозы излучения, производящей определенный эффект без кислорода, к дозе, дающей тот же эффект, но в присутствии кислорода. Для наблюдения полного кислородного эффекта необходимо наличие по крайней мере 2 % (17 мм рт. ст.) тканевого кислорода.
Способность опухолевых клеток к росту потенциально не ограничена, но практически зависит от поступающих с кровью питательных веществ. Известно, что любая опухоль размером более 200 мкм имеет некроз в центре вследствие ограниченной способности кислорода диффундировать на большие расстояния. Кислород легко проникает на 70 мкм от кровеносного сосуда.
Клетки, располагающиеся дальше этого расстояния, страдают от нехватки кислорода и переходят в фазу покоя. В них может развиться гипоксия и даже аноксия и некроз. Это важно с точки зрения радиобиологии, т. к. покоящиеся клетки проявляют более выраженную способность к восстановлению радиационных повреждений. Клетки в состоянии гипоксии более резистентны к облучению, чем нормально оксигенированные. Таким образом, большие опухоли труднее излечить с помощью ЛТ не только из-за большего числа составляющих их клеток, но и вследствие нахождения в них гипоксических, покоящихся и радиорезистентных клеток.
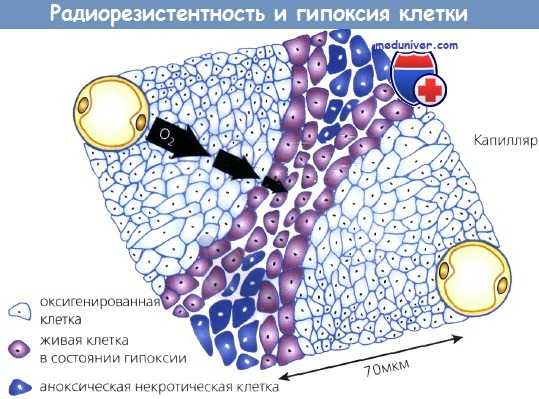
С увеличением расстояния от кровеносных сосудов клетки находятся в состоянии гипоксии и даже аноксии.
Гипоксические клетки более радиорезистентны и поэтому труднее поддаются лечению.
Кислород диффундирует примерно на 70 мкм от капилляров.
Клинический пример: замечено, что экзофитные рыхлые опухоли шейки матки, легко кровоточащие при контакте, лучше и быстрее отвечают на облучение, чем инфильтративные формы. Кровоснабжение и оксигенация этих двух видов новообразований значительно отличаются: рыхлая опухоль лучше васкуляризована и, следовательно, оксигенирована, поэтому ее радиочувствительность выше. К сожалению, к настоящему времени попытки преодолеть такое существенное различие в чувствительности к облучению с помощью гипербарической оксигенации и радиосенсибилизации не дали ожидаемых результатов.
Другим важным фактором, влияющим на радиочувствительность, служит содержание в опухоли митотических, или клоногенных, клеток. Размножающиеся клетки более чувствительны к облучению. Число митозов коррелирует с прогнозом лечения при многих опухолях. Фаза клеточного цикла тоже имеет большое значение. Клетки в поздней G2 и митотической (М) фазах наиболее чувствительны к облучению, а в поздней синтетической фазе (S) — наиболее резистентны. Это учитывается при совместном применении ЛТ и XT. Так, например, паклитаксел задерживает клетки в фазе митоза и, следовательно, выступает в роли чрезвычайно сильного радиосенсибилизатора.
От первоначального объема опухоли в значительной степени зависит возможность излечения: чем меньше объем, тем меньшая доза облучения требуется для уничтожения всехзлокачественных клеток и наоборот, при большем объеме доза, необходимая для исчезновения опухоли, возрастает. Принцип лечения сокращающимися полями заключается в последовательном уменьшении размера полей облучения с тем, чтобы подвести наибольшую дозу на центральную часть опухоли, где предположительно находятся наиболее радиорезистентные клетки в состоянии гипоксии.
В течение длительного времени клиницисты предпринимали попытки установить взаимосвязь между ответом опухоли на облучение и частотой местного рецидивировапия. В целом, чем полнее ответ опухоли к окончанию лечения и чем скорее он наступает, тем дольше период ремиссии, т. к. можно предположить, что отдаленные метастазы не появятся. Хотя эта зависимость не универсальна, при РШМ показана устойчивая корреляция между длительностью ремиссии и степенью резорбции опухоли к концу курса облучения — частичной или полной регрессией.

Grigsby установил взаимосвязь между выживаемостью и ответом опухоли к окончанию лечения, который он определял с помощью ПЭТ, основанной на измерении метаболизма глюкозы.
Другой фактор, ограничивающий излечиваемость с помощью лучевой терапии (ЛТ), — увеличение побочных эффектов со стороны нормальных тканей, связанное с повышением дозы. Появление этих осложнений зависит от суммарной дозы и дозы за фракцию, объема облученных тканей и их радиочувствительности. Цель любой терапии — достижение излечения с минимальным количеством побочных эффектов. Комбинирование ЛТ с хирургическим лечением или XT снижает толерантность нормальных тканей к облучению.
Установлены и хорошо обоснованы размеры полей, суммарные дозы и схемы фракционирования, но они не могут оставаться неизменными. Продолжают исследовать различные методы повышения процента выздоровления и снижения осложнений; для этого используют новые химиотерапевтические радиосенсибилизаторы, а также технические достижения в подведении излучения, такие как ЛТМИ и радиопротекторы, подобные этиолу.
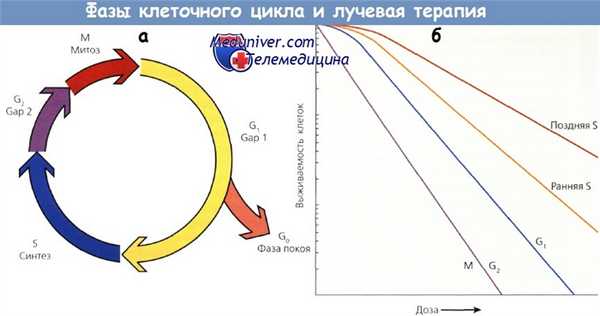
а - клеточный цикл
б - кривая выживаемости клеток в митозе и фазе G2 более крутая и не имеет плеча.
Кривая для клеток в поздней S-фазе более пологая и имеет большое плечо.
Фазы G1 и ранняя S характеризуются промежуточной чувствительностью.
В данной статье рассматривается радиочувствительность опухолей, его значение в лучевой терапии, а также процессы и способы радиомодификации. В основе лучевой терапии лежат понятия о действии различных видов ионизирующего излучения, а также возможности целенаправленного изменения эффектов облучения с помощью применения методов радиомодификации. В настоящее время в лучевой терапии методы радиомодификации позволяют, с одной стороны, путем применения радиосенсибилизаторов повысить эффективность облучения злокачественных опухолей, а с другой – увеличить защиту здоровых тканей при применении радиопротекторов. К способам радиомодификации относятся сочетание лучевой терапии с химиопрепаратами, гипертермией, повышение кислорода в опухолевых тканях, в том числе применение электрон-акцепторных соединений, искусственная гипергликемия, - это способы, повышающие радиочувствительность опухолей; гипоксирадиотерапия, применение модификаторов биологических реакций, - это способы, понижающие радиочувствительность нормальных тканей. Знания о радиочувствительности опухолей и нормальных тканей имеет существенное значение в лучевой терапии. Важен правильный выбор лучевой терапии, так как это играет ведущую роль в эффективности лечения опухолей, результатах выживаемости, частоте возникновения осложнений и рецидивов злокачественных новообразований, качества жизни. Благодаря знанию всех способов радиомодификации имеются реальные возможности улучшения результатов лучевой терапии путем управления радиочувствительности злокачественных новообразований с помощью радиомодифициующих агентов, что ведет к расширению радиокурабельности опухолей.
1. Асатурян М.А. и др. Основы и клиническое применение лучевой терапии //Лучевая диагностика и лучевая терапия: учеб. пособие / под ред. Г.Е. Труфанова.- СПб.: ВМедА, 2005. – С. 106-134.
2. Асатурян М.А. и др. Современные принципы лучевой терапии злокачественных опухолей // Сб. учеб. пособий по актуальным вопросам лучевой диагностике и лучевой терапии / под ред. Г.Е. Труфанова. – СПб.: Элби-СПб, 2004. – С. 253-271.
3. Ганцев Ш.Х. Онкология: учебник для студентов медицинских вузов. – 2-е изд., испр. и доп. – М.: ООО «Медицинское информационное агентство», 2006. – 488 с.: ил.
4. Труфанов Г.Е., Асатурян М.А., Жаринов Г.М., Малаховский В.Н. Лучевая терапия: учебник / под ред. Труфанова Г.Е. – М.: ГЭОТАР –Медиа, 2013. – 208 с.: ил.
5. Шайн А.А. Онкология: учебник для студентов медицинских вузов. Тюмень: Издат. центр «Академия»,2004. 544 с.
Введение: Степень восприимчивости к излучению называют радиочувствительностью. Клетки, ткани, органы человека в разной степени чувствительны к облучению. Радиочувствительность тканей и клеток не является величиной постоянной, она меняется в зависимости от состояния организма и от действия внешних факторов, а также от уровня пролиферативной активности органов и тканей. Согласно заключению экспертов ВОЗ, успех лучевой терапии примерно на 50% зависит от радиочувствительности опухоли, на 25% от аппаратного оснащения, на 25% от выбора рационального плана лечения и точности его воспроизведения от сеанса к сеансу облучения[3].
Цель: разделение опухолей по степени восприимчивости к ионизирующему излучению; изучение факторов, от которых зависит радиочувствительность; рассмотрение всех способов радиомодификации.
С целью представления о радиочувствительности различных опухолей и тканей приведем таблицу 12.
Степень восприимчивости к ионизирующему излучению
Неходжкинская лимфома, лимфогранулематоз, лейкемия, семинома, мелкоклеточный рак легкого, опухоли головы и шеи, дисгерминома, опухоль Юинга
Кроветворная, лимфоидная ткань, сперматогенный эпителий, эпителий фолликулов яичников, эпителий ротоглотки, кожа
Опухоли молочной железы, немелкоклеточный рак легкого, аденокарцинома желудочно-кишечного тракта, рак шейки матки, рак предстательной железы
Железистый аппарат желудка, толстой кишки, молочной железы, эпителий слизистой тонкой кишки
Фибросаркома, остеогенная саркома, хондросаркома, рак почки, нейрогенные опухоли
Хрящевая, костная, мышечная, фиброзная ткани
Из данной таблицы следует, что наиболее чувствительны к облучению кроветворная, лимфоидная ткань, сперматогенный эпителий, эпителий фолликулов яичников, эпителий ротоглотки, кожа. Далее по степени радиочувствительности идут железистый аппарат желудка, толстой кишки, молочной железы, эпителий слизистой тонкой кишки хрящевая, костная, мышечная, фиброзная ткани. К радиочувствительным опухолям относят неходжкинская лимфома, лимфогранулематоз, лейкемия, семинома, мелкоклеточный рак легкого, опухоли головы и шеи, дисгерминома, опухоль Юинга. Промежуточной радиочувствительностью обладают опухоли молочной железы, немелкоклеточный рак легкого, аденокарцинома желудочно-кишечного тракта, рак шейки матки, рак предстательной железы. Резистентными являются фибросаркома, остеогенная саркома, хондросаркома, рак почки, нейрогенные опухоли. Несмотря на то, что в данной таблице отмечены железистый аппарат желудка, толстой кишки, эпителий слизистой тонкой кишки, обладающие промежуточной радиочувствительностью, при опухолях с локализацией в этих органах лучевую терапию применяют редко либо вовсе не применяют, так как опухоли данных локализаций подвижны из-за перистальтических движений желудка и кишечника[4]. А при раке печени не применяют лучевую терапию из-за низкой толерантности печени к ионизирующему излучению[5].
Радиочувствительность злокачественной опухоли к ионизирующему излучению определяется большим числом факторов: возрастом, состоянием больного, формой роста, гистологическим типом новообразования, состоянием тканей, окружающих опухоль, соотношением в опухоли клеточных и стромальных элементов, скоростью репопуляции клеток, степенью оксигенации тканей, наличием некротических участков и гипоксических клеток[3].
Рассмотрим некоторые факторы, влияющие на чувствительность опухолей:
- На чувствительность опухоли к излучению влияет степень дифференцировки клеток: чем менее дифференцированы клетки, тем выше радиочувствительность опухоли. Например, мелкоклеточный рак легкого намного чувствительный к облучению, чем плоскоклеточный рак или аденокарцинома этого же органа.
- Степень повреждающего действия зависит от фазы клеточного цикла, в которой находятся пролиферирующие клетки в момент облучения: наибольшей чувствительностью обладают клетки в фазе G2 и M, меньшей – находящиеся в фазах G1 и S.
- Чувствительность к излучению в значительной мере зависит от клеточного состава злокачественной опухоли.
Способы радиомодификации. Достижения в области радиобиологии – изучение прямого и косвенного действия радиации – привели к исследованию процессов радиомодификации.
Прежде чем перейти к способам радиомодификации необходимо знать некоторые понятия о радиомодификации: Радиомодификация – это целенаправленное изменение чувствительности тканей к облучению. Радиомодифицирующие агенты – это физические и химические факторы, с помощью которых эффективность лучевых воздействий может быть повышена путем усиления радиопоражаемости опухоли и ослабления лучевых реакций нормальных тканей. Радиосенсибилизация лучевого воздействия – это процесс, при котором различные способы приводят к увеличению поражения тканей под влиянием облучения. Радиопротекция - действия, направленные на снижение поражающего эффекта ионизирующего излучения. Соответственно радиопротекторы – это вещества, снижающие радиочувствительность.
На основании выше сказанного способы радиомодификации можно разделить на две большие группы. Первая группа это способы, повышающие радиочувствительность опухолей или, другими словами, повышающие радиопоражаемость, вторая группа – способы, понижающие радиочувствиетльность нормальных тканей.
Подробно рассмотрим каждую группу.
Первая группа способов, повышающих радиочувствительность опухолей:
- Чувствительность опухоли ионизирующего излучения можно повысить, сочетая лучевую терапию с приемом некоторых химиопрепаратов. Используя химиопрепараты в качестве синхронизаторов клеточного цикла (5-фторурацил, платидиам, винкристин и др.), можно на некоторое время задерживать опухолевые клетки в фазе S. Затем большинство клеток синхронно вступает в наиболее радиочувствительные фазы G2 и М, и именно в этот период желательно производить облучение опухоли.
В фазе митоза, наиболее чувствительной к излучению, клетку задерживают винкаалколоиды и таксаны. Гидроксимочевина тормозит цикл в фазе G1. Препараты платины при сочетании с лучевым воздействием тормозят процессы восстановления повреждений опухолевых клеток. Митомицин С – влияет на радиорезистентные клетки в состоянии гипоксии. Применение его в сочетании с лучевой терапией при злокачественных новообразованиях головы и шеи значительно повышает выживаемость больных.
- Терморадиотерапия – сочетание ионизирующего излучения с гипертермией. Повышение местной температуры в опухоли до 42-44 °С вызывает гибель многих клеток злокачественного новообразования. Осуществляют с помощью генераторов электромагнитного излучения в СВЧ-, УВЧ-диапазонах. Используют при лечении больных меланомой, рака прямой кишки, молочной железы, опухоли головы и шеи, саркомы костей и мягких тканей.
- Сочетание лучевой терапии с повышением содержания в опухоли кислорода. Содержание кислорода в опухоли удается повысить искусственным путем. Для этого применяют облучение больных с использованием для дыхания чистого кислорода при обычном давлении (оксигенорадиотерапия) либо в барокамере под давлением 3-4 атм. (оксигенобарорадиотерапия). Особенно эффективно при лучевой терапии недифференцированных опухолей головы и шеи.
В качестве модифицирующего агента также используют электрон-акцепторные соединения (ЭАС) – метронидазол, мизонидазол, имитирующие функцию кислорода – его сродство к электрону.
- Сочетание лучевой терапии с искусственной гипергликемией. В связи с активным поглощением и накоплением опухолевой тканью глюкозы крови, введение глюкозы больному приводит к временной гипергликемии. Что, в свою очередь, приводит к снижению рН в опухолевых клетках. Следовательно, будет повышаться радиочувствительность за счет нарушения процессов пострадиационного восстановления в кислой среде. Поэтому гипергликемию обуславливает значительное усиление противоопухолевого действия ионизирующего излучения.
На основании данных о способах радиосенсибилизации рассмотрим частоту использования трех основных методов повышения радиочувствительности (оксигенобарорадиотерапия, терморадиотерапия, химиолучевая терапия) при различных видах опухолей (табл.2)[1,2].
Реакции клеток на облучение
Читайте также:
- Отравление противопаразитарными, противомалярийными лекарствами и их побочные эффекты
- Медуллярный рак щитовидной железы - лучевая диагностика
- Гематома глазницы: признаки, гистология, лечение, прогноз
- Лучевая диагностика злокачественой опухоли оболочки периферического нерва (ЗООПН) позвоночника
- Варианты доброкачественных опухолей яичников
