Ранее выявление рака яичников. Скрининг населения на рак яичников.
Добавил пользователь Morpheus Обновлено: 28.01.2026
Рак яичников в России находится на 9 месте по распространенности среди всех злокачественных опухолей у женщин и на 7 месте среди причин женской смертности от онкопатологий. Ежегодно он уносит около 8 тысяч жизней. Зачастую рак яичников диагностируют уже на поздней стадии, когда бороться с ним становится намного сложнее. Недавно ученые решили разобраться, помогает ли скрининг в ранней диагностике данного заболевания, и способствует ли это улучшению прогноза для пациенток. Было проведено крупномасштабное рандомизированное исследование, его результаты представлены в журнале The Lancet.
Исследователи проделали большую работу: они собрали данные более 200 тысяч женщин, а затем наблюдали за ними в течение 16 лет. Участницы были случайным образом поделены на три группы:
- женщины из первой группы регулярно проходили скрининг в виде УЗИ органов таза;
- участницы из второй группы регулярно сдавали анализы крови, после чего им выполняли УЗИ;
- третья группа была контрольной, в ней женщины не проходили никаких скрининговых исследований.
Наиболее эффективным оказался вариант с анализами и УЗИ: в этой группе у женщин лучше всего выявляли рак яичников на ранних стадиях. Однако, оказалось, что ни один вид скрининга не помогает повысить выживаемость среди заболевших.
Профессор Уша Менон (Usha Menon), ведущий автор исследования, комментирует результаты:
Это первое исследование, которое показало, что скрининг определенно помогает выявить рак яичников на ранних стадиях. Однако, ни один из проверенных нами подходов не помог снизить смертность среди пациенток. Мы не можем рекомендовать эти скрининговые исследования для всего населения.
Мы разочарованы, потому что проделали большую работу, потратили много лет, и всё же получили не тот результат, которого ожидали. Чтобы спасать жизни, нам нужен другой скрининг, который поможет выявлять рак яичников на более ранних стадиях и у большего числа женщин.
Детали исследования
Участницам исследования было от 50 до 74 лет. В этот интервал попадает средний возраст, в котором у женщин диагностируют рак яичников — в частности, в России он составляет 59,3 года. Наблюдение продолжалось до 2011 года. 100 тысяч женщин попали в контрольную группу, по 50 тысяч — в каждую из групп, где проводился скрининг. Профилактические обследования заключались либо в ежегодных трансвагинальных (специальным датчиком, введенным во влагалище) ультразвуковых исследованиях, либо в ежегодных анализах крови на онкомаркер CA125 с последующим УЗИ как методом диагностики второй линии.
Ученые обнаружили, что, по сравнению с группой без скрининга, в группе, где проводили анализы на онкомаркер, на 39% чаще удавалось выявить рак яичников на I и II стадиях, но на 10% реже — на III и IV стадиях. В группе, где применяли только УЗИ, заболевание выявляли примерно на тех же стадиях, что и в группе без скрининга.
Первоначальный анализ смертности от рака яичников среди участниц исследования был проведен еще в 2015 году. Но в то время не получилось точно определить, снижает ли скрининг смертность. Для этого потребовалось еще пять лет наблюдения.
Профессор Ян Джейкобс (Ian Jacobs), бывший ведущим исследователем в этой работе с 2001 по 2014 год, отмечает:
Стратегия скрининга рака яичников с применением анализа на онкомаркер и УЗИ позволяет выявлять заболевание на ранней стадии, но, к сожалению, не помогает спасать жизни. Мы надеялись, что наша работа поможет предотвратить тысячи смертей, но нас постигло разочарование.
Я надеюсь, что эффективный скрининговый тест всё же будет найден. Однако, его нужно будет проверить в аналогичном испытании. То есть, если такой метод диагностики будет разработан прямо завтра, то может пройти больше десяти лет, прежде чем мы убедимся в его эффективности и начнем проверять всех женщин.
Впрочем, авторы исследования и их коллеги не считают, что многолетняя работа была проделана впустую. Появились наработки, которые в будущем могут быть использованы в других крупных рандомизированных исследованиях с участием здоровых людей. Стало известно, что по крайней мере две стратегии скрининга рака яичников не работают, и нужно искать другие. Пока рекомендации для женщин остаются прежними: если ничего не беспокоит, то проверять яичники не нужно, а если появились любые подозрительные симптомы — нужно немедленно посетить врача.
В клиниках федеральной сети «Евроонко» существуют специальные программы комплексного обследования — чекапы (check-up) для женщин и мужчин. В них включены все необходимые инструментальные исследования, лабораторные анализы, консультации врачей-специалистов. Это хорошая возможность быстро провериться и обнаружить многие болезни на ранней стадии для людей, которые заботятся о своем здоровье, но не хотят тратить много времени на посещение больниц. Свяжитесь с нами, чтобы узнать подробности.
Ранее выявление рака яичников. Скрининг населения на рак яичников.
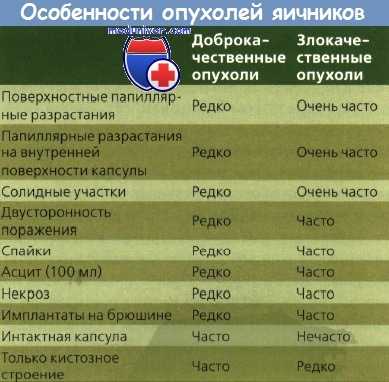
Рекомендации: Не рекомендуется проводить скрининг на рак яичников для асимптоматичных женщин. Целесообразно проверить придатки матки при гинекологическом обследовании по другим поводам.
Эффективность скрининговых тестов на рак яичников.
Потенциально возможными методами скрининга рака яичников являются пальпирование обеими руками таза, -мазок Папаниколау (Пап), цитологический анализ содержимого брюшной полости, опухолевые маркеры и ультразвуковое обследование. Что касается пальпирования таза, которое позволяет выявить целый ряд гинекологических заболеваний, то о его чувствительности и специфичности относительно рака яичников ничего неизвестно, однако можно утверждать, что небольшие опухоли яичников на ранней стадии часто при пальпировании не дискриминируются в силу того, что анатомически они располагаются глубоко от поверхности, отсюда рак яичников, обнаруженный пальпированием, обычно находится в прогрессирующей стадии и шансы на выживание оказываются невелики. К тому же обследование таза может дать ложно-положительные результаты, когда пальпируются доброкачественные массы придатков (например, функциональные кисты).
Мазок Папаниколау иногда может обнаружить злокачественные клетки яичников, однако его не считают надежным способом скрининга для определения карциномы яичниников. В исследованиях было показано, что мазок Пап имеет чувствительность только 40% при определении рака яичников, а некоторые авторы приводят еще более низкие показатели (10—30%). Еще один тест, который потенциально может быть использован для выявления рака,— цитологический анализ содержимого брюшной полости, полученного при пункции Дугласа,— также считается неподходящим для рутинного скрининга. Процедура малоприменима в качестве первичной меры, она сложна в техническом отношении, неудобна для пациента и имеет малую чувствительность в обнаружении заболевания на ранней стадии. В одной работе было показано, что только 36% пациентов, у которых рак яичников находился на стадии 1, имели положительный цитологический результат при выполнении пункции Дугласа до диагностической лапаротомии. Это исследование обнаружило также плохое прогностическое значение теста: только 5,4% женщин, у которых результаты цитологического анализа были положительными, действительно впоследствии были поражены раком яичников.
Раковые маркеры тоже обнаруживают более высокий титр при анализе крови у женщин с раком яичников. В качестве таких маркеров можно назвать канцероэмбриональный антиген, антиген кистоаденоматозного рака яичников, опухолевый антиген СА-125. Титр СА-125 у женщин с раком яичников III и IV стадии находят увеличенным у 82% женщин, он бывает увеличенным также и на более ранней стадии, но реже. Измерения, выполненные до диагностической лапаротомии, показали, что титр СА-125 оказался увеличенным у половины женщин, имевших опухоль I стадии; предоперативное увеличение наблюдается чаще у женщин с немуциновыми опухолями. Однако в целом эти случаи нерепрезентативны для асимптоматичных женщин в общей массе населения. Неизвестно, возрастает ли титр маркеров достаточно рано в процессе развития рака яичников, чтобы служить надежно чувствительным средством обнаружения. Недавно выполненное исследование показало, что увеличенный титр СА-125 (больше 30 единиц на мл) наличествовал в 24% проб крови, взятых у женщин за 5 и более лет до диагноза рака яичников. В то же время необходимо продолжить исследования для получения более надежных данных по чувствительности этих и других раковых маркеров с целью распознавания на ранней стадии рака яичников у асимптоматичных женщин.
Раковые маркеры имеют недостаточную специфичность. Сообщают, что титр СА-125 увеличен у 1% здоровых женщин, у 6—40% женщин с доброкачественными образованиями (например, фиброидные образования в матке, воспаление эндометрия, псевдокисты поджелудочной железы, легочная гематома) и у 29% женщин с негинекологическими раковыми заболеваниями (например, поджелудочная железа, желудок, прямая кишка, грудная железа). Возможно, можно улучшить специфичность измерения с помощью СА-125 за счет селективного скрининга женщин после менопаузы, за счет изменения в технике наборов, за счет сочетания использования СА-125 и ультразвукового обследования. Необходимы однако долгосрочные работы, чтобы иметь достоверные данные о том, какие результаты могут дать такие подходы при использовании в качестве скрининговых тестов. В качестве скринингового теста для выявления рака яичников использовали также ультразвуковое изображение, поскольку оно позволяет точно определить размер яичника, выявить опухоли размером до 1 см, а также отличать плотное образование от кисты. Однако исследования показали, что ультразвуковое обследование дает недостаточный эффект в определении рака яичников и генерирует целый ряд ложно-положительных результатов, которые влекут за собой диагностическую лапа-ротомию или лапароскопию. В одной работе ультразвуковой скрининг 805 женщин, относившихся к группе повышенного риска, побудил выполнить 39 лапаротомии, которые показали 1 рак яичников, 2 близкие к злокачественным опухоли, 1 рак слепой кишки и пять цистоаденом. В одной более обширной работе ультразвуковому обследованию были подвергнуты 5678 асимптоматичных женщин-добровольцев старше 45 лет, у которых в анамнезе был рак груди или гинекологический рак. В течение 2 лет было выполнено 6920 ультразвуковых снимков, по которым было определено 2 случая рака яичников I стадии. В одной недавно выполненной работе из того же центра опубликованы предварительные данные, согласно которым из 14356 ультразвуковых обследований, проведенных в течение 3 лет на 5489 асимптоматичных женщинах старше 45 лет, в пяти случаях был обнаружен рак яичников. Хотя показатели чувствительности и специфичности этого теста отличны (100% и 94,6% соответственно), прогностический эффект в массе асимптоматичных женщин оказывается очень низким — 2,6%. По этим и другим данным было подсчитано, что ультразвуковой скрининг 100 тысяч женщин старше 45 лет позволил бы обнаружить 40 случаев рака яичников — но это за счет 5398 ложно-положительных результатов и 160 осложнений в результате диагностической лапаротомии.
Точность ультразвука можно улучшить за счет сочетания его с другими скрининговыми тестами, такими, как использование маркера СА-125. Такой подход оказался полезным, когда речь идет о дискриминации между злокачественными и доброкачественными образованиями в придатках перед выполнением операции, однако необходимы дальнейшие исследования для определения чувствительности, специфичности и прогностической ценности выполнения этих тестов в комбинации со скринингом асимптоматичных женщин. В одном прогностическом исследовании был проведен скрининг 1010 асимптоматичных женщин в возрасте старше 45 лет после менопаузы. Тест включал в себя осмотр таза в сочетании с раковыми маркерами СА-125. При получении отклоняющегося от нормы результата дополнительно проводилось обследование ультразвуком. Хотя при этом удалось обнаружить один рак яичников (у этой женщины результаты всех трех тестов скрининга были положительными), исследование показало также плохую прогностическую перспективу каждого из трех тестов. У 28 из 31 женщины с увеличенным титром СА-125 никаких патологий обнаружено не было. В половине из 28 обследований таза, обнаруживших отклонения, речь шла о фиброидах и доброкачественных кистах. Насчитывалось 13 ультразвуковых снимков с отклонениями от нормы. 12 из этих женщин были выполнены лапаратомии которые дали 6 положительных кист в яичниках, две бахромчатые кисты, у двух женщин хирургия не дала никаких результатов, у одной женщины были спайки, и у одной рак яичников.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Диагностика стадии рака яичника

Обычное гинекологическое исследование позволяет выявить только 1 случай рака яичников (РЯ) на 10 000 пациенток без клинических симптомов, тем не менее оно продолжает оставаться самым распространенным методом диагностики ранних стадий заболевания. Боль — симптом поздних стадий заболевания; на ранней стадии она возникает только при разрыве опухоли, перекруте ножки опухоли или ее инфицировании.
Если врач пальпирует яичник у женщины, у которой менопауза наступила 3 года назад и более, он должен проявить высокую онкологическую настороженность и подумать о раннем раке яичников (РЯ). При обнаружении типичных УЗ-признаков (например, сложное образование диаметром более 5 см или внутрикистозные разрастания) показано безотлагательное выполнение лапароскопии или лапаротомии.
Обычные лабораторные исследования не играют большой роли в диагностике опухолей яичника; чаще их используют для исключения другой патологии органов таза. УЗИ или обзорная рентгенография брюшной полости позволяет выявить обызвествление миоматозныхузлов или кальцификаты в форме зубов при доброкачественных тератомах. На основании внутривенной пиелографии можно исключить поражение смежных структур таза.
Ирригоскопия показана при любом объемном образовании в тазу, а также у женщин в постменопаузе с клиническими симптомами, характерными для заболеваний нижних отделов толстой кишки. Коло-носкопию и эндоскопическое исследование верхних отделов ЖКТ проводят при наличии соответствующих симптомов. КТ с контрастированием позволяет оценить степень распространенности процесса; однако объемное образование в тазу у пациентки в постменопаузе — показание к операции независимо от результатов обследования.
Исход рака яичников (РЯ) зависит от ранней диагностики, поэтому длительное обследование с применением многочисленных методов опасно. Лапаротомия — окончательный и самый точный метод диагностики. Лапароцентез для цитологического исследования перитонеальной жидкости бесполезен, т. к. нередко можно получить ложноотрицательные результаты, а иногда даже опасен, поскольку может привести к попаданию содержимого злокачественной опухоли в брюшную полость. Лапаротомию выполняют в любом случае для удаления большой доброкачественной опухоли или определения распространенности злокачественного процесса, независимо от того, содержатся злокачественные клетки в жидкости из брюшной полости или нет.
Необходимо подчеркнуть, что число отрицательных результатов цитологического исследования асцитической жидкости у пациенток с истинными злокачественными опухолями яичников приближается к 50 %.
Еще раз напомним: для больной с асцитом и наличием опухолевидного образования в тазу диагностический лапароцентез не считается обязательной диагностической процедурой и несет потенциальную опасность.

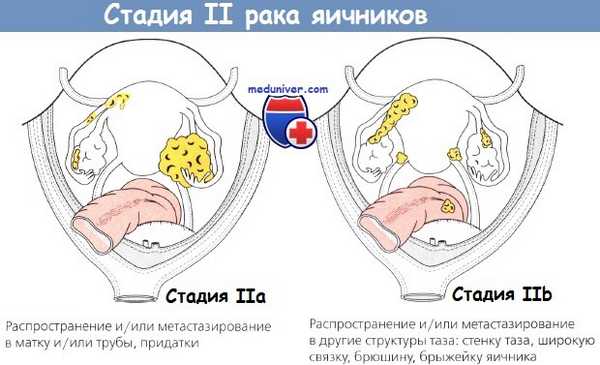
Стадию рака яичников (РЯ) устанавливают во время хирургического вмешательства, до основного этапа операции. Для облегчения удаления опухоли, адекватного исследования брюшной полости и нижней поверхности диафрагмы выполняют срединную лапаротомию. Классический рак яичников (РЯ) — заболевание, распространяющееся по серозным покровам, поэтому показано тщательное исследование брюшины, особенно в тех случаях, когда полагают, что процесс ограничен только малым тазом.
Несмотря на то что метастазирование в забрюшинные лимфоузлы типично для рака яичников (РЯ), заболевание чаще распространяется интраперитонеально и отделившиеся флотирующие клетки первичной опухоли могут имплантироваться на любом участке брюшины. Любое количество жидкости из брюшной полости отправляют на цитологическое исследование.
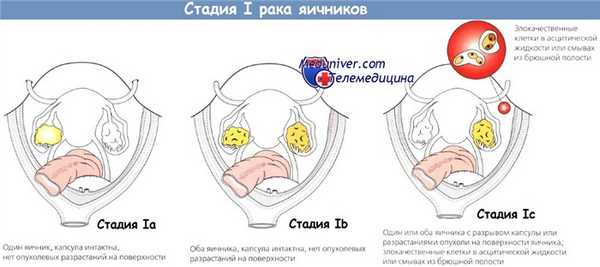
При ее отсутствии проводят 4 смыва (с нижней поверхности диафрагмы, обоих боковых каналов и брюшины таза) с использованием на каждый из них 50—75 мл 0,9% раствора натрия хлорида. Тщательно осматривают и пальпируют всю брюшину, обращая особое внимание на нижнюю поверхность диафрагмы, печень, боковые каналы, брыжейку тонкой и толстой кишки.
Для освещения особенно удобно использовать волоконно-оптические источники, которые помогают исследовать верхние отделы живота через вертикальный нижнесрединный разрез. Исследуют большой сальник и проводят биопсию или иссечение всех подозрительных участков. Если заболевание действительно ограничено тазом, показано удаление смежной части сальника или любого его участка, спаянного с органами таза. Часто сальник внешне не изменен и обнаруживают только микроскопические метастазы. Рекомендуемая последовательность операции представлена в таблице ниже.
Если опухоль ограничена полостью таза, необходимо соблюдать осторожность во избежание ее разрыва во время удаления. Все утолщенные или подозрительные поверхности в брюшной полости должны быть удалены как биопсийный материал. Это касается и спаек, которые не рассекают, а полностью иссекают, поскольку в них часто обнаруживают микроскопические признаки метастазов. Было проведено несколько исследований с целью оценить эффективность «слепого» метода биопсии брюшины и стандартной диссекции забрюшинных лимфоузлов для точной диагностики раннего РЯ. Любая отличающаяся по внешнему виду поверхность признается подозрительной и требует проведения биопсии.
Для планирования лечения и определения точного прогноза важно правильно установить стадию заболевания.
По данным недавнего исследования, при последовательном проведении позитронно-эмиссионной томографии (ПЭТ) с использованием глюкозы, меченной изотопом фтора-18, — 2-[18F]фтор-2-дезокси-D-глюкозы (ФДГ) — можно прогнозировать реакцию на неоадъювантную терапию. Avril и соавт. установили, что медиана общей выживаемости у пациенток с метаболическим ответом (по данным ФДГ-ПЭТ) составляла 38,3 мес, при его отсутствии — 23,1 мес, а 2-летняя выживаемость — 76 и 43 % соответственно.
Методика получения смывов из поддиафрагмального пространства для цитологического исследования во время лапаротомии.
Проводят промывание пространства между печенью и диафрагмой 0,9% раствором натрия хлорида, жидкость из боковых карманов аспирируют шприцем
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Диагностика и лечение опухолей яичника: Введение. Эпидемиология.
Проблема диагностики и лечения новообразований яичников является одной из самых трудных разделов онкогинекологии. У большинства больных злокачественными опухолями яичников заболевание выявляется на поздних стадиях, а результаты их лечения остаются неутешительными. Несмотря на высокую чувствительность многих современных методов диагностики, их специфичность недостаточна для дифференциации доброкачественного и злокачественного процессов в яичниках, что не может обеспечить эффективный скрининг для раннего выявления злокачественных опухолей. Общая пятилетняя выживаемость больных раком яичников не превышает 35-40%.
1. ЭПИДЕМИОЛОГИЯ
1.1. ЗАБОЛЕВАЕМОСТЬ, СМЕРТНОСТЬ И ВЫЖИВАЕМОСТЬ
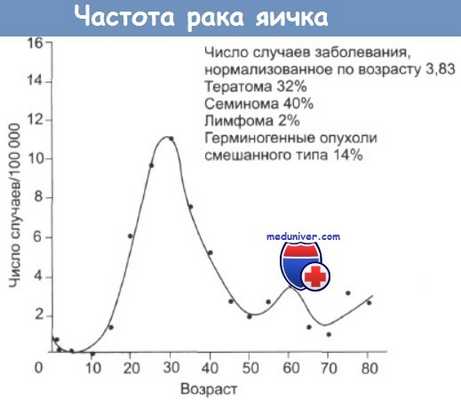
Большинство опухолей яичников являются эпителиальными. Все опухоли могут быть разделены на доброкачественные и злокачественные. Статистические сведения о частоте опухолей яичников в женской популяции касаются только их злокачественных форм. Среди злокачественных опухолей женских половых органов опухоли яичников (карциномы, стромальноклеточные и герминогенные опухоли) занимают третье место после рака шейки и тела матки, их доля достигает 30%. Среди всех злокачественных новообразований у женщин рак яичников занимает седьмое место по частоте, составляя 4-6%. По данным Международного агентства по изучению рака (МАИР) ежегодно в мире регистрируется более 165 000 новых случаев рака яичников, и более 100 тыс. женщин погибают от злокачественных новообразования яичников. Если удельный вес (%) рака яичников в онкологической заболеваемости женщин во всех странах мира примерно одинаков, то частота заболеваемости на 100000 женского населения (%ооо) значительно варьирует. В Европе, особенно в Северных странах и Великобритании, а также в Северной Америке, стандартизованные показатели заболеваемости наиболее высокие (10 и более на 100 000). В Центральной и Южной Америке, Африке и Азии, включая индустриальные страны, такие как Япония, но исключая Израиль, эти показатели значительно ниже (7 и менее на 100 000). За последние 20 лет уровни заболеваемости раком яичников в большинстве стран с высоким риском (Скандинавия, Великобритания, США, Канада) остаются стабильными и даже несколько снижаются. В то же время отмечено повышение заболеваемости в странах с низким риском, таких как Япония, Индия, Сингапур, а также в некоторых странах Южной и Восточной Европы (Португалия, Испания, Югославия, Польша). В России ежегодно рак яичников выявляется более чем у 11 000 женщин (10, 17 на 100 000), занимая седьмое место в структуре общей онкологической заболеваемости (5%) и третье — среди гинекологических опухолей после рака тела и шейки матки [2]. За последние 10 лет в стране произошел прирост заболевания на 8, 5%.
Интерпретация трендов в заболеваемости раком яичников крайне затруднительна, особенно в экономически развитых странах. С одной стороны, необходимо учитывать широкое применение оральных контрацептивов, обладающих протективным эффектом, подобным эффекту родов и лактации. С другой стороны, сокращение в цивилизованных странах числа беременностей и родов, приводящее к «непрекращающейся овуляции», возможно, способствует повышению риска развития неоплазии в яичнике, как и применение препаратов, стимулирующих овуляцию при лечении бесплодия, и эстрогенов в терапии климактерических расстройств. Кроме того, нельзя не учитывать и фактор питания. Повышенное потребление животных белков в рационе не исключает увеличения риска заболевания раком яичников.
По показателям смертности рак яичника опережает рак тела и шейки матки, занимая 5-е место среди причин смерти от всех опухолей у женщин. В большинстве индустриальных стран мира рак яичников имеет самые высокие показатели смертности среди всех гинекологических опухолей, что связано с поздней диагностикой заболевания. Летальность больных раком яичников на первом году после установления диагноза составляет 35%. По сводным данным популяционных раковых регистров стран Европы, однолетняя выживаемость больных раком яичников составляет 63%, трехлетняя — 41%, пятилетняя — 35%. За последнее десятилетие отмеченное в Европе увеличение пятилетней выживаемости больных злокачественными опухолями яичников на 3% (с 32% до 35%), а в США — на 4% (с 36% до 39%) объясняется не столько улучшением диагностики, сколько эффективным применением платиновой химиотерапии в лечении диссеминированных форм рака яичников и герминогенных опухолей. Риск заболеть раком яичника на протяжении жизни составляет 1,5%, и 1 из 100 женщин может умереть от этого заболевания [92].
1.2. ЭТИОЛОГИЯ
Причины возникновения большинства опухолей яичников остаются неизвестны. Обзоры эпидемиологических исследований указывают на высокую частоту рака яичника в индустриальных странах, за исключением Японии. Возможно, это обусловлено диетическими факторами, а именно, высоким потреблением животных жиров [34, 60], хотя последние исследования [71] не подтверждают связи развития рака яичников ни с высококалорийной пищей, ни с употреблением алкоголя, кофеина и никотина [60]. Нет и убедительных доказательств возможного канцерогенного эффекта радиации, применяемой в диагностических и терапевтических целях, в развитии рака яичников, хотя в эксперименте модели опухолей яичников создавали путем облучения грызунов рентгеновскими лучами или при помощи пересадки ткани яичника в селезенку или другие органы портальной системы. В нескольких исследованиях развитие карцином яичников связывают с использованием талька в гигиенических целях [45].
Наибольшая роль в развитии рака яичников в настоящее время отводится гормональным и генетическим факторам. В многочисленных эпидемиологических исследованиях отмечено, что беременность снижает риск возникновения рака яичников, а большое число беременностей обладает значительным защитным действием [36]. Бесплодие же повышает риск развития рака яичников, а препараты, стимулирующие овуляцию в течение более 12 циклов, увеличивают этот риск в 2-3 раза [63, 87]. В то же время, применение оральных контрацептивных препаратов снижает риск возникновения этого вида рака. В большом исследовании, проводившемся под эгидой ВОЗ, относительный риск развития рака яичников у женщин, когда-либо принимавших оральные контрацептивы, составил 0,75 [79]. Прием оральных контрацептивов в течение 5 лет у нерожавших женщин снижает риск до уровня рожавших [37]. Однако необходимо отметить, что длительный прием эстрогенов в менопаузе не ассоциируется с увеличением риска рака яичников в отличие от рака молочной железы и эндометрия [13]. Рак молочной железы в анамнезе увеличивает риск рака яичников в 2-4 раза, так же как и риск рака молочной железы повышен у больных раком яичника. Объяснения гормональным факторам, выявленным в многочисленных эпидемиологических исследованиях, можно найти в «овуляторной» гипотезе, постулирующей, что риск развития рака яичников находится в прямой зависимости от числа овуляторных циклов на протяжении жизни женщины [24, 35]. Покровный эпителий яичника, из которого развивается большинство опухолей, подвергается пролиферации и репарации после каждого овуляторного цикла. Чем больше число овуляций, тем выше потенциальный риск отклонений в репаративных процессах, что ведет к злокачественной трансформации.
Наследственный фактор является одним из важных факторов риска в развитии рака яичников, хотя большинство карцином яичника (95%) являются спорадическими по своей природе и их риск развития в популяции не превышает 1,5%, т. е. заболевает 1 из 100 женщин. Тогда как к наследственным формам могут быть отнесены только 5% случаев рака яичника, риск развития заболевания может возрастать до 50%, т. е. заболевает каждая вторая [6]. В настоящее время описаны три синдрома наследственной предрасположенности к возникновению рака яичника: семейный рак яичников, семейный рак молочной железы/яичников, синдром Линча II.
Семейный рак молочной железы /яичников. В таких семьях ближайшие родственницы заболевают раком молочной железы в молодом возрасте (до 50 лет) и раком яичников. Степень риска заболеть раком этих локализаций также определяется числом заболевших родственниц различной степени родства. Кроме того, как уже упоминалось, у женщин, ранее заболевших раком молочной железы или яичников, риск развития второй опухоли в 2-4 раза выше, чем в популяции.
Синдром Линча II. При этом синдроме в семьях среди ближайших родственников прослеживается заболеваемость аденокарциномами различных локализаций, преимущественно колоректальным раком, раком молочной железы и эндометрия, раком яичников. Риск возникновения аденокарциномы среди членов семьи также зависит от числа заболевших родственников, и он в любом случае выше в 2 раза, чем в популяции [46].
Недавно были идентифицированы гены BRCA1 в хромосоме 17 ql2-21 и BRCA2 в хромосоме 13 ql2, которые оказались ответственными за возникновение наследственных форм рака молочной железы и рака яичников. Выявление при описанных семейных синдромах мутаций в этих генах свидетельствует о наследственной передаче злокачественной опухоли. Однако рутинное генетическое тестирование ограничено по нескольким причинам. Во-первых, определение возможной точечной мутации на протяжении более 100 000 основании гена у больной и ее родственников при выявленном семейном синдроме остается весьма трудоемким, дорогостоящим и не всегда эффективным даже в современных генетических лабораториях. Во-вторых, генетическое тестирование наследственных форм рака яичников и молочной железы несет в себе этические и социальные проблемы. Отсутствие мутации генов BRCA1 и BRCA2 у обследуемой пациентки не исключает развития спорадических форм этих злокачественных опухолей. Выявление же мутаций генов BRCA1 и BRCA2 у здоровых носительниц ставит вопрос о рекомендациях по ранней диагностике и профилактике заболевания, которые во многом не решены в отношении скрининга рака яичника.
В табл. 1 определены критерии умеренного риска возникновения наследственного рака яичника [6].
1. Две родственницы 1* степени родства с наличием рака яичников в анамнезе
2. Одна родственница 1 степени родства с диагнозом рака яичников и одна родственница 1 степени с диагнозом рака молочной железы в возрасте моложе 50 лет
3. Одна родственница 1 степени родства с диагнозом рака яичников и две родственницы 1 и/или 2** степени с диагнозом рака молочной железы в возрасте моложе 60 лет
4. Наличие мутации гена BRCA1 или BRCA2, ответственных за возникновение рака яичников
5. Три родственницы 1 и/или 2 степени родства с диагнозом рака толстой кишки и один случай рака яичников
* Родственницы 1 степени родства — мать, дочь, родная сестра
** Родственницы 2 степени родства — бабушка, внучка, двоюродная сестра, тетя, племянница
Представленные эпидемиологические данные касаются эпителиальных злокачественных опухолей, т. е. рака яичников. В происхождении неэпителиальных опухолей (стромально клеточных и герминогенных), поражающих женщин преимущественно молодого возраста и детей, основная роль отводится неблагоприятным факторам в период эмбриогенеза. В развитии гранулезоклеточных опухолей также отмечена связь с гиперстимуляцией яичников кломифенцитратом или гонадотропинами при лечении бесплодия. По мнению Wiliemsen [S8], гиперстимуляция, возможно, способствует росту уже существующей опухоли или же возросший уровень фолликулостимулирующего гормона индуцирует канцерогенез в гранулезоклеточной ткани, хотя не исключается и случайное совпадение.
1.3. ПАТОГЕНЕЗ
Эпителиальные опухоли составляют 60% всех новообразований яичников и 80-90% их злокачественных форм. Остальные опухоли возникают из зародышевых и стромальных клеток. Эпителиальные опухоли развиваются из покровного эпителия яичников, т. е. из серозы. В течение эмбриогенеза выстилка целомической полости состоит из мезотелиальных клеток мезодермального происхождения, при этом гонадный валик покрыт серозным эпителием. Мюллеровы протоки, которые дают начало фаллопиевым трубам, матке и влагалищу, являются результатом инвагинации мезотелиальной выстилки. Клетки эпителиальных опухолей могут напоминать различные варианты дифференцировки мюллеровского типа. Серозные опухоли могут иметь сходство с фаллопиевой трубой, муцинозные — с эндоцервиксом, эндометриоидные — с эндометрием. Клетки герминогенных (эмбриональных) опухолей развиваются из зародышевых клеток, мигрирующих в гонады. Мезенхима является источником развития стромы яичника, и стромально клеточные опухоли развиваются из этих клеток.
Согласно овуляторной гипотезе возникновения эпителиальных опухолей, циклическая пролиферация покровного эпителия при непрерывных овуляторных циклах ведет к формированию кист включения. В дальнейшем под влиянием различных гормонов, вырабатываемых в строме яичника, пролиферирующие эпителиальные клетки могут формировать аденомы. Высокий уровень гонадотропинов также может обладать стимулирующим эффектом на пролиферирующий эпителий. Однако остается спорным, что цистаденомы являются предшественниками опухолей с низкой степенью злокачественности (пограничных), которые, в свою очередь, развиваются в инвазивные формы эпителиальных карцином. Последние молекулярно-генетические исследования выявили, что гистологически доброкачественные кисты с очагами малигнизации имели мутации гена р53, ответственного за супрессию опухоли, тогда как в доброкачественных опухолях без очагов малигнизации не было отмечено мутации гена р53 [96]. Тем не менее, пограничные опухоли также не имели мутации р53 [76]. Исследователи полагают, что часть цистаденом генетически предрасположены к развитию инвазивной злокачественной опухоли, а молекулярно-генетическое поведение пограничных опухолей имеет другой характер.
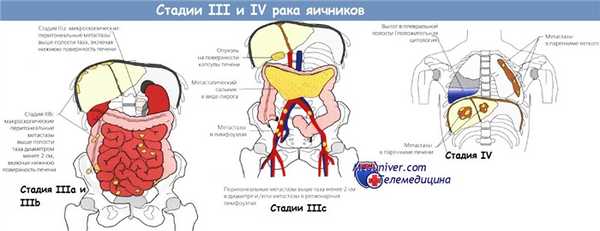
В большинстве случаев злокачественного течения эпителиальных опухолей яичников диссеминация происходит путем эксфолиации опухолевых клеток с поверхности пораженной яичниковой ткани с током внутрибрюшинной жидкости по всей брюшной полости, поражая париетальную и висцеральную брюшину, преимущественно правую половину диафрагмы и капсулу печени. Кроме того, сальник является излюбленным местом метастазирования рака яичников. Лимфогенные метастазы встречаются чаще при уже распространенном раке яичника в брюшной полости. Однако у 10-20% больных с локализованными формами рака яичников могут быть метастазы в забрюшинных лимфатических узлах [58]. Метастазирование в парааортальные лимфатические узлы осуществляется через подвешивающую связку яичника, в тазовые — через широкую связку и параметрии, в паховые — через круглую связку. Лимфогенное метастазирование как первый этап диссеминации более характерен для герминогенных опухолей. Наряду с нарушением нормального оттока лимфы с увеличением проницаемости канцероматозно измененной брюшины появляется асцит, в дальнейшем присоединяется плеврит, чаще правосторонний. У 2-3% больных возможно гематогенное метастазирование с поражением печени, костей, головного мозга. Не исключается прямое прорастание опухоли яичников в ректо-сигмоидный отдел кишки, мочевой пузырь.
Скрининг женщин на рак яичников (ранняя диагностика)
Поскольку разные опухоли яичников обладают сходной клинической картиной, диагноз раннего рака яичников (РЯ) скорее дело случая, а не триумф научного метода. Увеличение яичника вызывает прогрессирующую компрессию тазовых структур с неопределенным дискомфортом в животе, диспепсией, учащенным мочеиспусканием и чувством давления в тазу. Незаметное начало рака яичников (РЯ) не позволяет идентифицировать специфические симптомы. Когда опухоль достигает 15 см в диаметре, отмечается незначительное увеличение живота. Поскольку заболевание протекает скрыто, без патогномоничных ранних симптомов, пациенткам следует рекомендовать обращать внимание на минимальные изменения самочувствия.
Неопределенный абдоминальный дискомфорт, диспепсия и другие едва заметные расстройства пищеварения могут возникать за несколько месяцев до установления диагноза. Такие жалобы часто объясняют «несварением, свойственным среднему возрасту». Требуется высокая онкологическая настороженность в отношении рака яичников (РЯ) у всех женщин 40—69 лет со стойкими желудочно-кишечными симптомами при отсутствии выявленной патологии со стороны ЖКТ. К сожалению, большая часть таких неспецифичных жалоб обусловлена функциональными расстройствами и врач общей практики не думает о возможности злокачественной опухоли яичников. Правильный диагноз часто устанавливают только при значительном увеличении живота за счет асцита и распространения процесса по брюшной полости.
Цитологическое исследование аспирата из прямокишечно-маточного углубления и частое гинекологическое исследование не влияют на раннюю диагностику заболевания. Опухоли яичников растут быстро и безболезненно, любое длительно существующее объемное образование служит показанием коперации. Точныйдиагноз устанавливают только на основании морфологического исследования; тяжесть заболевания не зависит от размера опухоли. Некоторые самые большие опухоли — доброкачественные, чаще всего это муцинозные цистаденомы. Кроме того, многие объемные образования в проекции придатков матки не исходят из яичников. Как правило, они связаны с дивертикулитом, тубоовариальным абсцессом, раком слепой или сигмовидной кишки, тазовой дистопией почки, субсерозными, интрамуральными и интралигаментарными миомами.
Во время операции иногда трудно дифференцировать злокачественные и доброкачественные опухоли яичников. Значительное совпадение морфологических критериев злокачественных новообразований этой локализации представляет определенные диагностические трудности. Точный диагноз устанавливают только на основании гистологического исследования удаленного препарата. Ошибочные результаты срочного гистологического исследования получают в 5 % случаев.
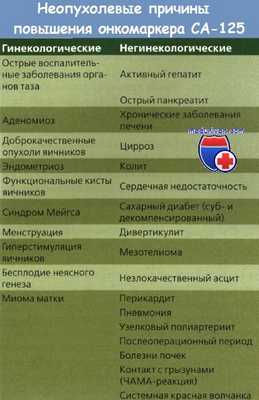
Остается надеяться, что иммунологическая диагностика субклинического рака яичников (РЯ) по специфическим опухолевым антигенам сыворотки — дело недалекого будущего. К настоящему времени обнаружили и выделили несколько опухоль-ассоциированных антигенов, включая СА-125. Достоверность современного изучения структуры белковых фрагментов у больных РЯ нуждается в подтверждении при проведении исследований с большим количеством пациенток.
Для ранней диагностики рака яичников (РЯ) и исключения скрытого заболевания каждой женщине необходимо регулярно проходить исследование у гинеколога, УЗИ органов таза и определение уровня СА-125. Но при этом подсчитали, что для выявления 1 случая раннего рака яичников (РЯ) в популяции пациенток без клинических симптомов необходимо провести 10 000 бимануальных исследований. Jacobs и соавт. провели скрининг СА-125 у 22 000 женщин в постменопаузе старше 45 лет, средний период наблюдения составил 6,76 года. Выявили 49 случаев РЯ и рака маточных труб: 16 (32 %) — 1 стадии, 4 — II, 22 — III, 7 — IV стадии. В этой группе в 1180 (2,5 %) образцах из общего количества 47 775 образцов у 767 (3,5 %) женщин концентрация СА-125 составляла 30 ед./мл.
Специфичность и прогностическая ценность положительного результата равнялись 96,6 и 3,1 % соответственно. Чувствительность 1-и 7-летнего наблюдения составляла 75 и 57 % соответственно. Только у 49 (6,3 %) женщин с повышенным уровнем СА-125 (16 %) обнаружили рак яичников (РЯ), что составляет 0,0022 % всех участниц скринингового обследования. Отметим, что скрининг рака яичников (РЯ) с определением СА-125 не организован для всех женщин в постменопаузе. Продолжая контроль над этими 22 000 женщинами, Jacobs разделил их на две группы: проходящие ежегодный скрининг в течение 3 лет и находящиеся под наблюдением.
В группе ежегодного скрининга выявили 6 случаев рака яичников (РЯ), поровну I и III стадии; при этом у 468 женщин с повышенным уровнем СА-125 выполнено 781 УЗИ, 29 диагностических лапаротомий и получено 80 % ложноположительных результатов. При последующем наблюдении после скрининга дополнительно выявили 10 случаев рака, из них 8 — III и IV стадий. В группе наблюдения (без скрининга) впоследствии диагностировали 20 случаев рака, из них 8 — III и IV стадий. Хотя в группе скрининга шанс ранней диагностики был выше, общее число случаев оставалось низким, что отражает уровень заболеваемости. Как уже отмечали раньше, определение СА-125 в качестве скринингового теста, особенно у женщин в пременопаузе, не представляется эффективным методом обнаружения рака яичников (РЯ). Концентрация СА-125 увеличена при многих доброкачественных процессах и злокачественных опухолях ЖКТ. Особое внимание для скрининга раннего рака яичников (РЯ) привлекает ультрасонография.
Herrmann сравнил результаты УЗИ у 312 пациенток, полученные до хирургического лечения, с данными из протоколов операций и установил, что прогностическая ценность метода составляет 73 %.
Campbell и соавт. сообщили о ранней диагностике 5 случаев первичного рака яичников (РЯ) при УЗИ органов брюшной полости примерно у 5000 пациенток. Трансвагинальное УЗИ повышает не только точность диагностики объемных образований придатков, но и стоимость обследования, особенно когда речь идет о длительном наблюдении женщин с увеличенными яичниками. Группа специалистов из Кентукки провела трансвагинальные УЗИ в большой группе женщин в постменопаузе, а также у более молодых, если у них были указания в семейном анамнезе на наличие рака яичников (РЯ) (24 %). Скрининг провели 6470 женщинам, выполнив 14 829 УЗИ; у 90 пациенток выявили персистирующие образования при трансвагинальном УЗИ и провели хирургическое лечение. Обнаружено 6 первичных злокачественных опухолей яичников (пять I стадии и одна — III ), из них только в 4 случаях выявлен эпителиальный рак.
Чувствительность метода составила 0,857, специфичность — 0,987, прогностическая ценность положительного результата — только 0,069, а отрицательного — 0,999.
Одно из возможных направлений улучшения эффективности скрининга рака яичников (РЯ) — обследование пациенток из группы повышенного риска, например с семейным анамнезом заболевания. Bourne и соавт. сообщили о результатах наблюдения за 1601 женщиной с применением трансвагинального УЗИ, цветного допплеровского картирования и морфологического исследования. Повторное трансвагинальное УЗИ для подтверждения диагноза объемного образования выполнено у 57 % пациенток, РЯ диагностировали в 6 случаях (2 — I стадии, 3 — низкой степени злокачественности, 1 — III стадии). Karlan и соавт. провели скрининг у 597 пациенток с семейный анамнезом рака яичников (РЯ): определение уровня СА-125, трансвагинальное УЗИ и цветное допплеровское сканирование. Первоначально при выполнении трансвагинального УЗИ у 115 пациенток обнаружили патологию, а у 68 — повышенный уровень СА-125.
По результатам цветного допплеровского исследования и повторного трансвагинального УЗИ 19 женщинам выполнили операцию и обнаружили только одну опухоль низкой степени злокачественности.
Bell и соавт. проанализировали 25 скрининговых исследований рака яичников (РЯ): в 16 участвовали женщины со средним риском и в 9 — с высоким. Во многих исследованиях былоо малое число обследованных женщин с неточным соблюдением методики; в немногих отражены детали наблюдения. В ряде исследований применяли один метод скрининга, в других — несколько. В группе пациенток со средним риском 75 % случаев первичного рака приходилось на I стадию, если использовали только УЗИ, и 50 %, если применяли несколько методов скрининга.
*ЧАМА — человеческие анти-мышиные антитела
При высоком риске во время скрининга выявили 60 % опухолей I стадии, но после исключения новообразований низкой степени злокачественности этот показатель снизился до 25 %. В популяции высокого риска количество ложноотрицательных результатов было выше.
Такой уровень ложноотрицательных результатов в популяции с ежегодной заболеваемостью 40 случаев на 100 000 женщин означает, что при каждом случае рака, выявленного с применением ежегодной эхографии по серой шкале, выполняют 30 — 60 операций (предполагая 100%-ю чувствительность), а при использовании мультимодального скрининга — 2,5—15 вмешательств. Даже при выявлении рака яичников (РЯ) благодаря скринингу и лечению всех случаев рака яичников (РЯ) со 100%-м успехом абсолютное снижение смертности составит всего 1 случай на 2500 женщин, прошедших скрининг в течение года. Это намного меньше числа осложнений от ненужных диагностических операций и избавляет от необходимости многократного повторения диагностических тестов.
Несмотря на проведенные рандомизированные клинические испытания, пока нет надежных данных о том, что скрининг рака яичников (РЯ) эффективно улучшает продолжительность и качество жизни пациенток. Другой путь повышения чувствительности и специфичности скрининга рака яичников (РЯ) состоит в определении нескольких маркеров опухоли, поскольку СА-125 повышен менее чем у 50 % больных раком яичников (РЯ) I стадии. В то время как исследования в этом направлении не увенчались успехом, недавние достижения в протеомике (область науки, изучающая белки и их взаимодействия в организме) вселяют надежду на открытие нового, более эффективного метода скрининга рака яичников (РЯ). Эти биомаркеры можно использовать при выборе метода лечения и прогнозировании его эффективности.
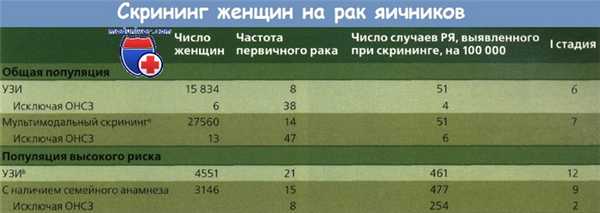
a Кроме УЗИ определяли также уровень СА-125.
b С определением уровня СА-125 или без него.
ОНСЗ - опухоли низкой степени злокачественности.
Выводы National Institutes of Health Consensus Development Conference поданным скрининга РЯ за 1994 г. представлены ниже.
До настоящего времени отсутствуют данные об эффективном использовании определения СА-125 и трансвагинального УЗИ для скрининга с целью снизить заболеваемость и смертность от рака яичников (РЯ). Стандартный скрининг приводит к выполнению ненужных операций с сопутствующими осложнениями. Необходимо разработать действенные методы скрининга рака яичников (РЯ), включая способы визуализации опухолей, оценить их эффективность в клинических исследованиях и продолжить поиск дополнительных маркеров. Если при наличии родственницы первой степени родства с РЯ (риск заболевания 5 %) женщина не может участвовать в клинических исследованиях, то ей, несмотря на отсутствие проспективных убедительных данных об эффективности скрининга, необходимо самой оценить имеющийся риск заболевания и пройти скрининговое обследование. Такой вариант женщина должна обсудить со своим врачом.
Удаление яичников во время операции на органах таза практически полностью устраняет риск рака яичников (РЯ), хотя остается минимальный риск канцеромато-за брюшины. У женщин в пременопаузе важно вначале обсудить заместительную терапию эстрогенами, поскольку при отсутствии лечения у молодых пациенток риск сердечно-сосудистых заболеваний и остеопороза может превышать риск сохранения яичников и развития рака.
Читайте также:
- Лабиринтиты гематогенные. Диагностика и лечение гематогенных лабиринтитов
- Состояние нейроэндокринной регуляции при ранениях
- Суженный артериальный конус левого желудочка. Клапанное сужение артериального конуса левого желудочка
- Классификация переломов лучевой и локтевой костей
- Карциноид тонкой кишки - диагностика
