Раннее выявление рака предстательной железы. Скрининг на рак простаты.
Добавил пользователь Алексей Ф. Обновлено: 08.01.2026
Рак предстательной железы лечение 1, 2, 3 стадии. Симптомы, признаки, метастазы, прогноз.
Содержание:
Что такое предстательная железа?
Предстательная железа это орган, являющийся частью мужской репродуктивной системы, расположенный в малом тазу у передней части прямой кишки, под мочевым пузырем.
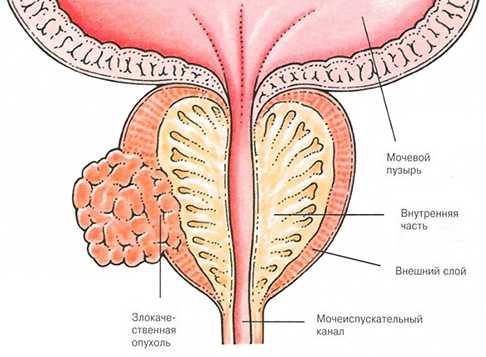
Размер предстательной железы в норме примерно соответствует размеру грецкого ореха. Так как предстательная железа окружает начальный отдел мочеиспускательного канала (уретры), то при увеличении она может сдавливать уретру и препятствовать нормальному току мочи из мочевого пузыря.
Предстательная железа состоит из двух типов ткани – железистой и мышечной. Первая состоит из желез, вырабатывающих жидкость, которая входит в состав семенной жидкости. Мышечная ткань обеспечивает опорожнение желез при семяизвержении. Функция предстательной железы зависит от наличия в организме мужских половых гормонов (андрогенов), которые стимулируют рост ткани предстательной железы.
Какие бывают опухоли предстательной железы?
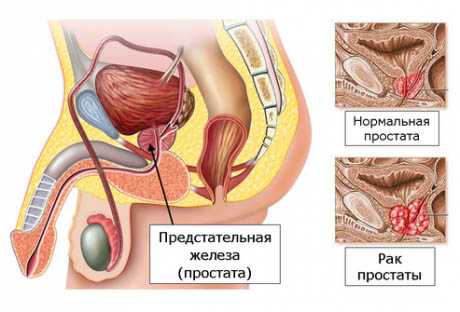
Наиболее распространенными заболеваниями предстательной железы являются простатит (воспаление предстательной железы) и доброкачественная гиперплазия предстательной железы (ДГПЖ), ранее ошибочно называемая "аденомой простаты".
ДГПЖ не является опухолью, а представляет собой избыточное образование нормальных клеток предстательной железы, когда железа увеличивается, сдавливает мочеиспускательный канал и создает препятствие нормальному току мочи.
Следует знать, что гиперплазия предстательной железы не может переродиться в злокачественную опухоль и развивается из других клеток, чем рак предстательной железы.
Однако наличие простатита или ДГПЖ, не исключает возможности наличия у мужчины рака предстательной железы.
ДГПЖ является распространенным заболеванием, частота которого увеличивается с возрастом.
Симптомы гиперплазии предстательной железы
Симптомы ДГПЖ встречаются у большинства мужчин старше 50 лет, а в возрасте старше 80 лет ДГПЖ выявляется более чем в 90 % случаев.
Наличие ДГПЖ само по себе не является показанием к лечению, но у некоторых мужчин имеются выраженные симптомы или осложнения ДГПЖ, которые нуждаются в лечении.
Из злокачественных новообразований наиболее часто встречается аденокарцинома, которая развивается из эпителиальных клеток желез предстательной железы и составляет 95 % всех случаев.
Довольно редко встречается переходно-клеточный рак и плоскоклеточный рак.
Еще более редко встречаются злокачественные неэпителиальные опухоли предстательной железы, информация о которых в данном материале не оговаривается.
Под термином "рак предстательной железы" обычно понимают именно аденокарциному, поэтому в дальнейшем речь будет идти только об аденокарциноме предстательной железы.
У кого чаще развивается рак простаты?
Далеко не всегда удается ответить на вопрос – почему один человек заболевает раком предстательной железы, а другой нет, тем не менее, известно, что у людей с определенными факторами риска РПЖ встречается чаще.
Исследования выявили следующие факторы риска для рака предстательной железы:
- возраст старше 65 лет. Возраст является основным фактором риска для рака предстательной железы. Большинство больных РПЖ старше 65 лет. Это заболевание редко встречается у мужчин моложе 45 лет;
- наследственность. Если кто-либо из ближайших родственников (отец, брат) болен раком предстательной железы, то риск заболевания возрастает в два раза. Если РПЖ выявлен у двух родственников, то риск возрастает более, чем в 5 раз;
- этническая принадлежность. Доказано, что рак предстательной железы чаще встречается среди представителей негроидной расы;
- некоторые морфологические изменения предстательной железы. Эти изменения на клеточном уровне выявляются только при биопсии предстательной железы): у мужчин с простатической интраэпителиальной неоплазией (ПИН) может быть повышен риск развития рака;
- генетическая предрасположенность. Выявлены определенные участки ДНК с генами, нарушения в которых повышают риск развития рака предстательной железы. Если у человека имеются генетические изменения в одном или более из этих участков, то вероятность развития РПЖ возрастает. Кроме того, другие исследования показали повышенный риск развития рака у мужчин с изменениями в конкретных генах, таких как BRCA1 и BRCA2.
Как часто встречается рак предстательной железы?
Рак простаты – очень распространенное заболевание. В мире РПЖ занимает 2-е место среди причин смертности от онкологических заболеваний у мужчин.
В Республике Беларусь уровень заболеваемости раком предстательной железы находится на 3 месте после рака кожи и легкого, и составляет 46,3 случая на 100 тыс. мужчин.
Как проявляется рак предстательной железы?
Рак предстательной железы может длительное время никак себя не проявлять. Обычно симптомы (признаки болезни) начинают проявляться с ростом и увеличением размеров опухоли.
Наиболее общие симптомы рака предстательной железы включают:
- нарушение мочеиспускания;
- затруднения при мочеиспускании (в первое время трудно начать мочиться или остановить поток мочи, в дальнейшем весь акт мочеиспускания протекает с большим усилием);
- боль или жжение при мочеиспускании;
- частые позывы к мочеиспусканию, особенно в ночное время;
- слабый поток мочи;
- нарушение эрекции;
- примесь крови в моче или сперме;
- частые боли в нижней части спины, в области таза или бедра.
Эти симптомы далеко не всегда связаны с наличием рака. ДГПЖ, инфекции мочевых путей и другие заболевания могут вызывать подобные симптомы. При наличии, каких либо из перечисленных выше проблем следует обратиться к врачу для прохождения обследования.
Диагностика рака предстательной железы
Рак предстательной железы может быть заподозрен при наличии вышеуказанных симптомов у пациента с факторами риска после проведения пальцевого исследования предстательной железы через прямую кишку (пальцевое ректальное исследование). Исследование позволяет определить размеры и плотность предстательной железы, а также наличие в ней опухолевых образований. Однако отсутствие каких-либо изменений по данным ректального исследования не исключает возможности наличия рака предстательной железы. В дальнейшем уточнить вероятность наличия рака, может помочь определение уровня в крови простат-специфического антигена (ПСА).
Простат-специфический антигена (ПСА)
ПСА – специфический белок, который образуется в клетках эпителия предстательной железы и секретируется в просвет желез предстательной железы. Некоторая часть ПСА попадает в кровоток, и может определяться в сыворотке крови. При наличии РПЖ уровень ПСА в крови может значительно повышаться.
Ранее считалось, что нормальное содержание ПСА в крови составляет 4 нг/мл и менее. В 2004 году были опубликованы данные исследования, которое показало, что при уровне ПСА
Поэтому в настоящий момент нет общепринятого значения "нормального" уровня ПСА в крови.
Увеличение уровня ПСА не всегда связано с опухолевым процессом и может наблюдаться в следующих случаях:
- наличие ДГПЖ;
- воспалительные заболевания предстательной железы (простатит);
- после езды на велосипеде;
- после полового акта;
- после урологических манипуляций (пальцевое ректальное исследование, цистоскопия, трансректальное УЗИ, биопсия предстательной железы).
Для получения наиболее "правильного" уровня ПСА, необходимо исключить возможные воздействия на предстательную железу и половые контакты за неделю до исследования. Если имеются явления простатита, следует предварительно пройти курс противовоспалительного лечения.
Учитывая сложность интерпретации данных уровня ПСА, оценивать анализ должен специалист, имеющий опыт диагностики и лечения рака предстательной железы.
Лечение рака простаты (предстатательной железы)
Хирургическое лечение рака простаты
1. Радикальная простатэктомия
Радикальная простатэктомия – операция, при которой полностью удаляется предстательная железа вместе с регионарными лимфатическими узлами. В основном эта операция выполняется при I-II стадии, но в ряде случаев, ее выполняют у пациентов с III стадией заболевания.
В ходе операции часто повреждаются нервы, проходящие рядом с предстательной железой и ответственные за эрекцию, в связи с чем после операции развивается эректильная дисфункция (частичное или полное отсутствие эрекции).
В некоторых случаях при малых размерах злокачественной опухоли возможно сохранение этих нервов, что может обеспечить сохранение эрекции. Но даже при сохранении эрекции после операции у мужчин отсутствует эякуляция (семяизвержение) и соответственно возможность зачать ребенка.
Если пациент планирует в дальнейшем завести детей, то перед проведением операции по лечению рака простаты необходимо обратиться в центр вспомогательной репродукции для консервации спермы и возможности в дальнейшем выполнить экстракорпоральное оплодотворение;
2. Трансуретральная резекция предстательной железы
трансуретральная резекция предстательной железы – операция, выполняемая для облегчения симптомов РПЖ при возникновении задержки мочи (невозможность самостоятельного мочеиспускания) в результате сдавления злокачественной опухолью мочеиспускательного канала.
При ТУРП невозможно удалить рак полностью, но возможно удалить часть опухоли, которая блокирует поток мочи. При этой операции на теле не делается разрезов. Операцию осуществляют с помощью специального инструмента – резектоскопа, который вводят через мочеиспускательный канал.
Онкологическую опухоль удаляют с помощью проволочной петли на конце резектоскопа, через которую проходит электрический ток большой мощности. Данное вмешательство позволяет пациенту восстановить самостоятельное мочеиспускание.
Лучевая терапия
При лучевой терапии используются высокие дозы рентгеновского или других видов облучения для уничтожения клеток рака и уменьшения опухоли. Этот метод лечения может быть использован при любой стадии рака.
Лечение рака простаты в Беларуси в нашем центре может быть двумя способами лучевой терапии
1. Дистанционная лучевая терапия
Дистанционная лучевая терапия это метод лечения, когда источник излучения находится на расстоянии от поверхности тела человека. Сеанс облучения длится несколько минут, более длительное время занимает процесс настройки и подготовки к лучевой терапии.
Обычно лечение проводят амбулаторно, 5 раз в неделю на протяжении 6 недель
2. Брахитерапия
Брахитерапия – вид лучевой терапии, когда при этом источник излучения помещают внутрь опухоли.
Лечение проводят в условиях стационара. В предстательную железу под наркозом вводятся полые иглы, через которые вводят радиоактивные зерна, которые остаются внутри предстательной железы. Источники такого излучения сохраняют свою активность в течение нескольких месяцев.
Основным недостатком лучевой терапии является то, что наряду с опухолевыми клетками, в процессе облучения повреждаются и близлежащие здоровые ткани. Поэтому после облучения могут наблюдаться кожные реакции в зоне полей облучения, частое и болезненное мочеиспускание, понос, боли и кровотечение из прямой кишки. Большинство этих явлений прекращаются вместе с прекращением лучевого лечения.
В современном виде метод брахитерапии рака предстательной железы, заключающийся в локальном облучении пораженного опухолью органа, начал применяться в США и Европе в 80–х годах прошлого столетия. В России этот метод радикального лечения рака предстательной железы используется с 2000 года (с использованием низкой мощности дозы, I125), а с 2008 года стали использоваться широко источники иридия (Ir 192) высокой мощности дозы.
Брахитерапия рака предстательной железы с использованием высокой мощности дозы используется в нашем Центре с 2008 года и зарекомендовала себя как надежный и эффективный метод лечения рака предстательной железы. Наши специалисты с большой ответственностью подходят к выбору диагностики и лечения данного заболевания. При обсуждении различных методов лечения, их преимуществ и недостатков, врачи всегда прислушиваются к мнению самого пациента и его родных.
По эффективности брахитерапия сравнима с радикальной простатэктомией, но имеет ряд преимуществ.
Преимущества высокодозной брахитерапии
- сохранение органа, ее структуры и половой функции;
- точность и равномерность распределения дозы излучения в предстательной железе;
- отсутствие источников излучения в организме после проведения брахитерапии;
- отсутствие радиационного воздействия на других людей;
- короткий курс лечения.
Брахитерапия хорошо переносится даже пожилыми людьми с тяжелыми сопутствующими заболеваниями. Уже на следующий день пациент может выписаться из клиники и вернуться к нормальной жизни. HDR–брахитерапия эффективна при лечении пациентов с низким, средним и высоким риском.
Доказано, что в группах онкологических пациентов с высоким риском сочетание наружной лучевой терапии с HDR–брахитерапией более эффективно, чем обычная лучевая терапия. Мы имеем большой опыт выполнения брахитерапии рака предстательной железы. Нами успешно пролечено более 500 человек.
Побочные действия:
В ближайший после процедурный период возможны учащенное мочеиспускание, примесь крови в моче, сперме, болезненные ощущения во время эякуляции. Иногда - задержка мочеиспускания, что требует установки катетера в мочевой пузырь.
В отделении брахитерапии имеются 2 самых современных брахитерапевтических комплекса с приставкой Swift и Oncentra prostate для лечения рака предстательной железы под контролем УЗИ в реальном времени и аппаратами "МикроСелектрон– HDR" и "Флекситрон".
Гормональная терапия
Цель гормонотерапии – снижение продукции мужского полового гормона (тестостерона), так как он усиливает рост клеток рака предстательной железы. Основным источником андрогенов в организме являются яички, кроме этого небольшое количество мужских половых гормонов вырабатывается надпочечниками.
Существует несколько способов снижения продукции организмом тестостерона:
1. Хирургическое удаление яичек (хирургическая кастрация).
Медицинское название этой операции – орхиэктомия. Орхиэктомия может быть выполнена как амбулаторная манипуляция, но, как правило, требует госпитализации и общего обезболивания.
Удаление яичек эффективно снижает продукцию тестостерона и облегчает боль, расстройства мочеиспускания и другие симптомы, связанные с РПЖ. Побочные эффекты этого вида лечения включают импотенцию и приливы жара (мужской климакс);
2. Медикаментозный способ (медикаментозная кастрация).
Для этого вида лечения используют препараты, представляющие собой аналоги природного лютеинизирующего гормона рилизинг-гориона (ЛГРГ). При применении аналогов ЛГРГ происходит прекращение выработки тестостерона яичками. Поэтому облегчается боль, расстройства мочеиспускания и другие симптомы, связанные с РПЖ.
Как правило, препарат вводится один раз в месяц в амбулаторных условиях, возможно самостоятельное введение препарата. На сегодняшний день существуют 3- и 6-месячные формы аналогов ЛГРГ. Кроме аналогов ЛГРГ для гормонотерапии используются другой класс препаратов – антиандрогены, которые блокируют связывание тестостерона с его рецепторами, и соответственно блокируют действие тестостерона.
Применение этих препаратов оправдано у молодых мужчин, желающих сохранить половую функцию;
Химиотерапия при лечении рака простаты
Химиотерапией называется использование лекарств, убивающих раковые клетки. Химиотерапия при раке предстательной железы используется в случае распространенного рака и при неэффективности гормонотерапии. Химиотерапия обычно проводится циклами.
Каждый цикл имеет период лечения и период отдыха. Побочные эффекты зависят от химиопрепарата и индивидуальной его переносимости. Для уменьшения повреждения здоровых тканей ведется контроль дозы и частоты введения химиопрепаратов.
Какой метод лечения более эффективен
Эффективность хирургического и медикаментозного метода одинакова, однако преимуществом медикаментозной гормонотерапии является возможность проведения прерывистого лечения и его отмены, что невозможно после удаления яичек.
Гормонотерапия РПЖ может использоваться отдельно или сочетаться с другими методами лечения, а также применяться для лечения рецидива заболевания.
Следует знать, что гормонотерапия не излечивает РПЖ, но может замедлить его рост, уменьшить размеры опухоли и облегчить симптомы, вызванные опухолью!
Какое наблюдение требуется после проведенного лечения
К сожалению, даже после проведения радикального лечения может наблюдаться повторное возникновение опухоли (рецидив). Поэтому врачи нашего онкологического центра в Белоруссии рекомендуют пациентам, прошедшим лечение по поводу рака предстательной железы, все же периодически проходить обследование.
Одним из важных компонентов обследования является анализ ПСА. Также обследование включает общий осмотр, анализы крови и мочи, может быть назначено УЗИ или компьютерная томография.
Рак простаты: доступно о диагностике, факторах риска и статистике
Простата — это небольшая железа, часть мужской репродуктивной системы. Она производит секрет простаты, входящий в состав семенной жидкости. Предстательная железа находится прямо под мочевым пузырем, по форме и размеру напоминает грецкий орех. Она может увеличиваться с возрастом. Через нее проходит мочеиспускательный канал — уретра. Простата есть только у мужчин, поэтому рак предстательной железы также встречается только у мужчин.
Рак предстательной железы часто растет настолько медленно, что большинство мужчин умирают от других причин до того, как болезнь станет клинически продвинутой.
Выживаемость мужчин с раком простаты связана со многими факторами, особенно с распространенностью опухоли во время диагностики. Так, 100% мужчин проживут 5 и более лет с раком, который не вышел за пределы простаты.
Основные симптомы
- трудности с мочеиспусканием: частое (больше семи раз в сутки) и/или болезненное мочеиспускание;
- кровь в моче или сперме;
- затрудненная эрекция;
- боль в нижней части спины, бедрах, костях.
Есть несколько типов рака простаты, но наиболее распространённым является аденокарцинома, развивающаяся из клеток железы. К другим, более редким, типам рака простаты относятся: саркомы, мелкоклеточный рак, нейроэндокринные опухоли и переходноклеточный рак.
Факторы риска
Возраст старше 50 лет. Рак простаты редко появляется у мужчин до 40-45 лет. Но при этом он — наиболее частая причина смерти от рака для мужчин старше 75 лет.
Диагностика
Большинство случаев рака простаты на ранних стадиях выявляется в результате анализа крови на простатический специфический антиген (ПСА) или ректального обследования.
Пока нет единого мнения о пользе скрининга рака предстательной железы, поскольку его результаты могут привести к гипердиагностике и ненужному лечению.
Однако обсудить возможность скрининга с лечащим врачом следует:
- мужчинам старше 50 лет в средней группе риска;
- мужчинам старше 45 лет в высокой группе риска. Например, если у близкого родственника мужчины был диагностирован рак предстательный железы в возрасте до 65 лет;
- мужчинам до 40 лет в очень высокой группе риска. Если у нескольких родственников был диагностирован рак простаты в молодом возрасте.
При этом врач должен четко объяснить всю последовательность действий, которые ждут человека во время диагностики.
Онкоэпидемиолог Антон Барчук
Скрининг — это всегда программа, протокол, последовательность действий. Сам единичный тест — это не скрининг. На данный момент используют в скрининге только ПСА, без уточнений, что будет потом, и поэтому называют тест на ПСА скринингом. Сейчас уже запущены рандомизированные исследования с МРТ, изучают алгоритмы использования ПСА-тестирования в разных возрастных группах. Но пока нет их результатов, общий вывод в том, что бессимптомный мужчина, выполнивший ПСА, обрекает себя на высокий риск вреда здоровью и небольшую пользу.
Анализ крови на ПСА
Простатический специфический антиген или ПСА — это белок, вырабатываемый как здоровыми, так и пораженными клетками предстательной железы. Раньше нормальным для здорового мужчины считался показатель ПСА 4.0 нг/мл и ниже. Однако дополнительные исследования показали, что уровень ПСА в крови зависит от множества факторов и может варьироваться у одного и того же мужчины.
Бывали случаи, когда рак простаты развивался у мужчин с ПСА ниже 4. И, наоборот, повышенный результат ПСА не всегда означает наличие рака.
Наличие инфекции мочевыводящих путей или простатита повышает уровень ПСА в крови. Кроме того, некоторые лекарства занижают его. К ним относятся финастерид и дутастерид, предназначенные для лечения доброкачественной гиперплазии предстательной железы.
Минусы ПСА-тестирования
Тестирование крови на уровень ПСА часто дает ложноположительный (когда мужчина, не имеющий рака предстательной железы, диагностируется с этим заболеванием) или ложноотрицательный результат. Чтобы уточнить диагноз, пациенту приходится проходить дополнительные обследования. Это пальцевое ректальное обследование, а также биопсию. Биопсия в редких случаях вызываетболь, провоцирует инфекции, кровотечения и кровь в моче или сперме.
Кроме того, с тестом на ПСА врачи обнаруживают небольшие бессимптомные опухоли. Они могут медленно расти в течение многих лет и никак не влиять на жизнь мужчины. Однако процесс их лечения (хирургическое вмешательство и лучевая терапия) может значительно снизить качество жизни и оказать негативное влияние на нормальное функционирование кишечника и половых органов, на процесс мочеиспускания.
ПСА-тест плох тем, что очень много ложноположительных результатов ведут к ненужным биопсиям. Кроме того, этот тест выявляет очень много неагрессивных форм рака, которые не влияют на здоровье мужчин. На 1000 мужчин скрининг ПСА предотвращает 1 смерть из 5, а остальные 4 умрут и со скринингом. Каждая предотвращенная смерть обходится ценой 25-30 случаев ненужного лечения выявленных только благодаря скринингу опухолей.
Результаты скрининга 1000 мужчин с помощью ПСА-теста
- У 720 мужчин будет отрицательный результат ПСА-теста.
- 178 мужчин будут с положительным ПСА-результатом, но при повторном анализе выяснится, что у них нет рака простаты.Четверо из этих 178 столкнутся с осложнениями биопсии - инфекциями и кровотечениями вплоть до госпитализации.
- У 102 мужчин подтвердится диагноз “рак простаты”.
- 33 из этих 102 диагностированных раков простаты не приведут к развитию заболевания или смерти. Однако из-за того, что неясно, будет ли прогрессировать опухоль, мужчины скорее выберут лечение с его вероятными осложнениями.
- Пять человек все равно умрут от рака простаты, несмотря на ПСА-анализ.
- Один человек избежит смерти от рака простаты благодаря ПСА-тесту.
Что делать, если уровень ПСА высокий?
Если результаты теста показали высокий уровень ПСА в крови, но у мужчины нет других симптомов развития рака простаты, врач может рекомендовать повторно пройти тестирование. Если высокий уровень ПСА в крови подтверждается, врач порекомендует пройти ректальное обследование и регулярно повторять тестирование на уровень ПСА в крови, чтобы отслеживать любые изменения.
При продолжении роста уровня ПСА в крови, могут быть рекомендованы дополнительные обследования, чтобы проверить наличие других заболеваний. В этот список входят анализ мочи на инфекции мочевыводящих путей, а также трансректальное УЗИ, рентген и цистоскопия. При подозрении на рак предстательной железы врач назначает биопсию простаты. Небольшие образцы ткани предстательной железы изучают патоморфологи для определения стадии заболевания.
Скрининг рака предстательной железы

В чем заключается скрининг рака предстательной железы?
Скрининг рака предстательной железы заключается в регулярном измерении уровня простат-специфического антигена (ПСА) в крови у мужчин от 50 до 65-70 лет.
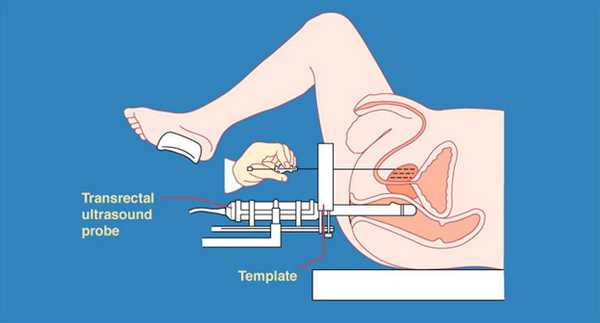
При повышении уровня ПСА выше определенного порогового значения (традиционно это 4 нг/мл) производится т.н. систематическая биопсия предстательной железы под контролем трансректального ультразвукового исследования. При биопсии забираются кусочки ткани простаты, которые исследуются под микроскопом на предмет выявления признаков рака простаты.
У каких мужчин скрининг рака предстательной железы не проводится?
Скрининг рака предстательной железы не проводится у молодых мужчин (до 40 лет), поскольку это заболевания в таком возрасте практически не встречается. В возрасте от 40 до 50 лет рак предстательной железы выявляется также редко, кроме случаев с наследственной предрасположенностью.
Поэтому в данном возрастном промежутке скрининг показан только при наличии рака простаты у близкого родственника пациента. У пожилых мужчин и мужчин с тяжелыми неизлечимыми заболеваниями, у которых вероятность прожить 10 лет и более невелика, скрининг может приносить больше вреда, чем пользы, поскольку выявление и лечение начальных форм рака предстательной железы никак не скажется на продолжительности жизни, но может ухудшить ее качество.
При помощи каких методов можно выявить рак предстательной железы?
Традиционно рак предстательной железы диагностировался при помощи пальпации простаты через прямую кишку. К сожалению, этот простой метод может выявить опухоль только в том случае, когда она достаточно большая и часто уже не подлежит радикальному лечению.
Поэтому, чтобы выявить опухоль на раннем этапе, когда она еще не пальпируется, требуется выполнить так называемую биопсию, которая заключается в заборе кусочков ткани простаты специальной иглой из определенных зон железы.
Чтобы не пропустить опухоль требуется выполнить от 6 до 10 (иногда и более) биопсий. Такая биопсия называется систематической и выполняется под контролем трансректального ультразвукового исследования. Обычно биопсия выполняется не всем мужчинам, а только тем, у которых имеется повышение уровня ПСА в крови.
Что такое Простат-специфический антиген (ПСА)
ПСА (простат-специфический антиген) – это опухолевый маркер рака предстательной железы. ПСА представляет собой белок, который вырабатывается исключительно в предстательной железе и в минимальных концентрациях попадает в кровь. При раке предстательной железы обычно в кровь попадает большее количество ПСА, что используется для раннего выявления этого заболевания.
Тем не менее, у такой методики имеется существенный недостаток, который заключается в том, что повышение уровня ПСА часто бывает при других, доброкачественных заболеваниях простаты (например, воспаление простаты или доброкачественная гиперплазия предстательной железы).
При помощи каких методов можно "увидеть" рак предстательной железы?
Несмотря на то, что болевые ощущения при биопсии можно значительно уменьшить, используя местную анестезию, многие мужчины опасаются этой процедуры и интересуются, нельзя ли каким либо образом «увидеть» (или визуализировать) рак, чтобы выполнять биопсию более избирательно. К сожалению, при помощи простых методов, например, трансректального ультразвукового исследования, надежно выявить рак предстательной железы нельзя.
Использование магнитно-резонансной томографии (МРТ)
Перспективным является использование магнитно-резонансной томографии (МРТ) в определенных режимах, однако это пока является предметом научных исследований.
Есть ли недостатки скрининга рака предстательной железы?
Да, как и у любого скрининга, они имеются. Так, в ходе скрининга можно выявить так называемый "незначимый" рак, который в отсутствие скрининга никогда бы не был выявлен (а значит и пролечен). А "ненужное" лечение в таких случаях может приводить к осложнениям и стойким последствиям.
Кроме того из-за неспецифичности ПСА рак выявляется только у 20-30 % из числа мужчин с повышенным уровнем этого маркера, а значит оказывается, что биопсия не нужна большинству пациентов, которым она проводится.
Нужен ли скрининг рака предстательной железы?
В настоящее время западные ученые ведут дискуссии о необходимости скрининга рака предстательной железы, поскольку у ученых нет твердой уверенности, что польза от скрининга превышает его потенциальные недостатки. Что касается нашей страны, то в настоящее время ведется изучение вопроса о необходимости внедрения скрининга.
Тем не менее, внедрение в Беларуси элементов скрининга в форме так называемого "раннего выявления" принесло бы несомненную пользу, учитывая частое выявление этого заболевания в далеко зашедшей стадии.
Что надо знать о скрининге рака предстательной железы?
Если у Вас в семье были случаи рака предстательной железы у кровных родственников или Вы ответственно относитесь к своему здоровью и хотели бы принять участие в программе раннего выявления рака простаты, несмотря на возможные неудобства, обратитесь к своему урологу для выполнения исследования уровня ПСА в крови.
Помните, что только профессионально выполненная биопсия предстательной железы (а иногда несколько биопсий) может исключить наличие рака предстательной железы при повышенном уровне ПСА.
Ультразвуковое исследование с эластографией сдвиговой волны и мультипараметрическая магнитно-резонансная томография при заболеваниях предстательной железы
В современной онкоурологии актуальность проблемы заболевания раком предстательной железы обусловлена широкой распространенностью данной патологии и лидирующим местом в структуре онкологической заболеваемости мужчин большинства стран мира. По данным Белорусского канцер-регистра в структуре заболеваемости злокачественными новообразованиями мужчин предстательная железа занимает первое место.
Существующие стандартные методы диагностики злокачественных опухолей предстательной железы обладают высокой точностью при выявлении заболевания. В РНПЦ ОМР им.Н.Н.Александрова используются и новые методы исследования, позволяющие улучшить стандартный подход на основе применения трансректального ультразвукового исследования с эластографией сдвиговой волны, которая открыла новые возможности количественной оценки жесткости ткани и позволяет определить локализацию подозрительных очагов.
Для подтверждения или исключения наличия злокачественной опухоли предстательной железы выполняется биопсия под контролем трансректального ультразвукового исследования. Она состоит из целевого этапа получения материала из подозрительных очагов, которые выявлены при помощи мультипараметрической МРТ таза и трансректального УЗИ с эластографией сдвиговой волны (т.к. точность определения диагноза возрастает, когда биопсия ориентирована на более жесткие области) и рекомендуется в сочетании с систематическим многоточечным этапом по определенной схеме.
Эластография показывает преимущества при выявлении в области верхушки и средней части простаты, тогда как МРТ – в визуализации базальной и переходной зон.
На рисунке представлен клинический пример пациента с повышенным уровнем ПСА. Ему выполнены мультипараметическая МРТ и трансректальное УЗИ с эластографией сдвиговой волны по данным которых определялись подозрительные очаги (указано стрелками или красным цветом). В последующем выполнена биопсии предстательной железы, которая состояла из систематического и целевого этапов. По результатам биопсии установлен диагноз рак предстательной железы с суммой баллов Глисона 4+3 (ISUP Grade 3). Пациенту выполнена радикальная простатэктомия в результатах которой подтвердилась правильно установленная стадия и лечение проведено успешно.
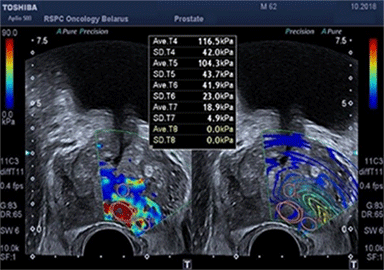
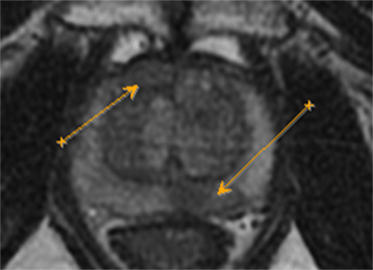
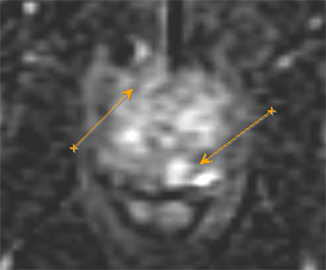
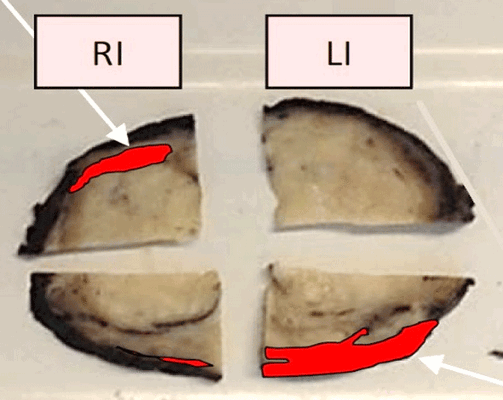
Установившийся тренд на изменение подходов к методике выполнения биопсии предстательной железы с включением целевого этапа при проведении систематической биопсии является результатом определенных успехов развития методов лучевой диагностики, в частности совместного использования при планировании биопсии результатов мультипараметрической МРТ и трансректального УЗИ с эластографией сдвиговой волны.
Раннее выявление рака предстательной железы. Скрининг на рак простаты.
СКРИНИНГ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Методические рекомендации N 543-ПД/623
Учреждение - разработчик: ФГУ Научно-исследовательский институт урологии РОСЗДРАВА
к.м.н. Сивков А.В., д.м.н. Чернышев И.В., д.м.н. Перепанова Т.С., к.м.н. Ощепков В.Н., Кешишев Н.Г.
Аннотация
Методические рекомендации посвящены скринингу рака предстательной железы. В работе отражены основные методы и направления скрининга РПЖ, проанализированы результаты программ, проведенных в России и за рубежом. Обращено внимание на достоинства и недостатки различных подходов к осуществлению скрининга РПЖ, произведена оценка их клинического значения и даны рекомендации по оптимальному построению таких программ. Показано, что только скрининг групп риска в отношении РПЖ клинически и экономически обоснован. Предложенная методика отражает современные представления о скрининге РПЖ.
Методические рекомендации предназначены для медицинских руководителей, планирующих проведение скрининга РПЖ, практических врачей урологов, хирургов, терапевтов и врачей общей практики.
Список сокращений
РПЖ - рак предстательной железы
ПСА - простатический специфический антиген
УЗИ - ультразвуковое исследование
ТРУЗИ - трансректальное ультразвуковое исследование
ПРИ - пальцевое ректальное исследование
ДГПЖ - доброкачественная гиперплазия предстательной железы
ПИН - простатическая интраэпителиальная неоплазия
Введение
Анализ иностранной медицинской литературы последних лет свидетельствует о росте интереса к разработке и проведению широкомасштабных скрининг-программ, направленных на раннюю диагностику урологических, в первую очередь онкоурологических заболеваний. Значительное число работ в области урологии посвящено скринингу рака предстательной железы (РПЖ). Специальными экономическими исследованиями было показано, что вложение средств в профилактику заболеваний для медицинских бюджетов более выгодно, нежели финансирование лечения запущенных случаев.
Эпидемиология РПЖ. Рак предстательной железы - одна из ведущих причин смерти мужчин пожилого возраста от злокачественных опухолей в мире. Расчетный риск возникновения РПЖ у американцев в возрасте 50 лет составляет: 40% для микроскопических форм; 9,5% - для клинических форм; 3% - для рака простаты с летальным исходом. В Европе этот же самый риск был оценен как 33%; 4% и 1,25% соответственно. При аутопсиях пожилых мужчин частота выявления скрытых форм РПЖ достигает 45%. В то же время, РПЖ является относительно медленно прогрессирующим заболеванием.
РПЖ широко распространен в России и характеризуется высокими темпами роста заболеваемости и показателями смертности. Последняя обусловлена поздней диагностикой и большим числом наблюдаемых пациентов с местно распространенными и диссеминированными формами рака.
В структуре онкозаболеваемости России РПЖ занимает 4 место. С 1994 по 2003 годы по темпу прироста он занял первое место среди всех злокачественных новообразований у мужчин: 8,81% в год и 113,80% за указанный период. В последние годы произошло более чем двукратное увеличение общего числа наблюдаемых больных и в абсолютных и в стандартизированных показателях на 100000 мужского населения: 29,7 и 66,0 в 1993 и 2002 годах. В 2002 году на учете в онкологических учреждениях России состояло 44411 больных РПЖ, а в 2004 году уже 54756 (38,2 на 100000 населения). Вновь было выявлено соответственно 13245 и 14565 случаев заболевания, что почти в 2 раза превысило данные 1993-1994 годов. Частота выявления РПЖ зависит от возраста: 75% всех случаев заболевания обнаруживается у мужчин старше 65 лет.
В настоящее время в нашей стране еще не произошло ожидаемого перелома в состоянии оказания медицинской помощи больным РПЖ. В отличие от развитых стран Запада, 5 лет и более наблюдается менее трети пациентов. В структуре смертности мужчин от злокачественных новообразований в 2002 году эта локализация заняла 4,7%, а за 10 лет - первое место по темпу прироста (25,21%). Смертность от РПЖ, как и заболеваемость, связана с возрастом. У лиц старше 70 лет смертность от РПЖ вышла на третье место - 8,0%. Если у мужчин 40-44 лет смертность от этого злокачественного новообразования на 100000 населения составила лишь 0,31 то у лиц старше 75 лет - уже 138,63. Стандартизированный показатель смертности был равен 9,02 при среднем возрасте умерших 70,4 лет. Стандартизированные показатели смертности в 2002 году были равны в Москве и Санкт-Петербурге 11,74 и 11,52 соответственно.
Высокие показатели смертности, вероятно, объясняются низким качеством диагностики РПЖ: лишь 4-6% случаев выявляются при профосмотрах. Больные с распространенным и/или метастатическим РПЖ в структуре впервые выявленных заболеваний составляют более 60%. В 2004 году среди пациентов с впервые в жизни установленным диагнозом, III стадия РПЖ была диагностирована у 38,4%, а IV - у 22,7%.
Оценка эпидемиологической ситуации и состояния оказания помощи больным РПЖ в России была бы не полной без рассмотрения экономических аспектов проблемы. Ранее было показано, что каждый случай заболевания РПЖ приводит, в среднем, к недопроизводству ВВП в размере 46500 рублей (в ценах 1999 года), а на помощь больным с поздними стадиями РПЖ приходится до 85% всех средств, расходуемых на лечение. Были сделаны важные выводы, имеющие и клиническое и экономическое значение:
- скрининг РПЖ экономически эффективен, несмотря на большие затраты;
- скрининг РПЖ и выявление заболевания на ранних стадиях экономически эффективнее лечения РПЖ на поздних стадиях;
- лечение РПЖ, эффективное с позиций медицины, приводящее к сохранению жизни и восстановлению работоспособности, экономически целесообразно, если затраты на него в среднем не превышают 69000 рублей.
Следует ожидать, что за последние годы затраты на лечение РПЖ только возросли. Таким образом, РПЖ в России является широко распространенным заболеванием с высокими темпами роста заболеваемости и показателями смертности. Последняя обусловлена поздней диагностикой РПЖ и большим числом наблюдаемых пациентов с местно распространенными и диссеминированными формами РПЖ. Сегодня в России наблюдается не менее 30000 мужчин с распространенным и/или метастатическим РПЖ, лечение которых требует больших медицинских ресурсов и экономических затрат. Поэтому разработка и внедрение в клиническую практику программ ранней диагностики РПЖ является не только важной медицинской, но большой социальной и экономической задачей государственного значения.
Основная часть
В качестве основной группы для проведения скрининга РПЖ рассматривают популяцию мужчин в возрасте старше 50 лет, не имеющих клинических признаков заболевания. До настоящего времени не завершен спор между сторонниками и противниками скрининга РПЖ. Ряд специалистов указывают, что убедительных данных в пользу поддержки национальных программ скрининга РПЖ нет. Другие, наоборот, рекомендуют ежегодное определение ПСА и включают этот тест в перечень обязательных исследований по программе страховой медицины. Остаются не до конца ясными следующие вопросы:
- Способно ли раннее выявление РПЖ снизить летальность?
- Не приводит ли скрининг к гипердиагностике РПЖ и обнаружению т.н. "клинически незначимых" случаев заболевания, необходимость курации которых неоправданно отягощает медицинский бюджет?
- С каким интервалом должны проводиться повторные обследования у пациентов с нормальными уровнями ПСА?
- Какова экономическая целесообразность широкомасштабного скрининга РПЖ? Несмотря на то, что пока не существует признаваемых всеми данных о снижении смертности от рака простаты при проведении скрининг-программ, это вовсе не означает, что целесообразность скрининга не будет доказана при долгосрочном наблюдении за пациентами.
Цель скрининга
Целью проведения скрининга является активное выявление ранее не диагностированных, латентно текущих случаев РПЖ, в первую очередь его локализованных форм, когда имеется возможность проведения радикального лечения, для уменьшения смертности и экономических затрат на лечение.
Диагностические методы, применяемые при скрининге РПЖ
В настоящее время основными инструментами раннего выявления РПЖ являются:
- определение уровня простато-специфического антигена сыворотки крови (ПСА);
- пальцевое ректальное исследование предстательной железы (ПРИ);
- трансректальное ультразвуковое сканирование (ТРУЗИ).
Простатический специфический антиген. Наиболее ценным опухолевым маркером РПЖ является ПСА. Скрининг на основе ПСА дает возможность диагностировать РПЖ у лиц с бессимптомным течением болезни, увеличить общее количество диагностируемых случаев, в том числе на ранних стадиях, снизить долю местнораспростаненных и метастатических форм. При этом изменение уровня ПСА существенно опережает появление симптомов.
Принято считать, что у взрослых мужчин уровень ПСА сыворотки крови не должен превышать 4 нг/мл. Уровень ПСА зависит от объема простаты, увеличивающегося с возрастом. Рассчитаны возрастные нормы ПСА:
Уровень ПСА более 3 нг/мл для пациента 50 лет является диагностически значимым, в то время как в 70 лет вероятность обнаружения РПЖ при значениях ПСА до 4 нг/мл невысока. Известно, что у 12-15% мужчин в возрасте 50-70 лет отмечается повышенный уровень ПСА, но только у 1/3 из них при биопсии простаты выявляется РПЖ.
Исследование ПСА имеет высокую чувствительность (75-87%) и приемлемую специфичность (37-63%), которые, однако, сильно зависят от целого ряда факторов (возраст, объем предстательной железы, наличие сопутствующего воспаления, собственно уровень ПСА). Так, специфичность метода снижается при развитии доброкачественной гиперплазии предстательной железы (ДГПЖ), приводящей к повышению ПСА у пожилых мужчин: более чем у половины из них регистрируется увеличение ПСА выше 4 нг/мл. Хотя уровень ПСА выше 10 нг/мл встречается и при ДГПЖ, вероятность наличия РПЖ при этом возрастает более чем в 20 раз.
Вероятность обнаружения опухоли во время биопсии значима при уровне ПСА более 10 нг/мл и очень мала при ПСА менее 4 нг/мл. С другой стороны, в зависимости от морфологической картины опухоли (в случае низкодифференцированного рака), до 10% пациентов с ПСА менее 4 нг/мл могут иметь стадию Т2с и выше. Поэтому большинство курабельных новообразований находится в так называемой "серой зоне" значений ПСА (4-10 нг/мл).
Прогностическая ценность положительного результата при уровне ПСА 4-10 нг/мл составляет 20-35%, а при 10 нг/мл - уже 42-80%, в зависимости от данных полученных при пальцевом ректальном исследовании. До 30% больных РПЖ с уровнем ПСА более 10 нг/мл имеют признаки экстрапростатического распространения опухоли. Риск метастазов в кости существенно повышается у пациентов с ПСА выше 20 нг/мл. При значении ПСА 40 нг/мл метастазы присутствуют у 40-60%, а при 100 нг/мл - у 100% больных.
Необходимо учитывать достаточно высокую частоту ложноотрицательных и ложноположительных результатов, которые у больных с локализованным РПЖ достигают 20-40% и 15-25% соответственно. На величину показателей ПСА могут влиять: массаж простаты или эякуляция накануне исследования, воспалительные изменения в простате, инструментальные манипуляции в области простатического отдела уретры или прямой кишки, ишемия или инфаркт простаты. Рутинная пальпация простаты, вероятно, не изменяет уровня ПСА. В редких случаях простатический антиген обнаруживается при почечно-клеточном раке и опухолях надпочечников. Изменение уровня сывороточного ПСА также может быть связано с проводимой терапией (гормональные средства, термальные методы лечения).
Для повышения специфичности теста предлагают вычисление индекса плотности ПСА, для чего величину ПСА делят на объем простаты, полученный при трансректальной эхографии. Показатель, превышающий 0,15 с большой долей вероятности свидетельствует о наличии РПЖ.
В сыворотке крови ПСА циркулирует в виде свободной и связанной с альфа 1-антихимотрипсином и альфа 2-макроглобулином форм. Для повышения точности лабораторной диагностики РПЖ, помимо общего ПСА, определяют свободную и связанные фракции. Наиболее широко в клинике применяется оценка концентрации свободного ПСА и соотношения свободный ПСА/общий ПСА. При значении этого соотношения ниже 15% показана биопсия простаты. Определение соотношения свободного и связанного ПСА относится к вспомогательным исследованиям и самостоятельного значения при первичном скрининге не имеет. Однако этот тест может оказать существенную помощь в спорных диагностических ситуациях (см. алгоритм).
Пальцевое ректальное исследование. Определение уровня ПСА дополняет ПРИ, которое на протяжении многих лет являлось основой скрининга РПЖ, позволяя диагностировать заболевание у 0,35-0,85% мужчин в различных группах. Метод остается востребованным и в наши дни. Его проведение у практически здоровых мужчин не сопряжено с каким-либо риском, занимает мало времени, не требует особых финансовых затрат и особенно информативно при развитии опухоли из периферических отделов железы, хорошо доступных пальпации.
Чувствительность метода при локализованном РПЖ невысока. В начальных стадиях заболевания (Т1) пальпаторно определить новообразование невозможно. При Т2 пальцевое исследование выявляет небольшие очаговые уплотнения или узелки в ткани предстательной железы. Последняя может быть обычных размеров или увеличена за счет сопутствующей ДГПЖ. Большой пальпируемый узел соответствует, как правило, уже местнораспространенному процессу. Постепенно рост опухоли приводит к деформации органа, который приобретает хрящевидную или каменистую консистенцию. В некоторых случаях прощупываются плотные тяжи инфильтрата, распространяющегося от предстательной железы к семенным пузырькам. В дальнейшем опухолевый конгломерат может занять большую часть или даже всю железу, переходя без четких границ на окружающую клетчатку. ПРИ позволяет заподозрить заболевание менее чем у половины больных с гистологически подтвержденным РПЖ стадии Т2. В то же время, при Т3-Т4 чувствительность теста приближается к 100%.
ПРИ является высокоспецифичным методом, так как 70-80% опухолей локализуется в периферической зоне предстательной железы, а минимальный объем РПЖ, который может быть выявлен пальпаторно, составляет 0,2 см. До 15-40% всех случаев РПЖ выявляется методом ПРИ. В половине пальпируемых узлов в предстательной железе при биопсии выявляют рак. Критерий ассиметричности органа не столь характерен: РПЖ обнаруживают лишь у 12%. Прогностическая ценность ПРИ не превышает 15-30%. Результативность пальпации уменьшается при центральном расположении опухоли.
Эффективность диагностики РПЖ методом ПРИ во многом зависит от квалификации специалиста. Частота выявления РПЖ во время профилактических осмотров, проводимых врачом диспансерного кабинета, не превышает 0,02%, в то время как при осмотре урологом - 0,3%.
Трансректальная эхография предстательной железы.
Трансабдоминальная эхография, в большинстве случаев не позволяет осуществить дифференциальную диагностику между простатитом, ДГПЖ и РПЖ. ТРУЗИ дает возможность более четко визуализировать размеры, конфигурацию простаты и его эхоструктуру. На ранних стадиях новообразование, как правило, имеет гипоэхогенную структуру. В 70-80% случаев оно локализуется в периферической зоне простаты и определяется, в виде четко отграниченного узла, отличающегося от окружающей нормальной ткани и ДГПЖ. Реже первичная опухоль локализуется в центральной или транзиторной зонах органа. Хорошо прослеживается неизмененная капсула простаты. В ряде случаев РПЖ может иметь нормо- или гиперэхогенную структуру.
Метод трансректальной эхографии характеризуется высокой чувствительностью и относительно низкой специфичностью: далеко не все гипоэхогенные или очаговые образования в предстательной железе обусловлены РПЖ. Подобные изменения могут наблюдаться и при ДГПЖ и при хроническом простатите. Полиморфизм ультразвуковой картины органа, при отсутствии патогномоничных для рака ультразвуковых признаков, делает метод мало пригодным для ранней диагностики РПЖ. ТРУЗИ способно выявить наличие изменений в эхоструктуре железы, но не может четко дифференцировать рак. Метод позволяет оценить величину опухолевого узла, его взаимоотношение с окружающими тканями, деформацию или прорастание капсулы предстательной железы, инвазию в мочевой пузырь, семенные пузырьки, инфильтрацию окружающих тканей, что имеет важное значение для уточнения состояния и определения стадии заболевания, но не для скрининга. Достоверность выявления РПЖ при ТРУЗИ составляет 33,0%. Она также зависит от квалификации специалиста и используемого оборудования.
Внедрение технологий доплеровского сканирования предстательной железы, вопреки ожиданиям, не привело к существенному повышению диагностической эффективности метода при скрининге РПЖ.
Скрининг рака предстательной железы: применение онкомаркеров и дальнейшие шаги

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 05.04.2022
- Reading time: 4 минут чтения
Онкоурологические заболевания – рак почки, мочевого пузыря, предстательной железы (РПЖ) – первые по распространенности среди всех злокачественных заболеваний и занимают второе место в структуре мужских причин смерти. Поэтому урология фактически является онкологической специальностью.
Одна из наиболее обсуждаемых проблем урологии — скрининг рака предстательной железы, состоящий из ряда этапов, включающих простые анализы (ПСА) и сложные инструментальные методы, например, МРТ. Рассмотрим возможные варианты диагностики РПЖ и доказательства ее необходимости.
Анализа на ПСА — первый шаг в диагностике рака предстательной железы
Анализ крови на простатический специфический антиген — простой анализ, позволяющий выявлять патологии предстательной железы, включая раковые опухоли. ПСА производится эпителиальными клетками канальцев органа, после чего попадает в сыворотку крови в свободной и связанной формах. Комплекс этих фракций (10 и 90% соответственно) называется общим простатическим специфическим антигеном. Концентрация ПСА меняется с возрастом: у пожилых мужчин она выше.
ПСА выполняет ряд физиологических функций:
- разжижает семенную жидкость;
- выделяет вещества, стимулирующие сокращение гладких мышц семенных пузырьков;
- замедляет рост клеток, что связано с антиканцерогенным и антиангиогенным эффектами.
Концентрация сывороточного ПСА при РПЖ растет, превышая норму, из-за увеличения опухоли, разрушения органа и выброса антигена в кровоток.
Анализ на ПСА для диагностики РПЖ был введен в медицинскую практику в 1984 г. По результатам международных исследований, благодаря своевременной и эффективной диагностике это дало ряд положительных результатов:
Следовательно, с внедрением ПСА в клиническую практику возросли статистические показатели заболеваемости РПЖ, что говорит о высокой степени выявляемости рака (а не росте числа случаев), и улучшились результаты лечения патологии. После введения скрининга ПСА ученые отметили, что в начале 1990-х годов смертность от рака предстательной железы снизилась на половину, а частота метастазирования на момент постановки диагноза более чем на 70%.
Для изучения влияния скрининга ПСА на смертность были проведены два крупномасштабных рандомизированных контролируемых исследования:
- американское (Andriole G.L., Crawford D.E., Grubb R.L. et al., 2009);
- европейское (Schröder F.H., Hugosson J., Roobol M.J. et al., 2014).
В американском исследовании 90% участников контрольной группы не подвергались скринингу ПСА до исследования, поэтому ученые не смогли установить, снижает ли проведение скрининга ПСА смертность от РПЖ. Согласно европейскому исследованию, было подтверждено, что скрининг ПСА связан с более низкими показателями смертности, поэтому в клинической практике учитываются результаты именно европейского исследования.
Недостатки анализа на ПСА
Недостаток скрининга ПСА — гипердиагностика РПЖ, заключающаяся в ошибочных диагнозах при фактическом отсутствии болезни или её осложнений, или протекании болезни в более легкой степени, чем диагностировано. Это недостаток любого скринингового исследования, используемого, для диагностики злокачественных заболеваний.
Что касается ПСА, то причина ошибок кроется в возможности повышения сывороточного уровня ПСА не только при раке простаты, но и при других состояниях: доброкачественной гиперплазии, хроническом простатите, инфекций почек или мочевыводящих путей. Также ПСА повышается при стимуляции простаты, интенсивных физических упражнениях, применении некоторых лекарств.
Концентрация ПСА превышает 4 нг/мл у более 80% больных с РПЖ и у менее 20% пациентов с аденомой простаты. Следовательно, высокий ПСА не всегда свидетельствует о злокачественности процесса.
Чтобы снизить число ошибочных диагнозов, в 2008 году Рабочая группа США по профилактике заболеваний (USPSTF) не рекомендовала скрининг ПСА для мужчин старше 75 лет. В результате у таких больных со временем повысилась частота диагностики отдаленных метастазов. У мужчин, своевременно обследованных на рак предстательной железы, частота отдаленных метастазов была стабильно низкой.
В 2012 году USPSTF вообще исключила скрининг ПСА из рекомендаций. Следствие такого решения — уже через 3 года увеличилась доля больных с метастазами в регионарные лимфатические узлы и отдаленные метастазы. Смертность от рака простаты за 10 лет выросла на 17%. Поэтому, в 2017 г. американские клиницисты вновь рекомендовали внедрение скрининга ПСА на РПЖ.
Ход скрининга рака предстательной железы зависит от результатов каждого этапа
Во избежание гипердиагностики в Европе рекомендуется использовать калькуляторы рисков. Но первичный этап скрининга рака предстательной железы всегда — определение уровня ПСА, остающегося основным маркером рака простаты. Дальнейшие действия уролога зависят от значения этого показателя. Другие маркеры РПЖ: биологически активные вещества, влияющие на рост, дифференцировку, инвазию, ангиогенез и метастазирование опухоли. Уровни дополнительных маркеров простаты сравниваются с уровнем ПСА, определенным у больного.
Далее, в зависимости от результатов, пациенты делятся на группы:
- Пациенты с низким риском развития рака предстательной железы подлежат наблюдению в результате стратификации риска;
- Пациенты с высоким риском направляются на МРТ.
Пациенты, прошедшие МРТ и получившие 1-3 балла за PI-RADS (система оценки изображений МРТ и обработка полученных данных), остаются в группе наблюдения.
Больные с оценкой 4-5 баллов по PI-RADS классифицируются как пациенты высокого риска, и направляются на биопсию простаты.
Если оценка полученного биоптата по шкале Глисона составляет ≥3 балла, пациенту показано активное лечение, основной вариант которого — простатэктомия. Радикальная простатэктомия – лучший метод лечения рака на начальных стадиях. Гормональная терапия может значительно снизить уровень ПСА, но повышает риск развития гормонорезистентной формы рака.
Конечно, такая операция обходится недешево. По статистике, стоимость радикальной простатэктомии в Европе составляет 10-15 тыс. евро. Но лечение поздних стадий РПЖ обходится еще дороже — в 140 тысяч евро в год.
Новые маркеры рака предстательной железы — перспективы и препятствия для внедрения
В 2005 г. были открыты специфические антитела, новые биомаркеры рака предстательной железы, в частности микроРНК, метилированные гены GSTP1, SFRP2, IGFBP3, IGFBP7, APC, PTGS2.
Общие исследования, назначаемые пациентам с раком предстательной железы, включают:
- 4K Score (4K Laboratory Research Panel);
- PHI (Prostate Health Index Panel);
- MiPS (Michigan Panel of Laboratory Tests to Determine Prostate Cancer Risk);
- STHLM3 (Stockholm-3 Laboratory Panel);
- PCA3 (специфический антиген рака предстательной железы типа 3).
Биомаркеры рака предстательной железы можно разделить по их происхождению на ДНК, РНК и белковые маркеры. Последние также делятся на тканевые, сывороточные и маркеры, выделенные из мочи.
Среди всех онкомаркеров, выявляемых при раке предстательной железы, особенно важны каликреины и кинины, действующие на опухолевые клетки, способствуя ремодуляции злокачественного образования, его интра- и экстравазации. Пример — каликрейн типа 2, определение которого предусмотрено онкологической скрининговой панелью «4К». Под действием каликреинов и кининов опухоль растет и метастазирует. Но эти же вещества подавляют метастатическую резорбцию кости, защищая организм, пораженный раком.
Помимо каликреина типа 2, определяются также каликреины 4-, 5- и 15 типов. ПСА также каликреин типа 3.
Учитывая разнообразие онкомаркеров, появляется проблема выбора оптимального маркера для скрининга РПЖ. Для этого необходима лабораторная идентификация, оценка актуальности с учетом типа, стадии и скорости прогрессирования опухоли, выживаемости и эффективности противоопухолевого лечения. Только после таких испытаний маркер утверждается для диагностики определенного вида рака. Все это очень длительный и дорогостоящий процесс, поэтому новых рекомендаций урологам приходится ждать годами и даже десятилетиями.
Требования к онкомаркеру:
- высокая экспрессия при развитии злокачественного процесса;
- возможность количественного определения в образцах биоматериала;
- корреляция уровня маркера со степенью прогрессирования опухоли;
- быстрый результат и экономическая выгода.
Применение онкомаркеров при дифференциальной диагностике рака простаты
Для достижения разных целей используются разные онкомаркеры:
- Универсальный скрининг рака простаты — уровень ПСА. Свободный и общий уровни ПСА — основные диагностические и прогностические маркеры РПЖ.
- Дифференциальная диагностика гиперплазии простаты и рака — уровень спермина и спермидина в крови и моче.
- Прогноз течения рака — уровень лактоферина, белка матриксной рибонуклеиновой кислоты NANOG, обнаружение экспрессии CD44 и CD24 рецепторов, определение уровня и экспрессии циркулирующей и опухолевой микроРНК-126, микроРНК-205 и микро-РНК-214.
Онкомаркеры спермина и спермидина (полиамины) — важные эндогенные регуляторы пролиферации, роста, дифференцировки и запрограммированной гибели клеток. Доказано, что уровни спермина и спермидина связаны с раком простаты. Уровень спермина у больных почти в два раза ниже, чем у здоровых. У пациентов с метастатическим раком очень низкий уровень спермина — 3-4 нмоль/л, следовательно, уровень спермина может быть использован для дифференциальной диагностики гиперплазии и рака.
Для одновременной диагностики и оценки прогрессирования опухоли определяют уровень лактоферина: он уменьшается с ростом опухоли, ее метастазированием в регионарные и отдаленные лимфатические узлы.
Один из новых диагностических прогностических маркеров — экспрессия рецепторов CD44 и CD24, положительно коррелирующая с увеличением размеров опухоли, повышением уровня ПСА и увеличением оценки опухоли по шкале Глисона.
Следующий маркер оценки степени злокачественности опухоли — белок матриксной рибонуклеиновой кислоты NANOG. Уровень NANOG в опухолевой ткани коррелирует с: предоперационным уровнем ПСА в сыворотке крови, размером новообразования, метастазами в регионарных лимфатических узлах.
Перспективный метод оценки степени злокачественности рака предстательной железы — определение микроРНК в ткани опухоли и сыворотке крови. Уровень циркулирующих и опухолевых микроРНК положительно коррелирует с возрастом пациента, повышением уровня ПСА, поздней стадией опухоли, наличием метастазов и более высокой оценкой опухоли по шкале Глисона.
Таким образом, в лабораторной диагностике рака простаты могут применяться анализы уровня ПСА и других биологически активных веществ. Основной лабораторный метод скрининга РПЖ сегодня — анализ на ПСА, а другие методы повышают точность диагностики.
Читайте также:
