Развитие и морфогенез глазного пузыря
Добавил пользователь Валентин П. Обновлено: 28.01.2026
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России
Особенности архитектоники структур полости носа и хоанальной зоны у детей с врожденными пороками развития глаз
Журнал: Вестник оториноларингологии. 2021;86(1): 63‑67
В статье приведены данные об эмбриогенезе глазного яблока, носослезного канала и полости носа. Отмечено нередкое сочетание врожденной атрезии хоан и аномалий развития глаз, по всей видимости, связанное с временным и топографическим параллелизмом внутриутробного развития данных анатомических областей. С целью оценки состояния полости носа и хоанальной области при врожденной патологии глаз были обследованы 43 ребенка с офтальмологическими пороками развития. У 32 (74,4%) детей по данным эндоскопического обследования выявлены изменения анатомии хоанальной области с изменением ее размеров в виде неполной атрезии. Полученные результаты позволяют авторам рекомендовать всем детям с врожденными офтальмологическими пороками развития осмотр и наблюдение у врача-отоларинголога с проведением эндоскопического исследования полости носа и носоглотки.
Дата принятия в печать:
Врожденные пороки в структуре младенческой заболеваемости и смертности занимают одно из первых мест. По данным популяционных исследований и сведений ВОЗ, частота встречаемости врожденных пороков развития составляет в среднем от 3 до 6% [1], а у новорожденных детей колеблется в широких пределах — от 11,5:1000 до 32:1000 [2]. Сочетание пороков развития лица и черепа с другими видами аномалий выявляется у 60% детей [3].
Этиология пороков и аномалий развития до конца не изучена. Взаимодействие множества разнообразных причинных факторов (тератогенов) определяет многофакторный характер врожденных аномалий развития носа и глаз. Эффект воздействия проявляется в виде физиологических, модифицирующих и повреждающих явлений [4]. Достаточно часто выявляются сочетанные пороки формирования полости носа и хоанальной зоны с пороками развития глаз, что обусловлено течением гестационного периода жизни.
Различные исследования, посвященные эмбриогенезу риноорбитальной зоны, свидетельствуют о крайне тесной взаимосвязи развития структур латеральной стенки полости носа, околоносовых пазух и носослезного канала [8—11]. Уже на 5-й неделе эмбрионального развития еще в первичной полости носа между латеральным и верхнечелюстным отростками прослеживается слезная пластинка, из которой на 7-й неделе гестации образуется слезный шнур. Затем, на 10-й неделе внутриутробного развития, в слезном шнуре проявляется просвет, так называемый истинный носослезный канал. К 20-й неделе заканчивается формирование костной трубки, окружающей носослезный канал [8, 12—14]. В связи с вышеуказанным считаем справедливым анатомо-топографически и клинически разделять у детей два понятия: «носослезный канал», представляющий собой костную структуру, и «носослезный проток», являющейся мягкотканым образованием. Воздействие негативных факторов окружающей среды на эмбрион в различные сроки гестации, по мнению W. Katowitz и соавт., может привести к появлению врожденных аномалий и пороков развития слезоотводящих путей, например стенозу носослезного канала [15].
Среди пороков развития носа и околоносовых пазух у детей наиболее часто хирургические вмешательства производят по поводу врожденной атрезии хоан. Имеются многочисленные наблюдения сочетания врожденной атрезии хоан с аномалиями развития других органов, в том числе при различных синдромах и расстройствах как часть сложного фенотипа [16, 17]. В наших наблюдениях более чем у 1 /2 детей с врожденной атрезией хоан (n=144), а именно у 76 (52,8%), выявлены сопутствующие пороки развития. При этом у 30 (20,8%) детей обнаружена врожденная патология со стороны органа зрения: в несиндромальных случаях сочетанного поражения — у 14 (9,7%) детей и с синдромальной патологией, в том числе при CHARGE-синдроме, — у 16 (11,1%). Чаще всего врожденная атрезия хоан ассоциировалась с такими пороками развития глаз, как колобома радужки или сетчатки (11 (7,6%) пациентов); у 1 ребенка двусторонняя врожденная атрезия хоан сочеталась с врожденным двусторонним стенозом носослезных каналов.
Нередкое сочетание врожденной атрезии хоан и аномалий развития глаз, по всей видимости, связано с тем, что формирование структур полости носа, носоглотки у эмбриона идет параллельно с закладкой структур органа зрения как во временных рамках, так и топографически. Воздействие различных потенциально тератогенных факторов в период с 3-й по 10—12-ю неделю внутриутробного периода может оказать влияние на закладку и полости носа, и глаз, и слезоотводящих путей.
Цель исследования — оценка состояния полости носа и хоанальной области при врожденной патологии глаз.
Пациенты и методы
Обследованы дети, наблюдающиеся с данной патологией в детской глазной консультативной поликлинике при Морозовской детской клинической больнице и в отделении офтальмологии Российской детской клинической больницы. Обследование проводилось амбулаторно на клинической базе кафедр оториноларингологии и офтальмологии — ОСП РДКБ ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России. Всего осмотрены 43 ребенка с врожденными аномалиями развития глаз от 2 до 14 лет, средний возраст обследуемых детей 6 лет.
Клиническое обследование больных включало в себя анализ жалоб, сбор анамнеза, проведение стандартных оториноларингологического и офтальмологического осмотров, эндоскопическое исследование полости носа и носоглотки по стандартной методике. Жалобы на частые риниты, затруднение носового дыхания предъявляли 10 пациентов, у 1 ребенка отмечалось нарушение оттока слезы, остальные жалоб не предъявляли.
Результаты. Структура патологии представлена в таблице, из которой видно, что наибольшее число детей в нашем исследовании (21 (48,8%) ребенок) имели колобому радужки, которая имеет форму перевернутой капли, связанной со зрачковой областью, и возникает вследствие незаращения щели глазного бокала. При колобоме радужки дефект локализовался у 16 детей на 6 ч, у 1 ребенка на 7 ч, у 4 детей в зоне 5—7 ч (рис. 1 на цв. вклейке). Микрофтальм наблюдался у 2 детей. При этом у 1 ребенка колобома радужной оболочки правого глаза сочеталась с левосторонним микрофтальмом и косоглазием.
Распределение детей по типу выявленной врожденной офтальмологической патологии
Развитие глаза в онтогенезе
Быстрое развитие и усложнение организации зрительного анализатора в эмбриональном периоде составляет один из наиболее интересных разделов теоретической биологии. В практическом отношении этот вопрос важен с точки зрения выяснения причинной обусловленности организации в пространстве элементов структуры оптико-физиологической системы глаза, определяющих его основные характеристики: преломляющую способность (рефракцию) и остроту зрения.
С точки зрения морфогенеза и формообразования преломляющая способность глаза представляет собой систему наиболее тонкой сопряженности элементов структуры. Можно полагать, что данная характеристика обусловлена основополагающими биологическими законами развития, так как именно категория оптической сопряженности органа зрения составляет первичную основу для последующего его функционального развития.
Увидеть - значит своевременно обнаружить всю совокупность объектов в пространстве в их взаимоотношениях друг с другом. Другие органы чувств выполняют те же функции, но менее быстро и с несравненно более близких дистанций. Таким функциональным назначением зрительный анализатор выдвинут на передние рубежи эволюционного процесса, что должно способствовать накоплению в его основе наиболее качественного генофонда.
Орган зрения, как и все другие органы чувств, в ходе филогенетического развития претерпел сложную эволюцию, которая шла в направлении большего и лучшего приспособления глаза к восприятию окружающего мира. Простейшей формой зрения следует считать начало реакции на свет. Почти все живущее чувствительно к свету. У растений световая реакция проявляется гелиотропизмом (листья растений расположены перпендикулярно солнечному свету, головки цветущего подсолнуха в течение всего дня повернуты к солнцу). У некоторых животных зрительные органы не локализованы, покровы их обладают общей раздражимостью по отношению к свету. Простейший орган зрения присущ дождевому червю – отдельные светочувствительные клетки, расположенные изолированно в эпидермисе животного. Они способны различать только свет и его направление. Глаза простейших животных значительно эволюционируют, заметно усложняясь. Моллюск, стоящий еще на достаточно низкой ступени развития, имеет глаз, который напоминает глаз высших животных. Клетки нейроэпителия обращены не к свету, не к центру глаза, а от света. Возникает тип перевернутой сетчатки, что характеризует глаза высших животных. В глазу моллюска уже есть подобие линзы. Фоторецепторы скрываются в углублениях, где они защищены от яркого света, уменьшающего способность улавливать движущуюся тень. Линза выполняет функцию прозрачной защитной мембраны. Постепенно начинает совершенствоваться защитный аппарат глаза.
Глаз человека по структуре представляет собой типичный глаз позвоночных, однако имеет существенные функциональные отличия. Он развивается из разных тканевых источников.
Сетчатка и зрительный нерв формируются из эктоневральной закладки центральной нервной системы.
С конца 4-й недели развития возникает хрусталик. Вначале он имеет вид утолщения покровной эктодермы в том месте, где первичный глазной пузырь начинает превращаться во вторичный. Быстро растущие задние и боковые области обрастают передние и нижние части. Однослойный первичный глазной пузырь на полой ножке превращается во вторичный пузырь, состоящий из двух слоев – глазной бокал. При образовании глазного бокала возникает зародышевая щель, которая заполняется прилежащей мезодермой. Между зачатком хрусталика и внутренней стенкой бокала формируется первичное стекловидное тело. В возрасте 6 недель зародышевая щель глаза и зрительного нерва закрывается, начинает дифференцироваться ножка глазного бокала, образуется a. hyaloidea, питающая стекловидное тело и хрусталик. Наружный листок бокала в дальнейшем превращается в пигментный слой сетчатки, из внутреннего же развивается собственно сетчатка. Края глазного бокала, прорастя впереди хрусталика, образуют радужную и ресничную части сетчатки. Ножка, или стебелек, глазного бокала удлиняется, пронизывается нервными волокнами, теряет просвет и превращается в зрительный нерв.
Из мезодермы, окружающей глазной бокал, очень рано начинает дифференцироваться сосудистая оболочка и склера. В мезенхиме, которая прорастает между эктодермой и хрусталиком, появляется щель – передняя камера. Мезенхима, лежащая перед щелью, вместе с эпителием кожи превращается в роговицу, лежащая сзади – в радужку. К этому времени начинается постепенное запустевание сосудов стекловидного тела. Сосудистая капсула хрусталика атрофируется. Внутри хрусталика образуется плотное ядро, объем хрусталика уменьшается. Стекловидное тело приобретает прозрачность. Веки развиваются из кожных складок. Они закладываются кверху и книзу от глазного бокала, растут по направлению друг к другу и спаиваются своим эпителиальным покровом. Спайка эта исчезает к 7 месяцу развития. Слезная железа возникает на 3-м месяце развития, слезный канал открывается в носовую полость на 5-м месяце.
К моменту рождения ребенка весь сложный цикл развития глаза не всегда оказывается полностью завершенным. Обратное развитие элементов зрачковой перепонки, сосудов стекловидного тела и хрусталика может происходить и в первые недели после рождения. Величайшая потребность новорожденного в совершенной и быстрой адаптации к внешним условиям, правильному развитию и росту, что в большой мере может быть обусловлено безупречным функционированием оптико-вегетативной системы, ведет к наиболее быстрому формированию, прежде всего зрительного анализатора. Рост и развитие глаза у ребенка в основном завершаются к 2-3 годам, а последующие 15-20 лет глаз изменяется меньше, чем за первые 1-2 года. Глаз новорожденного существенно отличается по размерам, массе, гистологической структуре, физиологии и функциям от глаза взрослого.
После рождения зрительный анализатор проходит определенные этапы развития, среди которых можно выделить следующие.
Развитие и морфогенез глазного пузыря
Изучение и термины морфогенеза глаза (биологии глаза)
Биология развития позволяет понять механизмы контроля изменений формы (морфогенез), различных типов клеток (гистогенез) и созревания функций во времени и пространстве в течение эмбриогенеза и раннего развития. Глаз и его развитие — очень популярная тема среди биологов, занимающихся проблемами развития, поскольку строение глаза не меняется на протяжении эволюции позвоночных, и высоко консервативные молекулярные механизмы развития хорошо изучены на модели беспозвоночного животного, плодовой мушки Drosophila melanogaster.
Как по этическим, так и по техническим причинам изучение биологии развития экспериментальными методами у человека невозможно. Это ограничение, вероятно, будет снято после разработки техники индуцированной трансдифференцировки клеток взрослого человека в индуцированные плюрипотентные стволовые (induced pluripotent stems — iPS) клетки. Все более глубокое понимание генетических причин пороков развития человека в сочетании с возможностью получения индуцированных плюрипотентных стволовых клеток пациента позволяет предположить, что биология развития человека станет важной и быстро развивающейся областью науки.
Однако наши современные знания о развитии глаза основаны на исследованиях моделей Drosophila и позвоночных: лягушек (Xenopus laevus, Xenopus tropicalis), рыб (данио рерио: Danio rerio, медака: Oryzias latipes), курицы (Gallus gallus) и мыши (Mus musculus). Каждая модель имеет свои преимущества и недостатки.
Например, эмбрионы курицы интенсивно изучались для составления карты зачатков и экспериментов по рекомбинации тканей, но существует всего несколько доступных исследованию естественных мутаций, поэтому генетические манипуляции затруднены. У мышей возможно прицельно инактивировать почти любой ген методом гомологической рекомбинации в эмбриональных стволовых клетках, но поскольку мышь — плацентарное млекопитающее, трудно визуализировать самые ранние стадии развития.
Хотя точное совпадение экспериментальных данных, полученных на животной модели, с ортологичными процессами у человека маловероятно, учитывая распространение семейств генов при дупликации предкового генома и существование видоспецифичных феноменов, возможно, что многие механизмы развития окажутся одинаковыми и обобщаемыми.
Домен — специфическая зона цепочки аминокислот белка, выполняющая особую функцию.
Картирование зачатков — техника, разработанная Vogt для выявления презумптивных областей на ранних стадиях развития эмбриона.
Гаструляция — процесс раннего эмбрионального развития, во время которого однослойная бластула преобразуется в трехслойную гаструлу.
Гаплонедостаточность — ситуация, при которой у гетерозиготного по какому-либо мутантному гену организма развиваются клинические проявления, поскольку единственной нормальной копии гена недостаточно для синтеза необходимого количества белка и обеспечения нормального функционирования.
Гомеобокс — короткая, обычно высококонсервативная последовательность ДНК различных генов, кодирующая гомеодомен.
Гомеодомен — домен белка, кодируемый гомеобоксом, распознающий и связывающий специфическую последовательность ДНК гена, регулируемого гомейозисным геном.
Гомологичная рекомбинация — тип генетической рекомбинации, при которой происходит обмен последовательностями нуклеотидов между двумя схожими или идентичными молекулами.
ДНК Лиганд — триггерная молекула, связывающаяся с участком белка-мишени.
Морфогены — секретируемые белки, определяющие разделение окружающей их области на определенные участки и определяющие таким образом характер развития ткани.
Градиенты морфогенов — морфогены, продуциремые локализованным источником, проникая в ткани, создают градиент концентрации. Различный по силе в зависимости от концентрации сигнал воздействует прямо на клетки.
Протеины nodal — подгруппа семейства трансформирующего фактора роста—бета (transforming growth factor-beta—TGFβ), регулирующая индукцию мезодермы, развитие нервной системы и формирование дорзо-вентральной оси эмбриона.
Nodal сигналы — пути сигнальной трансдукции в процессе эмбриогенеза, в которых участвуют протеины nodal, имеющие большое значение в формировании структуры и дифференцировке.
Сигнальный путь Notch — клеточная сигнальная система, имеющая важное значение при межклеточном взаимодействии, включающая в себя механизмы регуляции генов, контролирующих дифференцировку мультипотентных клеток в эмбриогенезе и во взрослом возрасте
Нуль мутация — мутация гена, ведущая к нарушению его транскрипции на РНК и/или трансляции в функционирующий белок.
Ортологичные гены — сходные между собой гены различных видов организмов, возникшие из одного гена и передавшиеся от последнего общего предка в процессе вертикального переноса.
Паралоги — пара генов, произошедших от одного предкового гена.
Гомология оследовательностей — наличие сходных последовательностей нуклеиновых кислот или белков, имеющих общее эволюционное происхождение.
Сигнальная трансдукция — процесс, в ходе которого экстрацеллюлярные сигнальные молекулы активируют мембранные рецепторы, которые, в свою очередь, изменяют интрацеллюлярные молекулы.
Транскрипция — процесс образования комплементарной РНК на матрице последовательности ДНК. Это первый этап экспрессии генов.
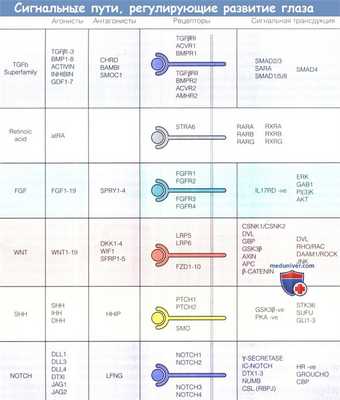
Основные сигнальные пути, регулирующие развитие глаза.
Сигнальные пути сформированы лигандами, антагонистами, рецепторами и эффекторами сигнальной трансдукции.
Пути называют по названиям лигандов, которые представляют собой либо группы белков, составляющих гомологическую последовательность, либо мелкие молекулы.
В зависимости от клеточного окружения в некоторых взаимодействиях рецептор-лиганд могут участвовать несколько каскадов сигнальных трансдукций.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Развитие и морфогенез глазного поля
При гаструляции образуются три зародышевых слоя (энтодерма, мезодерма и эктодерма), развитие нервных структур начинается с формирования нервной пластинки. Первые молекулярные признаки развития глаза — это единая «виртуальная» структура — глазное поле, пересекающее среднюю линию, и определяемое по дискретным и сцепленным экспрессирующим доменам различных факторов транскрипции—факторов транскрипции глазного поля.
Rax — наиболее часто используемый в качестве маркера глазного поля фактор транскрипции. Мутации гена RAX человека — редкая причина микрофтальмии. Гомозиготные нуль-мутации Rax у мышей вызывают полное отсутствие структур глаза из-за того, что не формируется оптическая борозда, из которой затем должен развиться глазной бокал. Другие факторы транскрипции глазного поля включают в себя Otx2, самый ранний молекулярный маркер глазного поля.
Гетерозиготные мутации потери функции ОТХ2 у человека вызывают тяжелые пороки развития глаз. Домен экспрессии фактора транскрипции глазного поля Lxh2 находится в пределах домена экспрессии Rax. Мишенные мутации гена Lhx2 мыши вызывают анофтальмию. Как и многие факторы транскрипции глазного поля, LHX2 функционирует на более поздних стадиях развития глаза. Hesx1 не является классическим фактором транскрипции глазного поля, но нарушение экспрессии Hesx1 в передней части нервной пластинки эмбриона мыши приводит к анофтальмии и микрофтальмии, тогда как у человека такие мутации вызывают септо-оптическую дисплазию.
Так же как и многие другие процессы развития, формирование глазного поля — это результат сбалансированного воздействия различных сигнальных механизмов, в том числе градиентов конкурирующих морфогенов, которые вырабатываются соседствующими тканями и часто оказывают разнонаправленное действие — некоторые сигналы стимулируют формирование глазного поля, другие ингибируют этот процесс.
Лиганды сигнальной системы Wnt секретируются в среднем мозге и параксиальной зоне мезодермы. Подавление или стимуляция сигналов Wnt приведет соответственно к увеличению или уменьшению размеров глазного поля. Например, искусственная стимуляция экспрессии ингибитора сигналов Wnt, dickkopfl у данио-рерио вызывает увеличение размеров глазного поля, тогда как гомозиготные мутации потери функции другого ингибитора сигналов Wnt, axinl вызывают уменьшение размеров глаза.
У эмбрионов шпорцевой лягушки (Xenopus) сигнализация Notch также индуцирует развитие глазного поля, а гипоморфные мутации Notch2 у мышей вызывают двустороннюю микрофтальмию. Преплакодная область — это полоска эктодермы, окружающая зрительное поле и нервную пластинку, которая в ходе эмбриогенеза мигрирует и формирует хрусталиковую плакоду.
Для образования двух глаз глазное поле должно разделиться пополам по средней линии, нарушение этого процесса приводит к циклопии. Сигнализация Nodal нижележащей прехордальной пластинки мезодермы вызывает подавление экспрессии Рах6 и Rax по типу отрицательной обратной связи на средней линии с вентральной стороны и только что разделенных доменов, отграничивающих два зачатка глаз. Лиганды Nodal принадлежат к надсемейству сигнальных молекул TGFβ.
У мутантов данио-рерио — циклопов (Cyclops), оер («одноглазый болван» — one-eyed pinhead) и sqt («косоглазый» — squint) — вследствие мутации потери функции (loss-of-function mutation) сигнального пути Nodal развивается циклопия и не формируется вентральный отдел переднего мозга. Действие Nodal оказывается посредством индукции экспрессии Sonic hedgehog (Shh); и у мышей, и у человека при мутациях Shh/SHH развивается циклопия и голопрозэнцефалия.
После разделения глазного поля двусторонние поля презумптивной нейроретины (presumptive neural retina—PNR) становятся различимы в виде пары мелких бороздок (зрительные бороздки) в передней части нервной пластинки; в конечном итоге из них сформируются глазные пузыри (optic vesicles — OVs). Формирование медиальных и латеральных границ презумптивной нейроретины продолжается под влиянием сигнализации Shh из прехордальной мезенхимы и костного морфогенетического белка (bone morphogenetic protein — BMP) параксиальной мезенхимы соответственно.
Этот процесс имеет критически важное значение для нормального развития глаза; у слепой пещерной рыбки астинакса (Astyanax) глаза отсутствуют вследствие эволюционной мутации, вызвавшей гиперактивацию сигнального каскада Shh в средней линии. Это приводит к смещению медиальной границы PNR кнаружи и образованию мелких глазных пузырей.
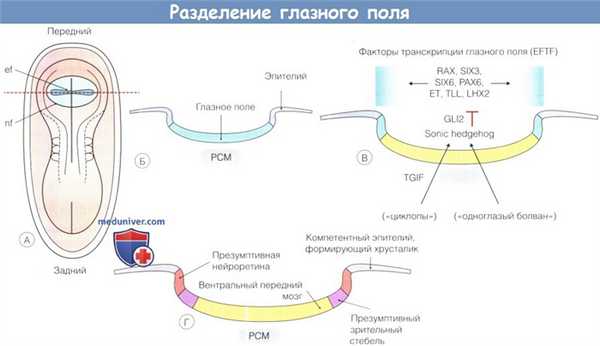
Разделение глазного поля:
(А) Глазное поле (eye field — ef) это виртуальное образование, формирующееся в пределах нервного поля (neural field — nf) на спинной поверхности эмбриона на ранних стадиях развития.
(Б) На разрезе через глазное поле видно, что оно представляет собою пересекающую среднюю линию пластинку нейроэпителиальных клеток, лежащую над структурой, которая называется прехордальной мезенхимой (precordal mesenchyme — PCM) и является ростральным продолжением ното-хорда.
Экспрессия группы факторов транскрипции глазного поля (eye field transcription factors—EFTFs) является отличительным признаком глазного поля на этой стадии развития.
(В) Сигнальный путь Sonic hedgehog (SHH) через GLI2 из прехордальной мезенхимы ингибирует экспрессию EFTF в области средней линии и разделяет глазное поле пополам.
(Г) SHH также вызывает разделение теперь уже двустороннего глазного поля на медиальный презумптивный зрительный стебель (показан зеленым цветом) и расположенную латеральнее презумптивную нейроретину (желтым).
На этой стадии большая часть поверхностной эктодермы является компетентной тканью и способна образовать хрусталиковый пузырек.
Градиент Shh на средней линии также определяет дифференцировку зрительного стебля от глазного бокала. Shh индуцирует экспрессию маркеров зрительного стебля, Рах2, Vax1 и Vax2. Чрезмерная экспрессия Shh на этой стадии вызывает более обширную экспрессию вентрального маркера Рах2 и супрессию Рах6. В результате реципрокной репрессии транскрипции между Рах2 и Рах6 образуется граница зон будущего зрительного стебля и презумптивной нейрортины, т.е. экспрессия Рах2 является маркером презумптивного зрительного стебля, а Рах6 — презумптивной нейроретины.
Мутация потери функции Рах2 вызывает кодовому зрительного нерва — дефект полного закрытия эмбриональной глазной щели. Предполагается, что это результат экспансии домена РАХ6 в зону презумптивного зрительного стебля за счет домена РАХ2. Мутации потери функции Vax2 или его паралога Vax1 у мышей вызывают развитие колобомы зрительного нерва, очевидно, вследствие недостаточности репрессии экспрессии РАХ6. У данио-рерио гены Vax1 и Vax2 экспрессируются в перекрывающихся вентральных доменах внутри развивающихся глаз, при их блокировании не происходит закрытия эмбриональной глазной щели и нейроретина прорастает в вентральную зону.
Дальнейший контроль функции Vaxl/2 осуществляется через контроль ядерной локализации этих белков посредством сигнальной системы SHH.
Shh, ретиноевая кислота и ВМР4 определяют строение развивающегося глазного пузыря и проксимо-вентральные и дорсо-дистальные характеристики нейроэктодермы. Bmp4 экспрессируется в дистальном отделе глазного пузыря, а впоследствии — в дорсальной части глазного бокала.
Чрезмерная экспрессия Bmp4 вызывает расширение области экспрессии домена Рах6 и, вследствие этого, репрессию Рах2. Фенотипически это приводит к прорастанию пигментного эпителия сетчатки (ПЭС) в зону переднего мозга. У мышей такой же фенотип связан с потерей Smoc1, антагониста BMP. Мутации SMOC1 у человека вызывают тяжелые пороки — анофтальмию, как часть офтальмо-акромегалического синдрома. Чрезмерная экспрессия другого антагониста BMP, Noggin, усиливает экспрессию Рах2 и снижает экспрессию Рах6.
Лечение эмбриона Xenopus ретиноевой кислотой вызывает вентрализацию дорсальной части глазного пузыря и расширение области экспрессии домена Vax2 в дорсальную область. Мутации потери функции рецепторов ретиноевой кислоты вызывают уменьшение размеров вентральной части сетчатки, что приводит к нарушению закрытия эмбриональной глазной щели. Утрата большого числа рецепторов к ретиноевой кислоте вызывает развитие еще большего количества аномалий вентральных структур, в том числе отсутствие вентральной части радужки.
Развитие и морфогенез нейроретины глазного пузыря
Shh и ВМР4 определяют дорсо-вентральную полярность презумптичной нейроретины (presumptive neural retina — PNR) глазного пузыря. Bmp4, индуцируемый Lhx2, в свою очередь индуцирует экспрессию Tbx5 дорсальной презумптивной нейроретины, тогда как Shh в вентральных отделах индуцирует экспрессию Vax2.
Чрезмерная экспрессия Bmp4 у Xenopus вызывает расширение области экспрессии домена Tbx5 в вентральную сторону и суппрессию Vax2. Tbx5 и Vax2 презумптивной нейроретины действуют друг на друга как негативные регуляторы и определяют дорсальное или вентральное положение ткани. Vsx2 (ранее известный как Chx10), фактор транскрипции — парноподобный гомеодомен, экспрессируется в прилежащей к хрусталиковой плакоде презумптивной нейроретине в ответ на индуктивную сигнализацию фактора роста фибробластов поверхностной эктодермы. Мутации VSX2 у мышей и людей вызывают развитие микрофтальмии.
Удаление хрусталиковой плакоды из растущего глазного пузыря вызывает аномальную дифференцировку, при введении экзогенного фактора роста фибробластов этого не происходит.
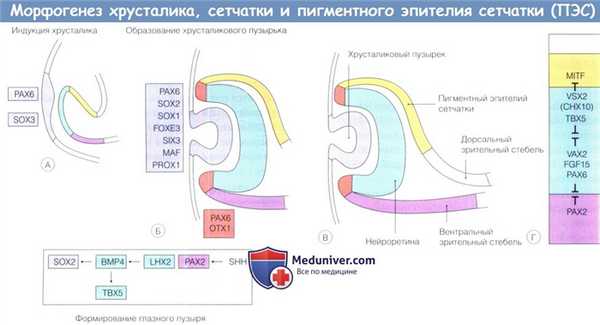
Формирование хрусталика, сетчатки и пигментного эпителия сетчатки (ПЭС):
(А) Для формирования хрусталика и образования хрусталиковой плакоды требуется сигнальная система между поверхностной эктодермой и глазным пузырем.
Формирование зрительного стебля происходит под влиянием индукции РАХ2 посредством SHH.
В презумптивной нейроретине LHX2 индуцирует экспрессию ВМР4, который, в свою очередь, индуцирует экспрессию SOX2 в поверхностной эктодерме; это запускает каскад экспрессии факторов трансдукции в хрусталиковой плакоде и индуцирует образование хрусталикового пузырька.
(Б, В). ВМР4 также индуцирует экспрессию ТВХ5.
(Г) Сложная сеть факторов транскрипции посредством индукции и репрессии определяет границы между зрительным стеблем и презумптивной нейроретиной, презумптивной нейроретиной и пигментного эпителия сетчатки (ПЭС).
Читайте также:
- Поражение сосудов при сахарном диабете. Атеросклероз сосудов при диабете
- Краниодиафизарная дисплазия: клиника, диагностика, наследственность
- Клетки Ходжкина и Рид-Штернберга (HRS) лимфомы Ходжкина
- Исходы травм уха. Течение травмы наружного уха
- Назофарингит (ринофарингит): причины, симптомы и лечение
