Рецепторы гормонов. Количество и чувствительность рецепторов гормонов
Добавил пользователь Cypher Обновлено: 30.01.2026
Гормоны классифицируются по химическому строению, биологическим функциям, месту образования и механизму действия.
Классификация по химическому строению. По химическому строению гормоны делят на 3 группы (табл. 12.1):
- пептидные или белковые;
- производные арахидоновой кислоты – эйкозаноиды (оказывают местное действие)
Классификация гормонов по химическому строению
| Пептидные (белковые) | Производные аминокислот | Стероиды |
| Кортикотропин Соматотропин Тиреотропин Пролактин Лютропин Лютеинеизирующий гормон Фолликулостимули-рующий гормон Мелоноцитстимули-рующий гормон Вазопрессин Окситоцин Паратгормон Кальцитонин Инсулин Глюкагон | Адреналин Норадреналин Трийодтиронин (Т3) Тироксин (Т4) | Глюкокортикоиды Минералокорти-коиды Андрогены Эстрогены Прогестины Кальцитриол |
Клетки некоторых органов, не относящихся к железам внутренней секреции (клетки ЖКТ, клетки почек, эндотелия и др.), также выделяют гормоноподобные вещества (эйкозаноиды), которые действуют в местах их образования.
По биологическим функциям гормоны можно разделить на несколько групп (табл. 12.2.)
Классификация гормонов по биологическим функциям.
| Регулируемые процессы | Гормоны |
| Обмен углеводов, липидов, аминокислот. Водно-солевой обмен. Обмен кальция и фосфатов. Репродуктивная функция. Синтез и секреция гормонов эндокринных желез. | Инсулин, глюкагон, адреналин, кортизол,тироксин,соматотропин. Альдостерон, вазопрессин. Паратгормон, кальцитонин, кальцитриол. Эстрогены, андрогены, гонадотропные гормоны. Тропные гормоны гипофиза, либерины и статины гипоталамуса. |
Эта классификация условна, поскольку одни и те же гормоны могут выполнять разные функции. Например, адреналин участвует в регуляции обмена липидов и углеводов и, кроме этого, регулирует артериальное давление, частоту сердечных сокращений, сокращение гладких мышц. Эстрогены регулируют не только репродуктивную функцию, но и оказывают влияние на обмен липидов, индуцируют синтез факторов свертывания крови.
По месту образования гормоны делятся на гормоны гипоталамуса, гипофиза, щитовидной железы, паращитовидных желез, поджелудочной железы, надпочечников, половых желез.
По механизму действия гормоны можно разделить на 3 группы:
1) Гормоны, не проникающие в клетку и взаимодействующие с мембранными рецепторами (пептидные, белковые гормоны, адреналин). Сигнал передается внутрь клетки с помощью внутриклеточных посредников (вторичные мессенджеры). Основной конечный эффект – изменение активности ферментов;
2) гормоны, проникающие в клетку (стероидные гормоны, тиреоидные гормоны). Их рецепторы находятся внутри клеток. Основной конечный эффект – изменение количества белков-ферментов через экспрессию генов;
3) гормоны мембранного действия (инсулин, тиреоидные гормоны). Гормон является аллостерическим эффектором транспортных систем мембран. Связывание гормона с мембранным рецептором приводит к изменению проводимости ионных каналов мембраны.
Основные свойства и особенности действия гормонов
1. Высокая биологическая активность. Гормоны регулируют метаболизм в очень малых концентрациях – 10 -8 – 10 -11 М.
2. Дистантность действия. Гормоны синтезируются в эндокринных железах, а биологические эффекты оказывают в других тканях-мишенях.
3. Обратимость действия. Обеспечивается адекватным ситуации дозированным освобождением и последующими механизмами инактивации гормонов. Время действия гормонов различно:
· пептидные гормоны: сек – мин;
· белковые гормоны: мин – часы;
· стероидные гормоны: часы;
3. Специфичность биологического действия.
4. Плейотропность (многообразие) действия. Например, катехоламины рассматривались как краткосрочные гормоны стресса. Затем было выявлено, что они участвуют в регуляции матричных синтезов и процессов, определяемых геномом: памяти, обучения, роста, деления, дифференциации клеток.
5. Дуализм регуляций (двойственность). Так, адреналин как суживает, так и расширяет сосуды. Йодтиронины в больших дозах увеличивают катаболизм белков, в малых – стимулируют анаболизм.
Биологическое действие гормонов проявляется через их взаимодействие с рецепторами клеток-мишеней. Клетки, наиболее чувствительные к влиянию определенного гормона, называют клеткой-мишенью. Специфичность гормонов по отношению к клеткам-мишеням обусловлена наличием у клеток специфических рецепторов, которые входят в состав плазматических мембран.
Рецепторы – это специфические структуры клетки, обладающие высоким сродством по отношению к одному определенному гормону.
Рецепторы по химической природе являются, сложными белками (гликопротеинами). Рецепторы пептидных гормонов и адреналина располагаются на поверхности мембраны и содержат три домена. Первый домен расположен на внешней стороне клеточной мембраны, содержит гликозилированные участки и обеспечивает узнавание и связывание гормона. Второй домен – трансмембранный. Третий (цитоплазматический) домен создает химический сигнал в клетке.
Рецепторы стероидных и тиреоидных гормонов содержат три функциональные области:
- домен узнавания и связывания гормона;
- домен связывания с ДНК;
- домен, отвечающий за связывание с другими белками, вместе с которыми участвует в регуляции транскрипции.
Механизм передачи гормональных сигналов через мембранные рецепторы
Гормоны (первичные посредники) связываются с рецепторами на поверхности клеточной мембраны и образуют комплекс гормон-рецептор. Этот комплекс трансформирует сигнал первичного посредника путем изменения концентрации внутри клетки вторичных посредников. Вторичными посредниками являются: циклический АМФ (цАМФ), цГМФ, инозитолтрифосфат (ИФ3), диацилглицерол (ДАГ); Са 2+ , NO (оксид азота II).
1. Аденилатциклазная система.
Гормоны, взаимодействие которых с рецептором клетки-мишени приводит к образованию цАМФ действуют через систему, включающую: белок-рецептор, G-белок и фермент аденилатциклазу.
Известно более 200 различных G-белков. В отсутствие гормона G-белок связан с ГДФ и неактивен. Образование комплекса гормон-рецептор приводит к конформационным изменениям G-белка, замене ГДФ на ГТФ и активации G-белка. Существуют GS-стимулирующий и GI-ингибирующий аденилатциклазу белки.
Последовательность событий, приводящих к изменению активности аденилатциклазы:
- связывание гормона с рецептором;
- комплекс гормон-рецептор взаимодействует с G-белком, изменяя его конформацию;
- вследствие изменения конформации G-белка происходит замена ГДФ на ГТФ;
- комплекс GS-белок • ГТФ активирует аденилатциклазу (комплекс GI-белок • ГТФ ингибирует аденилатциклазу);
- активация аденилатциклазы приводит к увеличению скорости образования цАМФ из АТФ.
Далее образовавшийся под действием аденилатциклазы цАМФ активирует протеинкиназу А. Активированная протеинкиназа А фосфорилирует ферменты и другие белки, что сопровождается изменением функциональной активности белков-ферментов(активацией или ингибированием).
Протеинкиназа – это внутриклеточный фермент, который может существовать в двух формах. В отсутствие цАМФ протеинкиназа представлена тетрамером, состоящим из двух каталитических (2С) и двух регуляторных (2R) субъединиц (неактивный фермент). В присутствии цАМФ протеинкиназный комплекс обратимо диссоциирует на одну 2R-субъединицу и две свободные каталитические субъединицы С. Субъединицы С обладают ферментативной активностью.
Рецепторы гормонов. Количество и чувствительность рецепторов гормонов
а) Механизм действия гормонов. Рецепторы гормонов и их активация. Первым этапом действия гормона является его взаимодействие со специфическим рецептором клетки-мишени. Клетки, утратившие рецепторы, не способны к ответу. Рецепторы некоторых гормонов локализуются на поверхности клеточных мембран, рецепторы других — присутствуют в цитоплазме и ядре. Взаимодействие гормона и рецептора инициирует начало каскада ферментативных реакций, каждая стадия которого становится все более мощной, поэтому даже малая концентрация гормона способна давать существенный эффект.
Рецепторы гормонов являются крупными белками, и каждая восприимчивая к гормону клетка может иметь от 2000 до 100000 таких рецепторов. Рецепторы высокоспецифичны для конкретного гормона, что предопределяет тип гормона, который сможет оказать влияние на определенную ткань. Гормоном активирует только те ткани, которые располагают специфическим к нему рецептором.
Локализация различных типов рецепторов гормонов обычно следующая.
1. Внутри клеточной мембраны или на ее поверхности (рецепторы к гормонам белковой и полипептидной природы, катехоламинам).
2. В цитоплазме клетки (рецепторы к различным стероидным гормонам).
3. В клеточном ядре (рецепторы к гормонам щитовидной железы, которые предположительно связаны с одной или более хромосомами).
б) Количество и чувствительность рецепторов гормонов регулируются. Количество рецепторов клеток-мишеней обычно меняется изо дня в день и даже в течение нескольких минут. Белки-рецепторы часто инактивируются и разрушаются в процессе функционирования, а затем реактивируются и воссоздаются протеин-синтезирующими механизмами клеток. Например, увеличение концентрации гормона и связывание его с рецепторами может спровоцировать уменьшение количества активных рецепторов.
Регулируемое снижение активных рецепторов может быть результатом:
(1) инактивации части молекул рецептора;
(2) инактивации части внутриклеточных белковых информационных молекул;
(3) временной секвестрации рецептора внутри клетки, вне области взаимодействия с гормоном на мембране клетки;
(4) разрушения рецепторов лизосомами после их попадания в клетку;
(5) снижения формирования рецепторов.
В этом случае низкая рецепторная плотность приводит к снижению способности клетки реагировать на присутствие гормона в межклеточном веществе.
Некоторые гормоны способны повышать активность рецепторов и внутриклеточных информационных белков-переносчиков в клетках-мишенях. Это означает, что гормон либо индуцирует большее, чем обычно, образование рецепторов или сигнальных молекул в клетке с помощью протеин-синтезирующих систем, либо повышает способность рецептора к взаимодействию с гормоном. В этом случае ткани-мишени становятся более чувствительными к стимулирующему действию гормона.
в) Внутриклеточные сигналы гормон-рецепторного взаимодействия. Практически всегда ответ тканей-мишеней формируется при условии образования гормон-рецепторного комплекса. Это изменяет функцию самого рецептора, и активированный рецептор инициирует ответную реакцию клетки. Чтобы пояснить это, приведем несколько примеров различных видов такого взаимодействия.
г) Рецепторы, связанные с ионными каналами. Практически все нейромедиаторы, такие как ацетилхолин и норадреналин, взаимодействуют с рецепторами постсинаптической мембраны, что всегда является причиной изменения структуры рецептора, приводя к открытию или закрытию каналов для одного или более ионов. Одни из связанных с ионными каналами рецепторов открывают или закрывают натриевые или калиевые каналы, другие — кальциевые и т.д. Ионный ток через канал обусловливает последующий эффект в постсинаптических клетках.
Некоторые гормоны могут реализовать свои влияния, активируя ионные каналы рецепторов, однако большинство гормонов, открывающих и закрывающих ионные каналы, делают это не напрямую, а взаимодействуя с G-белок-или энзим-сопряженными рецепторами, как это обсуждается далее.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Взаимодействие стероидного гормона с клеткой. Биологическая активность гормона
Ядерные рецепторы к стероидным гормонам известны как лигандзависимые факторы транскрипции. Не связанные с лигандами рецепторы могут находиться либо в цитоплазме (например, рецептор к глюкокортикоидам), либо в ядре (например, рецепторы к эстрогену, прогестерону и гормонам щитовидной железы). Для большинства стероидных гормонов не связанные с лигандом рецепторы находятся в клеточном ядре в виде олигомеров с большой молекулярной массой (300 кДа, скорость оседания 7-10 с) и могут быть изолированы в цитозольной фракции от клеток и тканей, разрушенных в гипотонической среде.
Олигомеры образуются за счет нековалентной связи мономерного рецептора протеина с димером белка теплового шока (HSP90, HSP70 или HSP56).
Стероидные гормоны, легко проникая через клеточную мембрану, связываются со специфическими рецепторами ядра. Лиганд, связывающийся с рецептором, запускает его трансформацию — так называемый процесс активации. В процессе активации рецептор изменяет свою конформацию; в итоге это выражается в его отделении от белка теплового шока, который освобождает ДНК-связывающий участок. После этого происходит ядерная транслокация и димеризация активированного рецептора.
К настоящему времени накоплены данные, указывающие на термодинамическую необратимость этого процесса. Комплекс гормон-рецептор после этого связывается со специфическим регионом ДНК, так называемым гормонспецифичным элементом (ГСЭ), который расположен выше (upstream) гена. Первый ГСЭ был идентифицирован для глюкокортикоидного рецептора. Позднее выяснилось, что ГСЭ для прогестеронового, андрогенового, эстрогенового и минералокортикоидного рецепторов сходны с таковым для глюкокортикоидного рецептора.
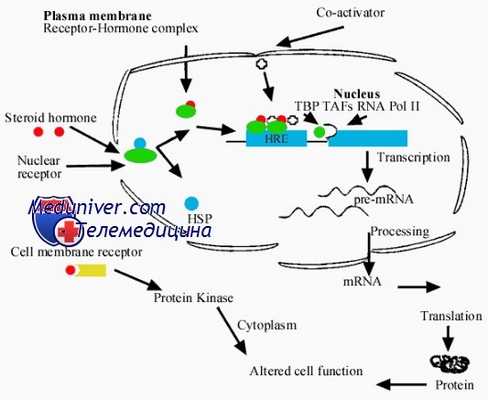
Стероидные ГСЭ генов-мишеней представляют собой палиндромные (с инвертированными повторами) последовательности ДНК из 15 нуклеотидных пар. Эта связь привлекает множество вспомогательных факторов, известных как корегуляторы (коактиваторы или корепрессоры), которые создают благоприятные (или неблагоприятные) для транскрипции условия в промоторной области и взаимодействуют с другими общими факторами транскрипции и РНК-полимеразой II. Коактиваторы можно представить как адаптеры на пути передачи сигнала.
Связывание с корегуляторами модулирует последующую транскрипцию, т.е. активацию и инактивацию специфических генов.
Например, антагонисты гормонов вызывают изменение конформации TAF-2, что закрывает коактиваторсвязывающий участок, вместо него давая путь корепрессору, что приводит к угнетению экспрессии гена. Содержание этих корегуляторов в разных тканях играет важную роль в определении реакции этих тканей на агонисты или антагонисты стероидных гормонов.
Биологическая активность гормона определяется по меньшей мере четырьмя факторами, тесно связанными со строением рецептора к данному гормону. Первый — родство гормона к гормонсвязывающему домену рецептора. Второй — различная экспрессия подтипов рецептора в ткани-мишени, изменяющая чувствительность к одному и тому же гормону. Третий — конформация лигандрецепторного комплекса и ее влияние на последующую димеризацию и модуляцию адаптерных протеинов. И наконец, четвертый — различная экспрессия адаптерных белков тканями-мишенями и разная степень фосфорилирования.
Более высокая концентрация коактиваторов или корепрессоров в ткани-мишени может оказывать влияние на клеточный ответ этой ткани на один и тот же лиганд. Фосфорилирование рецептора протеинкиназами повышает транскрипционную активность рецептора.
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
Чувствительность к андрогенам: за пределами общеизвестного
Журнал: Проблемы эндокринологии. 2018;64(5): 315‑320
Гонадные и внегонадные эффекты тестостерона у мужчин активно исследуются в последние годы. На сегодняшний день не вызывает сомнения увеличение рисков ожирения, сахарного диабета 2-го типа, артериальной гипертензии и атеросклероза у мужчин с дефицитом тестостерона. Одним из механизмов, посредством которых реализуется действие тестостерона, является чувствительность к андрогенам, определяемая длиной CAG-повторов в гене андрогенного рецептора. Увеличение количества CAG-повторов снижает их активность и проявляется низкой чувствительностью к тестостерону. Напротив, уменьшение числа тринуклеотидных повторов сопровождается повышением чувствительности рецепторов к андрогенам. В этом обзоре рассмотрены данные о влиянии полиморфизма гена андрогенного рецептора на эмбриогенез и дифференцировку пола, регуляцию сперматогенеза, прогрессирование рака и доброкачественной гиперплазии предстательной железы, симптоматику гипогонадизма, контроль углеводного и липидного обменов, минеральную плотность костной ткани, эндотелий сосудов, ответ на заместительную терапию тестостероном, а также на психосоциальные аспекты личности мужчин. Внедрение исследования полиморфизма гена рецептора андрогенов в клиническую практику позволит не только прогнозировать фертильность мужчины или риск развития рака простаты, но и подбирать индивидуальную терапию дефицита тестостерона.
Действие андрогенов затрагивает практически все органы и системы. Формирование половых признаков в процессе эмбриогенеза, становление и функционирование репродуктивной системы и обеспечение фертильности — это лишь малая часть эффектов тестостерона (Т) и его метаболитов. Гораздо шире внегонадное действие андрогенов, представленное их влиянием на сердечно-сосудистую систему, липидный и углеводный обмены, минерализацию костной ткани, стимуляцию кроветворения, формирование и функционирование когнитивных функций, психосоциальную адаптацию и сексуальность. Одним из наиболее важных вопросов клинической практики является различная выраженность симптомов гипогонадизма, а также разный ответ на заместительную терапию у пациентов с одинаковым уровнем сывороточного Т. Ответ на этот вопрос кроется в определении чувствительности к андрогенам и является на сегодняшний день крайне малоизученным. Данный обзор содержит анализ наиболее актуальных исследований, опубликованных в рецензируемых журналах баз данных PubMed и eLibrary.
Структура и функции андрогенного рецептора
Многогранное действие Т реализуется через андрогенные рецепторы (AR), расположенные внутриклеточно и структурно относящиеся к рецепторам стероидных гормонов. AR присутствуют в клетках семенников, простаты, кожи, нервной системы и других тканей. Генетический контроль за активностью этих рецепторов осуществляется геном AR, который и обусловливает чувствительность к андрогенам и реализацию действия Т. Широта и разносторонность эффектов, реализуемых через ген AR, впечатляют — от дифференцировки пола в эмбриогенезе, регуляции сперматогенеза, прогрессирования рака и доброкачественной гиперплазии предстательной железы (ДГПЖ), симптоматики гипогонадизма до влияния на углеводный и липидный обмены, минеральную плотность костной ткани, эндотелий сосудов и даже психосоциальные аспекты личности.
Ген AR локализован на длинном плече Х-хромосомы и состоит из 8 экзонов, кодирующих 3 структурно-функциональных белковых домена. N-концевой домен участвует в гомодимеризации рецептора и связывании с ко-активаторами или ко-репрессорами и представлен экзоном 1. Второй — ДНК-связывающий домен содержит петлевой участок из двух «цинковых пальцев» (экзоны 2 и 3). С-концевой домен обеспечивает связывание со стероидными гормонами и представлен экзонами 4—8 [1].
В последние годы внимание исследователей особенно сосредоточено на изучении первого экзона гена AR, для которого характерны повторы последовательности из трех нуклеотидов — цитозина, аденина и гуанина — CAG. Триплет CAG кодирует аминокислоту глутамин, поэтому от числа тринуклеотидных повторов зависит количество глутамина в белке. Так, меньшему числу CAG-повторов соответствует меньшая степень конформационных изменений рецептора, что делает связь гормона и рецептора прочнее и приводит к повышению транскрипционной активности AR. Напротив, с увеличением числа CAG-повторов связь между андрогенами и рецептором становится слабее и транскрипционная активность AR снижается. Таким образом, чем больше длина CAG-повторов, тем слабее оказывается эффект андрогенов при одинаковым уровне Т [2]. Слабая активность андрогенов, вызванная удлинением триплета, находит отражение в механизме обратной связи в пределах гипоталамо-гипофизарно-гонадной оси. У здоровых мужчин удлинение CAG-повторов сопровождается усилением секреции лютеинизирующего гормона (ЛГ) [3], что при интактных клетках Лейдига вызывает повышенную продукцию Т и, следовательно, компенсирует ослабление действия андрогенов. Результатом гипертестостеронемии будет повышенная ароматизация Т в эстрадиол, концентрация которого возрастет. По-видимому, именно с этим связана гинекомастия у пациентов с увеличенным числом CAG-повторов [4]. Высокие концентрации эстрадиола у мужчин с удлинением CAG-повторов и сохраненной обратной связью в оси гипоталамус-гипофиз-гонады может усиливать эффекты этих гормонов в эстроген-зависимых тканях, например в костной [3]. Рядом исследователей обнаружена отрицательная корреляция между длиной CAG-повторов и минеральной плотностью костной ткани [5—7]. Эта связь прослеживалась и у молодых субъектов, но с увеличением возраста мужчин негативное влияние полиморфизма гена AR на минеральную плотность костной ткани усиливалось.
Для мужчин европейской популяции нормальным считается количество CAG-повторов от 9 до 37. Однако в этом нормативе существуют популяционные различия. Так, среднее число CAG-повторов в гене AR у мужчин-европейцев составляет 21, у африканцев — 17, у азиатов — 23. При этом, например 25 CAG-повторов хотя и укладывается в нормативные значения, зачастую бывает связано с ослаблением действия андрогенов, проявляющимся соответствующей клинической симптоматикой [8].
Эмбриогенез и дифференцировка пола
Предстательная железа
Одним из наиболее андроген-чувствительных органов является простата, имеющая большое число рецепторов к андрогенам. Предполагается, что полиморфизм гена AR с его способностью моделировать эффекты андрогенов влияет на долю злокачественных клеток в предстательной железе (ПЖ) [9]. Согласно метаанализу множества исследований [10], отношение шансов возникновения рака ПЖ при снижении частоты тринуклеотидных повторов составляет 1,19.
Возможная связь между ДГПЖ и CAG-полиморфизмом гена AR имеет также другой аспект: ДГПЖ представляет собой разрастание ткани переходной зоны и периуретральной области ПЖ (эпителиальная и фибромышечная гиперплазия). В 2 крупных исследованиях сравнивали сопоставимые когорты здоровых добровольцев и пациентов с ДГПЖ. Отношение шансов увеличения размеров простаты до необходимого хирургического вмешательства в группе с частотой CAG-повторов 24 составляло 1,92. Более того, при снижении длины CAG-повторов увеличивалась частота средних и тяжелых обструктивных симптомов нижних мочевых путей. Также была найдена обратная корреляция между частотой аденом и размером простаты, с одной стороны, и длиной CAG-повторов — с другой [11, 12]. Помимо этого, была выявлена связь полиморфизма гена AR с сексуальной активностью мужчин с ДГПЖ [13].
Фертильность
Установлена связь числа CAG-повторов в гене AR с олигозооспермией [14, 15]. Хорошо известно, что для осуществления сперматогенеза необходима стимуляция клеток Сертоли фолликулостимулирующим гормоном (ФСГ). Так, интратестикулярная активность андрогенов опосредуется важным кофактором, положительно влияющим на функцию клеток Сертоли. Установлена отрицательная связь числа CAG-повторов с эффективностью сперматогенеза [16]. Наиболее тяжелые формы нарушений сперматогенеза наблюдаются у пациентов со спинобульбарной атрофией Кеннеди — редким наследственным заболеванием, характеризующимся яркой неврологической симптоматикой в сочетании с гипогонадизмом и бесплодием. При этом число тринуклеотидных повторов в гене AR достигает 36 и более [17].
Клинические проявления гипогонадизма и психосоциальные аспекты личности
Анализируя клинические проявления андрогенного дефицита, следует подчеркнуть их тесную связь с полиморфизмом гена AR. Так, среди пациентов с нормальными концентрациями Т у мужчин с большим числом CAG-повторов увеличен риск развития симптомов андрогенного дефицита [18, 19]. Регрессионный анализ данных международного опросника Aging Males’ Symptoms выявил нарастание симптомов дефицита Т по двум шкалам (психологической и соматической) по мере увеличения длины CAG-повторов в гене AR, тогда как симптомы сексуальной шкалы были связаны непосредственно с уровнем эндогенного Т [18]. Азиатское исследование с участием 702 мужчин, не выявив связи между уровнем Т и распределением в популяции полиморфизма гена AR, показало, что при уровне Т выше 340 нг/дл пациенты с числом CAG-повторов более 25 имели достоверно более высокий риск развития симптомов андропаузы, чем лица со значением тринуклеотидных повторов менее 22 [19]. Иными словами, мужчины с нормотестостеронемией, имеющие большую длину CAG-повторов в гене AR, подвержены более высокому риску возникновения симптомов андрогенного дефицита.
Кроме того, установлена связь между длиной CAG-повторов в гене AR с неспецифическими проявлениями андрогенного дефицита, такими как тревожность и депрессия [20, 21]. Регрессионный анализ выявил положительную связь числа CAG-повторов с выраженностью депрессии у мужчин старше 50 лет. Это демонстрирует нарастание симптомов депрессии синхронно с увеличением длины тринуклеотидных повторов по мере ослабления чувствительности рецепторов к андрогенам независимо от уровня эндогенного Т [21]. Показано также, что генетически детерминированное удлинение CAG-повторов в гене AR является независимым фактором риска высокой тревожности, панических атак и фобических расстройств [20].
Удивительными кажутся данные о связи полиморфизма гена AR с интеллектуальной одаренностью мальчиков [22]. Так, установлено, что высокий уровень интеллекта (IQ более 130) у мальчиков ассоциирован с малой длиной CAG-повторов в гене AR, даже при допубертатно низких уровнях Т. Другими словами, высокая чувствительность к андрогенам является фактором, предрасполагающим к интеллектуальной одаренности вне зависимости от уровня самого Т.
Представляют интерес данные о полиморфизме гена AR у мужчин с синдромом Клайнфельтера, имеющих дополнительную Х-хромосому, на которой и расположен обсуждаемый ген [23]. Длина тринуклеотидных повторов имела положительную связь с ростом, но в то же время была отрицательно связана с минеральной плотностью костной ткани и отношением размаха рук к росту, что отражает негативное влияние андрогенов на эпифизарные зоны роста кости. Кроме того, удлинение CAG-повторов способствовало развитию гинекомастии и уменьшению размеров тестикул, тогда как укорочение длины триплета ассоциировалось со стабильными партнерскими отношениями и профессиями, требующими более высокого уровня образования.
Поразительно, что чувствительность к андрогенам может обусловливать и такое явление, как транссексуализм. Установлено, что удлинение цепи CAG-повторов в гене AR является одной из трех изученных генетических причин мужского транссексуализма [24].
Метаболический статус
Выявлена положительная независимая корреляция числа CAG-повторов в гене AR с содержанием жировой ткани тела, уровнем лептина и инсулина. Малое число CAG-повторов было независимо ассоциировано с протективными параметрами (низкая жировая масса, низкий уровень инсулина плазмы), но одновременно и с нежелательными факторами (низкий уровень липопротеинов высокой плотности) [25]. Сходные данные в отношении дислипидемии были получены и в исследовании больных сахарным диабетом 2-го типа [26].
Еще одним интереснейшим аспектом влияния полиморфизма гена AR является эффективность заместительной терапии тестостероном (ЗТТ) у пациентов с различными формами гипогонадизма. Крупное исследование TIMES 2 показало, что высокая чувствительность к андрогенам, моделируемая малым числом CAG-повторов в гене AR, независимо положительно связана с более значимой динамикой уровня инсулина натощак, триглицеридов, диастолического артериального давления и индекса инсулинорезистентности НОМА на фоне ЗТТ. Однако связи полиморфизма гена AR с уровнем гликированного гемоглобина, другими показателями липидограммы, ожирением или распределением жировой ткани не выявлено [10]. Негативное влияние удлинения CAG-повторов было обнаружено и в другом исследовании [27], показавшем более высокие цифры артериального давления и худшие значения липидограммы на фоне ЗТТ в сочетании с более низкими значениями гематокрита, находящегося под контролем андрогенов. Еще одним параметром, реагирующим на ЗТТ, является размер ПЖ [28]. Выявлена негативная связь между длиной тринуклеотидных повторов и изменением объема ПЖ на фоне терапии Т [10]. Причем 20 триплетов гена AR и менее повышают риск увеличения размеров ПЖ и темпы роста уровня простат-специфического антигена (ПСА) [27].
Терапия Т у пациентов с синдромом Клайнфельтера при коротких триплетных повторах вызывает более глубокое подавление уровня ЛГ, выраженный рост концентрации ПСА и повышает уровень гемоглобина [23].
Эндотелий
Одной из важнейших точек приложения внегонадного действия Т является эндотелий, причем данное взаимодействие моделируется полиморфизмом гена AR. Этот вопрос наименее изучен. Ранее у здоровых добровольцев была обнаружена связь низкого числа CAG-повторов в гене AR с нарушениями артериальной вазореактивности вне зависимости от уровня общего и свободного T [29]. Некоторыми исследованиями [30, 31] доказано ухудшение функции эндотелия у больных сахарным диабетом 2-го типа. В то же время существуют данные о негативном влиянии дефицита Т на сердечно-сосудистую систему у мужчин [32, 33]. При исследовании влияния полиморфизма гена AR на формирование нарушений функции эндотелия у мужчин с сахарным диабетом 2-го типа [34] было установлено, что большее количество CAG-повторов в гене рецептора AR через ослабление чувствительности к андрогенам обусловливает снижение выраженности эндотелий-зависимой вазодилатации в ходе пробы с реактивной гиперемией одновременно с усилением продукции таких маркеров дисфункции эндотелия, как P-селектин и резистин. Таким образом, увеличение числа CAG-повторов в гене AR ухудшает как сосудодвигательную, так и секреторную функцию эндотелия и может рассматриваться как предиктор развития и прогрессирования сердечно-сосудистых поражений у мужчин с сахарным диабетом.
Заключение
Нарастающий интерес исследователей к изучению биохимических и молекулярных механизмов действия Т диктует необходимость расшифровки генетических аспектов функционирования AR. Изучение чувствительности к андрогенам, определяемой длиной тринуклеотидного повтора CAG в гене AR, не только объясняет феномен различного ответа на ЗТТ у пациентов с одинаковым уровнем эндогенного Т, но и необходимо для понимания половой дифференцировки, психологического статуса, сексуальности и репродуктивного потенциала, а также рисков развития рака ПЖ и ДГПЖ, остеопороза, нарушений углеводного, липидного обменов и даже сердечно-сосудистых заболеваний у мужчин. Наиболее важной в клинической практике является возможность прогнозирования ответа пациента на ЗТТ. У лиц с малым числом CAG-повторов в гене AR из-за высокой чувствительности к андрогенам могут быть использованы более низкие дозы препаратов Т, тогда как неэффективность стартовой дозы ТЗТ у мужчин с большим числом тринуклеотидных повторов, свидетельствует о необходимости повышения дозы вводимого Т. На сегодняшний день определение CAG-полиморфизма гена AR не рекомендовано для рутинной практики, однако в ближайшем будущем оно может быть использовано, в частности для подбора индивидуальной терапии андрогенного дефицита.
Дополнительная информация
Источник финансирования. Работа выполнена при поддержке Российского научного фонда (грант РНФ № 14−25−00052).
Конфликт интересов. Авторы статьи заявляют об отсутствии финансовой заинтересованности и других потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов:
Сбор и анализ материала, написание текста — Хрипун И.А.; написание и редактирование текста — Воробьев С.В. Оба автора внесли существенный вклад в проведение поисково-аналитической работы и подготовки статьи, прочли и одобрили финальную версию текста перед публикацией.
ВГМУ, Профессорская клиника Юцковских, Владивосток
Профессорская клиника Юцковских, Владивосток
Владивостокский государственный медицинский университет
Андрогензависимые синдромы кожи у женщин: роль антиандрогенной терапии на современном этапе
Одной из сложных задач современной дерматологии и косметологии остается лечение андрогензависимых синдромов кожи. Синдромы гиперандрогении (ГА) часто служат причиной психологического дискомфорта и отрицательно влияют на качество жизни женщин. Синдромы ГА у женщин являются частыми причинами психологического дистресса. Внешние проявления избытка андрогенов отмечаются у 10—30% женщин в популяции и становятся существенным косметическим дефектом, отражающимся на нервно-психическом статусе женщины, приводя к раздражительности, депрессивным состояниям, снижая качество жизни и обусловливая социальные проблемы в виде ограничений в выборе профессии и сложностей в трудоустройстве, снижая чувство достоинства женщин. В патогенезе этих процессов большое значение уделяется роли гормонов. Под влиянием избытка андрогенов у женщин развивается синдром ГА, что клинически проявляется себореей, гирсутизмом, андрогензависимой алопецией.
Заболевания, при которых имеются признаки повышенной продукции андрогенов, относятся к междисциплинарной патологии и требуют пристального внимания и знаний не только гинеколога, но и в равной степени затрагивают сферу интересов эндокринологов, дерматологов, косметологов.
Кожа человека является комплексом андрогенчувствительных структур (сальные и потовые железы, волосяные фолликулы). Под влиянием андрогенов находятся многие важные функции кожи: митотическая активность клеток, активность сальных желез, рост волос, выраженность пигментации. Являясь тканью-мишенью для половых стероидных гормонов, например андрогенов, кожа принимает активное участие в метаболизме стероидных половых гормонов, в частности, в экстрагландулярном образовании из стероидов-предшественников.
Источником андрогенов в организме женщины являются яичники и кора надпочечников. Их синтез происходит под стимулирующим действием лютеинизирующего гормона (ЛГ) и адренокортикотропного гормона (АКТГ). Основной андроген надпочечников — дигидроэпиандростерон (ДГЭА) и его сульфат (ДГЭАС), яичников — тестостерон (Т) и андростендион (А). Действие половых гормонов на кожу осуществляется через специфические андрогенные рецепторы (АР) сосочкового слоя дермы, фибробласты, кератиноциты, эпителиальные клетки просвета апокриновых желез и секреторный отдел эккриновых сальных желез, а также в себоцитах и волосяных фолликулах.
Мишенями для половых стероидов в коже являются эпидермис, волосяные фолликулы, сальные железы, меланоциты и фибробласты. Под воздействием андрогенов усиливаются дифференцировка и митотическая активность клеток эпидермиса, увеличивается синтез межклеточных липидов, увеличивается толщина эпидермиса, стимулируется рост и пигментация волос, усиливается продукция кожного сала, снижается синтез глобулина, связывающего половые стероиды (ГСПС) в печени. В то же время под воздействием эстрогенов тормозится рост волос в андрогензависимых зонах, угнетается продукция кожного сала, усиливается синтез ГСПС.
Важным патогенетическим звеном при ГА является нарушение связывания андрогенов со специфическим ГСПС. Связанные с ГСПС стероиды недоступны для соединения с рецепторами в тканях-мишенях и оказания биологического эффекта. Биологический эффект в клетках-мишенях оказывает лишь свободная фракция половых стероидов. Она же ответственна за клинические проявления андрогенного эффекта.
Таким образом, ГА в организме женщины сопровождается избыточной секрецией мужских половых гормонов или повышенной чувствительностью тканей к неизмененному уровню андрогенов. Совокупность признаков поражения кожи и ее придатков, возникающих в результате избытка андрогенов в женском организме (себорея, гирсутизм, андрогензависимая алопеция), можно обозначить термином «гиперандрогенная дермопатия».
ГА может проявляться в виде абсолютного увеличения количества гормонов (абсолютная ГА) или повышенной чувствительностью рецепторов к нормальному или сниженному содержанию андрогенов в организме (относительная ГА).
Акне. В клетках сальных желез — себоцитах тестостерон под действием фермента α5-редуктазы 1-го типа переходит в самый активный метаболит — дигидротестостерон, который служит непосредственным стимулятором роста и созревания себоцитов, образования кожного сала. Основными причинами относительной ГА являются повышенная активность фермента α5-редуктазы 1-го типа, повышенная плотность ядерных дигидротестостероновых рецепторов, увеличение свободной фракции тестостерона в крови. Таким образом, в патогенезе акне ведущая роль принадлежит гормональному фактору, приводящему к гипертрофии и повышенному функционированию сальных желез, фолликулярному гиперкератозу в протоке сально-волосяного фолликула (СВФ), активизации микроорганизмов с последующим воспалением.
Себорея. Себорея — патологическое состояние кожи, обусловленное нарушением функции сальных желез, изменением состава их секрета. Возникновение синдрома ГА — себореи, связано с избытком андрогенов. Проявляется в местах, богатых сальными железами, — на лице, волосистой части головы, верхней части груди, в межлопаточной области. Развитию себореи способствуют нарушения функции половых желез (в частности, нормального соотношения между эстрогенами и андрогенами), надпочечников, щитовидной железы, а также иммунной, пищеварительной, центральной и вегетативной систем. Различают сухую и жирную себорею. У некоторых больных может быть смешанная себорея: на одних участках имеются симптомы сухой, а на других — жирной себореи.
Огромная роль в патогенезе себореи отводится наследственности. Генотип — врожденные качества, заложенные в генах. Структура кожного покрова является врожденной и неизменной на протяжении всей жизни, несмотря на то что поверхность кожи может постоянно меняться — трескаться, шелушиться, менять цвет (тускнеть), стать более грубой, тем не менее структура ее всегда индивидуальная, не меняющаяся.
При повышенном уровне мужских половых гормонов может изменяться тип кожи. Она становится жирной, поры на лице и себорейных участках расширяются, рН достигает 6, появляется склонность к дисхромиям.
Жирную себорею подразделяют на жидкую и густую, в зависимости от консистенции кожного сала, что определяется его физико-химическим составом. Участвуя в формировании водно-липидной мантии, кожное сало оказывает выраженное бактерио- и фунгицидное действие на большинство микроорганизмов. Компоненты липидной пленки на поверхности кожи являются производными сальных желез и эпидермиса и на 60% представлены триглицеридами, на 20—25% — эфирами воска, на 10—15% — скваленом, на 1—3% — эстерифицированными стеролами и на 0,5—2% — свободным стеролом. В увеличенном объеме кожного сала снижается концентрация незаменимой α-линоевой кислоты, которая подавляет экспрессию фермента трансглутаминазы. α-Линоевая кислота является основным регулятором дифференцировки кератиноцитов. Трансглутаминаза участвует в синтезе кератина 1-й и 10-й фракций, белков инволюкрина, лорикрина и филлагрина — основных компонентов цементирующего межклеточного вещества. Уменьшение количества линолевой кислоты приводит к повышению рН кожного сала, в итоге значительно нарушается барьерная функция эпителия и создаются условия для роста микроорганизмов на поверхности кожи и внутри сально-волосяных фолликулов.
Основными критериями оценки типов кожи на приеме у врача-косметолога являются характеристика салообразования — повышенное, пониженное, умеренное; степень расширения пор — расширенные, умеренно-расширенные, точечные; состояние липидной субстанции эпидермиса после умывания — чувство стянутости, дискомфорт, шелушение, покраснение.
Сравнивая различные состояния кожи здоровых пациентов и пациентов с себореей посредством неинвазивных методов морфофункциональной диагностики кожи (себуметрии, корнеометрии, рН-метрии) с применением аппарата SOFT PLUS, CATELLANI GROUP (Италия), мы получили следующие результаты (табл. 1).
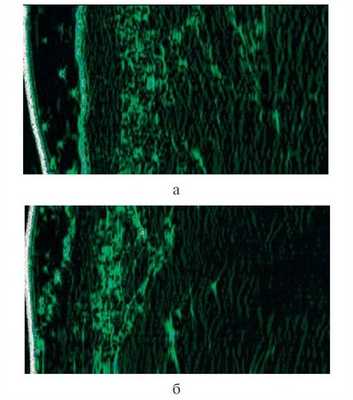
Одним из объективных методов оценки состояния кожи является ультразвуковое исследование (УЗИ). У пациента с нормальной кожей при УЗИ видны сглаженность рельефа эпидермиса, равномерное распределение эхосигнала; эпидермис четко отграничен от дермы, дерма дифференцирована на отделы, расположение волокон дермы линейное (рис. 1, а). Рисунок 1. Ультразвуковая картина кожи в норме (а) и у пациента с себореей (б). У пациента с себореей отмечаются изменение эхоструктуры эпидермиса, нарушение его рельефа, протоки сальных желез расширены; отсутствует четкая граница между эпидермисом и дермой, эхогенность субэпидермального отдела дермы снижена (рис. 1, б).
Еще одним симптомом ГА является гирсутизм.
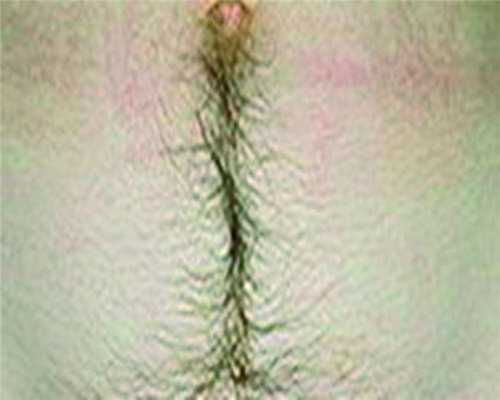
Гирсутизм. Под гирсутизмом (рис. 2) Рисунок 2. Гирсутизм у пациентки (из фотоархива ООО «Профессорская клиника Юцковских»). следует понимать увеличение у женщин количества волос на лице, груди, животе, вокруг сосков, а также на спине и бедрах. При усиленном оволосении женщин еще говорят о гипертрихозе. Между терминами «гирсутизм» и «гипертрихоз» существует разница: первый обозначает мужской тип роста волос у женщин, а второй — количественное увеличение волос на теле. Гирсутизм чаще всего является признаком некоторых эндокринных заболеваний, вызванных поражением гипоталамо-гипофизарной области, коры надпочечников и яичников. Но гирсутизм не всегда связан с нейроэндокринной патологией.
Выделяют следующие формы гирсутизма, не связанные с патологией яичников или надпочечников: конституциональный, экзогенный, идиопатический. Конституциональная форма гирсутизма носит наследственный характер. При этом виде повышенного оволосения продукция андрогенов в норме. К этой форме гирсутизма относится избыточное оволосение у женщин отдельных национальностей (жительницы стран Востока и Средиземноморья). Экзогенная форма гирсутизма возникает в тех случаях, когда приходится вводить андрогены в виде инъекций лекарственных препаратов. Гирсутизм может развиваться при применении таких препаратов, как кортикостероиды, стрептомицин. Предположение об идиопатическом гирсутизме возникает в тех случаях, когда не обнаруживается эндокринная патология и исключается экзогенный и конституциональный гирсутизм. Этот диагноз ставится при нормальном и повышенном содержании свободного тестостерона и невозможности установить причину заболевания. Учитывая, что достаточно часто гирсутизм служит проявлением ГА, целесообразно применение антиандрогенных препаратов. При гирсутизме косметическое устранение волос (эпиляция) эффективно только при условии удаления или угнетения источника повышенной секреции андрогенов.
Алопеция. В развитии андрогенной алопеции (рис. 3) Рисунок 3. Андрогенная алопеция у пациентки (из фотоархива ООО «Профессорская клиника Юцковских»). основная роль принадлежит α5-редуктазе — ферменту, который восстанавливает тестостерон до дигидротестостерона (ДГТ). ДГТ сокращает фазу роста волосяного фолликула, что приводит к его уменьшению и постепенной атрофии. Одновременно сокращается продолжительность жизненного цикла волоса, в результате чего наблюдается усиленное выпадение волос. Исследования показали, что уровень андрогенов у женщин с андрогенной алопецией часто не превышает норму. Это свидетельствует о том, что в патогенезе андрогенной алопеции основную роль играет повышенная чувствительность фолликулов к действию ДГТ. Женская андрогенная алопеция носит диффузный характер и редко приводит к облысению. При андрогенной алопеции на голове всегда остается венчик волос в затылочной и височных областях. Суть феномена состоит в том, что волосяные фолликулы в этих зонах не имеют рецепторов, способных воспринимать действие андрогенов. Поэтому исключается одна из обязательных причин андрогенной алопеции — гормональная активность — и волосы в этих областях генетически «застрахованы» от выпадения.
Современные подходы к лечению различных форм ГА включают назначение системных и наружных препаратов. Выбор методов лечения ГА должен основываться на адекватной клинической оценке степени тяжести синдромов ГА. Следует всегда учитывать состояние эндокринного фона, сопутствующие заболевания и состояния.
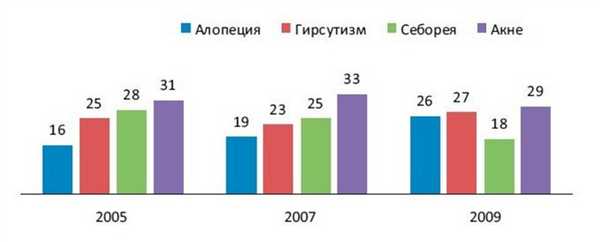
По нашим данным, за последние 5 лет значительно увеличилась обращаемость пациентов с синдромами ГА, особенно с такими, как алопеция и гирсутизм (рис. 4). Рисунок 4. Динамика обращаемости пациентов с синдромами гиперандрогении (по данным ООО «Профессорская клиника Юцковских», 2005—2009 гг.).
Механизм антиандрогенного действия КОК заключается в снижении продукции гонадотропинов (ЛГ), редукции уровня циркулирующих андрогенов, увеличении связывания андрогенов, снижении секреции андрогенов надпочечниками, ингибировании α5-редуктазы, связывании андрогенных рецепторов.
Первым КОК антиандрогенного действия был препарат диане-50, созданный на основе синтезированного в 1961 г. ципротерон-ацетата. В 1985 г. были созданы диане-35 (со снижением дозы эстрогенного компонента) и препарат андрокур (10 или 50 мг ципротерона ацетата).
Проведенные в 40 странах Европы два плацебо-контролируемых исследования с участием 1072 женщин в возрасте 14—45 лет с проявлениями акне показали, что применение КОК Джес по сравнению с плацебо к концу 6-го месяца способствует выраженному регрессу как невоспалительных, так и воспалительных акне. К окончанию терапии в среднем по группе акне регрессировали на 56%; состояния клинического излечения удалось достичь у 22% пациенток. Наиболее выраженное улучшение наблюдалось у женщин в возрасте от 14 до 22 лет.
В другом исследовании, посвященном оценке косметических аспектов приема антиандрогенного КОК на основе дроспиренона, к концу 6-го месяца терапии было продемонстрировано уменьшение себореи (на 71%), акне (на 75%) и гипертрихоза (показатель Ферримана—Галлвея — на 43%). При оценке толщины эпидермиса (корнеометрия) выявлено повышение гидратации на 26%, что было обусловлено как влиянием эстрогена в составе КОК, так и снижением концентрации андрогенов и/или их активности. Патоморфологически повышение гидратации эпидермиса обусловлено стимуляцией эстрогенами синтеза гиалуроновой кислоты. Определение снижения уровня испарения жидкости с поверхности кожи (на 35%) с помощью теваметрии (TEWL) также свидетельствовало об улучшении состояния кожи.
Важнейшим преимуществом Джес является хорошая переносимость, в частности, отсутствие влияния на массу тела, а иногда ее снижение. Это объясняется тем, что дроспиренон, входящий в состав препарата, дает антиминералокортикоидный эффект и препятствует задержке жидкости в организме, которая часто служит причиной увеличения массы тела при приеме КОК. Джес эффективно уменьшает проявления предменструального синдрома, в частности, появление акне в период, предшествующий менструации.
Таким образом, патогенетически оправдано и клинически актуально использование для лечения себореи, гирсутизма, андрогензависимой алопеции современных КОК, в частности Джес, которые подавляют секрецию гонадотропинов, стимулируют синтез ГСПС и снижают активность α5-редуктазы. Применение КОК, оказывающих антиандрогенный эффект, может улучшить не только гормональные параметры и классические проявления ГА, но и общее состояние, а также качество кожи, повышая гидратацию и улучшая характеристики, отражающие состояние кожи.
Так как диагностика и лечение различных форм ГА находятся на стыке нескольких специальностей (гинекология, эндокринология, дерматология), то только их объединение позволит добиться высоких результатов в лечении себореи, гирсутизма и андрогензависимой алопеции.
Читайте также:
