Рентгенограмма, МРТ при синдромах Марфана и Элерса-Данлоса
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Заболевания позвоночника очень многогранны и причины их различны — от врожденных патологий до инфекций и травм. Но чаще всего у современного человека болит спина из-за сидячего образа жизни и нехватки физической нагрузки.
Если не принять меры, пока ничего не беспокоит, с возникшими потом проблемами будет бороться сложнее. Как сегодня врачи лечат позвоночник и как можно предотвратить необходимость этого, рассказали специалисты на круглом столе «Доктора Питера».
Разные проблемы
Заболевания позвоночника могут быть как врожденного, так и приобретенного генеза. Игорь Комолкин , ортопед-травматолог, доктор медицинских наук, ведущий научный сотрудник ФГБУ «СПБНИИФ» Минздрава России, пояснил, что наиболее часто встречаемая ортопедическая патология у детей — нарушение осанки, обусловленное дисплазией соединительной ткани или особенностью формирования опорно-двигательного аппарата в различные периоды роста ребенка. Менее часто встречаются диспластические или идиопатические сколиозы, а также врожденные деформации позвоночного столба и грудной клетки. Дегенеративные заболевания позвоночника у детей встречаются значительно реже, чем у взрослых. К ним можно отнести кифозы, формирующиеся при болезни Шейермана-Мау, и другие дегенеративно-дистрофические заболевания с поражением позвоночно-двигательных сегментов. У взрослого населения дегенеративные заболевания позвоночника преобладают и в процентном соотношении к другой ортопедической патологии занимают ведущие позиции. К ним можно отнести межпозвоночные грыжи с корешковым синдромом, остеохондроз и т. д. Опухоли и инфекционные поражения позвоночного столба — значительно более редкие проблемы. Это тяжелые состояния, требующие хирургической помощи. Отдельный спектр составляют травмы позвоночника: подходы к их лечению могут быть консервативными и хирургическими, в зависимости от клинической симптоматики, а также данных лучевых и функциональных методов исследования.
— На самом деле, грыжа — это всего лишь 4% от обращений пациентов, а чаще всего к нам обращаются с так называемой неспецифической болью в спине, — рассказал Евгений Беляев , директор по медицине, главный врач, травматолог-ортопед «Мастерской Здоровья». — Ее вызывают как чрезмерные спортивные нагрузки, так и их нехватка. Сидячий образ жизни и отсутствие движения приводят к мышечной гипоксии, нарушению микроциркуляции в точках крепления мышц — возникает миофасциальный болевой синдром. Когда нет движения, начинает страдать и позвоночный диск: нарушается его эластичность, возникают трещины и начинает вытекать пульпозное ядро диска. Так что при сидячей работе есть смысл вспомнить регулярную разминку, как было в советское время, добавить физических нагрузок. При этом их избыток также может перегрузить мышцы и запустить ту же гипоксию. Так что все в жизни должно быть сбалансировано.
По словам эксперта, каждого пациента надо рассматривать индивидуально. Сначала стоит разобраться с причиной возникновения боли, отсюда выстраивать лечение. Как правило, здесь виной мышечные спазмы, фибромиалгия и несвоевременное обращение к врачу. Многие терпят: «Поболит и пройдет». Такой подход не срабатывает — боль возвращается с усилением патологии, и тогда справляться с ней сложнее. Если прийти к специалисту вовремя, процесс проще остановить, не доводя до поражения глубоких структур.
Большая часть детских сколиозов носит идиопатический характер — то есть причина возникновения неизвестна. По словам эксперта, общее количество пациентов с этим диагнозом почти не изменилось за сто лет: как и в начале 20 века, он поставлен 3 — 8% детского населения, а тяжелые формы более чем у 10% от этого числа.
— Причина возникновения сколиоза до сих пор неизвестна, хоть и изучены механизмы его развития, — пояснил Леин. — Думаю, за выяснение этих причин вполне могут дать Нобелевскую премию. Мы знаем, что сколиоз развивается из-за рассогласования роста позвоночника и спинного мозга, но конкретных факторов, влияющих на это, пока не выявлено. Еще мы знаем, что это генетически наследуемая проблема.
Диагностика всему голова
Пациентов с проблемами позвоночника действительно становится больше, но не из-за роста числа патологий, а потому, что диагностика ортопедических заболеваний стала чуть лучше, добавил Григорий Леин. В целом она проста: осмотр, при необходимости — рентген. Но все больше врачей и пациентов узнают о современных методах лечения, образованность людей растет, и к врачам они обращаются все активнее.
Во всех случаях показана консультация ортопеда-травматолога, включающая сбор жалоб, анамнеза, оценку ортопедического статуса.
— При обследовании позвоночника врач обращает внимание на асимметрию надплечий, лопаток, положение таза относительно оси позвоночника в трех плоскостях, активную подвижность позвоночника, рассказал Игорь Комолкин.
При выборе методов исследования необходимо учитывать все ключевые моменты, участвующие в формировании патологии опорно-двигательного аппарата. Например, при сколиотической деформации кроме рентгенографии позвоночника необходимо выполнить исследование подвздошных костей таза, чтобы оценить состояние зон роста и выявить признаки прогрессирования сколиоза.
— Впрочем, бывает, что стандартных рентгенограмм в двух проекциях недостаточно для составления алгоритма лечения, — пояснил эксперт.
Более сложные ортопедические проблемы, врожденные пороки развития требуют топической диагностики и визуализации — в этом случае рекомендовано КТ позвоночника. Для исключения конфликтных ситуаций с позвоночным каналом показано МРТ.
Если проблемы со спиной связаны с нервно-мышечными заболеваниями, в диагностике участвуют неврологи и нейрохирурги. В этом случае пациенту могут назначить электронейромиографию конечностей, позволяющую диагностировать структурные изменения в нервной системе.
Поскольку сколиоз бывает и при системных заболеваниях скелета — таких, как синдромах Марфана и Элерса-Данлоса, нейрофиброматозе и т.д., — то в этих случаях, требуется генетическое обследование для уточнения диагноза и прогнозирования течения заболевания. На основании полученных данных составляют план лечения и реабилитации. У пациентов с этими синдромами деформации позвоночника, как правило, усиливаются со временем.
Шаги прогресса
По словам Игоря Комолкина, топическая (относящаяся к конкретному месту) диагностика повышает шансы благоприятного сценария для ортопедической патологии. Можно заметить малейшие изменения и прицельно воздействовать на причину заболевания —например, опухоль.
— Прогресс в диагностике не стоит на месте, — сообщил Евгений Беляев. — Сейчас появились возможности сшивки снимков: если раньше врач соединял отдельные снимки скрепками, чтобы посмотреть все деформации, то сейчас появились программы, которые сшивают снимки, сохраняя все структурные особенности и масштаб. Это позволяет видеть не только искривление в одной оси, но и ротационные подвижки в позвоночнике.
Кроме того, 3D-моделирование уже позволяет строить прогнозы и подбирать лечение. Но сохраняется и классический подход к лечению, где первоочередная задача — убрать боль.
— Если есть возможность лечить консервативно, все же не стоит сразу отправлять пациента к нейрохирургу, — считает эксперт. — Прежде чем оперировать, надо исчерпать все возможные консервативные методы, так как после хирургического вмешательства возникает ряд своих проблем, требуется долгая реабилитация. Стоит отталкиваться от желаний пациента: что ему важно — просто избавиться от боли или, например, вернуться к любимому виду спорта?
— Ортопедия на протяжении своей истории менялась мало, — продолжил Григорий Леин, — как еще до нашей эры деформации спины лечили фиксирующими устройствами, так и сегодня пациентам с тяжелыми деформациями нужны гимнастика и корсет.
Поменялись разве что методики изготовления за это время — раньше это было тяжелое гипсовое изделие, сейчас же по индивидуальному 3D-скану можно изготовить легкий и удобный. К нему подбирают также комплекс упражнений. Надо понимать, что корсет — это не кусок пластика, а сложная медицинская методика, поэтому обязательно обращаться именно к врачу — специалисту по корсетированию. Все это методы доказательной медицины, т.е. эффективность фиксации спины в сочетании с гимнастикой доказана.
Твердая поддержка
Безусловно, любое лечение не будет эффективно без полного комплекса реабилитации, подчеркнули эксперты. Она многогранна: в нее входит и укрепление мышц упражнениями, и соблюдение режима использования корсета, сна и бодрствования. Технические средства реабилитации — например, корсеты — широко распространены при прогрессирующих формах идиопатического сколиоза. Но этим их использование не ограничивается. Как отметил Григорий Леин, есть гипертифоз, компрессионные переломы, повреждения мягкотканного аппарата мышц, связок — каждому варианту из множества корсетов находится применение. Кроме того, в комплекс реабилитации могут входить массаж, гимнастика и мануальная терапия. Гимнастику рассматривают как ведущий метод лечения в некоторых случаях — при ряде травм и легкой патологии.
— При реабилитации после травм нужен корсет жесткой фиксации для разгрузки мышц, — добавил Евгений Беляев, — но бывает, что надо ограничить какие-то группы мышц: например, при переломе и остеопорозе. Именно при последнем случаются спонтанные переломы, которые даже не осознать, — их обнаруживают уже на приеме у врача, на снимке видны компрессионные изменения позвонков. Поскольку врачи не знают, сколько прошло времени, в этом случае сильно обездвиживать уже нет смысла. Жесткая фиксация важна при недавнем переломе — с последующим переходом на более мягкие варианты. Тут важно найти грамотного специалиста, который подберет нужный корсет.
— Компания «Ecoten» и сотрудники клиники детской хирургии и ортопедии «СПБНИИ фтизиопульмонологии» разработали модульный функционально-корригирующий корсет для коррекции нарушения осанки, начальных сколиотических и кифотических деформаций позвоночника, — рассказал Игорь Комолкин. — В нем есть жесткая металлическая шина, которую можно моделировать с учетом условий оптимальной коррекции деформации. Далее, на этапах реабилитации, шину меняют на стандартные ребра жесткости, удерживающие корпус в правильном положении. Эти корсеты уже прошли клинические испытания и внедрены в производство.
По словам Игоря Комолкина, применение корсетов позволяет снизить темп прогрессирования деформации позвоночника, однако в периоды активного роста в пубертатном периоде эффективность лечения может быть ниже ожидаемой. Массаж, лечебная физкультура, физиотерапия являются неотъемлемой частью корсетотерапии. Все дополнительные меры реабилитации, включая остеопатию и мануальную терапию, нужно рассматривать в контексте общей системы восстановления.
Спасение в движении
В настоящее время не существует точных показателей, позволяющих определить, у какого человека сколиоз будет, а у какого — нет. Если при сколиотической деформации пациент вместо операции и лечения корсетом выберет спорт, это прежде всего его решение. Оно может снизить вероятность появления болевого синдрома при крайних степенях деформации, но не окажет влияния на прогресс деформации, считает Игорь Комолкин.
— У меня есть пациент со сколиозом четвертой степени и воронкообразной деформацией грудной клетки третьей степени. Он отказался от хирургического лечения, — рассказал эксперт. — Молодой человек активно занимался бодибилдингом, что позволило добиться такой мышечной массы, что искривления позвоночника под одеждой не было заметно. С эстетической точки зрения пациента беспокоила воронкообразная грудная клетка. Он согласился на операцию по исправлению формы грудной клетки, и операция дала отличный результат. В дальнейшем пациент продолжил заниматься спортом, так и не согласившись на операцию по исправлению позвоночника. Я пояснил ему, что это его выбор: если в дальнейшем он перестанет укреплять мышцы, для него это будет тупиковым вариантом — его будут беспокоить боли в позвоночнике, ограничивающие активность.
— Для профилактики хороши дозированные физические нагрузки, ЛФК и кинезиотерапия, — считает Евгений Беляев, — но по отдельности они не столь эффективны.
Григорий Леин добавил, что конкретных методов профилактики проблем с позвоночником, увы, нет. Но активный образ жизни с нормальным уровнем физических нагрузок совершенно точно позволяет предотвращать болевой синдром и травмы позвоночника, вызванные внезапной нагрузкой, — такие бывают у не привыкших к активности людей с сидячим образом жизни. В целом эксперт обобщил: физнагрузка в адекватном объеме полезна любому.
Рентгенограмма, МРТ при синдромах Марфана и Элерса-Данлоса
Рентгенограмма, МРТ при синдромах Марфана и Элерса-Данлоса
а) Определения:
• Синдром Марфана (МФ): семейное заболевание, обусловленное пороком развития соединительной ткани с поражением опорно-двигательного аппарата, глаз и сосудов, но с вариабельной фенотипической экспрессией
• Синдром Элерса-Данлоса (ЭД): наследственное заболевание соединительной ткани с различными фенотипическими проявлениями (множество синдромов)
б) Визуализация:
1. Непропорциональное удлинение конечностей (МФ, ЭД):
• Особенно кистей, стоп (арахнодактилия) в 89% случаев
2. Слабость связочного аппарата (МФ, ЭД):
• Патологическое искривление возможно в нескольких областях:
о Чаще возникает сгибательная деформация 5-го пальца (90°)
о Рекурвация коленного сустава, высокое стояние надколенника
• Реже нестабильность запястья
• Плоская стопа, вальгусная деформация большого пальца, молоткообразная деформация пальцев стопы
• Нестабильность суставов, вероятно обусловливающая хронические состояния:
о Повторяющаяся субклиническая травма
о Выпоты, гемартроз (ЭД>МФ)
о Ранний остеоартрит (ЭД>МФ)
• Вывихи суставов (наколенник, тазобедренный сустав, нижняя челюсть, ключица, пальцы) ЭД>МФ
• Протрузия вертлужной впадины
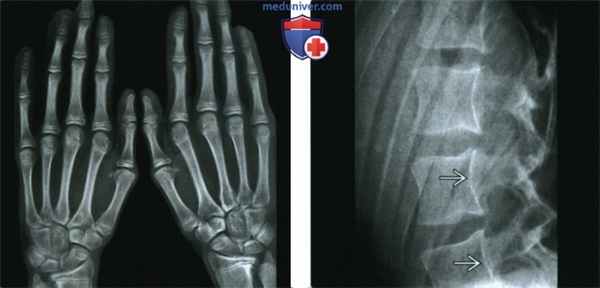
(Слева) Рентгенография кистей в ЗП проекции: определяется арахнодактилия при отсутствии других изменений. Наблюдается аномальный метакарпальный индекс.
(Справа) Рентгенография в боковой проекции, этот же пациент: определяется неровность задней поверхности тел позвонков. Плотность кости нормальная. На уровне позвонков L5-S1 был выявлен двусторонний спондилолизис с IV степенью спондилолистеза (изображение не представлено). Аномалии позвоночника в сочетании с арахнодактилией могут наблюдаться как при синдроме Марфана, так и при синдроме Элерса-Данлоса: в этом случае диагностирован синдром Марфана.
3. Мягкие ткани: различные проявления при МФ, ДМ:
• МФ: худощавость, атрофия мышц, скудная жировая клетчатка
• ЭД: подкожные кальцификации (некроз жировой ткани) в сочетании с повышенной частой гетеротопической оссификации
• При МРТ определяется слабость связочного аппарата, разрывы сухожилий, тендинопатия
4. Позвоночник (МФ, ЭД):
• Сколиоз (40-60%): картина схожа с идиопатическим сколиозом
• Неровность задней поверхности тел позвонков с эктазией твердой мозговой оболочки (63%):
о Также могут наблюдаться расширение отверстий, нарушение морфологии крестца
• Спондилолизис со спондилолистезом
• Подвывих атланто-аксиального сочленения (редко)
5. Грудная клетка (МФ, ЭД):
• Воронкообразная или килевидная деформация грудной клетки
6. Другие признаки:
• Плотность кости (МФ, ЭД): нормальная
• Эпифизиолиз головки бедренной кости (МФ, ЭД): ↑ частота встречаемости
в) Дифференциальная диагностика синдромов Марфана и Элерса-Данлоса:
1. Гомоцистинурия:
• Схожие признаки: непропорциональность длины конечностей, арахнодактилия и гиперподвижность суставов
• Клиническим признаком для дифференциального диагноза является задержка умственного развития
• Диффузная остеопения наблюдается при гомоцистеинурии, но не при других состояниях
• Большее число контрактур суставов
• Различный характер поражения глаз: двусторонний нижний вывих хрусталиков, возникающий в раннем детском возрасте
• Иной характер поражения сосудов: тромбоэмболия
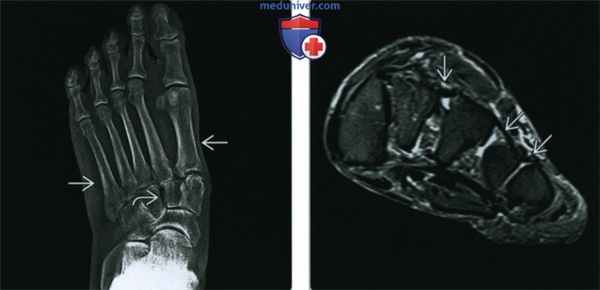
(Слева) Рентгенография в ПЗ проекции: плоская стопа, обусловленная болезнью Марфана. Наблюдается пронация переднего отдела стопы, определяемая по отклонению оснований плюсневых костей. Также имеется просвет между клиновидными костями, что говорит об ослаблении связок.
(Справа) МРТ Т2ВИ, режим подавления сигнала от жира, корональный срез: у этого же пациента определяется растяжение межклиновидных и межплюсневых связок В, что приводит к аномальному просвету между клиновидными и плюсневыми костями. На других изображениях (не представлены) определялись разрывы сухожилий, все это вносит вклад в формирование клинически плоской стопы, характерной для болезни Марфана.
г) Патология. Общая характеристика:
• Генетика:
о Синдром Марфана: обычно аутосомно-доминантный тип наследования; в 20-30% обусловлен спонтанными мутациями:
- Мутации в локусе (15q15-15q21) длинного плеча XV хромосомы (MFS1)
о ЭД: сложная классификационная система:
- Множество генетических дефектов, влияющих на синтез коллагена (не менее 19 фокусов минимум в 12 генах)
д) Клинические особенности:
1. Проявления:
• Типичные признаки/симптомы:
о Синдром Марфана:
- Высокий рост, худощавость (> 95-го перцентиля)
- Непропорциональная длина конечностей относительно туловища):
Кисти, стопы > нижние конечности > верхние конечности
- Поражение сосудов:
Кистозный медионекроз с расслоением и разрывом аорты
Расширение проксимального отдела восходящей аорты → недостаточность аортального клапана и расширение венечных пазух
Медионекроз основной легочной артерии (менее часто)
Недостаточность аортального и митрального клапанов
- Поражение глаз:
Патологическое изменение подвешивающих связок → двусторонний вывих хрусталиков (в верхнем направлении) в 57% случаев
Также наблюдаются страбизм и отслоение сетчатки
о Диагностика синдрома Элерса-Данлоса основана на наличии клинической триады:
- Хрупкость кожных покровов:
Кожу можно приподнять с формированием высокой складки; со временем складки становятся постоянными; кожа легко рубцуется
- Гипермобильность суставов
- Хрупкость сосудов:
Желудочно-кишечные, кожные и бронхолегочные кровотечения
Спонтанное расслоение аорты или крупных сосудов, смерть от потери крови
- Встречается поражение глаз, но двусторонний вывих хрусталиков встречается менее часто, чем при МФ
2. Демография:
• Возраст:
о Симптомы часто не проявляются до детского возраста
• Эпидемиология:
о Синдром Марфана: 4-6 на 100000 новорожденных
3. Течение и прогноз:
• Средний возраст смерти при синдроме Марфана 28 лет; смерть вызвана сердечно-сосудистыми заболеваниями
4. Лечение:
• Устранение проблем, связанных с сердечно-сосудистой системой и органами зрения
• Реконструкция нестабильных слабых связок
е) Список использованной литературы:
1. Hammarstedt JE et al: Arthroscopic ligamentum teres reconstruction of the hip in Ehlers-Danlos syndrome: a case study. Hip Int. 0, 2015
ВЕДЕНИЕ БЕРЕМЕННОСТИ И РОДОВ У ПАЦИЕНТОК С МЕЗЕНХИМАЛЬНЫМИ ДИСПЛАЗИЯМИ (СИНДРОМАМИ МАРФАНА, ЭЛЕРСА-ДАНЛО, ВРОЖДЕННОЙ ГЕМОРРАГИЧЕСКОЙ ТЕЛЕАНГИОЭКТАЗИЕЙ)
Цель – изучение особенностей течения беременности и родов и разработка тактики ведения беременных с мезенхимальными дисплазиями (синдромами Марфана, Элерса-Данло, врожденной геморрагической телеангиоэктазией).
Материалы и методы. Проведен анализ 56 беременностей у пациенток с мезензимальными дисплазиями, включая «стертые» формы заболеваний: 23 – с синдромом Марфана, 22 – с синдромом Элерса-Данло и 11 – с врожденной геморрагической телеангиоэктазией в возрасте от 18 до 36 лет. Исследование включало ретроспективный анализ и проспективное исследование. Обследование включало в себя сбор анамнеза, клиническое обследование, лабораторные тесты, включая расширенное гемостазиологическое исследование, инструментальные исследования (ЭКГ, ЭхоКГ, рентгенография грудной клетки, КТ, МРТ), молекулярную диагностику синдромов.
Результаты. Абсолютно у всех пациенток во время беременности отмечалось прогрессирование ранее имевшихся геморрагических проявлений и появление кровотечений новых локализаций. У беременных с синдромом Марфана отмечена высокая частота осложнений со стороны сердечно-сосудистой системы, включавших увеличение степени пролапса митрального клапана (18 беременных), развитие и прогрессирование аортальной недостаточности (10), формирование или прогрессирование недостаточности митрального клапана (13). Одна больная с синдромом Марфана погибла через полтора месяца после родоразрешения от разрыва аорты. Артериовенозные мальформации в легких обнаружены у 10 беременных с синдромом Рендю-Ослера. У шести из них имелись признаки гипоксии вследствие шунтирования крови справа налево. У одной беременной с синдромом Рендю-Ослера во второй половине беременности появились симптомы сдавления верхней полой вены, причиной которого явилось формирование аневризмы плечеголовного ствола. Различные дефекты в системе гемостаза обнаружены у 40 беременных: у 38 нарушение функции тромбоцитор, у 31 – признаки хронического ДВС-синдрома. 53 беременных с мезенхимальными дисплазиями были родоразрешены путем операции кесарево сечение. При родоразрешении через естественные родовые пути (у трех беременных с синдромом Элерса-Данло) отмечались глубокие разрывы мягких тканей промежности и массивные кровотечения.
Заключение. Беременность и роды у больных с мезенхимальными дисплазиями представляют высокий риск развития осложнений как у матери, так и у плода. Для успешного исхода беременности у таких больных следует рекомендовать мультидисциплинарный подход, а также тщательное динамическое наблюдение с широким спектром лабораторно-инструментальных исследований, включая расширенное гемостазиологическое исследование. Ввиду высокого риска угрожающих жизни осложнений при родоразрешении через естественные родовые пути пациенткам с мезенхимальными дисплазиями показано родоразрешение путем операции кесарево сечение.
Ключевые слова
Об авторах
ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России
Россия
к.м.н., доцент кафедры акушерства и гинекологии медико-профилактического факультета Первого МГМУ им. И.М. Сеченова. Адрес: ул. Трубецкая, 8, стр. 2, Москва, Россия, 119048
ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России
Россия
Список литературы
1. Камоева C.В., Савченко Т.Н., Иванова А.В., Абаева Х.А. Современные генетические аспекты пролапса тазовых органов у женщин. Акушерство, гинекология и репродукция. 2013; 1: 16-21.
2. Кудинова Е.Г., Момот А.П., Трухачева Н.В. Анализ эффективности тромбопрофилактики у беременных с мезенхимальной дисплазией. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2014; 7 (2): 14-18.
3. Радецкая Л.С. Беременность и мезенхимальные дисплазии (синдромы Марфана, Элерса-Данло, Рендю-Ослера). Акушерство, гинекология и репродукция. 2015; 4: 74-85.
4. Abdalla S.A., Geithoff U.W., Bonneau D., Plauchu H. et al. Visceral manifestations in hereditary hemorrhagic telangiectasia type 2. J Med Genet. 2003; 40: 494-502.
5. Borck G., Beighton P., Wilhelm C., Kohlhase J., Kubisch C. Arterial rupture in classic Ehlers- Danlos syndrome with COL5A1 mutation. Am J Med Genet A. 2010 Aug; 152A (8): 2090-3.
6. Combeer E.L., Combeer A.D. A rare cause of maternal death: liver and inferior vena cava rupture due to previously undiagnosed Ehlers- Danlos Syndrome type IV. Eur J Anaesthesiol. 2008 Sep; 25 (9): 765-7.
7. Coulon C. Thoracic aortic aneurysms and pregnancy. Presse Med. 2015 Nov; 44 (11): 1126-35.
8. Cox D.A., Ginde S., Kuhlmann R.S., Earing M.G. Management of the pregnant woman with Marfan syndrome complicated by ascending aorta dilation. Arch Gynecol Obstet. 2014 Oct; 290 (4): 797-802.
9. Emmanuel Y., Thorne S.A. Heart disease in pregnancy. Best Pract Res Clin Obstet Gynaecol. 2015 Jul; 29 (5): 579-97.
10. Erez Y., Ezra Y., Rojansky N. Ehlers-Danlos type IV in pregnancy. A case report and a literature review. Fetal Diagn Ther. 2008; 23 (1): 7-9.
11. Figueiredo S., Martins E., Lima M.R., Alvares S. Cardiovascular manifestations in Marfan syndrome. Rev Port Cardiol. 2001 Dec; 20 (12): 1203-18.
12. Guntupalli K.K., Karnad D.R., Bandi V., Hall N., Belfort M. Critical Illness in Pregnancy: Part II: Common Medical Conditions Complicating Pregnancy and Puerperium. Chest. 2015 Nov; 148 (5): 1333-45.
13. de Gussem E.M., Lausman A.Y., Beder A.J., Edwards C.P., Blanker M.H., Terbrugge K.G., Mager J.J., Faughnan M.E. Outcomes of pregnancy in women with hereditary hemorrhagic telangiectasia. Obstet Gynecol. 2014 Mar; 123 (3): 514-20.
14. Hassan N., Patenaude V., Oddy L., Abenhaim H.A. Pregnancy outcomes in Marfan syndrome: a retrospective cohort study. Am J Perinatol. 2015 Feb; 30 (2): 123-30.
15. Inocêncio G., Braga A., Lima T., Buchner G. Osler-Weber-Rendu syndrome during pregnancy. BMJ Case Rep. 2013 Jun 25; 2013.
16. Jakobi P., Weiner Z., Best L., Itskovitz-Eldor J. Hereditary hemorrhagic telangiectasia with pulmonary arteriovenous malformations. Obstet Gynecol. 2001 May; 97 (5 Pt 2): 813-4.
17. Jondeau G., Nataf P., Belarbi A., Farcot J.C., Iung B., Delorme G., Gandjbakhch I., Bourdarias J.P. Aortic dissection at 6 months gestation in a women with Marfan's syndrome. Masui. 2002 Aug; 51 (8): 916-20.
18. Khurshid I., Downie G.H. Pulmonary arteriovenous malformation. Postgrad Med J. 2002; 78: 191-197.
19. Kim S.W., Kim D., Hong J.M. Acute aortic dissection in pregnancy with the marfan syndrome. Korean J Thorac Cardiovasc Surg. 2014 Jun; 47 (3): 291-3.
20. Kim W.H., Bae J., Choi S.W., Lee J.H., Kim C.S., Cho H.S., Lee S.M. Stanford type A aortic dissection in a patient with Marfan syndrome during pregnancy: a case report. Korean J Anesthesiol. 2016 Feb; 69 (1): 76-9.
21. Koh M.B., Hunt B.J. The management of perioperative bleeding. Blood Rev. 2003 Sep; 17 (3): 179-85.
22. Kohler F., Fotuhi P., Baumann G. Pregnancy and congenital heart defects. Z Kardiol. 2001; 90 (4): 30-5.
23. Lambaudie E., Depret-Mosser S., Occelli B., Papageorgiou T., Dognin A., Bertrand M., de Martinville B., Codaccioni X., Monnier J.C. Marfan syndrome and pregnancy. Apropos of 4 cases. Gynecol Obstet Fertil. 2002 Jul-Aug; 30 (7-8): 567-75.
24. Master M., Day G. Acute aortic dissection in pregnancy in a woman with undiagnosed marfan syndrome. Case Rep Obstet Gynecol. 2012; 2012: 490169.
25. Mobeen I., Rossoff L.J. Pulmonary arteriovenous malformations: a clinical review. Postgrad Med J. 2000; 76: 390-394.
26. Murray M.L., Pepin M., Peterson S., Byers P.H. Pregnancy-related deaths and complications in women with vascular Ehlers- Danlos syndrome. Genet Med. 2014 Dec; 16 (12): 874-80.
27. Muiño Mosquera L., De Backer J. Managing aortic aneurysms and dissections during pregnancy. Expert Rev Cardiovasc Ther. 2015 Jun; 13 (6): 703-14.
28. Naud K., Horne G., Van den Hof M. A Woman With Marfan Syndrome in Pregnancy: Managing High Vascular Risk With Multidisciplinary Care. J Obstet Gynaecol Can. 2015 Aug; 37 (8): 724-7.
29. Omnes S., Jondeau G., Detaint D., Dumont A., Yazbeck C., Guglielminotti J., Luton D., Azria E. Pregnancy outcomes among women with Marfan syndrome. Int J Gynaecol Obstet. 2013 Sep; 122 (3): 219-23.
30. Palmquist M., Pappas J.G., Petrikovsky B., Blakemore K., Roshan D. Successful pregnancy outcome in Ehlers-Danlos syndrome, vascular type. J Matern Fetal Neonatal Med. 2009 Oct; 22 (10): 924-7.
31. Preiss M., Hosli I., Holzgreve W., Zerkowski H.R. Aortic dissection in pregnancy in Marfan syndrome-case report and treatment concept. Z Geburtshilfe Neonatol. 2001 May-Jun; 205 (3): 110-3.
32. Rahman J., Rahman F.Z., Rahman W., al-Suleiman S.A., Rahman M.S. Obstetric and gynecologic complications in women with Marfan syndrome. J Reprod Med. 2003 Sep; 48 (9): 723-8.
33. Shovlin C.L. Pulmonary arteriovenous malformations. Am J Respir Crit Care Med. 2014 Dec 1; 190 (11): 1217-28.
34. Smok D.A. Aortopathy in pregnancy. Semin Perinatol. 2014 Aug; 38 (5): 295-303.
35. Swietlik E., Doboszynska A. Recurrence of arterio-venous malformations with lifethreatening complications in a pregnant woman with hereditary teleangiectasia. J Physiol Pharmacol. 2008 Dec; 59 (6): 683-8.
36. Takahashi H., Matsubara S., Saito K., Bando M. Good obstetric outcome after embolisation of pulmonary arteriovenous malformation in hereditary haemorrhagic telangiectasia: planned pregnancy may also be important in this condition. Aust N Z J Obstet Gynaecol. 2014 Apr; 54 (2): 191.
37. Uchida T., Ogino H., Ando M., Okita Y., Yagihara T., Kitamura S. Aortic dissection in pregnant woman with the Marfan syndrome. Kyobu Geka. 2002 Jul; 55 (8): 693-6.
38. Wallace G.M., Shovlin C.L. A hereditary haemorrhagic telangiectasia family with pulmonary involvement is unlinked to the known HHT genes, endoglin and ALK-1. Thorax. 2000 Aug; 55 (8): 685-90.
40. Westhoff-Bleck M., Hilfiker-Kleiner D. Marfan syndrome and pregnancy:monitoring and management. Eur Heart J. 2015 May 7; 36 (18): 1066-7.
41. Yang G., Peng W., Zhao Q., Peng J., Xiang X., Chai X. Aortic dissection in women during the course of pregnancy or puerperium: a report of 11 cases in central south China. Int J Clin Exp Med. 2015 Jul 15; 8 (7): 11607-12.
42. Yang Z., Yang S., Wang F., Wang C. Acute aortic dissection in pregnant women. Gen Thorac Cardiovasc Surg. 2014 Aug 2.
Рентгенограмма, МРТ при синдромах Марфана и Элерса-Данлоса
Московский научно-практический центр дерматологии и косметологии Департамента здравоохранения Москвы, Москва, Россия, 119071
ГКБ №14 им. В.Г. Короленко Департамента здравоохранения Москвы
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии» Департамента здравоохранения Москвы, Москва, Россия, 119071
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии» Департамента здравоохранения Москвы, Москва, Россия, 119071
ГУ МОНИКИ им. М.Ф. Владимирского
Пахидермодактилия при недифференцированной дисплазии соединительной ткани
Журнал: Клиническая дерматология и венерология. 2016;15(4): 26‑31
Московский научно-практический центр дерматологии и косметологии Департамента здравоохранения Москвы, Москва, Россия, 119071
Представлен клинический случай редкого заболевания у ребенка 15 лет. Обсуждаются клинические особенности проявления и течения этого заболевания.
Московский научно-практический центр дерматологии и косметологии Департамента здравоохранения Москвы, Москва, Россия, 119071
ГКБ №14 им. В.Г. Короленко Департамента здравоохранения Москвы
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии» Департамента здравоохранения Москвы, Москва, Россия, 119071
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии» Департамента здравоохранения Москвы, Москва, Россия, 119071
ГУ МОНИКИ им. М.Ф. Владимирского
Термин «пахидермодактилия» (от греч. pachus: толстый, плотный, твердый) был предложен английским врачом J. Verbov в 1975 г. при описании диффузного утолщения (отека) кожи над проксимальными межфаланговыми суставами кистей у 19-летнего юноши. Утолщение околосуставных тканей отмечалось как с тыльной стороны, так и боковых поверхностей суставов, придавая пальцам веретенообразную форму [1].
В 1995 г. о подобных случаях сообщили педиатры из Швейцарии (M. Sauvain и соавт. [2]), наблюдавшие безболезненное утолщение мягких тканей в области проксимальных межфаланговых суставов кистей у 5 подростков 11—16 лет.
В 1996 г. F. Bardazzi и соавт. [2—4] представили классификацию пахидермодактилии, выделяя пять основных форм:
1. классическая (связанная с травмой);
2. локализованная или монопахидермодактилия;
3. трансградиентный вариант, при котором нарушается форма ладоней и проксимальных участков пальцев;
5. симптоматическая, связанная с другими синдромами.
Пахидермодактилия является редко встречающимся доброкачественным поверхностным фиброматозом. Морфологические изменения при пахидермодактилии характеризуются гиперкератозом, акантозом, увеличением толщины дермы, выраженной в разной степени пролиферацией фибробластов, иногда отложениями муцина. При иммуногистохимическом исследовании в дерме выявляют увеличение количества коллагенов III и V типов [5, 6]. При электронной микроскопии, по данным отдельных авторов [7], отмечают уменьшение диаметра коллагеновых волокон ретикулярной дермы.
F. Bardazzi [8] описывает пахидермодактилию у двух девушек, имеющих проявления синдрома Элерса—Данло и туберозного склероза. Предполагают, что у пациентки с туберозным склерозом пахидермодактилия является клиническим проявлением этого системного заболевания, а у пациентки с синдромом Элерса—Данло — наследственной патологией соединительной ткани с ее генетическим дефектом.
Наследственная патология соединительной ткани представляет собой уникальную онтогенетическую аномалию тканевой структуры, проявляющуюся в уменьшении содержания отдельных видов коллагена или изменения их соотношения, что приводит к снижению прочности соединительной ткани органов и систем [9—11]. Следствием этого является расстройство гомеостаза на тканевом, органном и организменном уровнях, что сопровождается различными морфофункциональными нарушениями висцеральных и локомоторных систем с прогредиентным течением [12, 13].
Наследственные заболевания соединительной ткани подразделяют на дифференцированные и недифференцированные [14, 15]. Дифференцированные дисплазии соединительной ткани характеризуются определенным типом наследования, отчетливо очерченной клинической картиной, а в ряде случаев — установленными и достаточно изученными генными дефектами. В этой группе дисплазий наиболее часто встречаются несовершенный остеогенез, синдром Элерса—Данло и синдром Марфана [16, 17].
Недифференцированная дисплазия соединительной ткани — это, несомненно, не единая нозологическая единица, а генетически гетерогенная группа фенотипических признаков, которая по большим и малым критериям не укладывается в клиническую картину ни одного из синдромов дифференцированной дисплазии соединительной ткани [13, 16]. Недифференцированная дисплазия соединительной ткани проявляется диспластическими изменениями как в одном, так и в нескольких органах, или системах [18]. Системность поражения во многом обусловлена широким распространением в организме самой соединительной ткани, составляющей строму всех органов. Морфологические изменения в тканях и органах неспецифичны и проявляются сходным образом при различных дисплазиях с разной степенью выраженности [13]. Характер поражения органов обусловлен их собственными паренхиматозно-стромальными взаимоотношениями [12].
Приводим собственное наблюдение выраженной недифференцированной дисплазии соединительной ткани с кифосколиотической деформацией, марфаноподобным фенотипом, сопровождающуюся симметричной деформацией проксимальных межфаланговых суставов кистей за счет утолщения мягких тканей у подростка.
Пациент Н., 15 лет, обратился к дерматологу с жалобами на деформацию суставов кистей. Болен с рождения, при введении прикорма отмечались вздутие живота, жидкий стул, плохая прибавка массы тела. Ребенку был выставлен диагноз целиакии, подтвержденный гистологически. Пациент находился на безглютеновой диете, периодически получал курсовое стационарное лечение в отделении гастроэнтерологии. У пациента выявлен наследственный гемохроматоз 1-го типа (подтвержден молекулярно-генетическим методом обследования — пробанд гомозигота гена H63D). Ребенок одновременно наблюдался у офтальмолога с миопией слабой степени, и у аллерголога с атопической бронхиальной астмой. С 12 лет у ребенка отмечалось безболезненное разрастание кожи и подлежащих тканей в области межфаланговых суставов.
Пациент был консультирован различными специалистами: ревматологом выявлена деформирующая артропатия при гемохроматозе; генетиком — целиакия, марфаноподобный фенотип, патологическая дерматоглифика, синдром Элерса—Данло 2-го типа; гемохроматозная артропатия; гастроэнтерологом — целиакия в клинической ремиссии, наследственный гемохроматоз без перегрузки железом на фоне сидеропенической диеты, неуточненная дефигурация суставов кистей рук; эндокринолог признаков акромегалии не выявил.
Клинико-лабораторное обследование
Рентгенограмма кистей (рис. 1): утолщение мягких тканей в области проксимальных межфаланговых суставов (изменения собственно суставов отсутствуют).
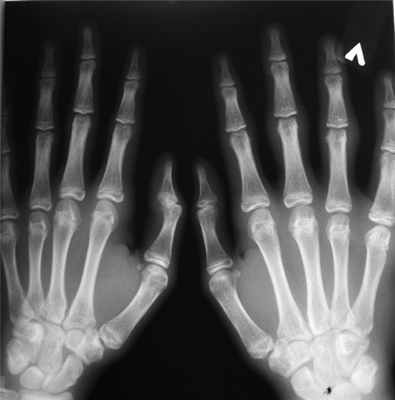
Рис. 1. Рентгенограмма кистей пациента Н.
УЗИ сердца: открытое овальное окно (около 2,5 мм), с левоправым сбросом, дисфункция трикуспидального клапана, регургитация 1—1,5+, дисфункция митрального клапана без регургитации.
МРТ кистей: уплотнение периартикулярных мягких тканей пальцев. Дегенеративные изменения коллатеральных связок межфаланговых суставов. Тендиноз сухожилий поверхностного и глубокого сгибателя 3-го пальца кисти. Синовит пястно-фаланговых и межфаланговых суставов.
ДНК-диагностика гена в «горячих» точках FBN1 экзоны 24−32 и гена PLOD-Arg 319X и дупликаций 8,9 т.п.н. мутаций не выявлено. На основании полученных данных невозможно подтвердить или исключить диагноз синдром Марфана и синдром Элерса—Данло.
Тандемная масс-спектрометрия (спектр ацилкарнитинов, аминокислот): данных за наследственные аминоацидопатии, органические ацидурии и дефекты митохондриального бета-окисления не выявлено. Мочевой скрининг на НБО отрицательный.
В связи с прогрессированием кожного процесса (увеличение гиперкератоза и утолщения подлежащих тканей в области межфаланговых суставов) ребенок был направлен в филиал «Центр детской дерматологии и косметологии», где врачами-дерматологами была диагностирована пахидермодактилия и проведена консультация врача-генетика.
Фенотип: дисгармоничное физическое развитие за счет преобладания роста над массой тела (рост 178 см, масса тела 65 кг), длинные дистальные отделы верхних и нижних конечностей, выраженный сколиоз, грудной кифоз, поясничный лордоз, истончение подкожно-жировой клетчатки, общая гипотония, относительная микроцефалия с долихоцефалией, узкое «птичье» лицо, относительно мелкие черты лица, арковидное небо, килевидная деформация грудной клетки. Нервно-психическое развитие соответствует возрасту.
Дополнительные симптомы: умеренная гипермобильность суставов, отрицательные симптомы запястья.
Анализ родословной: у отца пробанда имеется синдром Жильбера, подтвержденный молекулярно-генетическим методом, мерцательная аритмия, старший сибс пробанда имеет схожий фенотип (рост 182, масса тела около 65 кг), на диспансерном учете нигде не состоит. Повторный риск для потомства пробанда: 50% (при АД-типе наследовании), 25% (при АР-типе наследования, при носительстве подобной мутации у супруги). Заключение: недифференцированная дисплазия соединительной ткани, пахидермодактилия. Сопутствующая патология: целиакия, наследственный гемохроматоз, бронхиальная астма.
Локальный статус: патологический процесс на коже характеризуется хроническим дистрофическим поражением пальцев кистей и представлен булавовидным веретенообразным утолщением мягких тканей около мелких суставов всех фаланг кистей; контрактуры отсутствуют, субъективных ощущений нет. Пораженная кожа имеет желтый цвет с бронзовым оттенком, умеренный гиперкератоз (рис. 2). При пальпации суставов кистей движения в них не ограничены, безболезнены.
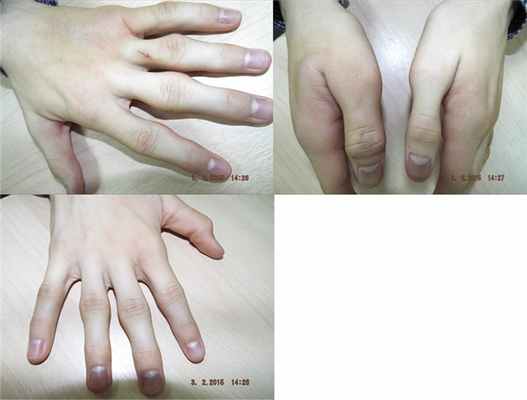
Рис. 2. Кисти пациента Н.
При гистологическом исследовании в препаратах, окрашенных гематоксилином и эозином, в эпидермисе были выявлены: акантоз, гипергранулез, выраженный ортогиперкератоз; в дерме определялось незначительное увеличение количества фибробластов, мелкоочаговые отложения муцина (рис. 3, 4, 5, 6).
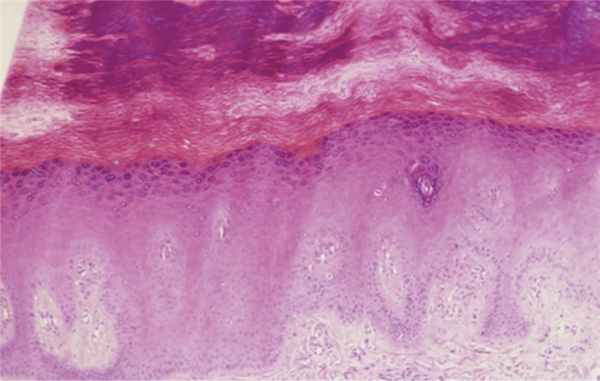
Рис. 3. Акантоз, гипергранулез. Ув. 100.
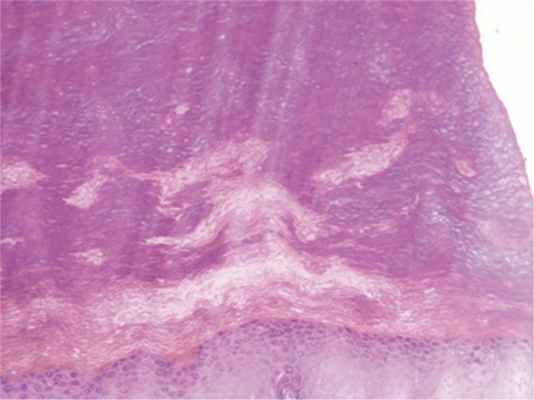
Рис. 4. Выраженный ортогиперкератоз. Ув. 100.
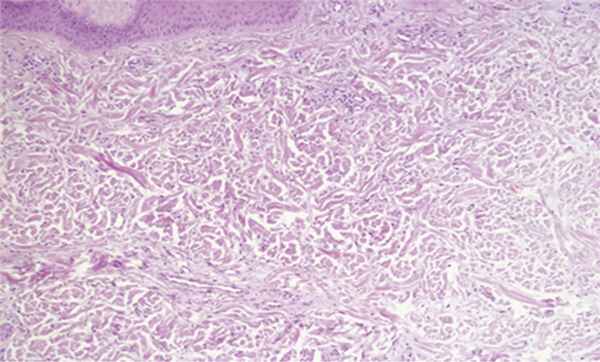
Рис. 5. Отложения муцина, пролиферация фибробластов. Ув. 100.
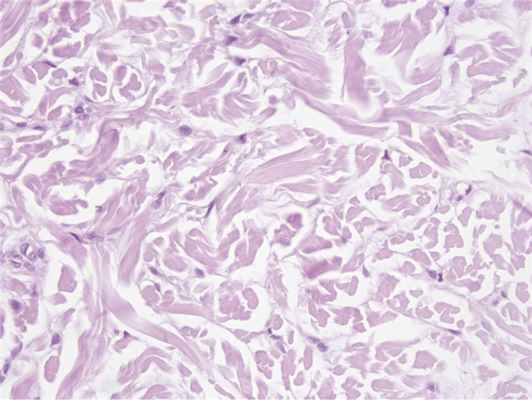
Рис. 6. Отложения муцина, пролиферация фибробластов. Ув. 200.
Заключение
Причины пахидермодактилии, избирательность локализации, участки гиперкератоза кожи остаются до конца неясными, но данные литературы свидетельствуют о нескольких возможных факторах, а именно о механическом факторе (микротравматизация) или о наследственном факторе. Анализируя анамнез, фенотип, особенности локального статуса и полученные данные обследования наблюдаемого пациента Н., можно сделать вывод о том, что проявления пахидермодактилии имеют прямое отношение к недифференцированной дисплазии соединительной ткани. Тип наследования: мутация de novo, но не исключаются аутосомно-доминантный и аутосомно-рецессивный типы. Клинический интерес данного наблюдения состоит в том, что впервые дерматологами описывается проявление пахидермодактилии при недифференцированной дисплазии соединительной ткани.
Аневризма сосудов головного мозга
Аневризма сосудов головного мозга – патологическое локальное выпячивание истонченной стенки мозговой артерии. Это «бомба замедленного действия», которая хотя бы однажды за жизнь человека «взорвется» – стенка аневризмы разорвется и кровь, содержащаяся в аневризме, изольется в мозг. Такая сосудистая катастрофа может привести к стойким неврологическим нарушениям и даже несет угрозу жизни пациента.
При появлении симптомов данного состояния следует в максимально короткий срок доставить больного в медицинское учреждение для оказания ему специализированной медицинской помощи. Идеальный сценарий – обнаружить и исключить аневризму из кровотока еще до ее разрыва. Это возможно при внимательном отношении человека к своему здоровью – своевременном обращении к грамотному невропатологу при наличии жалоб на головную боль или иные неврологические нарушения.
Врачи сети медицинских центров «СМ-Клиника» обладают достаточным опытом и необходимой базой знаний, позволяющим им проводить качественную диагностику и эффективное лечение аневризм сосудов головного мозга как на бессимптомном этапе, так и при кровоизлиянии в полость черепа.
О заболевании
Аневризма чаще поражает сосуды, внутри которых кровь течет под высоким давлением – в области их изгибов или участков разветвления. Истончение стенки и высокое давление приводят к увеличению диаметра сосуда, формированию патологического выпячивания. Постепенно оно начинает сдавливать окружающие мозговые структуры, нарушая функции центральной нервной системы.
Описываемая патология является опасной для пациента из-за высокого риска разрыва аневризмы с кровоизлиянием в полость черепа. Разрывы аневризм чаще случаются у женщин в возрасте от 50 до 65 лет.
Виды аневризм сосудов головного мозга
В основе классификации аневризм сосудов головного мозга лежат несколько критериев. В зависимости от формы выпячивание может быть мешкообразным или веретенообразным. Чаще встречается первый тип аневризмы.
В зависимости от размеров выпячивания бывают:
- миллиарными (до 3 мм в диаметре);
- обычного размера (до 15 мм);
- большими (до 25 мм);
- гигантскими (больше 25 мм).
Чем больше аневризма, тем сильнее она сдавливает ткань головного мозга и вызывает более выраженную неврологическую картину. Выпячивания также могут быть одно- или многокамерными, одиночными или множественными, врожденными или приобретенными.
Симптомы аневризм сосудов головного мозга
Опасность выпячиваний стенки артерий кроется в их «тихом» развитии. На ранних этапах пациент может даже не догадываться о наличии серьезной проблемы, поскольку маленькие аневризмы практически не сдавливают ткани головного мозга и не вызывают неприятных ощущений.
Клиническая картина проявляется на более поздних стадиях болезни. Первыми сигналами о проблеме могут служить:
- стойкие головные боли в определенной области;
- нарушение зрения, боль в области глаз и головы;
- изменение двигательных функций конечностей (пациент внезапно может «разучиться» держать ложку или у него резко портится почерк);
- нарушение тактильной и болевой чувствительности ног;
- судорожные припадки;
- онемение мышц лица, невозможность улыбнуться, внезапное нарушение дикции.
Эти признаки указывают на сдавливание тканей головного мозга. Развивается неврологический дефицит, который должен стать безотлагательным поводом для обращения за помощью к неврологу.
Если болезнь прогрессирует, аневризма может разорваться. Это состояние уже напрямую угрожает жизни пациента. Симптомами разрыва являются:
- внезапно возникшая интенсивная головная боль, которая плохо поддается медикаментозной коррекции;
- светобоязнь;
- тошнота, рвота;
- двоение в глазах;
- потеря сознания;
- интенсивные судороги.
При возникновении у человека описанных симптомов нужно вызывать бригаду скорой помощи.
Причины аневризмы сосудов головного мозга
Аневризмы сосудов головного мозга могут быть врожденными или приобретенными. В первом случае заболевание возникает на фоне уже имеющейся аномалии развития одной из стенок артерии. Это может способствовать повреждению внутренней оболочки сосуда с образованием выпячивания даже в молодом возрасте, являться одним из проявлений ряда заболеваний (синдрома Марфана, Рандю-Ослера, Элерса-Данлоса).
Приобретенные аневризмы могут быть следствием:
- травмы головы и головного мозга;
- гипертонической болезни;
- инфекции;
- онкологического заболевания внутричерепных структур;
- зависимости от наркотических средств;
- атеросклеротического поражения внутренней поверхности артерий.
Провоцирующими факторами заболевания выступают постоянные стрессы и тяжелые физические нагрузки. Они вызывают повышение давления в сосудах головы, увеличивая риск их механического повреждения.
Получить консультацию
Если у Вас наблюдаются подобные симптомы, советуем записаться на прием к врачу. Своевременная консультация предупредит негативные последствия для вашего здоровья.
Узнать подробности о заболевании, цены на лечение и записаться на консультацию к специалисту Вы можете по телефону:

Почему «СМ-Клиника»?
Диагностика аневризмы сосудов головного мозга
Выявление патологических выпячиваний артерий головного мозга – не всегда простая задача, особенно если пациент фактически не ощущает никакого дискомфорта. В таких случаях заболевание будет выявлено случайно, при профилактическом осмотре или обследовании в связи с подозрением на иную патологию.
Чтобы диагностировать аневризму при наличии у пациента жалоб и объективных симптомов неврологического дефицита, невролог назначит следующие инструментальные методы диагностики:
- компьютерную томографию или КТ – процедура чаще используется для определения уже состоявшегося разрыва сосуда со сформировавшимся кровоизлиянием в ткани мозга;
- магнитно-резонансную томографию (МРТ);
- ангиографию сосудов головного мозга – метод позволяет оценить размер, локализацию и особенности строения патологического выпячивания.
Если подозревается субарахноидальное кровоизлияние вследствие разрыва аневризмы, невролог проведет люмбальную пункцию для оценки состава спинномозговой жидкости.
Мнение эксперта
Как невролог, хочу сказать, что аневризма сосудов головного мозга – это очень серьезная медицинская проблема, которая требует комплексного подхода к лечению. Из-за бессимптомного течения болезнь иногда выявляется случайно во время профилактического осмотра. При наличии признаков заболевания нужно немедленно обращаться за специализированной помощью. Стабилизация состояния пациента и предотвращение разрыва проводится с помощью медикаментозной терапии и оперативного вмешательства.
Методы лечения аневризмы сосудов головного мозга
Лечение пациентов с поражением внутричерепных артерий всегда носит комплексный характер. Невролог оценивает факторы риска, которые преимущественно влияют на больного. На основании полученных данных специалист назначает препараты, которые воздействуют на механизмы развития вторичной аневризмы и способствуют стабилизации состояния человека.
Для предотвращения разрыва аневризмы пациенту рекомендовано радикальное лечение – плановая операция. Экстренное вмешательство показано при разрыве аневризмы.
Консервативная терапия
В рамках этого направления чаще всего используются:
- обезболивающие средства;
- гипотензивные медикаменты для контроля АД;
- противосудорожные препараты;
- средства для снижения концентрации холестерина в крови.
Консервативная терапия дополняет хирургическую операцию и способствует предупреждению рецидивов при наличии факторов риска.
Хирургическое лечение аневризмы сосудов головного мозга
Оптимальный метод лечения аневризмы – ее исключение из кровотока хирургическим путем. Это устраняет риск разрывов и негативные для центральной нервной системы последствия. Предпочтительный метод – эндоваскулярная хирургия. Нейрохирург пунктирует бедренную артерию, вводит в нее тонкий проводник (интродьюсер) до непосредственно сосуда с аневризмой, и уже локально при помощи миниатюрных инструментов заполняет аневризму платиновой микроспиралью или устанавливает в поврежденный участок артерии стент укрепляющий сосудистую стенку, после чего извлекает из артерий инструментарий. Все манипуляции проводятся не вслепую – врач наблюдает за происходящим через монитор специального рентген-аппарата.
Реже используют открытые вмешательства на мозге. Нейрохирург выполняет трепанацию черепа, рассекает оболочки мозга, достигает пораженного аневризмой кровеносного сосуда и с помощью микроинструментов выполняет необходимые манипуляции – иссекает выпячивания, перевязывает их с двух сторон или коагулирует, затем ушивает поврежденные ткани и закрывает трепанационное отверстие собственной костью пациента. Размер этого отверстия варьируется в широких пределах в зависимости от клинической ситуации. Выбор конкретного варианта лечения зависит от индивидуальных особенностей каждого клинического случая.
Читайте также:
