Рентгеновское излучение применяемое в терапии (радиотерапии) рака
Добавил пользователь Евгений Кузнецов Обновлено: 24.01.2026
Лучевая терапия — это один из ведущих методов противоопухолевого лечения, основанный на использовании ионизирующего излучения. Может применяться как самостоятельный вид терапии, так и в рамках комбинированного/комплексного лечения (совместно с другими методами), в качестве радикальной, нео- и адъювантной, консолидирующей, профилактической и паллиативной терапии.
Эффективность данного метода основана на повреждении ДНК. Существуют различные механизмы, позволяющие более эффективно разрушать опухолевые клетки в сравнении с нормальными. Во-первых, опухолевые клетки более активно делятся, соответственно, их ДНК чаще находится в «рабочем» режиме, когда она менее устойчива к воздействию ионизирующего излучения. По той же причине большая часть острых лучевых реакций представлена мукозитами, то есть воспалением слизистых, которым также свойственно активное деление. Во-вторых, окружающие здоровые клетки способствуют восстановлению поврежденных, подвергшихся лучевому воздействию. Поэтому важно сделать так, чтобы в объём облучения попало как можно меньше здоровой ткани. В-третьих, современное оборудование для лучевой терапии, управляемое командой грамотных специалистов, позволяет подвести максимально высокие дозы прямо в мишень, существенно снижая дозу ионизирующего излучения, приходящуюся к окружающим здоровым органам и тканям.

Виды лучевой терапии
Уже несколько десятилетий человечество изучает воздействие ионизирующего излучение на организм человека. При этом акцентируется внимание как на положительном, так и отрицательном эффекте, возникающем при его применении. Разрабатываются новые методы, которые позволяют добиваться максимального лечебного эффекта при снижении отрицательного действия на организм. Улучшается оборудование для проведения лучевой терапии, появляются новые технологии облучения.
Сейчас классификация методов лучевой терапии довольно обширна. Мы остановимся только на самых распространенных методиках.
Контактная лучевая терапия
При контактной лучевой терапии источник излучения вводится непосредственно в опухоль или прилегает к ее поверхности. Это позволяет прицельно облучать новообразование с минимумом воздействия на окружающие его ткани.
К контактным видам лучевой терапии относятся:
- Аппликационная лучевая терапия. Применяется при лечении поверхностно расположенных опухолей, например, новообразований кожи, слизистых оболочек гениталий. В этом случае используются индивидуально изготовленные аппликаторы, которые накладываются непосредственно на поверхность новообразования.
- Внутриполостная лучевая терапия. Источник ионизирующего излучения вводится в просвет полого органа, например, в пищевод, мочевой пузырь, прямую кишку, полость матки или влагалища. Для облучения используются специальные аппликаторы (их называют эндостатами), которые заполняются радионуклидами.
- Внутритканевое облучение. Источник ионизирующего излучения вводится непосредственно в ткань опухоли. Для этого используются интростаты, которые могут иметь вид игл, шариков, трубочек, заполненных источником излучения.
Кроме того, существует такой вид лечения, как радионуклидная терапия. В этом случае используются открытые источники излучения в виде растворов радионуклидов (радиофармацевтический препарат — РФП), которые при попадании в организм прицельно накапливаются в опухолевых очагах и уничтожают их. Чаще всего РФП вводится внутривенно. Наибольшее распространение получили следующие виды радионуклидной терапии:
- Терапия радиоактивным йодом. Используется для лечения ряда видов рака щитовидной железы, поскольку йод избирательно накапливается в тиреоидной ткани.
- Применение остеотропных РФП используется для лечения метастазов в костях или костных опухолей.
- Радиоиммунотерапия — радионуклиды присоединяют на моноклональные антитела, чтобы добиться прицельного воздействия на опухолевую ткань.
Дистанционная лучевая терапия
При дистанционной лучевой терапии источник излучения находится на расстоянии от тела пациента, при этом на пути его прохождения могут лежать здоровые ткани, которые в процессе проведения терапии также подвергаются облучению, что приводит к развитию осложнений разной степени выраженности. Чтобы их минимизировать, разрабатываются различные технологии, позволяющие сконцентрировать максимальную дозу ионизирующего излучения непосредственно на в мишени (опухоли). С данной целью используются:
- Короткофокусная рентгенотерапия. При облучении используется рентгеновское излучение малой и средней мощности, которое способно проникать в ткани на глубину до 12 мм. Метод назван так из-за того, что источник располагается на коротком расстоянии от облучаемой поверхности. Таким способом лечат неглубокие опухоли кожи, вульвы, конъюнктивы и век, ротовой полости.
- Гамма-терапия. Этот вид излучения имеет большую проникающую способность, поэтому может использоваться для лечения более глубоко расположенных опухолей, нежели рентген-терапия. Однако сохраняющаяся большая нагрузка на окружающие органы и ткани приводят к ограничению возможности использования данного метода в современной онкологии.
- Фотонная терапия. Именно этим видом излучения проводится лучевое лечение большинства онкологических пациентов в современном мире. Достаточно высокая проникающая способность в сочетании с высокотехнологичными способами подведения дозы (IMRT и VMAT), достаточно совершенные системы планирования позволяют очень эффективно использовать этот вид излучения для лечения пациентов с приемлемыми показателями токсичности.
- Применение корпускулярного излучения (электроны, протоны, нейтроны). Эти элементарные ядерные частицы получают на циклотронах или линейных ускорителях. Электронное излучение используют для лечения неглубоких опухолей. Большие надежды возлагаются на протонную терапию, с помощью которой можно максимально прицельно подводить высокие дозы излучения к глубоко расположенным опухолям при минимальном повреждении здоровых тканей за счет выделения радиационной дозы на определённом отрезке пробега частиц, однако пока эти виды излучения играют сравнительно небольшую роль в лечении онкологических заболевания из-за своей высокой стоимости и ряда не до конца решённых технологических аспектов реализации метода.
Этапы лучевой терапии
Весь процесс проведения лучевой терапии делят на три этапа:
- Предлучевая подготовка (КТ-симуляция), этап выбора объёмов облучения и критических структур, этап дозиметрического планирования, верификации плана лучевой терапии.
- Этап облучения.
- Постлучевой этап.
Этап планирования
Как правило, этап планирования занимает несколько дней. В это время проводятся дополнительные исследования, которые призваны дать возможность врачу более точно оценить границы опухоли, а также состояние окружающих ее тканей. Это может повлиять на выбор вида лучевой терапии, режима фракционирования, разовой и суммарной очаговых доз. Основой же данного этапа является выполнение так называемой КТ-симуляции, то есть компьютерной томографии необходимого объёма с определёнными параметрами и в определённом положении тела пациента. Во время КТ-симуляции на кожу пациента и/или его индивидуальные фиксирующие устройства наносятся специальные метки, призванные помочь правильно укладывать пациента в дальнейшем, а также облегчить задачу навигации по время проведения сеансов облучения.
Затем врач-радиотерапевт рисует объёмы облучения и критических структур (тех, на которые будет предписано ограничение дозы) на полученных срезах КТ с учётом данных других диагностических модальностей (МРТ, ПЭТ). Далее формируется задача для медицинского физика, включающая определение доз, которые должны быть подведены к мишени, мишеням или отдельным её частям, а также тех, которые не должны быть превышены в объёмах здоровых органов и тканей. Медицинский физик разрабатывает дозиметрический план в соответствии с заданными параметрами, при соблюдении которых и успешной верификации данного плана на фантоме, можно считать пациента готовым к лучевой терапии.
На этапе подготовки к лучевой терапии пациенту рекомендуется придерживаться нескольких правил:
- Отказаться от средств, раздражающих кожу.
- Если на коже в месте воздействия имеются повреждения или элементы сыпи, следует проконсультироваться с врачом.
- Если предполагается лучевая терапия в челюстно-лицевой области, требуется санация полости рта.
- Воздержаться от загара.
- Главное правило на любом этапе: обсудить все нюансы предстоящих подготовки и лечения с лечащим врачом-радиотерапевтом и строго придерживаться полученных рекомендаций!
Этап облучения
Проведение этапа облучения будет зависеть от выбранного метода лучевой терапии.
Проведение дистанционной лучевой терапии
Продолжительность курса дистанционной лучевой терапии зависит от выбранного режима фракционирования, а также цели лечения. Паллиативные курсы, как правило, короче неоадъювантных и адъювантных, а те, в свою очередь, менее продолжительны, чем радикальные. Однако подведение радикальной дозы возможно и за один-несколько сеансов в зависимости от клинической ситуации. В таком случае курс дистанционной лучевой терапии называется стереотаксической радиотерапией или радиохирургией. Варьирует и кратность сеансов в день и в неделю: чаще всего используются схемы с пятью сеансами в неделю, однако могут быть предложены и 2-3 сеанса в день (гиперфракционирование) и схемы с 1-4 и 6 сеансами в неделю.
Во время облучения пациент в подавляющем большинстве случаев располагается лежа на столе специальной установки. Крайне необходимо соблюдать полную неподвижность во время сеанса облучения. Для достижения этого могут использоваться специальные фиксирующие устройства и системы иммобилизации.
Перед тем как включить установку, медперсонал покидает помещение, и дальнейшее наблюдение осуществляется через мониторы или окно. Общение с пациентом осуществляется по громкой связи. Во время выполнения сеанса, части аппарата и стол с пациентом совершают движения по заданной траектории. Это может создавать шум и беспокойство у больного. Однако бояться этого не стоит, поскольку вся процедура контролируется.
Сам сеанс лучевой терапии может длиться как 5-10, так и 60-120 минут, чаще — 15-30 минут. Само воздействие ионизирующего излучения не вызывает никаких физических ощущений. Однако в случае ухудшения самочувствия пациента во время сеанса (выраженной боли, судороги, приступа тошноты, паники), следует позвать медицинский персонал заранее оговоренным способом; установку сразу отключат и окажут необходимую помощь.
Контактная лучевая терапия (брахитерапия)
Брахитерапия проводится в несколько этапов:
- Введение в облучаемую зону неактивных проводников — устройств, в которые затем имплантируют источник ионизирующего излучения. При внутриполостной лучевой терапии используются приспособления, называемые эндостатами. Их устанавливают непосредственно в полость облучаемого органа и рядом с ним. При внутритканевой лучевой терапии используются интростаты, которые устанавливаются непосредственно в ткань опухоли по заранее просчитанной схеме. Для контроля их установки, как правило, используются рентгенологические снимки.
- Перемещение источника излучения из хранилища в интро- и эндостаты, которые будут облучать опухолевую ткань. Время облучения и особенности поведения пациента будут зависеть от вида брахитерапии и используемого оборудования. Например, при внутритканевой терапии, после установки источника ионизирующего излучения пациент может покинуть клинику и прийти на повторную процедуру через рекомендуемый промежуток времени. Весь этот период в его организме будет находиться интростат с радионуклидами, которые будут облучать опухоль.
Проведение внутриполостной брахитерапии будет зависеть от используемых установок, которые бывают двух типов:
- Установки низкой мощности дозы. В этом случае один сеанс облучения длится около 2-х суток. Под наркозом имплантируются эндостаты. После контроля правильности их установки и введения радионуклидов, пациент переводится в специальное помещение, где должен будет находиться все время, пока длится процедура, соблюдая строгий постельный режим. Разрешается только немного поворачиваться на бок. Вставать категорически запрещено.
- Установки высокой мощности дозы. Время облучения составляет несколько минут. Для установки эндостатов наркоза не требуется. Но во время процедуры все равно необходимо лежать абсолютно неподвижно. Внутриполостная лучевая терапия установкой высокой мощности проводится несколькими сеансами с интервалами от одного дня до одной недели.
Радионуклидная терапия
При радионуклидной терапии пациент принимает радиофармпрепараты внутрь в виде жидкого раствора, капсул или инъекций. После этого он помещается в специальную палату, имеющую изолированную канализацию и вентиляцию. По истечении определенного срока, когда мощность дозы снизится до приемлемого уровня, проводится радиологический контроль, пациент принимает душ и переодевается в чистую одежду. Для контроля результатов лечения проводится сцинтиграфия, после чего можно покинуть клинику.
Как вести себя во время лучевой терапии
Лучевая терапия является серьезным стрессом для организма. У многих пациентов в этот период ухудшается самочувствие. Чтобы его минимизировать рекомендуется придерживаться следующих правил:
- Больше отдыхать. Минимизируйте физическую и интеллектуальную нагрузку. Ложитесь спать, когда почувствуете в этом необходимость, даже если она возникла в течение дня.
- Постарайтесь сбалансировано и полноценно питаться.
- Откажитесь на время проведения терапии от вредных привычек.
- Избегайте плотной обтягивающей одежды, которая бы могла травмировать кожу.
- Следите за состоянием кожи в месте облучения. Не трите и не расчесывайте ее, используйте средства гигиены, которые вам порекомендует врач.
- Защищайте кожу от воздействия солнечных лучей — используйте одежду и головные уборы с широкими полями.

Побочные эффекты лучевой терапии
Лучевая терапия, как и другие методы противоопухолевого лечения, вызывает ряд осложнений. Они могут быть общими или местными, острыми или хроническими.
Острые (ранние) побочные эффекты развиваются во время проведения радиотерапии и в ближайшие недели после неё, а поздние (хронические) лучевые повреждения — через несколько месяцев и даже лет после ее окончания.
Общие реакции
Угнетенное эмоциональное состояние
Подавляющее большинство пациентов, проходящих лечение по поводу злокачественного новообразования, испытывают тревожность, страх, эмоциональное напряжение, тоску и даже депрессию. По мере улучшения общего состояния, эти симптомы стихают. Чтобы облегчить их, рекомендуется чаще общаться с близкими людьми, принимать участие в жизни окружающих. При необходимости рекомендуется обратиться к психологу.
Чувство усталости
Чувство усталости начинает нарастать через 2-3 недели от начала терапии. На это время рекомендуется оптимизировать свой режим дня, чтобы не подвергаться ненужным нагрузкам. В то же время нельзя полностью отстраняться от дел, чтобы не впасть в депрессию.
Изменение крови
При необходимости облучения больших зон, под воздействие радиации попадает костный мозг. Это в свою очередь приводит к снижению уровня форменных элементов крови и развитию анемии, повышению риска кровотечения и развития инфекций. Если изменения выражены сильно, может потребоваться перерыв в облучении. В ряде случаев могут назначать препараты, стимулирующие гемопоэз (кроветворение).
Снижение аппетита
Обычно лучевая терапия не приводит к развитию тошноты или рвоты, но снижение аппетита наблюдается довольно часто. Вместе с тем, для скорейшего выздоровления требуется полноценное высококалорийное питание с высоким содержанием белка.
Локальные осложнения
Побочные реакции со стороны кожи
Вероятность развития кожных реакций и их интенсивность зависят от индивидуальных особенностей пациента. В большинстве случаев через 2-3 недели в области воздействия возникает покраснение. После окончания лечения оно сменяется пигментированием, напоминающим загар. Чтобы предотвратить чрезмерные реакции, могут назначаться специальные кремы и мази, которые наносятся после окончания сеанса. Перед началом следующего их необходимо смыть теплой водой. Если реакция выражена сильно, делают перерыв в лечении.
Реакции со стороны полости рта и горла
Если облучают область головы и шеи, могут развиться лучевой стоматит, который сопровождается болью, сухостью во рту, воспалением слизистых, а также ксеростомия вследствие нарушения функции слюнных желез. В норме эти реакции проходят самостоятельно в течение месяца после окончания лучевой терапии. Ксеростомия может беспокоить пациента в течение года и более.
Осложнения со стороны молочной железы
При прохождении лучевой терапии по поводу рака молочной железы могут возникать следующие реакции и осложнения:
- Покраснение кожи груди.
- Отек груди.
- Боль.
- Изменение размера и формы железы из-за фиброза (в некоторых случаях эти изменения остаются на всю жизнь).
- Уменьшение объема движения в плечевом суставе.
- Отек руки на стороне поражения (лимфедема).
Побочное действие на органы грудной клетки
- Воспаление слизистой пищевода, которое приводит к нарушению глотания.
- Кашель.
- Образование мокроты.
- Одышка.
Последние симптомы могут свидетельствовать о развитии лучевого пневмонита, поэтому при их возникновении следует немедленно обратиться к вашему врачу.
Побочные реакции со стороны прямой кишки/петель кишечника
- Расстройство стула — диарея или наоборот, запоры.
- Боли.
- Кровянистые выделения из заднего прохода.
Побочные действия со стороны мочевого пузыря
- Учащенное болезненное мочеиспускание.
- Наличие примеси крови в моче иногда может быть настолько выраженным, что моча приобретает кроваво-красный цвет.
- Наличие патологических примесей в моче — кристаллы, хлопья, гнойное отделяемое, слизь.
- Уменьшение емкости мочевого пузыря.
- Недержание мочи.
- Развитие везиковагинальных или везикоректальных свищей.
Побочные эффекты при облучении опухолей забрюшинного пространства, печени, поджелудочной железы
- Тошнота и рвота.
- Ознобы после сеансов.
- Боли в эпигастрии.
Химиолучевая терапия
Лучевая терапия довольно редко проводится в качестве самостоятельного лечения. Чаще всего она сочетается с каким-либо другим видом лечения: хирургическим, а чаще всего — с лекарственным. Это может быть как вариант одновременной химиолучевой терапии, так и последовательной, а также варианты сочетания лучевой терапии с иммунотерапией, таргетной и гормональной терапии. Такие виды лечения могут иметь ощутимо более высокую противоопухолевую эффективность, однако необходимо тщательно оценить риски совместных побочных эффектов, поэтому принятие решения о любом объёме лечения с онкологической патологией должен принимать мультидисциплинарный онкологический консилиум.
Рентгеновское излучение применяемое в терапии (радиотерапии) рака
Вскоре после открытия радия супругами Кюри Рентген сконструировал свой первый аппарат для получения рентгеновского излучения. Устройство представляло собой запаянную вакуумную трубку, содержащую на своих концах два электрода. Нагрев одного из электродов вызывал эмиссию электронов, которые пролетали через вакуум и бомбардировали второй электрод.
В процессе этого испускались особые лучи, которые, подобно лучам радия, могли засвечивать фотографическую пленку. Поначалу природа лучей была неизвестна, но постепенно становилось ясно, что рентгеновские лучи и у-излучение вомногом сходны по своим фундаментальным характеристикам, хотя происходят из совершенно разных источников.
В отличие от у-излучения, параметры которого зависят лишь от типа и степени чистоты радиоактивного материала, параметры рентгеновского излучения можно менять, просто изменяя напряжение на катоде рентгеновской трубки.
В диагностической радиологии используется рентгеновское излучение, получаемое от низковольтных аппаратов (около 50 кВ). Оно обладает довольно большой длиной волны и низкой проникающей способностью. В терапии, наоборот, используются более высокоэнергетические рентгеновские лучи, получаемые на установках, дающих напряжения от 50 кВ до 30 МэВ, т. е. в 600 раз больше.
По мере роста питающего напряжения уменьшается длина волны испускаемого рентгеновского излучения и повышается его способность проникновения в человеческие ткани.
При терапевтическом использовании основным критерием эффективности лечения является способность рентгеновских лучей проникать в биологические ткани (концепция так называемой поглощаемой в зависимости от глубины дозы) и воздействовать на глубоко залегающие опухоли.
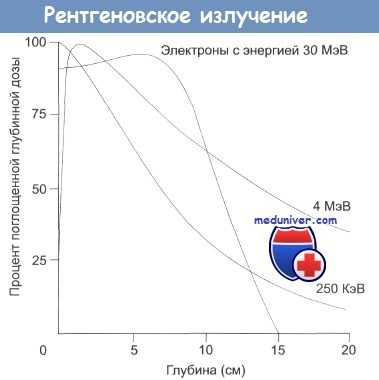
Типичные кривые зависимости поглощенной дозы от глубины для радиотерапевтического оборудования (киловольтного, мегавольтного и пучков электронов с энергией 30 МэВ).
Следует отметить «провал» поглощения на первом сантиметре от поверхности для мегавольтной терапии, что совершенно не характерно для киловольтных пучков и электронов.
Видно, что процент глубинной поглощенной дозы у мегавольтного оборудования и электронных пучков значительно выше, чем у киловольтного излучения.
Эффект «игнорирования кожи» вообще имеет огромное клиническое значение.
По этой причине любое отделение радиотерапии обычно укомплектовано оборудованием широкого спектра действия, способного облучать как поверхностно расположенные опухоли, так и глубоко залегающие новообразования, такие как опухоли средостения или тазовой области. При работе с классическим или ортовольтажным рентгеновским оборудованием, основная доза излучения поглощается в поверхностных тканях, а по мере увеличения глубины проникновения эффективная доза поглощенного облучения постоянно снижается.
Таким образом, доза, поглощенная опухолью на глубине 10 см и более под поверхностью кожи, будет незначительна, а общая доза излучения лимитируется неизбежными кожными реакциями. Также необходимо решать и целый ряд проблем, связанных с физической и электромагнитной безопасностью применения высоковольтного оборудования.
К счастью множество технических проблем удалось разрешить еще в 1960-х годах с внедрением принципиально нового подхода в генерировании высокоэнергетических мегаво-льтных пучков, а именно с изобретением и внедрением в практику линейных ускорителей. В основе таких установок лежит ускорение электронов в цилиндрическом волноводе, в результате чего происходит бомбардировка мишени пучком разогнанных почти до скорости света электронов.
Из-за высокой скорости электронов генерируется пучок очень высокой энергии. Такой пучок обладает высокой глубинной дозой, его можно очень точно направлять, и он практически не дает рассеянного излучения как традиционные кобальтовые пушки. Кроме того, выходная мощность ускорителя (или уровень дозы) достаточно высока, что ведет к сокращению времени лечения. В развитых странах линейные ускорители в настоящее время делаются стандартными «рабочими лошадками» во многих радиологических отделениях.
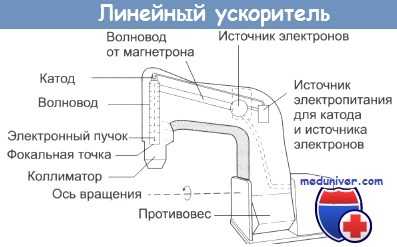
Еще одним существенным преимуществом этой техники является то, что такие установки могут изменять энергию потока электронов вплоть до 30 МэВ и более, что может найти разнообразное клиническое применение.
С точки зрения клинической практики, основное различие между рентгеновским излучением и электронными пучками состоит в том, что они обладают принципиально разными характеристиками поглощаемой в зависимости от глубины дозы. При проведении рентгенотерапии или у-терапии количество поглощенной тканями дозы радиации по мере продвижения излучения вглубь ткани падает экспоненциально. Это означает, что все ткани, в том числе и здоровые, на пути движения пучка будут получать определенную дозу облучения, величина которой будет зависеть от мощности источника и расстояния до него.
Таким образом, при облучении опухоли параллельно облучаются ткани, расположенные как перед, так и после опухоли по ходу действия пучка излучения. Необходимость избежания нежелательных эффектов такого облучения накладывает определенные ограничения на проводимое лечение. В электронной терапии такие побочные эффекты практически отсутствуют, так как пучок электронов в основном поглощается на вполне определенной глубине, в зависимости от его энергии.
Степень поглощения тканями рентгеновского излучения, генерируемого установками низкого и промежуточного напряжения, в значительной мере зависит от плотности облучаемых тканей. Поглощение тканями высоковольтного рентгеновского излучения, у-излучения и электронов в значительно меньшей степени зависит от плотности тканей, что снижает риск поглощения основной дозы облучения костной тканью (при которой возникают две проблемы: неравномерность облучения и радионекрозы).
Таким образом, радиотерапевты всегда с большой осторожностью подходят к облучению низковольтными пучками опухолей, расположенных рядом с костями или хрящевой тканью. В этих случаях предпочтительнее проводить облучение электронами, особенно кожных опухолей, расположенных рядом с хрящами. Типичным примером могут служить базально-клеточные карциномы в области носа или ушных раковин.
Еще одним перспективным направлением, которое сейчас активно разрабатывается, являются попытки клинического использования тяжелых заряженных и нейтральных частиц, к которым относятся нейтроны, протоны и пи-мезоны. Теоретически, пучки таких частиц могут обладать целым рядом преимуществ, но капитальные вложения, необходимые для разработки и внедрения в медицину генераторов протонов, нейтронов и заряженных частиц, могут значительно превышать стоимость обычного оборудования.
Поэтому в настоящее время клинические испытания нейтронной терапии могут позволить себе только некоторые крупнейшие исследовательские центры.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Физика радиотерапии - ионизирующей радиации
В недавно вышедшем обзоре Королевского колледжа радиологов (Великобритания) была проведена оценка того, какой вклад в общую долю успешно пролеченных онкологических пациентов вносят те или иные способы лечения. Оказалось, что 49% падает на хирургическое вмешательство, 40% составляет успешное радиологическое лечение, а вклад химиотерапии составляет 11%.
Еще со времен открытия Рентгеном в 1895 г. излучения, названного его именем, постоянно предпринимались попытки не только изучить физическую природу этого излучения, но и применить его на практике как в биологии, так и в лечении болезней человека.
Изобретение рентгеновской трубки открыло целый ряд возможностей для ее клинического применения вначале только в диагностике, а затем и в лечении больных злокачественными новообразованиями. Открытие радия Марией и Пьером Кюри в 1898 г. дало в руки врачей ряд радиоактивных материалов, которые они пытались использовать в лечении рака, так как единственным способом помочь онкологическим больным в то время было хирургическое вмешательство.
За последующие 100 лет мы узнали много нового о физических характеристиках, биологических эффектах и возможностях клинического использования ионизирующего излучения. Ссылки на наиболее заметные работы в этой области приведены имеются в разделе книги по онкологии.
Для ясного понимания физической природы радиоактивности и радиоактивного распада очень важно иметь представление о составе спектра электромагнитных волн, каждая из которых несет энергию, обратно пропорциональную длине своей волны.
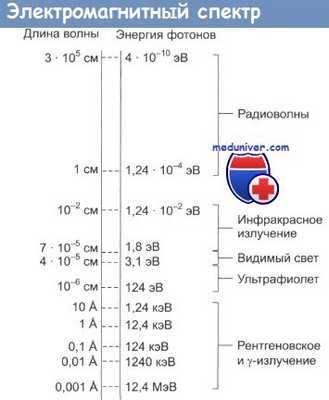
Шкала электромагнитных излучений включает в себя рентгеновское излучение (с высокой энергией и очень маленькой длиной волны), видимый свет (средняя энергия и длина волны) и радиоволны (малая энергия и большая длина волны), которые используются для передачи сигналов по радио и в телекоммуникациях. Из всего спектра электромагнитного излучения именно рентгеновские лучи и гамма-радиация (эти термины почти взаимозаменяемы) несут достаточную энергию для ионизации атомов при прохождении через биологические ткани.
В процессе ионизации электроны срываются со своих атомных орбит, что приводит к образованию нестабильных ионизированных атомов. Свободные электроны могут «захватываться» окружающими атомами, которые также становятся нестабильными, так как приобретают дополнительный отрицательный заряд.
При прохождении пучка излучения через живую ткань плотность и величину трека ионизации можно контролировать, изменяя характеристики источника излучения. Это позволяет избирательно повреждать определенные клетки, что происходит при терапевтическом использовании излучения (в радиотерапии).
Для диагностики применяется такое излучение, которое вызывает лишь кратковременные эффекты и не оказывает существенного биологического воздействия на ткани. Получение рентгеновских снимков возможно из-за разницы в степени поглощения излучения разными тканями, которые содержат атомы, отличающиеся по атомному весу.
Чувствительность опухолей к радиации и рентгеновскому излучению
Еще с самого начала XX века многие медицинские исследователи посвящали себя изучению загадочных процессов, которые происходят в живой ткани под действием ионизирующей радиации. Уже известно, что радиационное поражение может приводить к смерти за счет гибели клеток, а может быть сублетальным, если пораженные клетки полностью или частично восстанавливаются.
Применительно к онкологии можно сказать, что степень радиочувствительности каждой конкретной опухоли (определяемой врожденной чувствительностью к радиации) будет зависеть не только от непосредственного поражения клеток, но и от способности ткани опухоли к репарации. Хотя при планировании радиотерапевтического лечения в основном руководствуются радиочувствительностью клеток опухоли, на исход лечения может влиять также целый ряд других факторов. Таким образом, собственно радиочувствительность опухоли не является достаточным условием для успешного лечения.
Например, острый лимфобластный лейкоз (ОЛЛ) высоко радиочувствителен, так как его злокачественные малые лимфобласты обладают крайне высокой чувствительностью даже к малым дозам ионизирующей радиации. В то же время, из-за своей распространенности в организме, когда он поражает практически весь костный мозг и многие питаемые кровотоком органы, до недавнего времени было невозможно проводить эффективную радиотерапию этого заболевания без фатальной передозировки всего организма.
Только разработка современной методики аллогенной костномозговой трансплантации (КМТ) позволила проводить тотальное облучение организма достаточно высокими дозами, вызывающими гибель основной массы злокачественных клеток. В данном случае трансплантация оказывает не терапевтический эффект, а позволяет применять повышенные дозы облучения, летальные для лейкозных клеток.
До сих пор еще нет ясного понимания, какие физико-химические процессы начинают происходить в клетке в результате облучения. Хотя не вызывает сомнений, что радиацией в первую очередь поражается ядерная ДНК, повреждения не исчерпываются только «прямым воздействием» пучка излучения на эти молекулы: в этом случае повреждения состоят в необратимом расщеплении нитей ДНК.
Основной же эффект воздействия ионизирующего излучения состоит в образовании нестабильных высоко реакционноспособных молекул свободных радикалов. Эти свободные радикалы в свою очередь реагируют с молекулами ДНК, вызывая их деструкцию. Вероятность гибели клетки от действия излучения зависит не только от количества энергии, поглощенной тканью (которая в свою очередь зависит от мощности источника облучения), но и от интенсивности пучка и типа радиоактивного излучения: y - излучение, электроны, нейтроны или другие частицы.
Эти различия легли в основу концепции линейной поглощенной дозы (ЛПД), которая характеризуется как количество поглощенной тканью энергии на единичном отрезке пробега конкретного пучка. В общих чертах, киловольтный пучок рентгеновского излучения имеет более высокий коэффициент ЛПД, чем мегавольтный пучок, а пучок нейтронов обладает гораздо более высоким коэффициентом ЛПД, чем рентгеновское излучение или у-излучение. Таким образом, если мы применяем нейтронную терапию, необходимо вводить соответствующие поправки интенсивности облучения по сравнению с обычными источниками.
Еще одним существенным моментом является то, что гипоксия, присущая опухолевым тканям, может оказывать радиопротекторное воздействие, особенно при использовании пучков с низким коэффициентом ЛПД. Именно поэтому нейтронное облучение, да еще в сочетании с оксигенацией опухолевых тканей, уже давно считается эффективным способом борьбы со злокачественными опухолями.
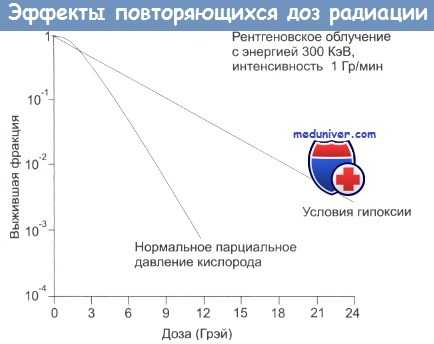
Фракционирование: эффект последовательно повторяющихся доз радиации.
Фракционирование увеличивает разницу в реакции на облучение между здоровыми и злокачественными тканями.
Экспериментальные исследования показывают, что человеческие опухолевые клетки значительно отличаются друг от друга по радиочувствительности. Современный уровень знаний позволяет постулировать два типа клеточной гибели: так называемую а-компоненту, которая является линейно-логарифмической (экспоненциальной) и на графиках дозо-зависимой гибели будет представлена прямой линией, и b-компоненту, которая отражает гибель клеток при краткосрочном облучении малыми дозами.
Наиболее существенные различия в радиочувствительности клеток отмечаются именно в этом низкодозном диапазоне (который одновременно имеет наибольшее значение для клинической практики) при облучении дозами до 2 Гр (200 рад). Более того, облучение низкими дозами, по-видимому, увеличивает разброс в чувствительности клеток. С другой стороны, облучение низкими дозами радиации приводит к тому, что некоторые клетки становятся более устойчивыми к действию радиации. Все эти факты позволяют многим выступать за необходимость применения высоких доз облучения для низкочувствительных опухолей.
В построении линейно-квадратических математических моделей с использованием а-компонентов как линейной дозово-зависимой функции и b-компонентов как квадратичной функции выживание клеток используется для анализа конечных результатов. Фракционированный подход в облучении чаще применяют к поздне-реагирующим опухолевым тканям, чем к быстро-реагирующим опухолям.
В ряде клинических случаев неудача при использовании радиотерапии происходит потому, что часто даже после относительно успешного сеанса облучения тем ни менее происходит развитие рецидивов заболевания. Довольно часто это случается, например, при лечении плоскоклеточной карциномы бронхов, когда даже точная рентгенография грудной клетки и бронхоскопия фиксируют удовлетворительный эффект проведенного лечения. Как мы можем объяснить возникновение рецидива через 1-2 года после завершения первичного лечения? Одна из наиболее распространенных точек зрения, которая к тому же согласуется с экспериментальными данными, состоит в том, что в момент проведения первичного лечения в организме присутствуют клетки с различной чувствительностью к излучению.
Этот факт, а также различия в степени оксигенации клеточных субпопуляций являются ключевыми факторами, влияющими на эффективность лечения. Таким феноменам посвящено множество радиобиологических исследований, и почти во всех экспериментах (как на экспериментальных животных, так и в клеточных культурах in vitro) четко показано, что повышение окигенации клеток значительно увеличивает их радиочувствительность по сравнению с клетками, находящимися в состоянии аноксии.
Различие в чувствительности клеток может быть таково, что для эффективного воздействия на клетки в состоянии аноксии требуется применять в два-три раза более мощные дозы облучения. Эта проблема имеет большое клиническое значение, так как если клетки лишаются хорошего артериального кровоснабжения, они неизбежно начинают страдать аноксией.
Предполагается, что в крупных опухолях со сравнительно быстрым ростом и обширными некротическими областями с низкой насыщенностью кровеносными сосудами аноксия может стать основным фактором, определяющим радиорезистентность опухолевой ткани. Эксперименты с использованием микроэлектродов для замеров парциального содержания кислорода подтверждают эти теоретические предположения.
Клетки-предшественники тоже могут иметь различную радиочувствительность, но эти различия не связаны с кислородным эффектом. Рецидивы, возникающие после успешно проведенного курса радиотерапии, в этом случае могут быть обусловлены регенерацией радиорезистентных стволовых клеток опухоли. Причем регенерация может происходить как после окончания полного курса радиотерапии, так и очень быстро, буквально в промежутках между сеансами облучения. Существует ряд наблюдений, показывающих, что возобновление популяции стволовых клеток нормальной ткани после облучения происходит несколько более быстро, чем у опухолевой ткани.
Этот факт может лечь в основу лечения, так как регенеративные способности нормальной ткани позволяют использовать такие дозы облучения, которые при слабом на нее воздействии окажут эффективное поражающее действие на опухоль. В некотором смысле этот эффект аналогичен воздействию химиотерапевтических препаратов, которые тоже воздействуют на все клетки — как нормальные, так и опухолевые — но в разной степени. Признание важности эффектов восстановления популяции опухолевых клеток и клеточной гипоксии ведет к росту числа исследований в данной области.
Среди множества попыток найти эффективное лечение следует отметить разработки методов гиперфракциональной радиотерапии и попытки повысить кислородное снабжение опухолевой ткани, чтобы добиться максимальной локальной эффективности при облучении внешними источниками радиации.
Протонная терапия рака безопаснее классической лучевой: теперь доказано научно
Недавно было проведено исследование, которое показало: эффективность протонной и классической лучевой терапии в лечении онкологических заболеваний одинакова. Но протонная терапия более безопасна.
Лучевая терапия входит в классическую триаду лечения рака, вместе с хирургическими вмешательствами и химиотерапией. Процедуры напоминают диагностическую рентгенографию. Здесь тоже применяют рентгеновское излучение, но в более высоких дозах, и облучение проводят дольше. Лучевую терапию назначают при разных типах злокачественных опухолей, как на ранних стадиях, так и при запущенном раке с метастазами. Это эффективный метод лечения, но он имеет серьезные побочные эффекты, потому что ионизирующее излучение поражает не только опухолевые, но и здоровые клетки.
Чаще всего пациентов во время курса лечения беспокоят такие симптомы, как постоянное чувство усталости, раздражение на коже, тошнота, рвота, диарея, повышение температуры тела, снижение аппетита, проблемы с глотанием и приемом пищи.
Протонная терапия — метод лечения, во время которого вместо рентгеновского излучения используют поток протонов. Она может иметь меньше побочных эффектов по сравнению с классической лучевой терапией. Именно это и решили проверить американские ученые во время недавнего исследования.
Риск побочных эффектов существенно ниже
Команда исследователей, возглавляемая доктором Брайаном Бауманном (Brian C. Baumann), онкологом-радиологом из Вашингтонского университета, обследовали почти 1500 пациентов с различными типами злокачественных опухолей, в том числе раком легких, мозга, пищеварительного тракта, женской репродуктивной системы, головы и шеи.
Все больные получали комбинированное лечение, включавшее химиотерапию и лучевую терапию. Ученые сравнили результаты применения рентгеновского излучения и протонной терапии. Они собрали информацию о ходе лечения и возникавших побочных эффектах, учитывая возраст и сопутствующие диагнозы каждого пациента. Главным образом внимание исследователей было сосредоточено на серьезных побочных эффектах, которые требовали госпитализации пациента.
Оказалось, что риск серьезных побочных эффектов в течение 90 дней лечения при использовании протонной терапии был примерно на две трети ниже, чем при облучении больных рентгеном.
В то же время, ученые не обнаружили различий в показателях выживаемости, а это значит, что эффективность протонной терапии так же высока, как и при использовании рентгеновского излучения.
Доктор Брайан Бауманн отмечает:
Протонная терапия значительно реже приводила к серьезным побочным эффектам — тем, при которых пациента приходится госпитализировать в стационар или вызывать «скорую помощь» — по сравнению с классической лучевой терапией, при одновременном применении химиопрепаратов и лучевой терапии.
Ранее проведенные исследования уже указывали на более высокую безопасность протонной терапии, но ученые не ожидали, что разница будет настолько существенной. При этом средний возраст пациентов в группе применения протонной терапии был на 5 лет больше, чем в группе классической лучевой терапии.
Более низкий риск побочных эффектов протонной терапии вполне объясним. Протон — это довольно тяжелая заряженная частица. Она останавливается вскоре после того, как достигает своей цели. Рентгеновские лучи — это поток фотонов, не имеющих массы. Они легко проходят через организм человека, в том числе через ткани, расположенные рядом с опухолью, и могут их повреждать.
Читайте также:
- Диагностика краниостеноза по КТ, МРТ
- Примеры эпителиомы (аденомы) пигментного эпителия сетчатки симулирующей меланоцитому
- Неврологические заболевания вызванные ВИЧ. ВИЧ-энцефалопатия.
- Дыхательный газообмен. Газообмен при физических нагрузках
- Кровь при пищевых токсикоинфекциях. Гемограмма при вирусных кишечных инфекциях
