Примеры эпителиомы (аденомы) пигментного эпителия сетчатки симулирующей меланоцитому
Добавил пользователь Дмитрий К. Обновлено: 16.01.2026
ФГБНУ «Научно-исследовательский институт глазных болезней»
ФГБНУ «Научно-исследовательский институт глазных болезней» Минобрнауки России
Аваскулярные отслойки ретинального пигментного эпителия при возрастной макулярной дегенерации
Журнал: Вестник офтальмологии. 2020;136(4): 284‑288
Отслойка ретинального пигментного эпителия сетчатки (ОРПЭС) — патологическое состояние, при котором пигментный эпителий сетчатки отделяется от подлежащей мембраны Бруха вследствие образования фиброваскулярной мембраны, друзеноидного материала, накопления жидкости и/или крови. Выделено 6 типов отслоек ретинального пигментного эпителия (РПЭ): псевдовителлиформные; отслойки, связанные со сливными друзами; серозные; сосудистые; геморрагические; отслойки, связанные с сосудистой аномалией сетчатки. Друзеноидная ОРПЭС всегда является аваскулярной, между РПЭ и мембраной Бруха содержится друзеноидный материал. Впервые описана A. Casswell в 1985 г. При офтальмоскопии на глазном дне определяется субретинальная, желто-белая ячеистая структура, иногда содержащая вкрапление пигмента, с неровной поверхностью, четкими границами и волнистым краем. Серозная ОРПЭС — большая по площади и проминенции, чем друзеноидная, характеризуется наличием гипорефлективной зоной под отслоенным РПЭ, по площади более 50% от всей площади отслойки. При офтальмоскопии определяется субретинальный прозрачно-желтый, иногда с коричневым оттенком очаг с четкими границами, куполообразно проминирующий. Истинная серозная ОРПЭС является аваскулярной (сочетание хориоидальной неоваскуляризации и серозной ОРПЭС мы рассмотрим в статье о васкуляризированных ОРПЭС).
Дата принятия в печать:
Отслойка ретинального пигментного эпителия (ОРПЭС) — патологическое состояние, при котором пигментный эпителий сетчатки отделяется от подлежащей мембраны Бруха вследствие образования фиброваскулярной мембраны, друзеноидного материала, накопления жидкости и/или крови [1]. Одним из первых классификацию ОРПЭС предложили M. Hartnett и соавторы в 1992 г. Авторы описали 6 типов отслоек ретинального пигментного эпителия (РПЭ): псевдовителлиформные, отслойки, связанные со сливными друзами, серозные, сосудистые и геморрагические, а также ОРПЭС, связанные с сосудистой аномалией сетчатки. Соотнесены типы отслоек РПЭ сетчатки с остротой зрения и анатомическими результатами. Самые низкие показатели наблюдались при ОРПЭС, связанных с неоваскуляризацией (сосудистых, геморрагических и сосудистых аномалиях). Глаза с псевдовителлиформными поражениями или сливными друзами имели лучший прогноз по зрению и анатомическим показателям. Субретинальная неоваскуляризация развилась в 16 (34%) глазах из серозных ОРПЭС в среднем за 25 мес. В случаях с псевдовителлиформной дистрофией и сливными друзами субретинальная неоваскуляризация встречалась редко. Предложенная система классификации может быть полезна для прогнозирования течения ОРПЭС [2]. В зависимости от патогенетических факторов развития ОРПЭС при возрастной макулярной дегенерации (ВМД) можно подразделить на следующие формы:
4. Геморрагическая [3].
Друзеноидная ОРПЭС — всегда аваскулярная, между РПЭ и мембраной Бруха содержится друзеноидный материал. Впервые описана A. Casswell в 1985 г. [4]. Формирование происходит за счет слияния большого количества преимущественно мягких друз. В мембране Бруха в процессе возрастных изменений происходят прогрессирующее утолщение двух коллагеновых слоев, модификация и дегенерация коллагена и эластина, повышение концентрации конечных продуктов гликирования, белков и липидов, и в финале — накопление конечных продуктов под РПЭ [5].
При офтальмоскопии на глазном дне определяется субретинальная, желто-белая ячеистая структура, иногда содержащая вкрапление пигмента, с неровной поверхностью, четкими границами и волнистым краем. При аутофлюоресценции (АФ) — гомогенная изоаутофлюоресценция, или гипераутофлюоресценция (средней интенсивности), возможна гипоаутофлюоресценция по краю и в местах скопления пигмента.
Флюоресцентная ангиография глазного дна (ФАГД) — на ранних фазах регистрируется гиперфлюоресценция средней интенсивности, с увеличением интенсивности по мере накопления флуоресцеина натрия под ОРПЭС к поздним фазам. Фокальные зоны, блокирующие флюоресцентный сигнал, соответствуют отложению пигмента. Ангиография глазного дна с индоцианином зеленым (ICGA) — гипофлюоресценция на протяжении всех фаз [6].
При оптической когерентной томографии (ОКТ) визуализируется ячеистая, куполообразная структура с волнистой поверхностью и подлежащей зоной гомогенного гиперрефлективного сигнала средней интенсивности. Участки отложения пигмента видны как интраретинальный гиперрефлективный материал высокой интенсивности. Над друзеноидной ОРПЭС можно обнаружить гиперрефлективную линию — ретинальный пигментный эпителий (рис. 1).
Рис. 1. Оптическая когерентная томограмма пациента с друзеноидной отслойкой ретинального пигментного эпителия сетчатки.
Течение друзеноидной ОРПЭС может быть разнообразным, она может существовать длительное время без изменений, может уменьшаться в размерах с развитием макулярной атрофии, терминальной стадией которой является географическая атрофия, или при росте хориоидальной неоваскуляризации (ХНВ) перейти в фиброваскулярный тип отслойки [7]. Персистенция друзеноидной ОРПЭС происходит в 38% случаев, развитие географической атрофии в 49% и только в 13% случаев под ней развивается ХНВ с переходом в фиброваскулярную ОРПЭС [5].
Начальный этап развития ОРПЭС характеризуется аккумуляцией друзеноидного материала между РПЭ и мембраной Бруха. Напряжение кислорода снижается на 30—50% у вершины в зависимости от роста друзеноидной ОРПЭС. Клетки РПЭ, лежащие на верхушке друзы, максимально удалены от хориокапилляров и могут мигрировать в поисках кислорода из капилляров сетчатки. Оставшиеся клетки РПЭ подвержены апоптозу, разрушению с переходом органелл клетки в состав друз [8]. Последующая фаза — регрессия, протекает с прогрессированием атрофии наружных слоев сетчатки по мере уменьшения количества клеток РПЭ на поверхности ОРПЭС. Процесс образования друзеноидного материала заканчивается, происходит «самоочищение» последнего, объем ОРПЭС уменьшается, и в конечном итоге наблюдается коллапс друзеноидной ОРПЭС, на месте которой регистрируется зона полной атрофии РПЭ и наружных слоев сетчатки (географическая атрофия). По мнению J. Sarks и соавторов, по мере увеличения как мягких сливных друз, так и друзеноидной ОРПЭС материал внутри них распадается и становится более тонким по своей природе, что приводит к более быстрому коллапсу друзы и развитию географической атрофии [9]. На ОКТ при этом можно наблюдать негомогенный характер друзеноидного материала с появлением гипорефлективных участков. Даже до явного развития географической атрофии ОРПЭС приводит к дисфункции фоторецепторов и последующей наружной атрофии сетчатки. Для друзеноидных ОРПЭС, выявленных на раннем этапе развития, характерна высокая острота зрения. Развитие наружной атрофии сетчатки в процессе существования ОРПЭС может объяснять потерю 15 и более букв в 26% случаев в отсутствие прогрессирования до поздней стадии ВМД (по классификации AREDS). При офтальмоскопии обнаружено, что при развитии гипопигментации риск снижения остроты зрения удваивается [7, 9] (рис. 2).
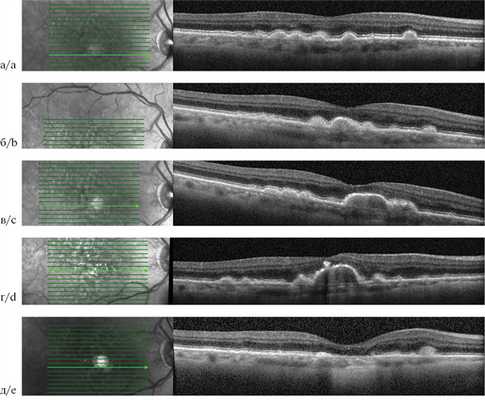
Рис. 2. Оптическая когерентная томограмма пациента с возрастной макулярной дегенерацией.
Жизненный цикл друзеноидной отслойки ретинального пигментного эпителия сетчатки от мягких друз до географической атрофии: а — 2013 г.; б — 2014 г.; в — 2015 г.; г — 2017 г.; д — 2018 г.
Гиперрефлективные локусы округлой формы на вершине аваскулярной ОРПЭС соответствуют «отторгающемуся» и «интраретинальному» фенотипам. Последние представляют собой интраретинальные включения РПЭ в наружном ядерном слое. При этом РПЭ также может быть обнаружен в непосредственной близости от капилляров и вплоть до слоя ганглиозных клеток сетчатки (ГКС). В процессе динамического наблюдения пациентов с друзеноидными ОРПЭС отмечено, что «отторгающий» фенотип является начальным этапом миграции клеток РПЭ в наружную сетчатку и в последующем переходит в «интраретинальный» фенотип. Существуют также сочетанные варианты. Миграция клеток РПЭ в наружные слои сетчатки приводит к истончению слоя РПЭ и развитию разрыва РПЭ, коллапса ОРПЭС и последующему формированию атрофии наружных слоев сетчатки и РПЭ [5]. Еще один фенотип друзеноидной ОРПЭС — «вителлиформный», служит плохим прогностическим признаком, поскольку приводит к выраженному снижению остроты зрения за счет быстрого развития географической атрофии. Считается, что образование вителлиформного материала у пациентов с ВМД происходит за счет разрушения РПЭ и наружных сегментов фоторецепторов вследствие дефекта фагоцитарной активности клеток РПЭ, что приводит к накоплению органелл РПЭ и дебриса наружных сегментов фоторецепторов [10—13].
Серозная ОРПЭС — большая по площади и проминенции, чем друзеноидная, характеризуется наличием гипорефлективной зоны под отслоенным РПЭ, составляет более 50% от всей площади отслойки. При офтальмоскопии определяется субретинальный прозрачно-желтый, иногда с коричневым оттенком очаг с четкими границами, куполообразно проминирующий. Истинно серозная ОРПЭС является аваскулярной (сочетание хориоидальной неоваскуляризации и серозной ОРПЭС мы рассмотрим в статье о васкуляризированных ОРПЭС). При формировании серозной ОРПЭС большое значение имеет жидкость, которая не может пройти из стекловидного тела в кровоток через мембрану Бруха и скапливается под пигментным эпителием сетчатки (ПЭС) на фоне изменения экстрацеллюлярного матрикса. Это приводит к повышенной осмолярности в зоне под ПЭС, и, как следствие, усиливается скопление жидкости по градиенту концентрации [1] (рис. 3).
Рис. 3. Оптическая когерентная томограмма пациента с серозной отслойкой ретинального пигментного эпителия сетчатки.
Аваскулярная серозная ОРПЭС при ВМД встречается редко, как правило, при ее обнаружении необходимо проводить дифференциальную диагностику с центральной серозной хориоретинопатией.
Выявлено, что очаговое повреждение клеток РПЭ при серозных, аваскулярных ОРПЭС является предиктором опускания купола отслойки, коллапса или развития разрыва РПЭ, что приводит к снижению остроты зрения. На ОКТ очаговое повреждение РПЭ на куполе ОРПЭС может выглядеть как зона ослабления сигнала с нарушением целостности монослоя РПЭ и штрихообразной гипертрансмиссией.
Заключение
Таким образом, дифференциальная диагностика аваскулярных отслоек ретинального пигментного эпителия сетчатки имеет решающее значение для выбора дальнейшей тактики ведения пациентов.
Примеры эпителиомы (аденомы) пигментного эпителия сетчатки симулирующей меланоцитому
Эпителиома (аденома) пигментного эпителия сетчатки: признаки, гистология, лечение, прогноз
Приобретенное новообразование, развивающееся из пигментного эпителия сетчатки, обычно не похоже как на меланому хориоидеи, так и на новообразования пигментного эпителия радужки или цилиарного тела (1-37).
Эта опухоль может быть доброкачественной или злокачественной, но случаи местного или отдаленного метастазирования редки или не встречаются вовсе.
Поскольку клиническая картина и тактика лечения одинаковы, мы будем называть и доброкачественные, и злокачественные опухоли эпителиомой пигментного эпителия сетчатки и опишем их вместе.
а) Клиническая картина. Эпителиома пигментного эпителия сетчатки обычно диагностируется во взрослом возрасте, средний возраст на момент постановки диагноза составляет 53 года (от 28 до 79 лет). В отличие от меланомы сосудистой оболочки у этой опухоли не отмечено расовой предрасположенности.
Возможна небольшая предрасположенность у женщин (1). Хотя аденома пигментного эпителия сетчатки обычно развивается в здоровых глазах, она также выявлялась в глазах, ранее перенесших травму или воспаление. В таких случаях эпителиома может развиваться на фоне ранее существовавшей реактивной гиперплазии пигментного эпителия сетчатки.
Эпителиома пигментного эпителия сетчатки обычно представляет собой солитарное одностороннее новообразование от темно-коричневого до черного цвета, она возникает как мелкая опухоль глубоких слоев сетчатки.
Обычно новообразование растет очень медленно и прорастает вышележащую сенсорную сетчатку; тогда же она приобретает питающую артерию и дренирующую вену из системы кровеносных сосудов сетчатки, оба этих сосуда расширяются и становятся извитыми, также как и сосуды гемангиобластомы сетчатки.
Медленно развивается интраретинальная экссудация, постепенно достигающая субретинального пространства и вызывающая формирование интраретинальных и субретинальных экссудатов желтого цвета; при меланоме хориоидеи такие изменения встречаются крайне редко.
В редких случаях при отсутствии лечения опухоль может заполнять все глазное яблоко и прорастать сквозь склеру в мягкие ткани глазницы (28). Иногда источником эпителиомы пигментного эпителия сетчатки становится очаг врожденной гипертрофии ПЭС (4).
ДОБРОКАЧЕСТВЕННАЯ ЭПИТЕЛИОМА (АДЕНОМА) ПИГМЕНТНОГО ЭПИТЕЛИЯ СЕТЧАТКИ: ФЛЮОРЕСЦЕНТНАЯ АНГИОГРАФИЯ И УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
Результаты флюоресцентной ангиографии и ультразвукового исследования могут оказать большую помощь при дифференцировке новообразований пигментного эпителия сетчатки от меланомы хориоидеи. При ангиографии, вероятнее всего, будут обнаружены ретинальные сосуды, питающие и дренирующие новообразование пигментного эпителия сетчатки, также опухоль будет менее гиперфлюоресцентной, чем большинство меланом. При опухоли ПЭС во время ультразвукового исследования отмечается более высокая эхогенность ткани, чем при меланоме.
Резко проминирующее в стекловидную камеру интенсивно пигментированное объемное образование овальной формы возле экватора глазного яблока у женщины 47 лет. В ранние фазы флюоресцентной ангиографии наблюдается гипофлюоресценция новообразования и несколько расширенный питающий сосуд сетчатки. При УЗИ определяется акустически плотное новообразование на ножке. Был отмечен рост опухоли, выполнена частичная послойная склероувеоэктомия, опухоль удалена. Микропрепарат новообразования, показанного на рисунке выше: наблюдаются пролиферация клеток пигментного эпителия и типичные микрокисты, выявляемые иногда в эпителиомах пигментного эпителия периферических отделов сетчатки и большинстве эпителиом пигментного эпителия цилиарного тела. Фото глазного дна: видны объемное образование сетчатки черного цвета, питающие его ретинальные сосуды и окружающие опухоль экссудаты сетчатки. Весьма вероятно, что это новообразование является эпителиомой, поскольку такие экссудаты желтого цвета для меланомы не характерны. Цитологическое исследование материала, полученного при ТАБ новообразования, показанного на рисунке выше. Интенсивно пигментированные клетки внешне соответствуют клеткам эпителия, изучение осветленных препаратов и иммуногистохимическое исследование подтвердили диагноз доброкачественной эпителиомы пигментного эпителия сетчатки. На основании результатов цитологического исследования принято решение наблюдать пациента, не прибегая к активному лечению.
б) Диагностика. В нашей серии наблюдений все пациенты были направлены к нам с предварительным диагнозом меланома хориоидеи (1). При диафаноскопии опухоль обычно полностью или частично блокирует свет.
При флюоресцентной ангиографии определяются питающие опухоль ретинальные сосуды, в ранние фазы наблюдается гипофлюоресценция, а в конце исследования - минимальная гиперфлюоресценция опухоли, при этом хориоидальные сосуды не визуализируются.
При ультразвуковом исследовании, как правило, видно, что новообразование резко проминирует в стекловидную полость; отмечается средняя или высокая эхогенность и акустическая плотность ткани опухоли.
При цитологическом исследовании материала, полученного при тонкоигольной аспирационной биопсии, определяются клетки, соответствующие клеткам пигментной эпителиальной опухоли (9).
в) Патологическая анатомия. Гистологически эпителиома пигментного эпителия сетчатки развивается в результате неопластической пролиферации клеток ПЭС, формирующих тяжи и тубулы.
В большинстве случаев выявляются высокодифференцированные клетки, но могут встречаться и низкодифференцированные опухоли. Часто наблюдается прорастание опухолью покрывающей ее сетчатки и нижележащей хориоидеи.
В опухолях пигментного эпителия передних отделов сетчатки часто выявляются микрокисты, также как и в эпителиомах пигментного эпителия цилиарного тела, а опухоли задних отделов имеют железистое или тубулярное строение.
г) Лечение. Лечение эпителиомы пигментного эпителия сетчатки неизбежно варьирует от случая к случаю. Мы считаем, что маленькие бессимптомно существующие новообразования можно лишь наблюдать.
Если опухоль локализуется спереди от экватора и демонстрирует рост, мы выполняем местную резекцию методом частичной послойной склероувеоэктомии (10) или проводим брахитерапию с применением аппликатора. Если опухоль лежит позади экватора и осложняется экссудативной отслойкой сетчатки, выполняется лазерокоагуляция, проводится термотерапия или криотерапия.
При опухолях среднего или крупного размера в глазах с хорошими зрительными функциями возможно проведение брахитерапии с применением аппликатора. Если зрение ухудшается вследствие витреоретинальной тракции, то, кроме описанного выше лечения, проводится витрэктомия с введением в стекловидную полость газа с целью восстановить прилегание сетчатки.
Клинические примеры эпителиомы (аденомы) пигментного эпителия сетчатки:
д) Список использованной литературы:
1. Shields JA, Shields CL, Gunduz К, et al. Neoplasms of the retinal pigment epithelium: the 1998 Albert Ruedemann, Sr, memorial lecture, Part 2. Arch Ophthalmol 1999;117:601-608.
2. Shields JA, Shields CL, Singh AD. Acquired tumors arising from congenital hypertrophy of the retinal pigment epithelium. Arch Ophthalmol 2000; 118:637-641.
3. Laqua Н. Tumors and tumor-like lesions of the retinal pigment epithelium. Ophthalmologica 1981;183:34-38.
4. Greer CH. Epithelial tumours of the retinal pigment epithelium. Trans Ophthalmol Soc UK 1952;72:265-277.
5. Shields JA, Shields CL, Gunduz K, et al. Adenoma of the ciliary body pigment epithelium: the 1998 Albert Ruedemann, Sr, memorial lecture, Part 1 .Arch Ophthalmol 1999;117:592-597.
6. Shields JA, Mashayekhi A, Ra S, et al. Pseudomelanomas of the posterior uveal tract. The 2006 Taylor Smith Lecture. Retina 2005;25:767-771.
7. Shields CL, Manalac J, Das C, et al. Choroidal melanoma. Clinical features, classification, and top 10 pseudomelanomas. Curr Opin Ophthalmol 2014;25(3): 177-185.
8. Tso MO, Albert DM. Pathologic conditions of the retinal pigment epithelium. Arch Ophthalmol 1972;88:27-38.
9. Shields JA, Shields CL, Ehya H, et al. Fine needle aspiration biopsy of suspected intraocular tumors. The 1992 Urwick Lecture. Ophthalmology 1993;100:1677-1684.
10. Shields JA, Shields CL, Shah P, et al. Partial lamellar sclerouvectomy for ciliary body and choroidal tumors. Ophthalmology 1991;98:971-983.
11. Theobald GD, Floyd G, Kirk HQ. Hyperplasia of the retinal pigment epithelium. Simulating a neoplasm: report of two cases. Am J Ophthalmol 1958;45:235-240.
12. Fair JR. Tumors of the retinal pigment epithelium. Am J Ophthalmol 1958;45: 495-505.
13. Blodi FC, Reuling FH, Sornson ET. Pseudomelanocytoma at the optic nervehead: an adenoma of the retinal pigment epithelium. Arch Ophthalmol 1965;73:353-355.
14. Garner A. Tumours of the retinal pigment epithelium. Br J Ophthalmol 1970;54: 715-723.
15. deHaan AB. Tumour of the pigment epithelium. Ophthalmologica 1971;163:26.
16. Font RL, Zimmerman LE, Fine BS. Adenoma of the retinal pigment epithelium. Am J Ophthalmol 1972;73:544-554.
17. Minckler D, Allen AW. Adenocarcinoma of the retinal pigment epithelium. Arch Ophthalmol 1978;96:2252-2254.
18. Chamot L, Zografos L. Tumeurs et pseudo-tumeurs de l’epithelium pigmentaire. J Fr Ophthalmol 1984;7:825-836.
19. Jampel HD, Schachat AP, Conway B, et al. Retinal pigment epithelial hyperplasia assuming tumor-like proportions: a report of two cases. Retina 1986;6:105-112.
20. Ramahefasolo S, Coscas G, Regenbogen L, et al. Adenocarcinoma of retinal pigment epithelium. Br J Ophthalmol 1987;71:516-520.
21. Shields JA, Eagle RC Jr, Shields CL, et al. Pigmented adenoma of the optic nerve head simulating a melanocytoma. Ophthalmology 1992;99:1705-1708.
22. Shields JA, Eagle RC Jr, Barr CC, et al. Adenocarcinoma of the retinal pigment epithelium arising from a juxtapapillary histoplasmosis scar. Arch Ophthalmol 1994;112: 650-653.
23. Fan IT, Robertson DM, Campbell RJ. Clinicopathologic correlation of a case of adenocarcinoma of the retinal pigment epithelium. Am J Ophthalmol 1995;119:243-245.
24. Finger PT, McCormick SA, Davidian M, et al. Adenocarcinoma of the retinal pigment epithelium: a diagnostic and therapeutic challenge. Graefes Arch Clin Exp Ophthalmol 1996;234: S22-S27.
25. Loeffler KU, Kivela T, Borgmann H, et al. Malignant tumor of the retinal pigment epithelium with extraocular extension in a phthisical eye. Graefes Arch Clin Exp Ophthalmol 1996;234: S70-S75.
26. Edelstein C, Shields CL, Shields JA, et al. Presumed adenocarcinoma of the retinal pigment epithelium in a blind eye with a staphyloma. Arch Ophthalmol 1998;16: 525-528.
27. Loose IA, Jampol LM, O’Grady R. Pigmented adenoma mimicking a juxtapapillary melanoma. A 20-year follow-up. Arch Ophthalmol 1999;117:120-122.
28. Shields JA, Shields CL, Eagle RC Jr, et al. Adenocarcinoma arising from congenital hypertrophy of the retinal pigment epithelium. Arch Ophthalmol 2001;119:597-602.
29. Shields JA, Melki T, Shields CL, et al. Epipapillary adenoma of retinal pigment epithelium. Retina 2001;21:76-78.
30. Shields JA, Materin M, Shields CL, et al. Adenoma of the retinal pigment epithelium simulating a juxtapapillary choroidal neovascular membrane. Arch Ophthalmol 2001;] 19:289-292.
31. Heegaard S, Larsen JN, Fledelius HC, et al. Neoplasia versus hyperplasia of the retinal pigment epithelium. A comparison of two cases. Acta Ophthalmol Scand 2001; 79:626-633.
32. Sommacal A, Campbell RJ, Helbig H. Adenocarcinoma of the retinal pigment epithelium. Arch Ophthalmol 2003;121:1481-1483.
33. Heindl LM, Naumann GO, Kruse FE, et al. Aggressive metastasizing adenocarcinoma of the retinal pigment epithelium with trisomy 21. Br J Ophthalmol 2008;92(3): 389-391.
34. Shields JA, Eagle RC Jr, Shields CL, et al. Malignant transformation of congenital hypertrophy of the retinal pigment epithelium. Ophthalmology 2009;116(11): 2213-2216.
35. Palamar M, Shields CL, Marr BP, et al. Retinal pigment epithelial tumor in a young Asian female. Eur J Ophthalmol 2009;19(3):487-489.
36. Wei W, Mo J, Jie Y, Li B. Adenoma of the retinal pigment epithelium: A report of 3 cases. Can J Ophthalmol 2010;45(2):166-170.
37. Cupp DG, McCannell ТА. Macular pucker in association with RPE adenoma: A report of a case and review of the literature. Semin Ophthalmol 2013;29:199-201.
Редактор: Искандер Милевски. Дата публикации: 29.6.2020
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Эпителиома
Эпителиома — это опухоль кожи и слизистых оболочек, развивающаяся из клеток их поверхностного слоя — эпидермиса. Эпителиомы отличаются многообразием клинических вариантов от небольших узелков до опухолей значительного размера, бляшек и язв. Могут иметь доброкачественную и злокачественную природу. Их диагностика включает дерматоскопию, бакпосев отделяемого, УЗИ образования, гистологическое исследование удаленных тканей или биопсийного материала. Лечение в основном хирургическое, при злокачественном характере опухоли — лучевое, химиотерапевтическое, фотодинамическое, с применением как общих, так и локальных способов воздействия.
МКБ-10
Общие сведения
В современной дерматологии большинство авторов относят к эпителиомам следующие новообразования кожи: базалиому (базально-клеточную эпителиому), плоскоклеточный рак (спиноцеллюлярную эпителиому) и трихоэпителиому (аденоидную кистозную эпителиому). Попытки некоторых исследователей отождествить эпителиому с раком кожи представляются нецелесообразными, поскольку среди эпителиом встречаются доброкачественные новообразования кожи, лишь в редких случаях претерпевающие злокачественную трансформацию. Большинство эпителиом возникает у пациентов зрелого и пожилого возраста. Наиболее распространенной эпителиомой является базалиома, на долю которой приходится 60-70% всех случаев заболевания.
Причины эпителиомы
К развитию эпителиомы приводят различные неблагоприятные факторы, хронически воздействующие на кожу и часто связанные с профессиональной деятельностью. К ним относятся:
- повышенная солнечная инсоляция;
- радиоактивное облучение;
- влияние химических веществ;
- постоянная травматизация кожи;
- локальные воспалительные процессы.
В связи с эти возникновение эпителиомы возможно на фоне хронического солнечного дерматита, лучевого дерматита, профессиональной экземы, травматического дерматита, на месте рубца после перенесенного ожога.
Симптомы эпителиомы
Базалиома
Базально-клеточная эпителиома чаще возникает на коже лица и шеи. Отличается многообразием клинических форм, большинство из которых начинаются с образования на коже небольшого узелка. Базально-клеточная эпителиома считается злокачественным образованием, так как она обладает инвазивным ростом, прорастает не только дерму и подкожную клетчатку, но также подлежащие мышечные ткани и костные структуры. Однако при этом она не склонна давать метастазы.
К редким формам базалиомы относятся саморубцующаяся эпителиома и обызвествленная эпителиома Малерба. Саморубцующаяся эпителиома характеризуется распадом типичного базалиомного узелка с образованием язвенного дефекта. В дальнейшем происходит медленное увеличение размеров язвы, сопровождающееся рубцеванием отдельных ее частей. В некоторых случаях переходит в плоскоклеточный рак кожи.
Обызвествленная эпителиома Малерба
Пиломатриксома — это доброкачественная опухоль, появляющаяся в детском возрасте из клеток сальных желез. Проявляется образованием в коже лица, шеи, волосистой части головы или плечевого пояса единичного очень плотного, подвижного, медленно растущего узелка, величиной от 0,5 до 5 см.
Спиноцеллюлярная эпителиома
Развивается из клеток шиповатого слоя эпидермиса и отличается злокачественным течением с метастазированием. Излюбленная локализация — кожа перианальной области и гениталий, красная кайма нижней губы. Может протекать с образованием узла, бляшки или язвы. Характеризуется быстрым ростом как по периферии, так и в глубину тканей.
Аденоидная кистозная эпителиома
Встречается чаще у женщин после пубертатного периода. В большинстве случаев она представлена множественными безболезненными опухолями размером до крупной горошины. Цвет образований может быть голубоватым или желтоватым. Изредка встречается белесоватый цвет, из-за которого элементы эпителиомы могут напоминать угри. В отдельных случаях наблюдается появление одиночной опухоли, достигающей размеров лесного ореха.
Типичная локализация элементов — ушные раковины и лицо, реже поражается волосистая часть головы, еще реже — плечевой пояс, живот и конечности. Характерно доброкачественное и медленное течение. Лишь в единичных случаях наблюдается трансформация в базалиому.
Диагностика
Многообразие клинических форм эпителиомы несколько затрудняет ее диагностику. Поэтому, проводя обследование, дерматолог старается подключить все возможные методы исследования: дерматоскопию, УЗИ кожного образования, бакпосев отделяемого отделяемого язвенных дефектов. Однако окончательный диагноз с определением клинической формы заболевания, его доброкачественности или злокачественности, позволяет установить только гистологическое исследование полученного при удалении эпителиомы или биопсии кожи материала. Дифференциальную диагностику проводят с:
- красным плоским лишаем;
- псориазом;
- болезнью Боуэна;
- системной красной волчанкой;
- склеродермией;
- себорейным кератозом;
- болезнью Кейра и др.
Аденоидная кистозная эпителиома требует дифференцировки от гидраденита, ксантелазмы, плоскоклеточного рака кожи, обыкновенной бородавки.
Лечение эпителиомы
Основной способ лечения эпителиомы, независимо от ее клинической формы, - это хирургическое иссечение образования. При мелких множественных опухолях возможно применение криодеструкции, удаления лазером, кюретажа или электрокоагуляции. При глубоком прорастании и наличии метастазирования операция может носить паллиативный характер. Злокачественная природа опухоли является показанием к сочетанию хирургического лечения с рентгенорадиотерапией, фотодинамической терапией, наружной или общей химиотерапией.
Прогноз
При доброкачественном характере заболевания, своевременном и полном удалении опухоли прогноз благоприятный. Базально-клеточная и спиноцеллюлярная эпителиома склонны к частым послеоперационным рецидивам, для раннего выявления которых необходимо постоянное наблюдение дерматоонколога. Наиболее неблагоприятной в прогностическом плане является спиноцеллюлярная форма заболевания, особенно при развитии метастазов опухоли.
Пигментный ретинит
Пигментный ретинит – генетически гетерогенное наследственное заболевание, характеризующееся нарушением функционирования пигментного эпителия сетчатки глаза с развитием разнообразных нарушений. Проявления и выраженность симптомов зависят от формы патологии, наиболее часто наблюдается снижение остроты и сужение поля зрения, развитие скотомы и нарушение темновой адаптации, в дальнейшем может возникать слепота. Диагностика пигментного ретинита производится на основании данных офтальмологических исследований (осмотр глазного дна, электроретинография и электроокулография), молекулярно-генетических анализов. Специфическое лечение этого состояния на сегодняшний день разрабатывается (генная терапия, использование стволовых клеток), в клинической практике применяют поддерживающую терапию.
Пигментный ретинит (пигментная абиотрофия сетчатки) – наследственное дегенеративное заболевание сетчатки глаза, которое характеризуется развитием выраженных нарушений зрения вплоть до полной слепоты. Это заболевание, как одна из причин потери зрения в различном возрасте, известно с древнейших времен, но термин «пигментный ретинит» был предложен голландским офтальмологом Ф. Дондерсом в 1857 году. По мере развития офтальмологии и генетики удалось выяснить, что это состояние представляет собой целую совокупность заболеваний сетчатки, имеющих различную этиологию, но сходный патогенез. В настоящий момент известно несколько десятков генов и сотни вариантов их мутаций, способных привести к этому заболеванию. Механизм наследования пигментного ретинита также может быть различным – описаны аутосомно-доминантные, аутосомно-рецессивные и сцепленные с Х-хромосомой формы патологии. Среди последних также выделяют рецессивные (болеют только мужчины) и доминантные (поражают лиц обоих полов) разновидности. Усредненное значение встречаемости пигментного ретинита составляет порядка 1:5000, существуют формы заболевания как с большей, так и с меньшей частотой. По данным медицинской статистики, носителями генетических дефектов (включая бессимптомное носительство) являются не менее 100-120 миллионов человек.
Причины и классификация пигментного ретинита
Этиология пигментного ретинита очень разнообразна по причине генетической гетерогенности этого заболевания. В настоящее время выделяют огромное количество форм данного состояния, обусловленных мутациями различных генов. В общих чертах причиной пигментного ретинита являются нарушения метаболизма в фоторецепторах и пигментном эпителии, что приводит к накоплению в сетчатке токсичных побочных веществ. Современная классификация заболевания основывается на механизме наследственной передачи генетического нарушения, по этому критерию определяют четыре основные группы пигментного ретинита.
Пигментный ретинит с аутосомно-доминантным наследованием – является самым распространенным вариантом патологии, по различным данным составляет от 70 до 90% всех случаев заболевания. Причиной этой формы абиотрофии сетчатки могут выступать мутации генов RP1 (8 хромосома), PRPH2 (6 хромосома), RP9 и IMPDH1 (7 хромосома) и целого ряда других. Все эти гены кодируют белки, принимающие участие в метаболизме пигментного эпителия, поэтому нарушения в их структуре ведут к разнообразным расстройствам зрения. Аутосомно-доминантный пигментный ретинит, несмотря на большую встречаемость, характеризуется менее выраженными нарушениями, медленным прогрессированием, что при адекватной поддерживающей терапии в ряде случаев позволяет значительно отсрочить или даже избежать развития слепоты.
Пигментный ретинит с аутосомно-рецессивным механизмом наследования – более редкая форма заболевания. Характеризуется довольно ранним началом, быстрым течением и нередко приводит к полной слепоте в молодом или детском возрасте. Его причина заключается в мутациях генов CRB1 (1 хромосома) и SPATA7 (14 хромосома), также имеются более редкие формы патологии, обусловленные дефектами других генов. Патогенез при аутосомно-рецессивных формах пигментного ретинита изучен недостаточно, предполагается участие белков, кодируемых вышеуказанными генами, в процессах эмбрионального развития органов зрения.
Пигментный ретинит с Х-сцепленным характером наследования – также представляет собой тяжелую форму этого генетического заболевания. Наиболее часто он обусловлен дефектами генов RP2 и RPGR с рецессивным характером наследственной передачи. По этой причине пигментный ретинит такого типа поражает только мальчиков, не имеющих гомологичной Х-хромосомы. Эти гены кодируют белки-ферменты, принимающие активное участие в метаболизме сетчатой оболочки глаза, поэтому их дефект приводит к нарушениям, клинически выражающихся в пигментном ретините.
Пигментный ретинит, обусловленный мутациями митохондриальной ДНК – представляет собой редчайший вариант этого заболевания. Он наследуется только по материнской линии и передается от матери потомству. Врачам-генетикам пока не удалось выявить участки митохондриальной ДНК, которые подвергаются мутации при этой форме патологии.
Существуют также другие типы классификаций этого состояния – по клиническому течению, наличию или отсутствию сопутствующих пороков развития, возрасту наступления патологии (врожденный, ювенильный) и ряду других критериев. В настоящее время единой общепринятой классификации этого состояния нет, однако разделение всех форм заболевания по механизму их наследования считается наиболее удобным и понятным, охватывающим большинство клинических и генетических разновидностей пигментного ретинита.
Симптомы пигментного ретинита
Развитие пигментного ретинита может начинаться в любом возрасте – рецессивные и сцепленные с полом формы заболевания чаще всего возникают еще в раннем детстве, тогда как некоторые аутосомно-доминантные разновидности могут проявлять себя во взрослом и даже пожилом возрасте. Как правило, одним из первых симптомов является снижение темновой адаптации и гемералопия, которая может оставаться единственным проявлением патологии на протяжении нескольких недель (быстропрогрессирующие формы) или лет. При дальнейшем течении пигментного ретинита развивается слепота в ночное время (никталопия) при нормальном уровне дневного зрения. Причиной этих проявлений становится преимущественная дегенерация палочек, отвечающих за световосприятие в условиях пониженной освещенности.
В дальнейшем пигментный ретинит характеризуется сужением поля зрения и выпадения его периферических участков (периферическая скотома). Это также является продолжением разрушения палочек, которые располагаются в основном по краям сетчатки. В тяжелых случаях развивается «туннельное» зрение, его острота значительно падает, больные пигментным ретинитом становятся инвалидами. Дегенеративные изменения затрагивают и сосуды глаза, что ведет к разрушению колбочек, помутнению хрусталика и стекловидного тела, истончению склер. Совокупность этих процессов приводит к полной слепоте больного. Однако далеко не каждая форма пигментного ретинита характеризуется таким исходом – многие аутосомно-доминантные разновидности заболевания длительное время проявляются только гемералопией и незначительным сужением поля зрения.
Диагностика пигментного ретинита
Для выявления пигментного ретинита используют осмотр глазного дна, электроретинографию, электроокулографию и другие офтальмологические исследования, изучение наследственного анамнеза больного, молекулярно-генетические анализы. При жалобах пациента на снижение зрения в вечерние часы необходимо производить полноценный офтальмологический осмотр. На глазном дне могут выявляться отдельные точки (костные пятна), расположенные по периферии сетчатки – они представляют собой отложения жироподобного пигмента. По мере прогрессирования пигментного ретинита их становится все больше, они начинают образовываться ближе к желтому пятну. При выраженной клинической картине заболевания на глазном дне также определяется сужение артериол, атрофия капилляров, а в дальнейшем – восковидная атрофия диска зрительного нерва.
Измерение ширины полей зрения при пигментном ретините обнаруживает их концентрическое сужение различной (в зависимости от стадии заболевания) степени выраженности. Характерным проявлением этой патологии также является снижение чувствительности синего цвета вплоть до тританопии, что определяется при помощи таблиц Рабкина. Картина электроретинографии при пигментном ретините зависит от стадии патологии – начиная от снижения всех волн и заканчивая нерегистрируемой ЭРГ при полной слепоте. Целью проведения электроокулографии является вычисление коэффициента Ардена, который в норме составляет не менее 180%. При пигментном ретините его значение может снижаться до 100% и даже ниже.
Молекулярно-генетические исследования необходимы для окончательного подтверждения диагноза пигментного ретинита, кроме того, эти данные могут быть полезными при определении прогноза заболевания. В настоящее время в лабораториях доступны методы генетической диагностики наиболее распространенных форм патологии, обусловленных мутациями генов RP1, RP2, RPO, CRB1, SPATA7, RPGR и ряда других. Эти исследования охватывают примерно70-80% всех случаев пигментного ретинита, но в отношении многочисленных более редких форм генетические методы диагностики не разработаны. Как правило, диагностическая техника в этом случае сводится к прямому или автоматическому секвенированию последовательности вышеуказанных генов.
Лечение и прогноз пигментного ретинита
В настоящий момент специфические методы лечения пигментного ретинита находятся в стадии разработки и клинических испытаний. Имеются перспективные результаты применения генной терапии, стволовых клеток и других медицинских методик. В клинической практике используют только поддерживающее лечение, направленное на замедление прогрессирования проявлений пигментного ретинита. С этой целью применяют препараты витамина А, средства, улучшающую трофику сетчатки и других структур органов зрения. В некоторых странах разработаны протезы сетчатки, их имплантация положительно влияет на зрительную функцию больных пигментных ретинитом. Однако во многих случаях, особенно при аутосомно-рецессивных и сцепленных с полом формах заболевания, несмотря на все терапевтические мероприятия, развивается необратимая слепота.
Прогноз пигментного ретинита считается в целом неблагоприятным, поскольку заболевание неуклонно прогрессирует, приводя в конечном итоге к полной слепоте. У различных форм этого состояния отличается только скорость нарастания симптомов – она выше у аутосомно-рецессивных разновидностей и значительно ниже при доминантных типах патологии. Поддерживающее лечение способно отсрочить наступление слепоты в среднем на 5-10 лет, но никаких других лечебных мероприятий в клинической практике относительно пигментного ретинита на сегодняшний день не существует. Профилактика возможна в качестве медико-генетического консультирования родителей, входящих в группы риска (больные пигментным ретинитом или его наличие у близких родственников). Также рекомендуется использование солнцезащитных очков, которые, по некоторым данным, замедляют прогрессирование симптомов заболевания.
Опухолеподобные заболевания и гамартомы сетчатки в практике офтальмолога
Журнал: Вестник офтальмологии. 2020;136(4): 367‑372
В статье представлен подробный обзор офтальмоскопической картины, а также данных оптической когерентной томографии сетчатки (ОКТ) и аутофлюоресценции глазного дна при таких редко встречающихся патологических процессах на глазном дне как макулопатия «torpedo», миелиновые волокна сетчатки, астроцитарная гамартома сетчатки и кавернозная гемангиома сетчатки.
Опухолеподобными принято называть те заболевания, течение которых схоже с течением доброкачественных опухолей. К данной группе можно отнести и некоторые редкие врожденные состояния, симптоматика которых может проявиться не сразу.
Гамартома — врожденное узловое доброкачественное опухолевидное образование, представляющее собой тканевую аномалию развития, состоящую из тех же тканевых компонентов, что и орган, в котором она расположена. При этом гамартома отличается аномальным строением и степенью дифференцировки тканей.
С врожденными заболеваниями сетчатки в первую очередь сталкиваются детские офтальмологи. Однако в редких случаях, если врожденная патология не приводит к появлению зрительных нарушений, с ней приходится впервые сталкиваться и взрослым офтальмологам, что нередко требует проведения дифференциальной диагностики с другими новообразованиями глазного дна.
Одним из таких состояний, не приводящих к нарушению зрительных функций, является макулопатия «torpedo» — врожденная аномалия ретинального пигментного эпителия (РПЭ) и наружных слоев сетчатки [1]. Впервые эта патология описана R. Roseman и J. Gass (1992) как гипопигментированный невус макулярной области [2]. В дальнейшем использовали различные термины: солитарный гипопигментированный невус, солитарный амеланотический невус, парамакулярная колобома и солитарный гипопигментированный меланоз [3].
Офтальмоскопически эта аномалия РПЭ представляет собой плоский беспигментный очаг овальной формы с четкими границами, расположенный в темпоральной части макулярной зоны (в редких случаях медиальный край может располагаться субфовеолярно). Край очага, обращенный к центральной ямке сетчатки (fovea centralis), может быть заостренным и гиперпигментированным [2—5].
Зрительные функции, как правило, не страдают. Однако в ряде случаев выявляют амблиопию со снижением максимальной остроты зрения до 0,4—0,8 [2, 4, 6] и/или относительную скотому с назальной стороны в соответствии с локализацией очага при сохранении нормальной светочувствительности (по данным микропериметрии) [4, 7, 8].
Среди теорий патогенеза данного состояния наиболее вероятным, с учетом данных оптической когерентной томографии (ОКТ), является предположение о поражении РПЭ, развивающемся во время закрытия швов сетчатки [9]. Существует также теория об эмбриогенетических изменениях в хориоидее макулярной локализации [10].
На основании данных ОКТ E. Wong и соавторы описали 2 томографических типа этого заболевания: незначительное разрушение наружных слоев сетчатки в отсутствие кавитации наружных слоев сетчатки (тип 1) и повреждение и кавитация наружных слоев сетчатки с/или без дегенерации внутренних слоев хориоидеи (тип 2) [8]. Позднее K. Tripathy и соавторы выделили тип 3, который характеризуется западением внутренней поверхности сетчатки и РПЭ, дезорганизацией РПЭ, истончением сетчатки и интраретинальными гипорефлективными пространствами без субретинальной щели [11].
Картина очага в свете коротковолновой аутофлюоресценции (К-АФ) варьирует от изоаутофлюоресценции с точечными участками гипераутофлюоресценции в заостренном крае очага, обращенном к макуле, до гипоаутофлюоресценции с ободком гипераутофлюоресценции. При исследовании аутофлюоресценции в ближнем инфракрасном диапазоне (ИК-АФ) макулопатия «torpedo» представляет собой зону гипоаутофлюоресценции, обусловленной, по-видимому, дефицитом отложения меланина в пораженном РПЭ [5, 7, 12].
При наблюдении в динамике увеличение размеров патологического очага не зафиксировано [6, 7], однако описаны единичные случаи развития субретинальной неоваскулярной мембраны на фоне макулопатии «torpedo» в сочетании с наличием «сателлитных» очагов на глазном дне [13—15].
Миелиновые волокна сетчатки (МВС) — практически непроминирующий беспигментный очаг на глазном дне — выявляют у 0,3—0,6% офтальмологических пациентов и в 0,9—1% случаев при аутопсии [16, 17].
Впервые миелиновые волокна в сочетании с миопией описал F. Berg (1914). Появление миелиновых волокон связывают с продолжением миелинизации за пределы решетчатой пластинки [18], что может быть связано с гетеротопией олигодендроцитов или глиальных клеток в слой нервных волокон сетчатки [19, 20] или распространением миелина в сетчатку через врожденный дефект в решетчатой пластинке [17, 21]. Подтверждением этому может служить встречающееся сочетание миелиновых волокон с ямкой диска зрительного нерва (ДЗН) [22].
Известны наследуемые формы аномалии с аутосомно-рецессивным и аутосомно-доминантным типами наследования. В 17—20% случаев эта аномалия двусторонняя [17, 23]. Миелиновые волокна могут сочетаться с гиперметропией [20], миопией, амблиопией, косоглазием, нистагмом, витреомакулярным тракционным синдромом [21, 23—25], а также с системными наследственными заболеваниями, такими как нейрофиброматоз, синдром Дауна, синдром Горлина [17, 24].
В литературе описаны случаи развития миелиновых волокон у пациентов, которым ранее выполнена фоторегистрация глазного дна. Так, G. Baarsma описал развитие миелиновых волокон после тупой травмы глаза у пациента, которому за 7 лет до данного события выполнена фоторегистрация глазного дна при обследовании по поводу сахарного диабета [18]. R. Duval и соавторы представили случаи появления двусторонних миелиновых волокон у пациентов с друзами ДЗН [17]. Отмечено также прогрессирование данного состояния в процессе наблюдения [26, 27].
Офтальмоскопически МВС проявляется белыми очагами, расходящимися от ДЗН в виде «языков пламени» с радиальной исчерченностью, частично прикрывающими ретинальные сосуды [23, 25, 28], они могут встречаться и на удалении от ДЗН, что вызывает наибольшие сложности в дифференциальной диагностике с беспигментными внутриглазными новообразованиями [28], а при локализации МВС по краю ДЗН — с его друзами [29].
Зрительные функции обычно не страдают, но при большом распространении миелинизации на глазном дне может быть выявлена относительная скотома и/или отмечено снижение зрения [23, 30].
При ОКТ миелиновые волокна выглядят как высокорефлективные очаги на уровне слоя нервных волокон сетчатки (СНВС) при сохранной ее толщине [25, 28, 30]. При этом возможно отсутствие линии сочленения фоторецептров в макулярной зоне даже при экстрамакулярном расположении миелиновых волокон [19].
При проведении флюоресцентной ангиографии МВС блокируют флюоресценцию [25], а также аутофлюоресценцию, что связано с блокированием эндогенной флюоресценции от подлежащего липофусцина [25, 28].
Как правило, МВС остаются стабильными в течение всей жизни пациента. Однако в литературе описаны случаи регресса данного состояния после окклюзии центральной артерии сетчатки [16], при некомпенсированной глаукоме за счет антероградной дегенерации аксонов [31, 32] и на фоне постлучевой ретино- и нейропатии после брахитерапии меланомы хориоидеи как результат потери олигодендроцитов [33].
Описаны осложнения миелиновых волокон: телеангиоэктазии, окклюзии ветвей ретинальных артерий и вен, неоваскуляризация и кровоизлияния в стекловидное тело, что связывают с ишимизацией глубже расположенных слоев сетчатки как исходом сдавления их утолщенным СНВС [34, 35].
Астроцитарная гамартома сетчатки (АС) — еще одно патологическое состояние, проявляющееся утолщением внутренних слоев сетчатки. Это доброкачественная глиальная опухоль, развивающаяся из слоя нервных волокон сетчатки, которую чаще выявляют случайно у молодых пациентов. Наряду с этим описаны случаи выявления АС у лиц старшей возрастной группы [36].
Чаще встречаются синдром-ассоциированные случаи АС, спорадические случаи составляют 29% [37]. АС может сочетаться с пигментным ретинитом, нейрофиброматозом или миелиновыми волокнами [37, 38], но наиболее часто она является одним из проявлений туберозного склероза [37—39].
Описаны две формы этого образования — некальцифицированная и кальцифицированная [39—41], возможен и комбинированный вариант [39].
Некальфицированные АС встречаются преимущественно при туберозном склерозе, возможно билатеральное и мультифокальное поражение [42]. Некальфицированная АС представляет собой единичный относительно плоский полупрозрачный светло-серый очаг округлой или овальной формы, размерами около 0,5 диаметров ДЗН, расположенный в слое нервных волокон сетчатки. Вокруг очага может быть выявлен слабый круговой световой рефлекс [41].
Офтальмоскопически кальцифицированная астроцитома представляет собой отграниченный узел, чаще всего локализованный в центральных отделах глазного дна, белого или желтовато-белого цвета, который при наличии кист на поверхности может приобретать вид «тутовой ягоды» [39, 43], возможны точечные зоны кальцификации интенсивно белого цвета [43].
На ОКТ некальцифицированная АС проявляется значительным утолщением СНВС с сохранением подлежащих слоев сетчатки [42, 44]. При ОКТ в режиме ангиографии (ОКТ-ангиография) в ряде случаев удается выявить наличие центрального питающего сосуда [44].
Кальцифицированная АС проявляется утолщением внутренних слоев сетчатки с дистальным затенением и витреоретинальной тракцией [36, 45]. ОКТ-ангиография позволяет выявлять блокирование сигнала от глубоких структур с уменьшением плотности поверхностных ретинальных сосудов [45].
F. Pichi и соавторы выделили 4 типа ОКТ изменений АС на уровне слоя нервных волокон сетчатки [46]:
Тип 1 — плоский, умеренно гиперрефлективный очаг без признаков витрео-ретинальной тракции, структуры подлежащей нейросенсорной сетчатки и РПЭ сохранены.
Тип 2 — очаг умеренной толщины (до 500 мкм) с признаками витрео-ретинальной тракции на его поверхности и гиперрефлективностью передней поверхности.
Тип 3 — грибовидный очаг с элевацией более 500 мкм и оптическими пустотами типа «проеденными молью», что соответствует кальцификации внутри очага и феноменом дистальной тени за очагом.
Тип 4 — очаг куполообразной формы с элевацией более 500 мкм с оптически пустыми одиночными полостями и гиперрефлективной передней поверхностью.
При проведении ФАГ характерно блокирование флюоресценции в ранние фазы и гиперфлюоресценция в поздние, что более показательно в кальцифицированных АС. В ряде случаев возможно выявление капиллярной сети на поверхности опухоли [41].
При исследовании К-АФ некальцифицированные АС проявляются ослаблением фоновой аутофлюоресценции, в то время как кальцифицированные, напротив — яркой гипераутофлюоресценцией [41].
Течение АС, как правило, бессимптомное. Снижение зрения возможно при развитии вторичной экссудативной отслойки сетчатки, в том числе изолированно в макулярной зоне, гемофтальма или неоваскулярной глаукомы [38, 39, 47]. АС может также осложняться витриитом с появлением отсевов в стекловидном теле [48].
Описано сочетание астроцитарной гамартомы сетчатки с ее миелиновыми волокнами [49].
Кавернозная гемангиома сетчатки (КГС) — редко встречающаяся гамартома, которую выявляют преимущественно в молодом возрасте, может сочетаться с кавернозными гемангиомами кожи и центральной нервной системы [50—52]. Офтальмоскопически КГС характеризуется наличием гроздевидных кистоподобных выпячиваний, которые представляют собой аномально расширенные сосуды, заполненные темно-красной венозной кровью и окруженные желто-белыми фиброзными изменениями [50, 51, 53, 54]. Течение КГС, как правило, бессимптомное [55]. Снижение зрительных функций выявляют при локализации образования непосредственно в фовеолярной зоне [55] или в случае возникновения осложнений [52, 54, 55]. Описан случай сочетания кавернозной гемангиомы сетчатки с колбочковой дистрофией [53]. В основном встречаются спорадические случаи, однако описаны и семейные формы с аутосомно-доминантным типом наследования, для которых характерно билатеральное поражение. При монолатеральном поражении чаще страдает правый глаз [55].
По данным морфологических исследований, КГС развивается во внутренних слоях сетчатки, постепенно в процесс вовлекаются все ее слои [55]. КГС характеризуется формированием интраретинальных полостей в сочетании с гиперрефлективными изменениями на ОКТ. ОКТ позволяет визуализировать интраретинально расположенные, четко-очерченные гроздевидные каверны, прикрытые преретинальной тканью [56, 57], а ОКТ-ангиография выявляет резкое расширение ретинальных сосудов с локальными изменениями в виде узлов и «гроздей винограда» [51, 57].
ФАГ в ранней фазе у таких больных подтверждает наличие микроаневризм, представленных зонами гипофлюоресценции и замедленным заполнением извитых и расширенных ретинальных сосудов в зоне КГС в средней и поздней венозных фазах. В фазе рециркуляции сосуды опухоли заполняются красителем, при этом для каверн характерен «уровень» Флуоресцеина натрия и крови [51, 53, 54, 56, 58].
Для КГС характерны рецидивирующие гемофтальм и гифема [54, 56, 58, 59]. Гемофтальм возникает в результате формирования эпиретинальной мембраны, прилежащей к сосудистым полостям и образующей мосты между ними. Рецидивирующая гифема может осложняться вторичной глаукомой [60], а в детском возрасте — стать причиной амблиопии [50, 52, 60].
Офтальмоскопическая картина перечисленных образований сетчатки редко, но достаточно подробно описана в «классической» офтальмологической литературе. Описаны и осложнения, которые могут возникать при этих, казалось бы, безобидных образованиях. Однако характер изменений в слоях сетчатки до появления оптической когерентной томографии оставался неизвестным. Понимание патологических изменений, которые возникают в сетчатке при этих образованиях и выявление их с помощью оптической когерентной томографии, возможно, станут базой для разработки методов предупреждения этих осложнений.
Читайте также:
