Результаты лечения инфицированного панкреонекроза. Исходы
Добавил пользователь Алексей Ф. Обновлено: 25.01.2026
1 ГОУ ВПО «Пермский государственный медицинский университет им. акад. Е.А. Вагнера» Минздрава России»
Представлен опыт лечения 148 пациентов с острым панкреатитом. Мужчин было 79 (53,4 %), женщин – 69 (46,6 %). Возраст больных колебался от 16 до 90 лет, в среднем составил 46,9±15,2 лет. Изменения в поджелудочной железе до и после лечения оценивали по результатам КТ с контрастированием. В результате исследований у 57 (38,5 %) диагностирован легкий острый панкреатит, у 42 (28,4 %) – асептический панкреанекроз, у 49 (33,1 %) – инфицированный (ИП). Компьютерная томография с контрастированием дает косвенные признаки для дифференциальной диагностики асептического и инфицированного панкреонекроза – обширные скопления жидкости вне поджелудочной железы плотностью 15–20 ед. Из 91 пациента с панкреонекрозом 28 (30,7 %) удалось вылечить консервативно, остальные 63 были оперированы по поводу инфицированного панкреанекроза в разные сроки с момента заболевания, а 23 из них – два и более раз. Послеоперационная летальность составила 16 (25,4 %) человек, 14 из них были оперированы впервые две недели от начала заболевания, а еще двое – на 19 и 21 сутки. При статистическом анализе установлено, что летальность после хирургических вмешательств по поводу ИП, выполненных в первые 7–14 дней с момента заболевания значимо выше, чем после операций в более поздние сроки (точный критерий Фишера, р=0,002). В течение года после операций проводили динамическое наблюдение. У 48 пациентов развился хронический панкреатит без расширения протоковой системы, не потребовавший дальнейших оперативных вмешательств. У 16 пациентов (17,6 %) исходом панкреонекроза было формирование постнекротической кисты, у 7 (7,7 %) – панкреатических свищей.
1. Андреев А.В. Лечение инфицированного панкреанекроза с помощью миниинвазивных вмешательств / А. В. Андреев, В. Г. Ившин, В. Р. Гольцов // Анналы хирургической гепатологии. – 2015. – № 3. – С. 110-116.
2. Гнойно-некротический панкреатит: эволюция взглядов на тактику лечения / В.Р. Гольцов, В. Е. Савелло, А.М. Бакунов и соавт. //Анналы хирургической гепатологии. – 2015. – № 3. – С.75-83.
4. Конфигурация некроза поджелудочной железы и дифференцированное лечение острого панкреатита / Т. Г. Дюжева, Е. В. Джус, А. В. Шефер и соавт. // Анналы хирургической гепатологии. – 2013. – № 1. – С.92-102.
5. Besselink MG, Verwer TJ, Schoenmaeckers EJ. et al. Timing of surgical intervention in necrotizing pancreatitis //Arch Surg. – 2007. – V.142. – P.1194-1201.
6. Cinquepalmi L., Boni L., Dionigi G. et al. Long-term results and quality of life of patients undergoing sequential surgical treatment for severe acute pancreatitis complicated by infected pancreatic necrosis // Surg Infect (Larchmt). – 2006. – № 7. Suppl 2. – S. 113-116.
7. Hartwig W, Werner J, Uhl W. et al. Management of infection in acute pancreatitis // J Hepatobiliary Pancreat Surg. – 2002. – № 9. – Р. 423-428.
8. Nilesh Doctor, Sujith Philip, Vidhyachandra Gandhi, Maharra Hussain, Savio G Barreto. Analysis of the delayed approach to the management of infected pancreatic necrosis // World J Gastroenterol. – 2011. – V.17 (№ 3). – Р. 366-371.
9. Uhl W, Warshaw A, Imrie C. Et al. IAP Guidelines for the surgical management of acute pancreatits//Pancreatology. – 2002. – № 2. – Р.565-573.
10. Wig J.D., Mettu SR., Jindal R. et al. Closed lesser sac lavage in the management of pancreatic necrosis // J Gastroemterol Hepatol. – 2004. – V.19 (№ 9). – Р. 1010-1015.
В 10-20 % при остром панкреатите течение заболевания осложняется развитием некроза ткани поджелудочной железы (ПЖ) и парапанкреатической клетчатки [9]. Инфицирование происходит в 40-70 % случаев, причем его частота зависит от распространенности и глубины процесса [7]. Инфицированные формы панкреонекроза (ИП) диагностируют у 24 % больных на 1-й неделе заболевания, у 36 % - на 2-й, у 71 % - на 3-й и у 47 % - больных - на 4-й неделе заболевания [3]. Если большая часть пациентов с асептическим панкреонекрозом (АП) может быть вылечена консервативным способом, то при ИП необходимо удалять секвестры, скопления жидкости, дренировать ретроперитонеальную флегмону. Наиболее спорным вопросом в лечении ИП остается выбор сроков оперативного вмешательства. Известно, что чем позднее выполнена операция, тем меньше летальных исходов [5], в то же время анализируемые сроки колеблются от одной до нескольких недель [3, 5, 8]. Снижению летальных исходов также способствует внедрение мини-инвазивных способов удаления инфицированных секвестров.
Перенесенный панкреонекроз может привести к развитию хронического панкреатита, кист и свищей поджелудочной железы, которые требуют дополнительного лечения, как консервативного, так и хирургического.
Цель
Изучить ближайшие и отдаленные результаты лечения асептического и инфицированного панкреанекроза по данным Пермской краевой клинической больницы (ПККБ) за последние три года.
Материалы и методы
За последние три года во втором хирургическом отделении ПККБ находилось на лечение 148 пациентов с диагнозом острого панкреатита. Мужчин было 79 (53,4 %) человек, женщин - 69 (46,6 %). Возраст колебался от 16 до 90 лет, в среднем составил 46,9±15,2 лет. Больные поступали в различные сроки с момента заболевания (от суток до трех месяцев), большинство - 88 (59,5 %) из других лечебных учреждений Пермского края, где 25 (16,9 %) из них были оперированы один или несколько раз, а остальные получали консервативную терапию, которая оказалась неэффективной.
При поступлении всем был проведен стандартный комплекс исследований, включающий проведение общеклинических анализов, УЗИ. Всем больным с тяжелым панкреатитом и 10 % с легким выполнено КТ брюшной полости с контрастированием. Оценку результатов КТ систематизировали при помощи интегральной шкалы Balthazar-Ranson. Тяжесть состояния пациентов определяли с помощью шкал AHACHE-2, SOFA.
Накопление, обработку и анализ материала производили с использованием стандартных пакетов прикладных компьютерных программ Excel 2003, Statistica for Windows 6.0. Изучаемые количественные признаки приближенно нормального распределения представлены в виде М±σ, где М - среднее арифметическое значение, σ - стандартное отклонение. Для определения значимых различий в рассматриваемых группах использовали стандартные методы непараметрической статистики: определяли односторонний и двусторонний точный критерий Фишера для таблиц 2х2, которые считали значимыми при величине ошибки р ≤ 0,05.
Результаты и их обсуждение
В результате исследований у 57 (38,5 %) пациентов был диагностирован легкий острый панкреатит, у 42 (28,4 %) - АП, у 49 (33,1 %) - ИП.
Среди больных тяжелым острым панкреатитом алкогольный установлен у 45 (49,5 %), билиарный - у 22 (24,2 %), алиментарной этиологии - у 15 (16,5 %), послеоперационный - у 3 (3,3 %). Закрытая травма живота послужила причиной тяжелого панкреатита у двух (2,2 %) пациентов, а у четырех причина не была установлена у 4 (4,4 %).
По данным литературы, желчнокаменная болезнь и злоупотребление алкоголем служат основными причинами развития тяжелого панкреатита [8].
Столь высокий процент пациентов с тяжелым острым панкреатитом и его осложнениями обусловлен госпитализацией в ПККБ больных из лечебных учреждений городов и районов края, у которых раннее проводимое лечение по месту жительства оказалось не эффективным или течение заболевания осложнилось развитием острой почечной недостаточностью, декомпенсацией хронической почечной недостаточности и потребовало проведения диализа.
При КТ с контрастным усилением у всех больных АП было обнаружено фокальное или диффузное увеличение поджелудочной железы (ПЖ), нечеткость ее контуров, чуть реже - очаги задержки жидкости в железе (83 %), инфильтрация парапанкреатической клетчатки (70 %), очаги задержки жидкости вне ПЖ плотностью 5-15 ед. и размерами 2-3 см: единичные (18 %), два и более (30 %). В 31,0 % случаев АП изменения, обнаруженные при КТ, соответствовали стадии C по шкале Balthazar-Ranson, в 50,0 % - D, в 19,0 % - E.
После проведения интенсивного консервативного лечения при повторной КТ через 7-8 суток в 55 % случаев было отмечено улучшение. В 40 %, несмотря на положительную клинико-лабораторную динамику, результаты КТ практически не изменились, а в 5 % - ухудшились. Изменения при КТ, которые соответствовали стадии D и Е по шкале Balthazar-Ranson, в сочетании с клинико-лабораторными признаками инфицирования и нарастанием интоксикации, развитием полиорганной недостаточности послужили показанием к оперативному лечению у 14 пациентов. Инфицирование АП, несмотря на интенсивное лечение, произошло в 33,3 %.
При ИП стадию С по шкале Balthazar-Ranson диагностировали в 14,3 %, D - в 18,4 %, E - в 40,8 %. У всех выявлено фокальное или диффузное увеличение ПЖ, нечеткость ее контуров, инфильтрация парапанкреатической клетчатки с наличием секвестров (84,6 %), очаги задержки жидкости в ПЖ - (66,6 %). Очаги скопления жидкости вне ПЖ плотностью 15-20 ед., размерами 5 см и более встречались чаще: единичные в 22,7 %, два и более - 29,5 %.
Из 91 пациента с панкреонекрозом 28 (30,7 %) удалось вылечить консервативно, остальные 63 были оперированы в разные сроки с момента заболевания, а 23 из них - два и более раз.
В первые 7-14 дней от начала заболевания оперировали 34 пациента (37,4 %), из них 19-ти больным операция была выполнена в центральных районных больницах и 15-ти в ПККБ. Из 19-ти пациентов, оперированных первично в районных больницах, большинству (12) пришлось выполнить репалапаротомию, причем двоим даже повторная операция была произведена в первые две недели с момента начала заболевания. Показаниями к операции послужили: 1) вклиненные конкременты БДС, билиарная гипертензия; 2) ферментативный перитонит; 3) неэффективность консервативной терапии, прогрессирование интоксикации и полиорганной недостаточности (ПОН).
Через 2 недели и более от начала заболевания оперировано 29 больных (31,9 %). Кроме того, 10 пациентам, уже первично оперированным в центральных районных больницах, в эти сроки были выполнены релапаротомии. Показаниями к хирургическому лечению при ИП считали скопление инфицированной жидкости в сальниковой сумке и парапанкреатической клетчатки с наличием свободно лежащих секвестров; флегмону забрюшинного пространства, парапанкреатической и параколической клетчатки; ферментативный перитонит с развитием множества межпетлевых абсцессов; сочетание клиники деструктивного панкреатита с нарастающей механической желтухой.
Большинство хирургов в настоящее время стремятся выполнять хирургические вмешательства при ИП в максимально поздние сроки с момента заболевания, что способствует развитию демаркации между некротизированной и здоровой тканью поджелудочной железы и снижению послеоперационной летальности [1, 2, 4, 8].
Оперативное вмешательство заключалось в широком вскрытии сальниковой сумки, удалении секвестров ПЖ и парапанкреатической клетчатки, по возможности абдоминизации ПЖ, вскрытии и санации гнойных затеков в параколической клетчатке, осумкованных межпетлевых скоплений жидкости или абсцессов. У 20 из 54 оперированных в ПККБ (37 %) проведен сквозной трубчатый дренаж сальниковой сумки для активной ее санации. Операция была дополнена формированием бурсостомы 25 пациентам (46,3 %).
В послеоперационном периоде проводили лечение в отделении реанимации и интенсивной терапии, используя комплекс мероприятий: парентерально-энтеральное питание, антибактериальную терапию, проведение гемотрансфузии по показаниям, введение антисекреторных препаратов, НПВС, механическую очистку гнойного очага за счет проведение проточного промывания через сквозной дренаж и бурсостому.
При повторной КТ через 10-14 после проведенного хирургического лечения ИП дней количество пациентов в стадии В и Е уменьшилось на 10 %, в стадии С и Д - увеличилось на 10 %. В последующем 23 пациентам (36,5 %) были выполнены повторные операции - повторные некрсеквестрэктомии, вскрытие и дренирование забрюшинных флегмон, абсцессов сальниковой сумки, холецистэктомия, наружное дренирование желчевыводящих путей.
Послеоперационная летальность составила 16 (25,4 %) человек, 14 из них были оперированы в первые дни от начала заболевания, а еще двое - на 19 и 21 сутки. При статистическом анализе установлено, что летальность после хирургических вмешательств по поводу ИП, выполненных в первые 7-14 дней с момента заболевания, значимо выше, чем после операций в более поздние сроки (точный критерий Фишера, р=0,002). Причинами летальных исходов послужили абдоминальный сепсис, полиорганная недостаточность, ДВС-синдром.
В течение года после операций по поводу ИП проводили динамическое наблюдение. У 48 пациентов развился хронический панкреатит без расширения протоковой системы, не потребовавший дальнейших оперативных вмешательств. У 16 пациентов (17,6 %) исходом панкреонекроза было формирование постнекротической кисты, у 7 (7,7 %) - панкреатических свищей. Через два-три месяца у троих (3,3 %) наружный панкреатический свищ закрылся и сформировалась киста головки поджелудочной железы. У 1(1,1 %) пациента образовалась ложная аневризма селезеночной артерии, осложнившаяся внутрибрюшным кровотечением, что потребовало выполнения в экстренном порядке дистальной резекции ПЖ со спленэктомией.
По данным Cinquepalmi L. et al. (2006), кисты поджелудочной железы в исходе панкреанекроза формируются в 23 %, а качество жизни, изученное с применением короткого варианта опросника SF-36, было хорошим у 68 % пациентов, перенесших инфицированный панкреонекроз [6]. Развитие наружного панкреатического свища встречается после оперативного лечения панкреонекроза в 18 %-50 %, чаще после «открытых» операций, выполненные в поздние сроки - не ранее, чем через три недели с момента заболевания [10].
Заключение
Компьютерная томография с контрастированием дает косвенные признаки для дифференциальной диагностики асептического и инфицированного панкреонекроза - обширные скопления жидкости вне поджелудочной железы плотностью 15-20 ед. Инфицирование при панкреонекрозе, несмотря на интенсивное консервативное лечение, произошло у трети пациентов. Летальность после оперативного лечения, выполненного в ранние сроки с момента заболевания, была значимо выше, чем после хирургических вмешательств, выполненных в более поздние сроки. Исходом панкреонекроза в 25,3 % было формирование постнекротических (17,6 %) кист и панкреатических свищей (7,7 %).
Рецензенты:
Палатова Л.Ф., д.м.н., профессор, профессор кафедры госпитальной хирургии БГОУ ВПО «Пермский государственный медицинский университет им. ак. Е.А. Вагнера» МЗ РФ, г. Пермь.
Мухамадеев И.С., д.м.н., зав. отделением сосудистой хирургии и диабетической стопы Пермской краевой клинической больницы, г. Пермь.
Результаты лечения инфицированного панкреонекроза. Исходы
Хирургические вмешательства у больных инфицированным панкреонекрозом в пожилом возрасте. Особенности
Ввиду значительной травматичности, высокой летальности при прямых вмешательствах на поджелудочной железе (дистальной резекции, панкреатэктомии, панкреатодуоденальной резекции) применение их у соматически отягощенных больных нецелесообразно. Отдается предпочтение дренирующим вмешательствам, направленных на эвакуацию гноя и удаление секвестров.
Хирурги единодушны во мнении, что реальную опасность несут в себе запоздалые и неадекватные вмешательства. Поэтому уже первое выявление жидкостных структур служит показанием к активным хирургическим действиям.
Во время операции осуществляется ревизия и дренирование сальниковой сумки. Дренажи (один или два) проводятся через отдельные разрезы на брюшной стенке и укладываются по ходу поджелудочной железы. Листки рассеченной желудочно-ободочной связки сшиваются. Брюшная полость ушивается послойно.
Подобное вмешательство применяется преимущественно при гнойных кистах сальниковой сумки и абсцессах.
Гнойное содержимое и детрит удаляются перед дренированием тупым путем. Полость промывается растворами антисептиков. При тонкостенных кистах с несформированными стенками любые типы анастомозов неприемлемы. Гнойное содержимое кисты даже при толстых фибринозных стенках исключает возможность цистоэнтеростомии и заставляет прибегать к наружному дренированию.
При оментобурсостомии производится дигитальное или инструментальное удаление отторгшихся некротических масс тупым путем. Определение границ некротических масс интраоперационно весьма затруднительно.
При диффузной кровоточивости тканей производится тампонирование раны.
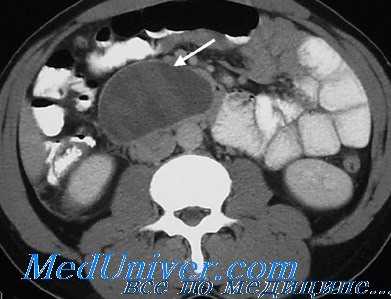
После ревизии сальниковой сумки операция может быть закончена оментопанкреатопексией с фиксацией пряди большого сальника отдельными швами по краям поджелудочной железы. Сальник проводится через рассеченную желудочно-ободочную связку. Цель вмешательства заключается в отграничении поджелудочной железы от забрюшинной клетчатки.
Весьма обнадеживающим оказывается лечение инфицированного панкреонекроза у больных пожилого и старческого возраста пункционными чрескожными вмешательствами, если они выполняются по строгим показаниям. При этом неоперационная санация в некоторых случаях служит альтернативой оперативному лечению.
Для подобного вмешательства необходима специальная подготовка хирургов и организация ультразвуковой хирургической службы, оснащение специальной операционной.
Обязательное условие выполнения пункционных процедур под контролем ультразвука — четкая визуализация жидкостного очага с оценкой его топографии.
Но тонкоигольные пункции (одно- или многократные) эффективны лишь при очагах не более 50 мл. Это оправдано, когда по ходу предполагаемого движения иглы располагается двенадцатиперстная кишка.
Дренирование обеспечивает пролонгированный санационный эффект.
Контроль эффективности пункционного вмешательства осуществляется при помощи динамических ультразвуковых исследований и фистулографий.
Обязательно проводится микробиологическое исследование отделяемого для определения чувствительности флоры к антибактериальным препаратам. При осумкованных жидкостных образованиях может быть установлено несколько дренажей для активного промывания очага. Для создания более адекватного оттока гноя возможно проведение бужирования дренажного канала с установлением трубок большего диаметра.
В настоящее время при распространенном гнойном процессе применяются открытые вмешательства, запланированные реоперации и пункционное чрескожное дренирование, проводимое под контролем ультразвука.
Особенность комплексного хирургического лечения соматически отягощенных пациентов — предварительная декомпрессия флегмоны для эвакуации жидкого гноя. Последний этап лечения — видеоскопическая санация флегмоны с удалением некротических тканей и секвестров. Это позволяет значительно уменьшить травматичность вмешательства.
При отсутствии жидкостных структур на фоне распространенного поражения забрюшинной клетчатки применение пункционных методов лечения невозможно. В данной ситуации альтернативы оперативному лечению нет.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Хирургическое лечение острого панкреатита. Принципы
Хирургическое лечение в стадии токсемии и парапанкреатического инфильтрата у больных пожилого и старческого возраста следует считать тактической ошибкой.
Особое внимание хирургов в настоящее время направлено на ситуации, когда первичная консервативная терапия панкреонекроза не приводит к желаемому результату и сопровождается ухудшением состояния больных. Предлагаемое при этом хирургическое лечение (лапаротомия) у лиц преклонного возраста приводит к летальному исходу в 100% случаев.
Несмотря на успехи в анестезиологии и реаниматологии, активную хирургическую тактику при стерильном панкреонекрозе даже при органосохраняющих вмешательствах у соматически отягощенных больных следует считать неоправданной. Исключение составляют вынужденные операции, показанием к которым служат аррозивные внутрибрюшные, профузные желудочно-кишечные кровотечения и гнойный перитонит.
При верификации инфицированного панкреонекроза и формировании гнойных очагов, гнойного перитонита показания к хирургическому лечению становятся абсолютными, а проводимый комплекс лечебных мероприятий до операции служит подготовкой к хирургическому вмешательству.
К ним следует отнести малоинвазивные вмешательства (пункционные и дренирующие), открытые операции и сочетанное лечение. При пункционных вмешательствах используется местная анестезия и внутривенный наркоз. Для обширных ревизий (лапаротомии, люмботомии) требуется, как правило, эндотрахеальный наркоз.
Доступ и объем хирургического вмешательства определяются распространенностью гнойного процесса и его характером (инфицированная киста, абсцесс, флегмона клетчаточных пространств). Чрезвычайно важно определение топической диагностики очага на основании комплексного обследования.
В настоящее время основными хирургическими доступами при лечении инфицированного панкреонекроза считаются срединная лапаротомия, мини-лапаротомия, внебрюшинный (люмботомия) и двухподреберный доступы.
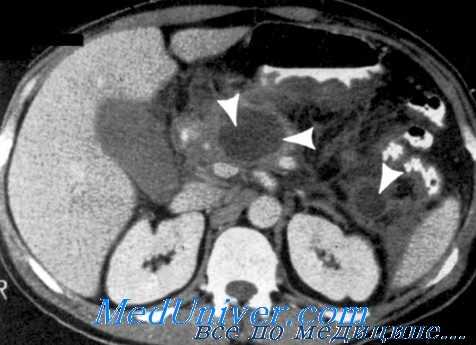
Срединная лапаротомия и трансректальные доступы, как правило, используются в экстренных ситуациях.
Срединная мини-лапаротомия применяется для доступа к сальниковой сумке, через желудочно-ободочную связку и для формирования оментобурсостомы путем подшивания краев lig. gastrocolicum к брюшной стенке.
Оментобурсостомия дает возможность осуществлять динамический контроль состояния поджелудочной железы и парапанкреатической клетчатки. Данный вид оперативного вмешательства целесообразно применять при локализованном поражении парапанкреатическои клетчатки и очагах, расположенных в пределах сальниковой сумки.
При локализованном поражении забрюшинной клетчатки оправданы внебрюшинные доступы: люмботомия и передне-боковой. При массивном инфицировании забрюшинной клетчатки оправдан двухподреберный внутрибрюшинный доступ с мобилизацией ободочной кишки, обеспечивающий широкий доступ к поджелудочной железе и клетчаточным пространствам. При жидкостных очагах различной локализации у больных пожилого и старческого возраста оправдано использование дренирующих манипуляций, проводимых под визуальным ультразвуковым контролем.
При кистах и абсцессах данная методика позволяет достичь весьма обнадеживающих результатов.
В настоящее время пункционное дренирование может быть окончательным вариантом лечения, а при его неэффективности становится первым этапом санации последующей операцией. В этом случае эвакуация жидкого гноя способствует уменьшению интоксикации, после чего операция у соматически отягощенных пациентов производится в более благоприятных клинических условиях.
При чрескожном дренировании предпочтителен внебрюшинный (транслюмбальный) доступ к очагу. После установления дренажа проводится рентгенологическая фистулография для оценки распространенности поражения, выявления кишечных и панкреатических свищей.
Помимо внебрюшинного доступа визуальный контроль позволяет направленно провести пункционное дренирование по оптимальной траектории.
Пункционное дренирование инфицированных очагов не приемлемо при апостематозном поражении поджелудочной железы и забрюшинной клетчатки.
При наличии секвестров в очаге у больных пожилого и старческого возраста может быть использована методика чресфистульной эндоскопической санации. Для обеспечения доступа производится либо бужирование дренажного канала, либо разрез по ходу дренажной трубки.
Окончательный этап этого варианта хирургического лечения — санация с помощью холедохоскопа и лапароскопа. При этом удаляются подвижные секвестры и нежизнеспособные ткани.
Лечебная видеоскопия может быть с успехом использована для динамической санации, ревизии очагов в послеоперационном периоде, в том числе после оментобурсостомии.
Интраоперационная ревизия и выделение инфильтрированных тканей может привести к профузному кровотечению и диффузной кровоточивости. Поэтому приходится манипулировать на ограниченных участках с учетом точной топической диагностики.
Кровотечение при оперативной санации локализованных очагов у больных пожилого и старческого возраста отмечается в 15% случаев, при чрескожном дренировании — лишь в 2%. Помимо этого во время традиционного вмешательства в 4% случаев выявляется ятрогенное повреждение полых органов. При пункционном же варианте лечения это происходит в 3,7% наблюдений.
Чрескожное дренирование внебрюшинным доступом с повреждением толстой кишки не приводит к фатальным последствиям. Проведение дренажа через стенки желудка может быть запланированным ввиду особенностей расположения очага в сальниковой сумке и также не сопровождается тяжелыми осложнениями.
В послеоперационном периоде лечение пациентов с гнойными осложнениями панкреонекроза комплексное, включает направленную антибактериальную терапию, а также консервативные мероприятия, способствующие нормализации функции легких, печени, почек, кишечника. Проводится коррекция водно-электролитных нарушений, нормализация белкового обмена и иммунокоррекция.
После операции по поводу абсцессов почти у каждого десятого пациента преклонного возраста формируются наружные кишечные свищи. Высокие тонкокишечные свищи приводят к трудно- или некорригируемым потерям жидкости и электролитов.
При щадящей санации подобное осложнение диагностируется в 2% наблюдений.
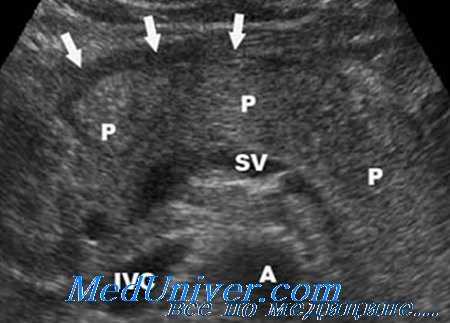
После чрескожного пункционного дренирования локализованного гнойного очага кишечные свищи, как правило, не сопровождаются наружными потерями и обнаруживаются лишь при рентгенологической фистулографии.
У трети больных в послеоперационном периоде образуются наружные панкреатические свищи. При пункционной санации это наблюдается лишь у каждого шестого пациента. В половине наблюдений отмечается поступление панкреатического сока наружу.
Стойкие панкреатические свищи, сформированные после лапаро- и люмботомий, требуют хирургического закрытия при неэффективности консервативного лечения с применением сандостатина (стиламина, октреотида). Подобные свищи не истощающие.
При лечении инфицированного панкреонекроза возможно образование желудочных, желчных и бронхиальных свищей. Желчные, желудочные, толстокишечные свищи (за исключением губовидных) склонны к самостоятельному закрытию.
После вмешательств, проводимых по поводу осумкованных гнойников, возможны аррозивные кровотечения: наружные (в послеоперационную рану) и внутренние (в полость кисты, желудочно-кишечный тракт).
При комплексном пункционном лечении распространенного гнойного поражения забрюшинной клетчатки у больных пожилого и старческого возраста значительно реже выявляются наружные аррозивные кровотечения.
Видеоскопическая санация сопровождается данным осложнением лишь в 10% случаев, при открытых операциях и запланированных реоперациях — почти у каждого второго. Кишечные свищи при указанных вариантах лечения выявляются соответственно в 20, в 32 и 37%. При распространенном поражении забрюшинной клетчатки панкреатические свищи диагностируются у каждого третьего больного, независимо от применяемого варианта хирургического лечения.
При профузном аррозивном кровотечении безальтернативно оперативное лечение. Вмешательство при этом направлено на обнаружение источника кровотечения и гемостаз.
При очаговом процессе прогноз результатов лечения панкреонекроза у лиц преклонного возраста благоприятный.
При субтотальном и тотальном поражении поджелудочной железы после завершения лечения у 38% выживших пациентов отмечаются нарушения углеводного обмена, что требует инсулинотерапии.
Почти у 70% больных после перенесенного панкреонекроза появляются признаки ферментативной недостаточности, подтверждающиеся лабораторно и клинически.
Таким образом, диагностика, лечение и выбор оптимальной хирургической тактики при остром панкреатите у больных пожилого и старческого возраста остаются актуальными задачами. Данное полиэтиологическое заболевание, как правило, сопровождается явлениями полиорганной недостаточности и требует интенсивной коррекции в условиях отделения реанимации. Развитие панкреонекроза на фоне имеющейся сопутствующей соматической патологии осложняется синдромом взаимного отягощения, что существенно отражается на результатах лечения.
Панкреонекроз (некроз поджелудочной железы)

Панкреонекроз (некроз поджелудочной железы) – это деструктивное заболевание поджелудочной железы, которое является серьезным осложнением острого или хронического панкреатита. Код панкреонекроза по МКБ-10 — K86.8.1. Характерная особенность этого грозного недуга – постепенное омертвление тканей поджелудочной железы. Это очень опасный диагноз, представляющий угрозу для жизни человека.
Отмирание этого органа происходит ввиду того, что ткани поджелудочной растворятся ферментами, которые она сама и вырабатывает. Как правило, этот процесс сочетается и с другими патологическими явлениями – воспалительными процессами, инфекцией и др.
Этот недуг является самым тяжелым осложнением панкреатита. Как правило, он поражает молодых людей в трудоспособном возрасте. Согласно медицинской статистике, эта болезнь составляет около 1% от всех фиксированных случаев острого живота. Однако количество случаев этой болезни в последнее время увеличивается. Настораживает и высокий уровень смертности при некрозе поджелудочной железы – он составляет 30-80%. Поэтому крайне важно своевременно диагностировать недуг и начать адекватное лечение незамедлительно.
Патогенез
Основой патогенеза панкреонекроза является сбой в механизме внутренней защиты поджелудочной от влияния панкреатических ферментов, которые ее разрушают. Если человек обильно употребляет спиртное и постоянно переедает, внешняя секреция существенно усиливается, протоки железы растягиваются, и отток панкреатических соков нарушается.
Некроз поджелудочной развивается на фоне панкреатита – воспалительного процесса поджелудочной железы, при котором часто происходит отмирание части или всего органа.
Поджелудочная железа — это важный для нормального функционирования организма орган. Его основные функции – продукция основных ферментов, участвующих в пищеварении, а также регулирование содержания сахара в крови ввиду выработки гормонов инсулина и глюкагона. Соответственно, дисфункция этого органа приводит к серьезным нарушениям общего состояния организма.
Когда человек чувствует голод, соки и ферменты транспортируются через соединительный проток в тонкую кишку, благодаря чему и обеспечивается ферментативная обработка пищи. Панкреатическая жидкость воздействует на кислую среду желудочного сока, нейтрализуя ее. В кишечнике пищеварительные ферменты расщепляют и перерабатывают вещества.
Поджелудочная вырабатывает основные пищеварительные ферменты:
Если у здоровых людей ферменты, которые вырабатывает поджелудочная, проявляют активность непосредственно в пищеварительном тракте, то у больных при поражении протоков железы ферменты влияют уже непосредственно на поджелудочную. На фоне повышения давления внутри протоков развивается отек паренхимы, разрушаются ацинусы поджелудочной железы, и протеолитические ферменты активируются преждевременно. Как следствие, железа «перетравливает» себя же. Вследствие активации липазы происходит некроз жировых клеток, под влиянием эластазы разрушаются сосуды, и активированные ферменты, а также продукты распада оказываются в кровотоке. При этом отмечается токсическое действие на все ткани и органы. Прежде всего, происходит поражение печени, почек, сердца, мозга.
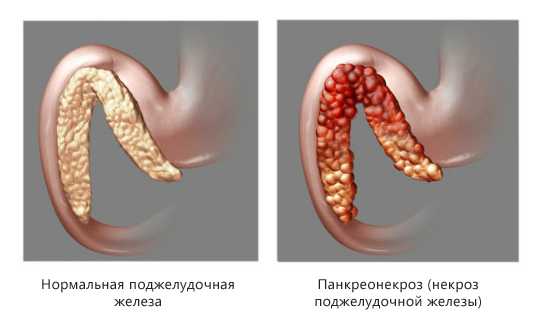
При панкреонекрозе определяется три стадии отмирания тканей:
- Токсемическая– в крови появляются токсины, имеющие бактериальное происхождение, железа активно вырабатывает ферменты.
- Развитие абсцесса – развивается гнойный воспалительный процесс тканей и органов, которые окружают поджелудочную.
- Гнойные изменения в тканях– если развивается гнойный сепсис, требуется немедленное оперативное вмешательство, так как это состояние угрожает жизни.
Классификация
В зависимости от преобладания повреждающих механизмов определяются три формы болезни:
- Жировая– при повышенной активности липазы разрушается жировая ткань поджелудочной. После того, как липаза оказывается за пределами панкреатической капсулы, она действует, провоцируя возникновение мест некроза в листках брюшины, большом и малом сальнике, брыжейке, внутренних органах. Как правило, при жировой форме впоследствии развивается тяжелый химический асептическийперитонит, полиорганная недостаточность.
- Геморрагическая– при повышенной активности эластазы преимущественно развиваются микроциркуляторные нарушения, вследствие чего развивается спазм сосудов поджелудочной. На протяжении короткого времени – нескольких дней, а иногда и часов – токсемия провоцирует парез сосудистой стенки, расширение сосудов, и кровоток в тканях железы замедляется. Это ведет к резкому увеличению вероятности образования тромбов, а позже — ишемического некроза. Изначально сосудистая стенка разрушается толще поджелудочной железы, позже – и в других органах. Следствием всех этих процессов является кровоизлияние в забрюшинную клетчатку и внутренние органы. Основной признак, которым характеризуется геморрагический панкреонекроз – это выпот в брюшную полость с наличием в нем крови. Болезнь развивается стремительно, поэтому в заключениях врачей можно часто увидеть вывод: «Причина смерти — геморрагический панкреонекроз».
- Смешанная– при примерно одинаковой активности эластазы и липазы одинаково выражены признаки жирового некроза и геморрагической имбибиции.
В зависимости от распространенности патологических проявлений определяют две формы:
- локальный(поражена одна область);
- диффузный(поражены две или больше областей).
В зависимости от темпов прогрессирования:
В зависимости от глубины поражения:
В зависимости от протекания болезни:
В зависимости от выраженности проявлений болезни определяют несколько ее степеней:
- Легкая степень – как правило, это отечный или диффузный некроз с необширными очагами.
- Средняя степень— диффузный или локальный с более выраженными очагами.
- Тяжелая степень — диффузный или тотальный с крупными очагами.
- Крайне тяжелая стадия – панкреонекроз сопровождается осложнениями, ведущими к необратимым последствиям и летальному исходу.
Причины
Определяют ряд факторов, провоцирующих некротические процессы в тканях поджелудочной:
- регулярное чрезмерное потребление спиртного;
- постоянное переедание, злоупотребление копченой, жареной и жирной пищей; ;
- камни в желчном пузыре;
- наличие травм брюшной полости и перенесенные хирургические вмешательства в этой области;
- тяжелые инфекционные заболевания.
Под воздействием этих факторов может развиваться дисфункция поджелудочной железы, что приводит к панкреатиту и панкреонекрозу. Но, как правило, панкреонекроз проявляется на фоне эпизодических приемов алкоголя. Исследования подтвердили, что в большинстве случаев панкреонекроз развивался после эпизода потребления спиртного в очень больших количествах.
Симптомы некроза поджелудочной железы
Признаки этого заболевания могут проявиться спустя несколько часов иди дней после того, как отмечалось влияние факторов, провоцирующих болезнь.
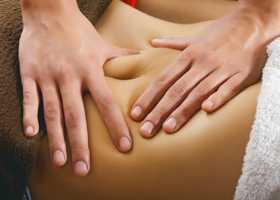
Основной признак – боли, проявляющиеся в левом подреберье. Также болевые ощущения могут отдавать в бока, спину, ощущаться под ложечкой. Боль является постоянной, достаточно интенсивной или умеренной. Она может быть опоясывающей, отдавать в плечо, лопатку, поэтому у человека может создаться впечатление, что развивается сердечный приступ. Боль становится сильнее после того, как больной поест. При этом может проявиться тошнота и многоразовая рвота. Панкреонекроз без боли невозможен.
Также вероятны следующие симптом панкреонекроза:
- покраснение кожи, так как из-за повреждения поджелудочной железы в кровь попадают вещества расширяющие сосуды; – следствие гниения и брожения в кишечнике;
- синюшные или багровые пятна на животе, ягодицах боках – так называемый симптом Грея-Тернера;
- кровотечения желудочно-кишечные – следствие разрушающего влияния ферментов на стенки сосудов;
- повышение температуры;
- напряженность передней брюшной стенки, болезненность при ее пальпации;
- сухость слизистых, кожи, жажда – следствие обезвоживания;
- понижение кровяного давления;
- спутанность сознания, бред.
Болезнь, как правило, начинается остро, и чаще всего первые ее признаки больные связывают с чрезмерным приемом алкоголя и существенным нарушением диеты. Медики свидетельствуют, что большая часть таких пациентов поступают в больницы еще в состоянии опьянения, что подтверждает стремительное развитие патологических изменений в железе. Существует прямая зависимость между выраженностью боли и степенью тяжести некроза. Если деструктивные изменения распространяются на нервные окончания, это ведет к постепенному снижению выраженности боли. Но этот признак в сочетании с интоксикацией является достаточно тревожным в плане прогноза.
После того, как появляется боль, спустя некоторое время больного начинает беспокоить рвота. Ее сложно укротить, и она не приносит облегчения. В рвотных массах присутствуют сгустки крови, желчь. Из-за постоянной рвоты развивается обезвоживание, что ведет к сухости кожи, обложенности языка. Постепенно замедляется диурез. Отмечается метеоризм, задержка стула и газов. Эти симптомы сопровождает лихорадка.
Вследствие колебания показателей глюкозы, токсемии и гиперферментемии поражается головной мозг и развивается энцефалопатия. Если воспалительный процесс прогрессирует, поджелудочная существенно увеличивается в размерах. В брюшной полости формируется инфильтрат. Такое состояние является опасным для жизни пациента.
Анализы и диагностика
При появлении подозрения на развитие некроза необходимо сразу же обратиться к врачу-терапевту. Специалист проводит осмотр, выясняет обстоятельства развития болезни. Он обязательно проводит пальпацию и определяет наличие, характер и место проявления боли. При подозрении на патологию железы больного осматривает эндокринолог. Если на железе обнаруживают опухоли, к процессу лечения подключается и специалист-онколог.
Чтобы установить диагноз, назначают инструментальное и лабораторное обследование.
Лабораторные исследования предусматривают расширенный анализ крови, так как при некрозе отмечаются следующие патологические изменения:
- Повышенный уровень сахара, повышенная зернистость лейкоцитов, нейтрофилов.
- Повышенный показатель СОЭ.
- Повышенный уровень эластаза, трипсина, гематокрита как следствие обезвоженности.
- Увеличение печеночных ферментов вследствие воспалительного процесса.
- На развитие некроза также указывает увеличенный уровень амилазы в моче.
- В процессе лабораторных исследований определяют состояние гормонов, пищеварительных ферментов.
Также в процессе диагностики могут назначать такие исследования:
- Ультразвуковое исследование – с целью определения неравномерности структуры тканей железы, выявления кист, абсцессов, жидкости в брюшной полости, камней в желчевыводящих путях. Также УЗИ дает возможность проанализировать, в каком состоянии протоки.
- Магниторезонансная томография, компьютерная томография – позволяют определить очаги развития болезни, размеры органа, а также узнать, развивается ли воспаление, есть ли отеки, абсцессы, новообразования, деформации.
- Ангиорграфия сосудов железы.
- Диагностическая лапароскопия.
- Пункция.
Окончательный диагноз специалист сможет поставить, только получив данные всех назначенных исследований.
Лечение
Если есть подозрение на развитие некроза, пациента необходимо сразу же госпитализировать. Ведь от своевременности лечения напрямую зависит благоприятность прогноза. Лечение проводят только в стационаре. Его схема зависит от того, насколько орган поражен. Если речь идет о ранней стадии, то хирургической операции часто удается избежать. Ведь такое вмешательство достаточно небезопасно, так как выяснить, какой именно орган пострадал, сложно.
В первые дни лечения практикуется лечебное голодание, далее – строгое соблюдение диеты.
Читайте также:
