Секрекция и адресование белков в клетке
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Открытая библиотека для школьников и студентов. Лекции, конспекты и учебные материалы по всем научным направлениям.
Категории
Биология АДРЕСОВАНИЕ БЕЛКОВ
Синтезированные пробелки (полипептиды) или сформировавшиеся зрелые белки должны быть правильно размещены в клетке или выделены из нее на экспорт. Распределением белков (направлением их по заданному адресу) управляют механизмы адресования белков. Эти механизмы достаточно сложны и для каждого белка имеют свои особенности. При этом, существуют и общие черты в процессах адресования различных белков.
В структуре полипептидной цепи выделяют сигнальный участок, который содержит условный адрес размещения данного белка. Функцию сигнального участка выполняет фрагмент аминокислотной последовательности белка. Учитывая зависимость отаминокислотного состава сигнального участка, белок направляется в какой-либо компартмент клетки. К примеру, неполярные аминокислотные остатки сигнального участка обеспечивают транспорт белка в липидный бислой мембран, полярные - способствуют распределению белка в цитоплазму клетки.
третьей рибосомы и так далее. Количество рибосом в полисоме определяется длиной мРНК, т.к. в связи с большими размерами рибосом минимальное расстояние между ними на мРНК составляет 80 нуклеотидов.
- Многократное использование одной и той же мРНК для параллельной трансляции на нескольких рибосомах. Данный механизм сочетает в себе как повторное использование мРНК, так и параллельную трансля- В образованной 80S рибосоме выделяют два участка (сайта): пептидильный (место, в котором осуществляется образование пептидных связей) - Р-участок и аминоацильный (место присоединения аа-тРНК) - А-участок. В завершение инициации мет-тРНК занимает область Р-участка, А-участок - свободен.
После этого начинается элонгация.
II Элонгация(продолжение трансляции) включает три последовательные фазы.
1) Присоединение к следующему кодону мРНК соответствующей ему аа-тРНК. Белковый фактор элонгации - 1 (ФЭ-1) образует комплекс сГТФ и молекулой аа-тРНК, что обусловливает присоединение аа-тРНК к рибосоме (рис. 9).
Взаимодействие происходит в А-участке рибосомы и обеспечивается энергией ГТФ. Антикодон аа-тРНК комплементарно связывается с кодоном мРНК .
Рис. 9
2) Пептизация с формированием пептида в А-участке и освобождением Р-участка рибосомы от предыдущей аа-тРНК
Аминогруппа новой аа-тРНК (поступившей в А-участок) и карбоксильная группа предыдущей аа-тРНК (находящейся в Р-участке) образуют пептидную связь. Реакция обеспечивается пептидилтрансферазой - ферментом 60S рибосомы, который катализирует процесс образования пептидной связи, а также разрыв сложноэфирной связи между тРНК и аминокислотой Р-участка. При этом, растущий пептид в виде пептидил-тРНК оказывается в А-участке. В Р-участке находится тРНК, освободившаяся от аминокислоты, которая быстро покидает рибосому (рис. 10).
В результате фазы пептизации: Р-участок свободен, но занят А-участок, необходимый для присоединения следующей аа-тРНК. Эта проблема решается с помощью следующей фазы этапа элонгации.
3) Транслокация. При транслокации происходит перемещение рибосомы (но не пептидил-тРНК) на один кодон в направлении 3`-конца мРНК. А-участок рибосомы становится свободным, а в Р-участке теперь находится пептидил-тРНК (осуществляется внутририбосомный переход пептидил-тРНК). Для транслокации необходимы: белковый фактор элонгации - 2 (ФЭ-2)иэнергияГТФ(рис. 11) .
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, освобождение А-участка делает возможным новый цикл элонгации с присоединением следующей молекулы аа-тРНК (аа2-тРНК, рис.12), соответствующей следующему кодону мРНК.
Когда в А-участке рибосомы появляется кодон мРНК, не имеющий смысла (нонсенс или терминирующий кодон), дальнейшее удлинение полипептидной цепи становится невозможным. Элонгация прекращается и наступает терминация
III Терминация. Терминирующий кодон распознается специальными белковыми факторами высвобождения (R-факторы, от англ.: to release - освобождать). Название данных факторов обусловлено тем, что в результате их действия из рибосомы высвобождаются полипептид, тРНК и мРНК. Гидролиз сложноэфирной связи между полипептидом и тРНК осуществляет фермент пептидилтрансфераза. На этапе терминации затрачивается энергия одной фосфатной связи ГТФ(рис. 13).
Существуют механизмы повышения эффективности трансляции.
- Многократная трансляция на рибосоме одной и той же мРНК. Матричный полинуклеотид может повторно использоваться для синтеза полипептидной цепи. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, несколько копий полипептида тиражируются с одной РНК-матрицы, что экономит ресурсы, требующиеся для синтеза мРНК.
- Параллельная трансляция одной мРНК на нескольких рибосомах. Образуется комплекс нескольких рибосом с одной мРНК, который принято называть полисомой. Образования полисомы происходит постепенно. После того, как в ходе трансляции рибосома с образующимся пептидом передвинулась от 5`-конца мРНК на расстояние не менее 80 нуклеотидов, на 5`-конце начинается параллельная трансляция (инициация, элонгация) следующей рибосомой. Теперь уже две рибосомы передвигаются по мРНК и каждая из них синтезирует по молекуле одного и того же полипептида. Затем, по аналогии, начинается трансляция с использованием
© Copyright 2022 - Open Library - открытая библиотека учебной информации | Все материалы сайта доступны по лицензии: Creative Commons Attribution 4.0
Секрекция и адресование белков в клетке
Организация клетки. Внутриклеточный транспорт
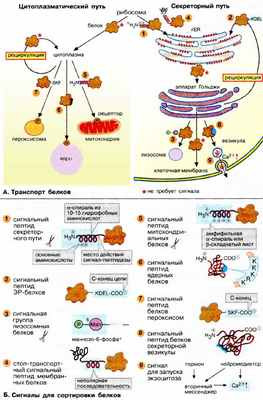
А. Транспорт белков
Биосинтез белков начинается на свободных рибосомах (на схеме вверху). Однако вскоре пути синтезируемых белков расходятся в соответствии с их функцией: белки, несущие на N-конце сигнальный пептид для ЭР ( 1 ), проходят через секреторный путь (на схеме справа), а прочие белки, не имеющие этой сигнальной последовательности, следуют по цитоплазматическому пути (на схеме слева).
Секреторный путь. Рибосомы, синтезирующие белок с сигнальной для ШЭР последовательностью, связаны с мембраной эндоплазматического ретикулума (см. с. 226). Растущая пептидная цепь направляется через мембрану в просвет ШЭР. Последующий путь растущей цепи определяется наличием соответствующего сигнального пептида или сигнального участка .
Белки, имеющие в растущей цепи специальную стоп-сигнальную последовательность ( 4 ), остаются в мембране ШЭР в качестве интегрального мембранного белка. По механизму везикулярного транспорта они могут быть перенесены из ШЭР на другие органеллы (см. с. 226).
Белки, попавшие в просвет ШЭР, транспортируются обычным путем в аппарат Гольджи и далее в плазматическую мембрану. Белки, которые остаются в ШЭР, например ферменты модификации белков, возвращаются из аппарата Гольджи в ШЭР с помощью сигнала возврата ( 2 ). Прочие белки из аппарата Гольджи попадают в лизосомы ( 3 , см. с. 228) или в плазматическую мембрану (в качестве интегральных мембранных белков или продуктов конститутивного экзоцитоза), либо транспортируются секреторными везикулами ( 8 ) в межклеточное пространство ( 9 ; регулируемый экзоцитоз).
Цитоплазматический путь. Белки, не имеющие сигнального пептида для ШЭР, синтезируются в цитоплазме на свободных рибосомах и остаются в этом отделе клетки. Для последующего транспорта в митохондрии ( 5 ), ядро ( 6 ) или пероксисомы ( 7 ) белки должны иметь специальные сигнальные последовательности.
Б. Сигналы для сортировки белков
Сигнальные пептиды — это короткие участки, расположенные на N- и С-концах, реже — в центральной части полипептидной цепи. Эти фрагменты имеют характерные физико-химические свойства, такие, как гидрофобный характер, наличие положительного или отрицательного заряда, более важные в функциональном отношении, чем аминокислотная последовательность. Сигнальные участки представляют собой трехмерные структуры на поверхности белка, составленные из различных фрагментов одной и той же или нескольких пептидных цепей. На схеме показаны некоторые из известных сигнальных последовательностей и сигнальных участков. Последовательности даны с использованием однобуквенного кода для аминокислот (см. с. 66). Например, последовательность KDEL-COO - ( 2 ) определяет сродство белка к мембране ШЭР.
Сигнальные пептиды (участки) — это структурные сигналы, которые могут быть прочитаны клеткой двумя способами. Обычно они узнаются и связываются рецепторами, локализованными в мембранах органелл. Затем рецепторы при участии белков-посредников переносят связанные белки энергозависимым образом через мембраны в соответствующие органеллы, обеспечивая селективность переноса. Кроме того, сигнальные последовательности могут служить местами узнавания для ферментов, которые модифицируют белки, существенно изменяя их свойства и дальнейшую судьбу, в качестве примера можно привести белки лизосом (см. с. 228) или мембранные белки с липидным якорем (см. с. 230).
Сигнальные пептиды, расположенные на N- или С-концах полипептидной цепи, после выполнения своей функции удаляются специфичными гидролазами. На схеме эти ферменты показаны в виде ножниц. При наличии в белке нескольких сигнальных последовательностей они удаляются поочередно. Это имеет место, например, в случае импорта белков в митохондрии и хлоропласты, когда большинству белков приходится последовательно проходить через несколько мембран.
Секрекция и адресование белков в клетке
• В клетке белки должны быть локализованы в сигнальных органеллах и мембранах
• Белки непосредственно поступают из цитозоля в несколько типов органелл
• Эндоплазматический ретикулум (ЭПР) представляет собой исходный компартмент, откуда белки вступают на путь секреции. ЭПР приспособлен к выполнению этой функции
• В некоторые органеллы и в плазматическую мембрану белки поступают по секреторному пути
Способность взаимодействовать с окружающей средой и реагировать на ее изменения имеет критическое значение для выживания и нормального функционирования клетки. В окружающей многоклеточный организм среде находятся питательные вещества, факторы роста, гормоны и другие метаболиты, под действием которых клетка может разделиться, вступить на путь дифференцировки или программированной гибели. Клетка должна чувствовать изменения в составе компонентов окружающей среды и реагировать на них соответствующим образом. В зависимости от своих нужд клетки меняют окружение.
Так, они могут секретировать белки, которые используются для построения или разрушения внеклеточного матрикса; могут передавать сигналы соседним клеткам при прямом контакте; а в многоклеточном организме некоторые клетки (например, эндокринные) секретируют гормоны, которые оказывают дистанционный эффект на другие клетки.
Основными посредниками клетки во взаимодействии с окружающей средой являются секреторные и трансмембранные белки. Эти белки синтезируются каждой клеткой, начиная от простейших бактерий до высокодифференцированных и специализированных клеток млекопитающих. Секреторные белки выходят во внеклеточную среду, а трансмембранные белки остаются в плазматической мембране, причем одна их часть контактирует с внешней средой, а другая остается внутри клетки.

Электронная микрофотография содержимого клетки печени.
Показаны характерные для эукариотической клетки органеллы, содержащие мембрану и обладающие различной плотностью.
Видны ядро, митохондрии, лизосомы, пероксисомы и гранулярный эндоплазматический ретикулум.
Фотография любезно предоставлена Дэниелем С. Френдом.
Необходимость полного или частичного транспорта некоторых белков через плазматическую мембрану создает для клетки проблему их отбора. В клетке белки образуются на рибосомах, в цитоплазме. Поэтому должен существовать механизм селективного отбора и транспорта к плазматической мембране только секреторных и трансмембранных белков. У бактерий селективный отбор при транспорте происходит только на белки, входящие в состав плазматической мембраны и не входящие в нее. В клетках эукариот проблема носит более сложный характер.
В то время, как типичная прокариотическая клетка имеет плазматическую мембрану и не обладает внутриклеточными органеллами, клетки эукариот содержат многочисленные структуры, окруженные мембранами, такие как ядра, митохондрии, хлоропласты (у растений), пероксисомы, эндоплазматический ретикулум (ЭПР), аппарат Гольджи и лизосомы.
Для каждой из этих органелл характерен уникальный набор белков. Таким образом, наряду со способностью выделять секреторные и трансмембранные белки, эукариотическая клетка также должна безошибочно узнавать белки органелл. В типичной клетке органеллы занимают примерно половину общего объема. Это означает, что большая часть белков, синтезирующихся в каждый данный момент времени, должна быть селективно локализована в одной из этих органелл.
Каким образом белки локализуются в органеллах? Обычно для направления белка к специфической органелле клетка использует адресные сигналы, которые представляют собой дискретные последовательности аминокислот в составе его первичной структуры. Характер сигнала определяет органеллу, к которой должен быть направлен белок, и эта органелла имеет аппарат специфического распознавания на белке соответствующего сигнала. Если белок синтезировался без адресного сигнала, то он остается в цитозоле.
Белки некоторых органелл (митохондрий, хлоропластов, ядра и пероксисом) транспортируются из цитозоля после окончания синтеза на рибосомах. Однако для других органелл (ЭПР, аппарат Гольджи, лизосомы и плазматическая мембрана) процесс протекает более сложно. Процесс транспорта белка через эти органеллы вместе с самими органеллами называется секреторный путь. Непосредственно белки не поступают в аппарат Гольджи, лизосомы и плазматическую мембрану. Вместо этого все белки, подлежащие секреции, или предназначенные для этих содержащих мембраны структур вначале проходят через мембрану ЭПР.
Там они приобретают нативную трехмерную структуру, обычно подвергаются ковалентной модификации, и образуют комплексы с другими белками. Затем эти комплексы попадают в аппарат Гольджи, а оттуда или назад, в ЭПР, или далее, в лизосомы и плазматическую мембрану. Перемещение белков между органеллами секреторного пути происходит с участием мелких везикул, которые отпочковываются от мембраны исходной органеллы и сливаются с мембраной органеллы назначения, высвобождая в нее белковое содержимое.
Важнейшая особенность секреторного пути состоит в том, что люмен (внутреннее содержимое) этих органелл по составу напоминает внеклеточное окружение. (Считается, что органеллы возникли в результате инвагинаций плазматической мембраны, специализированной на секреции белка, которые впоследствии превратились в везикулы.) В клетке, секретируемые белки способны принимать нативную структуру, причем это происходит в условиях, близких к тем, в которых они в конце концов должны функционировать.
В отдельных статьях на сайте рассмотрены начальные процессы, которые обеспечивают позиционирование белков на различных органеллах и мембранах внутри клетки. Поскольку почти все белки синтезируются в цитозоле, эти процессы происходят в мембранах органелл, непосредственно импортирующих белки, а именно в мембранах ЭПР, митохондрий, хлоропластов и пероксисом. К числу таких процессов относится узнавание белков, которые, в отличие от других белков цитозоля, должны быть импортированы в органеллу. В дальнейшем эти белки становятся интегральными белками мембраны или транспортируются через нее. Этот процесс известен как транслокация (перенос) белка.
В отдельных статьях на сайте также освещается особая роль, которую играет ЭПР в подготовке белков для экспорта по секреторному пути, и другие функции ЭПР. Вопросы, связанные с транспортом белков по секреторному пути и с их сортировкой в аппарате Гольджи перед адресной доставкой, рассматриваются в отдельных статьях на сайте.
Секреция белков начинается с их адресования и транслокации через мембрану гранулярного эндоплазматического ретикулума.
После формирования нативной структуры и посттрансляционных модификаций белки выходят из ЭПР в везикулах, связывающихся с аппаратом Гольджи.
Большая часть белков переносится из аппарата Гольджи к клеточной поверхности в секреторных везикулах. Органеллы секреторного пути могли возникнуть при интернализации участка плазматической мембраны,
обладающей функцией секреции белка.
В клетках эукариот белки непосредственно не секретируются через плазматическую мембрану,
а транспортируются в люмен ЭПР, который по составу напоминает внешнее окружение клетки.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Биология клетки/Часть 1. Клетка как она есть/9/1
Рибосомы - внутриклеточные органоиды, осуществляющие синтез белков. От синтезируемого в данный момент белка зависит расположение рибосомы в клетке.
"Свободные" рибосомы плавают в цитоплазме, не прикрепляясь к мембранам. Эти рибосомы синтезируют белки, которые работают в цитоплазме или поступают из цитоплазмы в митохондрии, пластиды и ядро. Например, протонная АТФ-синтетаза - белок, работающий в митохондриях; следовательно, рибосома, которая её синтезирует- "свободная". Миозин - двигательный белок, работающий в цитоплазме клетки, также синтезируется "свободными" рибосомами. ДНК-полимераза синтезируется "свободными" рибосомами, т.к. находится в ядре.
"Сидячие" рибосомы прикреплены к мембранам шероховатой эндоплазматической сети (ЭПС). Эти рибосомы синтезируют белки, поступающие в ЭПС. Большинство из таких белков затем поступает в АГ, а оттуда - в лизосомы, на наружную мембрану или во внеклеточную среду (секреция). Например, рецептор SRP - белок, который работает на мембране ЭПС, а следовательно рибосома, синтезирующая его - "сидячая". Белок коллаген выделяется во внешнюю среду; значит, рибосома - "сидячая".
Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР.
Сигнальная (лидерная) последовательность для ЭПР включает обычно 5-10 преимущественно гидрофобных аминокислот и расположена на N-конце белка. В ее удаленной от конца части имеется консенсусная последовательность, узнаваемая специфической протеазой (за счет этого лидерные последовательности удаляются после завершения синтеза белка). Сигнальная последовательность опознаётся специальным комплексом — «опознающей сигнал частицей» (signal-recognition particle, SRP). В состав SRP входит шесть белков и короткая молекула РНК.
Анимация, демонстрирующая процесс котрансляционного транспорта. Общая продолжительность ролика - 2 минуты
Этапы синтеза и транспорта белков в ЭПР:
- Один участок SRP связывает сигнальную последовательность, а другой связывается с рибосомой и блокирует трансляцию. Отдельный домен SRP отвечает за связывание с SRP-рецептором на мембране ЭПР.
Попавший в ЭПР белок остается в этой органелле, если имеет специальную «удерживающую в ЭПР» (ER-retaining) последовательность из четырех аминокислот на С-конце. Некоторые из остающихся в ЭПР белков играют важную роль в сворачивании и посттрансляционной модификации проходящих через ЭПР белков. Так, фермент дисульфид-изомераза катализирует окисление свободных SH-групп цистеина и образование дисульфидных связей, а белок-шаперон BiP препятствует неправильному сворачиванию и аггрегации белков до образования ими четвертичных структур, а также способствует удержанию связанных с ним белков в ЭПР.
Похожий, но более сложный механизм обеспечивает котрансляционное встраивание трансмембранных белков в мембрану ЭПР.
[1] - Видео с описанием транслокации белка в ЭПР. Также описан процесс встраивания в мембрану. Третье издание "Молекулярной биологии клетки" Б. Альбертса и др.
Презентация на тему Топогенез и секреция белков
Слайды и текст этой презентации
ТОПОГЕНЕЗ БЕЛКОВ
СЕКРЕЦИЯ БЕЛКОВ
СПЕЦГЛАВЫ БИОХИМИИ. Лекция 7

1. Секреторный путь транспорта белков. ЭПР
2. Везикулярный транспорт
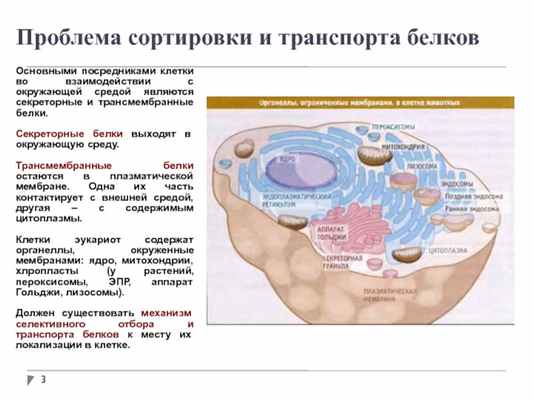
Проблема сортировки и транспорта белков
Основными посредниками клетки во взаимодействии с окружающей средой являются секреторные и трансмембранные белки.
Секреторные белки выходят в окружающую среду.
Трансмембранные белки остаются в плазматической мембране. Одна их часть контактирует с внешней средой, другая – с содержимым цитоплазмы.
Клетки эукариот содержат органеллы, окруженные мембранами: ядро, митохондрии, хлропласты (у растений, пероксисомы, ЭПР, аппарат Гольджи, лизосомы).
Должен существовать механизм селективного отбора и транспорта белков к месту их локализации в клетке.
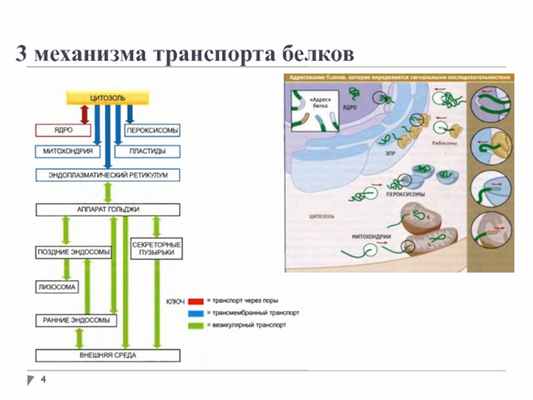
3 механизма транспорта белков

Сигналы таргетинга в различные органеллы
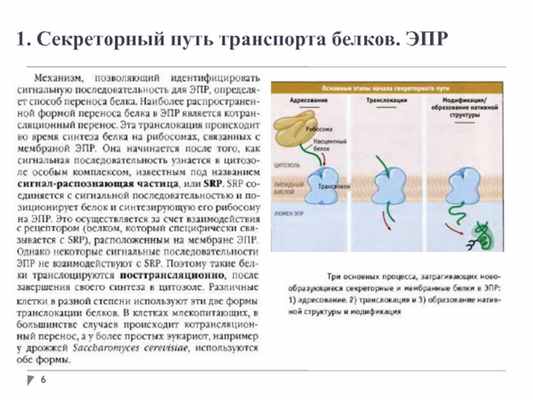
1. Секреторный путь транспорта белков. ЭПР
1. Секреторный путь транспорта белков. ЭПР
Адресование

лизосомные, мембранные и секретируемые белки
Длина 13-36 аминокислот
1. 10-15 гидрофобных аминокислот
2. один или несколько положительно заряженных остатков, обычно между N-концом и гидрофобной последователностью
3. короткая сравнительно полярная последовательность на С-конце, содержащая аминокислоты с короткими боковыми цепями вблизи сайта расщепления
1. Секреторный путь транспорта белков. ЭПР
Адресование

1. Секреторный путь транспорта белков. ЭПР
Адресование
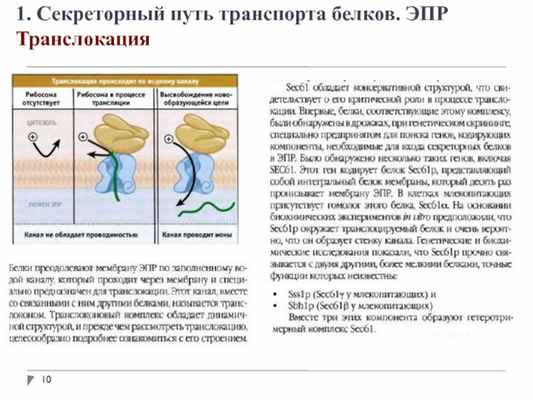
1. Секреторный путь транспорта белков. ЭПР
Транслокация

1. Секреторный путь транспорта белков. ЭПР. Транслокация
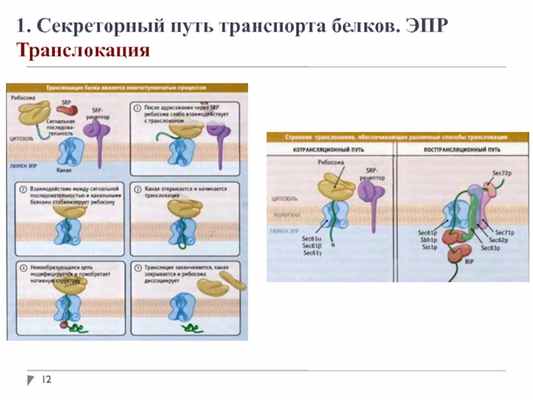
1. Секреторный путь транспорта белков. ЭПР
Транслокация
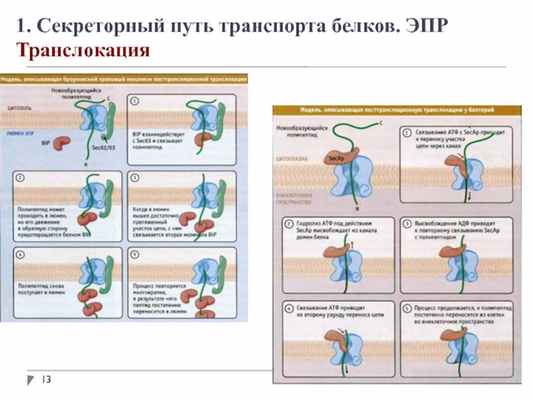
1. Секреторный путь транспорта белков. ЭПР
Транслокация
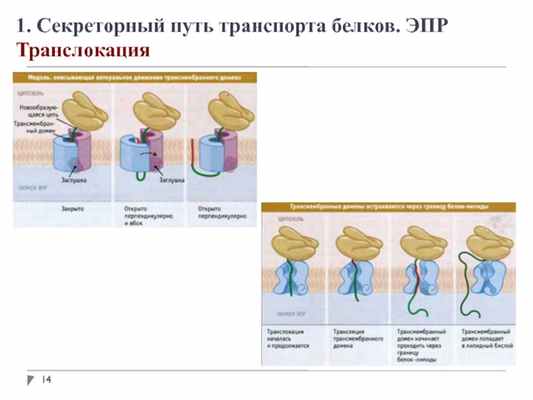
1. Секреторный путь транспорта белков. ЭПР
Транслокация
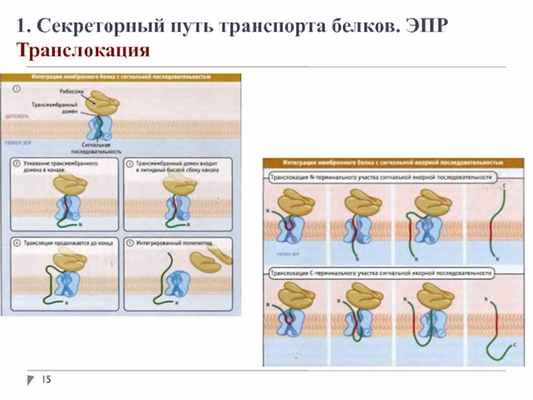
1. Секреторный путь транспорта белков. ЭПР
Транслокация
1. Секреторный путь транспорта белков. ЭПР
Транслокация

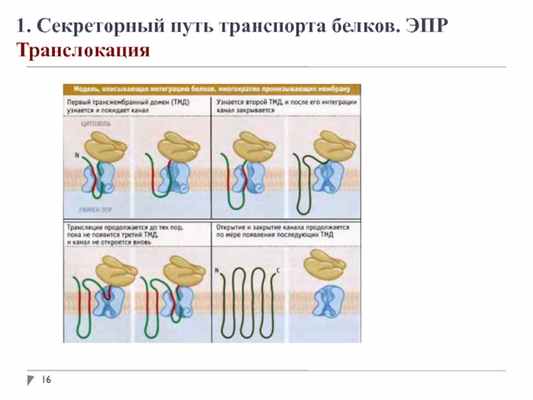
1. Секреторный путь транспорта белков. ЭПР
Модификация

1. Секреторный путь транспорта белков. ЭПР
Модификация
Присоединение фосфолипида гликозилфосфатидилинозитола (ГФИ)

В просвете ЭПР вновь синтезированные белки модифицируются различным образом. После удаления сигнальных последовательностей происходит укладка полипептидных цепей с возможным образованием дисульфидных связей. Многие белки гликозилируются с образованием гликопротеинов.
Во многих гликопротеинах связь с олигосахаридами осуществляется через остатки аспарагина. Такие N-связанные олигосахариды разнообразны.
Сначала синтезируется олигосахаридное ядро из 14 остатков, которое затем переносится от донорной молекулы долихолфосфата на остатки аспарагина в белке. Трансфераза находится на поверхности ЭПР, обращенной внутрь, поэтому не может катализировать гликозилирование белков в цитоплазме.
После переноса через мембрану олигосахариды в разных белках укорачиваются и модифицируются по-разному, но пентасахаридное ядро сохраняется во всех N-олигосахаридах.
Некоторые белки в ЭПР подвергаются О-гликозилированию, однако чаще О-гликозилирование осуществляется в комплексе Гольджи или в цитоплазме (для белков, не попадающих в ЭПР).
Читайте также:
