Симптоматическая терапия миелодиспластического синдрома (МДС) - лечение тромбоцитопении, нейтропении
Добавил пользователь Skiper Обновлено: 28.01.2026
Симптоматическая терапия миелодиспластического синдрома (МДС) - переливание эритроцитов, эритропоэтин
Большинство больных вне зависимости от варианта заболевания и принадлежности к той или иной прогностической группе нуждаются в симптоматической (сопроводительной) терапии. Этот вид лечения направлен на борьбу с осложнениями миелодиспластического синдрома, возникающими на протяжении заболевания.
Проведение гемотрансфузий эритроцитов часто оказывается необходимым мероприятием при выраженной анемии (менее 80 г/л). При многократных переливаниях эритроцитов возникает опасность гемосидероза, что диктует необходимость применения комплексонов железа, например дефероксамина (десферала). Препарат следует назначать, по данным разных авторов, после 20—30 или после 50 гемотрансфузий эритроцитарной массы.
Дефероксамин можно вводить как в дозе 2 г в день в виде 12-часовой подкожной инфузии (с помощью специального портативного дозатора), так и по 1 г в день в виде болюсного подкожного введения. Согласно рекомендациям NCCN, предпочтительным способом введения является подкожная инфузия, проводимая в ночное время. Помимо основного действия дефероксамина, при использовании его у больных миелодиспластическими синдромами описано уменьшение потребности в гемотрансфузиях, а в ряде случаев полное исчезновение необходимости переливания эритроцитов, увеличение числа тромбоцитов и нейтрофилов. Механизм уменьшения выраженности цитопении при терапии этим препаратом на настоящий момент остается неясным.
При хронической кровопотере или дефиците железа, развивающегося на фоне лечения эритропоэтином, наоборот, могут возникать показания к назначению препаратов железа.
Использование эритропоэтина (ЕРО) нередко позволяет нормализовать уровень гемоглобина или уменьшить частоту проведения гемотрансфузий. Применение ЕРО в онкологии, в том числе для лечения больных МДС, началось в конце 80-х годов XX в. К настоящему времени опубликовано большое количество работ, обобщающих результаты применения ЕРО более чем у 1000 больных МДС. G. Verhoef и соавт. приводят следующие данные: ответ на лечение ЕРО составляет 25 % (ни у одного больного не отмечено увеличения числа нейтрофилов, число тромбоцитов возросло в 1 % наблюдений, число бластных клеток повысилось в 0,7 % случаев).
У большинства больных ответ на лечение был получен в течение первых 8 нед, однако описаны случаи достижения эффекта и через 18 нед.
Многофакторный анализ, проведенный Е. Hellstrom-Lindberg, показал, что при лечении ЕРО в монорежиме наибольшее прогностическое значение имеют ФАБ-вариант миелодиспластического синдрома, исходный уровень ЕРО в крови и необходимость в гемотрансфузиях. В таблице продемонстрирована зависимость частоты ответа от выявленных признаков.
Зависимость эффективности лечения эритропоэтином больных миелодиспластическими синдромами от факторов прогноза

Наличие при миелодиспластическом синдроме двух- и трехростковой цитопении послужило основанием для применения комбинаций ростовых факторов. В основе совместного назначения различных цитокинов также лежит идея стимуляции дифференцировки клеток-предшественников на различных этапах их развития. В результате использования комбинации ЕРО с G- или GM-CSF, помимо увеличения числа нейтрофилов, был обнаружен синергизм препаратов при лечении анемии.
Обобщая опыт использования ЕРО с G-CSF или GM-CSF, G. Verhoef и соавт. указывают на увеличение общего ответа со стороны красного ростка до 42—46 %, увеличение числа нейтрофилов в 79— 87% случаев, тромбоцитов — в 1—12%, бластных клеток в костном мозге — в 8 %.
Представляет интерес тот факт, что при терапии EPO+G-CSF наиболее благоприятную группу составили больные РАКС (общий ответ получен в 52 %), которые реже больных с другими ФАБ-вариантами отвечают на терапию одним ЕРО. У части больных, не чувствительных к терапии ЕРО в монорежиме, после добавления G-CSF полностью нормализовался уровень гемоглобина. По данным R. Negrin и соавт., у половины больных, эффективно леченных EPO+G-CSF, после отмены G-CSF гематологический статус возвратился к исходному.
На основании результатов двух многоцентровых исследований была разработана числовая система прогноза эффективности терапии EPO+G-CSF.
По мнению G. Verhoef, достаточной дозой ЕРО для получения эффекта является 150 МЕ/кг 3 раза в неделю подкожно. В случае отсутствия ответа на лечение через 4—8 нед необходимо увеличить дозу ЕРО до 300 МЕ/кг 3 раза в неделю.
В последнее время рекомендуется терапия более высокими дозами ЕРО. По мнению Е. Hellstrom-Lindberg, доза ЕРО должна составлять 50 000— 70 000 ME в неделю, разделенная на 3—5 введений. Терапия в этом режиме должна продолжаться не менее 6 нед. При отсутствии эффекта рекомендуется дополнительно назначить G-CSF. В том случае, если число нейтрофилов составляет менее 1,5•10 9 /л, G-CSF применяется в дозе, поддерживающей их нормальный уровень. При числе нейтрофилов более 1,5•109/л препарат используют в дозе, позволяющей увеличить их уровень в 2 раза. Как правило, эффект от комбинированного лечения наступает в течение 3 мес.
Недавно были опубликованы предварительные результаты рандомизированного исследования терапии ЕРО в монорежиме (по 10 000 ME 3 раза в неделю подкожно) и в комбинации с G-CSF (этот же режим применения EPO+G-CSF по 5 мкг/кг 2 раза в неделю подкожно) у больных МДС с благоприятным прогнозом по шкале IPSS.
Вероятность ответа больных миелодиспластическими синдромами на лечение EPO+G-CSF
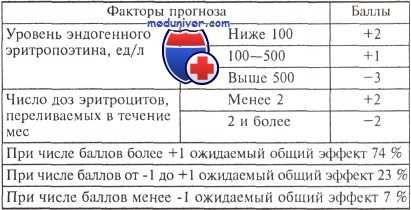
Примечание. Общий эффект объединяет полный ответ на лечение (повышение уровня гемоглобина до 115,0 г/л) и частичный (повышение уровня гемоглобина на 15,0 г/л или исчезновение показаний к гемотрансфузиям эритроцитов).
Через 2 мес лечения эффективность ЕРО в монорежиме и в комбинации с G-CSF составила 41,6 % и 75 % соответственно. К 6 мес лечения эффект сохранялся у 33 % больных первой группы и у 58 % — второй. Число больных, у которых произошла лейкемическая трансформация, было одинаковым в обеих группах — 16 %.
Учитывая накопленный опыт терапии ЕРО, NCCN предложило алгоритм лечения анемии.
1) У больных с отсутствием кольцевых сидеробластов и исходным уровнем эндогенного ЕРО < 500 ед/л рекомендована терапия ЕРО по 150—300 МЕ/кг в день подкожно в течение 2—3 мес. При ответе на лечение следует продолжить инъекции ЕРО в прежней дозе. При отсутствии эффекта можно дополнительно назначить G-CSF по 0,3—3 мкг/кг (обычно — 1 мкг/кг) в день подкожно на период 2—3 мес. В том случае, если получен эффект, следует попытаться снизить дозу ЕРО до приемлемого уровня, а при отсутствии эффекта дальнейшее лечение EPO+G-CSF в указанном режиме прекращается.
D. Т. Bowen и Е. Hellstrom-Lindberg предлагают снижать дозу ЕРО до 20 000—40 000 ME в неделю, разделенную на 2—3 введения. В том случае, если лечение ЕРО было начато в меньшей дозе и не был получен эффект, дозу препарата следует увеличить до рекомендуемой. На фоне лечения ЕРО необходимо контролировать показатели обмена железа в связи с возможностью развития его дефицита.
3) При исходном уровне эндогенного ЕРО > 500 ед/л лечение эритропоэтином не показано.
В настоящее время накапливается опыт применения гипергликозилированного человеческого рекомбинантного ЕРО (дарбепоэтина) у больных миелодиспластическими синдромами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Симптоматическая терапия миелодиспластического синдрома (МДС) - лечение тромбоцитопении, нейтропении
Методы лечения миелодиспластического синдрома (МДС) - современные возможности
Лечение миелодиспластических синдромов (МДС) можно условно разделить на два основных направления: уничтожение клеток патологического клона (достижение и сохранение полной ремиссии) и улучшение качества жизни больных.
Допустимость присутствия у больного с благоприятными прогностическими признаками клона неопластических клеток, в том числе бластных, принципиально отличает подходы к терапии миелодиспластических синдромов от лечения отстрых лейкозов. Однако с определенной уверенностью можно утверждать, что эта лечебная тактика обусловлена отсутствием препаратов, позволяющих уничтожать клетки патологического клона при минимальных побочных эффектах.
В настоящее время применяются следующие методы лечения миелодиспластических синдромов:
• уничтожение клеток патологического клона;
• ингибирование апоптоза клеток костного мозга;
• угнетение ангиогенеза;
• иммуносупрессивное лечение;
• индукция дифференцировки клеток патологического клона;
• различные комбинации указанных методов;
• симптоматическое лечение.
Большинство перечисленных методов позволяет получить ремиссию. Зачастую у больных удается уменьшить выраженность цитопении (например, повысить уровень гемоглобина и отказаться от трансфузии эритроцитов), уменьшить число бластных клеток или добиться отсутствия признаков прогрессирования.

Дакоген показан при всех ФАБ-вариантах МДС и во всех прогностических группах IPSS, кроме группы благоприятного прогноза. Ревлимид рекомендован для лечения пациентов с анемией в сочетании с хромосомной аномалией 5q- (синдром 5q-), особенно при благоприятном и промежуточном-1 прогнозе по шкале IPSS.
Многие препараты, используемые для терапии миелодиспластических синдромов, обладают несколькими функциями (например, цитокины являются стимуляторами пролиферации гемопоэтических клеток, индукторами их дифференцировки, а также оказывают антиапоптотическое действие). Учитывая сложность выделения основного лечебного эффекта, а также в связи с совместным применением препаратов разных групп, Национальное общество комплексного изучения рака, США (National Comprehensive Cancer Network — NCCN) выделяет лечение «высокой» интенсивности, «низкой» интенсивности и сопроводительную терапию.
Лечение «высокой» интенсивности направлено на уничтожение клеток патологического клона. Оно включает схемы «интенсивной» терапии острого миелоидного лейкоза с использованием идарубицина, цитарабина, флударабина, топотекана, более интенсивную химиотерапию по сравнению с используемой при de novo ОМЛ, схемы лечения резистентных форм ОМЛ, в том числе в сочетании с ингибиторами множественной лекарственной устойчивости, трансплантацию гемопоэтических стволовых клеток (аллогенную трансплантацию от сиблинга, включающую подготовительные этапы — режимы кондиционирования стандартной и сниженной интенсивности или трансплантацию от совместимого неродственного донора, а также аутологичную трансплантацию гемопоэтических стволовых клеток (ГСК) в рамках клинических испытаний).
При лечении «низкой» интенсивности используют препараты, направленные как на уничтожение опухолевых клеток, так и на улучшение качества жизни. Данный вид терапии включает применение химиопрепаратов в монорежиме или в малых дозах и нехимиотерапевтических средств — модификаторов биологических реакций (ингибирующих апоптоз и ангиогенез, индуцирующих дифференцировку опухолевых клеток, иммуносупрессантов).
К сопроводительному лечению относят гемозаместительную терапию, ЕРО и G- или GM-CSF, комплексны железа для профилактики гемосидероза, антифибринолитические средства, а также антимикробную терапию.
Вполне понятно, что выделение трех основных видов терапии миелодиспластического синдрома достаточно условно. Постоянное совершенствование лечебных программ и симптоматического лечения меняет представление об «интенсивности» терапии. Так, в некоторых клиниках для лечения de novo ОМЛ и МДС используется не только стандартная индукционная химиотерапия 3 + 7, но и схемы «высокой» интенсивности с включением высоких доз цитарабина и препаратов, обычно применяющихся для резистентных случаев заболевания или для ранних рецидивов.
Например, в М. D. Anderson Cancer Center, США, больным de novo ОМЛ, РАИБ и РАИБ-Т с различным прогнозом уже с 1991 г. проводилось индукционное лечение идарубицином с высокими дозами цитарабина (I+A) и флударабином с высокими дозами цитарабина (F+A), с 1992 г. — идарубицином с высокими дозами цитарабина и G-CSF (I+A+G), флударабином, высокими дозами цитарабина и G-CSF (FLAG), с 1993 г. — флударабином, высокими дозами цитарабина, идарубицином и G-CSF (FLAG-ida).
Использование различных направлений терапии определяется прогнозом течения заболевания, возрастом и общим состоянием больного, эффективностью отдельных препаратов в зависимости от ряда клинико-лабораторных показателей, наличием донора стволовых клеток и возможностью проведения адекватной сопроводительной терапии. Следует отметить, что в настоящее время практически не существует общепринятых стандартов лечения миелодиспластических синдромов, а определены только общие подходы к терапии больных разных прогностических групп.
Данные о факторах, влияющих на эффективность отдельных препаратов, способствуют проведению терапии с учетом исходных прогностических признаков.
Панцитопения
Панцитопения – это снижение количества всех форменных элементов в периферической крови. Состояние является одним из признаков костномозговой недостаточности, возникающей при апластических анемиях, лейкозах, действии ионизирующего излучения. Патология проявляется анемией, иммунодефицитом, геморрагическим синдромом. Для диагностики панцитопении проводится общий анализ крови, исследование биоптатов костного мозга, инструментальные методы визуализации. Лечение цитопении определяется ее причиной, схема терапии включает гемотрансфузии, иммуносупрессоры, противомикробные препараты. Радикальным методом лечения является трансплантация костного мозга.
МКБ-10

Общие сведения
Панцитопения не является самостоятельным заболеванием. Гематологический синдром возникает вторично при разнообразных нарушениях структуры и функций костного мозга, поэтому истинная частота встречаемости не установлена. Патология регистрируется во всех возрастных группах, у детей она может возникать как проявление врожденных нарушений работы системы кроветворения. Панцитопения имеет тяжелое течение и с трудом поддается коррекции, поэтому она представляет серьезную проблему для современной гематологии.
Причины панцитопении
Патологическое состояние развивается при грубых нарушениях системы кроветворения и непосредственном поражении костного мозга. Оно возникает при угнетении всех гемопоэтических ростков, в результате чего снижается образование форменных элементов. Синдром носит общее название недостаточности костного мозга, его непосредственными причинами выступают следующие:
- Врожденные апластические анемии. Панцитопения характерна для людей с анемией Фанкони, Эстрена-Дамешека, Даймонда-Блекфена. Причиной патологи могут быть синдромы Цинссера-Коула-Энгмана и Швахмана-Даймонда. Для пациентов с синдромом Дауна характерны амегакариоцитарная аплазия и апластичсекая анемия.
- Вторичные апластические анемии. Нарушения гемопоэза развиваются на фоне приема миелотоксических препаратов: противоопухолевых, противомалярийных, некоторых антибиотиков. Панцитопения может возникать при облучении всего тела, контакте с ядовитыми веществами. Изредка причиной патологии выступают тяжелые вирусные инфекции (ЦМВ, гепатиты В и С, инфекционный мононуклеоз).
- Миелопролиферативные болезни. Цитопения является одним из основных проявлений острых и хронических лейкозов. В этом случае существует два пика диагностики болезни: у детей и подростков возникают острые формы, для людей старше 60 лет характерны хронические лимфолейкозы.
Патогенез
Механизмы панцитопении различаются с учетом первопричины синдрома. При различных вариантах апластической анемии наблюдаются внутренние дефекты стволовых кроветворных клеток, расположенных в костном мозге. Патология развивается как следствие врожденных генетических мутаций, на фоне изменения состава костномозговой стромы либо под влиянием иммунопатологических воздействий. Степень угнетения кроветворения определяется тяжестью анемии.
При миелопролиферативных заболеваниях панцитопения возникает вследствие вытеснения здоровых гемопоэтических элементов злокачественными клетками. Зачастую вначале наблюдается угнетение только одного ростка кроветворения. Постепенно объем опухолевой ткани увеличивается, и она полностью заполняет соответствующие полости костей. Наблюдается феномен костномозговой гиперклеточности на фоне периферической цитопении.

Симптомы панцитопении
Клинические проявления складываются из отдельных признаков состояний, входящих в синдром панцитопении. При снижении числа эритроцитов развивается картина анемии. Пациент жалуется на постоянную слабость, головокружение, снижение работоспособности. При незначительной физической нагрузке возникает одышка, шум в ушах, покалывание в области сердца. Кожные покровы и слизистые оболочки становятся бледными.
Тромбоцитопения проявляется геморрагическим синдромом. Больной замечает точечные красно-коричневые пятна на коже, частое появление синяков даже при отсутствии механической травмы. Характерна повышенная кровоточивость десен, спонтанные кровотечения из носа, кровоизлияния в суставы. Реже возникают опасные легочные, желудочно-кишечные и маточные геморрагии.
Лейкопения характеризуется снижением иммунитета, на фоне чего постоянно возникают инфекционные болезни. Чаще всего у пациентов диагностируются бронхиты и пневмонии, рецидивирующие воспаления мочеполовой системы, гнойничковые поражения кожи. При миелодиспластическом синдроме возможно увеличение лимфатических узлов, боли в подреберье вследствие спленомегалии и гепатомегалии.
Осложнения
При панцитопении пациенты сталкиваются с рецидивирующими инфекциями, которые сложно поддаются лечению в условиях глубокой лейкопении. Особую опасность представляют затяжные патологии бронхолегочной системы, осложняющиеся дыхательной недостаточностью. Нередко возникают септические и септико-пиемические состояния, которые становятся причиной смерти.
Тяжелое угнетения эритроидного ростка кроветворения чревато развитием анемической комы. При критическом снижении числа красных кровяных клеток нарушаются процессы транспортировки кислорода к тканям. На фоне церебральной гипоксии происходит угнетение сознания и нарушение всех неврологических функций. Тромбоцитопении чреваты смертью от массивной кровопотери, геморрагического инсульта.
Диагностика
При подозрении на цитопенический синдром требуется консультация врача-гематолога или онкогематолога. Первичное обследование включает сбор жалоб, анамнеза заболевания и жизни, проведение физикального обследования, чтобы обнаружить признаки анемии, тромбоцитопении. Для подтверждения наличия панцитопении и выяснения ее первопричины проводятся следующие исследования:
- Гемограмма. В результатах анализа крови наблюдается тяжелая нормохромная анемия, у многих пациентов уровень гемоглобина снижается менее 30 г/л. Диагностируется лейкопения, абсолютная нейтропения и относительный лимфоцитоз. Также определяется тромбоцитопения, повышенная СОЭ.
- Биохимический анализ крови. Для исключения других видов анемий назначается исследование печеночных проб, показателей работы почек, уровня сывороточного железа. Также проводится анализ острофазовых показателей.
- Миелограмма. При цитоморфологическом анализе определяется уменьшение содержания миелокариоцитов, угнетение всех ростков гемопоэза, умеренная плазмоцитарная реакция. Зоны аплазии могут чередоваться с участками нормального кроветворения.
- Трепанобиопсия костного мозга. При панцитопении в трепанобиоптате обнаруживается замещение костного мозга жировой тканью, среди клеток которой встречаются разрозненные лимфоциты, плазмоциты, макрофаги. На начальном этапе болезни обнаруживаются небольшие клеточные скопления эритроидного и гранулоцитарного ростков.
- Инструментальные исследования. Для выяснения первопричины панцитопении назначается УЗИ лимфоузлов, органов брюшной полости. По показаниям проводится КТ костно-мышечной системы, для высокоинформативного сканирования костей применяется ПЭТ-КТ.

Лечение панцитопении
Консервативная терапия
Комплекс лечебных мероприятий подбирается с учетом первопричины гематологического синдрома. Задачей гематологов является максимально возможное восстановление клеточного состава крови, нормализация самочувствия пациента, коррекция жизнеугрожающих осложнений. При панцитопении используются следующие направления терапии:
- Иммуносупрессия. Пациентам назначаются длительные курсы антитимоцитарного иммуноглобулина как препарата первой линии, цитостатические препараты, среди которых чаще всего используется циклоспорин А. По показаниям схему терапии усиливают глюкокортикоидами.
- Заместительная терапия. Быстро восстановить состав периферической крови удается с помощью трансфузий эритроцитарной и тромбоцитарной масс, переливания свежезамороженной плазмы.
- Антибиотикотерапия. На фоне глубокой лейкопении больным проводятся длительные курсы противомикробной терапии для лечения существующих бактериальных инфекций и предупреждения их рецидивов.
- Колониестимулирующие факторы. Препараты гранулоцитарного и макрофагального факторов назначаются пациентам, имеющим резерв костномозговой миелоидной ткани. Для повышения уровня нейтрофилов в крови целесообразно применять интерлейкин-3.
Хирургическое лечение
При панцитопении, возникающей на фоне апластической анемии и не поддающейся консервативной терапии, рассматривается возможность проведения спленэктомии. Хирургическое удаление селезенки уменьшает разрушение эритроцитов, обеспечивает 90% длительную выживаемость в группе пациентов с нетяжелыми формами анемического синдрома. При тяжелой анемии вероятность благоприятного исхода после операции составляет 70-80%.
При тяжелых формах панцитопении максимальную эффективность показывает пересадка костного мозга или стволовых клеток, чтобы восстановить физиологические процессы гемопоэза. Для трансплантации требуется наличие гистосовместимого донора и отсутствие строгих противопоказаний. При соблюдении таких условий методом выбора является раннее проведение пересадки, которая сводит к минимуму регулярные гемотрансфузии и связанные с ними риски.
Прогноз и профилактика
Успешность коррекции панцитопении зависит от ее первопричины, общего состояния пациента, наличия сопутствующих патологий. Несмотря на развитие гематологии, возможности лечения остаются ограниченными, поэтому при лимфопролиферативных болезнях и тяжелых апластических анемиях возможен летальный исход. Ввиду сложности этиопатогенеза цитопенического синдрома эффективные меры профилактики пока не разработаны.
2. Патофизиологический анализ гемограмм и оценка типовых нарушений системы крови/ Ф.И. Висмонт, Л.С. Лемешонок, Д.М. Попутников. – 2011.
Миелодиспластический синдром
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
- Рефрактерная анемия. Сохраняется более полугода. В анализе крови бласты отсутствуют либо единичные. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная анемия с кольцевыми сидеробластами. Сохраняется более полугода. В анализе крови бласты отсутствуют. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией. В анализе крови тельца Ауэра отсутствуют, бласты отсутствуют либо единичные, выявляются панцитопения и увеличение количества моноцитов. В костном мозге диспластические изменения менее 10% клеток в 1 миелоидной клеточной линии, бластов менее 5%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-1. В анализе крови тельца Ауэра отсутствуют, бластов более 5%, цитопения и увеличение количества моноцитов. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 5-9%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-2. В анализе крови увеличение количества моноцитов, цитопения, бластов 5-19%, могут выявляться тельца Ауэра. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 10-19%, обнаруживаются тельца Ауэра.
- Неклассифицируемый миелодиспластический синдром. В анализе крови цитопения, бласты отсутствуют либо единичные, тельца Ауэра отсутствуют. В костном мозге дисплазия одного мегакариоцитарного либо гранулоцитарного ростка, бластов более 5%, тельца Ауэра отсутствуют.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q. В анализе крови анемия, бластов более 5%, возможен тромбоцитоз. В костном мозге более 5% бластов, тельца Ауэра отсутствуют, изолированная делеция 5q.
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
Диагноз выставляется с учетом данных лабораторных исследований: анализа периферической крови, биопсии костного мозга с последующим цитологическим исследованием, цитохимических и цитогенетических тестов. В анализе периферической крови больных миелодиспластическим синдромом обычно обнаруживается панцитопения, реже выявляется дву- или одноростковая цитопения. У 90% пациентов наблюдается нормоцитарная либо макроцитарная анемия, у 60% - нейтропения и лейкопения. У большинства больных миелодиспластическим синдромом отмечается тромбоцитопения.
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Тромбоцитопения
Тромбоцитопения – количественное нарушение тромбоцитарного звена гемостаза, характеризующееся снижением количества тромбоцитов в единице объема крови. Клинические признаки тромбоцитопении включают повышенную кровоточивость из поврежденной кожи и слизистых, склонность к образованию синяков и геморрагической сыпи, спонтанные кровотечения различных локализаций (носовые, десневые, желудочные, маточные и др.). Гематологическая диагностика основывается на изучении общего анализа крови с подсчетом тромбоцитов, иммунологическом обследовании, исследовании пунктата костного мозга. Возможными методами лечения тромбоцитопении являются медикаментозная терапия, спленэктомия, экстракорпоральное очищение крови.
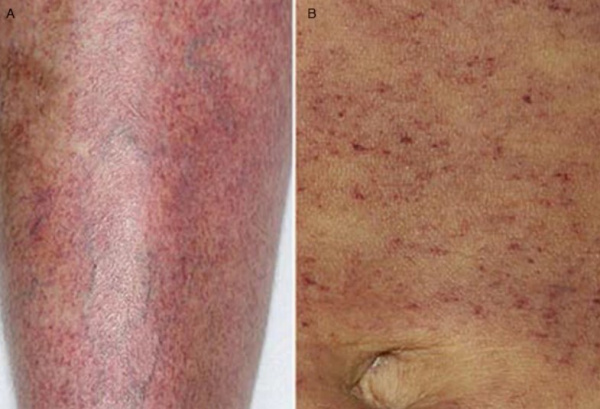
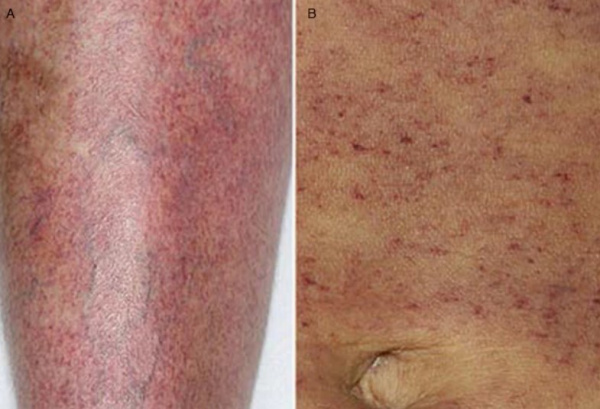
Тромбоцитопении – различные по этиологии, патогенезу и течению геморрагические диатезы, характеризующиеся склонностью к повышенной кровоточивости вследствие уменьшения количества кровяных пластинок. Пороговым критерием тромбоцитопении в гематологии принято считать уровень тромбоцитов ниже 150х109/л. Однако развернутая клиническая картина тромбоцитопении обычно развивается при снижении тромбоцитов до 50х109/л, а уровень 30х109/л и ниже является критическим. Физиологическая тромбоцитопения, возникающая у женщин в период менструации или беременности (гестационная тромбоцитопения), обычно не достигает выраженной степени. Патологические тромбоцитопении, обусловленные различными причинами, встречаются у 50-100 человек из 1 млн.
Тромбоциты (бляшки Биццоцеро) представляют собой мелкие кровяные пластинки размером 1-4 мкм. Они образуются из мегакариоцитов костного мозга при непосредственном стимулирующем воздействии полипептидного гормона тромбопоэтина. Нормальный уровень тромбоцитов составляет 150-400х109/л; примерно 70% тромбоцитов непрерывно циркулирует в периферической крови, а 1/3 часть находится в селезеночном депо. Средняя продолжительность жизни тромбоцитов составляет 7-10 дней, после чего происходит их разрушение в селезенке.
Причины тромбоцитопении
Врожденные тромбоцитопении в большинстве своем являются частью наследственных синдромов, таких как синдром Вискота-Олдрича, анемия Фанкони, синдром Бернара-Сулье, аномалия Мея-Хегглина и др. Поскольку при наследственных тромбоцитопениях, как правило, наблюдаются также качественные изменения тромбоцитов, их принято относить к тромбоцитопатиям.
Причины приобретенных тромбоцитопений крайне разнообразны. Так, возмещение кровопотери инфузионными средами, плазмой, эритроцитарной массой может привести к уменьшению концентрации тромбоцитов на 20-25% и возникновению, так называемой, тромбоцитопении разведения. В основе тромбоцитопении распределения лежит секвестрация тромбоцитов в селезенке или сосудистых опухолях – гемангиомах с выключением значительного количества тромбоцитарной массы из общего кровотока. Тромбоцитопении распределения могут развиваться при заболеваниях, сопровождающихся массивной спленомегалией: лимфомах, саркоидозе, портальной гипертензии, туберкулезе селезенки, алкоголизме, болезни Гоше, синдроме Фелти и др.
Наиболее многочисленную группу составляют тромбоцитопении, обусловленные повышенным разрушением тромбоцитов. Они могут развиваться как в связи с механическим разрушением тромбоцитов (например, при протезировании сердечных клапанов, искусственном кровообращении, пароксизмальной ночной гемоглобинурии), так и при наличии иммунного компонента.
Аллоиммунные тромбоцитопении могут являться следствием трансфузии иногруппной крови; трансиммунные – проникновения материнских антител к тромбоцитам через плаценту к плоду. Аутоиммунные тромбоцитопении связаны с выработкой антител к собственным неизмененным антигенам тромбоцитов, что встречается при идиопатической тромбоцитопенической пурпуре, системной красной волчанке, аутоиммунном тиреоидите, миеломной болезни, хроническом гепатите, ВИЧ-инфекции и др.
Гетероиммунные тромбоцитопении обусловлены образованием антител против чужеродных антигенов, фиксирующихся на поверхности тромбоцитов (лекарственных, вирусных и др.). Лекарственно-индуцированная патология возникает при приеме седативных, антибактериальных, сульфаниламидных препаратов, алкалоидов, соединений золота, висмута, инъекциях гепарина и др. Обратимое умеренное снижении числа тромбоцитов наблюдается после перенесенных вирусных инфекций (аденовирусной инфекции, гриппа, ветряной оспы, краснухи, кори, инфекционного мононуклеоза), вакцинации.
Тромбоцитопении, обусловленные недостаточным образованием тромбоцитов (продуктивные), развиваются при дефиците стволовых гемопоэтических клеток. Такое состояние характерно для апластической анемии, острого лейкоза, миелофиброза и миелосклероза, опухолевых метастазов в костный мозг, дефицита железа, фолиевой кислоты и витамина B12, эффектов лучевой терапии и цитостатической химиотерапии.
Наконец, тромбоцитопения потребления возникает в связи с повышенной потребностью в тромбоцитах для обеспечения свертываемости крови, например, при ДВС-синдроме, тромбозах и т. д.

Классификация
Тромбоцитопении принято классифицировать на основании ряда признаков: причин, характера синдрома, патогенетического фактора, тяжести геморрагических проявлений. По этиологическому критерию различают первичные (идиопатические) и вторичные (приобретенные) тромбоцитопении. В первом случае синдром является самостоятельным заболеванием; во втором – развивается вторично, при ряде других патологических процессов.
Тромбоцитопения может иметь острое течение (длительностью до 6 месяцев, с внезапным началом и быстрым снижением количества тромбоцитов) и хроническое (длительностью более 6 месяцев, с постепенным нарастанием проявлений и снижением уровня тромбоцитов).
С учетом ведущего патогенетического фактора выделяют:
- тромбоцитопении разведения
- тромбоцитопении распределения
- тромбоцитопении потребления
- тромбоцитопении, обусловленные недостаточным образованием тромбоцитов
- тромбоцитопении, обусловленные повышенным разрушением тромбоцитов: неиммунные и иммунные (аллоиммунные, аутоиммунные, трансиммунные, гетероиммунные)
Критерием тяжести тромбоцитопении служит уровень тромбоцитов крови и степень нарушения гемостаза:
- I - количество тромбоцитов 150-50х109/л – гемостаз удовлетворительный
- II - количество тромбоцитов 50-20 х109/л – при незначительной травме возникают внутрикожные кровоизлияния, петехии, длительные кровотечения из ран
- III - количество тромбоцитов 20х109/л и ниже – развиваются спонтанные внутренние кровотечения.
Симптомы тромбоцитопении
Обычно первым сигналом снижения уровня тромбоцитов служит появление кожных кровоизлияний при незначительном травмировании (ударе, сдавлении) мягких тканей. Больные отмечают частое возникновение синяков, специфической мелкоточечной сыпи (петехий) на теле и конечностях, кровоизлияний в слизистые оболочки, повышенную кровоточивость десен и т. п. В этот период тромбоцитопения выявляется лишь на основании изменений гемограммы, чаще исследуемой по другому поводу.
На следующем этапе отмечается увеличение времени кровотечения при незначительных порезах, длительные и обильные менструальные кровотечения у женщин (меноррагии), появление экхимозов в местах инъекций. Кровотечение, вызванное травмой или медицинской манипуляцией (например, экстракцией зуба) может продолжаться от нескольких часов до нескольких суток. Спленомегалия при тромбоцитопении обычно развивается только на фоне сопутствующей патологии (аутоиммунной гемолитической анемии, хронического гепатита, лимфолейкоза и пр.); увеличение печени не характерно. В случае присоединения артралгии следует думать о наличии у пациента коллагеноза и вторичном характере тромбоцитопении; при склонности к образованию глубоких висцеральных гематом или гемартрозов – о гемофилии.
При значительном снижении количества тромбоцитов возникают спонтанные кровотечения (носовые, маточные, легочные, почечные, желудочно-кишечные), выраженный геморрагический синдром после хирургических вмешательств. Профузные некупируемые кровотечения и кровоизлияния в мозг могут стать фатальными.

При любых состояниях, сопровождающихся повышенной кровоточивостью, следует обратиться к гематологу. Первым тестом на пути диагностики тромбоцитопении служит исследование общего анализа крови с подсчетом количества тромбоцитов. Мазок периферической крови может указывать на возможную причину тромбоцитопении: присутствие ядросодержащих эритроцитов или незрелых лейкоцитов скорее всего свидетельствует в пользу гемобластоза и требует более углубленного обследования (проведения стернальной пункции, трепанобиопсии).
Для исключения коагулопатии исследуется гемостазиограмма; при подозрении на аутоиммунный характер тромбоцитопении производится определение антитромбоцитарных антител. Возможную причину тромбоцитопении позволяет выявить УЗИ селезенки, рентгенография грудной клетки, иммуноферментный анализ крови. Дифференциальная диагностика проводится между различными формами тромбоцитопений, а также с болезнью Виллебранда, гемофилией, пернициозной анемией, тромбоцитопатиями и др.
Лечение тромбоцитопении
При установлении вторичного характера тромбоцитопении основное лечение заключается в терапии основного заболевания. Вместе с тем, наличие выраженного геморрагического синдрома требует госпитализации пациента и оказания неотложной медицинской помощи. При активных кровотечениях показаны трансфузии тромбоцитов, назначение ангиопротекторов ( этамзилаа), ингибиторов фибринолиза (аминокапроновой кислоты). Исключается прием ацетилсалициловой кислоты, антикоагулянтов, НПВС.
Пациентам с идиопатической тромбоцитопенической пурпурой проводится глюкокортикоидная терапия, внутривенное введение иммуноглобулина, плазмаферез, химиотерапия цитостатиками. В отдельных случаях (при неэффективности медикаментозной терапии, повторных кровотечениях) показана спленэктомия. При тромбоцитопениях неиммунного характера проводится симптоматическая гемостатическая терапия.
Читайте также:
