Причины болезни Ходжкина - этиология
Добавил пользователь Morpheus Обновлено: 22.01.2026
Лимфома Ходжкина - причины, механизмы развития
Лимфома Ходжкина (название введено ВОЗ в 2001 г., син. — болезнь Ходжкина, лимфогранулематоз) — это злокачественная опухоль, первично возникающая в лимфатических узлах и распространяющаяся преимущественно по лимфатической системе путем лимфогенного метастазирования. Поражение нелимфоидных органов происходит путем лимфогенного и гематогенного метастазирования. Патоморфологическим субстратом опухоли являются крупные многоядерные клетки Березовского — Рид — Штернберга.
Этиология лимфомы Ходжкина
Вирус Эпштейна — Барр (EBV — Epstein— Barr virus) является главным претендентом на роль этиологического фактора при лимфоме Ходжкина. В 1971 г. A. S. Evans, а затем в конце 80-х годов N. Mueller опубликовали исследования, выявившие зависимость между инфицированностью вирусом Эпштейна — Барр и частотой возникновения лимфомы Ходжкина. Они показали, что риск заболевания лимфомой Ходжкина среди тех, кто перенес инфекционный мононуклеоз, т. е. инфицирован вирусом Эпштейна — Барр, втрое выше по сравнению с неинфицированной популяцией.
Эти авторы также выявили повышенный по сравнению с контрольной группой титр антител к вирусному капсидному антигену и нуклеарному антигену вируса Эпштейна — Барр (EBNA — Epstein—Barr nuclear antigen — нуклеарный антиген вируса Эпштейна — Барр) при появлении клинических симптомов лимфомы Ходжкина. При изучении связи вируса Эпштейна — Барр с лимфомой Ходжкина выявлено еще несколько особенностей. Положительная реакция на вирус Эпштейна — Барр чаще отмечается у людей с низким социально-экономическим уровнем в экономически слаборазвитых странах и среди детей по сравнению с группой молодых взрослых и группой больных, имеющих высокий социально-экономический статус.
Последующие работы, в которых были использованы более чувствительные молекулярные методики (гибридизация in situ, полимеразная цепная реакция), показали, что в 30—50 % случаев лимфомы Ходжкина клетки Березовского — Рид — Штернберга содержат фрагменты генома вируса Эпштейна — Барр. Положительная реакция на вирус Эпштейна — Барр чаще выявляется у больных со смешанно-клеточным вариантом лимфомы Ходжкина (50—70 %) и реже — среди больных с нодулярным склерозом (10-42%).
Патогенез лимфомы Ходжкина
Морфологической особенностью лимфомы Ходжкина является малое количество злокачественных клеток в опухолевой ткани. Пораженный лимфатический узел на 99 % состоит из различных реактивных клеток: Т- и В-лимфоцитов, гистиоцитов, эозинофилов, плазматических клеток, фибробластов, дендритных клеток и других клеточных элементов, а на долю опухолевого субстрата — гигантских одноядерных клеток Ходжкина и многоядерных клеток Березовского — Рид — Штернберга — приходится лишь 1 % всей клеточной популяции.
Эти опухолевые клетки имеют необычный фенотип, резко отличающийся от всех известных нормальных гемопоэтических клеточных типов. Эти обстоятельства объясняют, почему в течение длительного времени так трудно было установить происхождение клеток Березовского — Рид — Штернберга. И только в последнее десятилетие, когда значительное развитие получили методы иммунофенотипирования и цитогенетики в изучении и диагностике лимфомы Ходжкина, появились методики, позволяющие работать с одной отдельно выделенной клеткой, удалось расшифровать природу клетки Березовского — Рид — Штернберга. Дополнительные трудности в понимании происхождения клетки Березовского — Рид — Штернберга возникали в связи с тем, что в отличие от всех других лимфом у клетки Березовского — Рид — Штернберга не существует аналога в нормальном лимфопоэзе.
Современная концепция, объясняющая природу клеток Березовского — Рид — Штернберга, основана на том, что эти клетки происходят из периферических В-лимфоцитов. Исследования последнего десятилетия уточнили, что клетки Березовского — Рид — Штернберга происходят из тех центробластов зародышевого (терминального) центра вторичного фолликула лимфатического узла, которые в силу своего несовершенства должны были бы подвергнуться апоптозу (клеточной смерти), но избежали такового.

Конечной целью соматических гипермутаций генов Ig является повышение аффинности (соответствия, сродства) кодируемого этими генами иммуноглобулина (антитела) к соответствующему антигену. Центробласты, прошедшие этап соматических гипермутаций, называются центроцитами. Центроциты, получившие в результате соматических гипермутаций способность продуцировать высокоспецифичные (высокоаффинные) антитела (иммуноглобулины), взаимодействуют с Т-хелперами зародышевого центра и фолликулярными дендритными клетками. В результате этого взаимодействия центроциты, способные продуцировать высокоаффинные антитела, выживают и дифференцируются в плазматические клетки или клетки памяти. Поскольку происходящие в центробластах соматические гипермутации случайны, абсолютное большинство их не приводит к повышению афинности Ig.
Напротив, мутации в этих клетках могут быть бессмысленными, приводить к образованию «стоп-кодонов» (stop codon), нарушению рамки считывания и т. п. Центробласты, не способные продуцировать высокоспецифичные антитела, получают сигнал к апоптозу и погибают.
Молекулярно-генетические исследования генов Ig показали, что клетки Березовского — Рид — Штернберга являются именно такими В-клетками терминального центра лимфатического узла, в которых произошли бессмысленные и вредные мутации и которые по каким-то причинам не погибли, а сохранили способность к пролиферации и малигнизировались.
Происхождение клеток Ходжкина и Березовского — Рид — Штернберга из терминального центра лимфатического узла было доказано не только при изучении реаранжировки генов Ig, но также и при изучении иммунофенотипа этих клеток.
В процессе нормального лимфопоэза В-лимфоциты на различных этапах созревания теряют одни маркеры и приобретают другие. Большинство клеток Березовского — Рид — Штернберга либо не экспрес-сирует многие более ранние В-клеточные маркеры, такие как CD19, CD20, J-цепь (J chain), CD79a и CD79b, либо эти маркеры экспрессируются лишь небольшой частью клеток Ходжкина и Березовского—Рид—Штернберга. Клетки Березовского — Рид — Штернберга в случаях классической лимфомы Ходжкина экспрессируют активационные маркеры CD30 (Ki-1), а также различные маркеры, которые не характерны для В-лимфоцитов.
В очень многих случаях клетки Березовского — Рид — Штернберга экспрессируют CD15 — маркер, характерный для гранулоцитов и моноцитов, и продуцируют хемокин TARC, который секретируют только дендритные клетки. На клетках Березовского — Рид — Штернберга была обнаружена экспрессия и других маркеров дендритных клеток, включая фасцин и CD83. В 10—15 % случаев классической лимфомы Ходжкина клетки Березовского — Рид — Штернберга экспрессируют один или более Т-клеточных маркеров, таких как CD3, TIA-1, перфорин и гранзим В, имея при этом В-клеточное происхождение. Очень редко (около 2 % случаев) лимфома Ходжкина имеет Т-клеточную природу.
Несмотря на то что на клетках Березовского — Рид — Штернберга при классической лимфоме Ходжкина не определяются многие В-клеточные маркеры, тем не менее некоторые В-линейно-ассоциированные белки экспрессируются у большинства больных. Это факторы транскрипции РАХ-5, MUM1, BCL-6, а также плазмоклеточный маркер CD138. Так как фенотип BCL-6-/CD138+ характерен для плазматических клеток, было сделано предположение, что клетки Березовского — Рид — Штернберга с подобным фенотипом при лимфоме Ходжкина происходят из В-клеток, уже прошедших преобразования в терминальном центре.
С этой точки зрения потеря некоторых В-клеточных маркеров, например CD20, может указывать на начало плазмоклеточной дифференцировки клеток Березовского — Рид — Штернберга, так как плазматические клетки утрачивают большинство В-клеточных антигенов. Все эти факты с учетом мутационного статуса клетки Березовского — Рид — Штернберга являются аргументом для предположения, что ключевой шаг в злокачественной трансформации произошел в терминальном центре или ранее.

На этом основана гипотеза, что клетки Березовского — Рид — Штернберга в случаях классической лимфомы Ходжкина происходят преимущественно из уже трансформировавшихся клеток терминального центра, но не из клеток, эффективно прошедших все этапы селекции и дифференцировки в зародышевом центре.
Наиболее доказана в патогенезе лимфомы Ходжкина роль вируса Эпштейна — Барр. Особенно важен тот факт, что в большинстве случаев наличие структур вирусного генома в клетках Березовского — Рид — Штернберга выявляет клон опухолевых клеток, и это прямо указывает на роль вируса Эпштейна — Барр в патогенезе лимфомы Ходжкина.
Вирус Эпштейна — Барр находится в клетках Березовского — Рид — Штернберга в латентном состоянии. Клетки Березовского — Рид — Штернберга, содержащие геном вируса Эпштейна — Барр (EBV-позитивные), кроме EBNAI и EBNA2, экспрессируют латентный мембранный протеин (LMP — latent membrane protein) LMP1 и LMP2. Коэкспрессия LMP1 и LMP2 (частично в кооперации с EBNA2), возможно, играет решающую роль в развитии EBV-позитивной лимфомы Ходжкина.
Имитируя основные сигналы к выживанию В-клеток герминального центра (например, сигнальный CD40), эти вирусные протеины позволяют выжить тем В-клеткам герминального центра, которые должны были подвергнуться апоптозу. В В-клетках с дефектными мутациями экспрессия LMP1 заменяет нормальные CD40-медиаторные сигналы, которые контролируют выживаемость и дифференцировку В-клеток герминального центра. Тем самым LMP1 отменяет сигнал к апоптозу в В-клетках с нежелательными мутациями и инициирует их выход из герминального центра. Наличие LMP1 и LMP2 предотвращает гибель инфицированных вирусом Эпштейна — Барр В-клеток и превращает их в клетки Ходжкина и Березовского — Рид — Штернберга.
Однако тот факт, что вирус Эпштейна — Барр обнаруживается не во всех случаях лимфомы Ходжкина, оставляет открытым вопрос о патогенезе лимфомы Ходжкина у EBV-негативных больных. Существует несколько гипотез, объясняющих EBV-негативные случаи лимфомы Ходжкина. Одна из них заключается в том, что другой вирус является этиологическим фактором в этих случаях, однако попытки найти другой вирус в большинстве случаев потерпели неудачу. В 2001 г. J. Gopas и соавт. сообщили о присутствии вируса кори в клетках Березовского — Рид — Штернберга у половины больных лимфомой Ходжкина.
Вторая гипотеза предполагает, что вирус Эпштейна — Барр не во всех случаях играет важную роль в патогенезе лимфомы Ходжкина. Существует и третья гипотеза — «hit-and-run» (ударил и убежал). Эта гипотеза предполагает, что инфицирование вирусом Эпштейна — Барр происходит всегда, но впоследствии вирус в ряде случаев элиминируется, оставляя клетки либо трансформированными, либо готовыми к трансформации, поэтому дальнейшее присутствие вируса в клетке уже необязательно для выживания и экспансии опухолевых клеток. Полагают, что элиминация вируса может происходить у больных с активной иммунной системой. Однако тот факт, что до настоящего времени в геноме EBV-негативных клеток Березовского — Рид — Штернберга не найдено даже фрагментов генома вируса Эпштейна — Барр, ставит под сомнение возможность существования последней гипотезы.
Классический цитогенетический анализ клеток Березовского — Рид — Штернберга затруднен, так как эти клетки редко разбросаны в опухолевой ткани и обладают низкой пролиферативной активностью, что делает сложным определение принадлежности метафаз к опухолевым клеткам. При анализе кариотипа клеток Ходжкина и Березовского — Рид — Штернберга в 30—80 % случаев выявляют количественные и структурные нарушения. Среди различных хромосомных изменений при лимфоме Ходжкина наиболее часто встречаются анеуплоидия — в 100%, при этом гиперплоидия — в 70%. Однако специфического хромосомного маркера найдено не было.
Имеются лишь указания на более частые хромосомные аберрации в нормальных лимфоцитах у больных лимфомой Ходжкина, но значение этого феномена пока неясно.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Причины болезни Ходжкина - этиология
Многие из морфологических и клинических аспектов болезни Hodgkin указывают на существование воспалительного фактора в возникновении заболевания, что побудило многих авторов, еще в конце прошлого столетия инкриминировать в этиологии болезни инфекционный агент. Таким образом были инкриминированы один за другим: человеческая туберкулезная бацилла (Sternberg, Frenkel и Much, Martinoli), птичья туберкулезная бацилла (L'Esperance), дифтероидные организмы (Bunting и Yates), Corynebacterium (Fleischer), Brucella (Forbus), грибки (Gendel и сотр.). Все эти гипотезы были опровергнуты.
В настоящее время злокачественная природа болезни Ходжкина доказана и признана единодушно. Экспериментальные исследования позволили определить вирусную этиологию при лейкемиях и лимфомах подопытных животных. Подобная этиология подозревается и у человека, однако до настоящего времени ее не удалось точно доказать.
Первичная затронутость шейных, медиастинальных или кишечных ганглиев побудили некоторых авторов утверждать существование некоего инфекционного агента, проникающего в организм диггестивным. и/или респираторным путем. Эта инфекция может происходить в самый момент рождения во время прохода через генитальный тракт матери.
Отдельные авторы утверждают, что амигдалектомия (Vianna и сотр.) или аппендэктомия (Bierman) якобы увеличивают частоту болезни Ходжкина, однако эти данные не были подтверждены другими авторами.
Что касается самого этиологического агента, современные исследования обращены на вирусы герпетического типа, а главным образом на вирус Epstein-Barr. Существуют исследования, показавшие значительный рост возникновения болезни Ходжкина у лиц, переболевших инфекционным мононуклеозом. Помимо этого, у больных с болезнью Ходжкина были найдены значительно повышенные титры антител анти-EpsteinBarr. Но это, возможно, говорит лишь об инфекции, которой способствовало понижение иммунной реактивности (Henle и Henle), тем более, что в спленических клетках больных не было обнаружено наличие вирусной ДРНК типа Epstein-Barr (Nonoyama и др.), а в культурах клеток Sternberg—Heed не были найдены вирусные геномы (Kaplan).
В возникновении болезни Ходжкина по-видимому действуют два главных процесса. Первым из них является злокачественная трансформация, а вторым — реакция иммунной ткани по отношению к неопластически трансформированным клеткам.

- Кликните по картинке для увеличения -
При болезни Ходжкина, неопластические клетки представлены клетками Sternberg и клетками Hodgkin. Их происхождение вызывает споры. Некоторые авторы рассматривают эти клетки как трансформированные лимфоциты (Lukes и сотр., Peckham и Cooper). Была выдвинута идея филиации от лимфоцита Б, так как некоторые авторы выявили на поверхности и в цитоплазме этих клеток наличие IgG (Leech, Taylor), в то время как другие считают, что эти клетки происходят от лимфоцитов Т (Order и Hellman).
Другая группа авторов, основываясь на данных, полученных при помощи цитохимии и трехмерной электронной микроскопии (Braunstein и сотр., Mori и Lennert, Kay и Kadin), считают, что клетки Sternberg-Reed и клетки Hodgkin происходят от трансформированных макрофагов.
Злокачественная трансформация клеток вероятно расстраивает их антигенную структуру, с потерей или изменением одного или нескольких антигенов гистосовместимости. В отношении этих клеток происходит реакция нормальных лимфоцитов Т. Kaplan и Smithers уподобляют болезнь Ходжкина болезни по поводу пересадки — против хозяина у подопытных животных. Order и Hellman предлагают следующий патогенный механизм: отдельные лимфоциты Т, злокачественно измененные неизвестным этиологическим агентом, который альтерирует их антигенность, индуцируют реакцию нормальных лимфоцитов Т.
Хроническая реакция Т—Т, индуцированная подопытным животным, ведет к образованию лимфом гистиоцитарного типа (Schwartz и Beldotti). Сложный гистологический аспект заболевания детерминирован пролиферацией злокачественных клеток, в сочетании с иммунной реакцией организма. Эволюцию болезни решает преобладание того или другого процесса: высокая пропорция нормальных лимфоцитов на срезе (форма с лимфоцитарным преобладанием и узелковык склерозом) указывает на более благоприятный прогноз, в то время как преобладание пролиферации злокачественных клеток (форма с смешанной целлюлярностью или с лимфоцитарной деплецией) указывает на более суровое течение.
Независимо от того, происходит ли злокачественная клетка от лимфоцита Т или от макрофага, реакция нормальных лимфоцитов Т твердо доказана. Как на гистологических срезах, так и в культурах тканей, клетки Sternberg-Reed окружены активированный, нормальными лимфоцитами (Carr). Исследования при помощи электронной микроскопии выявили существование цитоплазматических процессов, которые начинаются в нормальных лимфоцитах и инвагинируются в злокачественные клетки (Carr). Существует тесное взаимоотношение между этими клеточными контактами и дегенеративными изменениями, которые появляются в неопластических клетках (Archibald и Fenster).
Делались попытки выявить антигенные изменения, происшедшие в злокачественно трансформированной клетке. Order и сотр. нашли в ганглиях при болезни Гожкина два антигена, которые не существуют в ганглиях нормального взрослого человека. Эти антигены находятся и в примитивных кроветворных органах плода. Bieber и Bieber продемонстрировали, что одним из этих антигенов является феритин, существующий в большой количестве в лимфоидных органах больных с болезнью Ходжкина.
Семейные случаи болезни Ходжкина поставили вопрос о том, не играет ли роль в патогенезе заболевания и генетический фактор. Новейшие исследования показали, у больных с болезнью Ходжкина преобладание групп антигенов 4С системы HL—A (Amiel, Bodmer). Значение этого наблюдения не известно. Вознможо, что наличие этих антигенов гистосовместимости придает повышенную чувствительность к специфической инфекции или же оно изменяет иммунную реактивность организма.
В настоящее время точно известно, что существует тесная взаимосвязь между иммунной способностью организма и образованием злокачественных лимфом. Больные с дефицитной иммунной системой, врожденной или приобретенной благодаря долговременным иммуносупрессив-ным лечениям (пересадки органов), представляют гораздо большую частоту злокачественных лимфом, чем остальное население. С другой стороны, злокачественные лимфомы вообще и болезнь Ходжкина в частности, оказывают явное влияние на иммунную способность. При болезни Ходжкина развивается сокращение иммунитета целлюлярного типа, которое усугубляется параллельно с эволюцией заболевания.
Модификация иммунитета выражается потерей чувствительности к туберкульниу, к грибковым антигенам, запаздыванием отбрасывания кожного гомотрансплантата. Больные сенсибилизируются труднее динитрихлорбензолом (ДНХБ), как мы уже указывали, говоря о патофизиологии. Трудно уточнить роль этого расстройства в возникновении болезни, но оно играет несомненную роль в эволюции, сильно понижая защитную способность организма и ухудшая прогноз.
Лимфома Ходжкина у беременных
Лимфома Ходжкина у беременных — это злокачественное лимфопролиферативное заболевание с поражением B-лимфоцитов лимфатических узлов, лимфоидных структур и экстранодулярных тканей, перенесенное до гестации, возникшее или рецидивировавшее во время беременности. Проявляется увеличением лимфоузлов, беспричинной лихорадкой, ночной потливостью, снижением веса, слабостью, кожным зудом, признаками сдавления различных органов. Диагностируется с помощью МРТ, УЗИ, рентгенографии грудной клетки, биопсии лимфоидной ткани. Для лечения используют моно- или полихимиотерапию, дополненную облучением пораженных областей.
МКБ-10
Общие сведения
В структуре злокачественных неоплазий, выявляемых у беременных, лимфома Ходжкина (лимфогранулематоз, злокачественная гранулема, болезнь Ходжкина) занимает четвертое место. Заболевание выявляется с частотой 1:1 000 — 1:6 000 беременностей и поражает преимущественно молодых женщин европеоидной расы в возрасте 20-29 лет. Применение современных методов лечения гемобластозов с достижением стойкой ремиссии или полного выздоровления привело к увеличению числа ситуаций, когда под наблюдение акушеров-гинекологов попадают пациентки, ранее перенесшие лимфогранулематоз. При этом риск рецидива лимфомы у беременных с полной ремиссией, длящейся более 3 лет, составляет 9%, а у больных, забеременевших менее чем через 3 года после окончания терапии, достигает 44%.

Причины
Этиология лимфогранулематоза окончательно не установлена. Большинство специалистов в сфере онкогематологии, акушерства и гинекологии не считают гестацию причиной или провоцирующим фактором возникновения либо рецидива болезни Ходжкина. Локальная трансформация B-клеток, характерная для злокачественной гранулемы, вероятно, может быть спровоцирована действием таких факторов, как:
- Инфицирование вирусами Эпштейна-Барр. В 40-70% случаев В-клеточная лимфома EBV-позитивна. Возбудитель является герпесвирусом 4-го типа (HHV4), тропен к B-лимфоцитам, в результате длительного латентного персистирования способен оказывать на иммунные клетки трансформирующий эффект с экспрессией мембранных белков и запуском механизмов апоптоза. Некоторые авторы в числе возбудителей, вызывающих онкотрансформацию B-клеток, также называют микобактерии туберкулеза, герпесвирусы 6-го типа, ВИЧ.
- Воздействие мутагенов. При EBV-негативных формах лимфомы не исключено влияние других неблагоприятных факторов внешней среды. Генные аберрации, способствующие малигнизации лимфоидной ткани, могут происходить под влиянием профессиональных вредностей (работа с производственными ядами), химио- и лучевой терапии, некоторых лекарственных средств (фенитоина и аналогов). Предположительно у ряда пациенток возможен генетически наследуемый дефект систем сдерживания опухолевой трансформации и роста.
Вероятность возникновения В-клеточной лимфомы повышается при приеме иммунодепрессантов после трансплантации органов. В группу риска также входят беременные с врожденными нарушениями иммунитета (болезнью Вискотта-Олдрича) и аутоиммунными расстройствами (ревматоидным артритом, синдромом Шегрена, системной красной волчанкой, целиакией).
Патогенез
Механизм развития лимфомы Ходжкина у беременных аналогичен онкогенезу, происходящему вне гестационного периода. Под влиянием вирусов Эпштейна-Барр и других мутагенных факторов происходит ряд иммуногистохимических процессов, позволяющих перерожденным B-клеткам избегать апоптоза и цитолитического действия Т-киллеров, подавлять иммунную реакцию тканевого микроокружения на неоплазию. По мнению большинства онкогематологов, перерождению подвергаются герминативные лимфоидные B-клетки, которые происходят из зародышевого центра фолликула лимфатического узла.
Патогенез болезни Ходжкина представлен сложными изменениями на уровне транскрипционных факторов, TNF-белков, хемокинов, цитокинов. Утрата регуляторных механизмов апоптоза приводит к неконтролируемому размножению перерожденных B-лимфоцитов — одноклеточных клеток-предшественников Ходжкина и гигантских многоядерных клеток Рид-Березовского-Штернберга. Раковая пролиферация сопровождается ухудшением гуморального иммунитета и реактивным ответом в виде разрастания соединительной ткани. У большинства беременных с лимфогранулематозом прогрессирует недостаточность T-клеточного иммунитета, что впоследствии приводит к развитию интеркуррентных бактериальных, вирусных, грибковых, протозойных инфекций, осложняющихся септическими состояниями.
Классификация
При систематизации вариантов лимфомы Ходжкина учитывают гистологические особенности неоплазии, стадию заболевания, выраженность интоксикационных явлений. Такой подход позволяет наиболее точно прогнозировать течение злокачественной гранулемы и предложить женщине оптимальное решение с учетом возможной пролонгации беременности. Исход заболевания и гестации во многом зависит от типа опухоли. Онкологи различают:
- Лимфогранулематоз с нодулярным склерозом. Определяется у 60,3% беременных со злокачественной гранулемой. Поражаются преимущественно лимфоузлы средостения, лимфоидная ткань делится на отдельные участки («узлы») фиброзными тяжами. Заболевание обычно имеет благоприятный прогноз. В препарате определяются классические многоядерные и лакунарные клетки.
- Смешанноклеточный вариант болезни Ходжкина. При беременности диагностируется у 32,8% заболевших пациенток, протекает менее благоприятно. Как правило, в процесс вовлечены несколько групп лимфоузлов в разных областях, выражена общеклиническая симптоматика. Гистологически проявляется полиморфизмом клеточных элементов.
- Лимфоидное истощение. Редкий неблагоприятный вариант лимфогранулематоза у беременных. Выявляется в 1,4% случаев. Характерна диссеминация онкоклеток с экстралимфатическими повреждениями и значительным угнетением иммунитета. В биоптате присутствуют пласты малигнизированных клеток и фиброзные тяжи, отсутствует нормальная лимфоидная ткань.
Низкопрогредиентная и прогностически наиболее благоприятная лимфома с лимфоидным преобладанием (лимфогистиоцитарный вариант заболевания) и недифференцированные типы неоплазии при гестации возникают крайне редко. При разработке тактики сопровождения беременности акушеры-гинекологи обязательно учитывают стадию онкологического процесса. С учётом количества и локализации поражённых областей, структур (селезенки, вилочковой железы, лимфатического окологлоточного кольца, пейеровых бляшек, аппендикса), экстранодулярных тканей, выраженности клинических симптомов, размеров неоплазии различают 4 стадии болезни Ходжкина. В целом прогноз беременности ухудшается по мере прогрессирования заболевания.
Симптомы ЛХ у беременных
В большинстве случаев первым признаком лимфогранулематоза являются увеличенные безболезненные плотноэластичные лимфатические узлы, которые не спаяны с окружающими тканями и могут образовывать конгломераты. У 70-75% пациенток поражаются шейная и надключичная области, у 15-20% — подмышечная и средостение, у 10% — пах. Позднее всего выявляется поражение медиастинальных лимфоузлов, которые при значительном увеличении сдавливают бронхолегочную ткань, вызывая кашель и затруднение дыхания. Возможно возникновение генерализованного кожного зуда и транзиторной болезненности пораженных лимфоузлов после приема алкоголя.
У 20-30% беременных с ходжкинской лимфомой III-IV стадии выявляются системные общеинтоксикационные симптомы — беспричинное повышение температуры более 38° С, профузные ночные поты, снижение веса на 10% и более, ухудшение аппетита, слабость, что служит прогностически неблагоприятным признаком. У части пациенток отмечаются тяжесть и распирание в левом подреберье, свидетельствующие об увеличении селезенки. При вовлечении в процесс печени часто возникает желтуха, при сдавливании сосудов пораженными паховыми и тазовыми лимфоузлами отекают нижние конечности. У женщин с компрессией верхних дыхательных путей определяются хрипы и одышка. В редких случаях возникают невралгии, паралич верхних или нижних конечностей с утратой двигательной функции, нарушение глотания и речи.
Осложнения
Осложненное течение беременности определяется у 64,7% женщин с лимфомой Ходжкина. Наиболее часто гестация осложняется вирусно-бактериальными инфекциями. У 19,6% беременных обостряется герпетическая инфекция, из них у 10,8% определяется генитальный герпес, у 9,8% часто возникают ОРВИ, у 8,8% наблюдается гестационный пиелонефрит или рецидивирует хронический пиелонефрит. У 18,6% пациенток выявляется анемия. Угроза прерывания беременности в одном или всех трех триместрах диагностируется у 30,4% заболевших, гестозы — почти у 20%. Частота развития фетоплацентарной недостаточности составляет 8,8%, задержки развития плода — 2,9%, у новорожденного возможны нейтропения и тромбоцитопения.
Медикаментозное и лучевое лечение лимфогранулематоза на протяжении первых 2 недель после зачатия провоцирует спонтанный выкидыш. В период органогенеза (на 2-8 неделях гестации) препараты с низкой молекулярной массой индуцируют врожденные аномалии развития, начиная с 3-го месяца гестационного срока – вызывают задержку роста плода. Частота тяжелых полиорганных пороков при проведении полихимиотерапии в 1 триместре беременности достигает 10-25%. Вероятность радиационно-индуцированных генетических дефектов увеличивается на 1% с каждым 1 Гр поглощенной дозы ионизирующего излучения. Экранирование брюшной полости позволяет уменьшить риск мутагенеза вдвое. У женщин после химиолучевой терапии частота последующих многоплодных беременностей достигает 12%, что в 10-20 раз выше по сравнению с общей популяцией.
Диагностика
При рецидиве лимфомы Ходжкина постановка диагноза не представляет особых трудностей. Однако даже в случае первичного заболевания, несмотря на ограниченное применение исследований с использованием ионизирующего излучения (компьютерной томографии, лимфангиографии), современные методы диагностики позволяют вовремя выявить лимфогранулематоз и корректно установить его стадию. Наиболее информативными методами являются:
- Магнитно-резонансная томография. При обнаружении лимфаденопатии МРТ по информативности сопоставима с КТ, однако несколько хуже определяет пораженные узлы в средостении. Трехмерная визуализация органов грудной и брюшной полости, забрюшинного пространства, таза, мягких тканей, сосудов дает возможность точно установить распространенность патологического процесса. При необходимости выполняется МРТ всего тела.
- Ультразвуковое исследование. Эхография — наиболее безопасный метод обследования для беременной и плода. УЗИ брюшной полости и забрюшинного пространства назначают при подозрении на злокачественное перерождение забрюшинных лимфоузлов. Для корректного определения стадии болезни производят УЗИ селезенки, которая может вовлекаться в онкопроцесс. При поверхностном расположении проводят УЗИ лимфатических узлов.
- Рентгенологическое исследование. Рентгенография ОГК в двух проекциях применяется ограниченно при возможном поражении внутригрудных (медиастинальных) лимфоузлов. Для исключения негативного влияния на плод обязательно экранируется брюшная полость. При наличии показаний выполняется КТ грудной полости без использования контраста.
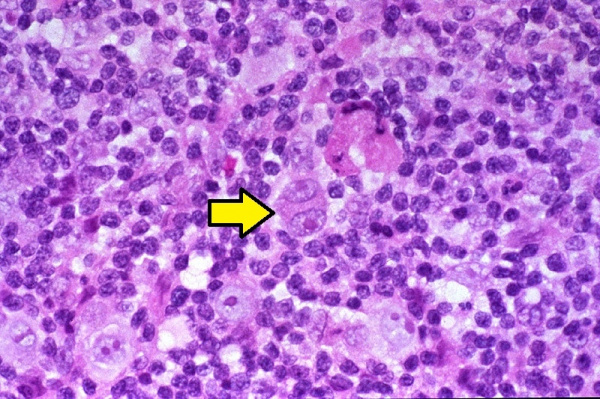
- Гистологическое исследование биоптата. Достоверными маркерами лимфогранулематоза являются опухолевые клетки — одноядерные Ходжкина и многоядерные Рид-Штернберга. В зависимости от гистологического варианта заболевания они могут быть единичными, располагаться очагами между фиброзными тяжами или полностью замещать нормальную лимфоидную ткань. В препарате также могут присутствовать лакунарные клетки.
В общем анализе крови обычно отсутствуют какие-либо специфические изменения, повышение СОЭ свидетельствует о неблагоприятном течении процесса. При наличии экстранодулярных симптомов лимфомы показано определение уровней щелочной фосфатазы, АлТ, АсТ, креатинина, общего белка, других лабораторных маркеров поражения печени и почек, биопсия костного мозга. Болезнь Ходжкина у беременных дифференцируют с вирусными лимфаденитами при краснухе, кори, инфекционном мононуклеозе, цитомегаловирусной инфекции, паразитарными поражениями лимфоузлов (токсоплазмозом, гистоплазмозом, эхинококкозом, дирофиляриозом, лейшманиозом), лейкозами, неходжкинскими лимфомами, туберкулезом, саркоидозом, раком легких. По показаниям пациентку кроме акушера-гинеколога и онкогематолога консультируют инфекционист, фтизиатр, пульмонолог, онколог, гастроэнтеролог, невропатолог, неонатолог.
Лечение ЛХ у беременных
При выборе терапевтической тактики учитывают агрессивность неоплазии, гестационный срок, желания пациентки. Вне зависимости от формы и стадии опухоли может быть принято одно из трех возможных решений: прерывание беременности, выжидательно-наблюдательный подход, активное противоопухолевое медикаментозно-лучевое лечение по общим принципам. В соответствии с рекомендациями Министерства здравоохранения и социального развития России, медицинский аборт до 12-недельного срока рекомендован больным с лимфомой 3-4-й стадии. На более поздних сроках при агрессивном течении онкопроцесса вопрос прерывания гестации решается консилиумом с учетом мнения беременной и ее родственников.
При индолентном (медленно прогрессирующем) нодулярном склерозе IA-IIA стадий возможно успешное ведение большинства пациенток без назначения лечения на протяжении некоторого времени. В таких случаях беременность пролонгируется до достижения плодом жизнеспособности, обеспечивается регулярный УЗИ- или МРТ-контроль, а терапия болезни Ходжкина откладывается до II-III триместров и даже на послеродовый период. Женщинам с массивным поражением, наличием общеклинической B-симптоматики, экстранодулярным поражением, поддиафрагмальным распространением процесса, быстрым прогрессированием лимфогранулематоза назначаются:
- Химиотерапия. До II триместра предпочтительна монохимиотерапия алкалоидными цитостатиками. Далее применяется протокол ABVD без алкилирующих препаратов либо CHOP-подобные режимы. При рефрактерных формах болезни Ходжкина и рецидиве заболевания после I триместра возможно назначении более активных MOPP и MOPP-подобных схем. Миелосупрессивное лечение должно быть завершено не позднее, чем за 3 недели до предполагаемых родов.
- Радиотерапия. Обычно лучевую терапию откладывают до конца гестации, но не дольше 9 недель после последней химиотерапии. При клинически диагностированном химиорезистентном лимфогранулематозе или невозможности проведения химиотерапии выполняется облучение мантиевидными либо мини-мантиевидными полями, обеспечивается защита плода с помощью свинцового фартука. Суммарная полученная доза не должна превышать 10 Гр.
B-клеточная лимфома не является показанием для оперативного родоразрешения. При отсутствии акушерских противопоказаний беременность завершают естественными родами. Больным с выраженной постхимиотерапевтической тромбоцитопенией (менее 100∙10 9 /л) из-за повышенного риска образования пункционных гематом противопоказаны спинальная и эпидуральная анальгезия. Кесарево сечение может производиться при наличии осложнений противоопухолевой терапии — постлучевого кардиофиброза, сердечно-легочной недостаточности II-III степени, патологических переломов поясничных позвонков, асептического некроза тазобедренного сустава. Пациенткам в состоянии ремиссии не противопоказано грудное вскармливание, при активной лимфоме лактацию рекомендуется подавить.
Прогноз и профилактика
По данным исследований, гестация и ее сохранение не влияют на течение лимфогранулематоза. Применение полихимиотерапии самостоятельно или в комбинации с лучевой терапией позволяет достичь излечения у 70-80% беременных с впервые выяв ленной лимфомой Ходжкина. Прогностически неблагоприятными признаками являются массивное поражение лимфоузлов средостения, вовлечение в процесс 3 и более областей (лимфоидных структур), наличие экстралимфатических поражений, значительное ускорение СОЭ (при отсутствии общеклинических симптомов — свыше 50 мм/ч, а при их наличии — свыше 30 мм/ч).
Пациенткам, получавшим противолимфогранулематозное лечение, рекомендуется воздержаться от зачатия в течение 3 лет после завершения терапии. Менструальная функция, которая часто нарушается после применения химиопрепаратов, обычно восстанавливается за 2-3 года. Если больной назначались протоколы с использованием больших доз глюкокортикоидов, перед планируемой беременностью желательно провести денситометрию для исключения остеопении или остеопороза. Беременных, пролеченных по поводу злокачественной гранулемы, относят в группу высокого акушерского риска. После постановки на учет в женской консультации их должен не менее 12 раз осмотреть онкогематолог (онколог). В связи с недостаточной изученностью этиологии специальных мер профилактики болезни Ходжкина не предложено.
1. Лимфома Ходжкина и беременность/ Скрябина Л.С., Россоха Е.И., Лазарева Д.Г., Задонцева Н.С., Нечунаева Т.Г.// Российский онкологический журнал. – 2015 - №4.
2. Беременность и лимфомы: тактика ведения беременности, принципы диагностики и лечения// Акушерство и гинекология, 2011 - №3.
3. Особенности течения беременности у женщин с лимфомой Ходжкина/ Комова Т.Д., Шмаков Р.Г., Демина Е.А.// Вестник РОНЦ им. Н. Н. Блохина РАМН. – 2008.
4. Тактика ведения беременности у женщин с онкогематологическими заболеваниями (часть i лимфопролиферативные заболевания)/ Шмаков Р.Г., Демина Е.А., Комова Т.Д., Пилова И.В.// Клиническая онкогематология. Фундаментальные исследования и клиническая практика. – 2009.
Лимфогранулематоз
Лимфогранулематоз - злокачественная гиперплазия лимфоидной ткани, характерным признаком которой является образование гранулем с клетками Березовского-Штернберга. Для лимфогранулематоза специфично увеличение различных групп лимфатических узлов (чаще нижнечелюстных, надключичных, медиастинальных), увеличение селезенки, субфебрилитет, общая слабость, похудание. С целью верификации диагноза осуществляется биопсия лимфоузлов, диагностические операции (торакоскопия, лапароскопия), рентгенография грудной клетки, УЗИ, КТ, биопсия костного мозга. В лечебных целях при лимфогранулематозе проводится полихимиотерапия, облучение пораженных лимфоузлов, спленэктомия.
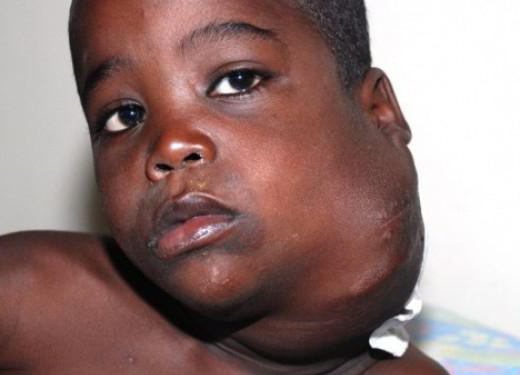
Лимфогранулематоз (ЛГМ) – лимфопролиферативное заболевание, протекающее с образованием специфических полиморфно-клеточных гранулем в пораженных органах (лимфоузлах, селезенке и др.). По имени автора, впервые описавшего признаки заболевания и предложившего выделить его в самостоятельную форму, лимфогранулематоз также называют болезнью Ходжкина, или ходжкинской лимфомой. Средний показатель заболеваемости лимфогранулематозом составляет 2,2 случая на 100 тыс. населения. Среди заболевших преобладают молодые люди в возрасте 20-30 лет; второй пик заболеваемости приходится на возраст старше 60 лет. У мужчин болезнь Ходжкина развивается в 1,5-2 раза чаще, чем у женщин. В структуре гемобластозов лимфогранулематозу отводится втрое место по частоте возникновения после лейкемии.
Причины лимфогранулематоза
Этиология лимфогранулематоза до настоящего времени не выяснена. На сегодняшний день в числе основных рассматриваются вирусная, наследственная и иммунная теории генеза болезни Ходжкина, однако ни одна из них не может считаться исчерпывающей и общепризнанной. В пользу возможного вирусного происхождения лимфогранулематоза свидетельствует его частая корреляция с перенесенным инфекционным мононуклеозом и наличием антител к вирусу Эпштейна-Барр. По меньшей мере, в 20% исследуемых клеток Березовского-Штернберга обнаруживается генетический материал вируса Эпштейна-Барр, обладающего иммуносупрессивными свойствами. Также не исключается этиологическое влияние ретровирусов, в т. ч. ВИЧ.
На роль наследственных факторов указывает встречаемость семейной формы лимфогранулематоза и идентификация определенных генетических маркеров данной патологии. Согласно иммунологической теории, имеется вероятность трансплацентарного переноса материнских лимфоцитов в организм плода с последующим развитием иммунопатологической реакции. Не исключается этиологическое значение мутагенных факторов - токсических веществ, ионизирующего излучения, лекарственных препаратов и других в провоцировании лимфогранулематоза.
Предполагается, что развитие лимфогранулематоза становится возможным в условиях Т-клеточного иммунодефицита, о чем свидетельствует снижение всех звеньев клеточного иммунитета, нарушение соотношения Т-хелперов и Т-супрессоров. Главным морфологическим признаком злокачественной пролиферации при лимфогранулематозе (в отличие от неходжкинских лимфом и лимфолейкоза) служит присутствие в лимфатической ткани гигантских многоядерных клеток, получивших название клеток Березовского-Рид-Штернберга и их предстадий – одноядерных клеток Ходжкина. Кроме них опухолевый субстрат содержит поликлональные Т-лимфоциты, тканевые гистиоциты, плазматические клетки и эозинофилы. При лимфогранулематозе опухоль развивается уницентрически - из одного очага, чаще в шейных, надключичных, медиастинальных лимфатических узлах. Однако возможность последующего метастазирования обусловливает возникновение характерных изменений в легких, ЖКТ, почках, костном мозге.
Классификация лимфогранулематоза
В гематологии различают изолированную (локальную) форму лимфогранулематоза, при которой поражается одна группа лимфоузлов, и генерализованную – со злокачественной пролиферацией в селезенке, печени, желудке, легких, коже. По локализационному признаку выделяется периферическая, медиастинальная, легочная, абдоминальная, желудочно-кишечная, кожная, костная, нервная формы болезни Ходжкина.
В зависимости от скорости развития патологического процесса лимфогранулематоз может иметь острое течение (несколько месяцев от начальной до терминальной стадии) и хроническое течение (затяжное, многолетнее с чередованием циклов обострений и ремиссий).
На основании морфологического исследования опухоли и количественного соотношения различных клеточных элементов выделяют 4 гистологические формы лимфогранулематоза:
- лимфогистиоцитарную, или лимфоидное преобладание
- нодулярно-склеротическую, или нодулярный склероз
- смешанно-клеточную
- лимфоидное истощение
В основу клинической классификации лимфогранулематоза положен критерий распространенности опухолевого процесса; в соответствии с ним развитие болезни Ходжкина проходит 4 стадии:
I стадия (локальная) – поражена одна группа лимфоузлов (I) либо один экстралимфатический орган (IE).
II стадия (регионарная) - поражены две или более группы лимфатических узлов, расположенных с одной стороны диафрагмы (II) либо один экстралимфатический орган и его регионарные лимфоузлы (IIE).
III стадия (генерализованная) – пораженные лимфоузлы расположены с обеих сторон диафрагмы (III). Дополнительно может поражаться один экстралимфатический орган (IIIE), селезенка (IIIS) либо они вместе (IIIE + IIIS).
IV стадия (диссеминированная) – поражение затрагивает один или несколько экстралимфатических органов (легкие, плевру, костный мозг, печень, почки, ЖКТ и др.) с одновременным поражением лимфоузлов или без него.
Для обозначения наличия или отсутствия общих симптомов лимфогранулематоза на протяжении последних 6 месяцев (лихорадки, ночной потливости, похудания) к цифре, обозначающей стадию болезни, добавляются буквы А или В соответственно.
Симптомы лимфогранулематоза
К числу характерных для лимфогранулематоза симптомокомплексов относятся интоксикация, увеличение лимфатических узлов и возникновение экстранодальных очагов. Часто заболевание начинается с неспецифических симптомов – периодической лихорадки с температурными пиками до 39°С, ночной потливости, слабости, похудания, кожного зуда.
Нередко первым «вестником» лимфогранулематоза служит увеличение доступных для пальпации лимфоузлов, которые больные обнаруживают у себя самостоятельно. Чаще это шейные, надключичные лимфатические узлы; реже - подмышечные, бедренные, паховые. Периферические лимфоузлы плотные, безболезненные, подвижные, не спаяны между собой, с кожей и окружающими тканями; обычно тянутся в виде цепочки.
У 15-20% пациентов лимфогранулематоз дебютирует с увеличения лимфоузлов средостения. При поражении медиастинальных лимфоузлов первыми клиническими признаками болезни Ходжкина могут служить дисфагия, сухой кашель, одышка, синдром ВПВ. Если опухолевый процесс затрагивает забрюшинные и мезентериальные лимфоузлы, возникают абдоминальные боли, отеки нижних конечностей.
Лимфома ЦНС
Лимфома центральной нервной системы — редкое новообразование, поражающее ткани головного и спинного мозга, заднюю стенку глаза. Клиническая картина зависит от локализации процесса, включает общемозговые симптомы, парезы, нарушения координации, расстройства зрения. Диагностика осуществляется с применением методов нейровизуализации, анализа спинномозговой жидкости, гистологического исследования биоптата. В лечении активно используется терапия химиопрепаратами, облучение мозга и их сочетание. При одиночном характере опухоли возможно нейрохирургическое вмешательство.
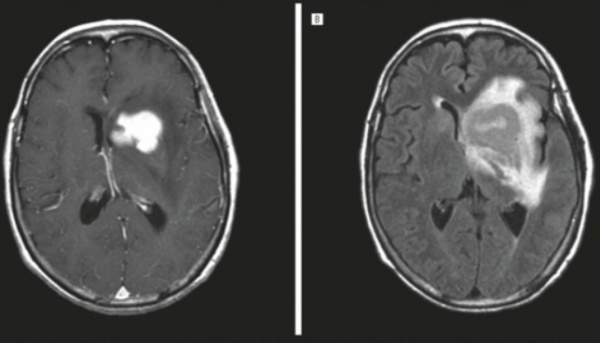

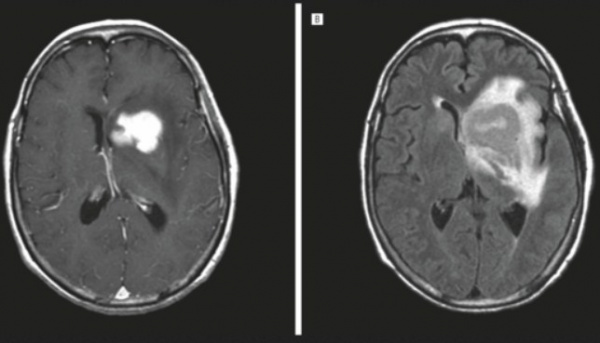
Лимфома ЦНС впервые выделена в отдельную нозологию в 1974 г. Относится к злокачественным новообразованиям, составляет около 4% опухолей центральных органов нервной системы. По статистическим данным, распространенность патологии находится на уровне 0,5-0,75 случая на 100 тысяч пациентов. Последнее время наблюдается увеличение заболеваемости, связанное с ростом иммуносупрессивных состояний. Риск возникновения лимфомы ЦНС у больных СПИДом составляет 4-6%, при врожденном иммунодефиците — 4%. Средний возраст заболевших среди иммунокомпетентных лиц — 62 года. Возрастная медиана у пациентов с врожденным иммунодефицитом составляет 10 лет. Гендерная предрасположенность не наблюдается.
Этиология возникающих в ЦНС лимфом не определена. У иммунокомпрометированных пациентов выявляют следы вируса Эпштейна-Барр и герпеса VI типа, также характерных для лимфоидных опухолей другой локализации. Однако роль данных вирусов в возникновении заболевания не доказана. Ведется дальнейший поиск триггеров, обуславливающих появление патологических, активно делящихся лимфоцитов. Среди установленных факторов риска выделяют следующие иммуносупрессивные состояния:
- Наследственные иммунодефициты: синдром Луи-Бар, синдром Вискотта–Олдрича, селективный дефицита Ig A и другие.
- ВИЧ-инфекция: у больных поражается Т-клеточная составляющая иммунитета.
- Аутоиммунная патология: системная красная волчанка, ревматоидный артрит.
- Состояния после трансплантации: иммуносупрессия создается медикаментозно для предотвращения реакции отторжения трансплантата.
Большинство лимфом ЦНС являются экстранодулярными, первично развивающимися в церебральных тканях без предварительного образования в лимфатическом узле. С целью объяснения их возникновения в нервной ткани, не имеющей лимфоидных образований, были выдвинуты 2 гипотезы. Первая предполагает проникновение лимфоцитов в мозговые структуры под действием неких триггеров, которыми могут служить вирусные инфекции. Попадая в нервные структуры, лимфоциты изменяют свои свойства и дают начало патологическому клеточному клону. Вторая гипотеза предполагает формирование опухолевого лимфоцитарного клона в отдалении, с последующей миграцией в ЦНС.
90% лимфом ЦНС состоят из трансформированных В-лимфоцитов. В большинстве случаев предшественниками опухолевых клеток являются В-лимфоциты герминогенного центра, реже — постгерминогенные активированные лимфоциты. В ряде случаев патологические лимфоциты пропитывают стенки церебральных сосудов, давая картину васкулита.

Единая классификация лимфом ЦНС не разработана. В современной клинической нейроонкологии новообразования разделяют морфологически, по характеру распространения и расположению.
- По иммунофенотипу подавляющее большинство образований представляют собой неходжкинские лимфомы. Лимфома Ходжкина, лимфобластные и Т-клеточные лимфомы наблюдаются значительно реже.
- По распространенности процесса в ЦНС образования могут быть одиночными, инфильтративными и множественными.
- По локализации различают церебральные и спинномозговые лимфомы. Первые составляют подавляющее большинство и классифицируются на полушарные, лептоменингеальные, лимфомы мозолистого тела. Поражения спинного мозга составляют менее 1%.
Симптомы лимфомы ЦНС
Клиническими проявлениями выступают неспецифические общемозговые и очаговые симптомы. У большинства больных заболевание манифестирует признаками поражения ЦНС в виде головных болей, психоневрологических изменений, сонливости и расстройств сознания. Возможны когнитивные нарушения, дискоординация. Эписиндром возникает в 10% случаев. У трети больных отмечаются симптомы интракраниальной гипертензии: интенсивные цефалгии, тошнота, чувство «тяжести» на глазах. Расположение очагов в задних отделах глазного яблока сопровождается зрительной дисфункцией, экзофтальмом, офтальмоплегией.
Спинномозговая форма проявляется мышечной слабостью, выпадением двигательной функции с последующим присоединением сенсорных нарушений и болевого синдрома. Лептоменингеальное поражение протекает с сенсомоторными расстройствами лицевой области, корешковым синдромом с локализацией в люмбосакральном отделе. Наблюдается нижний парапарез, расстройство мочеиспускания, гидроцефалия. Типичные для лимфом другой локализации подъемы температуры тела, потливость, снижение массы тела не наблюдаются.
Являясь объемным образованием, лимфома ЦНС по мере роста приводит к масс-эфекту с повышением ликворного давления и гидроцефалией. Последняя опасна дислокацией мозга с ущемлением его тканей. Локализуясь по ходу мозговых сосудов и прорастая их, опухоль может приводить к нарушению целостности сосудистой стенки и геморрагическому инсульту. Возможна диссеминация опухолевых клеток с образованием вторичных очагов в ЦНС.
Выявление общемозговых симптомов и очаговых выпадений в неврологическом статусе позволяет врачу-неврологу заподозрить новообразование ЦНС и его предположительную локализацию. Подтверждение диагноза возможно по результатам нейровизуализирующих обследований, для верификации опухоли требуется морфологическое исследование. В перечень необходимых обследований при подозрении на лимфому входит:
- Нейровизуализация. Церебральная КТ или МРТ позволяют оценить размер и расположение новообразования, степень дислокации серединных структур. В пользу лимфомы ЦНС говорит многоочаговость процесса, кольцевидное контрастирование, значительный перифокальный отек.
- Офтальмологическое обследование. Необходимо больным, имеющим зрительные расстройства. Выявляет экзофтальм, повышенное внутриглазное давление, застойные явления при офтальмоскопии.
- КТ всего тела. Необходимо для поиска первичного очага, локализующегося вне ЦНС. Его обнаружение свидетельствует о вторичном характере мозговой лимфомы.
- Исследование цереброспинальной жидкости. Забор материала производиться путем спинномозговой пункции. В половине случаев в ликворе определяется повышение белка, плеоцитоз с большим количеством реактивных лимфоцитов, наличием опухолевых клеточных элементов.
- Гистологическое исследование. Забор тканей опухоли предпочтительно производить путем стереотаксической биопсии, позволяющей минимизировать опасность диссеминации. При микроскопии типичная цитологическая картина представлена скоплением патологически трансформированных лимфоидных клеток со светлыми ядрами, окруженных зрелыми лимфоцитами. Иммунофенотипирование лимфомы ЦНС позволяет установить ее гистологический тип, степень зрелости клеток, спрогнозировать развитие заболевания.
Дифференциальная диагностика
Необходимо дифференцировать лимфому ЦНС с другими объемными образованиями:
- глиобластомой;
- абсцессом;
- церебральными метастазами.
Дифференцировка осуществляется по характерным особенностям МРТ. Для глиобластомы типичны некротические очаги центральной локализации, отсутствующие у лимфомы. С целью исключения метастатического характера новообразования производится поиск первичной опухоли экстраневральной локализации. Церебральный абсцесс характеризуется четким контуром. Лимфому ЦНС следует также отличать от нейросаркоидоза, лейкоэнцефалопатии, демиелинизирующих заболеваний, в пользу которых будет свидетельствовать диффузно-многоочаговый характер поражения.

Лечение лимфомы ЦНС
Консервативная терапия
Лимфомы чувствительны к химиотерапии и облучению. Текущие рекомендации по лечению основаны на нескольких проспективных исследованиях, однако в связи с редкой встречаемостью опухоли последние имеют небольшой размер выборки. Терапия осуществляется индивидуально в соответствии с характером поражения, возрастом пациента, преморбидным фоном. К наиболее популярным методикам относятся:
- Монотерапия цитостатиками. Проводится одним цитостатическим препаратом. Приводит к полной ремиссии у 30-40% больных. Побочными эффектами выступает почечная, печеночная недостаточность, гематологические нарушения, пневмонит.
- Комбинированная химиотерапия. Применение сочетания двух цитостатиков, способных проникать через гематоэнцефалический барьер, дает лучший ответ на терапию. К недостаткам метода относится его высокая токсичность.
- Лучевая терапия. Фракционное облучение мозга у большинства больных приводит к быстрой ремиссии. Однако, характерно раннее возникновение рецидивов. Средняя продолжительность жизни пациентов составляет 1-1,5 года.
- Сочетанная терапия. Лечение включает химио- и радиотерапию. Данное сочетание позволяет продлить жизнь пациента, но обладает высокой нейротоксичностью, приводящей к лейкоэнцефалопатии с кортикальной атрофией. В таких случаях наблюдаются тяжелые когнитивные нарушения, нарушения походки, недержание мочи, возникает необходимость ухода за больным.
Хирургическое лечение
Резекция может улучшить выживаемость без прогрессирования у пациентов с одиночными поражениями. Диффузное прорастание лимфомы ЦНС в окружающие ткани, ее локализация в глубинных церебральных структурах делает нейрохирургическое лечение малоэффективным. Оперативное вмешательство может способствовать распространению опухолевых лимфоцитов с возникновением множественных рецидивов. Медиана выживаемости таких больных после оперативного лечения без применения других методов не превышает 4 месяца.
Экспериментальное лечение
Возможно применение иммунотерапии ингибиторами контрольных точек. В современной нейроонкологии рассматривается использование препаратов, препятствующих передаче сигналов В-клеточного рецептора и таким образом влияющих на пролиферацию клеток лимфомы, Препараты первой группы были связаны со значительной токсичностью у некоторых пациентов. Пришедшие им на смену средства менее токсичны, но и менее активны. В настоящее время ведется поиск способов повышения их активности.
Лимфома ЦНС представляет собой высокозлокачественное новообразование со средней выживаемостью от недель до месяцев, если лечение является только симптоматическим. При противоопухолевой терапии 5-летняя выживаемость составляет 31%. Пожилой возраст, плохое клиническое состояние, повышенный уровень белка в спинномозговой жидкости, вовлечение глубоких церебральных отделов, спинальное поражение связаны с более неблагоприятным прогнозом. Профилактика сводится к предупреждению и своевременному лечению приводящих к иммунодефициту заболеваний.
1. Первичные лимфопролиферативные заболевания центральной нервной системы/ Губкин А.В., Звонков Е.Е., Кременецкая В.А. и др.// Клиническая онкогематология. - 2008. - 4(1).
2. Современные представления об этиологии, патогенезе, диагностике и методах лечения первичной диффузной В-клеточной крупноклеточной лимфомы центральной нервной системы/ С.В. Волошин, Ю.А. Криволапов, А.В. Шмидт, В.А. Шуваев, М.С. Фоминых, К.М. Абдулкадыров// Онкогематология. - 2013. - 2.
3. The Diagnosis and Treatment of Primary CNS Lymphoma/ von Baumgarten L, Illerhaus G, Korfel A, Schlegel U, Deckert M, Dreyling M.// Deutsches Arzteblatt international. - 2018. - 115(25).
4. Primary CNS Lymphoma/ Grommes, C., DeAngelis, L. M.// Journal of clinical oncology : official journal of the American Society of Clinical Oncology. - 2017. - 35(21).
Читайте также:
