Симптомы синдрома Пламмера-Винсона и его лечение
Добавил пользователь Alex Обновлено: 27.01.2026
Кафедра факультетской хирургии №1 ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва, Россия
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Россия
ГБУЗ «НИИ скорой помощи им. Н.В. Склифосовского» Департамента здравоохранения Москвы, Москва
- SPIN РИНЦ: 4591-3844
- Scopus AuthorID: 57022352600
- ResearcherID: M-2090-2018
- ORCID: 0000-0003-1327-6973
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2013;(10): 46‑49
Черноусов А.Ф., Ветшев Ф.П., Хоробрых Т.В., Рогаль М.М. Синдром Пламмера-Винсона. Хирургия. Журнал им. Н.И. Пирогова. 2013;(10):46‑49.
Chernousov AF, Vetshev FP, Khorobrykh TV, Rogal MM. The Plammer-Vinson syndrome. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2013;(10):46‑49. (In Russ.).
Синдром Пламмера-Винсона (сПВ) определяется классической триадой симптомов - дисфагией, железодефицитной анемией и стриктурой пищевода. Несмотря на редкость cПВ, своевременность диагностики крайне важна: известно, что заболевание сопряжено с высоким риском развития плоскоклеточного рака шейного отдела пищевода.
Другое название этого патологического состояния - синдром Паттерсона-Браун-Келли, принятое в честь британских ларингологов Дональда Росса Паттерсона (Donald Ross Paterson, 1863-1939 гг.) и Адама Браун-Келли (Adam Brown-Kelly, 1865-1941 гг.), которые в 1919 г. независимо друг от друга описали характерные клинические признаки этого синдрома [13, 25]. Несмотря на то что Д.Р. Паттерсон дал наиболее полное определение выявленного синдрома, он не упоминал анемию.
Точных данных о распространенности и частоте сПВ до настоящего времени нет. В первой половине XX века считали, что сПВ обычно характерен для людей белой расы из северных стран, при этом чаще болеют женщины среднего возраста [34]. Сегодня пациентов с подобным заболеванием можно встретить крайне редко. Например, из 1000 наблюдений, в которых выполнили кинерадиографическое исследование глотки и шейного отдела пищевода, стриктуры были обнаружены в 5,5%, но только у 6 больных была дисфагия и ни одно из этих наблюдений в полной мере не отвечало критериям сПВ [23].
В последнее время в литературе можно найти лишь отдельные клинические наблюдения. Раньше сПВ часто выявляли в Скандинавских странах, особенно среди сельского населения Швеции. Прогрессивное уменьшение частоты синдрома многие связывают с улучшением питания и коррекцией железодефицитной анемии в странах, где ранее часто выявляли сПВ [3]. Даже в Африке, где алиментарная железодефицитная анемия и недоедание - это подчас обычные явления, сПВ встречается крайне редко.
Основными клиническими проявлениями синдрома считают посткрикоидную дисфагию, мембранозные («пленочные») стриктуры верхних отделов пищевода и железодефицитную анемию. Большинство больных составляют белые женщины 40-70 лет, однако в литературе также описано заболевание у детей и подростков [1, 10, 16, 20, 34]. Дисфагия, как правило, безболезненная, временная или прогрессирующая в течение нескольких лет, что является ограничивающим фактором в приеме твердой пищи и приводит к потере в массе тела. В клинической картине могут доминировать симптомы, характерные для анемии, - слабость, бледность, усталость и тахикардия. Среди симптомов иногда присутствуют глоссит, угловой хейлит и койлонихия (ложкообразные ногти). Спленомегалия и увеличение щитовидной железы также могут быть проявлениями, характерными для сПВ [10].
Синдром Пламмера-Винсона был идентифицирован как фактор риска развития плоскоклеточного рака верхних отделов желудочно-кишечного тракта. Мембранозные стриктуры пищевода состоят из тонких складок слизистой с некоторыми изменениями, распространяющимися до слизистой полости рта. Эти изменения заключаются в атрофии эпителия или гиперкератозе и могут быть причиной высокой заболеваемости (более 16%) злокачественными опухолями дыхательной и пищеварительной систем. Известно, что у 3-15% женщин 15-50 лет, больных сПВ, развивается рак глотки или пищевода [8, 27]. Уменьшение частоты рака этой локализации у женщин, возможно, связано с уменьшением частоты сПВ [31].
У всех больных диагностирована железодефицитная анемия со средним показателем гемоглобина 82 г/л. Наиболее частыми сопутствующими заболеваниями были целиакия (n=6) [8, 12, 17, 19, 27], меноррагия (n=5), а также грыжа пищеводного отверстия диафрагмы с хроническим желудочно-кишечным кровотечением неясного генеза (n=3) [4, 12, 14, 22, 35, 36]. Одна пациентка была многорожавшая, у другой диагностирован ревматоидный артрит и еще у одной была лимфангиоматозная макроглоссия [2, 4, 18]. Две пациентки получали трансфузию эритроцитной массы, все остальные принимали препараты железа. Подавляющему большинству больных проводили дилатацию стриктур пищевода (n=20) и лишь в одном наблюдении стриктура была ликвидирована с помощью эндоскопических щипцов [17]. Одной больной была выполнена микроларингохирургическая операция с резекцией стриктуры [16]. У всех больных проведенное лечение позволило ликвидировать дисфагию. Однако в 2 наблюдениях был диагностирован плоскоклеточный рак шейного отдела пищевода [12, 27], в третьем - рак желудка при контрольном обследовании через год после проведенного лечения [14]. Со времени первого упоминания сПВ было описано лишь 2 наблюдения рака желудка у этих больных [15, 22].
Диагноз основывают на лабораторных показателях - доказанной железодефицитной анемии (уровень гемоглобина, гематокритное число, средний объем числа эритроцитов, железо сыворотки, ферритин, трансферрин, повышение железосвязываюшей способности сыворотки крови) и посткрикоидной дисфагии, обусловленной одной или более стриктурами пищевода. Стриктуры могут быть диагностированы при рентгенографии, а также при ЭГДС [4, 10]. Как правило, эндоскопически стриктуры гладкие, тонкие, серые с эксцентричным или центральным входом, типично расположены в проксимальных отделах пищевода и могут быть пропущены и случайно разорваны, если эндоскоп не введен под достаточным контролем при прямой визуализации [10].
Поскольку дисфагия является основным клиническим признаком сПВ, дифференциальная диагностика должна быть направлена на исключение других заболеваний, вызывающих дисфагию. В перечень дифференциально-диагностического поиска необходимо включать рак пищевода, дивертикулы пищевода, нервно-мышечные заболевания пищевода (ахалазия, кардиоспазм, диффузный эзофагоспазм), склеродермию, пептические и ожоговые стриктуры, грыжу пищеводного отверстия диафрагмы, сдавливающие пищевод образования средостения.
Этиология и патогенез синдрома Пламмера-Винсона неизвестны. Вероятно, основным возможным этиологическим фактором является дефицит железа. Известно, что железодефицитная анемия - это неотъемлемая составляющая триады симптомов наряду с дисфагией и стриктурами пищевода, а восполнение дефицита железа уменьшает проявления дисфагии [5, 6]. Доказано, что развитие железодефицитной анемии предшествует дисфагии [5]. В то же время масштабные клинические исследования показали, что у многих больных дефицит железа не является основной причиной формирования стриктур пищевода. Другие этиологические факторы, включая недоедание, генетическую предрасположенность или даже аутоиммунные процессы, также неоднократно рассматривали в качестве возможных причин развития заболевания. Основано это было на довольно частом сочетании синдрома Пламмера-Винсона с аутоиммунными заболеваниями (целиакия, аутоиммунный тиреоидит, ревматоидный артрит) [8, 12, 17, 19, 21, 27, 30].
Наиболее простыми и эффективными способами лечения заболевания являются восполнение дефицита железа и дилатация стриктуры пищевода. Как правило, прием препаратов железа купирует основные клинические проявления синдрома [10]. При выраженной дисфагии, обусловленной значимым сужением пищевода, необходимо прибегать к механическому расширению бужированием или дилатации. Согласно данным литературы, одного сеанса дилатации бывает достаточно для ликвидации дисфагии, однако рекомендуется проведение нескольких сеансов во избежание быстрого рецидива стриктуры [7].
Приводим собственные клинические наблюдения.
Больная Р., 48 лет, госпитализирована с жалобами на затруднение прохождения твердой и жидкой пищи по пищеводу, чувство тяжести за грудиной, ощущение застревания пищевого комка в области шеи, выраженную слабость, приступы сердцебиения, осиплость голоса, одышку при физической нагрузке. В 2006 г. при плановом обследовании была диагностирована железодефицитная анемия, гемоглобин 75 г/л. Проведенная тогда же ЭГДС позволила выявить лишь признаки хронического атрофического гастрита. С этого момента пациентка самостоятельно бессистемно принимала препараты железа без выраженного эффекта. Признаки дисфагии впервые появились лишь спустя 3 года, однако за медицинской помощью больная обратилась лишь в июне 2011 г. В анализах крови была выявлена хроническая гипохромная железодефицитная анемия (гемоглобин 77,9 г/л, цветовой показатель 0,49, гематокритное число 26,62%, средний объем клетки 56,3 мкм 3 ) и сидеропения (железо 4,3 мкмоль/л, насыщение железом 5,5%, ферритин 3 мкг/л, трансферрин 3,07 г/л). Полипозиционная рентгенография: в шейном отделе пищевода на уровне C6 участок циркулярного сужения протяженностью около 1-2 мм и диаметром до 3 мм (рис. 1). Рисунок 1. Рентгенограммы. а - короткая мембранозная стриктура шейного отдела пищевода больной Р., 48 лет. Рисунок 1. Рентгенограммы. б - баллонная дилатация стриктуры до полного расправления диаметром 2 см. Рисунок 1. Рентгенограммы. в - после дилатации. После приема густой взвеси бария явного супрастенотического расширения не выявлено. ЭГДС: устье пищевода проходимо, в шейном отделе пищевода просвет сужен до 2-3 мм, для аппарата непроходим. Выполнено два сеанса баллонной дилатации стриктуры под контролем рентгенотелевидения до максимального диаметра 2 см. Восполнен дефицит железа (космофер, ферлатум), уровень гемоглобина поднялся до 118 г/л.
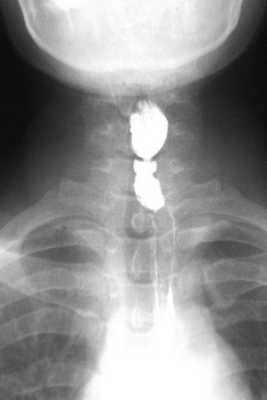
Больная Я., 39 лет, госпитализирована с аналогичными жалобами, среди которых превалировала дисфагия. В 2004 г. впервые обратила внимание на чувство дискомфорта и инородного тела в горле во время приема пищи, однако за медицинской помощью не обратилась. В течение последующих 5 лет клиническая картина нарастала: появилась выраженная слабость, быстрая утомляемость, прогрессировала дисфагия вплоть до затруднения прохождения жидкой пищи по пищеводу. Госпитализирована в хирургическое отделение, где при рентгенографии была выявлена короткая стриктура шейного отдела пищевода (рис. 2). Рисунок 2. Рентгенограмма. Короткая мембранозная стриктура шейного отдела пищевода больной Я., 39 лет. Общий анализ крови: гемоглобин 42,0 г/л, цветовой показатель 0,45, сидеропения (железо 10 мкг/дл, насыщение железом 2,1%). ЭГДС: устье пищевода проходимо, в шейном отделе пищевода просвет сужен до 3-4 мм, для аппарата непроходим, ткани в этом отделе рубцово изменены. Лечение начато с переливания эритроцитной массы. Последовательное применение препаратов железа (космофер, ферлатум, венофер, ферофольгамма) позволило поднять уровень гемоглобина крови до 115 г/л. Проведение трех сеансов баллонной дилатации стриктуры под контролем рентгенотелевидения до максимального расправления баллона (2 см) позволило ликвидировать стриктуру и проявления дисфагии.
Обе пациентки проходят регулярное обследование в течение более 3 лет. Регулярные курсовые приемы препаратов железа позволяют поддерживать гемоглобин на уровне 110-120 г/л. Лишь одной больной потребовался повторный сеанс баллонной дилатации стриктуры через 6 мес после проведенного лечения. В настоящее время проявления дисфагии у обеих пациенток купированы полностью. При рентгенографии и ЭГДС признаков сужения пищевода не выявлено.
Изложенное позволяет сделать заключение, что диагностика сПВ не вызывает серьезных затруднений, если врач обладает по сути элементарными сведениями о заболевании, т.е. осведомлен о триаде симптомов. В то же время лечение этой категории больных целесообразно проводить в стационарах, располагающих достаточным опытом и всем арсеналом современных диагностических и лечебных технологий. Крайне важно провести дифференциальную диагностику и исключить другие заболевания, проявлениями которых может быть дисфагия. Важно помнить, что целиакия, гигантская грыжа пищеводного отверстия диафрагмы, рак желудка, синдром Шегрена и пернициозная анемия могут быть причиной синдрома Пламмера-Винсона. В целом больные с сПВ хорошо поддаются лечению, однако нуждаются в динамическом наблюдении в течение многих лет.
Синдром Меллори-Вейса ( Желудочно-пищеводный разрывно-геморрагический синдром )
Синдром Меллори-Вейса — линейные разрывы слизистой кардиоэзофагеальной зоны, возникшие на фоне рвоты, позывов на рвоту, икоты. Проявляется наличием крови в рвотных массах, эпигастральными или загрудинными болями, артериальной гипотензией, тахикардией. Диагностируется с помощью эзофагогастроскопии, обзорной рентгенографии брюшной полости. Для лечения применяется гемостатическая, кровезаместительная терапия, противорвотные препараты, сердечные аналептики, ингибиторы протонной помпы, Н2-гистаминоблокаторы, антациды. При необходимости выполняется эндоскопический гемостаз, терапевтическая эмболизация, гастротомия для ушивания повреждений.
МКБ-10
Общие сведения
Впервые клиника разрывно-геморрагического синдрома была описана в 1929 году американскими патологами Дж.К. Меллори и С. Вейсом. В настоящее время заболевание является одной из ведущих причин неязвенных кровотечений из верхних отделов пищеварительного тракта. Распространенность патологии достигает 5-10%. Болезнь Меллори-Вейса выявляется преимущественно у 45-60-летних пациентов, злоупотребляющих спиртными напитками. У мужчин разрывы желудочной и пищеводной слизистой возникают в 7 раз чаще, чем у женщин. У 79-80% больных поражается эзофагогастральный переход, у 16-17% — стенка пищевода, у 3-5% — кардиальная оболочка. Длина разрывов обычно составляет 0,4-4,5 см. В 77-78% случаев повреждения являются единичными, в 22-23% — множественными.
Причины
Продольные разрывы слизистой в области пищеводно-желудочного перехода возникают при локальном повышении давления у пациентов со сниженной резистентностью эпителиального слоя. Предпосылками к развитию разрывно-геморрагического гастроэзофагеального синдрома служат патологические процессы, при которых повреждаются эпителиоциты или наблюдается повышенное кровенаполнение сосудов верхних отдела ЖКТ: асептическое воспаление слизистой при частом употреблении спиртных напитков, воспалительные заболевания ЖКТ (эзофагиты, гастриты), длительный прием НПВС, кортикостероидов, скользящая грыжа пищеводного отверстия диафрагмы, расширение пищеводных вен при портальной гипертензии у больных с гепатитами, жировым гепатозом, фиброзом, циррозом печени. Непосредственными причинами болезни Меллори-Вейса являются:
- Рвота, неукротимая икота. У 80-85% пациентов развитие рвоты связано с алкогольным опьянением. Провоцирующими факторами также становятся рвота беременных, диспепсические расстройства при патологии пищеварительного тракта (язвенной болезни, панкреатите, холецистите), отравления, уремия.
- Длительный интенсивный кашель. В редких случаях разрывно-геморрагический синдром провоцируется острыми и хроническими респираторными заболеваниями. Линейное повреждение слизистой пищевода, верхних отделов желудка может осложнить коклюш, ОРВИ, хронический бронхит, бронхиальную астму.
- Ятрогенные воздействия. Повреждение стенки пищевода, желудка возможно при грубом выполнении эндоскопических манипуляций (гастроскопии, эзофагогастродуоденоскопии), введении желудочного зонда. Иногда разрывы слизистой возникают при проведении сердечно-легочной реанимации.
В спорадических случаях повышение давления, приводящее к разрыву эпителиального слоя, вызывается другими факторами — подъемом тяжестей, интенсивными физическими нагрузками с резким напряжением мышц брюшного пресса, тупой травмой живота. Крайне редко заболевание осложняет течение судорожного синдрома при эпилепсии, опухолях головного мозга, энцефалопатиях, менингите, энцефалите, эклампсии.
Патогенез
Пусковым моментом разрыва пищеводно-желудочной слизистой обычно становится многократная рвота, резкое повышение абдоминального давления при переполненном желудке или кардиоэзофагеальном спазме, реже — прямые механические воздействия. Возникновение избыточного давления в кардиальном отделе желудка способствует перерастяжению стенки органа. При морфологической несостоятельности эпителия, вызванной воспалительными процессами, растянутая слизистая желудка, пищевода разрывается в наиболее истонченном или патологически измененном участке. Обычно разрыв распространяется не глубже эпителиального и подслизистого слоя. В тяжелых случаях повреждается мышечная, серозная желудочная либо адвентициальная пищеводная оболочки с выходом агрессивного содержимого в средостение или брюшную полость.
Классификация
- I стадия. Повреждение слизистой желудочно-пищеводного перехода и дистальной трети пищевода. Встречается у 36-37% пациентов. В большинстве случаев кровотечение прекращается спонтанно.
- II стадия. Дефекты расположены в той же зоне, однако их глубина достигает подслизистого слоя. Выявляется у 52-53% больных. Обычно проводится консервативная гемостатическая терапия.
- III стадия. Глубокие зияющие разрывы с вовлечением мышечной оболочки и интенсивным кровотечением. Наблюдаются в 9-11% случаев. Необходим эндоскопический или хирургический гемостаз.
- IV стадия. Редко диагностируемое тяжелое повреждение с разрушением всех оболочек гастроэзофагеального участка ЖКТ. Осложняется медиастинитом, перитонитом, пневмотораксом.
Симптомы синдрома Меллори-Вейса
Клинические проявления заболевания обычно развиваются на фоне многократной рвоты. Основным признаком синдрома является выделение ярко-красной крови с рвотными массами (гематемезис), которое может иметь различную интенсивность – от нескольких капель до профузного кровотечения. Возникает резкая боль в эпигастральной области или за грудиной. Вследствие кровопотери у больного формируется острый анемический синдром, для которого характерны головокружение, бледность кожных покровов, мелькание «мушек» перед глазами, падение артериального давления, значительное учащение сердцебиения. При массивном кровотечении возможна потеря сознания.
Осложнения
Острая кровопотеря при симптомокомплексе Меллори-Вейса может привести к развитию геморрагического шока с тяжелыми нарушениями микроциркуляции, изменениями реологических свойств крови, прогрессирующей гипоксией. При отсутствии лечения шок переходит в декомпенсированную стадию, сопровождающуюся полиорганной недостаточностью. Наиболее тяжелым осложнением синдрома является тотальный разрыв стенки брюшного отдела пищевода, распространяющийся выше уровня диафрагмы. При этом у пациента возникает приступ одышки, цианоз кожи, сильнейшие боли в грудной клетке. Такое осложнение, известное как синдром Бурхаве, в 20-40% случаев заканчивается летальным исходом. Попадание содержимого желудка в средостение, полость брюшины провоцирует развитие медиастинита, перитонита.
Диагностика
Постановка диагноза при синдроме Мэллори-Вейса может быть затруднена, что обусловлено стремительным нарастанием клинической картины и необходимостью оказания пациенту экстренной медицинской помощи. Диагностика заболевания предполагает комплексное инструментальное обследование пищеварительного тракта для выявления первопричины кровавой рвоты. Наиболее информативными являются:
- Эзофагогастроскопия. Введение гибкого эндоскопа через ротовую полость позволяет оценить состояние эпителиальной оболочки верхних отделов ЖКТ и обнаружить линейные разрывы, которые обычно локализованы в области перехода пищевода в желудок. С помощью визуального осмотра удается установить глубину поражения стенки пищевода или желудка.
- Обзорная рентгенография брюшной полости. Проведение рентгенологического исследования информативно при подозрении на разрыв полого органа. Основной признак перфорации – наличие свободного газа в полости брюшины (симптом «серпа»). На рентгенограмме также можно обнаружить другие болезни ЖКТ, которые являются первопричиной патологии Меллори-Вейса.
В клиническом анализе крови определяются изменения, характерные для анемического синдрома — уменьшения содержания эритроцитов и гемоглобина, снижение показателя гематокрита. Для исключения хронического кишечного кровотечения проводится реакция Грегерсена, позволяющая обнаружить скрытую кровь в кале. При выраженном диспепсическом синдроме может выполняться бактериологический посев кала для выявления патогенных микроорганизмов.
Дифференциальная диагностика синдрома осуществляется с легочным кровотечением, отеком легких, сердечной астмой, кровотечением из язвы желудка, варикозным расширением пищеводных вен, острым гастроэнтеритом, кишечными инфекциями, распадом опухоли желудка или пищевода, синдромом Рандю-Ослера. Кроме осмотра хирурга и гастроэнтеролога пациенту могут потребоваться консультации гематолога, инфекциониста, пульмонолога, кардиолога, гематолога, гепатолога.
Лечение синдрома Меллори-Вейса
Пациент подлежит неотложной госпитализации в хирургический стационар. На начальном этапе больному обеспечивается покой, холод на область желудка, при позывах на рвоту применяются блокаторы дофаминовых и серотониновых рецепторов с противорвотным эффектом. Назначается консервативное лечение и малоинвазивные манипуляции, направленные на остановку кровотечения, восполнение объема циркулирующей крови. При резком падении АД терапию дополняют введением средств для поддержания гемодинамики. Пациентам с болезнью Меллори-Вейса показаны:
- Инфузионная терапия. При умеренной кровопотере проводятся внутривенные вливания коллоидных и кристаллоидных растворов. При массивном кровотечении переливается эритроцитарная масса или взвесь, нативная и свежезамороженная плазма, реже — донорская кровь.
- Гемостатические препараты. Для медикаментозного гемостаза используют стимуляторы свертывающей системы крови. Эффективность кровоостанавливающей терапии повышается при парентеральном введении препаратов кальция, синтетических аналогов витамина К.
- Эндоскопический гемостаз. При продолжающемся кровотечении с помощью эндоскопа обкалывают место повреждения средствами с сосудосуживающим эффектом, вводят склерозанты, лигируют или клипируют сосуды. Возможно выполнение аргоноплазменной или электрокоагуляции.
- Терапевтическая эмболизация. Для прекращения кровотечения из поврежденных сосудов в них под контролем ангиографии вводят смесь эмболов с физиологическим раствором. Альтернативным методом является редко применяемое внутриартериальное вливание жировых суспензий.
Баллонная зондовая тампонада используется ограниченно из-за возможного усугубления разрывов. Важным условием быстрого восстановления поврежденной стенки является угнетение желудочной секреции при помощи ингибиторов протонной помпы, блокаторов Н2-гистаминорецепторов. Прием секретолитиков дополняют назначением невсасывающихся антацидов, препаратов коллоидного висмута. Хирургические методы лечения геморрагического разрывного синдрома показаны при неостанавливающихся или рецидивирующих кровотечениях, глубоких дефектах, полном разрыве пищеводной или желудочной стенки. Рекомендованным вмешательством является гастротомия с прошиванием надрывов, кровоточащих сосудов, ушиванием дефектов, иногда — перевязкой левой желудочной артерии.
Прогноз и профилактика
Исход патологического состояния зависит от величины кровопотери и тяжести основного заболевания пациента. В 90% случаев кровотечение останавливается самопроизвольно или консервативными способами. Прогноз синдрома относительно неблагоприятный при потере больше 10% ОЦК и наличии сопутствующей патологии. Меры профилактики при заболевании Меллори-Вейса заключаются в отказе от злоупотребления алкоголем, своевременном устранении провоцирующих факторов, выявлении и лечении болезней желудочно-кишечного тракта, соблюдении техники проведения инвазивных медицинских манипуляций на пищеводе, желудке.
2. Лечение разрывно-геморрагического синдрома (синдрома Маллори-Вейсса) в специализированном Центре: автореферат диссертации/ Чередников Е.Е. – 2011.
Симптомы синдрома Пламмера-Винсона и его лечение
Симптомы хронического фарингита и его лечение
Код по МКБ-10: J31.2
«Хронический фарингит» - собирательный термин, который объединяет ряд хронических ирритативных и воспалительных заболеваний слизистой оболочки глотки.
а) Симптомы и клиника. Выделяют несколько форм хронического фарингита:
1. Простой хронический фарингит. Для этой формы хронического фарингита характерны ощущение кома в горле, постоянное откашливание, иногда приступы кашля, ощущение сухости в горле или, наоборот, накапливания мокроты, боль различной интенсивности в шее и при глотании, секреция вязкой слизи. Течение заболевания волнообразное и обычно не сопровождается общими симптомами и повышением температуры тела.
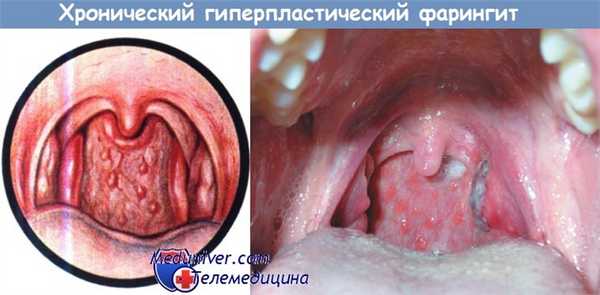
2. Хронический гиперпластический фарингит. Заболевание проявляется утолщением и зернистостью слизистой оболочки задней стенки глотки, увеличением одиночных фолликулов. Слизистая оболочка гиперемирована или приобретает серовато-красный цвет, возможно связанный с появлением телеангиэктазий и вязкой бесцветной слизи. Больные жалуются на необычные ощущения в горле, удручающие их и заставляющие постоянно откашливаться и совершать глотательные движения; иногда появляются рвотные движения вплоть до рвоты.
3. Хронический атрофический фарингит. Характерны сухость и «лакированность» задней стенки глотки, часто в сочетании с образованием сухих, плотных корочек. Слизистая оболочка гладкая, розовая, часто очень болезненная и просвечивает, но возможны также ее гиперемия и утолщение. У части больных одновременно наблюдаются сухой атрофический ринит и ларингит.
Они бывают вынуждены постоянно сплевывать вязкий секрет. По ночам возникает чувство удушья, расстраивается сон. Постоянное откашливание для «прочищения горла» может вызвать появление незначительной примеси крови в секрете. Течение хронического атрофического фарингита зависит от климатических условий и температуры окружающей среды; симптомы заболевания исчезают на морском побережье и усиливаются при сухой жаркой погоде. Заболевают чаще пожилые люди.
Хронический гранулярный (гландулярный) латеральный фарингит.
Характерны яркая гиперемия и отек трубно-глоточных складок и лимфатических фолликулов, диффузно рассеянных или группирующихся.
Больные жалуются на ощущение жжения, зуда или инородного тела, особенно при глотании вне приема пищи.
б) Причины и механизмы развития. У больных хроническим фарингитом часто отмечается конституциональное ослабление функции слизистой оболочки глотки. Заболевание может быть связано с хроническим воздействием пыли, химических веществ или горячего воздуха (например, у представителей определенных профессий).
Существенным способствующим фактором являются значительные колебания температуры, работа на сквозняке, в дымном или недостаточно кондиционируемом помещении (например, у работников скотобоен или ресторанных работников), злостное курение, злоупотребление алкоголем, дыхание через рот, в том числе при обструкции носовых ходов, чрезмерное употребление капель в нос или спреев, хронический синусит, гипертрофированные аденоиды.
К другим причинам хронического фарингита относятся изменения гормонального фона и эндокринные заболевания (например, менопауза, гипотиреоз), авитаминоз А, системные заболевания (например, сердечная и почечная недостаточность, сахарный диабет, легочная недостаточность, хронический бронхит). Наконец, причиной фарингита могут быть аллергические заболевания слизистой оболочки дыхательных путей и чрезмерная нагрузка на голосовые связки у работников некоторых профессий (например, у учителей, политиков, певцов).
в) Диагностика. Местная симптоматика типична. Заболевание длится годы и имеет волнообразное течение. Нередко отмечается несоответствие между относительно скудными объективными изменениями при исследовании глотки и обилием жалоб больного.
При атрофическом фарингите важно исключить опухоль носоглотки и хроническую инфекцию околоносовых пазух. Желательно исследовать функцию носа с помощью риноманометрии.

Атрофический фарингит (сухой фарингит).
Характерны истончение, атрофия и сухость слизистой оболочки глотки; иногда она бывает покрыта тонким слоем слизи, придающим ей лакированный вид.
Отмечается выделение вязкого слизисто-гнойного секрета из носоглотки или образование трудноотделимых серовато-зеленых корочек.
Больные жалуются на выраженное ощущение сухости в горле, болезненность при глотании из-за образования корочек и неприятный запах изо рта.
г) Дифференциальный диагноз. В дифференциальный диагноз включают синдром Шегрена, синдром Пламмера-Винсона (синдром Патерсона-Келли) и злокачественную опухоль любой части глотки, а также опухоль пищевода. В последнем случае необходимо тщательное эндоскопическое исследование.
Хронический фарингит следует дифференцировать также с хроническим тонзиллитом и синуситом, специфическим фарингитом (в частности, туберкулезным и сифилитическим), спондилезом шейного отдела позвоночника и синдромом недостаточности антител (диагностируется на основании результатов электрофореза белков сыворотки крови). В перечень дифференцируемых болезней включают также воспаление сумки Торнвальдта, синдром длинного шиловидного отростка, увеличение задних концов носовых раковин, хоанальный полип и психоневрозы.
д) Лечение. Для лечения хронического фарингита врачу предстоит исключить местное или системное заболевание, которое могло быть причиной фарингита.
1. Хронический гиперпластический фарингит. Местное лечение состоит в назначении средств, направленных на редукцию гиперпластической слизистой оболочки, например прижигании под микроскопом 2-4% раствором нитрата серебра. Сухие и атрофичные участки слизистой оболочки следует стимулировать, например раствором Люголя. В дальнейшем на «сырую» слизистую оболочку наносят (путем закапывания в нос) ароматические масла с мягким действием.
2. Хронический атрофический фарингит. Для стимулирования сохранившихся секреторных элементов атрофичной слизистой оболочки используют раствор Люголя. При метаплазии применение этого раствора противопоказано.
3. Симптоматическое лечение включает увлажнение слизистой оболочки глотки с помощью паровых ингаляций. Курить и употреблять алкоголь не следует. Местное лечение включает применение препаратов на масляной основе для обеспечения сухой слизистой оболочки защитной пленкой. Рекомендуются смена климата и увлажнение воздуха в рабочем помещении. Может даже понадобиться смена работы или места жительства.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Синдром Пламмера-Винсона ( Сидеропеническая дисфагия , Синдром Келли-Паттерсона )
Синдром Пламмера-Винсона — патологическое дисфагическое состояние, обусловленное сужением пищевода и атрофией эпителия верхних отделов ЖКТ на фоне железодефицитной анемии. Проявляется затруднениями глотания в сочетании с бледностью кожи и слизистых, головокружениями, болезненностью и покраснением языка, трещинами в углах рта, сухостью кожи, деформацией ногтевых пластин. Диагностируется с помощью общего анализа крови, определения уровней железа, ферритина, проведения эзофагоскопии, рентгенографии пищевода. Для лечения используют препараты, содержащие железо, В-витаминные комплексы. При стойкой обструкции выполняют баллонную дилатацию, бужирование пищевода.
Сидеропеническую дисфагию (болезнь Пламмера-Винсона, синдром Келли-Паттерсона) в 1911-1919 годах независимо друг от друга описали американские физиологи Г.С. Пламмер, П.П. Винсон и британские ларингологи Д.Р. Паттерсон, А. Браун-Келли. Заболеванию более подвержены белые женщины климактерического возраста, хотя известны случаи диагностики синдрома у подростков и даже детей. Патология выявляется крайне редко, самые высокие показатели заболеваемости отмечались в XX столетии на территории скандинавских стран. Уменьшение распространенности сидеропенической дисфагии связано с улучшением питания и эффективной медикаментозной коррекцией железодефицитных состояний. Актуальность своевременной диагностики расстройства обусловлена высоким риском развития сопряженного рака пищевода.
Причины синдрома Пламмера-Винсона
Хотя заболевание стойко ассоциировано с железодефицитной анемией и гипосидерозом, его этиология на сегодняшний день окончательно не установлена. С учетом характерных патоморфологических и клинических проявлений специалистами в сфере гастроэнтерологии, гематологии, иммунологии предложено несколько теорий происхождения сидеропенической дисфагии:
- Железодефицитная теория. Атрофия слизистых ЖКТ — одно из проявлений сидеропенического синдрома. Из-за нехватки миоглобина и несостоятельности ферросодержащих ферментных систем при гипосидерозе развивается мышечная слабость, возникают нарушения акта глотания, характерные для дисфагии Пламмера-Винсона.
- Теория системного гиповитаминоза. У некоторых пациентов снижены уровни рибофлавина, фолиевой кислоты. Клинически гиповитаминозы обычно проявляются анемией, поражением слизистых, что послужило основанием для их рассмотрения в качестве этиологического фактора сидеропенической дисфагии.
- Аутоиммунная теория. Заболевание часто сочетается с аутоиммунным тиреоидитом, ревматоидным артритом, целиакией. Из-за преимущественного выявления у женщин климактерического возраста и несостоятельности железистого эпителия часть авторов рассматривает заболевание как легкий вариант синдрома Шегрена.
В качестве предпосылок к развитию расстройства рассматривается неполноценное питание, наследственная несостоятельность ферментов, участвующих в метаболизме железа, заболевания, сопровождающиеся хронической кровопотерей (метроррагии, геморрой, язвенная болезнь и др.), нарушение всасывания макроэлементов, витаминов при ахилии, энтеритах, другой патологии ЖКТ. У пожилых пациентов определенную роль могут играть инволюционные нарушения утилизации железа.
Механизм развития синдрома Пламмера-Винсона продолжает изучаться. Считается, что патогенез сидеропенической дисфагии основан на системных изменениях в тканях, связанных с железо-витаминной недостаточностью. В эпителиальной оболочке пищеварительных органов происходят гиперкератические и атрофические процессы, приводящие к сухости и истончению слизистых. Ситуация усугубляется повреждением железистой ткани с апоптозом секретирующих клеток, эпителиоцитов выводных протоков желез, выделением более густого секрета. В результате в верхнем отделе пищевода образуются небольшие липкие пленки (пищеводные мембраны), которые задерживают продвижение твердой части пищи и провоцируют спастическое сокращение мускулатуры. Атония дистальной части пищеводной трубки, вызванная низким содержания миоглобина в мышечных клетках, нарушает эзофагеальную перистальтику и препятствует нормальному прохождению пищевого комка.
Симптомы синдрома Пламмера-Винсона
Клиническая картина заболевания развивается постепенно. Вначале возникают признаки анемического синдрома: бледность кожи, слизистых оболочек, быстрая утомляемость, головные боли и головокружение, нечеткость зрения, учащение пульса, снижение артериального давления. Типичные симптомы сидеропенической дисфагии — воспалительная атрофия слизистой оболочки языка, которая проявляется его покраснением, жжением, сглаженностью, сухостью, болезненностью при пережевывании пищи. Характерно выделение небольшого количества вязкой слюны, появление чувствительных трещин в углах губ (ангулярный хейлит). У многих пациентов выявляется кератоконъюнктивит, кожа становится сухой, ногти — ложкообразными, отмечаются признаки себореи. При прогрессировании заболевания обнаруживается дисфагия (нарушение глотания) вначале твердой, а затем и жидкой пищи. Возможны боли и тяжесть в левом подреберье, обусловленные увеличением селезенки. Типично сезонное обострение синдрома в весенний период.
При тяжелом течении симптомокомплекса Пламмера-Винсона у пациентов наблюдается стремительная потеря массы тела вплоть до кахексии, что вызвано невозможностью проглатывания пищи из-за значительного сужения пищевода. Длительное белково-энергетическое голодание ведет к дистрофическим изменениям в мышцах и внутренних органах. При выраженном снижении уровня гемоглобина может возникать анемическая кома, вызванная недостаточным поступлением кислорода в структуры головного мозга. При вовлечении в атрофический процесс слизистой желудка развивается гастрит с пониженной кислотностью, усугубляющий расстройства пищеварения. Наиболее опасное осложнение синдрома, выявляющееся у 3-15% больных, — плоскоклеточный рак пищевода, глотки, реже наблюдаются злокачественные неоплазии дыхательных путей.
Постановка диагноза может представлять затруднения вследствие неспецифичной клинической картины и низкой распространенности заболевания. О возможном наличии синдрома Пламмера-Винсона свидетельствует сочетание дисфагии с сидеропенической анемией и сужением пищевода. Наиболее информативными в диагностическом плане являются:
- Общий анализ крови. Выявляется анемический синдром: снижение количества гемоглобина и эритроцитов, появление большого количества микроцитов, уменьшение среднего объема эритроцита. Для болезни Пламмера-Винсона характерна сидеропения — падение уровня ферритина и железа в крови, повышение железосвязывающей способности сыворотки.
- Эзофагоскопия. С помощью гибкого эндоскопа, введенного в пищевод, в проксимальном отделе органа удается обнаружить тонкие гладкие стриктуры с эксцентричным входом. При подозрении на развитие злокачественной опухоли осуществляется эндоскопическая биопсия измененного участка эпителия для гистологического анализа.
- Рентгенография пищевода. Метод рекомендован больным с выраженными стриктурами пищевода, препятствующими продвижению эндоскопа. Выполнение серии рентгенограмм после перорального введения контрастного вещества эффективно обнаруживает участок сужения органа. Рентгенография также позволяет оценить состояние пищеварительного тракта.
Для исключения других причин анемического синдрома может назначаться исследование клеточного состава костного мозга (миелограмма). Для обнаружения структурных изменений при выраженной спленомегалии производят УЗИ селезенки. Дифференциальную диагностику проводят с дивертикулами и злокачественными опухолями пищевода, кардиоспазмом, эзофагоспазмом, ахалазией пищевода, склеродермией, стриктурами органа после термических или химических ожогов, грыжей пищеводного отверстия диафрагмы, новообразованиями средостения, наследственными формами анемий, синдромом функциональной дисфагии, болезнью Меллера-Гунтера. Кроме осмотра гастроэнтеролога пациенту рекомендованы консультации онколога, хирурга, оториноларинголога, терапевта, гематолога, невролога, иммунолога, ревматолога.
Лечение синдрома Пламмера-Винсона
Тактика ведения пациента основана на вероятных причинах и механизмах развития заболевания. Обычно стойкого терапевтического эффекта удается достичь консервативными методами и изменением рациона с употреблением достаточного количества белка, продуктов, содержащих витамины группы В. Рекомендованная схема лечения включает следующие лекарственные средства:
- Препараты железа. Коррекция сидеропенического синдрома позволяет уменьшить или полностью купировать дисфагию. Для улучшения усвоения железа применяют лекарственные формы с большей биодоступностью, комбинированные средства с аскорбиновой кислотой.
- Витаминные комплексы. С учетом патогенетической роли рибофлавина и фолиевой кислоты в возникновении расстройства Пламмера-Винсона пациентам показаны монопрепараты витаминов В2, В9. Еще более эффективно назначение поливитаминных препаратов.
При наличии сведений о патологических состояниях, осложнившихся анемией и сидеропенией, этиопатогенетическая терапия основного заболевания проводится по соответствующим протоколам лечения. Пациентам со стойкой дисфагией и выраженной эзофагеальной обструкцией для разрыва пленок, устранения спазма выполняется бужирование или баллонная дилатация пищевода.
Исход заболевания зависит от выраженности структурных изменений пищевода и наличия функциональных расстройств других органов. Прогноз относительно благоприятный, после проведения комплексного лечения у большинства пациентов с расстройством Пламмера-Винсона наступает выздоровление. Меры профилактики заболевания неспецифичны, предусматривают соблюдение сбалансированной диеты, употребление продуктов с высоким содержанием железа и витамина С, посильные физические нагрузки, отказ от вредных привычек. Для предупреждения развития осложнений все больные, перенесшие синдром сидеропенической дисфагии, после выздоровления подлежат длительному диспансерному наблюдению.
1. Синдром Пламмера-Винсона/ Черноусов А.Ф., Ветшев Ф.П., Хоробрых Т.В., Рогаль М.М.// Хирургия. Журнал им. Н.И. Пирогова – 2013 - №10.
Болезнь Пламмера ( Тиреотоксическая аденома , Токсический многоузловой зоб )
Болезнь Пламмера – это эндокринная патология, обусловленная развитием аденомы щитовидной железы, активно продуцирующей тиреоидные гормоны. Проявляется симптомами гипертиреоза: снижением массы тела, одышкой, слабостью, сонливостью, тахикардией, аритмией. В диагностический комплекс входит консультация и осмотр эндокринолога, УЗИ и сцинтиграфия щитовидной железы, анализ крови на тироксин, трийодтиронин и тиреотропный гормон. Лечение проводится хирургическими методами (реже медикаментозно), пациентам пожилого возраста показана терапия радиойодом, этаноловая склеродеструкция узлов щитовидной железы.
Болезнь Пламмера (тиреотоксическая аденома, токсический многоузловой зоб) получила свое название по фамилии американского физиолога, врача-эндокринолога Генри Стенли Пламмера. В 1913 году он опубликовал работу, в которой описал патологическое состояние, проявляющееся тиреотоксикозом, но лишенное некоторых классических признаков диффузного токсического зоба и отличное от него по механизмам происхождения. Заболеваемости больше подвержены женщины, гендерное соотношение составляет 4:1. Редкие случаи токсической аденомы регистрируются среди подростков и детей. Общие эпидемиологические показатели выше в эндемических по зобу областях.
Природа тиреотоксической аденомы полиэтиологична и не всегда может быть установлена достоверно. Считается, что основную роль в возникновении эндокринопатии играют соматические мутации клеток железы и внешние провоцирующие воздействия (интоксикации, ионизирующая радиация). Встречаемость изменений генов, ведущих к развитию синдрома, учащается в регионах с йодным дефицитом. Предположительно, мутации запускают активацию домена рТТГ в тироцитах независимо от силы естественных регулирующих сигналов гипофиза и аутоанатител к рецепторам ТТГ, определяемых при аутоиммунных триеопатиях. Мутации ТТГ-рецепторов, расположенных на эпителии щитовидной железы, приводят к гиперактивации отдельных секреторных клеток, которые начинают автономно и бесконтрольно продуцировать тиреоидные гормоны.
Болезнь Пламмера сопровождается тиреотоксикозом, который вызван избыточным производством йодированных гормонов клетками автономной аденомы. Ключевым звеном патогенеза являются мутации рецепторов тиреотропина, приводящие к их аутоактивации – способности усваивать большее количество йода и синтезировать тироксин (Т4), трийодтиронин (Т3) без регулирующего воздействия тиреотропного гормона. Развивается гиперплазия и гиперфункция отдельных эпителиальных клеток. В дальнейшем под воздействием факторов роста тироциты пролиферируют, формируя доброкачественную гормонально-активную эпителиальную опухоль – токсическую тиреоаденому. Еще один патогенетический механизм образования опухоли – изменения гена G-белка, повышающего функциональную активность отдельных фолликулов.
Тиреотоксикоз возникает преимущественно вследствие влияния трийодтиронина. Уровень ТТГ и тиролиберина остается нормальным либо снижается. При продолжительном течении заболевания подавляется выработка тиреотропина гипофизом – срабатывает закон обратной связи. На морфологическом уровне для болезни Пламмера характерно микрофолликулярное строение аденом. Если формируется многоузловое образование, параллельно с характерными микрофолликулярными опухолями могут возникать макрофолликулярные.
Симптомы болезни Пламмера
Отличительная особенность заболевания – преобладание в клинической картине нарушений сердечного ритма и миопатии. У пациентов определяется синусовая тахикардия и трепетание предсердий – кардиологические синдромы, которые субъективно переживаются как учащенное сердцебиение, дискомфорт, чувство тяжести или боль в области сердца. При тяжелом течении болезни появляется ощущение нехватки воздуха, одышка, слабость, головокружения, снижение работоспособности.
Тиреотоксическая миопатия проявляется мышечной слабостью, гипотрофией, дрожью, реже – миалгиями. Снижение тонуса диафрагмальной мышцы усиливает одышку. Привычная ранее физическая нагрузка становится непосильной. Офтальмологические расстройства представлены симптомом Грефе (отделение верхнего века от радужки при взгляде вверх) и симптомом Мебиуса (неспособность сфокусироваться на близко расположенных объектах).
Изменяется эмоциональное состояние больных: они становятся чрезмерно возбудимыми, эмоционально неуравновешенными, часто плачут, провоцируют конфликты, испытывают беспричинный страх и беспокойство. Снижается целенаправленность поведения, ускоряется речь и мыслительные процессы, но концентрация внимания ухудшается. Наблюдается суетливость, бессонница, тремор пальцев рук.
Увеличивается скорость метаболизма, поэтому больные испытывают приливы жара, часто потеют, плохо переносят жару и повышенную влажность воздуха, теряют вес, несмотря на то, что их аппетит усиливается, а калорийность рациона растет. Температура тела нормальная или повышенная до субфебрильных значений. Нарушаются половые функции: у мужчин снижается потенция, у женщин менструальный цикл становится нерегулярным, месячные кровотечения сопровождаются сильными болями, обмороками. У представителей обоих полов увеличивается риск бесплодия.
При разрастании аденомы и отсутствии лечения болезни Пламмера увеличивается риск перерождения доброкачественной опухолевой ткани в злокачественную. Фолликулы трансформируются в карциноматозные клоны, которые служат основой для развития рака щитовидной железы, особенно его агрессивных форм. По данным статистики, частота данного осложнения среди взрослых пациентов составляет от 2 до 5%. Другой проблемой являются побочные эффекты от лечения радиойодом. Патофизиологи предполагают, что такая терапия может служить провоцирующим фактором аутоиммунной тиреопатии, например, болезни Грейвса-Базедова, тиреоидита Хашимото. Сочетание этих заболеваний с болезнью Пламмера встречается в 2-4% случаев всех аутоиммунных патологий щитовидной железы.
Обследование пациентов проводит врач-эндокринолог. Основными диагностическими задачами являются определение тиреотоксикоза и дифференциация болезни Пламмера с клинически схожими аутоиммунными тиреопатиями – болезнью Грейвса, тиреоидитом Хашимото. Комплексное исследование включает следующие методы:
- Клинический опрос. Пациенты предъявляют жалобы, характерные для тиреотоксикоза – усталость, чувство жара, приступы учащенного сердцебиения, усиление жажды и аппетита, повышенная температура. Характерно, что среди симптомов особо подчеркиваются нарушения со стороны сердечно-сосудистой системы.
- Физикальное обследование. Пальпация области шеи обнаруживает образование округой формы с ровными четкими контурами. Узел чаще эластический, гладкий, не вызывает боли, смещается в момент глотания. В ходе аускультации диагностируется тахикардия. При осмотре не выявляется эндокринная офтальмопатия и/или претибиальная микседема.
- Инструментальное обследование. По итогам УЗИ щитовидной железы определяется округлое новообразование (четкий ободок, однородная гиперэхогенная структура). При радионуклидном исследовании наблюдается низкое накопление или полное отсутствие препарата в ткани, которая не входит в состав узла.
- Лабораторные тесты. По результатам анализов крови выявляется повышенный или высокий уровень трийодтиронина, нормальная либо умеренно повышенная концентрация тироксина. Показатели уровня ТТГ снижены. Титры аутоантител к тиреопероксидазе и тиреоглобулину не превышают нормы.
Лечение болезни Пламмера
Схема терапии всегда подбирается индивидуально. На сегодняшний день в клинической эндокринологии наиболее распространенными способами лечения аденомы являются консервативный, хирургический и радиоактивный. Целесообразность и безопасность того или иного вмешательства оценивается врачом индивидуально в зависимости от объемов опухоли, прогрессирования патологии, возраста пациента. Известны четыре тактических подхода:
- Медикаментозное лечение. Консервативная терапия проводится тиреостатическими препаратами в тех случаях, когда активность опухолевого процесса незначительна, новообразование небольших размеров, не наблюдается динамики роста, а также, если необходимо добиться ремиссии перед хирургическим вмешательством. Действие тиреостатиков направлено на ингибирование отдельных стадий биосинтеза йодсодержащих гормонов.
- Хирургическая операция. Большинству пациентов показано оперативное устранение опухоли. Объем операции зависит от величины аденомы, ее локализации. Проводится энуклеация узла, резекция доли железы или тиреоидэктомия. После операции функции постепенно восстанавливается функционирование железистых тканей (кроме случая тиреоидэктомии).
- Радиойодтерапия. При наличии противопоказаний к оперативному вмешательству пациентам старше 50-60 лет назначается терапия радиоактивным йодом. Недостатки этого метода – риск развития гипотиреоза и присоединения аутоиммунных тиреопатий.
- Этаноловая деструкция узлов. При небольших токсических аденомах могут применяться чрескожные склерозирующие инъекции этанола. Интервалы между сеансами и количество вводимого спирта определяется в процессе курса процедур. Данный способ лечения является относительно новым, исследования его эффективности и безопасности продолжаются.
При своевременной диагностике и назначении адекватной терапии болезнь Пламмера не представляет опасности для здоровья и жизни пациента. Хирургическими и консервативными методами возможно полностью устранить опухоль и восстановить функции железистой ткани, а малигнизация аденом – достаточно редкое явление. Существует ряд мер, которые способны снизить вероятность развития данного заболевания. Рекомендуется придерживаться питания с достаточным поступлением йода, по назначению врача принимать йодсодержащие препараты, избегать ионизирующего облучения, поступления токсинов в организм.
1. Токсическая аденома щитовидной железы у детей/ Гостимский А.В., Скородок Ю.Л., Дитковская Л.В.// Вестник хирургии имени И.И. Грекова. – 2007.
2. Заболевания щитовидной железы, обусловленные дефицитом йода: учебно-методическое пособие/ Забаровская З.В., Мохорт Т.В., Шепелькевич А.П. – 2007.
4. Аденома щитовидной железы/ Пинский С.Б., Белобородов В.А.// Сибирский медицинский журнал (Иркутск). – 2010.
Читайте также:
- Инактивация натриевого (Nа) - тока.
- Диагностика опоясывающего герпеса. Постановка диагноза опоясывающего герпеса
- Нарушения свертывания, вызванные циркулирующими факторами противосвертывания
- Скелетная мышца - особенности строения
- Гентамицин и стрептомицин. Побочные эффекты и токсичность аминогликозидов
