Синдром фето-фетальной трансфузии. Диагностика и лечение синдрома фето-фетальной трансфузии.
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Цель исследования: оптимизировать обследование детей из монохориальных диамниотических двоен в раннем возрасте в зависимости от того, перенесли ли они синдром фето-фетальной трансфузии (СФФТ).
Дизайн: сравнительное проспективное когортное наблюдение.
Материалы и методы. Проведено наблюдение за 60 недоношенными детьми из монохориальных диамниотических двоен с гестационным возрастом 26 недель 0–6 суток — 32 недели 0–6 суток. Основную группу (группу I) составили 30 детей, перенесших СФФТ и его внутриутробную хирургическую коррекцию. В группу сравнения (группу II) вошли 30 детей, у которых СФФТ не было. Промежуточные контрольные точки — сроки катамнестического (проспективного) наблюдения: 1-я точка — рождение (26 нед 0–6 суток — 32 нед 0–6 суток); 2-я точка — 6 мес корригированного возраста; 3-я точка — 12 мес корригированного возраста; 4-я точка — 18 мес корригированного возраста. Всем детям выполняли диффузионно-тензорную магнитно-резонансную томографию с трактографией. В качестве основных исходов сочетанной перинатальной патологии у детей в обеих когортах фиксировалась частота грубых органических поражений центральной нервной системы (ЦНС) и негрубых резидуальных (функциональных) нарушений.
Результаты. Согласно данным МР-трактографии, изучаемые показатели у детей групп I и II в 6 месяцев корригированного возраста значимо не различались, кроме среднего коэффициента диффузии (average diffusion coefficient, ADC) справа задней ножки внутренней капсулы. В возрасте 12 месяцев у младенцев, перенесших СФФТ, отмечались значимые снижение показателя FA в средней трети ствола мозолистого тела (р = 0,034) и валике мозолистого тела справа (р = 0,001), повышение значения ADC в валике мозолистого тела справа (р = 0,0001). Выявлена тенденция к повышению FA у детей основной группы в изучаемых параметрах внутренней капсулы, значимо более высокий показатель FA справа зафиксирован в колене внутренней капсулы (р = 0,0001). В возрасте 18 месяцев корригированного возраста значения FA справа средней трети ствола мозолистого тела у пациентов, перенесших СФФТ, были значимо ниже, чем в группе сравнения. Показатели ADC справа задней ножки и колена внутренней капсулы, а также средней трети ствола мозолистого тела были существенно выше в группе I, чем в группе II.
Структура исходов перинатальной патологии у пациентов, достигших 18 месяцев корригированного возраста: грубая органическая патология ЦНС у детей группы I зафиксирована значительно чаще — 14 (46,7) против 5 (16,7%) в группе II (р < 0,05); негрубые резидуальные проявления перинатальной патологии ЦНС отмечены у 15 (50,0%) детей группы сравнения и у 13 (43,3%) младенцев основной группы (р >0,05), условно здоровыми признаны 10 (33,3%) пациентов группы II и только 3 (10,0%) ребенка группы I (р < 0,05).
Заключение. Дети из монохориальных диамниотических двоен, перенесшие СФФТ, составляют группу риска нарушения темпов миелинизации проводящих путей в 18 месяцев корригированного возраста. Определена прогностическая значимость СФФТ и темповой задержки созревания проводящих путей кортикоспинального тракта и задней таламической лучистости, доказана необходимость динамического контроля процесса миелинизации проводящих путей головного мозга у детей из группы риска.
Вклад авторов: Павличенко М.В. — разработка концепции и дизайна исследования, сбор и обработка материала, написание текста рукописи, ответственность за целостность всех частей статьи; Косовцова Н.В. — разработка концепции и дизайна исследования, редактирование рукописи, утверждение окончательного варианта статьи; Зырянов М.Н., Липацев Ю.А. — проведение магнитно-резонансной трактографии, интерпретация результатов; Маркова Т.В. — статистическая обработка материала, выполнение работы по систематизации материала; Поспелова Я.Ю. — сбор литературных данных, выполнение работы по систематизации материала.
Конфликт интересов: авторы заявляют об отсутствии возможных конфликтов интересов.
Широкое внедрение в практику ВРТ, успехи преодоления бесплодия привели к повышению частоты монохориального многоплодия [1–3] . При данном виде многоплодия велика вероятность возникновения осложнений у женщины, плодов, новорожденных и детей раннего возраста [4–6] . Высокие заболеваемость и смертность детей из монохориальных диамниотических двоен обусловлены особенностями ангиоархитектуры монохориальной плаценты. Морфологической основой развития трансфузионного синдрома является функционирование плацентарных анастомозов [7–9] .
Современные возможности фетальной хирургии повышают вероятность сохранения жизни обоих плодов, однако вопрос о влиянии преодоленного трансфузионного синдрома на здоровье ребенка нуждается в дополнительном изучении и уточнении [10, 11] . Поскольку у недоношенных детей из монохориальных диамниотических двоен наиболее высок уровень инвалидности по нервно-психическим заболеваниям [12, 13] , целью нашей работы стала оптимизация обследования детей из монохориальных диамниотических двоен в раннем возрасте в зависимости от того, перенесли ли они синдром фето-фетальной трансфузии (СФФТ).
МАТЕРИАЛЫ И МЕТОДЫ
Проведено наблюдение за развитием недоношенных детей из монохориальных диамниотических двоен от рождения до достижения возраста 18 месяцев с проведением магнитно-резонансной трактографии.
- гестационный возраст 26 недель 0–6 суток — 32 недели 0–6 суток;
- монохориальная диамниотическая беременность;
- родители — жители Екатеринбурга и Свердловской области;
- принадлежность пациентов к славянской этнической группе.
Для всех пациентов родителями оформлялось информированное согласие на включение в исследование.
- дети из дихориальных диамниотических двоен;
- дети из троен;
- наличие серьезных врожденных пороков развития, не связанных с СФФТ (врожденных пороков сердца и ЖКТ);
- выявление наследственных (генетических) заболеваний у детей.
- отказ родителей на очередном этапе от последующего наблюдения;
- переезд семьи в другой регион России или за границу.
В исследование включены 60 недоношенных новорожденных из монохориальных диамниотических двоен. Основную группу (группу I) составили 30 пациентов, перенесших СФФТ и его внутриутробную хирургическую коррекцию методом лазерной коагуляции плацентарных анастомозов в сроке 22–24 недели гестации. В группу сравнения (группу II) вошли 30 детей, у которых СФФТ не было.
Наблюдаемые дети родились в 2019–2020 гг. в ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России (директор — д. м. н. Галина Борисовна Мальгина). Все они выхаживались в стационаре второго этапа указанной медицинской организации и до достижения конечной точки наблюдения (18 месяцев постменструального возраста, ПМВ) в декретированные сроки госпитализировались в стационар отделения детской реабилитации для дообследования и проведения лечебных мероприятий.
Промежуточные контрольные точки — сроки катамнестического (проспективного) наблюдения:
1-я точка — рождение (26 нед 0–6 суток — 32 нед 0–6 суток, гестационный возраст равен ПМВ);
2-я точка — 6 мес корригированного возраста (64 нед ПМВ);
3-я точка — 12 мес корригированного возраста (88 нед ПМВ);
4-я точка — 18 мес корригированного возраста (112 нед ПМВ).
- осмотр и физикальное обследование;
- общеклинические лабораторные исследования;
- инструментальные исследования (нейросонография с ультразвуковой доплерометрией, электроэнцефалограмма-видеомониторинг, МРТ головного мозга с МР-трактографией).
Диффузионно-тензорную МРТ с трактографией (МР-трактографию) проводили на томографе Signa HDxt 1.5Т (General Electric, США) с индукцией магнитного поля 1,5 Тл. Исследование включало 2D BRAVO Т1 последовательность (TR/ТЕ — 8,4/3,1 мс, толщина среза — 1,2 мм, непрерывно, FOV — 24 × 24 см, матрица — 200 × 200, аксиальная плоскость), Т2 FLAIR (TR/ТЕ — 9002,0/135,6 мс, толщина среза — 4 мм, непрерывно, FOV — 24 × 24 см, матрица — 288 × 56, аксиальная плоскость). Диффузионно-тензорные изображения были получены с использованием следующих параметров: TR/ТЕ — 9000,0/94,9 мс, матрица — 96 × 96; толщина среза — 2,5 мм, непрерывно, максимальный коэффициент диффузии (b-value) — 1000 с/мм 2 , без наркоза и седации, в период естественного дневного сна.
Полученные данные обрабатывались на рабочей станции AW версии 4.3, где проводили измерения среднего коэффициента диффузии (average diffusion coefficient, ADC) и фракционной анизотропии (fractional anisotropy, FА) в выделенных симметричных областях (region of interest, ROI) с использованием инструментов программного обеспечения Functools рабочей станции AW версии 4.3. Проводилась трехмерная реконструкция проводящих путей головного мозга. Результаты оценивались совместно со специалистами отделения биофизических и лучевых методов исследований.
Для оценки моторных и сенсорных путей исследовали кортикоспинальный тракт и заднюю таламическую лучистость. Кортикоспинальный тракт оценивали на уровне передней ножки, задней ножки и колена внутренней капсулы. Для оценки комиссуральных межполушарных волокон проводили измерения мозолистого тела на следующих уровнях: колено мозолистого тела, средняя и задняя треть ствола, а также валик мозолистого тела. Для каждой исследуемой анатомической структуры выделялись области интереса (ROI). Количество пикселей соответствовало размерам анатомической области на данном срезе. Для основной группы и группы сравнения показатели FA и ADC были получены в аналогичных анатомических структурах.
Возрастные периоды выбраны с учетом стадий миелинизации по R.B. Dietrich (1988): младенческая стадия — до 6 мес, переходная стадия — 8–12 мес, ранняя взрослая стадия — 10–31 мес жизни.
Восстановительное лечение (абилитация) всех пациентов включало:
- нейропротекторы и противосудорожные средства по индивидуальным показаниям;
- кинезиотерапию (лечебную физкультуру, массаж, тактильно-кинестетическую стимуляцию);
- гидротерапию;
- иглорефлексотерапию;
- физиотерапию — токолечение, теплолечение, сухую иммерсию;
- семейно-ориентированное психологическое сопровождение (работу с перинатальным психологом).
В качестве основных исходов сочетанной перинатальной патологии у детей в обеих когортах фиксировалась частота:
- грубых органических поражений ЦНС, таких как детский церебральный паралич, судорожный синдром, выраженная задержка психомоторного развития;
- негрубых резидуальных (функциональных) нарушений — темповой задержки психомоторного развития, вегето-висцеральных нарушений.
В связи с ограниченным контингентом больных и небольшой длительностью наблюдения гендерные различия не фиксировали.
Этическая экспертиза осуществлена в соответствии с процедурой комплексной экспертной оценки полного конкурсного цикла Российского фонда фундаментальных исследований, предусмотренной для исследования по данному направлению.
За время наблюдения нежелательных явлений не было. Все пациенты перенесли исследование удовлетворительно.
Обработка цифрового материала выполнена с использованием пакета компьютерной программы Statistica 10.0 for Windows ХР, BioStat в соответствии с общепринятыми методами медицинской статистики. Количественные данные (FA и ADC) представлены в формате медианы (Me) и стандартного отклонения (m). Рассчитывали также непараметрические показатели: χ 2 , критерий Фишера, отношения рисков. Различия считали статистически значимыми при р ≤ 0,05.
В настоящее время диффузионно-тензорная МРТ с трактографией (МР-трактография) прочно вошла в клиническую практику, с ее помощью совершенствуются подходы к диагностике заболеваний в детской неврологии благодаря уникальным возможностям клинико-нейровизуализационных сопоставлений. Трактография головного мозга — диагностический метод, основанный на диффузионно-тензорной МРТ (МР-трактографии), позволяющий визуализировать ориентацию и целостность проводящих путей головного мозга in vivo. Еще несколько лет назад трактография была предметом научных исследований, в настоящее время этот метод становится доступным [14, 15] .
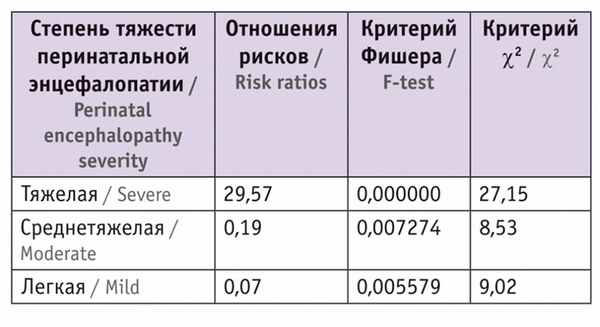
При оценке тяжести перинатальных энцефалопатий у наблюдаемых детей из монохориальных диамниотических двоен мы учитывали следующие показатели: оценку по шкале Апгар, тяжесть состояния при рождении, неврологические синдромы в постнатальном периоде, характер патологических изменений по данным нейросонографии, результаты доплерометрии.
Таблица 1
Частота диагностированных перинатальных энцефалопатий у пациентов
СФФТ вызывает развитие гемодинамических нарушений у плодов, что может спровоцировать гибель нейронов, снижение как общего числа нейронов, так и количества правильно миелинизированных аксонов. С целью диагностики целостности и направления проводящих каналов головного мозга у изучаемых детей была проведена диффузионно-тензорная МРТ с трактографией в возрасте 6, 12, 18 месяцев корригированного возраста ( табл. 2–4 ).
Таблица 2
Показатели магнитно-резонансной трактографии у младенцев в 6 месяцев корригированного возраста
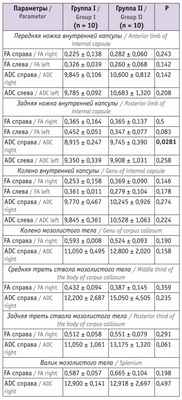
Примечание. Здесь и в таблицах 3, 4: ADC — средний коэффициент диффузии (average diffusion coefficient) (единица измерения — –10 3 мм/с), FА — коэффициент фракционной анизотропии (fractional anisotropy).
Таблица 3
Показатели магнитно-резонансной трактографии у младенцев в 12 месяцев корригированного возраста
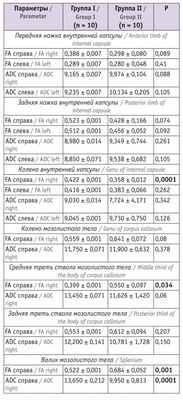
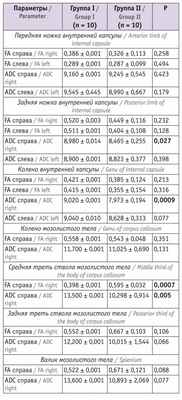
Таблица 4
Показатели магнитно-резонансной трактографии у младенцев в 18 месяцев корригированного возраста
Согласно представленным в таблице 2 данным, исследуемые показатели у детей групп I и II значимо не различались, кроме показателя ADC справа задней ножки внутренней капсулы. У детей в возрасте 12 мес значимые различия в изучаемых параметрах выявлялись чаще (см. табл. 3 ).
При анализе изучаемых показателей в возрасте 12 месяцев у младенцев, перенесших СФФТ, отмечались значимые снижение показателя FA в средней трети ствола мозолистого тела и валике мозолистого тела справа, повышение значения ADC в валике мозолистого тела справа. Выявлена тенденция к повышению FA у детей основной группы в изучаемых параметрах внутренней капсулы, значимо более высокий показатель FA справа зафиксирован в колене внутренней капсулы. Значения ADC в колене, передней и задней ножках внутренней капсулы в основной группе и группе сравнения существенно не различались.
В возрасте 18 месяцев корригированного возраста значения FA справа средней трети ствола мозолистого тела у пациентов, перенесших СФФТ, были значимо ниже, чем в группе сравнения. Показатели ADC справа задней ножки и колена внутренней капсулы, а также средней трети ствола мозолистого тела были существенно выше в группе I, чем в группе II.
Структура исходов перинатальной патологии у пациентов, достигших 18 месяцев корригированного возраста: грубая органическая патология ЦНС у детей группы I зафиксирована значительно чаще — 14 (46,7) против 5 (16,7%) в группе II (р < 0,05); негрубые резидуальные проявления перинатальной патологии ЦНС отмечены у 15 (50,0%) детей группы сравнения и у 13 (43,3%) младенцев основной группы (р >0,05), условно здоровыми признаны 10 (33,3%) пациентов группы II и только 3 (10,0%) ребенка группы I (р < 0,05). Случаев оформления инвалидности по неврологической патологии не было.
Проведенный нами анализ подтверждает значимость базового критерия — задержки темпов миелинизации кортикоспинального тракта и задней таламической лучистости у недоношенных детей из монохориальных диамниотических двоен, перенесших СФФТ, в определении прогноза развития отсроченных неврологических нарушений, особенно грубой органической патологии ЦНС. Полученные значимые различия при относительно небольшой численности наших когорт и ограниченном сроке исследования свидетельствуют о том, что требуется дальнейшее изучение состояния здоровья недоношенных детей, перенесших СФФТ.
В настоящее время все больше возрастает необходимость в неинвазивном бесконтактном получении информации о характере регионарных и очаговых процессов, происходящих в головном мозге ребенка, как на диагностическом этапе, так и в процессе лечения заболеваний ЦНС у детей различных возрастных групп. В этом отношении новые перспективы открывает метод МР-трактографии [16, 17] . МР-трактография мозга у детей в различные возрастные периоды обладает рядом особенностей. У новорожденных реконструкция проводящих путей затруднена из-за малонаправленного характера диффузии на фоне незавершенной сформированности. Тяжелое состояние новорожденного ребенка, ИВЛ могут стать препятствиями для проведения данной диагностической процедуры. Малые размеры головного мозга требуют использования уменьшенной величины вокселя, что снижает интенсивность получаемых сигналов и затрудняет реконструкцию трактограмм [18, 19] .
Процесс миелинизации мозга (увеличение содержания липидов и уменьшение содержания воды в оболочках нервных путей) начинается на пятом месяце внутриутробного развития и продолжается активно до 2 лет. В этом возрасте миелинизация мозга является ключевым компонентом неврологического развития, она коррелирует с увеличением сенсорных, моторных и когнитивных способностей, тесно связана с неврологической функциональной зрелостью [20] .
Недоношенные новорожденные из монохориальных диамниотических двоен, перенесшие синдром фето-фетальной трансфузии (СФФТ), составляют группу риска нарушения миелинизации проводящих путей, по результатам магнитно-резонансной трактографии. Определена прогностическая значимость СФФТ и темповой задержки созревания кортикоспинального тракта и задней таламической лучистости, доказана необходимость динамического контроля за процессом миелинизации у детей из группы риска. Ранняя диагностика повреждения, своевременный подбор абилитационной и реабилитационной терапии повышают шансы успешного лечения и благоприятных отдаленных исходов у недоношенных детей из монохориальных диамниотических двоен. Предполагается продолжить медицинское сопровождение семей недоношенных детей из монохориальных диамниотических двоен, перенесших СФФТ, с целью этапной коррекции неврологических нарушений и улучшений показателей здоровья и психомоторного развития.
Осложненная многоплодная беременность и фето-фетальный синдром
Ожидание рождения близнецов всегда большая радость в семье, но иногда это счастье омрачается осложнениями, возникающими во время беременности. Многоплодная беременность ассоциируется с высоким риском развития осложнений, как со стороны матери, так и со стороны плодов. В связи с этим многоплодную беременность и роды относят к состоянию пограничному между нормой и патологией.
Многоплодные беременности различают по типу плацентации и по количеству амниотических полостей. При беременности дихориальной диамниотической двойней у каждого ребенка есть своя плацента и своя отдельная амниотическая полость, в результате такой беременности рождаются разнополые дети или дети не похожие друг на друга. При монохориальной диамниотической двойне близнецы находятся в отдельных амниотических полостях, но делят одну плаценту на двоих, в результате такой беременности рождаются однополые дети похожие друг на друга как две капли воды.
Осложнения монохориальной многоплодной беременности
Монохориальная многоплодная беременность часто сопровождаются серьезными осложнениями, встречающимися только при данном типе плацентации. Уникальная ангио-архитектоника монохориальной плаценты прямо или косвенно связана с большинством осложнений. При монохориальной многоплодной беременности возможно развитие специфических, не характерных для дихориальной беременности, осложнений: селективная задержка роста одного плода из двойни, фето-фетальный трансфузионный синдром, синдром анемии-полицитемии, синдром обратной артериальной перфузии.
Фето-фетальный трансфузионный синдром (ФФТС)
Самым грозным осложнением монохориальной двойни является фето-фетальный трансфузионный синдром (ФФТС). Наличие патологических артерио-венозных анастомозов в плаценте между близнецами приводит к неравномерному распределению кровотока, со сбросом крови от одного плода к другому. Один близнец “обкрадывает” другого. В случае отсутствия лечения беременность может прерваться или близнецы погибнут внутриутробно в 73-100% случаев.
Диагностика фето-фетального трансфузионного синдрома
ФФТС диагностируется с 16 недель при проведении ультразвукового исследования. Диагноз основывается на наличии многоводия одного плода и маловодия другого, состояния мочевых пузырей плодов. Ранняя диагностика ФФТС является крайне важной задачей. Для обеспечения благоприятного исхода беременности необходимы своевременная диагностика и выбор правильной тактики ведения. Ультразвуковое исследование монохориальной двойни должно проводиться каждые две недели, начиная с 16 недель беременности и продолжаться до 27 недель, так как ФФТС обычно развивается между 16 и 27 неделями гестации.
Лечение фето-фетального трансфузионного синдрома
Единственным патогенетическим методом лечения ФФТС, позволяющим максимально пролонгировать беременность и родить здоровых детей, является лазерная коагуляция сосудистых анастомозов плаценты. В нашем Центре проводится фетоскопическая селективная лазерная коагуляция анастомозов плаценты с 16 до 27 недель беременности.
Фетоскопическая селективная лазерная коагуляция
Фетоскопическая лазерная процедура выполняется трансабдоминально под внутривенной, местной или региональной анестезией. Троакар диаметром 2,3-3,3мм под эхографическим контролем вводят в амниотическую полость плода-реципиента, одновременно вводят 2 мм эндоскоп с проводником лазерной энергии (400-600 μm). Коагуляцию осуществляют бесконтактно, процедуру завершают амниоредукцией до достижения нормального количества околоплодных вод. Выживание одного или двух близнецов после проведенного лечения составляет 70%.
Важным является последующий ультразвуковой и допплерометрический контроль за состоянием плодов, наблюдение за течением беременности, выбор оптимального времени родоразрешения. Вы можете получить квалифицированную медицинскую помощь в нашем стационаре – 2-м отделении акушерском патологии беременности, под руководством д.м.н. Н. К. Тетруашвили, где будущие мамы проходят необходимое лечение и готовятся к родоразрешению.
Возможности неонатальной службы позволяют сделать все возможное для выхаживания недоношенных новорожденных при осложненной монохориальной беременности.
В Научном Центре акушерства, гинекологии и перинатологии им. В.И. Кулакова Вы можете получить экспертную консультацию акушеров-гинекологов, фетальных хирургов, хирургов неонатологов, провести экспертное эхографическое обследование плода, МРТ плода.
Наша команда состоит из врачей акушеров – гинекологов, фетальных хирургов, специалистов ультразвуковой диагностики, хирургов неонатологов, генетиков, трансфузиологов, неонатологов.
Фетальные операции в рамках государственных программ
Стационарное лечение, фетальные операции субсидируются государством в рамках программы Высокотехнологичной медицинской помощи (ВМП) и бесплатны для пациентов.
Пациентам проводится полное эхографическое обследование плода, эхокардиография плода, при необходимости МРТ плода, для полной оценки состояния ребенка. Мультидисциплинарная команда специалистов совместно с будущими родителям, обсуждают план лечения, возможные результаты и риски осложнений.
В Научном Центре акушерства, гинекологии и перинатологии им. В.И. Кулакова проводится
- Экспертная ультразвуковая оценка состояния плода
- МРТ плода
- Фетоскопические операции при осложненной монохориальной двойне
- Фетоскопические операции при синдроме амниотических тяжей
- Пункционная хирургия плода под контролем эхографии (амниоредукция, редукция эмбрионов при многоплодной беременности)
- Кордоцентез, внутриутробное переливание эритроцитарной массы плоду при диагностированной анемии плода.
- Наблюдение, амбулаторное, стационарное лечение и родоразрешение женщин, перенесших фетальные хирургические вмешательства, выхаживание новорожденных.
В ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России Вы получаете уникальную возможность получить БЕСПЛАТНО оперативное стационарное лечение по квотам на высоко-технологическую медицинскую помощь (ВМП по ОМС).
Диагностика фето-фетального трансфузионного синдрома, синдрома анемии-полицитемии при монохориальной многоплодной беременности
Цель исследования. Провести систематический обзор данных, имеющихся в современной литературе, принципов и методов диагностики осложнений монохориальной многоплодной беременности.
Материал и методы. В обзор включены данные зарубежных статей и клинических протоколов, найденных в Pubmed и ScienceDirect по данной теме, опубликованных за последние 5 лет.
Результаты. Описаны диагностические критерии фето-фетального трансфузионного синдрома и синдрома анемии полицитемии. Приведены ранние диагностические маркеры развития осложнений, даны основы обследования осложненной монохориальной многоплодной беременности.
Заключение. Применение приведенных в обзоре клинических рекомендаций и протоколов обследования монохориальной двойни позволит своевременно диагностировать осложнения и провести адекватное лечение.
В последнее время наблюдается тенденция к увеличению частоты наступления многоплодной беременности в связи с внедрением в практику программ вспомогательных репродуктивных технологий. Известно, что при многоплодной беременности перинатальная заболеваемость и смертность значительно выше, чем при одноплодной.
В связи с этим многоплодную беременность относят к состоянию пограничному между нормой и патологией.
При монохориальной многоплодной беременности возможно развитие специфических осложнений, не характерных для дихориальной, связанных с уникальной ангио-архитектоникой монохориальной плаценты [1]. Неравномерное распределение кровотока со сбросом крови от одного плода к другому является общепринятой причиной синдрома фето-фетальной трансфузии (ФФТС) и синдрома анемии-полицитемии (САП). Причиной возникновения синдрома селективной задержки роста плода (ССЗРП) является неравномерное разделение территории плаценты между близнецами. В основе возникновения синдрома обратной артериальной перфузии (СОАП) лежит несбалансированный кровоток через сосудистые анастомозы. Некоторые из представленных выше осложнений поддаются внутриутробной коррекции, в связи с чем своевременная диагностика позволяет провести необходимые лечебные мероприятия.
Мы приводим клинически значимые диагностические критерии, которые могут и должны быть использованы при ведении монохориальной многоплодной беременности.
Фето-фетальный трансфузионный синдром
Монохориальная плацента имеет сеть сосудистых анастомозов, объединяющих циркуляторные системы обоих плодов, которая обеспечивает трансфузию крови между близнецами. Это состояние является физиологическим до тех пор, пока гемотрансфузия между плодами сбалансирована. Несбалансированная сеть анастомозов может привести к серьезным осложнениям, самым известным из которых является ФФТС, который встречается в 9–15% случаев всех монохориальных двоен [2].
В эпоху до эхографии, ФФТС диагностировался в момент рождения. Основными критериями выступали разница в весе новорожденных более 15–20% и в концентрации гемоглобина более 50 г/л [3]. Последующее исследование Wenstrom и соавт. [4] показало, что различия в весе и концентрации гемоглобина у близнецов не является достоверным признаком ФФТС. Исследователи пришли к выводу, что «исторические» неонатальные признаки не должны использоваться в качестве диагностических критериев данного синдрома. В настоящее время ФФТС диагностируется антенатально с помощью эхографии. Первоначально необходимо подтвердить, что данная беременность является монохориальной (выявление T-признака и четкая визуализация единственного плодного яйца с двумя эмбрионами в первом триместре). Различие фетометрических параметров плодов не является критерием диагностики ФФТС. Несмотря на это, общее убеждение об обязательном отставании роста одного из плодов все еще существует. В исследовании 270 пациенток с ФФТС только у 20% было выявлено отставание веса одного из плодов [5].
Ключевым диагностическим критерием ФФТС является обнаружение многоводия у одного плода и маловодия у другого. Маловодие устанавливается на основании измерения максимал.
Синдром фето-фетальной трансфузии: чтобы спасти близнецов, врачи оперируют их в утробе матери
В России с 2005 года проводят операции при синдроме фето-фетальной трансфузии (ФФТС или СФФТ). Синдром развивается во время беременности у 15-20% монохориальных близнецов (когда два-три малыша делят одну плаценту). В норме однояйцевые близнецы обмениваются друг с другом кровью через сосуды общей плаценты по принципу взял-вернул. При ФФТС в сосудах, соединяющих кровеносные системы плодов возникает дисбаланс – количество крови, которая перетекает от близнеца-«донора» к плоду «реципиенту» больше, чем возвращается обратно. В народе говорят «один другого объел ».
Если фето-фетальный трансфузионный синдром прогрессирует, это может приводить к выкидышу, внутриутробной гибели одного или нескольких близнецов и/или преждевременным родам на ранних сроках.
Врачи научились справляться с этой проблемой: коагулировать – «прижигать » патологические сосуды плаценты с помощью лазера. Но не всегда беременные с ФФТС вовремя узнают о такой возможности.
Большой успех
В 2019 году равный консультант фонда «Право на чудо » Елена Соболенко забеременела двойней. В 20 недель врачи поставили диагноз – фето-фетальный трансфузионный синдром и сказали: чтобы спасти детей, нужна внутриутробная операция. Из родного Краснодара Елену направили в Москву.
«Перед операцией врач сказал: «Да, это опасно. Шансов, что дети выживут оба – где-то 60%, что выживет один – 80% » . Перелет и переживания из-за диагноза привели к тому, что у меня дополнительно произошло сокращение шейки матки, открытие, наступила угроза преждевременных родов », – рассказывает Елена Соболенко.
Оперировал Елену Андрей Евгеньевич Бугеренко – акушер-гинеколог, кандидат медицинских наук, доцент кафедры акушерства и гинекологии факультета фундаментальной медицины МГУ им. М.В.Ломоносова, который первым в России в 2005 году провел лазерную коагуляцию сосудов плаценты при фето-фетальном трансфузионном синдроме.
По словам Андрея Бугеренко, предотвратить развитие фето-фетального трансфузионного синдрома заранее невозможно: то, что сосуды в плаценте формируются так, что возникнет дисбаланс перетока крови между близнецами – несчастный случай.
«Операция прошла успешно, у малышей все нормализовалось. Какое-то время я еще наблюдалась в московской клинике, потом врачи разрешили мне вернуться в Краснодар. На следующий день после перелета я снова попала в больницу с сокращением шейки и пролабированием пузыря. Мне наложили швы и оставшуюся часть беременности я вылеживала. Мы долежали до 34,5 недель. И это – большой успех, потому что моя беременность могла закончиться на любом сроке » , – говорит Елена Соболенко.
Малыши появились на свет с весом 2610 и 1880 граммов и задышали самостоятельно. 3 недели они провели в отделении патологии новорожденных. По словам Елены, сейчас сыновья ничем не отличаются от сверстников.
Елена Соболенко с сыновьями Андреем и Матвеем.
Андрея родители назвали в честь доктора – Андрея Евгеньевича Бугеренко,
который провел операцию и спас близнецов
Развитие современной фетальной хирургии (то есть хирургии плода) в мире началось в 1980-е годы, с появлением пренатальной диагностики – когда у врачей появилась возможность увидеть человека до его рождения.
Фетальная хирургия уже достигла успехов в лечении синдромов фето-фетальной трансфузии, обратно-артериальной перфузии, изолированной задержки роста плода, синдрома анемии и полицитемии, врожденной диафрагмальной грыжи, крестцово-копчиковой опухоли, а также таких тяжелых врожденных пороков, как гидроцефалия и спинномозговая грыжа (Spina bifida).
«Предложили подождать, пока ребенок погибнет»
«Эффективность операций при фето-фетальном синдроме в России и в мире сегодня – 85-90%. Это значит, что хотя бы один из плодов выживает, женщина донашивает беременность до приличного срока, дети рождаются и вырастают без тяжелых неврологических поражений, ДЦП и т.д. Раньше, когда не было фетоскопии, выжившие дети очень часто оставались тяжелыми инвалидами, так как при трансфузионных синдромах страдает головной мозг, сердце. Операция предотвращает и гибель второго плода в случае, если один ребенок все-таки гибнет внутриутробно», – говорит Андрей Евгеньевич Бугеренко , акушер-гинеколог, кандидат медицинских наук, доцент кафедры акушерства и гинекологии факультета фундаментальной медицины МГУ им. М.В.Ломоносова.
Именно с такими последствиями фето-фетального трансфузионного синдрома столкнулась Мария Исакова из Томска. В 2019 году в 27 недель беременности она потеряла одного ребенка из монохориальной двойни – он погиб внутриутробно. Чтобы спасти второго близнеца, врачи провели экстренное кесарево сечение – Ваня появился на свет с весом 745 граммов.
«В 20 недель беременности врачи заметили на УЗИ разницу в весе между близнецами – она была около 300 граммов. Сказали, что будут наблюдать каждые две недели. На следующих обследованиях все было без серьезных изменений. Но на 25 неделе живот вдруг резко вздулся, стал каменным, близнецы почти перестали шевелиться. Я встала на весы и поняла, что за неделю набрала сразу три килограмма. Побежала к врачу, там срочно направили на УЗИ и после осмотра озвучили диагноз – синдром фето-фетальной трансфузии».
Специалисты выделяют несколько стадий развития фето-фетального трансфузионного синдрома:
На I начальной стадии возникает маловодие у плода-донора и многоводие у плода-реципиента.
На следующих II-III стадиях признаки синдрома нарастают, на фоне многоводия/маловодия появляются нарушения кровотока у одного или обоих плодов.
На IV-V стадиях у плодов с ФФТС (чаще реципиента), возникает избыток жидкости в брюшной и плевральной полостях, сердце, отёк подкожно-жировой клетчатки головы и туловища. Происходит гибель одного или обоих плодов [1].
При ФФТС операцию проводят на II-IV стадии развития синдрома: через прокол в передней брюшной стенке в матку вводят тонкую оптическую систему с лазером и проводят коагуляцию сосудов, которые соединяют кровеносные системы близнецов. Операция проходит под местным наркозом или эпидуральной анестезией, реже – под общим наркозом.
На консилиуме Марии сказали, что операцию по коагуляции сосудов в плаценте делать уже поздно – срок большой, и даже если рискнуть, то гарантий, что малыши выживут, никаких – у одного из близнецов уже развился отек мозга. Если сделать кесарево на сроке в 25 недель, малыши тоже скорее всего погибнут, т.к. у второго плода (донора) еще слишком маленький вес.
Марии предложили подождать 3-4 дня, когда ребенок с отеком мозга погибнет, и, скорее всего, погибнет и второй малыш – при ФФТС начнется отток крови от донора к реципиенту. Тогда врачи смогут вызвать искусственные роды.
«Я согласилась, но чтобы облегчить беременность, мне предложили сделать амниоредукцию (откачивание лишних вод). В этот же день мне сделали эту операцию и откачали 2 литра жидкости», – рассказывает Мария.
Вопреки прогнозам, оба малыша были живы еще 2 недели. Когда сердце Саши остановилось, врачи спасали Ваню. Он выжил, но, к сожалению, тяжелых последствий избежать не удалось – у мальчика ДЦП, он не может ходить, старается сидеть с поддержкой, есть проблемы со зрением и слухом.
Мария Исакова и Ваня (здесь Ванечке 1 год)
«Сейчас уже привыкаешь, что ребенок особенный. Первое время думала, почему это случилось со мной, винила врачей. Сейчас общаюсь с другими мамочками тяжелых ребятишек – становится легче. Жалко конечно, но что уж…», – говорит Мария.
Проблемы диагностики
«В прошлом году в Кулаковском центре было 60 пациентов с ФФТС, которых мы прооперировали. Мы принимаем пациентов со всей России и лечение проводится бесплатно за счёт квот высокотехнологичной медицинской помощи. Важнейшими проблемами являются несвоевременная диагностика и неправильный выбор тактики ведения беременности, осложненной ФФТС. По статистике в России на наше количество родов должно быть около 1000 пациентов с ФФТС, плюс-минус 100. Я знаю все центры в России, которые этим занимаются – в Москве, Санкт-Петербурге и Екатеринбурге. На всех приходится 150-160 операций по поводу ФФТС в год. Все остальное теряется, т.е. прерывается, в том числе, происходят преждевременные роды», – комментирует Кирилл Витальевич Костюков , врач акушер-гинеколог, доктор медицинских наук, заведующий отделением ультразвуковой и функциональной диагностики НМИЦ АГП им. В.И. Кулакова.
По мнению Костюкова, причина такого расхождения – неосведомленность врачей и пациентов, а также проблемы с диагностикой и неправильный подход к ведению двоен и троен.
По словам специалистов, чаще всего ФФТС развивается постепенно.
«За время работы я наблюдал около тысячи монохориальных двоен, почти 300 операций мы провели. Вариантов, когда все хорошо, а потом через неделю или десять дней резко развивается ФФТС – такое встречается, но редко – на моей практике было два случая», – говорит Костюков.
Под наблюдением
При ФФТС операцию проводят на II-IV стадии развития синдрома. Редко, но бывает, что синдром останавливается на I стадии – тогда врачи ведут наблюдательную тактику.
Але Гордиенко синдром фето-фетальной трансфузии диагностировали в 18 недель беременности, на втором скрининге. Из районной женской консультации будущая мама перевелась под наблюдение в НМИЦ им. Кулакова. Врачи рассказали о возможности фетоскопии, но по результатам обследований решили наблюдать – синдром был на первой стадии. Каждые 2 недели Аля ездила на контрольные УЗИ – ухудшений не было. Но на 30 неделе, независимо от ФФТС, развилась преэклампсия – и родились две дочки с весом 998 и 1498 граммов.
«К счастью, нам удалось выбраться из этой ситуации без последствий. У одной дочери была тяжелая бронхолегочная дисплазия, но вскоре диагноз сняли. Мамам в такой ситуации рекомендую самое главное – не паниковать и постараться найти хорошего специалиста, который вместе с вами будет сохранять спокойную уверенность. А еще при любом исходе не вините себя – вы не виноваты ни в диагнозах, ни в преждевременных родах»,– говорит Аля Бубнова .
Нередко ФФТС сочетается с другими осложнениями беременности – например, синдромом изолированной задержки роста плода. Так случилось с москвичкой Олесей Балакиной . Шесть лет назад популярный Instagram-блогер @alex.and.alex родила близнецов. Сыновья появились на свет с огромной разницей в весе: Саша – 750 граммов, а Леша – 2050.
Саша и Леша. Фото из Instagram Олеси Балакиной
«В половине случаев, по моим наблюдениям, фето-фетальный синдром сочетается с синдромом изолированной задержки роста плода. Причем, какой из них ведущий, не всегда понятно», – комментирует Андрей Бугеренко, – «Практически всегда близнецы разной массы. Но если разница в предполагаемой массе составляет более 25% – это синдром изолированной задержки роста. Возникает он потому, что плацента делится на двоих детей неравномерно. Если 40% на 60% по площади, то синдром не возникает. На если 35% на 65% или 30% на 70% – синдром возникает. Так как площадь питания для одного плода маленькая, он начинает отставать.
Причем, есть три допплерометрических типа этого синдрома:
- Наиболее благоприятный – 80-90% шансы, что беременность закончится хорошо.
- Второй 50 на 50%.
- Третий стараемся прооперировать, так как заканчивается он чаще всего внезапной гибелью одного или двух плодов».
То, что у Олеси один из плодов стал резко отставать по весу и росту от второго, врачи заметили на 21 неделе беременности, а спустя несколько недель на контрольном УЗИ обнаружили ФФТС. Операцию Олесе не предлагали, отправили домой. Но в 27 недель срочно госпитализировали в Московский областной перинатальный центр – один плод уже критически отставал в развитии.
Беременность удалось сохранить до 33 недели. Малыши выжили оба, хотя врачи прогнозировали гибель одного близнеца. Сейчас мальчикам 6 лет. Об истории рождения Саши и Леши, их долгом выхаживании и лечении Олеся рассказывает в своем блоге, а недавно написала книгу .
Шанс на спасение
В России большинство пациенток с выявленным фето-фетальным синдромом, если им требуется операция, направляют в НМИЦ АГП им. В.И. Кулакова. В Москве оперируют ФФТС также в Перинатальном центре при ГКБ №24, клиническом госпитале «Лапино» и госпитале «МД-групп» на Севастопольском проспекте. В Санкт-Петербурге – в 17 роддоме и НМИЦ им. В.А. Алмазова, также давно и успешно занимаются фетальной хирургией в Екатеринбурге в Уральском НИИ охраны материнства и младенчества.
Диагностика фето-фетального трансфузионного синдрома, синдрома анемии-полицитемии при монохориальной многоплодной беременности
Цель исследования. Провести систематический обзор данных, имеющихся в современной литературе, принципов и методов диагностики осложнений монохориальной многоплодной беременности.
Материал и методы. В обзор включены данные зарубежных статей и клинических протоколов, найденных в Pubmed и ScienceDirect по данной теме, опубликованных за последние 5 лет.
Результаты. Описаны диагностические критерии фето-фетального трансфузионного синдрома и синдрома анемии полицитемии. Приведены ранние диагностические маркеры развития осложнений, даны основы обследования осложненной монохориальной многоплодной беременности.
Заключение. Применение приведенных в обзоре клинических рекомендаций и протоколов обследования монохориальной двойни позволит своевременно диагностировать осложнения и провести адекватное лечение.
Ключевые слова
В последнее время наблюдается тенденция к увеличению частоты наступления многоплодной беременности в связи с внедрением в практику программ вспомогательных репродуктивных технологий. Известно, что при многоплодной беременности перинатальная заболеваемость и смертность значительно выше, чем при одноплодной.
В связи с этим многоплодную беременность относят к состоянию пограничному между нормой и патологией.
При монохориальной многоплодной беременности возможно развитие специфических осложнений, не характерных для дихориальной, связанных с уникальной ангио-архитектоникой монохориальной плаценты [1]. Неравномерное распределение кровотока со сбросом крови от одного плода к другому является общепринятой причиной синдрома фето-фетальной трансфузии (ФФТС) и синдрома анемии-полицитемии (САП). Причиной возникновения синдрома селективной задержки роста плода (ССЗРП) является неравномерное разделение территории плаценты между близнецами. В основе возникновения синдрома обратной артериальной перфузии (СОАП) лежит несбалансированный кровоток через сосудистые анастомозы. Некоторые из представленных выше осложнений поддаются внутриутробной коррекции, в связи с чем своевременная диагностика позволяет провести необходимые лечебные мероприятия.
Мы приводим клинически значимые диагностические критерии, которые могут и должны быть использованы при ведении монохориальной многоплодной беременности.
Фето-фетальный трансфузионный синдром
Монохориальная плацента имеет сеть сосудистых анастомозов, объединяющих циркуляторные системы обоих плодов, которая обеспечивает трансфузию крови между близнецами. Это состояние является физиологическим до тех пор, пока гемотрансфузия между плодами сбалансирована. Несбалансированная сеть анастомозов может привести к серьезным осложнениям, самым известным из которых является ФФТС, который встречается в 9–15% случаев всех монохориальных двоен [2].
В эпоху до эхографии, ФФТС диагностировался в момент рождения. Основными критериями выступали разница в весе новорожденных более 15–20% и в концентрации гемоглобина более 50 г/л [3]. Последующее исследование Wenstrom и соавт. [4] показало, что различия в весе и концентрации гемоглобина у близнецов не является достоверным признаком ФФТС. Исследователи пришли к выводу, что «исторические» неонатальные признаки не должны использоваться в качестве диагностических критериев данного синдрома. В настоящее время ФФТС диагностируется антенатально с помощью эхографии. Первоначально необходимо подтвердить, что данная беременность является монохориальной (выявление T-признака и четкая визуализация единственного плодного яйца с двумя эмбрионами в первом триместре). Различие фетометрических параметров плодов не является критерием диагностики ФФТС. Несмотря на это, общее убеждение об обязательном отставании роста одного из плодов все еще существует. В исследовании 270 пациенток с ФФТС только у 20% было выявлено отставание веса одного из плодов [5].
Ключевым диагностическим критерием ФФТС является обнаружение многоводия у одного плода и маловодия у другого. Маловодие устанавливается на основании измерения максимального вертикального кармана (МВК), который не должен превышать 2 см, этот плод является донором. Многоводие, развивающееся у плода реципиента, констатируют при увеличении МВК более 8 см до 20 недель беременности [6] и более 10 см после 20 недель [7]. Выявление многоводия при отсутствии визуализации плодных оболочек между плодами не всегда указывает на моноамниотическую двойню. Хотя ФФТС может развиться и при данном типе беременности, более вероятно, что амниотическая жидкость у донора полностью отсутствует, и плодные оболочки плотно облегают его. Это явление называется плод в «коконе». В большинстве случаев, донор прикреплен к стенке матки или поверхности плаценты.
На основании эхографических признаков ФФТС Рубен Квинтеро с соавт. [6], в 1999 году, предложили классификацию (таблица), которая получила широкое распространение и используется во всем мире.
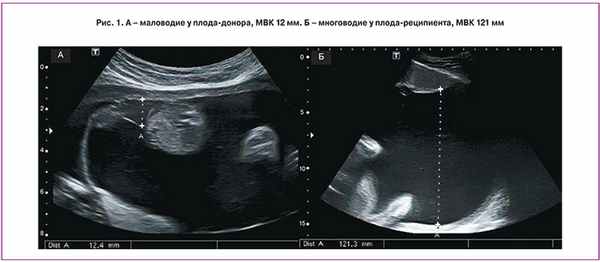
I стадия ФФТС характеризуется наличием маловодия плода донора (МВК менее 2 см) и многоводия реципиента (МВК более 8–10 см) (рис. 1).
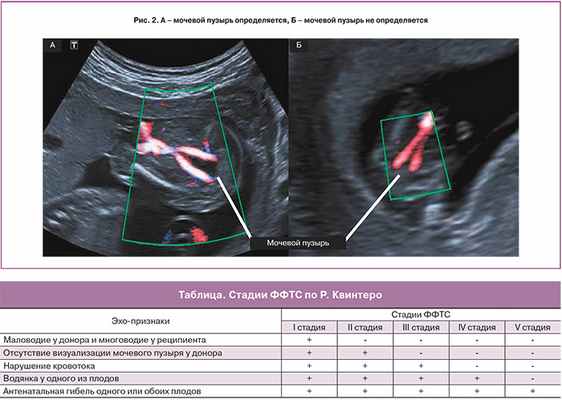
II стадия является отражением дальнейшего прогрессирования заболевания. К описанным выше признакам выраженного различия количества амниотической жидкости близнецов присоединяется отсутствие визуализации наполнения мочевого пузыря донора (рис. 2). Некоторые исследователи утверждают, что наличие небольшого мочевого пузыря донора, не наполняющегося на протяжении ультразвукового исследования, также следует расценивать как II стадию ФФТС [8].
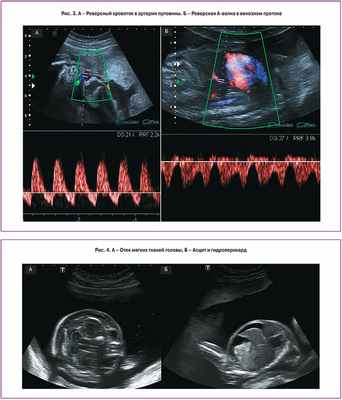
III стадия характеризуется нарушением кровотока одного или обоих плодов. При допплеровском исследовании кровотока в артериях пуповины выявляются нулевой или реверсный диастолический компонент, реверсная А-волна в венозном протоке или пульсирующий спектр в вене пуповины (рис. 3). Таким образом, возможны различные комбинации нарушений кровотока, выявляемые при допплерометрии. Как правило, нарушения кровотока в артериях пуповины чаще выявляются у донора, в то время как у реципиента чаще диагностируют аномальный кровоток в венозном протоке или пульсирующий спектр в вене пуповины, что свидетельствует о развивающейся сердечной недостаточности.
При IV стадии ФФТС у одного из плодов, чаще у реципиента, возникает водянка (асцит, гидроперикард, плевральный выпот и отек подкожно-жировой клетчатки головы и туловища) (рис. 4).
V стадия ФФТС является финальной в прогрессировании данного осложнения и проявляется гибелью одного или обоих плодов.
Ряд исследований показали зависимость перинатального исхода от стадирования тяжести ФФТС по классификации Квинтеро [7, 9, 10]. В случае прогрессирования заболевания прогноз неблагоприятный [11].
Таким образом, для обеспечения благоприятного исхода беременности крайне важны своевременная диагностика ФФТС и выбор правильной тактики ведения. Несмотря на большое количество публикаций, количество беременных с тяжелыми и запущенными случаями ФФТС не сокращается. В связи с чем необходимо придерживаться следующих рекомендаций: ультразвуковое исследование должно проводиться регулярно с интервалом 1 раз в две недели, пациентка должна быть осведомлена о типе беременности и возможных осложнениях [12]. При скриннинговом ультразвуковом исследовании в I триместре необходимо обращать внимание на ранние маркеры ФФТС. К ним относятся: разница копчико-теменного размера плодов более 6 мм, увеличение толщины воротникового пространства и аномальный кровоток в венозном протоке у одного из плодов, разница в количестве амниотической жидкости. В последующем регулярные ультразвуковые исследования должны осуществляться, начиная с 16 недель беременности, и продолжаться до 28 недель, так как ФФТС обычно развивается в этих сроках [13].
В заключение следует отметить, что, несмотря на невозможность антенатальной визуализации анастомозов монохориальной плаценты, современные эхографические технологии и знания ключевых диагностических критериев позволяют своевременно диагностировать и оценить степень тяжести ФФТС. После того как диагноз подтвержден или, по крайней мере, весьма вероятен, следующей задачей становится определение оптимального времени и метода лечения.
Синдром анемии-полицитемии
САП, описанный впервые в 2007 году, характеризуется наличием значительной разницы концентрации гемоглобина между близнецами при отсутствии различия количества амниотической жидкости, которое необходимо для диагностики ФФТС [14]. Данное осложнение монохориальной многоплодной беременности может возникнуть спонтанно или как осложнение лазерной коагуляции сосудистых анастомозов плаценты при ФФТС. Спонтанная форма САП встречается в 3–5% монохориальных многоплодных беременностей, в то время как ятрогенная форма – от 2 до 13% случаев [15, 16].
Для типичной ангио-архитектоники плаценты при САП характерно наличие небольшого количества мелких (менее 1 мм) однонаправленных артерио-венозных анастомозов [17]. Объем кровотока в сосудах малого калибра снижен из-за низкого сосудистого сопротивления (Закон Пуазейля). Предполагается, что гемотрансфузия между близнецами происходит очень медленно, в связи с чем реализуется гемодинамический компенсаторный механизм. Гиповолемия донора и гиперволемия реципиента купируется активацией или инактивацией ренин-ангиотензиновой системы, что объясняет отсутствие классических признаков ФФТС. К тому же артерио-венозные анастомозы, которые обычно равномерно распределены вдоль сосудистого экватора плаценты, локализуются вблизи края плаценты, артерио-артериальные анастомозы крайне редки, а вено-венозные и вовсе отсутствуют в плацентах при САП [18].
САП может быть диагностирован как внутриутробно, так и в послеродовом периоде. Отсутствие эхографических признаков ФФТС является необходимым условием для диагностики САП [19]. Пренатальная диагностика основана на выявлении с помощью допплерометрии увеличения максимальной систолической скорости кровотока в средней мозговой артерии (МСК МСА) более 1,5 МОМ у одного плода, что указывает на анемию, и снижения МСК у другого менее 1,0 МОМ – полицитемия [20].
Для своевременной диагностики САП целесообразно проводить допплерометрическое измерение МСК МСА плодов раз в две недели, особенно после фетоскопической лазерной коагуляции сосудистых анастомозов плаценты.
Послеродовая диагностика САП заключается в определении концентрации гемоглобина и ретикулоцитов у близнецов и детальном патоморфологическом исследовании плаценты. Для диагностики САП новорожденных оценивается разница концентрации гемоглобина у близнецов, а не сравнение с нормативными показателями. Разница в концентрации гемоглобина более 80,0 г/л достоверно указывает на наличие САП [21]. Однако в результате острой фето-фетальной трансфузии в родах или острой плодово-плацентарной трансфузии после извлечения первого близнеца, концентрация гемоглобина у новорожденных может значительно различаться. В связи с чем для дифференциальной диагностики САП и трансфузии в родах проводится определение количества ретикулоцитов. В случаях, когда кровопотеря происходит быстро при острой фето-фетальной трансфузии в родах или острой плодово-плацентарной трансфузии, концентрация ретикулоцитов не увеличивается. Напротив, при САП количество ретикулоцитов у плода с анемией всегда увеличивается. Увеличение соотношения количества ретикулоцитов между близнецами свыше 1,7 является патогномоничным признаком САП [20]. Третий критерий послеродовой диагностики САП основан на выявлении в плаценте небольшого количества артерио-венозных анастомозов малого диаметра (менее 1 мм).
САП может иметь различные проявления – от незначительного повышения МСК МСА до антенатальной гибели плода. В настоящее время разработана система стадирования САП, главной целью которой является определение степени тяжести заболевания. В её основе лежат эхографические критерии, отражающие степень тяжести анемии и полицитемии у близнецов. I стадия характеризуется увеличением MCК МСА донора более 1,5 МОМ и уменьшением MCК МСА реципиента менее 1,0 MОM, для II стадии характерно увеличение MCК МСА донора более 1,7 МОМ и уменьшение MCК МСА реципиента менее 0,8 MОM, при III стадии помимо аномальных скоростей кровотока в МСА плодов, описанных при I и II стадиях, определяются признаки сердечной недостаточности донора (нулевой или реверсный кровоток в артерии пуповины, пульсирующий спектр в пупочной вене, реверсная А-волна в венозном протоке), IV стадия характеризуется водянкой плода, а при V стадии диагностируется внутриутробная гибель одного или обоих плодов.
Определение степени тяжести позволяет прогнозировать исход беременности, осложненной САП, и своевременно начать лечение.
Выводы
Последовательное и тщательное наблюдение за течением монохориальной беременности специалистом, обладающим знаниями патофизиологии возможных осложнений, с использованием соответствующих диагностических инструментов, является неотъемлемой частью надлежащей акушерской тактики ведения и залогом успешного исхода беременности.
Список литературы
1.Denbow M.L., Cox P., Taylor M., Hammal D.M., Fisk N.M. Placental angioarchitecture in monochorionic twin pregnancies: relationship to fetal growth, fetofetal transfusion syndrome, and pregnancy outcome. Am. J. Obstet. Gynecol. 2000; 182(2): 417-26.
2.Lewi L., Gucciardo L., Huber A., Jani J., Van Mieghem T., Doné E. et al. Clinical outcome and placental characteristics of monochorionic diamniotic twin pairs with early- and late-onset discordant growth. Am. J. Obstet. Gynecol. 2008; 199(5): 511. e1-7.
3.Rausen A.R., Seki M., Strauss L. Twin transfusion syndrome. A review of 19 cases studied at one institution. J. Pediatr. 1965; 66: 613-28.
4.Wenstrom K.D., Tessen J.A., Zlatnik F.J., Sipes S.L. Frequency, distribution, and theoretical mechanisms of hematologic and weight discordance in monochorionic twins. Obste.t Gynecol. 1992; 80(2): 257-61.
5. Habli M., Livingston J., Harmon J., Lim F.Y., Plozin W., Crombleholme T. The outcome of twin-twin transfusion syndrome complicated with placental insufficiency. Am. J. Obstet. Gynecol. 2008; 199(4): 424. e1-6.
6.Quintero R.A., Morales W.J., Allen M.H., Bornick P.W., Johnson P.K., Kruger M. Staging of twin-twin transfusion syndrome. J. Perinatol. 1999; 19(8, Pt1): 550-5.
7.Senat M.V., Deprest J., Boulvain M., Paupe A., Winer N., Ville Y. Endoscopic laser surgery versus serial amnioreduction for severe twin-to-twin transfusion syndrome. N. Engl. J. Med. 2004; 351(2): 136-44.
8.Ville Y. Twin-to-twin transfusion syndrome: time to forget the Quintero staging system? Ultrasound Obstet. Gynecol. 2007; 30(7): 924-7.
9.Duncombe G.J., Dickinson J.E., Evans S.F. Perinatal characteristics and outcomes of pregnancies complicated by twin-twin transfusion syndrome. Obstet. Gynecol. 2003; 101(6): 1190-6.
11.Taylor M.J., Govender L., Jolly M., Wee L., Fisk N.M.Validation of the Quintero staging system for twin-twin transfusion syndrome. Obstet. Gynecol. 2002; 100(6): 1257-65.
13.Visintin C., Mugglestone M.A., James D., Kilby M.D.; Guideline Development Group. Antenatal care for twin and triplet pregnancies: summary of NICE guidance. BMJ. 2011; 343: d5714.
15.Robyr R., Lewi L., Salomon L.J., Yamamoto M., Bernard J.P., Deprest J., Ville Y. Prevalence and management of late fetal complications following successful selective laser coagulation of chorionic plate anastomoses in twin-to-twin transfusion syndrome. Am. J. Obstet. Gynecol. 2006; 194(3): 796-803.
16.de Villiers S.F., Slaghekke F., Middeldorp J.M., Walther F.J., Oepkes D., Lopriore E. Placental characteristics in monochorionic twins with spontaneous versus post-laser twin anemia–polycythemia sequence. Placenta. 2013; 34(5): 456-9.
17.Zhao D.P., de Villiers S.F., Slaghekke F., Walther F.J., Middeldorp J.M., Oepkes D., Lopriore E. Prevalence, size, number and localization of vascular anastomoses in monochorionic placentas. Placenta. 2013; 34(7): 589-93.
18.Lopriore E., Deprest J., Slaghekke F., Oepkes D., Middeldorp J.M., Vandenbussche F.P., Lewi L. Placental characteristics in monochorionic twins with and without twin anemia- polycythemia sequence. Obstet. Gynecol. 2008; 112(4): 753-8.
19.Slaghekke F., Kist W.J., Oepkes D., Pasman S.A., Middeldorp J.M., Klumper F.J. et al. Twin anemia-polycythemia sequence: diagnostic criteria, classification, perinatal management and outcome. Fetal Diagn. Ther. 2010; 27(4): 181-90.
20.Lopriore E., Slaghekke F., Oepkes D., Middeldorp J.M., Vandenbussche F.P., Walther F.J. Clinical outcome in neonates with twin anemia-polycythemia sequence. Am. J. Obstet. Gynecol. 2010; 203(1): 54. e1-5.
21.Lopriore E., Sueters M., Middeldorp J.M., Vandenbussche F.P., Walther F.J. Haemoglobin differences at birth in monochorionic twins without chronic twin-to-twin transfusion syndrome. Prenat. Diagn. 2005; 25(9): 844-50.
Поступила 19.06.2015
Принята в печать 26.06.2015
Об авторах / Для корреспонденции
Читайте также:
