Синдром Фразера. Диагностика и лечение синдрома Фразера у плода
Добавил пользователь Дмитрий К. Обновлено: 30.01.2026
УЗИ, МРТ при синдроме Фрейзера у плода
а) Синонимы:
• Синдром криптофтальм-синдактилии (OMIM 219000)
б) Лучевая диагностика. УЗИ при синдроме Фрейзера:
• Глазные яблоки уменьшены или отсутствуют:
о Анофтальм, микрофтальм, криптофтальм
о Исследование выполняют в поперечной плоскости на уровне глаз:
- Оценивают костные стенки глазниц и глазные яблоки
о Измеряют диаметр глазницы (ДГ) и соотносят значение с нормативными данными
о Нормальные значения соответствуют «правилу третей»:
- Интраорбитальный размер = ДГ:
Между внутренними стенками глазниц должен помещаться «третий глаз»
Увеличение интраорбитального размера связано либо с уменьшением размеров глазных яблок (синдром Фрейзера), либо с гипертелоризмом
• Аномалии развития мочевыводящих путей:
о Агенезия или гипоплазия почек
о МКДП
• Аномалии развития гортани и трахеи:
о Могут вызывать сужение и последующую обструкцию верхних дыхательных путей:
- Легкие увеличены, гиперэхогенны
- Эвентрация диафрагмы
- Сдавление сердца
- Характерен асцит, иногда выраженный
• Маловодие вследствие пороков развития почек
• 3D УЗИ позволяет исследовать черты лица, однако возможности метода нередко ограничены маловодием
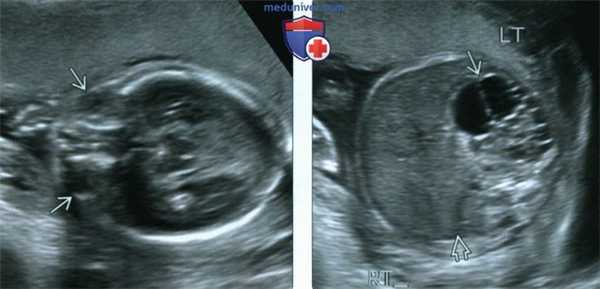
(Слева) УЗИ плода в 20 нед., поперечная плоскость. Срез через глазницы. Определяется микрофтальм. Межглазничное расстояние кажется достаточно большим (в норме это расстояние соответствует ширине одного глазного яблока), что объясняется уменьшением размеров глазных яблок, как в данном случае, или гипертелоризмом.
(Справа) Тот же плод. УЗИ брюшной полости. Визуализируется мультикистозная дисплазированная левая почка в правом почечном ложе почка отсутствует. Сочетание пороков развития почек и органа зрения позволяет заподозрить синдром Фрейзера.
в) Дифференциальная диагностика синдрома Фрейдера у плода:
1. Анофтальм, микрофтальм:
• Т13
• Синдром Уокера-Варбург: врожденная мышечная дистрофия в сочетании с пороками развития головного мозга и органа зрения:
о Первичное персистирующее гиперпластическое стекловидное тело имеет вид гиперэхогенных полос или объемного образования внутри глазницы
• Синдром CHARGE: колобома, порок сердца, атрезия хоан, задержка умственного развития, аномалии гениталий и органа слуха
• Аномалии развития органа зрения, вызванные мутацией гена SOX2
2. CAKUT:
• Аномалии развития мочевыводящих путей часто обозначают термином «врожденные аномалии почек и мочевыводящих путей» (congenital anomalies of kidney or urinary tract)
• CAKUT в сочетании с внепочечными проявлениями характерны для многих синдромов, отдельные признаки которых нередко совпадают
• Синдром Вольфа-Хиршхорна, или синдром делеции 4р: делеция дистального конца короткого плеча хромосомы 4; лицевая дизморфия, задержка роста и умственного развития, CAKUT
• Гипоплазия почек: ВМР4, SIX2\ микрофтальм, расщелина верхней губы, гипоплазия или дисплазия почек
• Синдром Барде-Бидля: многие гены, кодирующие функциональные протеины цилий; ретинопатия, аномалии развития пальцев, ожирение, мужской гипогонадизм, дисплазия почек
• Синдром Смита-Лемли-Опица: ген, кодирующий фермент, необходимый для биосинтеза холестерина (DHCR7); лицевая дизморфия, микроцефалия, синдактилия, нарушение умственного развития, дисплазия почек
• Бранхио-ото-ренальный синдром: EYA1, SIX1, SIX5, MYOG; тугоухость, боковые кисты шеи, CAKUT
• Колобома-ренальный синдром: РАХ2; колобома сосудистой оболочки глаза, CAKUT
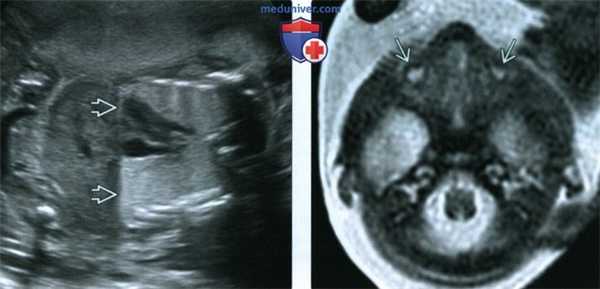
(Слева) Тот же плод. УЗИ грудной клетки, фронтальный срез. Легкие расширены и гиперэхогенны вследствие врожденной обструкции верхних дыхательных путей. Диафрагма уплощена. Также определяется маловодие, связанное с наличием аномалий развития почек.
(Справа) МРТ плода в 27 нед., Т2-ВИ, поперечная плоскость. Выраженный двусторонний микрофтальм является одной из отличительных черт синдрома Фрейзера.
г) Патологоанатомические особенности. Общие сведения:
• Генетические факторы:
о Аутосомно-рецессивный тип наследования:
- Во многих случаях заболевание возникает в результате кровосмешения
о Мутации генов FRAS1, FREM2 и GRIP1:
- Все указанные гены участвуют во взаимодействии между зачатком мочеточника и метанефрогенной мезенхимой
д) Клинические особенности:
1. Клиническая картина:
• Самые частые субъективные и объективные симптомы:
о Наиболее явной патологией являются аномалии развития почек:
- Проводят тщательный поиск других патологий
• Для диагностики заболевания в постнатальном периоде оценивают наличие «больших» и «малых» критериев:
о «Большие» критерии:
- Криптофтальм
- Патология мочевыводящих путей
- Гениталии промежуточного типа
- Пороки развития гортани и трахеи
- Положительный семейный анамнез
о «Малые» критерии:
- Аноректальные аномалии
- Дисплазия ушных раковин
- Нарушения оссификации черепа
- Расщелина верхней губы и нёба
- Пупочная грыжа
2. Демографические особенности:
• 1:200 000 живых новорожденных
• 1:10 000 плодов
3. Естественное течение и прогноз:
• Заболевание часто имеет летальный исход
• Продолжительность жизни зависит от количества и тяжести аномалий
• У многих выживших детей отмечаются задержка развития и низкий интеллект
е) Особенности диагностики. Признаки, учитываемые при интерпретации изображений:
• Пороки развития почек и мочевыводящих путей у плодов встречаются довольно часто и могут быть изолированными, однако следует всегда проводить поиск внепочечной патологии
• Патология почек и лица характерна для многих синдромов
ж) Список использованной литературы:
1. Ozemri Sag S et al: A novel mutation in the FRAS1 gene in a patient with Fraser syndrome. Genet Couns. 26(1):21—7, 2015
2. Kohl S et al: Mild recessive mutations in six Fraser syndrome-related genes cause isolated congenital anomalies of the kidney and urinary tract. J Am Soc Nephrol. 25(9): 1917-22, 2014
3. Barisic I et al: Fraser syndrome: epidemiological study in a European population. Am J Med Genet A. 161A(5):1012-8, 2013
4. Mesens T et al: Congenital high airway obstruction syndrome (CHAOS) as part of Fraser syndrome: ultrasound and autopsy findings. Genet Couns. 24(4):367-71, 2013
- Вернуться в оглавление раздела "Акушерство."
Редактор: Искандер Милевски. Дата обновления публикации: 17.11.2021
Синдром Фразера. Диагностика и лечение синдрома Фразера у плода
Данный синдром представляет собой сочетание акрофациальных и урогенитальных аномалий с криптофтальмом (аплазия или гипоплазия глазных яблок) или без него. В состав синдрома Фразера входят четыре основных клинических признака: криптофтальм, синдактилия, аномалии развития половых органов, а также наличие аналогичных поражений у братьев или сестер, и еще восемь дополнительных признаков: нарушения строения носа, ушных раковин, гортани, расщелина ротовой полости, пупочная грыжа, двухсторонняя или односторонняя агенезия почек, скелетные аномалии и задержка умственного развития.
Синонимы. Синдром криптофтальма - синдактилии.
Распространенность. Частота встречаемости составляет 0,043 на 10 000 новорожденных и 1,1 на 10 000 мертворожденных.
Этиология. Возможно, аутосомно-рецессивный тип наследования, поскольку такого рода аномалии отмечаются у детей, рожденных в близкородственных браках. Риск рецидива составляет 25%.
Диагностика. Диагноз устанавливается пренатально при выявлении сочетания обструктивной уропатии, микрофтальмии, синдактилии, обструкции воздухоносных путей легких вследствие атрезии гортани, асцита, водянки плода с отеком тканей в области шеи и маловодия.
Патогенез. Предполагаются дефекты апоптоза, поскольку несколько аномалий вызываются отсутствием прцессов программированной гибели клеток (слияние век, пальцев и нарушение формирования просвета гортани и влагалища).
Сочетанные аномалии. Криптофтальм; аплазия или недоразвитие слезных протоков; аномалии среднего и наружного отделов уха; высокое небо; расщепление носа и языка по средней линии; гипертелоризм; стеноз гортани; синдактилия; широкое расстояние между костями лонного сочленения; нарушение расположения пупочного кольца и сосков; недоразвитие брыжейки тонкого кишечника; нарушение развития почек; сращение половых губ и увеличение клитора; двурогая матка и неправильно сформированные маточные трубы.
Дифференциальный диагноз. Гиперэхогенные легкие могут отмечаться при диафрагмальной грыже, кистозно-аденоматозном пороке леких (тип III), секвестрации легкого и атрезии трахеи или бронхов. Дифференциальный диагноз криптофтальма включает алобарную голопрозэнцефалию, которую легко отличить на основании простой формы гидроцефалии, имеющейся у плодов с синдромом Фразера.
Прогноз. При атрезии гортани или агенезии почек прогноз летальный. Если основным признаком является криптофтальм, то даже хирургическая коррекция в редких случаях, когда это бывает возможно осуществить, дает очень низкую остроту зрения (20/200 и 20/360).
Акушерская тактика. Зависит от особенностей доминирующих аномалий. При наличии агенезии почек или атрезии гортани может быть рекомендовано прерывание беременности.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Ветряная оспа плода. Диагностика и тактика при ветряной оспе у плода
Определение. Внутриутробная ветрянка плода проявляется сочетанными аномалиями различных органов, возникающих вследствие его инфицирования при заболевании матерью ветряной оспой.
Синонимы. Врожденный синдром ветряной оспы, ветряночная эмбриопатия, ветряная оспа, опоясывающий герпес.
Распространенность. Частота встречаемости инфицирования матери вирусом Varicella из группы герпес-вирусов составляет 7 случаев на 10 000 беременностей. При этом риск поражения плода среди всех беременных, зараженных ветряной оспой, варьирует от 1 до 20%.
Этиология. Вирус герпеса Varicella. Риск рецидива. Менее 1%.
Диагностика. Инфицирование матери в любые сроки беременности подвергает плод высокому риску трансплацентного заражения и указывает на необходимость проведения наблюдения за его развитием. Риск возникновения аномалий у плода, бывает выше во время первого и второго триместров. Эхографические признаки заболевания включают антенатальную гибель плода, задержку его внутриутробного развития, скелетно-мышечные аномалии, такие как косолапость и аномальное положение рук (вызванное как некрозом, так и денервацией пораженных тканей), ограничение объема разгибания конечностей вследствие образования рубцов, гипоплазию конечностей, хориоретинит, катаракту, микрофтальмию, водянку плода, многоводие, появление гиперэхогенных включений в печени, аномалии мозга, такие как вентрикуломегалия или атрофия и микроцефалия. Для подтверждения наличия инфицирования плода рекомендуется выделение вируса или определение специфичного IgM в амниотической жидкости или крови плода.
Патогенез. Прямое поражение тканей плода нейротропным вирусом.
Сочетанные аномалии. Как было описано выше, при поражении вирусом ветряной оспы могут отмечаться различная степень тяжести аномалий многих органов. У выживших детей могут развиваться задержка умственного развития, судороги и ограничения в объеме движения конечностей.
Дифференциальный диагноз. Другие вирусные инфекции, острые сосудистые нарушения и синдром амниотических перетяжек.
Прогноз. Тяжесть поражения плода варьирует от кожных поражений до летального диссеминированного течения болезни. При ограниченном количестве кожных дефектов имеется тенденция к очень благоприятному прогнозу. Деструкция мозга плода, а также тяжелое течение заболевания ветряной оспой у матери вплоть до развития у нее летальной пневмонии или энцефалита сопровождается исключительно высоким риском антенатальной гибели. Уровень смертности плода колеблется от 39 до 61%.
Инфицирование матери в первом или в начале второго триместра беременности чаще сопровождается развитием у него аномалий, в то время как поражение в третьем триместре характеризуется более высоким риском возникновения опоясывающего герпеса в неонатальном периоде.
Акушерская тактика. Если принимается решение о ее пролонгировании, рекомендуется проведение периодического эхографического контроля с целью выявления возможных аномалий, контрактур конечностей и других признаков заболевания плода. Показано лечение тяжело больных взрослых и новорожденных ацикловиром (acyclovir), который активен против вируса ветряной оспы.
Синдром Фрейзера: внутриротовые симптомы и протокол лечения
Синдром Фрейзера является редкой формой генетически детерминированных пороков развития с аутосомно-рецессивным типом наследования. Частота унаследования колеблется в диапазоне 15-25%. Выживаемость при данном типе патологии низкая, дети умирают в возрасте до одного года. Синдром Фрейзера характеризуется множественными пороками развития, в том числе криптофтальмией, синдактилией рук и ног, половыми аномалиями, и часто ассоциирован с пороками развития почек, уха, носа, гортани, скелета. Одним из главных диагностических признаков синдрома Фрейзера является криптофтальмия, но она не является обязательной. В 1962 году Джордж Фрейзер был первым, кто диагностировал у двух братьев криптофтальмию, связанную с другими отклонениями в развитии.
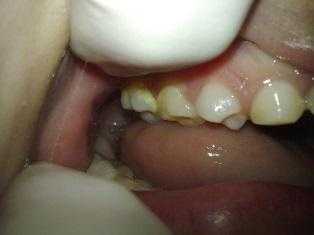
Результаты анализа литературы показывают, что орофациальные аномалии редко ассоциированы с данным синдромом. Частота возникновения челюстно-лицевых аномалий и их диагностическое значение имеют следующий характер распределения: асимметрия лица встречается в 10% случаев, заячья губа и волчья пасть – в 2%-11%, оживальная форма неба – в 12% , также в более редких случаях встречается анкилоглоссия, скученность зубов, слияние молочных зубов и зубная гипоплазия.
Данное исследование посвящено анализу общих и стоматологических проявлений характерных клинических признаков синдрома Фрейзера у пациента, а также созданию протокола химиотерапевтического лечения с возможностью ручного удаления зубного камня.
Клинический случай
Хотя симптом криптофтальмии и не был диагностирован, у пациента наблюдались асимметрия лица, двусторонний порок развития ушной раковины, потеря слуха, агенезия правой почки, симптом барабанных палочек, крипторхизм, паралич пищевода и трахеи, пупочная грыжа, ларинготрахеомаляция, половые аномалии, и повторяющиеся приступы на фоне хронического заболевания легких. Ребенка кормили парентерально от рождения.
Фото 1: Лицевые характеристики пациента: асимметрия лица и двусторонний порок развития ушной раковины.
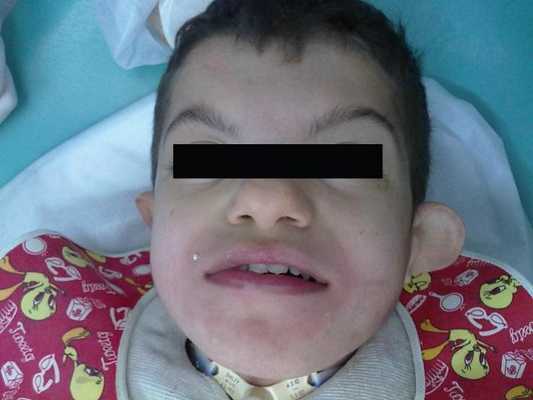
Ребенок и его семья обратились за помощью в медпункт в городе Баруэри в 2000 году. Пациент был направлен на дополнительное стоматологическое обследование в связи с повторяющимися эпизодами хронического заболевания легких, после чего его госпитализировали в связи с возникновением осложнений на фоне синдрома Фрейзера. Для профилактики такого рода прогрессирующих последствий возникла необходимость в мультидисциплинарном подходе к организации лечения с участием стоматологических и медицинских экспертов.
Во время проведения опроса мать отрицала какое-либо кровное родство с мужем и сообщила, что младший ребенок не имеет никаких подобных признаков. Применение перманентной антибактериальной терапии стало жизненной необходимостью для профилактики заболеваний легких. В течение первых 4 лет лечения больному ни разу не проводились стоматологические вмешательства в связи с присущей тяжелой формой умственной отсталости. Следовательно, о проведении целенаправленной терапии в течение этого периода не могло быть и речи.
Примерно через 3 года после начала стоматологического лечения, лечащий персонал смог наладить контакт с пациентом, позволив ему с почувствовать себя частью группы и больше не опасаться окружающего пространства при проведении консультаций.
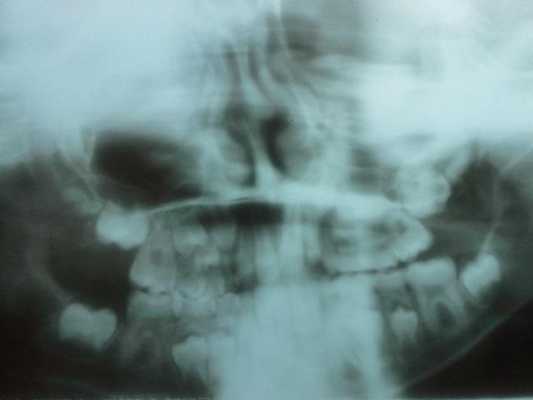
Во время внутриротового обследования у пациента обнаружена смешанная форма прикуса, а рентгенографическое исследование (фото 2) подтвердило присутствие всех постоянных зубов и отсутствие каких-либо нарушений в тканях пародонта. Цемент, парадонтальная связка и кость остались неповрежденными, несмотря на наличие маргинального гингивита.
Фото 2: Рентгенографическое исследование.
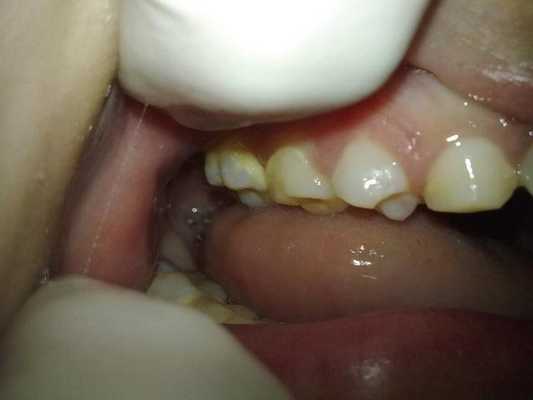
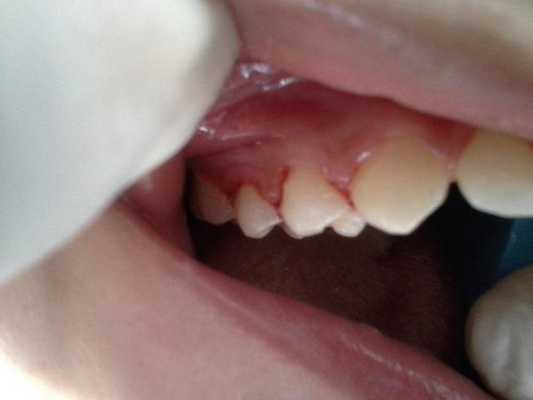
Поверхность зубов была покрыта налетом, а в районе жевательных зубов верхней и нижней челюстей, а также на фронтальных зубах нижней челюсти было диагностировано присутствие наддесневого зубного камня (фото 3).
Фото 3: Внутриротовые проявления: наличие зубного камня.
При реализации концепции протокола предоставления медицинской помощи, первоочередной задачей являлось уменьшение периодических приступов пневмонии, что предусматривало использование химиотерапевтических агентов в сочетании с ручным удалением видимого зубного камня (фото 4). Так, непосредственно перед клиническим вмешательством проводилась антибактериальная терапия с использованием 0,12% хлоргексидина, за которой следовала гигиеническая манипуляция удаления зубного камня.
Во время механического удаления твердых отложений команда врачей-стоматологов использовала мощную аспираторную систему для удаления частиц зубного камня, отделившихся в процессе ручного выскабливания. Целесообразность данной процедуры обоснована возможностью физиологической аспирации фрагментов зубного камня при вдохе. Поэтому один аспиратор поместили в ротовую полость, а другой – в отверстие трахеостомы.
Фото 4: Клиническая картина ротовой полости после лечения.
Для уменьшения бактериальной обсемененности в полости рта после завершения сеанса с помощью зубной щетки нанесли 2% гель хлоргексидина. Повторная процедура была назначена через 2 месяца. Семье было настоятельно рекомендовано контролировать состояние зубов с помощью роторасширителя (учитывая трудности открывании рта у данного пациента).
Второе, чему было уделено внимание во время разработки протокола лечения, это рентгенологическая оценка и мониторинг баланса между ризолизисом и ризогенезом молочных и постоянных зубов, а также оценка необходимости экстракции при высоком уровне ризолизиса молочных зубов. Параллельно проводилась оценка стадий развития постоянных зубов по шкале Nolla для профилактики риска аспирации молочных зубов.
Домашнее лечение предусматривало активное участие матери в чистке зубов пациента, с использованием только зубной щетки без пасты для удаления налета. Мы не рекомендовали использовать зубную пасту из-за риска ее аспирации и возможности возникновения легочных осложнений. Родители были проинструктированы, как чистить зубы с помощью пропитанной 0,12% раствором хлоргексидина марли. Данную процедуру рекомендовалось проводить на протяжении 1 недели в месяц.
Вышеописанный протокол комплексного подхода к пациенту был применен в начале лечения. Иногда повидон-йод (PVP-I) использовался как альтернатива хлоргексидину, так как никаких аллергических реакций на йод у пациента диагностировано не было.
В 2013 году, когда у пациента сформировался постоянный прикус, фокус лечения с учетом характерных для периода полового созревания изменения в тканях пародонта переместился на контроль заболеваний пародонта путем проведения ежемесячных консультаций. Пациент в настоящее время находится на указанном этапе лечения.
Данный клинический случай описывает клинические проявления синдрома Фрейзера, в том числе и криптофтальмию – наиболее серьезное осложнение данной патологии, проявление которого не всегда является обязательным.
Некоторые авторы утверждают, что один второстепенный и два основных диагностических критерия или же один основной и, по крайней мере, четыре дополнительных, необходимы для корректной диагностики заболевания. Основные критерии включают криптофтальмию, синдактилию, генитальные аномалии, а также проявление аналогичных признаков синдрома у двойни. Второстепенные (дополнительные) диагностические критерии включают врожденные пороки развития носа, уха, гортани, расщелины губ и неба, скелетные дефекты, пупочные грыжи, агенезию почек и умственную отсталость.
В данном клиническом случае у пациента были диагностированы половые аномалии (как основной критерий) и врожденные пороки развития уха, гортани, а также пупочная грыжа, агенезия почки и умственная отсталость в качестве второстепенных (дополнительных) критериев.
Клинические проявления, ассоциированные с синдромом Фрейзера, включают задержку развития зубов, длительную ретенцию молочных зубов, агенезию вторых премоляров, микродонтию молочных моляров и формирование широкой зоны фиброзной ткани в вестибулярной части слизистой оболочки.
Ни одно из этих клинических проявлений не наблюдалось у данного пациента. Образование кальцинированного налета в области десен было связано с невозможностью ее механического удаления, что в результате привело к накоплению отложений на поверхности зубов. При некоторых системных заболеваниях проблема налета обусловлена необходимостью использования препаратов, снижающих слюноотделение.
Аккумуляция налета и бактериального роста у подобных больных прогрессирует также вследствие трудностей обучения мануальным навыкам чистки зубов. В случае с данным пациентом трудность или даже невозможность самостоятельного ухода за зубами вызвана умственной отсталостью и ограниченным доступом к ротовой полости. Эти факторы и способствовали формированию твердых отложений.
Среди системных нарушений респираторные заболевания наиболее тесно ассоциированы с заболеваниями пародонта. Предыдущие исследования доказали, что заболевания пародонта могут повлиять на ход развития респираторных инфекций, особенно пневмонии.
В данном исследовании удаление наддесневого камня и снижение бактериальной нагрузки с использованием химиотерапевтических препаратов помогли уменьшить частоту приступов при хроническом заболевании легких. Такой результат обусловлен тесной взаимосвязью между бактериями, присутствующими в полости рта и бактериями, вызывающими воспаление органов дыхания.
Хлоргексидин является одним из наиболее изученных противомикробных препаратов и, как доказано, обладает наиболее мощным действием. Он очень эффективен, и является золотым стандартом в стоматологии, применяемым в антибактериальных целях. Химически он классифицируется как бис-гуанидин с присущими гидрофильными и гидрофобными свойствами.
Хлоргексидин обладает широким спектром противомикробного действия, высокой субстантивностью, является безопасным и эффективным препаратом. Первоначально молекулы хлоргексидина абсорбируются на бактериальной клеточной стенке, где их положительный заряд взаимодействует с отрицательно заряженными молекулами поверхности бактериальной мембраны. Это приводит к увеличению проницаемости бактериальной мембраны, молекулы хлоргескидина проникают в цитоплазму бактерий, что в результате приводит к разрушению клеточной мембраны и утечке внутриклеточных компонентов. Кроме того, хлоргексидин инициирует нарушение метаболизма глюкозы и молочной кислоты Streptococcus mutans и снижение протеолитической активности Porphyromonas gingivalis. PVP-I был выбран в качестве антимикробного агента в данном протоколе лечения из-за его широкого противомикробного спектра действия в отношении грамположительных и грамотрицательных бактерий, грибов, микобактерий, хламидий, вирусов и простейших. Антимикробная активность PVP-I является результатом сильных окислительных эффектов на структуру аминогрупп (-NH), тиоловых (-SH) и фенольных гидроксильных групп (-ОН) в аминокислотах и нуклеотидах. Кроме того, PVP-I сильно реагирует с двойными связями ненасыщенных жирных кислот клеточной стенки и органелл мембран.
Мы также решили добавлять хлоргексидин к PVP-I для снижения микробной резистентности.
Пациент в настоящее время находится в подростковом возрасте, поэтому внимание к диагностике клинических признаков должно быть удвоено в связи с гормональными изменениями в период полового созревания. Такие физиологические процессы являются предрасполагающими факторами заболеваний пародонта, а гормоны могут влиять на состояние сердечно-сосудистой системы, вызывая увеличение проницаемости сосудов, и, как следствие, кровоточивость десен.
В подростковом возрасте колонизация тела микроорганизмами изменяется из-за возрастающего влияния половых гормонов. Как следствие, нагрузка биопленки в результате размножения грамотрицательных бактерий увеличивается в течение этой фазы.
Повышенные уровни гормонов, в частности, эстрогена и прогестерона, усугубляют реакцию десен на присутствие налета.
Как сообщалось ранее, существует прямая связь между повышением уровня этих двух гормонов и увеличением числа анаэробных микроорганизмов, которые играют важную роль в возникновении и прогрессировании заболевания пародонта путем уменьшения фагоцитарной способности полиморфноядерных (PMN) лейкоцитов и увеличения секреции интерлейкина-1b (IL-1b). Кроме того, данные половые гормоны увеличивают проницаемость сосудов и способствуют взаимодействию протеолитических ферментов с интерлейкином-6 (IL-6) – медиатором воспалительного процесса.
Половые гормоны также изменяют продуцирование цитокинов. Прогестерон снижает производство IL-6 в фибробластах десны в два раза по сравнению с уровнем IL-6, наблюдаемым при нормальной концентрации гормона.
Сопутствующее продуцирование прогестерона и эстрогена также может изменять иммунную реакцию за счет экспрессии и презентации антигена, продуцирования цитокинов, экспрессии факторов апоптоза и гибели клеток.
Прогестерон стимулирует выработку медиаторов воспаления, например, простагландина Е2, а также увеличивает количество и хемотаксис PMN лейкоцитов в десневой борозде. В отличие от этого, эстрадиол уменьшает скорость хемотаксиса. Эти данные подтверждают текущие предположения о возможных заболеваниях пародонта больных с синдромом Фрейзера, которым они подвергаются в подростковом возрасте и в период полового созревания.
Изменения гормонального и иммунного профиля данного пациента могут повлиять на его стоматологическое и общее здоровье, в частности, путем возникновения повторных эпизодов пневмонии. Таким образом, на данном этапе лечения мы намерены клинически контролировать возможность возникновения заболеваний пародонта в связи с инфекционными осложнениями, так как корригировать иммунные факторы в данном возрасте не желательно.
Выводы
На основании клинических проявлений синдрома Фрейзера в полости рта, дантист должен способствовать сохранению стоматологического здоровья пациента и соответственного уровня общего качества жизни. Стоматологическое здоровье тесно связано с общесоматическим состоянием и болезнью в целом, поскольку заболевания полости рта также могут инициировать биологические нарушения и системное распространение инфекций.
Авторы: Talita Lopes de Oliveira, Giselle Rodrigues de Sant Anna
Синдром Пфайффера
Синдром Пфайффера – генетическое заболевание с аутосомно-доминантным механизмом наследования, характеризующееся нарушением формирования костей черепа и конечностей. Симптомами являются деформации черепа (в результате краниосиностоза), костей пальцев рук и ног. Некоторые формы заболевания характеризуются глухотой, нарушением интеллектуального развития, стоматологическими патологиями. Диагностика синдрома Пфайффера производится на основании данных настоящего статуса больного, рентгенологических исследований, молекулярно-генетических анализов. Специфическое лечение отсутствует, применяют паллиативные мероприятия для предотвращения тяжелых осложнений (в том числе и хирургического характера) и симптоматическую терапию.
Общие сведения
Синдром Пфайффера – врожденное генетически обусловленное нарушение формирования черепа и конечностей, которое характеризуется краниосиностозом, деформацией лица, расширением и укорочением пальцев, частыми синдактилиями. Впервые это заболевание было описано в 1964 году немецким педиатром Рудольфом Пфайффером, в дальнейшем было выявлено несколько клинических форм патологии.
По данным современной генетики, синдром Пфайффера является аутосомно-доминантным состоянием с полной пенетрантностью, половое распределение больных не имеет особенностей – с одинаковой частотой болеют как мальчики, так и девочки. Встречаемость точно не определена, по некоторым данным она составляет примерно 1:100 000 новорожденных. Каких-либо национальных или расовых особенностей в распределении этого заболевания также не выявлено. В отношении синдрома Пфайффера крайне важна ранняя диагностика, так как от времени начала паллиативного лечения во многом зависит прогноз заболевания и качество дальнейшей жизни больного.
Причины синдрома Пфайффера
Несмотря на то, что синдром Пфайффера является наследственным заболеванием с аутосомно-доминантным механизмом передачи, большинство случаев этой патологии являются следствием спонтанных герминативных мутаций в половых клетках родителей. При этом за развитие состояния отвечают дефекты двух генов, кодируемые ими белки обладают сходными функциями.
По причине того, что вышеуказанные белки обладают очень похожими функциями, патогенез синдрома Пфайффера при дефектах гена FGFR1 и FGFR2 тоже весьма схож. В результате миссенс-мутаций изменяется структура экспрессируемого белка, из-за чего полученный рецептор становится неспособен полноценно связываться с веществом-стимулятором (фактором роста фибробластов) и передавать информацию внутрь клетки. Так как фибробласты активно участвуют в процессах остеогенеза в эмбриональный период и в первые годы жизни ребенка, такое изменение рецепторов ведет к разнообразным костным патологиям.
Доказательством этого является тот факт, что дефекты гена FGFR1, помимо синдрома Пфайффера, приводят к тригоноцефалии 1-го типа и ряду других нарушений, а FGFR2 – к неспецифическому краниосиностозу, синдрому Крузона и иным похожим патологиям. При синдроме Пфайффера происходит преждевременное сращение костей черепа, что становится причиной деформации головы и лица, повышения внутричерепного давления – это, в свою очередь, способно вызывать ряд вторичных нарушений от нейросенсорных расстройств до глубокой умственной отсталости.
Классификация и симптомы синдрома Пфайффера
На сегодняшний день выделяют как минимум три клинические формы синдрома Пфайффера, которые различаются между собой выраженностью нарушений, течением и прогнозом заболевания. Причина такого различия лежит в молекулярно-генетических механизмах развития патологии – 1-й тип обусловлен единственной мутацией гена FGFR1 (252Pro-Arg) и некоторыми нарушениями структуры FGFR2, тогда как 2-й и 3-й типы вызваны различными вариантами дефектов только гена FGFR2.
Более тонкие особенности патогенеза каждой формы заболевания в настоящее время находятся в стадии изучения. Благодаря характерной клинической картине, специалисты могут определить разновидность синдрома Пфайффера, основываясь только на симптомах патологии. Молекулярно-генетический анализ во многих случаях необходим лишь для окончательного подтверждения диагноза.
Синдром Пфайффера 1-го типа является наиболее распространенным и благоприятным в прогностическом отношении вариантом заболевания. При этом состоянии уже с самого рождения ребенка отмечаются аномалии развития лица – гипертелоризм, недоразвитие верхнечелюстных костей, расширенные плоские переносица и спинка носа. Иногда могут отмечаться расщепление твердого нёба и экзофтальм. При этой форме синдрома Пфайффера характерные изменения формы черепа сводятся к увеличению его высоты и длины, очень редко отмечается асимметрия. В дальнейшем могут возникать аномалии зубов – искривление зубного ряда, гипоплазия, склонность к кариесу. Деформации костей конечностей сводятся к расширению фаланг первых пальцев на руках и ногах, может отмечаться частичная синдактилия.
Синдром Пфайффера 2-го типа – более тяжелая форма заболевания, проявляющаяся значительной выраженностью сращения костей черепа между собой и рядом других аномалий. Голова из-за краниосиностоза приобретает характерную форму «трилистника» или «листка клевера», наблюдается значительная гипоплазия средней трети лица. По причине грубого нарушения формирования черепа данный тип синдрома Пфайффера характеризуется выраженной умственной отсталостью и рядом неврологических нарушений. Пороки развития конечностей сводятся к расширению первых пальцев, синдактилии, анкилозу локтевых суставов. Кроме того, синдром Пфайффера 2-го типа часто сопровождается различными пороками развития внутренних органов. Все вышеперечисленные нарушения могут стать причиной летального исхода в раннем возрасте.
Синдром Пфайффера 3-го типа во многом схож по своим проявлениям с предыдущим вариантом заболевания, но краниосиностоз при этом не приводит к формированию деформации черепа в виде «листка клевера». У больных отмечается увеличение головы в высоту, пороки развития конечностей (синдактилии, анкилозы суставов), экзофтальм, неврологические нарушения. Для этого варианта синдрома Пфайффера характерно раннее развитие зубов, нередко младенцы уже рождаются с ними (натальные зубы). Также возможны пороки внутренних органов и ранняя смерть из-за совокупности нарушений.
Такое различие в клинической картине и прогнозе различных вариантов синдрома Пфайффера накладывает свой отпечаток на наследование этого заболевания. Так как 1-й тип, особенно в случае своевременного выявления и правильного лечения, характеризуется сохранением нормального уровня интеллекта, фертильности и выживаемости больных, возможна аутосомно-доминантная передача патологии потомству. Более тяжелые 2-й и 3-й типы чаще всего приводят к ранней смерти или глубокой инвалидизации больных, эти варианты синдрома Пфайффера возникают только в результате спонтанных мутаций.
Диагностика
Своевременная диагностика синдрома Пфайффера крайне важна, так как она позволяет вовремя составить схему паллиативного лечения, тем самым избежать осложнений и значительно улучшить качество жизни больного. Но это справедливо лишь в отношении 1-го типа заболевания, так как при других вариантах патологии комплекс пороков развития настолько тяжел, что практически не оставляет шансов на сохранение интеллекта, а в дальнейшем – жизни больных.
Для выявления синдрома Пфайффера используют ультразвуковые методики (в том числе и в качестве пренатальной диагностики), рентгенографию, молекулярно-генетические анализы. На профилактических УЗИ во время беременности при наличии этого заболевания у ребенка во 2-3 триместре можно выявить нарушение формирования черепа, синдактилию, пороки развития внутренних органов.
Рентгенологические методы редко используют при ранней диагностике синдрома Пфайффера у детей – в основном, производят исследование черепа, которое обнаруживает наличие краниосиностоза различной степени выраженности, гипоплазию верхнечелюстных костей, изменение формы глазниц. Также на рентгене можно определить изменение формы костей больших пальцев рук и ног.
Молекулярно-генетическая диагностика производится врачом-генетиком – в этом случае при подозрении на наличие синдрома Пфайффера 1-го типа производят поиск точечной мутации 252Pro-Arg методом прямого секвенирования экзона 7а гена FGFR1. В других случаях выполняют секвенирование 7-го и 9-го экзонов гена FGFR2 – именно там возникает большинство дефектов, приводящих к развитию синдрома Пфайффера. Вспомогательную роль в диагностике заболевания могут играть методы медицинской визуализации, направленные на определение аномалий развития внутренних органов.
Лечение синдрома Пфайффера
Лечение синдрома Пфайффера только симптоматическое и паллиативное – специалисты стараются устранить повышенное внутричерепное давление, обеспечить нормальное развитие нервной системы, снизить выраженность нарушений со стороны внутренних органов. Для этого широко применяют хирургические методики – разделение пальцев, пластику черепа и ряд других. Также назначают препараты, направленные на улучшение питания нервной ткани – ноотропные средства, витамины. При своевременно начатом лечении синдрома Пфайффера 1-го типа выживаемость больных значительно увеличивается. К сожалению, объем медицинской помощи зачастую недостаточен для полноценного лечения больных синдромом Пфайффера 2-го и 3-го типов.
Прогноз и профилактика
Прогноз синдрома Пфайффера определяется вариантом этого заболевания. Первый тип характеризуется относительно благоприятным прогнозом, который зависит от своевременности выявления патологии и правильности подобранного лечения. В благоприятных условиях больные сохраняют нормальный интеллект, доживают до преклонного возраста и способны иметь потомство – при этом риск передачи заболевания детям составляет минимум 50%.
Однако синдром Пфайффера 2-го и 3-го типов обладает крайне неблагоприятным прогнозом – совокупность неврологических и других нарушений часто становится причиной летального исхода в раннем детстве. Даже при выполнении паллиативных мероприятий у больных наблюдается выраженная олигофрения и глубокая инвалидизация. Профилактика синдрома Пфайффера, учитывая часто спонтанный механизм развития этого заболевания, возможна только в рамках пренатальной диагностики ультразвуковыми или генетическими методами.
Читайте также:
