Синдром Иценко—Кушинга. Гипертония при синдроме Иценко-Кушинга.
Добавил пользователь Alex Обновлено: 29.01.2026
Патогенетические механизмы развития АГ - одного из наиболее частых проявлений синдрома Иценко-Кушинга - также остаются неуточненными. По гемодинамической характеристике АГ при эндогенном гиперкортизолиз- ме является в первую очередь гипертензией вследствие повышения периферического сопротивления, при этом величина ударного и сердечного выбросов у большинства больных снижена. Уменьшение разовой и минутной производительности сердца объясняется как адаптивной реакцией кровообращения на значительное повышение ОПСС, так и стероидной миокардиодистрофией, сопровождаемой нарушением инотропной функции сердечной мышцы у таких больных.
Важным патогенетическим звеном формирования АГ при синдроме Иценко-Кушинга является значительное увеличение продукции кортизола. Гипертензивный эффект высоких концентраций кортизола в организме объясняется следующим образом. Во-первых, глюкокортикоиды воздействуют на центральную нервную систему (ЦНС) и увеличивают симпатическую активность. Во-вторых, избыточные количества кортизола в организме могут взаимодействовать с минералокортикоидными рецепторами (кортикостероидные рецепторы 1-го типа) сосудистой стенки и почек. В-третьих, возможно, значение имеет воздействие высоких концентраций кортизола на кортикостероидные рецепторы 2-го типа сосудистой стенки, что приводит к увеличению активности натрий-калиевой- аденозинтрифосфатазы (АТФаза) гладкомышечных элементов и вазоспазму. Важную роль в патогенезе АГ у больных эндогенным гиперкор- тизолизмом играет увеличение чувствительности сосудистой стенки под влиянием гиперкортизолемии к прессорным веществам, таких как норадреналин и AT II.
Дискуссионным является вопрос о значении РААС в развитии и поддержании АГ у больных с синдромом Иценко-Кушинга. Многие исследователи полагают, что вторичный гиперальдостеронизм - важный фактор повышения АД. Выявлено значительное увеличение активности ренина плазмы и уровня альдостерона у лиц с синдромом Иценко-Кушинга, причем между активностью ренина плазмы, содержанием альдостерона в плазме крови и величиной ОПСС наблюдалась сильная корреляция. Кроме того, доказано, что секреция альдостерона значительно увеличена при раке коры надпочечника. Вместе с тем в работах последних лет продемонстрировано, что у пациентов с синдромом Иценко-Кушинга наблюдаются нормальные показатели содержания альдостерона в плазме крови и суточной моче. Известно, что помимо плазменной существует тканевая РААС. Причем при АГ именно ренин ткани играет решающую роль в активации РААС.
Ряд авторов полагают, что определенную роль в патогенезе АГ у пациентов с синдромом Иценко-Кушинга играют прессорные стероиды, отличные от кортизола и альдостерона. В первую очередь это относится к дезоксикортикостерону, 19-нор-дезоксикортикостерону и, возможно, другим вазоактивным стероидам не установленного пока строения. Гипер- кортизолизм приводит к усилению синтеза липокортина, угнетающего мембранную фосфолипазу А2. Это может вызвать уменьшение продукции депрессорных простагландинов. Кроме того, снижение экскреции калликреина с суточной мочой у больных с синдромом Иценко-Кушинга свидетельствует о снижении у них функциональной активности такой депрессорной системы, как калликреин-кининовая. Недостаточность депрессорных систем у пациентов с синдромом Иценко-Кушинга может возникать также на уровне взаимодействия эндотелий - гладкая мускулатура сосуда. Гиперкортизолизм приводит к дисбалансу продукции эндотелиального фактора релаксации сосудов и эндотелина, а также к снижению эндотелийзависимого торможения репликации гладкомышечных клеток.
Вместе с тем необходимо отметить, что у больных с синдромом Иценко-Кушинга увеличена секреция вазопрессина, стимулирующего натрий- урез и вызывающего вазо дилатацию. Данная реакция нейрогуморальной регуляторной системы, по-видимому, имеет компенсаторный характер, однако является недостаточной для устранения дисбаланса, возникающего вследствие активации прессорных гормональных систем и угнетения депрессорных звеньев регуляции. Также отмечают, что примерно у 25% больных с синдромом Иценко-Кушинга имеются мочекаменная болезнь и вторичный пиелонефрит. Ренопаренхиматозный компонент является важным патогенетическим звеном в развитии АГ при синдроме Иценко- Кушинга, причем с сохранением гипертонии у некоторых пациентов даже после радикального устранения гиперкортизолизма определяется, в первую очередь, персистированием ХИН.
Анализ гемодинамических нарушений, выявленных в процессе исследования функционального состояния сердечно-сосудистой системы у больных эндогенным гиперкортизолизмом, дает возможность утверждать, что в основе АГ у пациентов с синдромом Иценко-Кушинга лежит значительное увеличение удельного периферического сопротивления в сочетании с гипокинетическим кровообращением.
У больных с синдромом Иценко-Кушинга выявлен ряд эндокринных нарушений. Отмечается снижение секреции тиреотропина и ТЗ. Нарушение секреции ТТГ объясняется, по-видимому, расстройством гипоталамо- гипофизарной системы при данном заболевании. Снижение уровня ТЗ при нормальном содержании тироксина в сыворотке крови обусловлено как уменьшением ТТГ-активности, так и блокированием синтеза трийод- тиронина из Т4 в тканях под влиянием гиперкортизолизма.
Верификация клинического диагноза. Аспекты дифференциальной диагностики. В диагностике эндогенного гиперкортизолизма выделяют 2 этапа: установление диагноза синдрома Иценко-Кушинга и определение его клинической формы. Проведение первого этапа связано с необходимостью установления наличия гиперкортизолизма, второго - с выявлением характера изменений в гипофизе, надпочечниках. На первом этапе диагностики синдрома Иценко-Кушинга используют специальные лабораторные методы исследования.
При общем лабораторном обследовании отмечаются полицитемия, лейкоцитоз, снижение толерантности к глюкозе, умеренная гипокалие- мия. Уточнить диагноз позволяют специальные тесты: повышенная экскреция 17-ОКС и 17-КС с мочой за сутки. Только при положительном результате этого скринингового теста переходят к установлению причины гиперкортизолизма путем определения уровня АКТГ в крови и дексаме- тазоновой пробы. Меньшее диагностическое значение имеет увеличение уровня кортизола в крови. Для гиперкортизолизма гипофизарного происхождения, наряду с повышением уровня кортизола, характерны увеличение содержания в крови АКТГ в базальных условиях и подавление его секреции после приема дексаметазона. При этом снижаются также содержание 17-ОКС в крови и их экскреция с мочой. При синдроме Иценко-Кушинга повышенная продукция кортизола угнетает гипоталамо- гипофизарную ось и вызывает снижение уровня АКТГ, а прием дексаметазона не приводит к уменьшению выработки кортизола и его содержания в плазме крови.
Рентгенодиагностика опухолей гипофиза и надпочечников представляет значительную сложность. В большинстве случаев на обычном снимке какие-либо изменения органов отсутствуют. Более информативна КТ или ЯМР-визуализация области турецкого седла, которая позволяет обнаружить его расширение и разрушение. Косвенные признаки опухоли надпочечника изредка определяются при проведении экскреторной урогра- фии и УЗИ почек. В ряде случаев, однако, даже КТ и ЯМР не позволяют обнаружить опухоль, в связи с чем приходится идти на пробную операцию. При карциноме надпочечника могут оказаться полезными селективная артериография и флебография с раздельным забором проб крови из обеих надпочечниковых вен.
Синдром Иценко-Кушинга (Синдром Кушинга, Сushing's syndrome)
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Синдром Кушинга: причины появления, симптомы, диагностика и способы лечения.
Синдром Иценко-Кушинга – это сочетание клинических симптомов, вызванных хроническим повышением уровня кортизола или родственных ему кортикостероидов в крови. Болезнь Иценко-Кушинга – это синдром Кушинга, причиной которого служит избыточная гипофизарная продукция адренокортикотропного гормона (АКТГ), как правило, обусловленная небольшой доброкачественной опухолью гипофиза – аденомой. Иногда АКТГ производится опухолью, которая не связана с гипофизом, она может находиться где угодно, чаще - в легких и грудной клетке. Порой злокачественные опухоли хорошо маскируются под железы и начинают вырабатывать гормоны альдостерон и кортизол, что, в свою очередь, приводит к повышению их концентраций в человеческом организме. При этом собственные железы понемногу начинают атрофироваться - таким образом организм старается бороться с избытком гормонов.
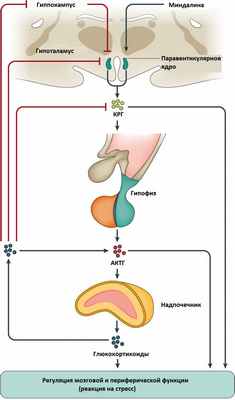
Синдром Иценко-Кушинга также возникает из-за перепроизводства кортизола надпочечниками или употребления больших доз глюкокортикоидных препаратов таких как преднизолон или дексаметазон при лечении ряда болезней (астмы, ревматоидного артрита и некоторых других аутоиммунных патологических состояний). Заболевание может возникнуть в любом возрасте, но чаще всего в 20-40 лет, оно может быть врожденным или приобретенным. Женщины поражаются в 10 раз чаще, чем мужчины.
У пациентов, страдающих алкоголизмом или тяжелыми депрессивными расстройствами, а также во время беременности, иногда наблюдается небольшое повышение уровня гормонов надпочечников и развивается псевдо-синдром Иценко-Кушинга.
Классификация заболевания. Кодирование по МКБ-10
Синдром Иценко-Кушинга (E24):
E24.0. Болезнь Иценко-Кушинга гипофизарного происхождения (гиперсекреция АКТГ гипофизом, гиперадренокортицизм гипофизарного происхождения);
E24.1. Синдром Нельсона;
E24.3. Эктопический АКТГ-синдром;
E24.4. Кушингоидный синдром, вызванный алкоголем;
E24.8. Другие состояния, характеризующиеся кушингоидным синдромом;
E24.9. Синдром Иценко-Кушинга неуточненный.
Симптомы синдрома Иценко-Кушинга
У большинства больных с различными формами гиперкортицизма: АКТГ-зависимыми (болезнь Иценко-Кушинга, аденома гипофиза, АКТГ эктопический синдром) и АКТГ-независимыми формами (аденома коры надпочечника и/или двусторонняя микро-, макроузелковая гиперплазия) клинические проявления заболевания постоянны и зависят от скорости секреции кортизола надпочечниками.
К классическим признакам синдрома Иценко-Кушинга у взрослых относятся «лунообразное» лицо багрово-красного цвета, часто возникают многочисленные угревидные высыпания, центральное ожирение с одновременной потерей жировой ткани на бедрах, ягодицах и руках, истончение кожи и ломкость капилляров, приводящие к легкому и часто спонтанному образованию синяков. За счет неправильного и неравномерного жироотложения происходит необратимая деформация позвоночника, больные сутулятся, происходит нарушение осанки (кифоз, сколиоз). На бедрах, предплечьях, животе можно увидеть растяжки ярко-красного или даже фиолетового цвета, надключичные жировые подушечки и периферические отеки. Часто происходит разрушение костной ткани, отмечается склонность к переломам. У женщин по причине избытка половых гормонов возникают признаки излишнего оволосения по мужскому типу, появляются существенные перебои менструального цикла. У детей самым ранним признаком служит избыточная масса тела при задержке роста.
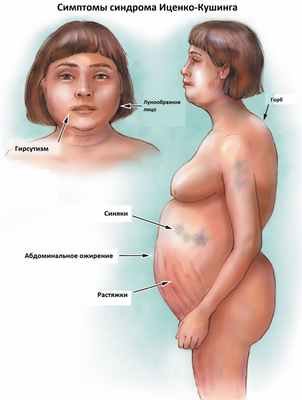
За счет повышенного уровня кортизола могут возникать гипертония, аритмия, поражение сердца и сосудов, высокий уровень глюкозы в крови, снижение зрения, приступы агрессивности, депрессия, нарушения терморегуляции (именно такие больные очень часто потеют, а также могут мерзнуть в жаркую погоду).
Диагностика синдрома Иценко-Кушинга
Ярко выраженный синдром Иценко-Кушинга не представляет особых диагностических трудностей. Достаточно лишь оценить внешний облик человека и провести с ним беседу. Но заболевание с умеренными проявлениями может вызвать у врача ряд проблем. Всегда следует исключать предварительный прием глюкокортикостероидов пациентом (экзогенный синдром Кушинга). Диагноз ставится клинически, а подтверждается данными лабораторных и визуализирующих методов исследований для установления стадии болезни и выяснения первопричины патологии.
Подтверждение избытка кортизола выполняется строго по показаниям врача одним из четырех методов:
- оценка количества кортизола - определение свободного кортизола мочи в двукратных суточных пробах;
Синонимы: Анализ мочи на кортизол; Анализ суточной мочи на свободный кортизол; Кортизол мочи. Hydrocortisone; Urine cortisol; Free Cortisol Urine Test; Urine Cortisaol Test. Краткое описание теста .
Артериальная гипертония при болезни Иценко — Кушинга

Изучена зависимость между степенью артериальной гипертонии и ожирения и уровнем кортизолемии у больных, страдающих болезнью Иценко — Кушинга. Показано, что выраженность артериальной гипертензии при болезни Иценко — Кушинга находится в прямо пропорциональной зависимости от степени ожирения. С помощью факторного анализа удалось установить ведущую роль гиперкортизолемии в развитии гипертонии, тогда как ожирению отводится роль фактора, способствующего прогрессированию последней.
Ключевые слова
Полный текст
Артериальная гипертония является одним из наиболее ранних и стойких симптомов болезни Иценко — Кушинга. Определенное влияние на развитие гипертонии может оказывать прогрессирующее ожирение, являющееся также одним из наиболее частых и стойких проявлений этой эндокрднопатии. Наряду с отмеченными фактами известно, что более чем у 50% лиц, страдающих экзогенным ожирением, наблюдается и артериальная гипертензия. Многие исследователи указывают на транзиторный характер артериальной гипертонии при ожирении, которая исчезает (или становится менее выраженной) после снижения массы тела пациента [4, 6, 9]. В большинстве работ, посвященных изучению гемодинамических нарушений при болезни Иценко — Кушинга, гипертензивный синдром рассматривается лишь в связи с изменением секреции гормонов, тогда как вопрос о роли ожирения в генезе гипертонии остается в стороне. Нам представилось целесообразным выяснить зависимость между выраженностью гипертонии и ожирения у больных, страдающих болезнью Иценко — Кушинга. Учитывая ведущую роль повышения функции коры надпочечников в развитии клинических проявлений адреногиперкортицизма, мы сочли уместным одновременно изучить уровень кортизолемии.
Под наблюдением находилось 60 больных (48 женщин и 12 мужчин в 4 возрасте 19—55 лет), страдающих в течение 1 года — 20 лет болезнью Иценко — Кушинга. Диагноз основывался на клинических данных и результатах биогормональных, рентгенологических и ангиографических исследований. Контрольную группу составили И здоровых лиц (женщин — 9, мужчин — 2, возраст — от 21 до 35 лет).
Определение «идеальной» массы тела, ее избытка и степени ожирения проводили с помощью номографа А. А. Покровского (1964). Уровень кортизола в плазме крови изучали радиоиммунологическим методом. Полученный цифровой материал обработан методом вариационной статистики с определением достоверности различия средних величин по таблице Стьюдента. Наряду с этим в 13 наблюдениях проведена обработка изученных параметров с помощью факторного анализа [3, 7].
У большинства обследованных выявлена артериальная гипертензия, и лишь у 4 больных АД было нормальным. Показатель систолического АД был в пределах 130—250 мм рт. ст., а диастолического — в пределах 70—150 мм рт. ст. Масса тела больных составляла от 74 до 156 кг (среднестатистический показатель—96,9 + 2,7 кг), а избыток массы тела — от 10% до 100% (среднестатистический показатель — 42,2 + 3,3%). У 56 больных имелось ожирение (у 17 — Г ст., у 20 — II ст., у 19 — III ст.). Концентрация кортизола в сыворотке крови больных колебалась от 198,6 нмоль/л до 965,6 нмоль/л, а среднестатистический показатель уровня кортизолемии достигал 579,4 + 35,3 нмоль/л и достоверно (Р<0,01) превышал его значение в контрольной группе (156,4+10,8 нмоль/л).
В соответствии с выраженностью артериальной гипертонии больные были разделены на 3 группы: 1-я — 21 чел. с АД, не превышающим 150/100 мм рт. ст., 2-я — 18 чел., у которых АД колебалось от 160/110 до 180/120 мм рт. ст., и 3-я—21 чел. с АД, превышающим 180/120 мм рт. ст. При сопоставлении выраженности артериальной гипертензии с уровнем гиперкортизолемии отмечен отчетливый параллелизм изменения этих показателей. У больных 1-й группы концентрация кортизола была равна 492,2+51,6 нмоль/л, тогда как у больных 3-й гр. — 666,8+62,1 нмоль/л. Наряду с этим установлено, что концентрация кортизола в сыворотке крови возрастала прямо пропорционально продолжительности заболевания, достигая максимального показателя (679,5 + 56,0 нмоль/л) у больных с продолжительностью заболевания, превышающей 10 лет. В то же время достоверной зависимости уровня артериальной гипертензии от продолжительности заболевания не установлено.
Как свидетельствует приводимая ниже таблица, выраженность артериальной гипертензии при болезни Иценко — Кушинга находится в прямо пропорциональной зависимости от степени ожирения. Наряду с систолическим достоверно повышается и пульсовое давление. Сопоставление этих данных с уровнем кортизолемии показало, что концентрация кортизола в крови также увеличивается прямо пропорционально степени ожирения. Интеркорреляции между выраженностью артериальной гипертензии и величиной избытка массы тела, с одной стороны, и между выраженностью артериальной гипертензии и уровнем кортизолемии, с другой, были примерно одинаковыми (соответственно г + 0,600, г + 0,621). На заключительных этапах математических пересчетов полученная матрица факторов подвергнута ортогональному вращению по методу «варимакс». При интерпретации факторов, полученных в результате «вращения», выделены параметры со значимыми факторными весами. Наибольшая взаимосвязь констатирована между показателем гиперкортизолемии и величиной пульсового давления.
Зависимость выраженности артериальной гипертензии и кортизолемии от степени ожирения при болезни Иценко — Кушинга (М+ш)
Артериальная гипертония при гиперсекреции глюкокортикоидов (синдром и болезнь Иценко-Кушинга) (Н.М. Чихладзе, И.Е. Чазова НИИ кардиологии им. А.Л. Мясникова РКНПК Росздрава, Москва)
Синдромы, связанные с гиперсекрецией глюкокортикоидов, - редкая причина артериальной гипертонии (АГ), встречается в 0,1% случаев в общей популяции, а среди всех форм АГ наблюдаются у 1 из 400 пациентов. Клиническая картина гиперкортицизма может быть обусловлена эндогенными причинами - гормонпродуцирующими опухолями или гиперпластическими изменениями в гипофизе или надпочечниках, а также может быть связана с экзогенными воздействиями при ятрогенных формах заболевания.
Выделяют адренокортикотропный гормон (АКТГ) - зависимые и АКТГ-независимые эндогенные формы гиперкортицизма.
АКТГ-зависимые формы эндогенного гиперкортицизма выявляются в 85% случаев и включают следующие заболевания.
Болезнь Иценко-Кушинга (БИК) - заболевание, обусловленное опухолью гипофиза или гиперплазией аденоматозных клеток, секретирующих повышенное количество АКТГ, что приводит к увеличению продукции гормонов коры надпочечников с развитием клинической картины гиперкортицизма.
Впервые клиническая картина данного заболевания и установленная связь при нем между функцией гипофиза и надпочечниками были представлены в 1912 г. американским нейрохирургом Кушингом и независимо от него в 1924 г. невропатологом Н.М. Иценко в России. В дальнейшем в нашей стране эта патология стала известна под именами обоих авторов.
В соответствии с размером выделяют микроаденомы гипофиза - опухоли до 1 см, которые выявляются у большинства больных. У остальных больных обнаруживаются макроаденомы, размер которых превышает 1 см. В редких случаях у больных БИК выявляется первичное «пустое» турецкое седло.
При БИК нарушается секреция всех тропных гормонов гипофиза, однако ведущей является повышенная продукция АКТГ, что приводит к стимуляции биосинтеза гормонов во всех трех зонах коры надпочечников: кортизола, кортикостерона, андрогенов, альдостерона. Повышение функционального состояния надпочечников сопровождается увеличением их размеров. В 20% случаев на фоне гиперплазии надпочечников выявляются вторичные аденомы размером 1-3 см.
При БИК нарушается механизм «обратной связи» в результате снижения чувствительности гипоталамо-гипофизарной области к кортизолу в периферической крови. Этот дефект приводит к неконтролируемой секреции АКТГ и гормонов коры надпочечников.
АКТГ-эктопированный синдром - наблюдается при опухолях эндокринной и неэндокринной систем, которые секретируют кортикотропин-рилизинг-гормон и/или АКТГ. Стимуляция этими продуктами коры надпочечников приводит к развитию гиперкортицизма. Наиболее часто этот синдром развивается при злокачественных опухолях грудной клетки (легкие, бронхи), поджелудочной и щитовидной желез, при феохромоцитоме, опухолях желудочно-кишечного тракта.
АКТГ-независимые формы эндокринного гиперкортицизма выявляются в 15% случаев и включают в свой состав следующие синдромы.
Синдром Кушинга

Синдром Кушинга – это сочетание клинических симптомов, вызванных хроническим повышением уровня кортизола или родственных ему кортикостероидов в крови. Болезнь Кушинга – это синдром Кушинга, причиной которого служит избыточная гипофизарная продукция адренокортикотропного гормона (АКТГ), как правило, обусловленная аденомой гипофиза. Типичные симптомы и признаки включают лунообразное лицо и центральный типожирения, тонкие конечности и легко образующиеся синяки. Диагноз устанавливают на основании анамнестических данных о применении кортикостероидов или повышенного уровня и/или относительно автономного кортизола в сыворотке. Лечение зависит от этиологии заболевания.
Этиология синдрома Кушинга
Гиперфункция коры надпочечников бывает как зависимой от адренокортикотропного гомона (АКТГ-зависимой), так и АКТГ-независимой.
Причиной АКТГ-зависимого гиперкортицизма может быть:
Гиперсекреция АКТГ гипофизом (болезнь Кушинга)
Секреция АКТГ негипофизарной опухолью, такой как мелкоклеточный рак легкого Классификация Рак легких является основной причиной смерти от рака во всем мире. В 85% случаев причиной заболевания становится курение. К симптомам рака легкого относится кашель, дискомфорт или боль в грудной. Прочитайте дополнительные сведенияВведение экзогенного АКТГ
АКТГ-независимая гиперфункция обычно появляется из-за
Терапевтическое применение кортикостероидов
Надпочечниковые аденомы или карциномы
Редкие причины АКТГ-независимой гиперфункции включают первичную пигментированную узловую дисплазию надпочечников (обычно у подростков) и двустороннюю макронодулярную гиперплазию (у пожилых пациентов).
Симптомы и признаки синдрома Кушинга
Клинические проявления синдрома Кушинга включают:
Лунообразное лицо с плеторической внешностью
Центральный тип ожирения с видными надключичным и надшейными скоплениями жировой ткани (бычий горб)
Обычно очень тонкие конечности и пальцы

На этой фотографии изображен пациент с лунообразным лицом, характерным для синдрома Кушинга.
© Springer Science+Business Media

Этот пациент с синдромом Кушинга имеет характерный бычий горб и красные стрии.
© Springer Science+Business Media
Пурпурные линейные растяжки (стрии) видны на животе данного пациента с синдромом Кушинга.
SCIENCE PHOTO LIBRARY
У данного пациента с синдромом Кушинга наблюдаются следующие признаки: округление лица, большие щеки, надключичные жировые отложения и стрии.
с разрешения издателя. Из Biller B. В Atlas of Clinical Endocrinology: Neuroendocrinology and Pituitary Disease . Edited by SG Korenman (series editor) and ME Molitch. Philadelphia, Current Medicine, 2000.
Характерна атрофия мышц и слабость. Кожа атрофирована, раны заживают плохо и легко образуются кровоподтеки. На животе можно обнаружить багровые стрии. Часто отмечаются артериальная гипертония, нефрокалькулез, остеопороз, нарушение толерантности к глюкозе, снижение сопротивляемости инфекциям, а также психические отклонения. Дети обычно отстают в росте.
У женщин возможны нарушения менструального цикла. Повышенная продукция андрогенов опухолями надпочечников может приводить у женщин к гирсутизму, височному облысению и другим проявлениям вирилизации.
Диагностика синдрома Кушинга
Определение уровня свободного кортизола в моче
Супрессивный тест с дексаметазоном
Уровни кортизола в сыворотке или в слюне в середине ночи
Определение уровня АКТГ плазмы; если он поддается определению – проведение провокационной пробы
Диагноз обычно предполагают на основании характерных симптомов и признаков. Подтверждение диагноза (и выяснение причины), как правило, требует гормональных исследований и применения визуализирующих методов.
Определение уровня свободного кортизола в моче
В некоторых центрах исследование начинается с 24-часового измерения свободного кортизола в моче, которое повышено > 120 мк /24 часа ( > 331 нмоль/24 ч) почти у всех пациентов с синдромом Кушинга. У многих пациентов с уровнем свободного кортизола суточной мочи между 100 и 150 мкг/24 часа (276 и 414 нмоль/24 часа) имеется ожирение, депрессия или синдром поликистозных яичников, но не синдром Кушинга. Пределы нормы могут варьироваться в зависимости от анализа.
У пациента с подозрением на синдром Кушинга с сильно повышенным уровнем свободного кортизола в моче (в 4 раза > верхней границы нормы) данный диагноз почти наверняка подтвердится. Два-три нормальных показателя исключают диагноз. Несколько повышенные уровни, как правило требуют дальнейшего иccледования, как и в случае нормальных уровней, если при этом, согласно клиническим данным, высока вероятность заболевания.
Определяют также утренний базальный уровень кортизола в сыворотке крови (например, в 9 часов утра).
Супрессивный тест с дексаметазоном
Альтернативный подход к исследованию заключается в супрессивном тесте с дексаметазоном, при котором назначается 1, 1,5 или 2 мг дексаметазона перорально с 11 до 12 часов вечера, а уровень кортизола в сыворотке крови измеряется на следующий день с 8 до 9 часов утра. У большинства здоровых лиц его уровень составляет < 1,8 мкг/дл ( < 50 нмоль/дл), тогда как при синдроме Кушинга этот показатель практически всегда выше. Более специфичным и равно чувствительным является тест с приемом 0,5 мг перорально дексаметазона каждые 6 часов в течение 2 дней (низкодозовый тест). Отсутствие снижения уровня кортизола в следствие введения небольших доз дексаметазона , как правило, подтверждает диагноз, если нет оснований подозревать аномальную абсорбцию или метаболизм дексаметазона.
Определение уровня кортизола в ночное время
При неоднозначных результатах теста для определения свободного кортизола в суточной моче и теста на подавление дексаметазона , пациента госпитализируют для определения уровня кортизола в сыворотке ночью, что дает больше оснований для определенного вывода. Можно также собирать пробы слюны для определения кортизола, сохраняя их дома в холодильнике. В норме уровень кортизола в сыворотке в ранние утренние часы (6.00–8.00) колеблется от 5 до 25 мкг/дл (138–690 нмоль/л), а к середине ночи постепенно снижается до < 1,8 мкг/дл ( < 50 нмоль/л). При синдроме Кушинга содержание сывороточного кортизола в утренние часы иногда остается нормальным, но отсутствует обычное снижение его продукции в течение суток, так что в середине ночи концентрация кортизола в сыворотке превышает норму и его общая суточная продукция может быть повышена.
Ложная трактовка возможна при обнаружении повышенного уровня кортизола в сыворотке крови у пациентов с врожденно увеличенным содержанием кортикостероид-связывающего глобулина или у получающих эстрогены , но в этих случаях суточные изменения уровня кортизола остаются в пределах нормы.
Определение уровня АКТГ в плазме крови
Для выяснения причины синдрома Кушинга определяют уровень АКТГ. Если он остается неопределимым, как в базальных условиях, так и особенно после введения кортикотропин -рилизинг гормона (КРГ), то это указывает на первичное поражение надпочечников. Высокий уровень АКТГ свидетельствует о гипофизарной причине или эктопическом начале. Если уровень АКТГ поддается определению, то с помощью провокационных проб можно отличить болезнь Кушинга от более редкого эктопического АКТГ-синдрома. В большинстве случаев болезни Кушинга введение большой дозы дексаметазона (2 мг перорально каждые 6 часов в течение 48 часов) снижает утренний (9:00) уровень кортизола > 50%, тогда как при эктопическом АКТГ-синдроме столь значительное снижение наблюдается редко. Наоборот, у большинства пациентов с болезнью Кушинга в ответ на введение человеческого или овечьего КРГ (внутривенно 100 мкг или 1 мкг/кг) уровень АКТГ возрастает на > 50%, а содержание кортизола – на 20%, тогда как при эктопическом АКТГ-синдроме такая реакция наблюдается очень редко (см. таблицу Диагностическое обследование при синдроме Кушинга Диагностическое обследование при синдроме Кушинга ).
Альтернативный способ выяснения локализации причины повышенного уровня АКТГ (более точный, но и более инвазивный) заключается в катетеризации обеих каменистых вен (по которым идет отток крови от гипофиза) с определением уровня АКТГ в пробах из этих вен, полученных через 5 минут после болюсного введения КРГ в дозе 100 мкг или 1 мкг/кг (человеческого или овечьего). Отношение уровня АКТГ в крови синусов к его уровню в периферической крови > 3 практически исключает диагноз эктопического АКТГ-синдрома; отношение < 3 требует продолжения поисков источника гиперсекреции АКТГ.
Визуализация
Если уровень АКТГ и провокационные тесты указывают на гипофизарную причину гиперкортицизма, применяют методы визуализации гипофиза; самые точные результаты дает МРТ с контрастным усилением, но некоторые микроаденомы визуализируются и с помощью КТ. Если же результаты обследования предполагают причину негипофизарного происхождения, используют КТ с высоким разрешением для исследования грудной клетки, области поджелудочной железы и надпочечников, сцинтиграфическое исследование или ПЭТ-сканирование с радиоактивным октреотидом или, желательно, с галлием-68, а иногда и ПЭТ-сканирование с фтордезоксиглюкозой (ФДГ-ПЭТ-сканирование). Может потребоваться отбор проб из каменистого синуса для дифференциации гипофизарной продукции АКТГ от эктопической.
У детей с болезнью Кушинга опухоли гипофиза крайне малы и не визуализируются при МРТ. В этой ситуации особенно полезным оказывается забор проб крови из каменистых синусов. У беременных женщин во избежание облучения плода вместо КТ проводят МРТ.
Лечение синдрома Кушинга
Диета с большим содержанием белка и прием калийсодержащих препаратов (или калийсберегающих препаратов, таких как спиронолактон)
Ингибиторы надпочечников, такие как метирапон или кетоконазол и реже митотан
Хирургическая операция или лучевая терапия при гипофизарных, надпочечниковых или эктопических АКГТ-продуцирующих опухолях
Иногда аналоги соматостатина, дофамин агонисты или антагонист глюкокортикоидных рецепторов мифепристон
АКТГ-продуцирующие опухоли гипофиза подлежат хирургическому удалению или разрушению с помощью лучевой терапии. Если опухоль не визуализируется, но имеются веские причины считать источником избытка АКТГ именно гипофиз, предпринимают попытку тотальной гипофизэктомии, особенно у пожилых пациентов. У более молодых пациентов можно применять высокоинтенсивное облучение гипофиза с дозой 45 Гр (Грей). Однако у детей облучение гипофиза может снижать секрецию гормона роста и иногда вызывает преждевременное половое созревание. В специализированных центрах с успехом применяют однократное облучение протонным пучком, обеспечивающее поглощение гипофизом 100 Гр, или используют радиохирургию. В качестве альтернативы можно использовать протонную терапию, если она доступна. Реакция на облучение иногда проявляется через несколько лет; у детей эффект наступает быстрее.
Исследования показывают, что легкие случаи сохраняющегося или рецидивирующего заболевания поддаются терапии аналогом соматостатина – пасиреотидом. Тем не менее, гипергликемия является существенной нежелательной побочной реакцией. Иногда также можно использовать агонист дофамина каберголин. Альтернативный подход заключается в применении блокатора рецепторов кортикостероидов мифепристона. Антагонист рецептора глюкозы мифепристон увеличивает содержание кортизола в сыворотке, но блокирует эффекты кортикостероидов и может вызвать гипокалиемию.
В случаях, когда радиотерапия противопоказана, а также при отсутствии эффекта операции, облучения или исследования гипофиза (с возможной аденомэктомией) у больных с гиперкортицизмом гипофизарного происхождения производят двустороннюю адреналэктомию. После такой операции необходима пожизненная заместительная терапия кортикостероидами.
Опухоли коры надпочечников удаляют хирургически. Во время и после операции пациенту нужно вводить гидрокортизон, так как неопухолевая ткань коры за время болезни атрофируется и не функционирует. При доброкачественных аденомах можно выполнять лапароскопическую операцию. Многоузловая гиперплазия надпочечников может требовать двусторонней адреналэктомии. Даже при тотальной (предположительно) адреналэктомии у некоторых пациентов возникает функциональный рецидив.
При эктопическом АКТГ-синдроме удаляют негипофизарную опухоль, продуцирующую АКТГ. Тем не менее, в некоторых случаях, опухоль является диссеминированной и не может быть удалена. Тяжелые метаболические нарушения (например, гипокалиемия Гипокалиемия Гипокалиемия – снижение концентрации калия в сыворотке 3,5 мЭкв/л ( 3,5 ммоль/л), обусловленное уменьшением его общих запасов в организме или патологическим его перемещением в клетки. Наиболее. Прочитайте дополнительные сведения ) обычно контролируются с помощью применения ингибиторов гормонов надпочечников, таких как метирапон в дозах 500 мг перорально 3 раза в день (и больше, до максимальной суточной дозы – 6 г/день) или митотан – 0,5 г 1 раз в день (максимально 3-4 г/день). При применении митотана возникает необходимость в приеме больших доз гидрокортизона или дексаметазона, иногда делает измерение продукции кортизола ненадежным. Также может развиться гиперхолестеринемия Кетоконазол (в дозах 400-1200 мг перорально 1 раз в день) также блокирует синтез кортикостероидов, но этот препарат обладает гепатотоксичностью, и его прием может сопровождаться проявлениями аддисоновой болезни. Мифепристон также может быть полезен для лечения синдрома эктопической продукции АКТГ; однако, поскольку он блокирует действие кортизола, но не снижает его уровни в сыворотке, мониторинг его использования может быть проблемным. В экстренной ситуации парентеральное введение этомидата может вызвать быстрое снижение уровня кортизола в сыворотке, поэтому его применение требует тщательного мониторинга состояния пациента.
Иногда АКТГ-секретирующие опухоли реагируют на длительно действующие аналоги соматостатина (например, октреотид и/или другие), но их применение на протяжении > 2 лет требует тщательного клинического наблюдения за больными, поскольку могут развиться такие осложнения, как гастрит в легкой форме, желчекаменная болезнь, холангит, а также мельабсорбция.
синдром Нельсона
Синдром Нельсона обусловлен разрастанием гипофиза после двусторонней адреналэктомии, что сопровождается повышенной секрецией АКТГ и его предшественников и приводит к выраженной гиперпигментации. Этот синдром развивается почти у ( ≤ ) 50% больных, перенесших адреналэктомию. Облучение гипофиза, по-видимому, снижает риск возникновения синдрома.
Хотя облучение может приостановить продолженный рост гипофиза, многим пациенты также показана гипофизэктомия. Показания к гипофизэктомии те же, что и при любой гипофизарной опухоли: увеличение размеров со сдавлением соседних структур (нарушения полей зрения, давление на гипоталамус и другие осложнения).
После гипофизэктомии обычно проводят его облучение (если это не сделано предварительно), особенно при явном наличии опухоли. В отсутствие явной патологии лучевую терапию можно отложить. Если стандартное наружное облучение уже проводилось, используют метод радиохирургии – разовое облучение гипофиза сфокусированным пучком нейтронов (при локализации процесса в достаточном отдалении от зрительных нервов и их перекреста).
Основные положения
Основанием для диагноза обычно служит повышенный уровень кортизола в сыворотке или слюне в ночные часы или уровень свободного кортизола в суточной моче, а также результаты супрессивного теста с дексаметазоном , в которых нет подавления кортизола.
Гипофизарную причину от негипофизарной отличают по уровню адренокортикотропного гормона (АКТГ).
Для обнаружения возможной опухоли используют визуализирующие методы.
Опухоли обычно лечат хирургическим путем или лучевой терапией.
До радикального лечения можно подавить секрецию кортизола метирапоном или кетоконазолом.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Читайте также:
