Синдром Клиппеля—Тренонея—Вебера. Диагностика и лечение синдрома клиппеля-тренонея-вебера.
Добавил пользователь Morpheus Обновлено: 09.01.2026
а) Терминология:
1. Сокращения:
• Синдром Клиппеля-Треноне-Вебера (СКТВ)
2. Синонимы:
• Синдром ангиоостеогипертрофии
• Гипертрофическая гемангиоэктазия
3. Определения:
• Аномалия развития капилляров, лимфатических и венозных сосудов, сопровождающаяся избыточным ростом тканей
• Преимущественное поражение одной ноги:
о Гемангиомы, имеющие крупные кожные части
о Гипертрофия костных и мягких тканей
б) Лучевая диагностика:
1. Общие сведения:
• Критерии диагностики:
о Асимметричная гипертрофия нижней конечности
о Кистозные образования подкожной локализации
• Локализация:
о Чаще всего полностью поражена одна нога:
- Очаги поражения могут распространяться с бедра на ягодицы:
Внешний вид напоминает крестцово-копчиковую тератому
о Поражение может выходить за пределы ноги:
- Может распространяться в брюшную полость и полость малого таза:
Ретроперитонеально
Интраперитонеально
• Размеры:
о Варьируют:
- Поражения у плода характеризуются значительным объемом пораженных тканей
• Морфология:
о Инфильтрирующее кистозное образование
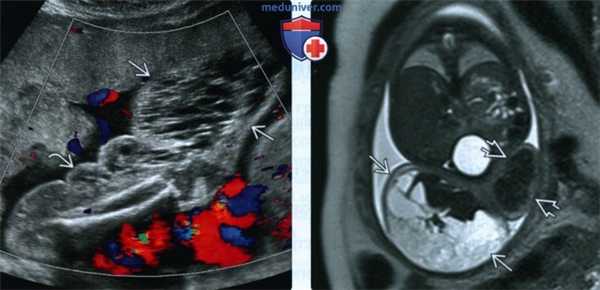
(Слева) УЗИ плода с СКТВ. Визуализируется многокамерное инфильтрирующее кистозное образование бедра и голени. Образование преимущественно аваскулярное и имеет кистозную структуру.
(Справа) МРТ голени, поперечный срез. Происхождение образования, окружающего мышцы, неочевидно. В данном случае образование не распространяется в глубь туловища. Стрелками отмечена пораженная голень, - здоровая.
2. УЗИ при синдроме Клиппеля-Треноне-Вебера у плода:
• Кистозное образование нижней конечности, локализующееся подкожно:
о Многокамерная киста:
- Кисты локализуются вокруг бедренной, большеберцовой и малоберцовой костей
- Соотношение эхогенности кистозно-измененных и мягких тканей варьирует:
Зависит от степени гипертрофии мягких тканей, выраженности поражений лимфатических и кровеносных сосудов
о Васкуляризация, по данным ЦДК, варьирует:
- Чаще находят снижение васкуляризации, чем усиление:
Интенсивная васкуляризация чаще становится причиной сердечной недостаточности
- Возможна персистенция эмбриональной латеральной маргинальной вены:
Крупная вена, проходящая от боковой поверхности голени к боковой поверхности стопы
- Могут определяться флеболиты:
Венозные кальцинаты
Гиперэхогенные очаги в подкожной жировой клетчатке
• Поражение нередко распространяется за пределы нижней конечности:
о Поверхностное распространение:
- В толще подкожной жировой клетчатки спины и боковых поверхностей туловища
о Глубокое распространение:
- В брюшную полость и полость малого таза
• Осложнения: сердечная недостаточность, анемия и водянка плода:
о Кардиомегалия
о Гепатомегалия
о Водянка плода вследствие сердечной недостаточности или обструкции лимфатических сосудов:
- Накопление избытка жидкости в различных частях тела плода:
Анасарка
Асцит
Плевральный выпот
Перикардиальный выпот
- Изменение объема околоплодных вод:
Многоводие
Маловодие при почечной недостаточности
- Утолщение плаценты
о Анемия вследствие коагулопатии:
- ↑ ПСС в средней мозговой артерии
3. МРТ при синдроме Клиппеля-Треноне-Вебера у плода:
• Наилучшим образом позволяет визуализировать глубокие поражения:
о Уточнение анатомической локализации:
- Поражение кишечника
- Поражение других органов
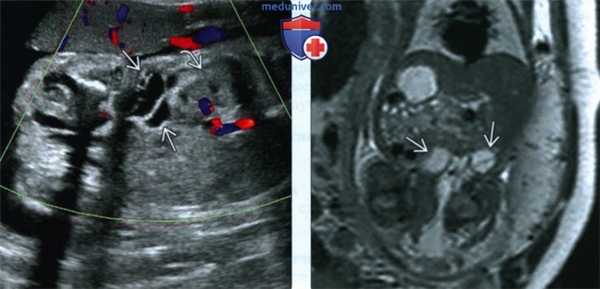
(Слева) УЗИ таза и брюшной полости плода, фронтальная плоскость. СКТВ с поражением нижней конечности. Образование распространяется в забрюшинное пространство до уровня почек.
(Справа) Тот же плод. МРТ, Т2-ВИ. Глубина распространения образования внутрь туловища визуализируется более отчетливо.
4. Рекомендации по лучевой диагностике:
• Предпочтительный метод исследования:
о Исследование нижних конечностей во время скринингового УЗИ во II триместре:
- В плоскости, проходящей по длинной оси бедра
- В плоскости, проходящей через всю нижнюю конечность и стопу
- Стопа в подошвенной плоскости
• Советы по проведению исследования:
о Тщательное наблюдение за появлением признаков водянки плода
о Наблюдение за развитием анемии у плода:
- ПСС в средней мозговой артерии соотносят с нормальными значениями для данного ГВ
о Для оценки распространенности поражений выполняют МРТ

(Слева) Другой плод с СКТВ. Кистозным образованием поражено бедро, брюшная полость, а также подкожная жировая клетчатка левой боковой поверхности туловища плода до уровня подмышечной ямки. Впоследствии развилась водянка плода.
(Справа) Тот же случай. Клиническая фотография новорожденного. Определяется массивное поражение бедра и передней брюшной стенки. Ребенок погиб вскоре после рождения.
в) Дифференциальная диагностика синдрома Клиппеля-Треноне-Вебера у плода:
1. Лимфангиома, не связанная с синдромом Клиппеля-Треноне-Вебера:
• Сложное кистозное образование, локализующееся подкожно:
о Ультразвуковая картина напоминает СКТВ, однако преимущественное поражение одной нижней конечности менее характерно
о В 70% случаев локализуется в подмышечной области, однако возможна любая другая локализация
• Варикозное расширение вен и сосудистые пятна отсутствуют
• Характерна инфильтрация, схожая с СКТВ:
о Более характерно распространение в средостение
о Возможно распространение в брюшную полость и забрю-шинное пространство
2. Крестцово-копчиковая тератома:
• Новообразование в крестцовой области, состоящее из производных всех трех зародышевых листков
• Смешанное кистозно-солидное образование, берущее начало в области крестца:
о В 15% случаев образование имеет целиком кистозную структуру:
- Ультразвуковая картина совпадает с таковой при СКТВ
о Васкуляризация солидных образований чаще всего усилена:
- Может стать причиной водянки плода
• Размеры варьируют
• Нередко распространяется в полость малого таза:
о Наилучшим образом визуализируется с помощью МРТ
3. Синдром Беквита-Видемана:
• Заболевание, имеющее мультигенную природу и характеризующееся мутацией гена, отвечающего за регуляцию роста тканей:
о 5-10% случаев - мутация CDKN1C
• Гемигиперплазия может напоминать СКТВ:
о Возможно поражение конечности как целиком, так и ее части
о Избыточный рост кистозного характера не свойственен
• Другие симптомы:
о Макроглоссия
о Макросомия, органомегалия
о Омфалоцеле
о Эмбриональные опухоли
4. Синдром Протея (редко):
• Чаще диагностируется в течение 1-го года жизни ребенка
• Подкожные образования и избыточный рост тканей:
о Не только лимфангиома
о Липома, гамартома, эпидермальный невус
• Другие симптомы:
о Гемигипертрофия
о Макродактилия
о Экзостозы
г) Патологоанатомические особенности:
1. Общие сведения:
• Этиология:
о Патология мезодермы:
- Нарушение регуляции выработки факторов роста ангиогенеза
о Этиология водянки плода при СКТВ:
- Сердечная недостаточность с высоким сердечным выбросом вследствие наличия образований с усиленным кровотоком
- Обструкция лимфатических сосудов и гиперволемия
о Коагулопатия:
- Диссеминированное внутрисосудистое свертывание вследствие гемангиомы
- Внутрисосудистый гемолиз
• Генетические факторы:
о Предположительная генетическая этиология:
- Мутации или транслокация гена VG5Q
- Наличие гена KTW на длинном плече 5-й хромосомы или коротком плече 11-й хромосомы
о Заболевание возникает случайным образом и не связано с анеуплоидией:
- Описаны случаи семейной агрегации
2. Стадирование, градация и классификация синдрома Клиппеля-Треноне-Вебера у плода:
• Триада симптомов заболевания впервые описана Клиппелем и Треноне в 1900 г.:
о «Винные пятна»
о Варикозное расширение вен
о Гипертрофия мягких тканей
• В 1907 г. Вебером добавлен еще один признак — артериовенозная фистула
д) Клинические особенности:
1. Клиническая картина:
• Самые частые субъективные и объективные симптомы:
о Патологические находки по данным скринингового УЗИ во II триместре:
- Диагностика возможна с 15 нед.
• Другие субъективные и объективные симптомы:
о Результаты скрининга с исследованием сыворотки крови матери в норме:
- Описаны случаи ↑ уровня ХГЧ и α-фетопротеина
2. Демографические особенности:
• Пол:
о М=Ж
• Эпидемиология:
о Единичные случаи; заболевание является редким (1:100 000)
3. Естественное течение и прогноз:
• Чем выше объем поражений, тем ↑ выраженность осложнений
• Заболевание может привести к развитию синдрома Казабаха-Мерритт:
о Тромбоцитопения и коагулопатия потребления на фоне гемангиомы
о По данным одной серии случаев, 36% случаев СКТВ осложняются данным синдромом
о Сообщается об уровне неонатальной смертности, составляющем 45%
• Сепсис вследствие язвенного поражения кожи (может быть летальным)
4. Лечение синдрома Клиппеля-Треноне-Вебера у плода:
• Рекомендовано родоразрешение с помощью КС:
о Риск кровотечения
• Тактика в отношении небольших по объему поражений может быть наблюдательной (заболевание, диагностированное у плода, обычно характеризуется значительным объемом поражений)
• Хирургическое лечение:
о Циторедуктивные операции:
- В том числе ампутация
о Высокая частота рецидивирования
• Малоинвазивные методы лечения:
о Стероидная терапия преднизолоном:
- Способствует тромбозу и подавляет фибринолиз
о Лечение с помощью импульсных лазеров на красителях
о Введение интерферона α
о Эмболизация
о Антитромбин III
е) Особенности диагностики:
1. Важно знать:
• Критерием диагностики является лимфангиома одной конечности
2. Признаки, учитываемые при интерпретации изображений:
• Для прогнозирования риска водянки плода оценивают васкуляризацию образований
• МРТ позволяет оценить глубину распространения поражений
3. Информация, отражаемая в заключении:
• При подозрении на СКТВ рекомендовано генетическое консультирование
• Для обучения родителей и согласования плана лечения до рождения ребенка показана консультация хирурга:
о Зачастую требуется выполнение серии операций, в том числе ампутация
Редактор: Искандер Милевски. Дата обновления публикации: 19.11.2021
Синдром Клиппеля—Тренонея—Вебера. Диагностика и лечение синдрома клиппеля-тренонея-вебера.
1. Аббревиатура:
• Клиппеля-Треноне-Вебера (КТВ) синдром
2. Синонимы:
• Синдром ангиоостеогипертрофии, синдром Клиппеля-Треноне, остеогипертрофический сосудистый невус
б) Визуализация:
1. Общая характеристика:
• Лучший диагностический критерий:
о Классическая триада, включающая в себя гипертрофию костей и мягких тканей, кожную гемангиому, врожденный варикоз вен
• Локализация:
о Обычно поражается одна конечность:
- Нижняя конечность поражается у 3/4 пациентов
о Может быть ограничена поражением пальцев
2. Общая характеристика:
• Гипертрофия конечности и/или макродактилия
• Утолщение кортикального слоя кости
• Гипертрофия подкожной жировой клетчатки
• Патологические соединения поверхностных и глубоких вен:
о Отсутствие венозных клапанов
• Флеболиты
• У 70% пациентов имеются некомпетентные вены, идущие от лодыжки до области, расположенной ниже паховой области
3. Редкие признаки:
• Костные аномалии: синдактилия, полидактилия, вывих тазобедренного сустава, кифоз, сколиоз
• Патологические изменения внутренних органов: гемангиомы, пузырно-мочеточниковый рефлюкс, поликистозная болезнь почек, гидронефроз, перикардиальный и плевральный выпот
• Различные сосудистые аномалии: аплазия, мальформация, расширение или удвоение главных сосудов; артериовенозное соустье
• Патологические изменения ЦНС: миелопатия, атрофия головного мозга, гемигипертрофия головного мозга, гемигипертрофия мозжечка, кальфицикаты головного мозга, лепотоменингеальное контрастирование
(Слева) МРТ Т1ВИ, сагиттальный срез: визуализируются множественные округлые и извитые образования, имеющие схожую по отношению к мышцам интенсивность сигнала. Эта очаги представляют собой сосудистые мальформации.
(Справа) МРТ Т2 ВИ, режим подавления сигнала от жира, сагиттальный срез: лучше определяется обширно инфильтрирующая природа сосудистых мальформаций. Они поражают все мягкие ткани, как внесуставные, так и внутрисуставные. Кроме этого, определяется поражение костей бедренной, большеберцовой и малоберцовой. (Слева) При допплерографии мышц бедра в поперечной плоскости, у этого же пациента определяются множественные очаги кровотока. Наличие тромба в таких сосудистых мальформациях иногда ограничивает визуализацию кровотока при допплерографии.
(Справа) Рентгенография в ПЗ проекции:определяется диффузно увеличенная левая нога. Визуализируются расширенные мягкотканные структуры в виде плотных извитых областей. Обратите внимание на несоответствие длины ноги и диспропорциональный запущенный остеоартрит. (Слева) МРТ Т1 ВИ, аксиальный срез: визуализируются гемангиомы, растущие в области поверхности кожи через мышцы и прорастающие в кость. Обратите внимание на то, что подкожная жировая клетчатка также гипертрофирована, что привело к общему увеличению левой нижней конечности.
(Справа) MPT, STIR, аксиальный срез: гиперинтенсивные гемангиомы, поражающие подкожную жировую клетчатку, мышцы и, вероятнее всего, прорастающие в кость. При подколенной ампутации, выполненной по поводу боли, был выявлен венозный тромбоз, который в таких случаях встречается довольно часто.
4. УЗИ:
• Пренатальная ультрасонография позволяет обнаружить периферические и висцеральные сосудистые аномалии, кардиомегалию, неиммунную водянку, макроцефалию, гемигипертрофию и гемангиому пупочного канатика
5. Радионуклидная диагностика:
• При лимфосцинтиграфии определяются гиперплазия лимфатической ткани, патологический кровоток в дерме, аплазия и гипоплазия
• При радионуклидной венографии и артериографии определяется накопление радиометки в пораженной конечности, коллатеральные венозные каналы, венозная окклюзия и легочные эмболы
в) Дифференциальная диагностика синдрома Клиппеля-Треноне-Вебера:
1. Синдром Паркса-Вебера:
• Классические признаки КТВ и артериовенозного соустья
• Иногда считается такой же нозологической единицей, как и КТВ
2. Нейрофиброматоз:
• Сетчатый тип роста может привести к увеличению конечности с гипертрофией нижележащей кости
• Также будут определяться дополнительные признаки нейрофиброматоза
• Отсутствие сосудистых мальформаций
3. Липоматозная макродистрофия:
• Чрезмерный рост кости и жировой ткани
• Обычно поражаются пальцы
• Отсутствие сосудистых мальформаций
г) Патология. Общая характеристика:
• Генетика:
о Изредка аутосомно-доминантное
• Ассоциированные состояния:
о Болезнь Фабри
о Синдром Стерджа-Вебера
(Слева) МРТ колена, PD, режим подавления сигнала от жира, сагиттальный срез: определяются обширные сосудистые мальформации во всех мягких тканях, приведшие к диффузному увеличению ноги.
(Справа) МРТ Т2ВИ, режим подавления сигнала от жира, аксиальный срез: на уровне кожи определяются обширные сосудистые мальформации поражающие мышцы и сустав. Внутрисуставное распространение гемангиомам повышает риск гемартроза. (Слева) Рентгенография стопы в косой проекции: определяется диффузный избыточный рост мягких тканей и костей. Пациенту ранее была выполнена ампутация пальцев стопы и частичная ампутация пястных костей для уменьшения объема конечности.
(Справа) Рентгенография коленных суставов в ПЗ проекции определяется чрезмерный рост костей и мягких тканей правой нижней конечности. Обратите внимание на расширение межмыщелковой вырезки, что является схожей чертой визуализации при гемофилии. Также отмечается флеболит в голени. (Слева) МРТ голени, постконтрастные Т1 ВИ, режим подавления сигнала от жира, аксиальный срез: определяются множественные узловые и извитые контрастируемые области, характерные для сосудипых мальформаций. Увеличенные кровеносные сосуды также поражают большеберцовую кость. Флеболит, визуализируемый на предыдущем изображении, сформировался в одной из поверхностных сосудистых мальформаций с медленным кровотоком.
(Справа) При допплерографии голени в поперечной плоскости в одной из ранее визуализируемых гемангиом у этого же пациента определяется обширный активный кровоток.
1. Проявления:
• Типичные признаки/симптомы:
о Гипертрофия мягких тканей и костей
о Кожная гемангиома
о Варикозно-расширенные вены
о «Пылающие» телеангиэктатические невусы
о Боль
• Другие признаки/симптомы:
о Внутренние органы: висцеральные сосудистые мальформации, энтеропатия с потерей белка, кровотечения из прямой кишки, гематурия, хроническая почечная недостаточность, эмболия легких
о Периферические: тромбоз глубоких вен, атрофия конечности, недостаточность лимфатических сосудов
о Черепно-лицевые: раннее прорезывание постоянных зубов, аномалия прикуса, врожденный нистагм, анизомиопия, увеличение половины головы, гипертрофия половины лица
о Другие: гипертония, тромбоцитопения, аневризма почечной артерии, гипоспадия, базальноклеточный рак, плоскоклеточный рак, псевдосаркома Капоши
2. Демография:
• Возраст:
о Патологии могут быть обнаружены пренатально
• Пол:
о Отсутствие половой принадлежности
• Эпидемиология:
о Докладывалось о
3. Лечение:
• Эластичная поддерживающая одежда при венозной недостаточности и лимфостазе
• Хирургическое лечение при серьезных деформациях или кровотечении:
о Лигирование вен может ухудшить течение глубоких венозных мальформаций
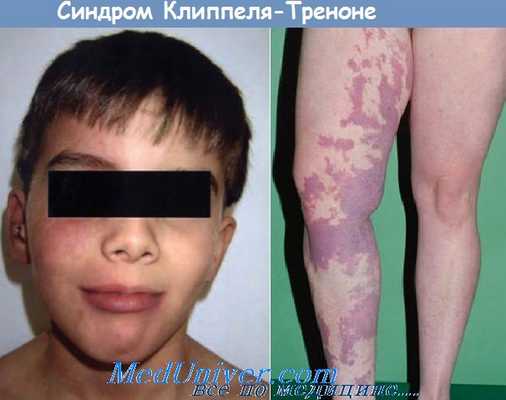
Синдром Клиппеля—Тренонея—Вебера (син.: гипертрофическая гемангиэктазия, ангиоостеогипертрофический синдром; nevus varicosus osteohipertrophicus) — сосудистый факоматоз с нарушением развития сосудов конечностей. Относительно редкое заболевание, минимальными диагностическими признаками которого являются пламенеющий невус в области конечности, сопровождающийся мягкотканной или костной гипертрофией этой конечности.
Впервые описано М. Klippel и соавт. в 1900 г. под названием остеогипертрофического невуса. Через несколько лет P. Weber описал несколько случаев болезни, в том числе с артериовенозной фистулой. В настоящее время синдром охватывает широкий спектр разнообразных аномалий сосудов конечностей, при водящих к их увеличению. В его составе выделяют группы с преобладанием венозных мальформаций (в большинстве случаев с признаками, описанными М. Klippel и P. Trenauney), артериовенозных фистул (описанных Р Weber), смешанных венозно-лимфатических мальформаций. Чаще встречается у мужчин, хотя в большинстве случаев возникает спорадически, существует предположение об аутосомно-доминантном наследовании. Этиология и патогенез этого синдрома недостаточно изучены. В отношении патогенеза ряд авторов придерживается неврогенной теории, которую обосновывают тем, что невусы на пораженных участках туловища обычно, будучи односторонними, не переходят срединную линию тела.
Клинически полный синдром Клиппеля—Тренонея—Вебера включает следующее:
1) пламенеющий невус области пораженной конечности;
2) варикозное расширение вен;
3) гипертрофию костей и мягких тканей пораженной конечности (частичный гигантизм), обусловленную интенсивной васкуляризацией с наличием артериовенозных анастомозов.
Наиболее характерные кожные проявления — односторонние капиллярные мальформации типа пламенеющего невуса, почти всегда врожденные и лишь иногда возникающие в раннем детстве. Они сегментарные и существенно различаются как по распространенности, так и по цвету, варьирующемуся от светло-розового до темно-фиолетового. Обычно невусы локализуются на пораженной (преимущественно нижней) конечности, реже — на нескольких конечностях и/или туловище, обычно захватывая голень, ягодицы, живот или нижнюю часть туловища, и примерно в 50% случаев постепенно бледнеют. По данным ряда авторов, почти в 68% случаев синдром встречается и без пламенеющего невуса. В то же время нередко встречаются мелкие кавернозные ангиоматозные невусы, ангиокератомы, поражения, напоминающие телеангиэктатическую гранулему, а также другие сосудистые мальформации. в том числе лимфатические и венозные (обычно врожденные).
Пораженная конечность (или ее часть) может быть удлинена или утолщена уже при рождении, теплее на ощупь, чем другие части тела, быстрее растет. Увеличение длины конечности обусловлено костной гипертрофией, а диаметра — быстрым ростом мягких тканей в условиях улучшения кровоснабжения. Описаны поражения двух или даже четырех конечностей. Иногда образуются деформации суставов, костей, утолщение или дистрофия мышц. В ряде случаев наступает не гипертрофия, а атрофия костей и мягких тканей пораженной конечности.
Вторичными кожными проявлениями синдрома клиппеля-тренонея-вебера могут быть папилломы, шелушение, гиперпигментация, телеангиэктазии, мраморная кожа, кистозная лимфангиома, лимфедема, сопровождающаяся рецидивирующим рожистым воспалением, тромбофлебит, трофические язвы. В ряде случаев в области ангиоматозных невусов наблюдается варикозное расширение вен, иногда очень выраженное. Кроме того, отмечаются очаги псевдосаркомы Калоши (акроангиодерматита), ассоциирующиеся, как правило, с недостаточностью артериовенозных анастомозов (тип Стюарта— Блюфарба).
В составе синдрома также описывают поражение лица, часто с признаками синдрома Стерджа—Вебера—Краббе (энцефалотригеминального ангиоматоза), гемигипертрофию грудной клетки на стороне поражения конеч ности, косолапость, аплазию ребра, глаукому, катаракту, колобому и гетерохромию радужки, висцеромегалию, гемангиомы желудочно-кишечного тракта, мочевой системы, добавочные крупные сосуды, увеличение наружных половых органов, липодистрофию, умственную отсталость, судорожный синдром. Рентгенологически выявляются внутри- и подкожные кальцификаты и истончение коркового слоя костей.
Течение синдрома клиппеля-тренонея-вебера неуклонно прогрессирующее. Множественные врожденные пороки развития артериовенозной системы часто приводят к поражению сердца за счет заметного увеличения сердечного выброса. После травматизации телеангиэктатических участков кожи могут быть длительные кровотечения.
Диагноз синдрома клиппеля-тренонея-вебера устанавливается по типичной триаде симптомов с наличием пламенеющего невуса (около половины больных) и/или кавернозного ангиоматозного невуса (около половины больных), варикозного расширения вен, гипертрофии конечности. Необходимо проведение рентгенологического исследования сосудов пораженной конечности: артериографии и флебографии — соответственно, для исключения непроходимости артерий и глубоких вен.
Дифференциальный диагноз синдрома клиппеля-тренонея-вебера проводится с изолированным пламенеющим невусом, синдромом Стерджа—Вебера—Краббе, синдромом Маффуччи, лимфедемой, синдромом Протея, нейрофиброматозом I типа, псевдосаркомой Капоши.
Лечение синдрома клиппеля-тренонея-вебера симптоматическое. Проводятся консервативные и, при необходимости, оперативные мероприятия. Ряд авторов рекомендуют удаление некоторых венозных сосудов или их перевязку, однако во избежание ухудшения состояния больного перед этим следует исключить непроходимость глубоких вен, их гипоплазию или атрезию. При наличии варикозных вен и связанных с ними отеков используют эластические бинты.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Синдром Клиппеля-Фейля
Синдром Клиппеля-Фейля — генетически детерминированная аномалия строения шейного отдела позвоночника, включающая уменьшение количества и сращение позвонков. Клинически проявляется визуально определяемым укорочением шеи, низким расположением границы роста волос на затылке, ограничением движений головой. Как правило, синдром Клиппеля-Фейля сочетается с другими врожденными аномалиями скелета и соматических органов. В диагностике участвуют различные узкие специалисты, проводится рентгенография, КТ и МРТ позвоночника, генетический анализ, расширенное обследование внутренних органов (сердца, почек, легких, головного мозга). Консервативное лечение проводится средствами массажа, ЛФК и физиотерапии. Возможно хирургическое лечение — операция цервикализации.
МКБ-10
Общие сведения
Синдром Клиппеля-Фейля — врожденная, генетически обусловленная патология шейного отдела позвоночника, заключающаяся в сращении (синостозе) и уменьшении количества позвонков. Наиболее типичным и постоянным признаком синдрома является выраженное укорочение шеи, в связи с чем в медицинской практике он также упоминается как синдром короткой шеи. В большинстве случаев сочетается с другими аномалиями развития костно-мышечной системы (кривошеей, сколиозом, болезнью Шпренгеля, гипоплазией верхней конечности, синдактилией) и врожденными пороками внутренних органов (почек, сердечно-сосудистой системы, легких). Синдром Клиппеля-Фейля относится к редким заболеваниям. Частота его встречаемости — примерно 1 случай на 120 тыс. новорожденных детей. Впервые синдром был описан в 1812 г. во Франции неврологом Клиппелем и рентгенологом Фейлем, имена которых легли в основу его названия.
Современная клиническая неврология классифицирует синдром Клиппеля-Фейля на 3 типа. Первый тип — KFS1 — характеризуется уменьшенным количеством шейных позвонков. В норме у человека в шейном отделе 7 позвонков, при KFS1 обычно 4-5. Второй тип — KFS2 — синостоз всех позвонков шейного отдела, их спаянность с затылочной костью и верхнегрудными позвонками. Третий тип — KFS3 — представляет собой комбинацию первого или второго со сращением позвонков в нижнем грудном и поясничном отделах. Зачастую в шейном отделе наблюдаются добавочные ребра и spina bifida — незаращение позвонковых дужек.
Причины
Наиболее изученным является ген GDF6, ответственный за возникновение KFS1. Мутации в этом гене приводят к нарушению синтеза белка, участвующего в формировании костно-суставного аппарата путем создания разграничения между отдельными костями. В зависимости от типа синдром Клиппеля-Фейля имеет различный механизм наследования: для KFS1 и KFS3 он аутосомно-доминантный, для KFS2 — аутосомно-рецессивный.
Симптомы
Основной клинической триадой, характеризующей синдром Клиппеля-Фейля, выступает укорочение шеи, смещение границы роста волос вниз по задней поверхности шеи, нарушение подвижности позвоночника в шейном отделе. Выраженность укорочения шеи может варьировать, в наиболее тяжелом варианте мочки ушей достают плеч, а подбородок — грудины, затруднено глотание и дыхание. Характерно широкое разведение лопаток и зачастую их укорочение. Может наблюдаться типичное для болезни Шпренгеля высокое стояние одной из лопаток. В ряде случаев отмечаются аномалии мускулатуры плечевого пояса и складки на шее. В редких случаях возникает корешковый синдром — боли, связанные со сдавлением шейных спинномозговых корешков.
В 50-60% случаев синдром Клиппеля-Фейля сочетается со сколиозом, в 25% случаев — с костным вариантом кривошеи. Возможно сочетание синдрома короткой шеи с аномалиями верхних конечностей (полидактилией, синдактилией, врожденными ампутациями), деформацией стоп, пороками ребер, аномалиями зубов, асимметрией лица, дальнозоркостью. У 45% пациентов диагностируется дистопия, аплазия или гипоплазия почек, возможен гидронефроз, эктопия мочеточников. У 25% больных выявляется врожденная глухота, у 20% — волчья пасть, у 15% — врожденные пороки сердца (открытый артериальный проток, ДМЖП, ДМПП, декстрапозиция аорты). Может наблюдаться аплазия или гипоплазия легких.
Со стороны нервной системы бывает олигофрения (умственная отсталость), эпилепсия, гидроцефалия, спинно-мозговая грыжа, микроцефалия, глазодвигательные расстройства (косоглазие, птоз, синдром Горнера). С раннего возраста характерна мышечная слабость в конечностях и синкинезии — непроизвольные одновременные движения обеих рук, чаще только кистей. Со временем могут возникать спастические и вялые пара- и тетрапарезы.
Диагностика
Верификация диагноза проводится на основании наблюдаемой с рождения типичной триады признаков, данных осмотра, семейного анамнеза, результатов инструментальных и генетических исследований. Установить синдром Клиппеля-Фейля с подробным указанием имеющихся сопутствующих аномалий возможно только в результате совместной работы многих узких специалистов: невролога, ортопеда, генетика, кардиолога, нефролога, пульмонолога, офтальмолога.
В первую очередь проводится рентгенография шейного отдела позвоночника в 2-х проекциях. При KFS1 на рентгенограммах в большинстве случаев определяется полный синостоз 4-5 позвонков в единый малодифференцированный конгломерат. В ряде случаев между позвонками находятся узкие светлые полоски, соответствующие недоразвитым дискам, что говорит о частичном синостозе, который по мере роста ребенка приводит к искривлению позвоночника. Синдром Клиппеля-Фейля II типа рентгенологически характеризуется сочетанием синостозов 7 шейных позвонков с ассимиляцией атланта и сращением верхних грудных позвонков. Для исключения KFS3 проводят рентгенографию грудного и поясничного отделов позвоночника.
Более полную информацию о костных аномалиях дает КТ позвоночника. Однако ее применение в раннем детском возрасте ограниченно из-за сопутствующей исследованию лучевой нагрузки. При необходимости для оценки состояния мягкотканных структур пораженного отдела (корешков, спинного мозга) возможно проведение МРТ позвоночника. Дифференцировать синдром Клиппеля-Фейля следует от врожденной мышечной кривошеи и туберкулеза позвоночника.
Диагностический алгоритм также включает обследование состояния внутренних органов: нейросонографию, МРТ головного мозга, УЗИ брюшной полости, УЗИ сердца, ЭКГ, УЗИ или КТ почек, экскреторную урографию, рентгенографию органов грудной полости. Проводится консультирование у генетика с анализом генеалогического древа и ДНК-тестированием.
Лечение синдрома Клиппеля-Фейля
Осуществляются преимущественно консервативные лечебные мероприятия, направленные на предупреждение развития деформаций позвоночника и увеличение объема движений в шее. Проводят массаж шейного отдела и воротниковой зоны, плечевого пояса и верхних конечностей. Рекомендованы регулярные занятия лечебной физкультурой. Возможно применение физиотерапии. По показаниям проводят симптоматическое лечение нарушений в работе соматических органов. При корешковых болях назначают анальгетики, ношение воротника Шанца.
Стойкий болевой синдром, обусловленный компрессией корешков верхними ребрами, является показанием к проведению операции. Хирургическое вмешательство проводится согласно технике Бонола и представляет собой т. н. цервикализацию путем резекции верхних 4-х ребер. Доступ осуществляют через паравертебральный разрез, идущий параллельно внутреннему краю лопатки. Операция выполняется в 2-этапа, отдельно на каждой стороне.
Прогноз
Сам по себе синдром Клиппеля-Фейля имеет благоприятный витальный прогноз. Наличие пороков развития соматических органов значительно осложняет ситуацию и может выступать причиной преждевременной смерти. В функциональном отношении прогноз неблагоприятный, несмотря на проводимые консервативные мероприятия, у пациентов сохраняется выраженное ограничение движений головой, степень которого зависит от типа и тяжести синдрома. Течение заболевания может усугубиться происходящими в позвоночнике дегенеративными изменениями.
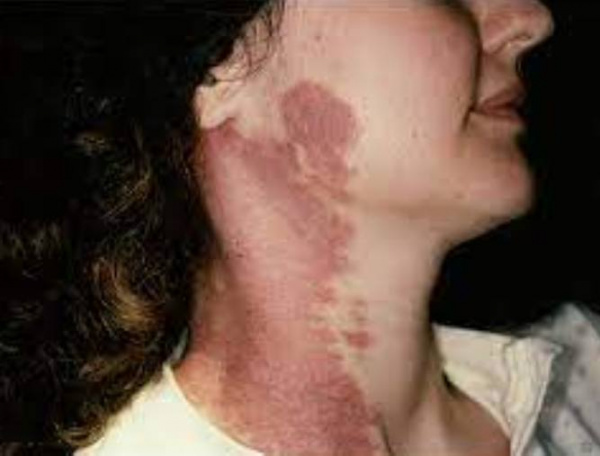
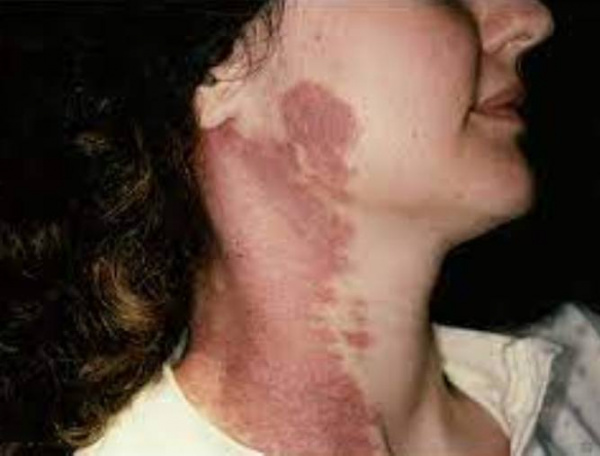
Пламенеющий невус ( Винное пятно )
Пламенеющий невус – это капиллярная ангиодисплазия, которая возникает в эмбриональном периоде внутриутробного развития. Изредка наблюдается приобретенная форма невуса, связанная с травмами, перенесенными инфекциями, приемом медикаментов. Пламенеющий невус имеет вид ярко-розового, красного или багрового пятна разных размеров и причудливой формы. Он преимущественно расположен на лице, шее и верхней части туловища. Диагностика требует клинического осмотра, проведения ультразвуковой допплерографии, МР-ангиографии и компьютерной томографии. Наиболее эффективным методом лечения признана лазерная коагуляция.
В медицинской литературе используется два синонимичных понятия: пламенеющий невус (nevus flammeus) и винное пятно (port wine stains, PWS), которые описывают одну и ту врожденную аномалию развития. Патология встречается у 0,3-0,5% новорожденных, существенных половых, этнических и расовых различий не обнаружено. Ввиду своей распространенности и выраженного косметического дефекта пламенеющий невус является важной проблемой в практической дерматологии. Усилия специалистов направлены на разработку минимально инвазивных и результативных способов удаления пятен.
Этиологическая структура винных пятен точно не установлена. Достижения генетики позволили выделить несколько точечных мутаций, вероятно связанных с капиллярными мальформациями. У детей с пламенеющим невусом зачастую обнаруживаются дефекты генов GNAQ6, RASA16, EPHB4 и PIK3CA. У некоторых пациентов сосудистая ангиодисплазия на коже является частью генетических синдромов, таких как:
- Синдром Стерджа-Вебера. Для этого заболевания характерно расположение винных пятен на лице по ходу ветвей тройничного нерва. Помимо кожной симптоматики возникают сосудистые аномалии головного мозга и глаз, возможна атрофия нервной ткани.
- СиндромCLOVES. Патология проявляется множественными капиллярными, венозными и лимфатическими дисплазиями в сочетании с эпидермальными невусами. Дети страдают от липоматоза, сколиоза, поражения костей и суставов.
- Синдром Протея. Сосудистые мальформации сочетаются с аномально быстрым и чрезмерным ростом отдельных участков тела. Патогномоничным проявлением болезни считается разрастание кожи в области ладоней и подошв.
- СиндромCLAPO. Капиллярные дисплазии локализованы в области нижней губы с разрастанием на кожу периоральной зоны. Патология сопровождается макроглоссией, деформацией черт лица и конечностей.
- Синдром Клиппеля-Треноне. Отличительная черта пламенеющего невуса при данном пороке – его расположение на нижних конечностях. Патология сопровождается варикозным расширением вен на ногах, гипертрофией костей и мягких тканей.
В отдельную категорию выделяют приобретенный пламенеющий невус, который был впервые описан немецким дерматологом Ф. Фегелером в 1949 году. Винные пятна возникают после травмы шейного или грудного отдела позвоночника. Патология может проявляться в любом возрасте. Позже были установлены другие триггеры приобретенного PWS: отморожение, прием гормональных и гиполипидемических препаратов, перенесенный опоясывающий герпес.
Патогенез
Формирование врожденной патологии приходится на 5-10 неделю внутриутробного периода. В патогенезе выделяют две ключевые гипотезы: нарушение иннервации сосудов и генетические мутации ангиогенеза. Установлено, что в патологических дермальных сосудах резко снижено число нервных волокон S-100. Это вызывает снижение базального сосудистого тонуса и уменьшение числа нейротрофических факторов – основные причины аномального разрастания сосудов.
В аномальных кожных сосудах происходит патологическая экспрессия артериального (EfnB2) и венозного маркеров (EphB1). Такие процессы вызывают нарушения в первичной дифференцировке дермальных артериол и венул, способствует избыточному капиллярному росту. В патогенезе заболевания замешана патологическая активация сигнальных путей ферментов: активированных протеинкиназ, фосфоинозитид-3-киназ.
Патоморфологически пламенеющий невус характеризуется расширенными капиллярами и посткапиллярными венулами, которые располагаются в сосочковом слое и верхней части сетчатого слоя дермы. Признаки эндотелиальной пролиферации и клеточной атипии отсутствуют. Постепенно число эктазированных сосудов увеличивается, прогрессирует периваскулярный фиброз.

Симптомы пламенеющего невуса
Сосудистое пятно развивается еще во внутриутробном периоде и хорошо контурируется сразу после рождения ребенка. Типичная локализация – кожа головы и шеи, причем у 85% пациентов новообразование расположено с одной стороны тела относительно срединной линии. У младенцев пятно окрашено в розовый цвет, со временем приобретает красноватый, винный или багровый оттенок. Кожный дефект имеет четкие контуры, напоминающие очертания географических карт.
Изначально пятно имеет гладкую поверхность и незначительно возвышается над уровнем неизмененной кожи. Оно не сопровождается болью, зудом и другими субъективными симптомами. Пламенеющий невус увеличивается пропорционально росту пациента. Постепенно он становится бугристым, на поверхности появляются отдельные сосудистые узлы. Изредка в пораженной зоне наблюдается гипертрофия кожи и мягких тканей.
Осложнения
Главной проблемой винных пятен является косметический дефект внешности, из-за чего пациенты стыдятся себя, испытывают трудности при новых знакомствах и общении с противоположным полом, ограничены в выборе профессий и карьерном росте. Крупные невусы, расположенные на лице, зачастую становятся причиной депрессивного расстройства, социальной изоляции, неустроенности личной жизни.
Кожа в области винного пятна легко травмируется, раздражается от механического трения нижним бельем или одеждой. Взрослые пациенты могут испытывать парестезии и зуд, которые ухудшают качество жизни. Если невус возникает как компонент генетического синдрома, развивается большой перечень осложнений со стороны нервной, костно-мышечной, сердечно-сосудистой и лимфатической системы.
Пламенеющий невус сопровождается характерными внешними симптомами, поэтому верификация диагноза достаточно проста. Обследование пациентов проводится под руководством педиатра и детского дерматолога. Решающую роль в постановке диагноза играет врожденный характер пятна, его типичная локализация и винный цвет. Ценную информацию получают при уточнении акушерского и семейного анамнеза. Дополнительно проводят следующие методы исследования:
- УЗИ с допплерографией. Ультразвуковая диагностика пораженной области тела необходима для оценки кровотока в патологических сосудах, исключения более опасных артериовенозных мальформаций, которые могут имитировать пламенеющий невус.
- МР-ангиография. Магнитно-резонансная диагностика рекомендована как наиболее точный и безопасный метод исследования, который применяется в сложных случаях. На снимках удается рассмотреть любые поверхностные и глубокие сосудистые аномалии.
- Компьютерная томография. Исследование проводится при пороках развития, чтобы оценить структуру соединительной ткани, выявить патологии опорно-двигательного аппарата. При сопутствующих невралгических симптомах показана КТ головного мозга.
- Биопсия ткани. Забор биоматериала требуется для дифференциальной диагностики между врожденными и приобретенными формами винного пятна, проведения генетических исследований в рамках диагностики наследственного синдрома.
В практической педиатрии возникают сложности при синдромальной диагностике пламенеющего невуса как компонента генетических заболеваний. Поскольку он входит в структуру более 10 сочетанных пороков развития, для определения нозологии требуется консультация генетика, клинико-генеалогический метод, исследование биоптатов кожи. В особо сложных случаях проводится секвенирование генома.

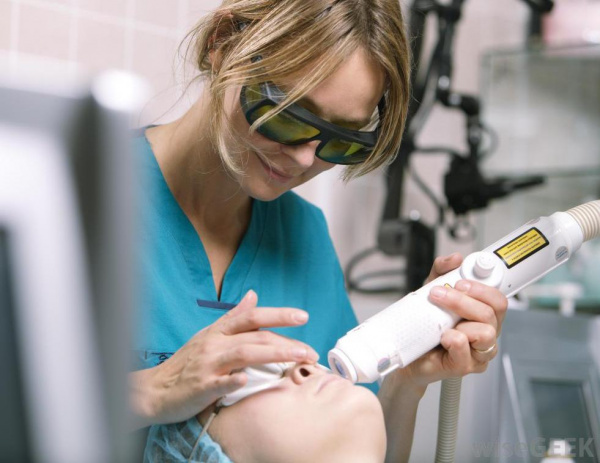
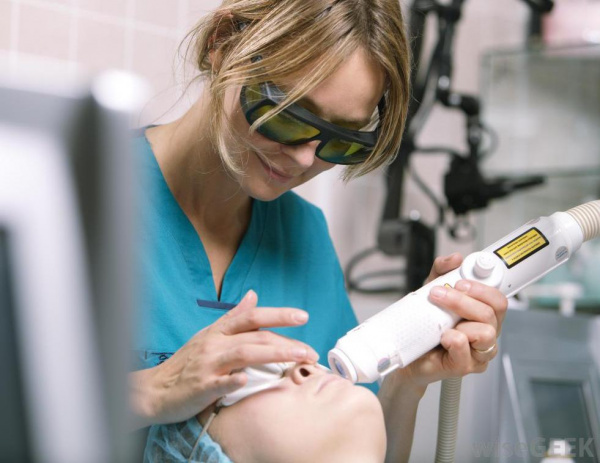
Лечение пламенеющего невуса
Винные пятна подлежат эстетической коррекции методом лазерной терапии. Эффективность лечения зависит от возраста пациента, размеров, количества и глубины залегания сосудов. Оптимальный возраст для первой процедуры – от 3 месяцев до 6 лет. В этом периоде удается достичь осветления на 55% за одну процедуру, тогда как у старших детей результативность лазерной коагуляции в 1,5-2 раза ниже.
«Золотой стандарт» терапии пламенеющего невуса – обработка импульсным лазером с длиной волны 595 нм. Методика показывает максимальную результативность при поверхностно расположенных новообразованиях. Винные пятна на боковых поверхностях лица лучше всего поддаются коррекции, поскольку сосуды располагаются в папиллярном слое дермы. Невусы в центральной части лица и на теле уходят медленнее, требуют длительного курса лазеротерапии.
У 20% пациентов с гигантскими и узловатыми сосудистыми мальформациями наблюдается резистентность к стандартному лазерному лечению. В такой ситуации используют альтернативные аппаратные процедуры: воздействие интенсивным импульсным светом (фототерапия), александритовые и неодимовые лазеры. Для достижения стойкого результата потребуется около 10 сеансов с интервалами от 2 до 6 недель между ними.
Прогноз и профилактика
Методика лазерной коагуляции позволяет значительно осветлить пламенеющий невус, что положительно сказывается на внешности и психологическом комфорте пациентов. При изолированной сосудистой аномалии прогноз благоприятный. При сочетании сосудистых пятен с генетическими синдромами прогноз определяется тяжестью соматической симптоматики. Меры профилактики заболевания пока не разработаны.
1. Особенности лазерной коагуляции «винных пятен» (случай из практики)/ Е.О. Белянина// Амбулаторная хирургия. – 2019. – №1-2.
2. Лазерная терапия сосудистых образований кожи у детей/ Т.С. Белышева, Е.И. Моисеенко// Саркомы костей, мягких тканей и опухоли кожи. – 2011. – №3.
Читайте также:
